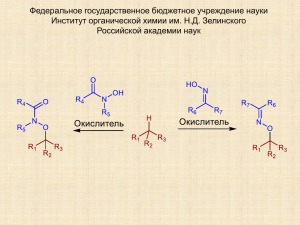
Реакции окислительного С-О сочетания
реклама

ИОХ им. Н.Д. Зелинского РАН; РХТУ им. Д.И. Менделеева Терентьев Александр Олегович (лекции для студентов и аспирантов университетов, обучающихся по специальности «Органическая химия») Реакции окислительного С-О сочетания Москва, 2014 Реакции сочетания - надежные инструменты органического синтеза 2 С-С сочетание Реакции Сузуки, Стилле, Хияма, Негиши, Кумада и др. Реакция Хека X = Hal, OTf .... ; M = B(OH)2, SnR3, SiR3, ZnHal, MgHal С-O, C-N, C-P, C-S сочетание Реакции Ульмана, Бухвальда-Хартвига и др. Реакция Чана-Лэма Нуклеофильное замещение Направление реакции определяется специально введенными функциональными группами • Дополнительные стадии синтеза (введение групп) • Образование отходов Окислительное кросс-сочетание Окислитель 1 R —H 2 H—R 3 1 2 R —R • Повышение атомной эффективности • Минимизация отходов • Минимизация количества стадий синтеза • Сложно обеспечить селективность • Сложно прогнозировать результат реакции • На данный момент ограничен ряд исходных реагентов Реакции окислительного сочетания С-С (наиболее изучено) C-O С-N C-P 4 C-S Окислительное C-O сочетание остается одним из наименее изученных R1—H + H—O—R2 R1—O—R2 Проблемы окислительного C-O сочетания: - один из реагентов в большом избытке - в то время, когда О-реагент только начинает окисляться, С-реагент претерпевает глубокое окисление Реакции окислительного C-O сочетания 5 Ðåàãåí òû ñ í àï ðàâëÿþ ù èì è ãðóï ï àì è Êàðáî í èëüí û å ñî åäèí åí èÿ RCOOH Ñï èðòû Ñï èðòû C H Ñî åäèí åí èÿ ñ áåí çèëüí û ì è àëëèëüí û ì ô ðàãì åí òàì è Ï ðî ñòû å ýô èðû , àì èí û , àì èäû Ôåí î ëû DDQ Cun+ Pdn+ H O R2NOH RSO3H ROOH ArIX2 Bu4NI / t-BuOOH Î êèñëèòåëü Fen+ N-î êñèëüí û å ðàäèêàëû Mn Êèñëî ðî ä Ï åðî êñèäû n+ C O Примеры реакций окислительного C-O сочетания с направляющими группами OMe R2 OMe R2 N H N Pd(OAc)2 (5-10 mol%) Oxone or K2S2O8 (2-3 equiv.) OMe MeOH 40-80 °C, 48 h R1 59-70% R1 = Me, OMe, Hal R2 = H, Me R1 Org. Lett. – 2006. – V. 8. – Issue 6. – P. 1141-1144. DOI: 10.1021/ol0530272 R H O NH R Pd(OAc)2 (10 mol%) PhI(OAc)2 (1 equiv.) MeOH 100 °C, 5-8 h O Ph OMe O NH 70-85% R = H, Me, Hal, Alkoxy, OPh O Ph Tetrahedron Lett. – 2011. – V. 52. – Issue 45. – P. 5926-5929. DOI: 10.1016/j.tetlet.2011.08.098 6 Примеры реакций окислительного C-O сочетания с направляющими группами HO N H AcO AcOH/Ac2O (1:1), 25 °C, 2 h N H Pd(OAc)2 (5 mol%) PhI(OAc)2 (1-3 equiv.) AcO 80-100 °C, 4-12 h (one pot) N OAc 33-86% Examples of synthesized products, yields OAc O ( )5 N N OAc OAc N H OAc AcO N N OAc OAc OAc O 61% 65% H 41% Org. Lett. – 2010. – V. 12. – Issue 3. – P. 532-535. DOI: 10.1021/ol902720d 66% 7 Примеры реакций окислительного C-O сочетания с участием альдегидов и спиртов O O R2 + 1 R 2 equiv. 4 R R + R3 O Bu4NI (10 mol%) t-BuOOH 5.5 M in decane (2 equiv.) CF3 1 R OH O CF3 EtOAc, 70 °C, 6 h F3C 1 equiv. O N O 43-98% F3C H R2 EtOAc, 70 °C, 7-12 h O 1 equiv. O O O 1 N OH R3 H Bu4NI (10 mol%) or Bu4NBr (10 mol%) t-BuOOH 5.5 M in decane (2 equiv.) 79-93% 2 equiv. Angew. Chem. Int. Ed. – 2012. – V. 51. – Issue 50. – P. 12538-12541. DOI: 10.1002/anie.201205921 H R1 O H OH Bu4NI (20 mol%) t-BuOOH 70% aq. (6 equiv.) + R2 R3 PhCN 90 °C, 24-60 h H R1 = Ar, CH=CHPh, i-Pr R2 = Ph, 4-BrC6H4, 4-Pyridyl, 2-Thiophenyl, CH=CHPh, etc. R3 = Me, Et, n-Pr, etc. O R3 2 R O O 33-90% Chem. Commun. – 2014. – V. 50. – Issue 47. – P. 6240-6242. DOI: 10.1039/C4CC01652A R1 8 Примеры реакций окислительного C-O сочетания с участием эфиров, кислот и пероксидов H 1 R OR2 OOt-Bu Fe(acac)3 (10 mol%) R1 t-BuOOH 5-6 М in decane (5-6 equiv.) MeCN 80 °C, 3 h R1 = H, Me, OMe, Cl, NO2, etc. R2 = Bu, t-Bu, Cy, etc. OR2 49-99% Adv. Synth. Catal. – 2012. – V. 354. – Issue 18. – P. 3480-3484. DOI: 10.1002/adsc.201200410 O + Ar Fe(acac)3 (20 mol%) t-BuOOt-Bu (2 equiv.) H OH O 120 °C, 24 h O O Ar O 42 - 97 % J. Org. Chem. – 2014. – V. 79. – Issue 9. – 3847-3855. DOI: 10.1021/jo500192h 9 Принципы C-O сочетания 10 • Нуклеофильное замещение • Большинство реакций окислительного CO сочетания Ограничен круг O-электрофилов: • Ацилпероксиды • Нитрозокарбонильные интермедиаты R OH R1 R O + R2 R3 • Аналоги реакций Ульмана и Бухвальда-Хартвига • Реакция Чана-Лэма • Окислительное C-O сочетание с применением направляющих групп Реакции селективного C-O сочетания с участием нестабильных O-радикалов редки Обнаружен общий класс реакций окислительного C-O сочетания с использованием дикарбонильных соединений и их гетероаналогов EWG2 EWG1 EWG1 EWG1 H H EWG2 EWG2 O H H H H O O N N EWG1, EWG2 = COOEt, COMe, CN R-O-O Обнаружен общий класс реакций окислительного C-O сочетания с использованием дикарбонильных соединений и их гетероаналогов EWG2 EWG1 O EWG1, EWG2 = COOEt, COMe, CN Катализированное переходными металлами (Cu, Fe, Mn, Co) пероксидирование β-дикарбонильных соединений O O O O H H 13 O Mn+ O O O R R Terent'ev A.; Borisov D.; Yaremenko I.; Chernyshev V.; Nikishin G. // J. Org. Chem. 2010, 75, 5065. A. O. Terent’ev, D. A. Borisov, V. V. Semenov, V. V. Chernyshev, V. M. Dembitsky, G. I. Nikishin // Synthesis 2011, 2091. Катализированное переходными металлами (Cu, Fe, Mn, Co) пероксидирование β-дикарбонильных соединений трет-бутилгидропероксидом ButOO-H O O H R''' R' R'' O ButOOH, Mn+ R' CH3CN R', R''' = CH3, OEt, OMe R'' = ArCH2, alkyl R'' O R''' OOBut 16 примеров Выход 37-90 % Terent'ev A.; Borisov D.; Yaremenko I.; Chernyshev V.; Nikishin G. // J. Org. Chem. 2010, 75, 5065-5071. 14 Пероксидирование кетоэфира 15 O Ph O EtO Êàòàëèçàòî ð Ph Ðàñòâî ðèòåëü O EtO 1 № OO + HOO O 2 Катализатор Растворитель Конверсия 1, % Выход 2, % 1 Cu(OAc)2H2O CH3CN 71 60 2 Cu(ClO4)26H2O CH3CN 100 90 3 Cu(ClO4)26H2O EtOH следы 0 4 Cu(ClO4)26H2O CH3COOH следы 0 5 Cu(BF4)26H2O CH3CN 100 79 6 Cu(acac)2 CH3CN 60 40 7 CuCl CH3CN следы следы 8 CuCl22H2O CH3CN 16 следы 9 Mn(OAc)24H2O CH3CN 33 21 10 FeCl3 CH3CN 50 24 опыта CH3CN 11 0 0 Co(ClO4)26H2O 2 Моль ButOOH / моль 1, 0.1 моль катализатора / моль 1, время реакции 1 ч Пероксидирование дикетона 16 O Ph O Êàòàëèçàòî ð Ph OO + HOO CH3CN O O 1 2 № Моль t-BuOOH Конверсия 1, Выход 2, опыта / моль 1 % % 1 1 87 34 Cu(ClO4)26H2O 0.5 100 64 Cu(ClO4)26H2O 0.5 100 71 Cu(ClO4)26H2O 0.25 100 73 3 Cu(BF4)26H2O 0.5 100 69 6 3 Cu(acac)2 1 38 29 7 3 CoCl26H2O 1 100 34 8 3 Co(acac)2 1 98 24 9 3 45 23 Катализатор τ, ч 2 Cu(OAc)2H2O 2 2 3 3 4 3 5 Fe(acac)3 1 0.05 моль катализатора / моль 1 Пероксидирование диэфира OEt Ph O EtO Cu(ClO4)2 * 6H2O + HOO CH3CN O 17 EtO Ph O EtO O 1 № OO 2 Моль t-BuOOH / Моль катализатора / моль 1 Время реакции, Конверсия 1, ч % Выход 2, % опыта моль 1 1 2 0.2 2 62 41 2 5 0.3 1 87 65 3 5 0.3 1.5 98 42 4 5 0.4 1 98 67 5 5 0.5 0.5 98 59 Сравнение реакционной способности дикарбонильных соединений 18 OEt Ph O O Оптимальный мольный % катализатора (Cu(ClO4)26H2O) Время необходимое для полной конверсии > Ph EtO O O > Ph O EtO 5% 10 % 40 % 15 мин 1ч 1ч Реакционная способность снижается O Примеры полученных соединений 19 Структура, выход, % EtO Bu OO t EtO ButOO O O O O 90 ButOO EtO 53 NO2 O NC O ButOO EtO ButOO EtO O 58 OMe OOBut O 78 O ButOO O O O 45 ButOO O O O O O 66 72 46 NO2 O O O O O t OOBu t Bu OO 61 EtO t Bu OO O EtO O ButOO EtO 67 Bu OO O 37 O 75 O EtO O t 51 O O EtO O EtO O O ButOO EtO 51 O 57 EtO NC ButOO O ButOO EtO 52 O Катализированное переходными металлами (Cu, Fe, Mn, Co) окисление малононитрилов и циануксусных эфиров трет-бутилгидропероксидом в α-положение NC CN R O C ButOOH, M n+ CN Bu OOH, M EtO CN OOBut R Solvent t NC n+ O C CN R OOBut EtO R Solvent 20 A. O. Terent’ev, D. A. Borisov, V. V. Semenov, V. V. Chernyshev, V. M. Dembitsky, G. I. Nikishin // Synthesis 2011, 2091. Структура и выход пероксидов, полученных из производных малононитрила и циануксусного эфира 94% 69% 63% 89% 73% 64% 68% 81% 83% 78% 71% 64% 21 Возможные маршруты пероксидирования CuII O O R ButOO O O R OOBut ButOO O O R 22 Исследование механизма пероксидирования β-дикарбонильных соединений O O Ph O O Ph + HOO Cu OO O MeCN Ph O 1 2 O O + + HOO Ph O 23 Ph O O OO O Ph Cu O O MeCN Ph (5 mol. %) 3 2 HOO O O OO O (10 mol. %) Cu(ClO4)2*6H2O + Ph O EtO O MeCN Ph EtO 5 4 O Продукты присоединения дикарбонильного соединения к аллилацетату отсутствуют Предполагаемый механизм пероксидирования ButOO . CuII O B O R II ButOO . O A O D O O CuI t Bu OOH t Bu OOH R OOBut III ButO . R I CuII C E ButOOH E Terent'ev A.; Borisov D.; Yaremenko I.; Chernyshev V.; Nikishin G. // J. Org. Chem. 2010, 75, 5065 24 25 Окислительное C-O сочетание алкиларенов, β-дикарбонильных соединений и их аналогов с оксимами, N-гидроксиимидами и N-гидроксиамидами O R4 R5 H-O O R4 N R1 R3 Окислитель R7 N R6 H R6 R5 O R2 N O-H R1 R2 R3 R7 Окислитель N R1 O R2 Terent’ev A.O., Krylov I.B., Timofeev V.P., Starikova Z.A., Merkulova V.M., Ilovaisky A.I., Nikishin G.I., Adv. Synth. Catal. 2013, 355, 2375-2390. Krylov I.B., Terent’ev A.O., Timofeev V.P., Shelimov B.N., Novikov R.A., Merkulova V.M., Nikishin G.I., Adv. Synth. Catal. 2014, 356, 2266-2280. R3 Окислительное C-O сочетание β-дикарбонильных соединений с оксимами O H H O O O O Окислитель O N N Krylov I.B., Terent’ev A.O., Timofeev V.P., Shelimov B.N., Novikov R.A., Merkulova V.M., Nikishin G.I., Adv. Synth. Catal. 2014, 356, 2266-2280. 26 Условия образования продуктов окислительного C-O сочетания O O Mn+1 R3 R1 R Mn+ O O Mn+1 O O R2 2 A R 1 R R R3 R1 2 3 1 27 Сложная смесь B Необходимое условие сочетания î äí î âðåì åí í î å ñóù åñòâî âàí è å ðåàê öè î í í î ñï î ñî áí û õ ÷àñòè ö N OH R5 R4 2 Mn+1 N O R5 R4 C Ox кетоны, нитрозо-, нитросоединения, сложная смесь продуктов N-N, N-O и O-C сочетания Влияние окислителя и растворителя O O O OEt O O O Окислитель OEt O N + N 1 OH 25-80 °C, 5-60 min 2 O 3 № Окислитель Р-ль 1 2 3 4 6 7 MnO2 KMnO4 Mn(OAc)3•2H2O Mn(OAc)2/KMnO4 Mn(OAc)3•2H2O Mn(OAc)3•2H2O AcOH AcOH AcOH AcOH MeCN MeOH Выход 3, % 79 90 92 92 78 85 8 Mn(acac)3 AcOH 74 28 № Окислитель 14 15 16 17 9 10 13 Cu(ClO4)2•6H2O Cu(NO3)2•2.5H2O Cu(OAc)2•H2O (NH4)2Ce(NO3)6 Fe(ClO4)3•nH2O Fe(NO3)3•9H2O Fe(ClO4)3•nH2O O Р-ль MeCN MeCN MeCN AcOH MeCN MeCN CHCl3 Krylov I.B., Terent’ev A.O., Timofeev V.P., Shelimov B.N., Novikov R.A., Merkulova V.M., Nikishin G.I., Adv. Synth. Catal. 2014, 356, 2266-2280. Выход 3, % 45 49 <5 55 84 25 55 Продукты сочетания с оксимами 29 O O O N O O O OEt O N OEt O O O OEt O N OEt EtO O O O 1, 90% , 92%b, 92%c O O 2 (E/Z = 10/1) 39%a, 70%b, 71%c O O 3, 90%a, 91%b, 92c OEt O N O N OEt Ph O O 7, 78%a O O O N O N OEt O O O N O O O N OEt Ph O N 11 (E/Z = 4/1) 36%a, 56%b a b c 12, 84 , 85 , 84% b) Mn(OAc)3•2H2O O EtO O Окислитель: a) KMnO4 N O 8, 80a O 9 (E/Z = 16/1) 40%a, 67%b O O 6, 55% , 72%b, 71%c O 4, 82% O a O O a O O 5, 76%b O O OEt O EtO O OEt O O O OEt O N N O O a O O 13, 65b c) Mn(OAc)2•4H2O / KMnO4 Продукты сочетания с оксимами (с донорными заместителями) Окислитель: a) KMnO4 b) Mn(OAc)3•2H2O c) Mn(OAc)2•4H2O/KMnO4 30 Окислительное C-O сочетание β-дикарбонильных соединений и их гетероаналогов с N-гидроксиамидами и N-гидроксиимидами Terent’ev A.O., Krylov I.B., Timofeev V.P., Starikova Z.A., Merkulova V.M., Ilovaisky A.I., Nikishin G.I., Adv. Synth. Catal. 2013, 355, 2375-2390. 31 Влияние окислителя O O OEt O O HO N O Окислитель O N O + AcOH 60 C, 5-45 мин. o 1 № 32 Окислитель OEt O O 2 3 Выход № Окислитель 3, % Выход 3, % 1 KMnO4 39 9 Cu(OAc)2 <5 2 MnO2 46 10 Mn(OAc)2cat. / (NH4)2S2O8 <5 3 Mn(OAc)3 87 11 Co(OAc)2cat. / O2 41 4 Co(OAc)2cat. / KMnO4 80 12 Co(OAc)2cat. / (NH4)2S2O8 37 5 (NH4)2Ce(NO3)6 74 13 Co(OAc)2cat. / H2O2 34%aq. 35 6 Fe(ClO4)3 (MeCN, 80 °C) 73 14 MCPBA <5 7 Pb(OAc)4 12 15 BzOOBz <5 8 Co(OAc)2cat. / Pb(OAc)4 61 16 (NH4)2S2O8 <5 Продукты сочетания из β-дикетонов и кетоэфиров O O O O O O O Br O N O O O O O O O Cl O 14, 87%a, 81%b O O Ph O O N O OEt N 15, 83%b 11, 94%b 10, 78%a O O OEt N OEt O 9, 90%b a OEt O O O N O 8, 90%a O O O O N 5, 47%a O OEt N O N 4, 85%a O O O Ph O 3, 80%a O N O O 2, 72%a, 63%b O O O O N O O O N O O O OEt O O NC O 16, 81%a, 77%b OEt N O 17, 90%b Окислитель Mn(OAc)3•2H2O; b Окислитель Co(OAc)2cat./KMnO4 O 33 Малоновые эфиры, малононитрилы и циануксусные эфиры 34 в реакции сочетания EWG1 O N EWG2 Mn(OAc)3•2H2O (a) или KMnO4 (b) H H O EWG1 O O N O AcOH EWG1, EWG2 = COOEt, CN O O O EtO O OEt O N NC NC NC N O O 1, 60 oC: 0a или b 80 oC: 30a O Ph O N NC 5, 80 oC: 51a CN NC O OEt O Ph O N COOEt O O Ph O N O o a 2, 80 C: 67% O O 3, 60 oC: 60a O COOEt N O EtO O O 4, 60 oC: 80a, 55b EWG2 6, 60 oC: 61%a O Вероятный механизм окислительного C-O сочетания ЭПР мониторинг: aN = 4.7 G g = 2.0073 ЭПР мониторинг: aN = 28.4 G g = 2.0047 35 Окислительное сочетание N-гидроксифталимида с алкиларенами и родственными соединениями O O Окислитель Ar H + HO N O Ar O N O Terent’ev A.O., Krylov I.B., Sharipov M.Y., Kazanskaya Z.M., Nikishin G.I. Tetrahedron. 2012, 68, 10263-10271. А. О. Терентьев, И. Б. Крылов, А. Д. Липатников. ЖОХ, 2014, Т. 84, Вып. 11, 1786–1789. 36 Окислительное сочетание N-гидроксифталимида с толуолом под действием различных окислителей O O Окислитель O N + HO N O 1 2 O Опыт Окислитель Растворитель Температура, °С Выход 2, % 1 (NH4)2Ce(NO3)6 Ацетон, AcOH 20-25 65-80 2 (NH4)2Ce(NO3)6 AcOH 60 40 3 Pb(OAc)4 AcOH или CHCl3 20-60 36-40 4 PhI(OAc)2 MeCN или AcOH 20-60 45-62 5 Mn(OAc)3•2H2O AcOH 60 45 6 KMnO4 AcOH 60 54 37 O-замещенные производные N-гидроксифталимида из алкиларенов и родственных соединений 80% 75% 70% 35% 76% 63% 65% 52% 50% 51% 38 Механизм окислительного сочетания алкиларенов с N-гидроксифталимидом 39 CAN = (NH4)2Ce(NO3)6 O O CAN N N O NHPI OH O O . Ar-CH2-R O N O Ar-CH-R R CH O Ar Terent’ev A.O., Krylov I.B., Sharipov M.Y., Kazanskaya Z.M., Nikishin G.I. Tetrahedron. 2012, 68, 10263-10271 Новые реакции окислительного С-О сочетания 40 C-H реагенты O O NC H CN H O O O O NC COOEt O O O N N H H Ar NC NC O O O CN N Mn(OAc)3; KMnO4; Mn(OAc)2/KMnO4; Co(OAc)2/KMnO4; Fe(ClO4)3; Cu(ClO4)2; (NH4)2Ce(NO3)6 C-O сочетание O N O COOEt O O O N Ar O-H реагенты O N OH N O OH O O O NC O N OH OOH O NC OEt O O O O O O CN