Введение в реакционную способность молекул.
реклама

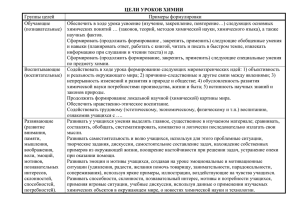
Введение в реакционную способность молекул. • Константа скорости химической реакции Уравнение Аррениуса. Способы интенсификации химических процессов. • Понятие о гомогенном, гетерогенном и гомогенном и ферментативном катализе. Биомиметика. Скорость химических реакций • Скорость химической реакции есть число элементарных актов химической реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций). • Скорость химической реакции есть изменение концентрации реагирующих веществ в единицу времени. N2(г) + 3H2(г) = 2NH3(г) Закон действующих масс • В основе химической кинетики лежит т. н. основной постулат химической кинетики: • Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях. • Т. е. для реакции • аА + bВ + dD + ... ––> еЕ + ... • можно записать: Коэффициент пропорциональности k есть константа скорости химической реакции. Она численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/ • Этот закон называется законом действующих масс. Он был экспериментально открыт и теоретически обоснован в середине XIX столетия и получил свое название от термина «действующая масса» – синонима современного понятия «концентрация». Пусть реакция происходит в некоторой точке R через предшествующее взаимодействию столкновение. Если молярные концентрации веществ А и В выразить через их символы в квадратных скобках, то вероятность нахождения веществ А в точке R будет пропоциональна [A], т. е. ω(A)=α[A]. Вероятность ω(B) нахождения вещества в этой точке равна ω(B) = β[B], а вероятность их одновременного присутствия в точке R (точке столкновения) равна произведению ω(A)∙ω(В) = α[A]∙β[B]. Поскольку только часть столкновений приводит к химической реакции, то скорость реакции образования АВ равна VAB = γ∙α[A]∙β[B] = γαβ[A][B]. Обозначив γ·α·β = k, получаем для реакции A + B, VAB = k [A] [B] Температура и скорость реакции • Почти все химические реакции при повышении температуры идут быстрее •ВАНТ-ГОФФА ПРАВИЛО - повышение температуры на 10° приводит к увеличению скорости в 2–4 раза. ВАНТ-ГОФФ Якоб Хендрик Нобелевская премия по химии (1901) Уравнение Аррениуса При фиксированной температуре реакция возможна, если взаимодействующие молекулы обладают определенным запасом энергии. Аррениус эту избыточную энергию назвал энергией активации, а сами молекулы активированными. Если Ea = 50–100 кДж ∙ моль–1 АРРЕНИУС Сванте Август то выполняется Правило Нобелевская премия по химии (1903). Вант-Гоффа Энергетическая диаграмма химической реакции изобара Вант-Гоффа СПОСОБЫ ИНТЕНСИФИКАЦИИ ХИМИЧЕСКИХ ПРОЦЕССОВ Повышение температуры Увеличение давления Использование более активных химических агентов Применение катализаторов Молекулярная организация каталитической системы Катализ Некаталитическая реакция A+B C Каталитическая реакция A+B +K(ABK) (ABK) C