и Молекулярная масса (в Да)
реклама
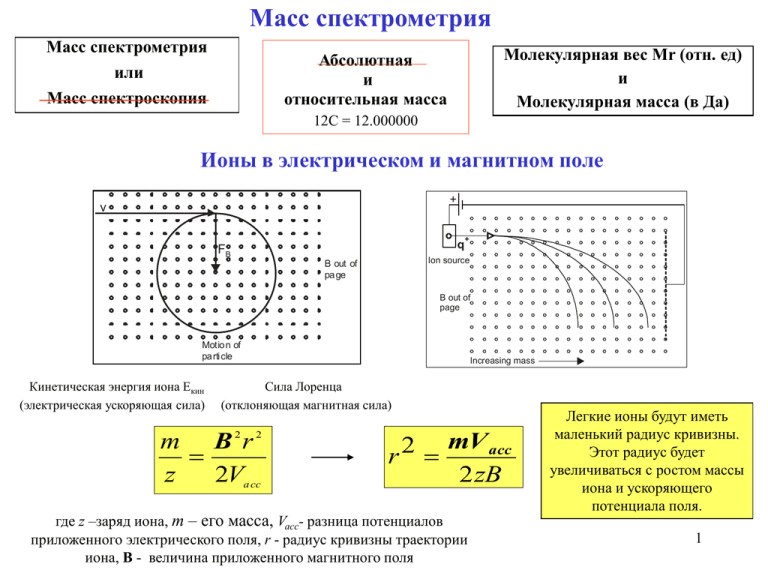
Масс спектрометрия Масс спектрометрия Молекулярная вес Мr (отн. ед) и Молекулярная масса (в Да) Абсолютная и относительная масса или Масс спектроскопия 12C = 12.000000 Ионы в электрическом и магнитном поле + v q FB + Ion source B out of pa ge B out of page Motio n of pa rti cle Кинетическая энергия иона Екин (электрическая ускоряющая сила) Increasing mass Сила Лоренца (отклоняющая магнитная сила) m B 2r 2 z 2Va cc r2 mV acc 2 zB где z –заряд иона, m – его масса, Vacc- разница потенциалов приложенного электрического поля, r - радиус кривизны траектории иона, B - величина приложенного магнитного поля Легкие ионы будут иметь маленький радиус кривизны. Этот радиус будет увеличиваться с ростом массы иона и ускоряющего потенциала поля. 1 От ионов в растворе - к ионам в газовой фазе Перенос ионов из раствора в газовую фазу требует большой энергии и не происходит самопроизвольно. Например, перенос иона Na+ требует 98 ккал/моль. Поэтому перенос десятков тысяч ионoв в газовую фазу из раствора в масс спектрометре требует очень большой затраты энергии Способы получения ионов 1) 2) 3) Удаление электронов из молекулы для получения позитивно заряженного катиона, который может быть ускорен либо увеличением отрицательного градиента или уменьшением позитивного градиента поля. Добавление электрона к молекуле для получения отрицательно заряженного аниона. В этом случае знак ускоряющего напряжения противоположен знаку, требуемому для катиона. Удалением или добавления протона. В этом случае результирующая масса будет отличаться на ±1 от массы исходного нейтрального иона. Техника ионизации Электронная ионизация Ионизация полем Бомбардировка быстрыми атомами Плазменная ионизация Лазерная ионизация с использованием матрицы (MALDI) Ионизация электрораспылением (ESI) 2 Лазерная ионизация с использованием матрицы (MALDI) (a) (b) (c) Laser pulse Analyte molecule UV - absorbing matrix Матрица – ключевой элемент техники. Специфика лазерного излучения. Специфика массспектрометра Ее главная роль: Два типа лазеров используются в технике MALDI: Поскольку большинство лазерных источников являются пульсирующими, то для регистрации используются такие методы как метод времени пролета или метода ионного циклотронного резонанса. Точность определения массы составляет ± 0.01% (±1 3Da при молекулярной массе 10 кДa). содержать хромофор, поглощающий лазерное излучение. Последнее не должно затрагивать хромофоры исследуемой молекулы. Матрица испаряясь переходит в газовую фазу, увлекая за собой исследуемую молекулу. Инфракрасный лазер, возбуждающий вибрационные моды и УФ - лазер, возбуждающий электронные переходы в молекуле. Длина импульса обычно составляет 100 нс или меньше. Большие длины импульсов обычно приводят к тепловому разложению образца. Ионизация электрораспылением Nanoflow electrospray ionisation Free jet expansion in the ion source Disassembly in the collision cell Mass analysis -7 -10 1e - 1e mBar Схематическое представление прохождения ионов от кончика иглы, содержащего раствор биологических макромолекул, до детектора масс спектрометра. Раствор белка (объем - 1-2 μл, концентрация - 5 μM) выходит из тонкого капилляра (внутренний диаметр около 10 μм). К концу капилляра, покрытого золотом, прикладывается высокое напряжение (обычно несколько кВ), вызывая распад капель на очень мелкие капли. Десольватация последних приводит к появлению облака молекул, которые детектируются масс спектрометром. Точность определения молекулярных масс 4 составляет 0.001-0.005%. Инструменты и техника регистрации в масс спектрометрии ESA Magnet A Single and double focusing mass spectrometers Source Slit B Collector Slit Quadrupole mass filter Fourier transform mass spectrometry D Triple mass filter Signal out -Vdc + Vrf cos t rf excite QII -Vdc + Vrfcos t +Vdc + Vrf cos t Fourier Transform RF only q (collection cell) +Vdc + Vrf cos t -Vdc + Vrf cos t Fourier Transform QI S +Vdc + Vrfcos t Ion cyclotron resonance mass spectrometry Receiver plate Time Filament Electric lens Electro n gate Ring electrode FT + Time-domain signal B Transmitter plate Trap plate Frequency Quadrupole ion trap Top and bottom end cap electrod es Mass Spectrum 5 Electro n multiplier To amplifier Определение масс белков Моноизотопная масса +1Da horse cytochrome c +2Da +3Da horse myoglobin [Arg8]-вазопресин 1084.446 ESI-FTIR масс спектр двух белков: цитохрома c и миоглобина лошади. Концентрация образца 0.4 нM. Общее количество белка около 135 зM 80 000 молекул). 1 зепто моль = 10-21 моля (~ МАЛДИ спектр высокого разрешения белка [Arg8]-вазопресина. Основной спектр 1084.446 относится к «моноизотопному» пику протонированного белка. Три пика более высокой массы относятся к вкраплению в белок изотопа 13C, доля встречаемости которого в природе равна 1.108%. 6 Молекулярная масса нейтральной молекулы M может быть найдена из значений регистрируемых масс m1 и m2 и (что эквивалентно значениям m/z) и числа добавленных зарядов или протонов n1 и n2 : Цитохром с М = n2 (m2 - 1) (A) где n1 = n2+1 и n2 = (m1 -1) / (m2 - m1) Следовательно, M, можно рассчитать, если брать пики регистрируемых масс попарно. Применяя формулу (А) для расчета молекулярной массы цитохрома c с использованием двух соседних пиков с = 952.3 и = 1031.3, получим для следующее значение: n2 m1 1 m2 m1 951.3 1031.3 952.3 12.04 Это означает, что 12 положительных зарядов ассоциированы с относительной массой, равной 1031.3. Молекулярная масса в этом случае рассчитывается как М = n2 (m2 -1) и равна 12363.6. Рассматривая следующие два пика с относительными массами = 884.3 и = 952.3, мы получим: n2 m1 1 884.3 12.989 m2 m1 952.3 884.3 или Z = 13, т.е. 13 положительных зарядов ассоциированы с относительной массой 952.3. Рассчитанная из этих пиков молекулярная масса равна 12366.9. 7 Сворачивание белков: конечные и промежуточные состояния Folded Protein ESI - MS m/z Unfolded Protein ESI - MS m/z Различные моменты времени Различные pH Цитохром c Апомиоглоин Кислая денатурация миоглобина 8 Виртуальный двумерный форез Вертикальная полоска: одномерный полиакриламидный гель, окрашенный.серебром. Каждый участок его дубликата ( не окрашенного серебром) анализируется масс спектрометрией. 20 9 Нуклеиновые кислоты и их комплексы с белками. Проблема: «любовь НК» к ионам. bacterial plasmid (pBR322) 5 мМ Мg Мономер Димер 1 mM Mg Гистограмма средних масс образца ДНК. Доминантный пик 2.88 MДa соответствует Na-бактериальной ДНК плазмиде (pBR322), а меньший пик ее димеру (Benner, 1997). Расчетное значение молекулярной массы 30S субьединицы равно 852187 ± 3918 Дa. Эта величина на 0.6% отличается от «точного значения», вычисленного из составляющих ее 10 компонентов (16S РНК и белков). Статический и динамический протеомы и масс-спектрометрия Cell or tissue sample Extract cellular proteins ic c tr g e l in e Iso cuss fo ele P ctr ag op e ho r 2D gel Trypsin treatment peptides Si ze charge es is Trypsin treatment Liquid chromatograhy separation peptides Mass Spectrometry Две стратегии анализа протеома методом масс спектрометрии (GodovachZimmermann and Brown, 2001). 11 Формирование изображения с помощью масс спектрометрии Методология пространственного анализа ткани методом MALDI-MS. Замороженные секции помещаются на металлической плате и покрываются UVабсорбирующей матрицей. Затем они помещаются в массспектрометр и сканируются лазерным лучом. (Stoeckli et al., 2001, Nature Medcine, 7, p.494). Масс спектрометрическое изображение замороженных секций ткани мозга мыши. (а) Оптическое изображение замороженной секции на золотой подложке. (b) Распределение белков с m/z = 8528 в области центральной коры головного мозга (c) Тоже для m/z 6716 в области медиальных сучковатых ядер. (d) Тоже для m/z 2564 в области среднего 12 мозга.