Ядерный магнитный резонанс
реклама

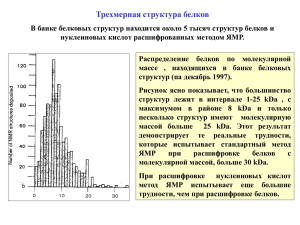
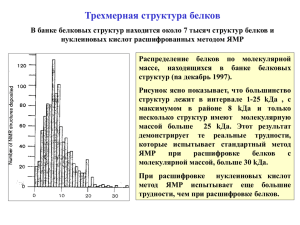
Ядерный магнитный резонанс в изучении структуры синтетических и биологических полимеров Основы ЯМР • у частиц есть момент количества движения (спин) • если спин отличен от нуля, частица имеет ненулевой магнитный момент μ (т.к. она заряжена), параллельный моменту количества движения • наложение внешнего магнитного поля H вызывает расщепление энергитического уровня на величину E 2H Расщепление уровней H m 1 2 H 1 2 H I 1 2 H m0 2 H m m 1 0 H m 1 I 1 I – спин, m – магнитное квантовое число (проекция магнитного момента) Явление ЯМР • при увеличении поля H0 мы лишь увеличим скорость прецессии, но не сориентируем моменты • приложим дополнительное поле H1 и начнём вращать его • если частота вращения H1 близка к частоте вращения магнитного момента (ларморовой прецессии), оно вызовет нутацию (раскачивание) последнего • как только частота вращения H1 становиться равной частоте ларморовой прецессии наступает резонанс – угол между магнитным моментом и полем H0 будет заметно меняться H0 H1 Характеристики ядер Изотоп Распростране нность, % Частота ЯМР в поле 10 кГс, МГц Отн. чувствительн ость1 Магнитный момент2 Спин3 1H 99.984 42.577 1.000 2.7972 ½ 2H(D) 0.0156 18.83 81.17 1.108 99.635 0.365 100 100 6.536 4.575 13.660 10.705 3.076 4.315 40.055 17.235 0.0096 0.0199 0.165 0.0159 0.0010 0.0010 0.834 0.0664 0.8574 -1.1774 1.8006 0.7022 0.4036 -0.2830 2.6273 1.1305 1 3 3/2 ½ 1 ½ ½ ½ 10B 11B 13C 14N 15N 19F 31P 1 При равном числе ядер в постоянном поле Н 2 В единицах ядерного магнетона eh 4M п c (теоретический магнитный момент протона) 3 В единицах h 2 Магнитное экранирование или чем интересен ЯМР В 1951 году Арнольд с сотрудниками[1] зарегистрировали спектр этилового спирта, в котором различным химически неэквивалентным ядрам, принадлежащим одной и той же молекуле, соответствовали отдельные линии спектра. Причина различий резонансных напряженностей магнитного поля – электронные облака вокруг каждого ядра. Теперь можно идентифицировать химический состав молекул: как входящие в них протоны, так и число протонов соответствующего типа. [1] J.T. Arnold, S.S. Dharmatti, M.E. Packard, J. Chem. Phys., 19, 507 (1951) ЯМР в изучении полимеров Для примера рассмотрим по одному “представителю” синтетических и биологических полимеров, соответственно Изучение структуры синтетических полимеров опишем на примере полистирола (исторически, это первый синтетический полимер, для которого были описаны спектры ЯМР) Изучение структуры биологических полимеров опишем на примере белков (общие черты “семейства” биополимеров) ЯМР полистирола о, м, п Бензол м Толуол о п м Этилбензол о трет-Бутилбензол оп м п мп Полистирол 2.5 о 3 Сопоставление химических сдвигов ароматических протонов полистирола о – орто-протоны м – мета-протоны п – пара-протоны 3.5 ЯМР полистирола Отличительная особенность полистирола (по сравнению с простыми алкилбензолами и дифенилпентанами) – все ароматические протоны полистирола – и в особенности ортопротоны – экранированы аномально (это видно из предыдущего рисунка). Причина такого экранирования – кольцевые токи бензольных колец. ЯМР белков Исследования с помощью ЯМР были посвящены трем основным аспектам структуры белков в растворе: • прямое изучение самой структуры молекулы белка • связывание с белками малых молекул • исследование активных парамагнитных субъединиц ферментов и белков-переносчиков электронов путем изучения их влияния на химические сдвиги соседних протонов и на релаксацию магнитных ядер растворителя или других ассоциированных с белком молекул ЯМР белков Впервые спектр ЯМР белка наблюдали для раствора рибонуклеазы в D2O. В спектре было обнаружено 4 широких пика без тонкой структуры. (Саундерс и сотр.) Бови с сотрудниками описали спектры растворов многих белков в трифторуксусной кислоте. В этом растворителе белки имеют полностью развернутую структуру. В спектрах удалось наблюдать и отнести уже 9 пиков. Спектры всех белков имеют большое сходство, но различаются в деталях, что обусловлено, в частности, связыванием малых молекул, свертыванием и развертыванием цепи и другими структурными изменениями. Выводы • ЯМР является универсальным средством определения химической структуры молекул, как мономеров, так и полимеров • ЯМР позволяет делать более “тонкие” исследования конформации полимерных цепей • ЯМР в биополимерах, в частности в белках, позволяет более детально исследовать денатурацию белков и связывание с ними малых молекул (субстарты, ингибиторы, кофакторы и сами растворители)