Химерные коровые частицы HBcAg, несущие эпитопы
реклама
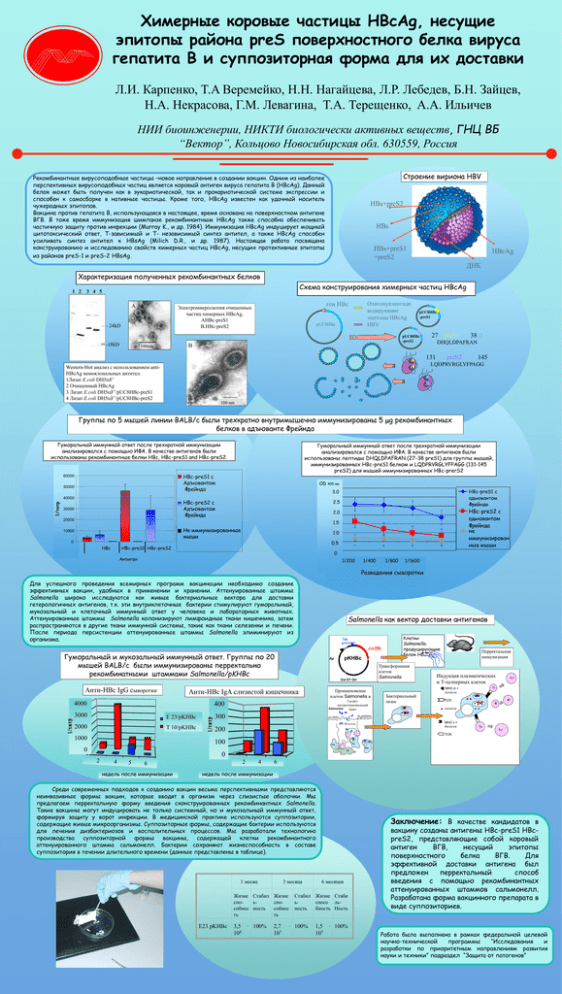
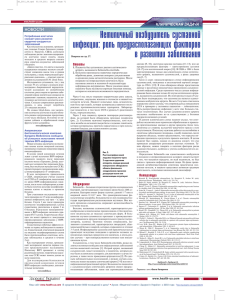
Химерные коровые частицы HBcAg, несущие эпитопы района preS поверхностного белка вируса гепатита В и суппозиторная форма для их доставки Л.И. Карпенко, T.A Веремейко, Н.Н. Нагайцева, Л.Р. Лебедев, Б.Н. Зайцев, Н.А. Некрасова, Г.М. Левагина, T.A. Терещенко, A.A. Ильичев НИИ биоинженерии, НИКТИ биологически активных веществ, ГНЦ ВБ “Вектор”, Кольцово Новосибирская обл. 630559, Россия Строение вириона HBV Рекомбинантные вирусоподобные частицы –новое направление в создании вакцин. Одним из наиболее перспективных вирусоподобных частиц является коровый антиген вируса гепатита В (HBсAg). Данный белок может быть получен как в эукариотической, так и прокариотической системе экспрессии и способен к самосборке в нативные частицы. Кроме того, HBcAg известен как удачный носитель чужеродных эпитопов. Вакцина против гепатита В, использующаяся в настоящее, время основана на поверхностном антигене ВГВ. В тоже время иммунизация шимпанзе рекомбинантным HBcAg также способна обеспечивать частичную защиту против инфекции (Murray K., и др. 1984). Иммунизация HBcAg индуцирует мощный цитотоксический ответ, Т-зависимый и Т- независимый синтез антител, а также HBcAg способен усиливать синтез антител к HBsAg (Milich D.R., и др. 1987). Настоящая работа посвящена конструированию и исследованию свойств химерных частиц HBcAg, несущих протективные эпитопы из районов preS-1 и preS-2 HBsAg. HBs+preS2 HBs HBs+preS1 +preS2 HBcAg ДНК Характеризация полученных рекомбинантных белков Схема конструирования химерных частиц HBcAg 1 2 3 4 5 A - 24kD Олигонуклеотидв кодирующие эпитопы HBsAg HBV ген HBc Электромикроскопия очищенных частиц химерных HBcAg. AHBc-preS1 B.HBc-preS2 pUC8HBc pUC8HBc -preS1 pUC8HBc -preS2 -18kD 27 38 DHQLDPAFRAN B 100nm preS1 131 preS2 145 LQDPRVRGLYFPAGG Western-blot анализ с использованием antiHBcAg моноклональных антител. 1Лизат E.coli DH5F’ 2 Очищенный HBcAg 3 Лизат E.coli DH5F’/pUC8HBc-preS1 4 Лизат E.coli DH5F’/pUC8HBc-preS2 100 nm Группы по 5 мышей линии BALB/c были трехкратно внутримышечно иммунизированы 5 g рекомбинантных белков в адъюванте Фрейнда Гуморальный иммунный ответ после трехкратной иммунизации анализировался с помощью ИФА. В качестве антигенов были использованы рекомбинантные белки HBc, HBc-preS1 and HBc-preS2. HBc-preS1 c Адъювантом Фрейнда 60000 50000 OD 405 nm 3000 HBc-preS1 c адьювантом Фрейнда 3.0 2500 40000 1/титр Гуморальный иммунный ответ после трехкратной иммунизации анализировался с помощью ИФА. В качестве антигенов были использованы пептиды DHQLDPAFRAN (27-38 preS1) для группы мышей, иммунизированных HBc-preS1 белком и LQDPRVRGLYFPAGG (131-145 preS2) для мышей иммунизированных HBc-prerS2 2.5 HBc-preS2 c Адъювантом Фрейнда 30000 20000 2000 HBc-preS2 с адьювантом Фрейнда не иммунизирован ные мыши 2.0 1500 1.5 1000 Не иммунизированные мыши 10000 500 1.0 0.50 0 HBc 1 HBc-preS1 HBc-preS2 1 2 3 4 -500 0 Антиген 1/200 1/400 1/800 1/1600 Разведения сыворотки Для успешного проведения всемирных программ вакцинации необходимо создание эффективных вакцин, удобных в применении и хранении. Аттенуированные штаммы Salmonella широко исследуются как живые бактериальные вектора для доставки гетерологичных антигенов, т.к. эти внутриклеточные бактерии стимулируют гуморальный, мукозальный и клеточный иммунный ответ у человека и лабораторных животных. Аттенуированные штаммы Salmonella колонизируют лимфоидные ткани кишечника, затем распространяются в другие ткани иммунной системы, такие как ткани селезенки и печени. После периода персистенции аттенуированные штаммы Salmonella элиминируют из организма. Salmonella как вектор доставки антигенов Tag promotor ген HBc Гуморальный и мукозальный иммунный ответ. Группы по 20 мышей BALB/c были иммунизированы перректально рекомбинатными штаммами Salmonella/pKHBc pKHBc Ap Трансформация клеток Salmonella Col E1 Ori Анти-HBc IgG сыворотки Анти-HBc IgA слизистой кишечника Проникновение клеток Salmonella в Гастроткани 350 3500 4000 400 интерстициональный тракт 300 3000 3000 2500 EE2323/pKHBc pKHBc 2000 2000 T10 pKHBc T 10/pKHBc 1500 1000 1000 Клетки Salmonella. продуцирующие белок HBc Salmonella Бактериальный лизис Перректальная иммунизация Индукция плазматических и Т-хелперных клеток Tх* Tх MHC-II + Антиген B* TCR B Антиген 250 300 200 MHC-I + Aнтиген M клетка 200 150 Tц Tц* Л Л TCR 100 500 100 50 0 00 0 2 4 5 Mф Л ДК 2 6 недель после иммунизации Mф 2 4 4 Mф 66 недель после иммунизации Среди современных подходов к созданию вакцин весьма перспективными представляются неинвазивные формы вакцин, которые вводят в организм через слизистые оболочки. Мы предлагаем перректальную форму введения сконструированных рекомбинантных Salmonella. Такие вакцины могут индуцировать не только системный, но и мукозальный иммунный ответ, формируя защиту у ворот инфекции. В медицинской практике используются суппозитории, содержащие живые микроорганизмы. Суппозиторные формы, содержащие бактерии используются для лечения дизбактериозов и воспалительных процессов. Мы разработали технологию производства суппозиторной формы вакцины, содержащей клетки рекомбинантного аттенуированного штамма сальмонелл. Бактерии сохраняют жизнеспособность в составе суппозитория в течении длительного времени (данные представлены в таблице). 1 месяц 3 месяца Жизне Стабил Жизне споьспособнос ность собнос ть ть E23 pKHBc 3,5 108 · 100% 2,7 107 Заключение: В качестве кандидатов в 6 месяцев Стабил Жизне Стаби ьспосо льность бность Ность · 100% 1,5 · 100% 107 вакцину созданы антигены HBc-preS1 HBcpreS2, представляющие собой коровый антиген ВГВ, несущий эпитопы поверхностного белка ВГВ. Для эффективной доставки антигена был предложен перректальный способ введения с помощью рекомбинантных аттенуированных штаммов сальмонелл. Разработана форма вакцинного препарата в виде суппозиториев. Работа была выполнена в рамках федеральной целевой научно-технической программы “Исследования и разработки по приоритетным направлениям развития науки и техники” подраздел “Защита от патогенов”