Средства, влияющие на желудочно кишечный тракт
реклама

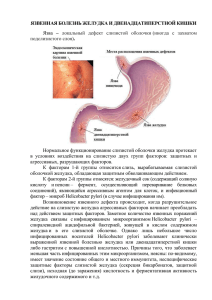
Средства, влияющие на желудочно кишечный тракт Кафедра фармакологии ЧелГМА Заведующий кафедрой профессор Волчегорский И. А. 2011 год Желудок Гистология, функции клеток, теории язвообразования Площадь слизистой оболочки желудка – 526-525 см2; толщина – 0,25-1,0 мм; V – 16-45 см3; на ней расположено от 4 до 25 миллионов желез. Слизистая оболочка Подслизистая оболочка Мышечный слой Серозная оболочка Кардиальный и антральный отделы желудка Слизистые клетки в эпителии желез и на поверхности слизистой оболочки фундального отдела желудка Шеечные мукоциты вырабатывают простагландин, слизь, нейтральные гликопротеины, сиаломуцины, обеспечивают высокую степень пролиферации. Фундальный отдел желудка Главные клетки локализованы в базальной части фундальных желез, осуществляют синтез и секрецию пепсиногена Париетальные (обкладочные) клетки, локализованы в области перешейка, секретируют соляную кислоту Фундальные железы Эндокринные клетки, локализованы в эпителии желез собственного слоя слизистой оболочки желудка, вырабатывают полипетидные гормоны и биогенные амины А энтероглюкагон D соматостатин D1 вазоактивный интенстициальный пептид ЕC серотонин ЕС1 (ECL) ЕС2 серотонин гистамин субстанция Р(нейропептид) серотонин мотилин G гастрин I холецистокинин K желудочно-ингибирующий пептид, секретин двенадцатиперстной кишки S секретин Типы и функции основных эндокринных клеток Энтерохромаффиноподобные клетки (ECL) – 35% всех эндокринных клеток Локализация – фундальный отдел Функция – вырабатывают гистамин (хромогранин), регулируют секрецию соляной кислоты Гастринпродуцирующие клетки (G) Локализация – нижняя треть пилорических желез Энтерохромаффинные клетки (ЕС) – 25% всех эндокринных клеток. Функция – вырабатывают серотонин (78% вырабатываются тучными клетками, 22% эндокринными клетками) D-клетки (26%) - всех эндокринных клеток Локализация – пилорический отдел Функция – секретирует соматостатин, который тормозит эффект гастрина и ингибирует секрецию НСl; вырабатывает секретоневрин, являющийся основным модулятором моторики ЖКТ Классификация гастритов Модифицированная Сиднейская система 1990 – девятый Международный конгресс гастроэнтерологов (патология, топография, гистология) Тип гастрита Синонимы Этиологические факторы Неатрофический Поверхностный, диффузный антральный интерстициальный гиперсекреторный тип В H. pylori и другие Атрофический Тип А, диффузный тела желудка ассоциированный с пернициозной анемией Аутоиммунный H. pylori, особенности питания, факторы среды Особые формы Химический Реактивный рефлюс-гастрит, тип С Радиационный Химические раздражители, желчь, НПВП Лучевые поражения Лимфоцитарный Бариломорфный ассоциированный с целиакией Болезнь крона, саркоидоз, гранулематоз Вегенера, инородные тела, идиопатический Эозинофильный Пищевая аллергия, другие аллергены Аллергический Другие инфекционные Бактерии, кроме H. pylori, вирусы, грибы, паразиты Полуколичественная оценка морфологических изменений при хроническом гастрите Обсеменение Н .pylori Инфильтрация лейкоцитами Хроническое воспаление Атрофия Кишечная метаплазия При обнаружении, хотя бы в одном из биоптатов в гистологический диагноз хронического гастрита вносится «ассоциированный с Н. pylori гастрит». Если этиология была доказана другими методами (серология, дыхательный тест) в морфологическом диагнозе диагнозе этиология не указывается. Основной показатель активности. Активность хронического гастрита может быть обусловлена также Т-лимфоцитами и другими эффекторными клетками участвующими в повреждении ткани с разрушением желез. В норме слизистая оболочка желудка содержит не более 2-5 лимфоцитов в поле зрения (объектив х40). Наличие даже 1-2 плазмоцитов в поле зрения уже свидетельствует о хроническом воспалении Считается, что в норме в поле зрения (х40) видно 3-4 поперечно срезанные железы. Если их меньше - можно диагностировать атрофию. Оценка ее должна быть и качественной и количественной. Необходимо указать тип метаплазии (неполную метаплазию связывают с развитием рака) Теории этиопатогенеза язвенной болезни Этап Год Теория Автор I 1852 сосудистая Virchow R. 1856 кислотно-пептическая Bernard C. 1912 механическая Aschoff L. 1926 воспалительная Palmer E. 1930 ацидозная Балинт-Зимницкий 1954 слизистого барьера Hollander F. 1913 неврогенная Bergman G. 1934 психо-соматическая Alexander F. 1935 нервно-трофическая Сперанский А.Д 1937 «вегетативной болезни» Hetenij Р. 1949 кортико-висцеральная Быков К.М. и Курцин И.Т. 1953 нервно-вегетативная Katsch G. 1963 нервно-гормональная Рысс С. М., Радбиль О.С., Боянович К. Д. 1968 гиперсекреции адренокортикоидов Katz R., Siegel С. 1983 инфекционная (Helicobacter pylori) Warren J. и Marshall B. II III Развитие инфекционной концепции язвообразования • • • • • • • • • • • • • • • • • • 1852 Bidder F., Schmidt C. Впервые обнаружили уреазу в желудке животных. 1874 Bottcher G., Lettulle M. Предположили, что причиной язвенной болезни может быть бактерия, первыми описали бактерии в желудке собак. 1893 Bizzozero G. 1896 Salomon H. Описали спиральные микроорганизмы, располагающиеся в толще слизи и на поверхности слизистой оболочки желудка кошек и собак, которых они назвали «желудочными спириллами». 1906 Balfor A. Описал спиралевидные бактерии в язвах желудка и тонкой кишки у кошек и собак. 1906 Krienitz W. Впервые описал спирохеты на изъявившейся карциноме желудка человека. 1913 Fibiger J. Впервые создал экспериментальную модель рака желудка у мышей при введении в их пищу Spiroptera carcinoma, за что в 1927 году получил Нобелевскую премию. 1916 Kassi K., Kabayashi R. Описали спирохеты в желудке у млекопитающих. 1924 Luck J.M, Seth T.N. Обнаружили активную уреазу в желудке человека. 1938 Doenges J. Описал спирохеты в желудке человека. 1940 Freedberg S., Barron L. Впервые описали спирохеты в прижизненном материале слизистой резецированного желудка больных. 1951 Allende J. Опубликовал монографию по успешному лечению язвы желудка пенициллином. 1955 Kornberg H.L., Davis R.E. Выдвинули предположение о бактериальной природе уреазы желудка человека. 1975 Steer H.W., Colin-Jones D.G. Описали спиралевидные бактерии на эпителии желудка, открыли их муколитические свойства и предположили их связь с язвообразованием. 1983 Warren J.R., Marshall B.J. Описали неидентифицированные изогнутые бактерии на эпителии желудка и доказал их связь с активным хроническим антральным гастритом. 1984 Skirrow M. Воспроизвел работу B.J. Marshall и J.R. Warren. 1984 Marshall B.J., Goodwin S. Получили культуру спиралевидных бактерий и назвали их Campilobacter pyloridis. НР располагаются на поверхности эпителиальных клеток и «окутаны» слизью. Они видны на вершинах валиков, боковой их поверхности и в глубине ямок, местами они как бы разрывают эпителиальный покров и разъединяя эпителий, внедряются в межклеточное пространство, не проникая при этом за базальную мембрану. слабая степень (+) – до 20 микробных тел в поле зрения средняя степень (++) – от 20 до 50 микробных тел в поле зрения высокая степень (+++) – более 50 микробных тел в поле зрения Нelicobacter Рylori (НР), открытый в 1983 году – микроаэрофильная, грам-отрицательная, оксидаза - и каталаза – положительная бактерия С помощью уреазаы НР расщепляет мочевину пищевых продуктов, окружает себя аммиаком и двуокисью углерода, что обеспечивает защиту от соляной кислоты. Этому способствует также наличие каталазы и расположение бактерии в подслизистом слое. Уреаза обеспечивает вирулентность НР и проникновение бактерии в межклеточные пространства, где аммиак оказывает повреждающее действие на эпителий желудка. Физиологические медиаторы и лекарственные средства влияющие на желудочную секрецию. Гистамин Стимуляция Н1-рецепторов активация фосфолипазы С гидролиз фосфолипидов клеточной мембраны диаглицерол (ДАГ) инозитолтрифосфат (ИФ3) быстрыйвыход Са2+ из саркоплазматического ретикулума. ДАГ + Са2+ активация протеинкиназы С Са2+ активация Са2+- кальмодулинзависимых протеинкиназ фосфолипазы А2 Стимуляция Н2-рецепторов активация аденилатциклазы (бронхи, кишечник, нервная ткань) протеинкиназы А образование ИФ3 повышение концентрации Са2+ в цитоплазме активация Са2+-кальмодулинзависимой киназы легких цепей миозина образование актомиозиновых мостиков Гистамин Сосудорасширяющее действие гистамина связано с активацией Н1-рецепторов эндотелиальных клеток и Н2 – рецепторов гладкомышечных клеток возрастанием концентрация Са2+ в цитоплазме, активацией фосфолипазы А2 и образованием NO (Palmer et al., 1987). Диффузия NO в гладкомышечные клетки, активирует гуанилатциклазу, вызывает накопление цГМФ которая стимулирует протеинкиназу G и фосфорилирование фосфоламбана, что приводит к активации транспорта ионов кальция Ca2+-АТФазой в саркоплазматический ретикулюм, снижению уровня Са2+ в цитоплазме и разобщению актина и миозина. Кроме того, активация фосфолипазы А2 в эндотелиальных клетках увеличивает продукцию простагландинов, в основном простациклина который, действуя на гладкомышечные клетки сосудов, вносит важный вклад в сосудорасширяющее действие гистамина. В желудке гистамин воздействует на Н2 - рецепторы на мембранах обкладочных клеток, в результате чего повышается уровень цАМФ, активируется Н+- К+АТФ аза – повышается секреция иона Н+ в просвет желудка, что приводит к увеличению содержания HCl в желудочном содержимом. Действие гистамина на главные клетки приводит к увеличению секреции пепсиногена по аналогичному механизму. Блокаторы Н2 подтипа рецепторов гистамина: а) средства 1-го поколения циметидин б) средства 2 и 3 поколений ранитидин (зантак) фамотидин (квамател) низатидин Механизм действия: конкурентная блокада рецепторов гистамина Н2 подтипа на мембранах обкладочных клеток. Эффект: возникающее в результате снижение активности аденнилатциклазы приводит к снижению уровня внутриклеточного 3,5 цАМФ и подавлению функции Н+ К+ - АТФ-азы. Снижается секреция иона Н+ в просвет желудка и снижается количество HCL в желудочном соке. Конкурентная блокада рецептров гистамина Н2 подтипа на мембранах главных клеток приводит к уменьшению секреции пепсиногена по тому же механизму. Блокаторы Н1 подтипа рецепторов гистамина Блокада рецепторов гистамина Н2 - подтипа не устраняет его эффекты стимуляции рецепторов Н1 подтипа Блокаторы Н2 подтипа рецепторов гистамина Показания: 1) язвенная болезнь желудка и 12-перстной кишки (во всех фазах) 2) рефлюкс-эзофагиты 3) гиперацидные эрозивные гастриты 4) эрозивные и язвенные поражения желудка при выраженном стрессе, кровопотере и шоке Побочные эффекты: Циметидин 1) антиандрогенное действие (блокада рецепторов андрогенов - импотенция и гинекомастия) 2) угнетение микросомального окисления ксенобиотиков в печени (увеличение периода полувыведения и потенциирование эффекта диазепама и анаприлина) 3) лейкопения У препаратов второго и третьего поколений отмечаются: 1) диспепсия 2) астения и головная боль 3) кожные высыпания Блокаторы Н2 подтипа рецепторов гистамина Фармакокинетика. H2-блокаторы быстро всасываются после приема внутрь; максимальная сывороточная концентрация достигается через 1—3 ч. В отличие от ингибиторов Н+,К+-АТФазы, они мало связываются с белками плазмы и лишь на 10—35% метаболизируются в печени. Исходные вещества и их метаболиты выводятся почками путем клубочковой фильтрации и канальцевой секреции. При их снижении дозы Н2-блокаторов следует уменьшать Гемодиализ и перитонеальный диализ удаляют лишь очень небольшую часть этих препаратов. Болезни печени сами по себе не требуют снижения доз, но это необходимо в тяжелых случаях, когда одновременно нарушается функция почек. Н2-блокаторы применяются внутрь, в/в и в/м. В/в введение быстро создает терапевтическую сывороточную концентрацию, которая сохраняется несколько часов (5 ч для циметидина, 6 - 8 ч для ранитидина и 10 - 12 ч для фамотидина). Побочные эффекты и лекарственные взаимодействия. Риск побочных эффектов не превышает 3%, обычно они незначительные (понос, головная боль, сонливость, утомляемость, миалгия, запор). Реже, в основном на фоне в/в введения, возникают более тяжелые осложнения со стороны ЦНС (оглушенность, делирий, галлюцинации, дизартрия, сильная головная боль). Циметидин блокирует андрогеновые рецепторы и нарушает гидроксилирование эстрадиола цитохромом Р450, что может вызывать гинекомастию у мужчин и галакторею у женщин; описаны случаи олигозооспермии и обратимой импотенции. Возможно угнетение кроветворения, в том числе тромбоцитопения. Н2-блокаторы проникают через плаценту и выводятся с молоком. Сведений о тератогенных свойствах Н2-блокаторов нет, но при беременности их надо использовать с осторожностью. Все препараты, снижающие кислотность желудочного содержимого, могут нарушать всасывание Н2-блокаторов, уменьшая их биодоступность. Циметидин сильнее других Н2-блокаторов ингибирует цитохром Р450, из-за чего может нарушать метаболизм и повышать сывороточные концентрации препаратов, выступающих субстратами цитохрома Р450, включая варфарин, фенитоин, некоторые адреноблокаторы, хинидин, кофеин, трициклические антидепрессанты, теофиллин, хлордиазепоксид, карбамазепин, метронидазол, антагонисты кальция и производные сульфанилмочевины. Циметидин ингибирует канальцевую секрецию прокаинамида, повышая сывороточную концентрацию этого препарата и его активного метаболита N-ацетилпрокаинамида. Ацетилхолин Ацетилхолин М1, М3 холинорецепторы Gq-белки фосфолипаза С инозитол-1,4,5-трифосфат высвобождение ионов Са2+ из саркоплазматического ретикулума фосфатидилинозитол- 4,5-дифосфат диацилглицерол активация протеинкиназы С облегчение транслокации протеинкиназы С из цитозоля в плазматическую мембрану повышение сродства протеинкиназы С к Са-кальмодулину активация протеинкиназы С при более низкой концентрации Са2+ в цитоплазме повышение секреторной и сократительной активности клеток М-холиноблокаторы Неселективные: атропин, платифилин, метацин Селективные (блокаторы холинорецепторов М1-подтипа): пирензепин Атропин и другие неселективные М-холиноблокаторы уменьшают секрецию соляной кислоты, так как • • • • блокируют: М3-холинорецепторы париетальных клеток (уменьшается продукция соляной кислоты); М1-холинорецепторы энтерохромаффиноподобных клеток (уменьшается выделение гистамина, стимулирующего париетальные клетки); М3-холинорецепторы G-клеток, выделяющих гастрин (уменьшается продукция гастрина, стимулирующего энтерохромаффиноподобные клетки); М2-холинорецепторы D-клеток желудка, продуцирующих соматостатин (при блокаде М2-холинорецепторов выделение соматостатина усиливается; соматостатин снижает активность энтерохромаффиноподобных клеток и выделение гастрина). Селективнный блокатор холинорецепторов М1- подтипа - пирензепин (гастроцепин) – трициклическое соединение бензодиазепина, подавляет выделение гистамина из мастоцитов подслизистой, блокируют интрамуральные парасимпатические ганглии желудка - в результате подавляется секреция гастрина, пепсиногена и соляной кислоты; не подавляет продукцию слизи, тормозит протеолитические процессы в эпителии, улучшает кровоснабжение и регенерацию слизистой оболочки желудка Эффекты атропина зависят от дозы. В первую очередь нарушаются функции, в наибольшей степени зависимые от парасимпатической регуляции. В малых дозах: тормозит отделение секретов потовых, слезных, слюнных, бронхиальных желез (блокада М3ХР). В средних дозах: вызывает мидриаз, паралич аккомодации (М3ХР) и тахикардию (М2ХР). В больших дозах: расслабляет гладкие мышцы бронхов, кишечника, мочевого пузыря (М3ХР). В очень больших дозах: уменьшает секрецию муцина, пепсина и соляной кислоты в составе желудочного сока (М3ХР). Дозы Эффекты 0,5 мг Сухость кожи, незначительная сухость во рту и снижение частоты сердечных сокращений 1 мг Сухость во рту, жажда, тахикардия, умеренное расширение зрачков 2 мг Сильная сухость во рту, тахикардия, максимальное расширение зрачков, паралич аккомодации 5 мг Выражены вышеперечисленные нарушения, затруднение речи и глотания, беспокойство, расстройство мочеиспускания, угнетение перистальтики желудка и кишечника 10мг и более Выражены вышеперечисленные нарушения, пульс частый и слабый, кожа сухая, покрыта сыпью; бред, галлюцинации, делирий; кома Ацетилхолин Ганглиоблокаторы. Ганглиоблокаторы блокируют NN - холинорецепторы нейронов симпатических и парасимпатических ганглиев, хромаффинных клеток мозгового вещества надпочечников, каротидных клубочков, блокируя в равной степени симпатическую и парасимпатическую иннервацию на уровне ганглиев. На фоне действия ганглиоблокаторов М-холиномиметики, адреномиметики вызывают обычные эффекты. Ганглиоблокаторы действуют как антагонисты NN-холинорецепторов вегетативных ганглиев. Их действие проявляется в устранении влияний симпатической и парасимпатической иннервации. Чем больше выражено влияние того или иного вида иннервации на орган, тем более выраженными будут проявления блокирующего действия. Сокращения гладких мышц желудочно-кишечного тракта и мочевого пузыря (за исключением сфинктеров), а также секреция слюнных, бронхиальных желез, желез желудка и кишечника определяются стимулирующим влиянием парасимпатической иннервации. Ганглиоблокаторы снижают перистальтику желудочно-кишечного тракта, тонус мочевого пузыря, секрецию бронхиальных и пищеварительных желез. Побочные эффекты ганглиоблокаторов: мидриаз, паралич аккомодации, сухость во рту, заложенность носа, снижение моторики кишечника и тонуса мочевого пузыря, выраженная ортостатическая гипотензия. Гастрин Гастрин содержится в D – клетках слизистой желудка. Рецепторы – холецистокининовые ССКв – рецепторы. Вторичный внутриклеточный посредник – ионы Са2+. Соматостатин - существует в двух биологически активных формах, происходящих от одного предшественника и различающихся длиной N-остатка. Функция: подавляет секрецию гипоталамусом соматостатин-рилизинг гормона и секрецию передней долей гипофиза соматотропного и тиреотропного гормона. Также угнетает секрецию гормонально активных пептидов и серотонина, продуцируемых в желудке, кишечнике, печени и пожделудочной железе. В частности, он понижает секрецию инсулина, глюкагона, гастрина, холецистокинина, вазоактивного интестинального пептида, инсулиноподобного фактора роста-1. Кофеин Механизм действия: взаимодействует с пуринергическими нейронами. Медиаторы: аденозин и АТФ. Органы получающие пуринергические волокна: сердце, кровеносные сосуды, почки, желудок, кишечник, жировая клетчатка. Типы пуриновых рецепторов: А1-рецепторы: • посредством G-белка ингибируют аденилатциклазу и снижают в клетках синтез цАМФ, • блокируют кальциевые каналы • увеличивают калиевую проводимость мембран. • уменьшают выделение нейромедиаторов — дофамина, норадреналина, серотонина, ацетилхолина, аспарагиновой и глутаминовой кислот. Основные эффекты А1-рецепторов: • угнетение ЦНС — снижение спонтанной активности нейронов, двигательной активности, противотревожный эффект, подавление судорог, эпилептических припадков, центральная миорелаксация, угнетение дыхания; • ослабление сердечной деятельности — снижение атриовентрикулярной проводимости, частоты и силы сокращений сердца; • сужение приносящей артериолы почечных клубочков с ухудшением фильтрации первичной мочи; торможение освобождения ренина и эритропоэтина в почках; • подавление липолиза в жировой ткани. Кофеин А2-рецепторы активируют аденилатциклазу, повышают синтез цАМФ. Эффекты А2-рецепторов: расширяют сосуды (суживают только приносящую артериолу почечных клубочков), стимулируют продукцию эритропоэтина, тормозят агрегацию тромбоцитов. Аденозин: вызывает бронхоспазм у больных бронхиальной астмой; освобождает гистамин из тучных клеток; улучшает процессы всасывания в кишечнике, расширяя его сосуды; тормозит перистальтику кишечника; модулирует секрецию желудочного сока и сока поджелудочной железы . Пуриновые рецепторы второго типа (Р2): реагируют на АТФ и в меньшей степени — на аденозин. Р2Х -рецепторы открывают натриевые, калиевые и кальциевые каналы. Р2Y-рецепторы, ассоциированные с G-белками, повышают синтез инозитолтрифосфата и диацилглицерола. Кофеин: блокирует A1-рецепторы, повышает синтез цАМФ. в больших дозах ингибирует фосфодиэстеразу, что задерживает инактивацию цАМФ, в ЦНС, сердце, гладких и скелетных мышцах, жировой ткани. увеличивает выделение нейромедиаторов, усиливает передачу в дофаминергических синапсах, Протонная помпа (Н\К+-АТФаза) Физиология и фармакология желудочной секреции. (по Goodman и Gillmann, Pharmacological basics of therapeutics, 2006 ) Представлены взаимоотношения между энтерохромаффиноподобными клетками, выделяющими гистамин, обкладочными клетками, образующими соляную кислоту, и эпителием, который вырабатывает слизь и ионы бикарбоната, обеспечивая защиту слизистой. Черными стрелками обозначены стимулирующие (+) и тормозные (-) регуляторные влияния; пунктирными стрелками — действие препаратов, имитирующее или усиливающее физиологические эффекты; серыми линиями с крестиками — блокирующее действие препаратов. 1 — преганглионарные парасимпатические нейроны, 2 — постганглионарные парасимпатические нейроны. АХ — ацетилхолин, ПГЕ2 — простагландин Е2, ПП2 — простациклин, ЭХП — энтерохромаффиноподобная клетка, ССКВ — рецепторы гастрина (холецистокининовые ССКврецепторы), ЕР3 — ЕР3-рецепторы, Н — гистаминовые рецепторы, М — М-холинорецепторы, N — N-холинорецепторы. Вторичные посредники М3 – холинорецепторов ацетилхолина, Н2 – рецепторов гистамина и холецистокининовых ССКв рецепторов гастрина (АТФ и ионы Са2+) активируют «протонную помпу» - Н+К+ АТФазу. Этот белок создает максимальный градиент pH описанный у позвоночных, от 7,3 внутри обкладочных клеток, до 0,8 в просвете канальцев. Ингибиторы Н\К+-АТФазы Строение и фармакодинамика. Ингибиторы Н+,К+-АТФа-зы (омепразол, лансопразол, рабепразол и пантопразол) — производные а-пиридинилметилсульфинилбензимидазола с различными заместителями в пиридиновом и бензимидазольном фрагментах, близкие по фармакологическим свойствам. Все препараты этой группы являются неактивными предшественниками, активирующимися в кислой среде. Они попадают через кровь в обкладочные клетки и, будучи слабыми основаниями, накапливаются в секреторных канальцах, в кислой среде которых происходит активация препаратов с образованием сульфенамидов и сульфеновых кислот. Благодаря сродству к сульфгидрильным группам эти метаболиты ковалентно связываются с остатками цистеина, входящими во внеклеточный домен Н+,К+-АТФазы. Так, связывание с Цис813 вызывает необратимую инактивацию Н+,К+-АТФазы и прекращает секрецию ионов Н+. Лечебные дозы ингибиторов Н+,К+-АТФазы (например, омепразол, 20 мг/сут в течение 1 нед) подавляют секрецию cоляной кислоты более чем на 95%. Секреция возобновляется лишь после встраивания в мембрану новых молекул Н+,К+-АТФазы. Кроме того, омепразол избирательно ингибирует карбоангидразу слизистой желудка, что также способствует снижению кислотности желудочного содержимого. Ингибиторы Н+,К+-АТФазы. А. Химическое строение. Б. Активация омепразола в кислой среде канальцев обкладочных клеток. Сульфенамид необратимо ковалентно связывается с сульфгидрильными группами внеклеточного домена Н+, К+-АТФазы и ингибируют его. (по Goodman и Gillmann, Pharmacological basics of therapeutics, 2006 ) Фармакокинетика. При низком рН ингибиторы Н+,К+-АТФазы разрушаются, и поэтому их выпускают в кислотоустойчивой оболочке – в таблетках или гранулах, покрытых желатиновой капсулой, которая растворяется только в щелочной среде кишечника. Поскольку ингибиторы Н+,К+-АТФазы активируются в кислой среде, их нужно принимать перед едой или вместе с едой, так как пища стимулирует выработку соляной кислоты. Совместное назначение препаратов, снижающих кислотность (например, Н2-блокаторов), ослабляет действие ингибиторов Н+,К+АТФазы. Поскольку не все молекулы Н+,К+-АТФазы и обкладочные клетки работают одновременно, максимальный эффект достигается лишь после нескольких приемов препарата. Ингибиторы Н+,К+-АТФазы быстро всасываются, в значительной степени связываются с белками плазмы и окисляются микросомальными ферментами печени, особенно изоферментами НС 19 и IIIA4 цитохрома Р450. Их метаболиты выводятся с мочой и калом в виде сульфатов. Т1/2 ингибиторов Н+,К+-АТФазы составляет 1-2 часа, но продолжительность действия намного дольше . ХПН и цирроз печени не ведут к накоплению препаратов при приеме 1 раз в сутки. При назначении 1 раз в сутки для постоянного уровня ингибирования (около 70% Н+,К+-АТФазы) требуется 2—5 сут (Sachs, 2000). Поскольку активные метаболиты связываются с Н+,К+-АТФазой необратимо, действие ингибиторов Н+,К+АТФазы длится не менее 1 —2 сут, пока не образуются новые молекулы этого белка, и мало зависит от их Т1/2. Побочные эффекты и лекарственные взаимодействия. Ингибиторы Н+,К+-АТФазы угнетают микросомальные ферменты печени, замедляя метаболизм бензодиазепинов, варфарина, фенитоина и многих других препаратов. Побочные эффекты ингибиторов Н+,К+-АТФазы минимальны: возможны тошнота, боль в животе, запор, метеоризм и понос, изредка встречаются подострая миопатия, артралгия, сыпь и головная боль. Длительное лечение омепразолом нарушает всасывание витамина В 12, в 5—10% случаев существенно повышается сывороточная концентрация гастрина (> 500 нг/л). Показания. Ингибиторы Н+,К+- АТФазы назначают главным образом для лечения рефлюкс-эзофагита (при неэффективности Н2-блокаторов) и язвенной болезни, а также при синдроме ЗоллингераЭллисона. Эрадикация Helicobacter pylori Стандартная эрадикационная терапия при инфицировании Нelicobacter Рylori (в соответствии с Маастрихтскими договоренностями 1996, 2000 г. ) Первая линия Ингибитор Протонной Помпы Кларитромицин Амоксициллин Метронидазол Стандартная дозировка омепразол (20 мг х 2) ланзопразол (30 мг х 2) пантопразол (40 мг х 2) рабепразол (20 мг х 2) эзомепразол (20 мг х 2) 500 мг х 2 500 мг х 2 1000 мг х 2 Вторая линия Ингибитор Протонной Помпы Висмут Тетрациклин Метронидазол Стандартная дозировка субцитрат (120 мг х 4) субсалицилат (600 мг х 4) 500 мг х 4 500 мг х 3 «Терапия спасения» При неэффективности стандартных схем эрадикации рекомендуется применение следующих схем терапии: ИПП + Амоксициллин в высоких дозах (3 г/сут) в течение 10-14 дней; ИПП + Амоксициллин + Левофлоксацинв течение 7-10 дней; ИПП + Висмут + Тетрациклин + Фуразолидон в течение 7 дней. Уничтожение Helicobacter pylori показано при гастрите, язвенной болезни, раке и В-клеточной лимфоме желудка (Veldhuyzen and Lee, 1999). Уничтожение Helicobacter pylori почти всегда предотвращает рецидив (если больной неполучает НПВС). Следует учитывать: А) монотерапия любым антибиотиком неэффективна и ведет к лекарственной устойчивости. Б) ингибиторы Н+,К+-АТФазы и Н2-блокаторы усиливают действие антибиотиков, активность которых зависит от рН (амоксициллина и кларитромицина). В) курсы лечения 10-14 суток эффективнее более коротких курсов. Устойчивость к кларитромицину вызвана мутациями генов рибосомных белков, в результате чего антибиотик утрачивает способность связываться с рибосомами (устойчивость по принципу «все или ничего»). Устойчивость к метронидазолу связана с несколькими различными мутациями, может быть выражена в большей или меньшей степени. Защитные системы слизистой желудка и влияющие на них средства Гастрит и язвенная болезнь, как нарушение равновесия между защитными системами слизистой и повреждающими факторами. Соляная кислота и пепсин Защитные системы слизистой: бикарбонат, слизь, простагландины, окись азота, факторы роста и другие пептиды НПВС Глюкокортикоиды (блокада ЦОГ1 и синтеза простогландина Е2 и простациклина) Helicobacter pylori Продукция уреазы, нарушение синтеза соматостатина в D-клетках, ослабление их тормозного влияние на выработку гастрина, повышение секреции соляной кислоты в желудке, снижение секреции бикарбоната в двенадцатиперстной кишке Гастропротекторы К гастропротекторам или средствам уменьшающим действие на слизистую оболочку желудка повреждающих факторов относятся: I. Препараты обеспечивающие механическую защиту слизистой оболочки желудка: а) препараты висмута (субцитрат) б) препараты аллюминия (сукралфат) II. Препараты повышающие устойчивость слизи и устойчивость слизистой оболочки к повреждающим факторам: а) мизопростол (синтетический аналог Pg E1) б) карбеноксолон (синтетическое производное глицирризиновой кислоты, извлекаемой из корня солодки голой) Антациды 1. Cредства резорбтивного действия: Na-гидрокарбонат Са-карбонат осажденный 2. Cредства не обладающие резорбтивным действием: Препараты Mg окись Mg трисиликат Mg Препараты Al гидрокись Al фосфат Al 3. Комбинированные препараты Al и Mg Альмагель Маалокс Гелусил Показания: 1) комплексная терапия язвенной болезни желудка 2) гиперацидные сстояния 3) эзофагиты 4) изжога Эффективность антацида зависит от: •скорости его растворения, •гидрофильности, •концентрации оснований, •физиологических свойств катиона •присутствия пищи в желудке. Пища повышает рН примерно до 5 на один час и продлевает действие антацидов на два часа. Ощелачивание желудочного содержимого усиливает моторику желудка за счет выброса гастрина Антациды карбонат натрия, бикарбонат натрия, карбонат кальция системный алкалоз (нейтрализация антацидами соляной кислоты ведет к отсутствию расходования и всасывания собственного бикарбоната), гипернатриемия, выделение углекислого газа при взаимодействии с HCL желудка,растяжение желудка выделяющимся СО2,вторичная волна секреции, метеоризм, отрыжка, изжога, усугубление пищеводного рефлюкса алюминий расслабление гладких мышцы желудка, замедление опорожнения желудка, запор, на фоне почечной недостаточности усугубляет остеопороз, .энцефалопатию и проксимальную миопатию магний стимуляция гладких мышцы желудка, ускорение опорожнения желудка, понос . Повышая рН желудочного содержимого и мочи, антациды влияют на растворение, всасывание, биодоступность и почечную экскрецию многих препаратов. Mg(OH) и Аl(ОН) способны адсорбировать другие препараты, образуя нерастворимые невсасывающиеся комплексы. При неизменной биодоступности препарата, замедление его всасывания при регулярном приеме не играет важной роли. Одновременного приема других препаратов с антцидами лучше избегать; предотвратить большинство лекарственных взаимодействий позволяет назначение антацидов за 2 ч до или через 2 ч после других препаратов. При нормальной функции почек небольшое накопление Аl3+ и Mg2+ не опасно, ионы Са2+ всасываются примерно на 15%; что в норме вызывает преходящую гиперкальциемию, и при ХПН прием даже 3-4 г СаСО3 в сутки может быть опасен. Сравнительная характеристика антацидов (по Goodman и Gillmann, Pharmacological basics of therapeutics, 2006 ) Простагландины Простагландины Е2, Е12 (простациклин) повышения секреции слизи и бикарбоната, усиления кровотока в слизистой ЕР3-рецептор обкладочной клетки снижение активности аденилатциклазы и концентрации цАМФ подавление секреции соляной кислоты Простагландины Поскольку НПВС ингибируют синтез простагландинов, синтетические аналоги последних – способ уменьшить повреждающее действие НПВС на слизистую желудка. Мизопростол (A5-дезокси-16-гидрокси-16-метилпростагландин Е) - синтетический аналог простагландина Е, с метоксигруппой в С-1 (она повышает активность и длительность действия), гидроксигруппой в С-16 вместо С-15 и добавлением метильной группы (что повышает активность препарата при приеме внутрь и длительность действия, а также ослабляет побочные эффекты). Мизопростол вызывает дозозависимое подавление желудочной секреции; 100-200 мкг снижают базальную секрецию соляной кислоты на 85—95%, а секрецию во время еды — на 75—85%. Фармакокинетика. Мизопростол быстро всасывается, при первом прохождении через печень большая его часть гидролизуется до мизопростоловой кислоты, основного активного метаболита. Угнетение желудочной секреции начинается через 30 мин после однократного приема препарата, достигает пика через 1—1,5 ч и длится до 3 ч. Пища и антациды замедляют всасывание мизопростола; при этом максимальная сывороточная концентрация мизопростоловой кислоты становится меньше и достигается позже. Эта кислота выводится в основном с мочой, Т1/2 составляет 20—40 мин. Побочные эффекты. Понос, возникающий примерно у 30% больных и иногда сопровождаемый спастической болью в животе. Риск поноса зависит от дозы; этот побочный эффект возникает примерно через 2 нед от начала лечения и нередко самостоятельно проходит в течение 1 нед. Возможны обострения хронических воспалительных заболеваний кишечника, поэтому таким больным препарат противопоказан. Мизопростол противопоказан при беременности, так как повышает сократимость матки и может вызвать самопроизвольный аборт.