г-ж
реклама

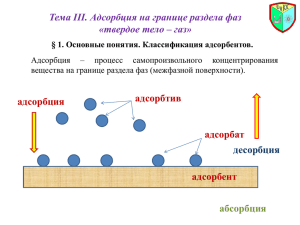
Раздел III. Адсорбция 1 Основные понятия и определения Движущей силой адсорбции является стремление системы уменьшить свою поверхностную энергию за счет уменьшения поверхностного натяжения. S G S Адсорбция – процесс самопроизвольного перераспределения компонентов системы между поверхностным слоем и объемной фазой. На любой границе раздела существует «поверхностный слой» – переходная область от одной объемной фазы к другой. Поверхностный слой имеет очень малую толщину (всего несколько молекул), но в нем сосредоточен весь избыток поверхностной энергии. В однокомпонентных системах при формировании поверхностного слоя происходит изменение его структуры (сгущение, уплотнение), которые часто называют автоадсорбцией. В многокомпонентных системах в поверхностный слой предпочтительнее переходит тот компонент, который сильнее уменьшает межфазное (поверхностное) натяжение. 2 Адсорбент (поглотитель) – вещество, на поверхности которого идет адсорбция. Адсорбат – вещество, которое адсорбируется на поверхности адсорбента (перераспределяется на границе раздела фаз). Адсорбтив – вещество, находящееся в объемной фазе, способное к адсорбции. С термодинамической точки зрения адсорбция – самопроизвольный процесс выравнивания химических потенциалов в объеме системы и поверхностном слое. 3 Количественные способы выражения величины адсорбции 1. Абсолютная адсорбция (А) – количество вещества (моль) в поверхностном слое, приходящееся на единицу площади поверхности или единицу массы адсорбента (моль/м2, моль/г): А nS С SVS CS h s s 2. Гиббсовская (избыточная) адсорбция (Г) – избыточное число моль адсорбата в поверхностном слое по сравнению с тем его количеством, который бы находился в адсорбционном объеме в отсутствие адсорбции: Г N общ CV V s VS (CS CV ) VS CS VS CV А СV h s s s При больших избытках адсорбата в поверхностном слое (СS>>CV), концентрацией адсорбтива в объеме фазы (CV) можно пренебречь, величины А и Г приблизительно равны. Экспериментально определяют величину Г. 4 Классификации адсорбции 1. Классификация по типу взаимодействия адсорбата и адсорбента Различают физическую адсорбцию, хемосорбцию и ионный обмен. Физическая адсорбция Хемосорбция Обусловлена физическими силами (силами Ван-дер-Ваальса) Обусловлена химическими силами Теплота адсорбции мала, 10-40 кДж/моль Теплота адсорбции велика, 40-400 кДж/моль С повышением температуры часто уменьшается (преобладает процесс десорбции) Повышение температуры способствует процессу адсорбции (достигается Еа) Мало специфична, слабо зависит от природы адсорбата Специфична, часто образуется поверхностное химическое соединение Обратима (что адсорбируется, то и десорбируется) Часто необратима Не локализованная (молекулы адсорбата способны перемещаться по поверхности адсорбента) Локализованная (молекулы адсорбата связаны с адсорбентом за счет прочных 5 химических связей) Хемосорбция процесс образования поверхностного химического соединения. Например: хемосорбция кислорода на угле, в результате окисления поверхностных атомов углерода образуются, различные поверхностные оксиды. Не существует четкой границы между физической адсорбцией и хемосорбцией. На практике обычно: основная масса вещества связывается с адсорбентом слабо (физическая адсорбция), а небольшая часть прочно (хемосорбция). Классификация по природе границы раздела твердое тело – газ. жидкость - газ. твердое тело – жидкость (адсорбция из растворов). 6 A f ( p) T2 T1 A f (T ) Основные экспериментальные зависимости адсорбции 1. Изотерма адсорбции - зависимость адсорбции от равновесного давления (концентрации) при Т=const. 2. Изобара (изопикта) адсорбции - зависимость адсорбции от температуры при С, р = const. где: 1 – изобара при физической адсорбции, 2 – изобара при хемосорбции. p f (T ) 3. Изостера адсорбции - зависимость давления от температуры при А=const. 7 В 1915-1917 гг. было получено более 30 адсорбентов, на которых получено, пять основных типов изотерм адсорбции. 8 Адсорбция на границе твердое тело – газ Основные уравнения: 1. Уравнение адсорбции Лэнгмюра (1915 г.) Кр А А 1 Кр КС А А 1 КС Величина А∞ зависит: от числа адсорбционных центров на единице поверхности или массы адсорбента; от размеров молекул адсорбата, чем крупнее молекула, тем меньше А∞. • • 9 Анализ уравнения адсорбции Лэнгмюра Изотерма Лэнгмюра в координатах А=f(p) Изотерма Лэнгмюра в координатах θ =f(p) I - область малых давлений (Кр<<1): А=А∞Kp уравнение Генри θ =Kp III - область больших давлений (Кр>>1): А = А∞ θ=1 10 Расчет констант в уравнении Лэнгмюра Для этого уравнение Лэнгмюра приводят к линейному виду: y=a+bx р р(1 Кр) 1 Кр 1 1 p А А Кр А К А К А р 1 1 р А А К А уравнение Лэнгмюра в линейной форме ctg A 11 2. Уравнение полимолекулярной адсорбции БЭТ. Современная обобщенная теория полимолекулярной адсорбции была развита в 1935-1940 гг. Брунауэром, Эмметом и Теллером. Эта теория получила название теории БЭТ по первым буквам имен авторов A C p pS A 1 p pS 1 (С 1) p pS С К КL ; aж 1 KL ; апара pS C K pS 12 Строим график линейной формы уравнения БЭТ: p pS 1 (С 1) p pS А1 p pS A С A С 13 3. Эмпирическое уравнение адсорбции Фрейндлиха Аp 1 n Физический смысл констант: β – значение адсорбции при парциальном давлении газа, равном единице (при р=1, А = β), β =2 ÷ 2,5 1/n характеризует степень отклонения изотермы адсорбции от прямой линии, 1/n = 0,2 ÷ 0,7. Константы уравнения Фрейндлиха из опытных данных определяют графически. Для этого уравнение логарифмируют: 1 lg A lg lg p n 14 1 lg A lg lg p n Строят график в координатах lg A - lg p: 15 Адсорбция на границе жидкость – газ Особенность границы раздела : на границе раздела фаз нет активных центров, поверхность жидкости гладкая; молекулы адсорбата свободно перемещаются по поверхности адсорбента (жидкости). В результате адсорбции на поверхности жидкости оказывается то вещество, которое в большей степени будет снижать ее поверхностное натяжение. Адсорбция вещества на поверхности жидкости связана с величиной поверхностного натяжения фундаментальным уравнением адсорбции Гиббса. 16 Фундаментальное уравнение адсорбции Гиббса (вывод) Запишем объединенное уравнение первого и второго начал термодинамики для систем с переменным числом моль через изменение энергии Гиббса: dG Vdp SdT i dni ds i dG i dni ds при р, Т = const: (1) i Проинтегрируем уравнение (1), при постоянных интенсивных параметрах (σ, μ): G i ni s (2) Продифференцируем уравнение (2), считая все параметры переменными: dG i dni ni di ds sd i i Вычтем из уравнения (3) уравнение (1): Получим: d ni i s 0 ni di sd (3) (4) i d i à i d i 17 i (5) d Ãi di i Фундаментальное адсорбционное уравнение Гиббса Уравнение теоретически применимо к любой границе раздела фаз, но в основном используется для границ раздела: г-ж и ж-ж, т.к. поверхностное натяжение для этих границ раздела легко определяется из опыта. 18 Получим выражение, связывающее величину поверхностного натяжения с концентраций адсорбата. Для системы. состоящей из двух компонентов: растворителя (1) и растворенного вещества (2) можно записать: d Г1d1 Г 2 d2 В разбавленном растворе d1 0 , тогда: da2 d Г 2 d 2 Г 2 RT a2 a d Г RT da Фундаментальное адсорбционное уравнение Гиббса, выраженное через активность растворенного вещества. В разбавленных растворах неэлектролитов а ≈ С, тогда: Г C RT С Фундаментальное адсорбционное уравнение Гиббса, выраженное через концентрацию растворенного вещества. 19 Анализ адсорбционного уравнения Гиббса C Г RT С Из уравнения Гиббса следует, что концентрирование вещества в поверхностном слое или, наоборот, переход его в объемную фазу определяется знаком производной dσ/dС. I. Если dσ/dC>0, то Г <0, СS < CV , данное вещество ПИВ (поверхностноинактивное). II. Если dσ/dC=0, то Г = 0, СS = CV, данное вещество ПИВ (ПНВ) - растворы сахаров, глицерин. Такие вещества равномерно распределяются между объемом фазы и поверхностным слоем. III. Если dσ/dC<0, то Г >0, СS > CV, данное вещество ПАВ (поверхностноактивное). 20 Свойства ПАВ и ПИВ Поверхностно-инактивные вещества а) σПИВ > σ0; б) ПИВ хорошо растворимы в растворителе и более полярны, чем чистый растворитель; в) ПИВ – электролиты, ионы которых окружены сольватной оболочкой, препятствующей выходу иона в поверхностный слой. Поверхностно-активные вещества а) σПАВ < σ0; б) ПАВ сравнительно малорастворимы и менее полярны, чем чистый растворитель; в) Молекулы ПАВ имеют дифильное строение, т.е. состоят из гидрофильной (полярная группа) и гидрофобной (углеводородная цепь, радикал) группировок – полярные органические вещества. В качестве полярных групп могут выступать: OH, -COOH, -NH2, -CN, -NO, -CHO, -SO2H. 21 Строение адсорбционного слоя на границе раствор - газ В следствие своего дифильного строения молекулы располагаются в поверхностном слое определенным образом: СПАВ мала – псевдогазовые пленки СПАВ средняя - крупные конденсированные кластеры «острова» - псевдожидкие пленки. СПАВ велика (Г∞) - «молекулярный частокол Ленгмюра» из вертикально расположенных молекул. Применение пленок •гашение волн (в древности); •предотвращение высыхания водных бассейнов 22 ПАВ Расчет гиббсовской адсорбции из изотермы поверхностного натяжения (лабораторная работа) Графическое дифференцирование изотермы поверхностного натяжения: в нескольких точках изотермы проводят касательные и определяют тангенсы угла их наклона, которые соответствуют значениям производных ∂σ/∂С в этих точках: Z tg tg C C С Г RT C Z Z RT C RT C Получают зависимость Г=f(C). 23 Применение уравнения Лэнгмюра к адсорбции на границе жидкость-газ. Расчет молекулярных констант ПАВ С 1 1 1. Уравнение Лэнгмюра приводят С Г Г К Г к линейному виду: 2. Строят изотерму адсорбции в линейных координатах: 3. Определяют параметры К и Г∞: 4. Определяют площадь молекулы ПАВ в поверхностном слое (S0): 5. Определяют длину молекулы ПАВ толщину поверхностного слоя (δ): 24 S0 1 Г N A ГМ Эмпирическое уравнение Б.А.Шишковского (1908) 0 kC СПАВ мала: СПАВ средние: 0 В ln( 1 AC) где: В - константа для всего гомологического ряда, А – константа для данного ПАВа. Чтобы выяснить физический смысл констант в уравнении Шишковского, продифференцируем уравнение по концентрации: d ( 0 ) d [ B ln( 1 AC )] dC dC d 1 B A dC 1 AC d AB dC 1 AC Уравнение Шишковского в дифференциальной форме 25 Подставим уравнение Шишковского в дифференциальной форме в уравнение Гиббса: С Г RT С RT С Отсюда: А = К, BA B AC 1 AC RT 1 AC В = Г∞RT. Физический смысл констант в уравнении Шишковского •константа В определяет предельную адсорбцию (независимо от длины углеводородного радикала в гомологическом ряду, каждая молекула занимает одну и туже площадь в поверхностном слое); •константа А - равновесный характер адсорбции (константа равновесия). 26 Поверхностная активность Величина ∂σ/∂С служит характеристикой поведения веществ при адсорбции: g C C 0 Поверхностная активность (g) способность вещества понижать поверхностное натяжение на данной поверхности (Дж·м/моль, Н·м2 /моль):. g tg tg C C 0 С Г g RT Чем больше поверхностная активность, тем больше величина гиббсовской адсорбции. 27 Правило Дюкло – Траубе (1884-1888) Правило Дюкло - Траубе: при увеличении углеводородного радикала на группу –СН2– поверхностная активность увеличивается в 3 – 3,5 раза. g n1 const 3,0 3,5 gn где: 1 – пропанол (С3Н7ОН); 2 – бутанол С4Н9ОН; 28 3 – пентанол С5Н11ОН. Границы применимости правила Дюкло – Траубе 1. Выполняется только для полярного растворителя. Если растворитель не полярный, то с увеличением углеводородного радикала поверхностная активность ПАВ уменьшается (обращение правила). 2. Применимо в области малых концентраций ПАВ в растворе (если «частокол Лэнгмюра», то с увеличением УВрадикала количество ПАВ в поверхностном слое не меняется). 3. Правило выполняется при комнатной температуре, т.к. с увеличением температуры происходит десорбция ПАВ в объем раствора. 29 Работа адсорбции Работа адсорбции (Wадс) – работа перемещения 1 моль ПАВ из объема раствора в поверхностный слой при Т=const. Wадс G S RT ln K где: ΔGS – свободная поверхностная энергия, К – константа адсорбционного равновесия. Рассчитаем разность работ адсорбции для двух соседних членов гомологического ряда: W2 W1 RT ln K n1 RT ln K n RT ln K n1 8,314 298 ln 3,5 3000 Дж / моль Kn Таким образом, для перевода каждой –СН2– группы из поверхностного слоя в объемную фазу надо затратить около 3 кДж/моль работы. 30 Мицеллообразующие ПАВ Мицеллообразующие (коллоидные) ПАВ вещества, очень сильно снижающие величину поверхностного натяжения в области малых концентраций, и, практически, не влияющие на величину поверхностного натяжения в области больших концентраций (кривая 4). Молекулы коллоидных ПАВ состоят из большого гидрофобного углеводородного радикала и сильно гидратирующейся полярной группы. Например: стеариновая кислота: С17Н35СООН, пальмитиновая кислота С15Н31СООН, олеиновая кислота С17Н33СООН. В растворах коллоидных ПАВ самопроизвольно образуются агрегаты из ориентированных молекул – мицеллы. Мицелла - ассоциат дифильных молекул, лиофильные группы которых обращены к растворителю, а лиофобные группы собираются вместе, образуя ядро мицеллы. 31 Прямые мицеллы - мицеллы ПАВ, образующиеся в водной среде (гидрофильные полярные группы снаружи, а гидрофобные углеводородные радикалы – внутри). Обратные мицеллы - мицеллы ПАВ, образующиеся в неполярной жидкости (гидрофильные полярные группы внутри, а гидрофобные углеводородные радикалы – снаружи). Концентрация, при которой происходит образование мицелл, называется критической концентрацией мицеллообразования (ККМ) Растворы коллоидных ПАВ являются лиофильными дисперсными системами, самопроизвольно образующимися с минимумом энергии Гиббса и термодинамически устойчивыми. 32 Мицеллы коллоидных ПАВ: а – сферические; б – дискообразные; в – цилиндрические. При концентрации ПАВ, превышающих ККМ, в растворе образуются сферические мицеллы (мицеллы Гартли). Сферические мицеллы могут содержать от 20 до 100 и более молекул ПАВ. С увеличением концентрации сферические мицеллы принимают цилиндрическую, дискообразную или пластинчатую форму. При концентрациях, в 10-50 раз превышающих ККМ, молекулы ПАВ приобретают цепочечную ориентацию и могут образовывать жидкокристаллическую структуру. 33 Классификация мицеллообразующих ПАВ Анионные ПАВ (соли карбоновых кислот) – органические соединения, диссоциирующие на небольшой катион и крупный анион (например, олеат натрия – С17Н33СООNa). Анионные ПАВ проявляют поверхностную активность, в основном, в щелочной среде. 34 Катионные ПАВ – органические вещества, диссоциирующие на анион (Cl– , SO42–) и поверхностно-активный катион (алифатические и ароматические амины, их соли и др.). Проявляют поверхностную активность, в основном, в кислой среде, обладают низкой «биоразлагаемостью», являются токсичными и используются для изготовления бактерицидных и дезинфицирующих препаратов. Амфолитные ПАВ – органические соединения, содержащие катионную и анионную группы (белковые вещества, аминокислоты). Производство таких веществ ограничено из-за высокой стоимости. Неионогенные ПАВ – вещества, не диссоциирующие на ионы в полярном растворителе. Проявляют хорошие моющие свойства как в кислой, так и в щелочной среде, обладают хорошей «биоразлагаемостью», недорогие в производстве. Многие из таких веществ не имеют ни вкуса, ни запаха, и поэтому, широко применяются в пищевой, парфюмерной и фармацевтической промышленностях. 35 Солюбилизация Солюбилизация - явление растворения веществ в мицеллах ПАВ. В водных мицеллярных системах солюбилизируются вещества, нерастворимые в воде (бензол, органические растворители, жиры), т.к. ядро мицеллы проявляет свойства неполярной жидкости. Вещество, солюбилизированное раствором ПАВ, называют солюбилизатом, а ПАВ – солюбилизатором. Например, растворимость октана в воде – 0,0015%, а в 10%-ом растворе ПАВ олеата натрия, растворимость октана составляет – 2%. Применение солюбилизации •моющее действие ПАВ; •изготовление эмульсионно-смазочных жидкостей; •получение фармпрепаратов; •получение пищевых продуктов. 36 Адсорбция на границе твердое тело - раствор Особенности адсорбции из растворов 1. Одновременно могут протекать два параллельных процесса: адсорбция молекул растворенного вещества; адсорбция молекул растворителя. 2. Адсорбироваться будет то вещество, которое в большей степени будет снижать поверхностное натяжение адсорбента. Различают: молекулярную адсорбцию; ионную адсорбцию; ионообменную адсорбцию. Молекулярная адсорбция Молекулярная адсорбция – адсорбция на поверхности адсорбента молекул неэлектролитов. Правило уравнивания полярностей Ребиндера: вещество В будет адсорбироваться на границе раздела фаз А/С, если оно будет уравнивать полярности этих фаз: А B C или À B C Адсорбат должен занимать промежуточное значение по полярности между полярностью адсорбента и полярностью растворителя. Влияние природы растворителя на адсорбцию Правило Шилова: чем лучше растворяется адсорбтив в растворителе, тем он хуже адсорбируется поверхностью твердого адсорбента. Малополярные адсорбенты (уголь) лучше адсорбируют неполярные органические соединения. Полярные адсорбтивы лучше адсорбируются на поверхности ионных кристаллов, оксидов. Инверсия смачивания Инверсия смачивания – качественное изменение смачивания за счет адсорбции ПАВ на твердой поверхности. Применение молекулярной адсорбции: хроматография – разделение многокомпонентных смесей, очистка жидкостей, питьевой воды, извлечение ценных примесей, медицина (отравление ядами, токсинами). Ионная адсорбция Ионная адсорбция – адсорбция сильных электролитов из водных растворов, обусловленная химическими и электростатическими силами. Ионы избирательно адсорбируются на поверхностях, состоящих из ионов или полярных молекул. Правило избирательной адсорбции Пескова – Фаянса На твердой поверхности адсорбента в первую очередь адсорбируются ионы, которые: входят в состав кристаллической решетки адсорбента; способны достраивать кристаллическую решетку адсорбента; изоморфны с ионами адсорбента. Влияние природы ионов на их адсорбционную способность Ионы адсорбируются тем лучше: чем больше заряд иона; чем больше радиус иона; чем больше поляризуемость иона. 1. С увеличением заряда иона его адсорбционная способность увеличивается: 2 3 4 âîçðàñòàíè å Ê Ca Al àäñîðáöèîí íîé Th ñïîñîáíîñò è 2. С увеличением радиуса иона его адсорбционная способность увеличивается. Ионы, расположенные в порядке возрастания адсорбционной способности образуют лиотропные ряды (ряды Гофмейстера): Li Na K Rb Cs Mg 2 Ca 2 Sr 2 Ba 2 возрастание адсорбционной способности 3. С увеличением поляризуемости иона его адсорбционная способность увеличивается. Поляризуемость анионов всегда больше поляризуемости катионов, поэтому на твердой поверхности преимущественно будут адсорбироваться анионы. Cl Br NO J CNS OH 3 Ионообменная адсорбция. Ионный обмен Ионообменная адсорбция - процесс обмена ионов между раствором и ионообменником (сорбентом). Ионообменники (иониты) – высокомолекулярные полиэлектролиты, состоящие из синтетического нерастворимого каркаса с привитыми функциональными группами кислотного (-SO3Н, -COOН, и др.) и основного ( =NH, -NH2 и др.) характера. Особенности ионообменная адсорбции специфична, каждый адсорбент (ионит) обменивается определенными типами ионов; не всегда обратима; протекает более медленно, чем молекулярная адсорбция; часто меняется рН среды. Уравнение изотермы ионного обмена Б.П.Никольского q11 z1 C11 z1 k 1 z2 1 z2 q2 C2 При z1=z2 =1 уравнение упрощается: q1 C k 1 q2 C2 Применение ионного обмена 1. Обессоливание (деминерализация) воды – удаление СаCl2, МgCl2 и т.д. Процесс обессоливание состоит в пропускании засоленной воды через колонки, заполненные катионитом в Н+ - форме и анионитом в ОН- - форме: 2Kat H CaCl2 Kat2 Ca 2 2HCl An OH HCl An Cl H 2O 2. Опреснение воды на морских судах и космических кораблях: Kat Н NaCl Kat Na HCl An OH HCl An Cl H 2O 3. Очистка сточных вод – удаление ионов тяжелых металлов (Zn2+, Cd2+, Pb2+, Cu2+): 2 2 2Kat Na Pb Kat2 Pb 2 Na Адсорбция на пористых адсорбентах Пористые адсорбенты – твердые тела, внутри которых имеются поры, обуславливающие наличие внутренней межфазной поверхности. Адсорбция на пористых телах значительно выше адсорбции на ровной поверхности. Увеличение пористости сорбента приводит к увеличению Sуд и обеспечивает конденсацию пара при давлениях меньших, чем для ровной поверхности. Пористые сорбенты широко применяются в промышленности: в гетерогенном катализе, при улавливании выбросов предприятий (экология) и т.д. Классификация пористых сорбентов по размерам пор (М.М. Дубинина) • макропористые тела (r > 200 нм), для количественного описания используют уравнения Лэнгмюра; • мезопористые (переходнопористые) тела (r = 2 – 200 нм), в порах - полимолекулярная адсорбция, которая заканчивается капиллярной конденсацией (силикагели, алюмогели), процесс адсорбции описывается теориями Поляни и БЭТ; • микропористые тела (r = 0,5 – 2 нм) – молекулярные сита (цеолиты, алюмосиликаты, активированные угли, обладающие строго регулярной кристаллической структурой). Капиллярная конденсация на пористых адсорбентах Поры тонкопористых адсорбентов в результате капиллярной конденсации заполняются молекулами адсорбата уже в области малых относительных давлений паров, так что адсорбция достигает предела. Капиллярная конденсация: •обусловлена наличием пор в адсорбенте •часто сопровождает физическую адсорбцию; •имеет место тогда, когда адсорбат смачивает стенки поры (вогнутый мениск); •характеризуется наличием петли гистерезиса на изотерме адсорбции. р р е 2Vm rRT сферическая пора р р е Vm rRT цилиндрическая пора 1. Конусообразная пора При смачивании адсорбатом стенок поры, на ее стенках образуется адсорбционная пленка жидкости и в самой узкой части поры - вогнутый мениск. Т.к. р р , пар конденсируется, пора начинает заполняться. По мере заполнения поры радиус кривизны увеличивается, поэтому для дальнейшего заполнения поры необходимо увеличить давление (кривая изотермы адсорбции имеет наклон вправо) – пора заполняется. Когда вся пора заполнена жидким адсорбатом, дальнейшее увеличение давления не влияет на адсорбцию – на изотерме предельный участок. При уменьшении давления наблюдается явление десорбции – адсорбат уходит от поверхности адсорбента. Процесс десорбции идет в обратном направлении и описывается той же изотермой. 2. Цилиндрическая закрытая пора Т.к. радиус кривизны цилиндрической поры не меняется, то пора заполняется при определенном постоянном значении давления пара (на изотерме прямая вертикальная линия). Процесс десорбции описывается той же изотермой. 3. Цилиндрическая открытая пора р р е 2Vm rRT сферический мениск р р е Vm rRT цилиндрический мениск Давление пара над цилиндрической поверхностью больше, чем над сферической, то заполнение поры будет происходить при большем давлении пара, чем если бы пора имела шарообразный мениск. Десорбция начнется со сферических менисков при меньшем давлении. Опорожнение капилляра будет происходить при меньшем давлении, чем его заполнение. Появляется петля капиллярноконденсационного гистерезиса (отклонение изотермы адсорбции от изотермы десорбции). 4. Бутылкообразная пора. Заполнение поры начинается со сферического мениска с радиусом кривизны r1. Десорбция идет со сферического мениска радиуса r2. Так как r2 < r1, то рдес < радс. Опорожнение капилляра будет происходить при меньшем давлении, чем его заполнение, появляется петля капиллярноконденсационного гистерезиса. Реальные пористые сорбенты имеют поры различных размеров и форм, поэтому на изотермах адсорбции всегда имеются петли гистерезиса. Дальнейшие представления об адсорбции: активные центры адсорбента энергетически не равноценны; возможна одновременно физическая и химическая адсорбции; молекулы адсорбата взаимодействуют друг с другом на поверхности адсорбента. Изотермы адсорбции: Гаркинса и Юра; Хилла –де Бура; Фрумкина и др.