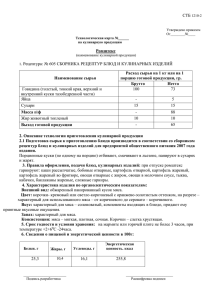
Протокол санитарно-гигиенического исследования тушек, мяса
реклама

Модуль 1. Исследование пищевых продуктов животного происхождения. Лабораторная работа № 1. Санитарно- гигиенический и микробиологический контроль мяса Цель занятий - Освоить методы санитарной экспертизы мяса. 1. 2. 3. 4. 5. Задания: Ознакомиться с правилами отбора проб мяса для санитарно-гигиенического исследования. Провести органолептическое исследование предложенных образцов пищевых продуктов. Исследовать физико-химические свойства образцов. Провести бактериоскопическое исследование проб. Оформить протокол исследования проб мяса. Составить санитарно-гигиеническое заключение о качестве мяса и его пригодности для употребления в пищу. 6. Ответить на контрольные вопросы и решить задачи. Отбор проб. Пробы целым куском массой не менее 200 г из следующих мест: у зареза, против IV и V шейных позвонков; в области лопатки, в области бедра и толстых частей мышц. Каждый отобранный образец упаковывают в пергамент, целлюлозную пленку или пищевую полиэтиленовую пленку. На пергаменте обозначают наименование ткани или органа и номер туши, присвоенный при приемке. Образцы, отобранные от одной туши, упаковывают вместе в бумажный пакет и укладывают в металлический закрывающийся ящик. Ящик опечатывают и пломбируют. Образцы сопровождают в лабораторию документом с обозначением: даты и места отбора образцов, вида скота, номера туши, присвоенного при выемке, причины и цели испытания, подписи отправителя. Решение о доброкачественности исследуемого мяса принимают на основании комплекса определений по 25-балльной системе, включающей следующие показатели: Показатели Количество баллов Органолептические 13 Химические 10 Бактериологические 2 Органолептическая оценка 1. Определение внешнего вида и цвета. Вид и цвет мышц на разрезе определяют в глубинных слоях мышечной ткани на свежем разрезё мяса. При этом устанавливают: наличие липкости путем ощупывания; увлажненность поверхности мяса на разрезе путем приложения к разрезу кусочка фильтровальной бумаги. 2. Определение консистенции. Консистенцию определяют по скорости выравнивания ямки, которая образуется от легкого надавливания пальца на всежем разрезе. На свежем разрезе туши или испытуемого образца легким надавливанием пальца образуют ямку и следят за ее выравниванием. Медленное выравнивание в течение 1 мин характерно для мяса подозрительной свежести. 3. Определение запаха. Органолептически устанавливают запах поверхностного слоя туши или испытуемого образца. Затем чистым ножом делают разрез и сразу определяют запах в глубинных слоях. При этом особое внимание обращают на запах мышечной ткани, прилегающей к кости. Для обнаружения запаха нагревают нож и втыкают его в толщу мяса и проверяют запах, ощущаемый на поверхности после извлечения. Запах исследуемого образца определяют также и после варки в момент появления первых паров. 4. Определение состояния жира. Определяют в момент отбора образцов, устанавливают цвет, запах и консистенцию жировой ткани. 5. Определение состояния сухожилий. Определяют в туше в момент отбора образцов. Ощупыванием сухожилий устанавливают их упругость, плотность и состояние суставных поверхностей. 6. Определение прозрачности и аромата бульона. Качество бульона определяют после варки исследуемого образца. Устанавливают цвет, вкус, запах бульона и жира. Подготовка к определению. Для получения однородной пробы каждый образец отдельно пропускают через мясорубку (диаметр отверстий решетки 2 мм) и фарш тщательно перемешивают. 20 г полученного фарша взвешивают на лабораторных весах с погрешностью не более 0,2 г и помещают в коническую колбу вместимостью 100 см 3, заливают 60 см3 дистиллированной воды, тщательно перемешивают, закрывают часовым стеклом и ставят в кипящую водяную баню. Ход определения. Запах мясного бульона определяют в процессе нагревания до температуры 80 — 85 °С в момент появления паров, выходящих из приоткрытой колбы. Для определения прозрачности 20 см3 бульона наливают в мерный цилиндр вместимостью 25 см3 и устанавливают степень его прозрачности визуально. Таблица 1.1. - Характерные признаки свежего мяса и субпродуктов Наименование Свежее Сомнительной Несвежее показателя свежести корочку Местами увлажнена, Сильно подсохшая, Внешний вид и Имеет липкая покрытая слизью цвет поверхности подсыхания бледно- слегка розового или потемневшая сероватотуши бледно-красного коричневого цвета цвета, у или плесенью размороженных туш красного цвета, жир мягкий, частично окрашен в яркокрасный цвет Мышцы на разрезе Слегка влажные, не Влажные, оставляют оставляют влажного влажное пятно на пятна на фильтровальной фильтровальной бумаге, слегка Влажные, оставляют бумаге; цвет, липкие, темновлажное пятно на свойственный красного цвета Для фильтровальной данному виду мяса размороженного бумаге, липкие, для говядины от мяса с поверхности красно-коричневого светло-красного до разреза стекает цвета. Для темно- красного, для мясной сок, слегка размороженного баранины от мутноватый мяса: с поверхности красного до красносреза стекает мутный вишневого; для мясной сок свинины от светлорозового до красного; для ягнятины розовый На разрезе мясо На разрезе мясо На разрезе мясо менее плотное и дряблое; плотное, упругое; менее упругое; образующаяся при образующаяся при образующаяся при надавливании надавливании надавливании пальцем ямка не Консистенция пальцем ямка пальцем ямка выравнивается, жир быстро выравнивается мягкий; у выравнивается медленно (в течение размороженного мяса I мин), жир мягкий; жир рыхлый, у размороженного осадившийся мяса жир слегка разрыхлен Специфический, Слегка кисловатый Кислый или затхлый, Запах свойственный или с оттенком или слабогнилостный каждому виду затхлости свежего мяса Говяжьего имеет Имеет серовато- Состояние жира белый, желтоватый матовый оттенок, или желтый цвет, слегка липнет к консистенция пальцам, может твердая при иметь легкий за пах раздавливании осаливания. крошится, свиного Сухожилия менее белый или бледно- плотные, матоворозовый цвет; белого цвета. мягкий, эластичный, Суставные бараньего белый поверхности слегка цвет, консистенция покрыты слизью плотная. Жир не должен иметь запаха осаливания Упругие, плотные, Имеет сероватоСостояние поверхность матовый оттенок, при сухожилий суставов гладкая, раздавливании блестящая, у раз мажется .Свиной жир мороженного мяса может быть покрыт сухожилия мягкие, небольшим рыхлые, окрашены в количеством ярко красный цвет плесени. Запах прогорклый. Сухожилия раз мягчены, сероватого цвета. Суставные поверхности покрыты слизью Прозрачный, Прозрачный или Мутный, с большим Прозрачность и ароматный мутный, с запахом количеством хлопьев, ароматность не свойственным резким, неприятным бульона свежему бульону запахом Уменьшение баллов по органолептическим показателям приведено в таблице Таблица 1.2 – Оценка качества мяса по органолептическим покащателям Вид на разрезе Запах Состояние Состояние Скидка баллов жира бульона Поверхность С поверхности Цвет с Слегка 2-5 влажная, ямки слегка кислый сероватомутный. при или затхлый. матовым надавливании оттенком. Жир выравниваются слегка быстро. прилипает к Суставные поверхности слегка покрыты слизью. Поверхность слегка липкая. На приложенной фильтровальной бумаге остается много влаги. Ямки при надавливании выравниваются не сразу и не всегда полностью, мясо мягкое, рыхлое. Цвет темный, мясо дряблое, ямки при надавливании не выравниваются. Зеленоватого или сероватого цвета, сильно липкая поверхность. Мясо дряблое, ямки при надавливании не выравниваются. пальцам. С поверхности Цвет с слабо сероватогнилостный. матовым оттенком. Запах легкого осаливания. Говяжий жир при надавливании мажется. Мутный, не 7 ароматный с привкусом затхлого мяса. Жировые капли на поверхности мелкие с привкусом осаливания. Кислый или затхлый, или слабо гнилостный в глубоких слоях мускульной ткани. Явно гнилостный или сильно выраженного закисания, или резко затхлый в глубоких слоях мускульной ткани. Грязный хлопьями затхлым запахом. Серый цвет с грязноватым оттенком. Запах прогорклый или резкого осаливания. Цвет зеленоватый с грязным оттенком. Консистенция мажущаяся. Запах прогорклый или резкого осаливания. с 13 и Грязный с хлопьями, запах гнилостный, жировых капель почти нет. Вкус, запах жира прогорклые. Не производится. Мясо бракуется по органолептическим показателям без исследования. Мясо или субпродукты, отнесенные к сомнительной свежести хотя бы по одному признаку, подвергают химическим и микроскопическим анализам. Химические показатели При гнилостном разложении мяса под действием протеолитических ферментов, выделяемых микроорганизмами, происходит гидролитическое расщепление белковой молекулы. Белки распадаются вначале до полипептидов, а затем до аминокислот. Дезаминирование аминокислот сопровождается также выделением аммиака, общее количество которого может характеризовать глубину гнилостного разложения мяса. О наличии в мясе продуктов распада белка судят также по качественной реакции с сернокислой медью. 1. Определение аммиака по Несслеру Принцип метода. Водная вытяжка из мяса, содержащая аммиак и аммонийные соли, при добавлении к ней реактива Несслера приобретает желтое окрашивание; при больших количествах аммиака образуется красно-бурый осадок иодистого меркураммония. Приготовление экстракта из мяса. 10 г мяса разрезают на мелкие кусочки, помещают в колбу, заливают 100 см3 дистиллированной воды и настаивают в течение 15 мин, периодически встряхивая. Фильтруют через складчатый бумажный фильтр. Реактив Несслера. В 50 мл воды растворяют 50 г иодида калия (KI). К этому раствору при постоянном перемешивании прибавляют насыщенный раствор хлорида ртути (HgCl2) (6 г HgCl2 в 100 мл воды) до появления до образования красного осадка йодида ртути. Затем прибавляют 200 мл 6 н. раствора KOH и воду до 500 мл, дают отстояться и сливают прозрачную жидкость. Реактив сохраняют в темном месте. Применение HgI2 вместо HgCl2 увеличивает чувствительность реактива Несслера. Для этого растворяют 11,5 г HgI2и 8,0 г KI в минимальном количестве воды и разбавляют полученный раствор водой до 50 мл в мерной колбе. В результате реакции между исходными веществами образуется хорошо растворимое в воде комплексное соединение – тетраиодомеркурат калия: HgI2 + 2 KI = K2[HgI4] . Раствор из мерной колбы выливают в стакан, добавляют 50 мл раствора KOH; раствор декантируют (если образовался осадок) и хранят в склянке из темного стекла с резиновой или полиэтиленовой пробкой. Ход определения. К 1 мл экстракта добавляют 1 - 10 капель реактива Несслера. Встряхивая пробирку после прибавления каждой капли, наблюдают цвет и степень прозрачности экстракта. Таблица 1.3 - Определение качества мяса с раствором Несслера Количество Качество Качество мяса капель Примечание экстракта раствора Свежее Не мутнеет, не 10 желтеет Через 10 мин уменьшается, прозрачность Подозрительной свежести Помутнение, пожелтение 6 и более раствор не мутнеет через 20 мин появляется слабый осадок Несвежее То же 12 После добавления 10-й капли — сильное пожелтение и обильный осадок при отстаивании 2. Реакция на свободный аммиак (проба Эбера на гниение). Принцип метода. Аммиак с cthyjq кислотой, входящей в состав реактива Эбера, образует хлорид аммония ( NH3 + HCl = NH4Cl), который обнаруживается в виде белого тумана (облачка). Реактив Эбера. 1 часть 25% раствора HCl, 3 части 96% спирта и 1 часть эфира. Ход определения. Помещают небольшой кусочек исследуемого мяса на крючок со стеклянной палочкой, продетой через пробку. Мороженое или сильно охлажденное мясо предварительно согревают до комнатной температуры. В широкую пробирку или небольшой цилиндр наливают 2 мл реактива Эбера и закрывают цилиндр пробкой с крючком так, чтобы не касаться мясом стенок цилиндра (пробки) и чтобы кусочек мяса находился на 1 — 2 см выше уровня налитого в цилиндр реактива. Появление белого тумана (облачка) означает наличие аммиака в мясе. Если образуется быстро исчезающее расплывчатое облачко, то такая реакция обозначается знаком +. В случае несвежего мяса реакция ярко выражена (устойчивое облачко) и обозначается знаком ++. Облачко рассматривают на черном фоне (черная бумага). Необходимо помнить, что проба Эбера на свободный аммиак неприменима для парного мяса, солонины, колбасы, мясных консервов, так как она может дать ложную реакцию. Неточные результаты получаются и при исследовании вареного мяса. 3. Реакция на сероводород Принцип метода. Сероводород, реагируя со щелочным раствором свинца, которым смочена фильтровальная бумага, образует на ней сульфид свинца, окрашивающий бумагу в светло-бурый или черный цвет. Ход определения. Исследуемое мясо нарезают мелкими кусочками и помещают в колбу вместимостью 100 см3, примерно до 1/3 объема. Затем колбу плотно закрывают пробкой, зажав ею одновременно полоску фильтровальной бумаги, смоченной каплей щелочного раствора свинца (4% раствор ацетата свинца - Pb(CH3COO)2 и равное количество 30% раствора NaOH) и оставляют стоять при комнатной температуре 15 мин. Затем проверяют изменение цвета бумаги. Появление светло-бурого или черного цвета указывает на наличие в мясе сероводорода. Мясо подозрительной свежести дает слабоположительную реакцию, а несвежее мясо — ярко выраженную реакцию. Проба на сероводород для оценки вареного мяса и вареных колбас нехарактерна, так как в результате деструкции белков мяса при варке из него выделяется сероводород. 4. Реакция на пероксидазу Принцип метода. Фермент пероксидаза, находящийся в мышечной ткани здорового животного, в присутствии перекиси водорода становится активным окислителем. Наличие пероксидазы определяется изменением цвета индикатора, добавляемого к экстракту мяса. Ход определения. В пробирку наливают экстракт мяса, приготовленного как для реакции на аммиак по Несслеру в количестве 2 мл, прибавляют 5 капель 0,2% спиртового раствора бензидина, встряхивают пробирку, прибавляют 2 капли 1% раствора перекиси водорода. При положительной реакции (свежее мясо) в течение 1 — 2 мин появляется сине-зеленое окрашивание, постепенно переходящее в коричневое. Отрицательная реакция с бензидином при отсутствии других признаков разложения мяса указывает на необходимость бактериологического исследования (на сальмонеллы). Отрицательную бензидиновую пробу может давать мясо утомленных и больных животных, в таком мясе пробы на аммиак и сероводород могут быть отрицательными из-за отсутствия гнилостных микроорганизмов. 5. Реакция с сернокислой медью Принцип метода. В бульоне из несвежего мяса при взаимодействии меди с первичными продуктами распада белков появляются хлопья, при взаимодействии с продуктами более глубокого распада – образуется окрашенный осадок. Приготовление бульона из мяса. 20 г мясного фарша, помещают в колбу, заливают 60 мл дистиллированной воды, перемешивают, затем колбу закрывают, нагревают в течение 10 мин в кипящей водяной бане. Содержимое фильтруют в пробирку, помещенную в стакан с холодной водой, через слой ваты толщиной не менее 0, 5 см. Если фильтрат содержит хлопья белка, его снова фильтруют. После фильтрации 2 мл бульона помещают в пробирку, добавляют 3 капли 5% раствора сернокислой меди, встряхивают 2 -3 раза и выдерживают 5 мин, после чего определяют результат реакции по наличию хлопьев или осадка. Скидка баллов по результатам реакции следующая. Таблица 1.4 - Определение свежести мяса по реакции с сернокислой медью Показатели Бульон прозрачный или с мутью Бульон с хлопьями Выпадение осадка желеобразного синеголубого или зеленоватого цвета Количество баллов 0 3 4 Бактериологические показатели Размножаясь при благоприятных условиях на поверхности мяса, микроорганизмы постепенно проникают в его толщу. Проникновение бактерий в глубину мяса сопровождается снижением его качества. На этом основано бактериоскопическое исследование мяса, позволяющее быстро установить степень его свежести. 1. Бактериоскопическое исследование мяса Принцип метода. Микроскопическое исследование мяса основано на определении количества бактерий в мазках-отпечатках и степени распада его мышечной ткани. Ход определения. Поверхность исследуемой мышечной ткани стерилизуют раскаленным шпателем или обжигают тампоном, смоченным в спирте. Вырезают стерильными ножницами кусочки размером 2,0 Х 1,5 Х 2,5 см, поверхностями срезов прикладывают к предметному стекул (по три отпечатка на двух предметных стеклах). Мазки-отпечатки высушивают на воздухе, фиксируют, окрашивают по Граму и микроскопируют (на 1 предметном стекле исследуют 25 полей зрения). Таблица 1.5 - Количество бактерий и степень распада мышечной ткани в мазках-отпечатках Степень свежести мяса Показатели бактериоскопической пробы (в поле зрения микроскопа) Свежее Микроорганизмы не обнаружены или найдены лишь единичные (до 10 клеток) кокки или палочки. Следов распада мышечной ткани нет. Сомнительной свежести Обнаружено не более 30 кокков или палочек, а также следы распада мышечной ткани: ядра мышечных волокон в состонии распада, исчерченность волокон слабо различима. Несвежее Обнаружено свыше 30 коккков или палочек. Распад мышечной ткани значительный: почти полное отсутствие ядер и полное исчезновение исчерченнности мышечных волокон. Скидка баллов по результатам бактериоскопического исследования мяса следующая. Таблица 1.6 - Определение свежести мяса при актериоскопическом исследовании Показатели Количество баллов Свежее 0 Сомнительной свежести 1 Несвежее 2 2. Микробиологическое исследование мяса Мясо, забракованное по органолептическим показателям, микробиологическому исследованию как правило, не подвергают, если не возникает необходимость выявления и идентификации патогенной микрофлоры (возбудителей сибирской язвы, БКГП, листериоза, клостридиозов и др.). Микробиологическое исследование мяса проводят во всех случаях, когда предполагают, что оно обсеменено возбудителями зооантропозонов или пищевых токсикоинфекций и токсикозов. Согласно правилам ветеринарносанитарной экспертизы мяса и мясопродуктов предусмотрены обязательные микробиологические исследования их при подозрении на сибирскую язву, а также при чуме, роже свиней, листериозе, болезни Ауэски, осложненной форме ящура, некробациллезе, мыте и других инфекционных и незаразных заболеваниях в целях решения вопроса о возможности и порядке использования мяса и других продуктов убоя животных. Для проведения микробиологических исследований с целью выделения и идентификации микроорганизмов отбирают пробы (мышечную ткань, лимфатические узлы, паренхиматозные органы), которые направляют в лабораторию. Показания к отбору проб: вынужденный убой животных, независимо от причин, в том числе при отравлении или подозрении на отравление животных ядами; задержка удаления кишечника из туши более чем на 2 часа после убоя животного; недостаточное обескровливание туши; затруднения в определении пригодности мяса в пищу по данным санитарного анамнеза и осмотра на месте; расхождение результатов органолептической оценки и химических исследований; подозрение на то, что мясо или субпродукты послужили источниками пищевых отравлений. Ход определения. Отбирают образцы массой не менее 200 г, упаковывают в пищевую плеку или пергамент, помещают в бумажный пакет и сразу направляют в лабораторию. Каждый образец (мышечная ткань, лимфатические узлы, паренхиматозные органы) перед посевом освобождают от видимой жировой и соединительной ткани, погружают на 2-3 мин в этиловый спирт и два раза обжигают с поверхности. Затем стерильными ножницами из каждого образца (с различной глубины) вырезают кусочки размером 2,0 Х 1,5 Х 2,5 см. Лимфатические узлы разрезают пополам. Все вырезанные кусочки измельчают стерильными ножницами. Для последующих исследований готовят две пробы по 15 г каждая. Одна проба состоит из кусочков мышц и лимфатичсеких узлов, а вторая – из паренхиматозных органов (печени, почек, селезенки). Каждую помещают в стерильный стакан (колбу) гомогенизатора, добавляют по 1,5 мл раствора физиологического раствора и готовят взвеси в течение 2 – 5 мин. Полученные взвеси отстаивают 10 мин, и для исследования берут надосадочную жидкость. Выделение и идентификацию патогенных микроорганизмов проводят по общепринятым тестам. Микробиологическое исследование проводят согласно ГОСТ 21237—75 для обнаружения аэробных и факультативно-анаэробных возбудителей зооантропонозов, обнаружения сальмонелл, бактерий рода Proteus, бактерий группы кишечных палочек, токсигенных стафилококков и патогенных анаэроб Исследования на гельминты 1. Финны Финны личиночная стадия цикла развития ленточных червей. Финны имеют вид беловатых пузырьков или крупинок величиной от булавочной головки до горошины. От крупинок жира финны отличаются тем, что раздавливаются труднее и с некоторым треском. Финны чаще встречаются в мышцах сердца, живота, жевательных и межреберных мышцах. При обнаружении на площади 40 см3 среза мышц более трех финн тушу и субпродукты подвергают технической утилизации или уничтожению. Мясо, пораженное финнами При обнаружении на площади 40 см не более трех финн мясо считается условно годным и допускается к употреблению после предварительного обеззараживания путем проварки мяса кусками массой не более 2 кг и толщиной до 8 см в открытых котлах в течение 3 ч. Куски массой до 2,5 кг обезвреживаются посолкой в течение 20 дней. При замораживании мясо доводят до температуры — 10 °С и выдерживают 10 сут при температуре воздуха — 12 °С. 2. Трихинелла Трихинелла относится к круглым червям, встречается главным образом в свином мясе. Личинки в виде спирально свернутых червячков, окруженных капсулрй, чаще всего локализуются в мышцах диафрагмы. Ход определения. Для исследования мяса на трихинеллы применяют компрессориум. Он состоит из двух стеклянных пластинок с нумерованными 24 квадратами, сжимаемых двумя винтами, расположенными на концах. На каждый квадрат нижней пластинки помещают по одному кусочку исследуемого мяса, предварительно обработанного 4% раствором гидроксида калия (мышцы становятся прозрачными, а трихинеллы более заметными), затем пластинки сжимают и получают прозрачные препараты, которые рассматривают при малом увеличении в микроскопе. Для исследования берут две пробы мяса из ножек диафрагмы или межреберных мышц и от каждой пробы исследуют 12 срезов. При обнаружении в 24 срезах хотя бы одной трихинеллы тушу и субпродукты направляют на техническую утилизацию или уничтожение. Протокол санитарно-гигиенического исследования сырого мяса. Оформление результатов лабораторного исследования продуктов должно производиться в виде протокола утвержденной формы. Протокол состоит из трех частей: описательной, результативной и заключительной. В описательной части указываются: название и время поступления образца в лабораторию; вид и характер упаковки; кто, когда, откуда произвел выемку (по данным сопроводительного документа); масса (или количество экземпляров) каждого образца и описание его органолептических свойств. В результативной части приводятся данные органолептического, физикохимического и бактериологического исследований. Результаты исследований в протоколе подписываются лицами, производившими данное исследование. Таблица 1.7 – Результаты органолептической оценки качества мяса Вид на Запах разрезе, консистенция Состояние жира Состояние бульона Скидка баллов Средний балл: Подпись лица, проводившего анализ: Таблица 1.8 – Результаты химического анализа сырого мяса Вид анализа результат Проба Эбера Проба на сероводород Проба на пероксидазу Проба с CuSO4 Средний балл: Подпись лица, проводившего анализ: Скидка баллов Количество баллов Таблица 1.9 – Результаты бактериоскопического исследования сырого мяса Показатели бактериологической пробы Скидка баллов Количество баллов Подпись лица, проводившего анализ: В заключении дается оценка свойств, качества исследуемого образца и пригодности его для питания. Заключение на образец подписывается заведующим лабораторией или врачом отдела гигиены питания. Таблица 1.10 – Результаты санитарно-гигиенической оценки качества сырого мяса Вид оценки Количество баллов Результат Органолептическая Химическая Бактериоскопическая Заключение: Попись ответственного лица: Протокол и заключение лаборатории относятся только к образцу и не являются заключением о качестве партии. Решают вопрос о качестве партии, ее пригодности для пищевых целей санитарный врач, проводящий экспертизу, и главный врач СЭС, выносящий постановление. Контрольные вопросы и задачи 1. Как производится отбор образцов мяса для лабораторного исследования? 2. Как производится органолептическое исследование мяса? Как определяют прозрачность и аромат бульона? 3. Перечислите признаки свежего мяса, мяса сомнительной свежести, несвежего мяса по органолептическим показателям. 4. С какой целью и когда производится химическое исследование мяса? Каким образом и по каким тестам оно осуществляется? 5. Каков принцип метода определения аммиака? Как проводится исследование на определение свободного аммиака в мясе? 6. Каков принцип метода определения сероводорода? Как проводится исследование на определение сероводорода в мясе? 7. Как определяют наличие в мясе пероксидазы? 8. Как определяют свежесть мяса по реакции с сернокислой медью? 9. Каким образом проводят бактериоскопическое исследование мяса? 10. Как производится исследование мяса на гельминты? 11. На пищеблок пионерского лагеря поступило говяжье мясо вынужденного убоя в связи с травмой. Справка ветеринарного надзора о разрешении на реализацию мяса имеется. На туше стоит фиолетовое клеймо. Со дня забоя прошло 3 дня. Цвет мяса темно-красный, поверхность разреза блестящая, влажная, упругая, запах свежий, приятный. Жир белый, твердый. Перечислите, какие исследования для оценки доброкачественности мяса нужно произвести? Возможно ли приготовление 1-х и 2-х мясных блюд для питания детей? Вопросы СРС. 1. Пищевая и биологическая ценность мяса и мясных продуктов. 2. Факторы, способствующие развитию микроорганизмов и разрушению тканей мяса. 3. Микробные пороки мяса. Лабораторная работа № 2. Санитарно - микробиологическое исследование тушек, мяса птицы и птицепродуктов. Цель занятий - Освоить методы санитарно микробиологического контроля тушек, мяса птицы и птицепродуктов. Задания: 1. Ознакомиться с правилами отбора проб тушек, мяса птицы и птицепродуктов для санитарно-микробиологического исследования. 2. Определить ОМЧ тушек, мяса птицы и птицепродуктов. 3. Определить наличие бактерий рода Salmonella в тушках, мясе птицы и птицепродуктах. 4. Оформить протокол-отчет исследования проб тушек, мяса птицы и птицепродуктов. 5. Ответить на контрольные вопросы. Лабораторная работа предусматривает проведение микробиологического контроля при переработке птицы, признанной ветеринарно-санитарным надзором здоровой, а также производства птицепродуктов. Основной задачей микробиологического контроля птицеперерабатывающего предприятия является обеспечение выпуска продукции высокого качества, безопасного в эпидемическом и эпизоотическом отношениях. Микробиологическому контролю подвергают санитарное состояние производства, поступающие материалы и сырье, продукты в процессе технологической обработки, готовую продукцию. Результаты микробиологического исследования качества готовой продукции являются ретроспективными и позволяют оценивать санитарно-гигиеническое благополучие предприятия, по ним судят о соблюдении технологических процессов. В случаях ухудшения микробиологических показателей готовой продукции контроль должен быть направлен на выявление источников и причин повышения микробной обсемененности с целью их ликвидации. Микробиологические исследования проводят специалисты-микробиологи предприятия. В случае отсутствия названных специалистов на предприятии контроль осуществляют по особому графику контрольно-производственные лаборатории головных предприятий или заключается договор с ветеринарными или другими лабораториями о проведении микробиологических исследований на предприятии с указанием периодичности контроля. Плановые микробиологические исследования на предприятиях проводят в соответствии с настоящей Инструкцией, исследования по эпидемиологическим показаниям - в соответствии с требованиями территориальной санэпидемслужбы. Контроль тушек птицы, потрохов, мяса фасованного, бескостного мяса Исследования проводят: - в партиях для торговли, производства полуфабрикатов, колбасно-кулинарных изделий, сублимационной сушки по показателям ОМЧ и наличия сальмонелл в 25 г продукта, а по показаниям производства и требованиям ветсанслужбы дополнительно по показателям: содержание спор аэробных и факультативно-анаэробных бактерий (бацилл); содержание спор сульфитредуцирующих клостридий (СРК); наличие протея, коагулазоположительных стафилококков, БГКП. - в партиях для выработки стерилизованных и пастеризованных консервов по показателям: ОМЧ, содержание спор мезофильных клостридий. - в партиях для выработки консервов детского питания и спецназначения по показателям: ОМЧ, содержание спор мезофильных клостридий, содержание спор термофильных клостридий, содержание спор факультативно-анаэробных термофильных бактерий плоскокислой порчи консервов. Тушки птицы (с потрохами и внутренними органами) с признаками заболеваний, в сомнительных случаях для установления диагноза по патологоанатомической картине направляют в ветеринарные бактериологические лаборатории. Отбор проб. Тушки кур, цыплят, индеек, индюшат, уток, утят, гусей, цесарок, цесарят, перепелов, а также их потроха (печень, мышечный желудок, сердце), фасованное мясо, бескостное мясо (кусковое и механической обвалки сепарированием) от здоровой птицы подвергают микробиологическому контролю после выработки или перед отгрузкой не реже двух раз в месяц, в также по показаниям производства и требованию ветсанслужбы. Для анализа мяса здоровой птицы от партии отбирают не менее трех тушек. Оценку результатов исследования проводят по каждой тушке в отдельности. Отбор проб от каждой тушки проводят одним из трех методов: 1) методом вырезания кусочков мышц и других тканей из различных участков тушек; 2) методом смыва со всей поверхности тушки смывной стерильной жидкостью; 3) методом смыва с поверхности тушки тампоном. Метод вырезания кусочков тканей (мышц) используют для выявления сальмонелл, а также для определения других микробиологических показателей тушки. Масса отобранной пробы должна составлять не менее 100 г. Пробу измельчают, после чего 25 г продукта используют для исследования на сальмонеллы, а 10 г продукта служат исходным материалом для приготовления серии десятикратных разведений в исследованиях на другие предусмотренные микробиологические показатели (ОМЧ и др.). Метод смыва со всей поверхности потрошеной тушки смывной стерильной жидкостью (водой), как и метод смыва тампоном, используют для оценки санитарного состояния производства. В смывах определяют микробиологические показатели: ОМЧ, споры клостридий и бацилл, а также другие микроорганизмы по показаниям производства. Оценку тушек птицы на наличие сальмонелл по анализу смывов не производят. Отбор проб методом смыва со всей тушки проводят следующим образом. Тушку массой не более 0,5 кг помещают в новый пакет из полимерного материала, разрешенного Минздравом СССР для контакта с пищевыми продуктами. В пакет с тушкой наливают стерильную водопроводную воду в количестве, равном массе тушки, встряхивают содержимое пакета в течение 2 мин. Полученная смывная жидкость служит исходным материалом, из которого готовят серию десятикратных разведений. Расчет количества микроорганизмов проводят на 1 кубических см смывной жидкости. Отбор проб методом смыва стерильным тампоном применим к потрошеным тушкам любой массы. В связи со сложной конфигурацией поверхности тушки птицы применяют фламбированный проволочный металлический трафарет малой площадью (4 кв. см). С тушек птицы малых размеров, например, перепелов, смыв берут от разных участков тушки, при этом общая площадь смывной поверхности должна составлять 10 кв. см. Смыв осуществляют с разных участков тушки одним и тем же стерильным увлажненным тампоном. Использованный тампон помещают пробирку с 10 мл стерильной жидкости (водопроводной воды, физраствора, пептонной воды), после чего жидкость тщательно перемешивают. С тушек крупной птицы (кур, цыплят-бройлеров и др.) общая площадь смывной поверхности должна составлять 100 кв. см. При этом смыв осуществляют 2 - 5 тампонами и все их помещают в колбу с 100 мл стерильной жидкости (воды и др. - см. выше). Колбу с тампонами встряхивают в течение 2 мин. Смывная жидкость служит исходным материалом для серии десятикратных разведений. Расчет количества микроорганизмов проводят на 1 кв. см поверхности тушки. Отбор проб методами смывов допускается в помещении производственных цехов. Тушки, подвергнутые смывам, допускается использовать для пищевых целей. В соответствии с требованиями Методических указаний "Лабораторная диагностика сальмонеллезов человека и животных, обнаружение сальмонелл в кормах, продуктах питания и объектах внешней среды" (1990 г.) для обнаружения сальмонелл на потрошеных и полупотрошеных тушках используют метод смыва тампоном со всей поверхности тушки. При этом с тушек массой до 3-х кг используют один стерильный тампон, увлажненный предварительно средой обогащения для сальмонелл (забуференной пептонной водой). После взятия смыва тампон помещают в пробирку с 10 куб. см пептонной воды. С тушек массой более 3-х кг для смывов по всей поверхности используют несколько тампонов (число тампонов зависит от размера тушки); после взятия смыва все тампоны помещают в одну колбу со средой обогащения (пептонной водой) из расчета 10 куб. см среды на один тампон. Для полупотрошеных тушек при исследовании на сальмонеллы используют и паренхиматозные органы (25 г) по ГОСТ 7702.2-74. При выделении сальмонелл вводится система профилактических и противоэпизоотологических мероприятий, предусмотренная Инструкцией по борьбе и профилактике сальмонеллезов у людей и животных. Отбор проб потрохов и бескостного кускового мяса проводят следующим образом. От партии продукта каждого наименования отбирают из разных мест точечные пробы (10 - 50 г), помещают в стерильную посуду, составляют в ней общую пробу массой не менее 150 г. Измельчают с соблюдением правил асептики, тщательно перемешивают и отбирают навеску 25 г для посева на сальмонеллы и 10 г для приготовления серии десятикратных разведений. Для получения 1 разведения к 10 г мясной массы добавляют 90 мл стерильной воды или физраствора, или пептонной воды. Для мышечных желудков и кускового мяса для определения микробиологических показателей, кроме выделения сальмонелл, допускается отбор проб методом смыва в полимерном пакете. При этом общую пробу одного наименования продукта массой не менее 150 г помещают в новый пакет, взвешивают, добавляют стерильную смывную жидкость в количестве, равном массе пробы. Встряхивают в течение 2 мин. 1 мл смывной жидкости используют для серии последовательных десятикратных разведений. Расчет количества микроорганизмов проводят для 1 г продукта (таблица 2.1) или на 1 мл смывной жидкости по массе, равной массе пробы продукта. Таблица 2.1. - САНИТАРНАЯ ОЦЕНКА КАЧЕСТВА ТУШЕК ПТИЦЫ, БЕСКОСТНОГО МЯСА, ПОТРОХОВ Объект Наличие ОМЧ (КОЕ/г; КОЕ/куб. см; КОЕ/кв. см) исследования сальмонелл в хорошо удовлетворительно плохо 25 г продукта Тушки птицы Не допускается Менее 2,0 х 10 Менее 1,0 х 10 Более 1,0 х 10 Мясо То же То же То же То же безкостное потроха (печень То же То же То же То же с сердцем, мышечные желудки) Превышение уровня бактериальной обсемененности продуктов, приведенного в табл. 2.1, свидетельствует о неудовлетворительном санитарном состоянии производства и качества продуктов. Результаты микробиологических исследований регистрируют в журнале. При показателе ОМЧ более 1,0 х 10 КОЕ/г при отсутствии признаков органолептической порчи названные выше продукты не подлежат хранению в охлажденном состоянии. Их срочно отправляют на заморозку или на изготовление термически обработанных продуктов. Реализация их в охлажденном состоянии возможна в течение 4 - 6 ч. Партии продукта с показателем ОМЧ более 1,0 х 10 КОЕ/г и признаками органолептической порчи направляют на утилизацию. При обнаружении сальмонелл в нереализованных партиях тушек птицы, бескостного кускового мяса, потрохов эти партии должны быть направлены на изготовление консервов в соответствии с Правилами ветеринарного осмотра убойных животных и ветеринарно-санитарной экспертизы мяса и мясных продуктов. МЕТОДЫ МИКРОБИОЛОГИЧЕСКОГО КОНТРОЛЯ 1. Определение общего количества мезофильных аэробных и факультативноанаэробных микроорганизмов - общее микробное число (ОМЧ) Метод основан на количественном подсчете колоний микроорганизмов, вырастающих на плотном питательном агаре при температуре 30 °С в течение 72 ч. Для определения ОМЧ следует выбирать разведения, при посеве которых на чашках Петри вырастает не менее 30 и не более 300 колоний. При посеве продуктов, не требующих разведения, учитывают все выросшие на чашках колонии (т.е. и менее 30). Ход определения. При посеве по 1 куб. см цельного продукта или каждого соответствующего его разведения вносят в 2 чашки Петри (параллельное определение) и заливают в каждую чашку по 15 - 20 мл агаризованной питательной среды, расплавленной на водяной бане и остуженной до 45 °С. Сразу после заливки агара содержимое чашки Петри тщательно перемешивают путем легкого вращательного покачивания для равномерного распределения посевного материала. После застывания агара чашки с посевами помещают в термостат дном вверх, инкубируют при 30 °С в течение 72 ч; при необходимости предварительный учет производят через 48 ч. Количество колоний подсчитывают на каждой из высеянных чашек.. Для лучшей видимости считают колонии на темном фоне (под чашку кладут темную бумагу), чашки помещают дном кверху. Каждую колонию отмечают на дне чашки чернилами или тушью. При подсчете придерживаются следующих правил: - если на чашке выросло небольшое количество колоний, примерно до 100, подсчитывают все колонии; - если колонии распределены равномерно и их количество измеряется несколькими сотнями (200 - 300 колоний), допускается подсчет колоний не менее чем на 1/3 площади чашки. В этих случаях дно чашки делят карандашом на 6 секторов и считают колонии в 3 секторах. Затем делают пересчет на всю площадь чашки: вычисляют среднее количество колоний на площади одного сектора и полученное количество колоний на одном секторе умножают на 6. Число колоний, выросших на чашке, должно отражать количество жизнеспособных микроорганизмов, содержащихся в засеянном объеме исследуемого материала. Поскольку последний, как правило, засевают в разведенном виде, число выросших на чашке колоний умножают на степень взятого разведения, рассчитывают среднее арифметическое и устанавливают количество мезофильных аэробных и факультативно-анаэробных микроорганизмов в 1 куб. см продукта. При установлении количества мезофильных бактерий не все чашки могут быть использованы для вычисления среднего арифметического: - нельзя использовать посевы для вычисления среднего арифметического, если количество выросших колоний на чашках менее 30. В этом случае в протокол исследований вносят показатели обсемененности, полученные при подсчете колоний только по одной или двум чашкам, число колоний на которых больше 30. В случае роста колоний на засеянных чашках в количестве менее 30 в результатах анализа рекомендуется следующая формулировка: "Рост единичных колоний при посеве (указать количество засеянного продукта)"; - не используются посевы для вычисления среднего арифметического показателя на тех чашках, на поверхности которых более чем на 1/2 площади отмечается ползучий рост спорообразующих микроорганизмов; последние могут маскировать рост прочих бактерий. Возможны случаи, когда на чашках из всех разведений получен рост споровых микроорганизмов, и подсчет изолированных колоний практически невозможен. В этих случаях в протоколе исследования следует указать: "Рост спорообразующих микроорганизмов". Пример расчета: если на чашках Петри при посеве 0,1 г продукта выросло в среднем 135 колоний, а при посеве 2-го разведения (0,01 г продукта) - 9 колоний, то в результатах исследования учитывают цифровые данные, полученные при посеве 1-го разведения, т.е. количество микроорганизмов 135 х 10 = 1350 в 1 г продукта. Для получения более точных данных по количеству мезофильных бактерий целесообразно сопоставлять результаты подсчета колоний, полученные на чашках, с посевами материала из последовательных разведений. Числа подсчитанных колоний должны примерно соответствовать кратности взятых разведений. Если количество колоний на чашках с посевами из последующих разведений (1:10, 1:100) почти совпадает или мало между собой разнится, то это указывает на недостаточное перемешивание посевного материала при приготовлении разведений и перед посевом. 2. Определение бактерий из рода сальмонелл Сальмонеллы - обширный род семейства энтеробактерий, включающих более 2200 серотипов, большинство из которых обладает патогенными свойствами. К сальмонеллам относятся аэробные и факультативно-анаэробные грамотрицательные подвижные (за исключением S.gallinarum-pullorum) палочки, хорошо растущие на обычных питательных средах и разнообразных пищевых субстратах. При исследовании образцов на наличие сальмонелл нижеизложенными методическими рекомендациями. Ход определения. Навеску продукта (25 г или др.) высевают в пептонную буферную воду в соотношении 1:9. Посевы инкубируют при 37 °С в течение 18 - 24 часов. После этого производят пересев по 1 мл культуры из пептонной буферной воды в одну из сред: Мюллера, Кауфмана, хлормагниеваемую М, селенитовый бульон в соотношении посевного материала и среды 1:9. Посевы инкубируют 24 - 48 ч при 37 °С. Через 24 ч и 48 часов со второй среды обогащения (Мюллера, Кауфмана, магниевой, селенитового бульона) пересевают на две любые дифференциальные среды (по выбору): Эндо, Плоскирева, Левина, висмут-сульфитный агар. Посевы просматривают через 18 - 24 ч термостатирования при 37 °С. При отсутствии роста подозрительных колоний инкубирование посевов продолжают еще 24 ч. Сальмонеллы на средах Эндо и Плоскирева растут в виде прозрачных бесцветных колоний, на среде Левина - бледно-розовых, голубоватых, розовато-фиолетовых колоний. На висмут-сульфитном агаре сальмонеллы растут в виде черных колоний с характерным металлическим блеском, при этом наблюдается прокрашивание в черный цвет участка среды под колонией. Исключение составляют S. paratyphoid, S. choleraesuis, S. abortusovis, S. gallinarum-pullorum и некоторые другие, которые при росте на висмут-сульфитном агаре образуют нежные светло-зеленые или серовато-зеленые колонии. Из каждой среды на чашке Петри из подозрительных колоний (не менее трех) производят посев штрихом и уколом на одну из комбинированных сред (Олькеницкого, Клиглера, Ресселя). Пробирки с посевами выдерживают в термостате при 37 °С 24 ч. Производят идентификацию культур, высеянных на комбинированные среды, по ферментации лактозы, глюкозы, сахарозы и расщеплению мочевины. Покраснение или пожелтение скошенной части столбика среды Олькеницкого указывает на образование кислоты в результате ферментации лактозы, сахарозы или обоих сахаров. Покраснение или пожелтение самого столбика указывает на расщепление глюкозы. Восстановление цвета среды до исходного (бледно-розовый) свидетельствует о расщеплении мочевины. Механизм действия среды Клиглера и Ресселя идентичен со средой Олькеницкого. Об образовании сероводорода судят по почернению среды в столбике. Если культуры сбраживают лактозу с образованием газа и расщепляют мочевину, они не принадлежат к бактериям рода сальмонелл. Культуры, не ферментирующие лактозу и не расщепляющие мочевину, но ферментирующие глюкозу (с образованием или без образования газа), подвергаются дальнейшему исследованию. Подозрительные колонии с комбинированной среды пересевают в пробирки со скошенным МПА, а также на среды Гисса с сахарами, 1-процентную пептонную воду для определения индола и сероводорода. Сальмонеллы расщепляют маннит с образованием кислоты, вследствие чего меняется цвет среды Гисса. При исследовании на индол и сероводород из подозрительной колонии микроорганизмы высевают в пробирки с 1-процентной пептонной водой и термостатируют при 37 °С 24 ч. Затем в пробирку с суточной культурой по стенке добавляют 5 - 10 капель реактива Эрлиха. При наличии индола не позднее чем через 5 мин. в пограничном слое образуется ярко-красное кольцо, при отсутствии кольцо остается светло-желтого цвета. Для определения индолообразования пользуются также реактивом Ковача. К суточной культуре добавляют 0,2 - 0,3 куб. см реактива и взбалтывают. Результаты учитывают через 10 мин.: реактив поднимается на поверхность среды и при наличии индола окрашивается в темно-красный цвет. Сальмонеллы индола не образуют. Для определения сероводорода в пробирку с посевом культуры в 1-процентную пептонную воду помещают под пробку полоску фильтровальной бумаги, предварительно смоченной уксусно-кислым свинцом и высушенной. Полоска не должна соприкасаться с питательной средой. Посев инкубируют при 37 °С 24 - 72 ч. Если культура выделяет сероводород, то бумажка с уксусно-кислым свинцом чернеет от образующегося сернистого свинца. При использовании среды Клиглера об образовании сероводорода судят по почернению среды в столбике. Сальмонеллы выделяют сероводород. Из пробирок с комбинированной средой с суточной культурой, показавшей типичную окраску среды для сальмонелл, или из пробирок с суточной культурой, пересеянной на МПА, проводят серологическое исследование. Для этого петлей берут небольшое количество культуры из пробирок, эмульгируют в капле физиологического раствора на предметном стекле. Добавляют каплю поливалентной O-сыворотки к раствору и осторожно покачивают предметное стекло, чтобы смешать жидкости. Положительная реакция на сальмонеллы (агглютинация) наблюдается в течение 30 - 60 сек. Обязательна постановка отрицательной реакции (культура + физиологический раствор). Если при проведении серологического исследования агглютинация не обнаруживается, конечный результат записывают как отсутствие сальмонелл. Любая агглютинация, которая появляется на стекле, говорит о вероятности присутствия сальмонелл. По показаниям для полной биохимической типизации сальмонелл проводят посев на расширенный пестрый ряд (ГОСТ 7702.2-74) и реакцию агглютинации не только с O-, но и с H-сыворотками (ГОСТ 7702.2-74). ПИТАТЕЛЬНЫЕ СРЕДЫ 1. Среды для определения общего количества факультативно-анаэробных микроорганизмов Обогащенный питательный агар Сухой питательный агар - 35,0 г Сухой экстракт кормовых дрожжей - 2,5 г Глюкоза - 1,0 г Вода дистиллированная - 1000 куб. см. Довести pH до 7,0, стерилизовать 20 мин. при 121 °С. мезофильных аэробных и 2. Среды и реактивы для определения сальмонелл 1. Среды предварительного обогащения 1.1. Пептонно-буферная вода Калия дигидрофосфат (KH2 PO4 ) - 0,45 г Натрия гидрофосфат, безводный (Na2 HPO4) - 5,34 г Пептонная вода (1 г пептона + 1000 куб. см - 1000 куб. см. дистиллированной воды) Приготовление: ингредиенты смешивают, разливают в пробирки или флаконы, стерилизуют в автоклаве при 121 °С 30 мин. 2. Среды обогащения 2.1. Среда Мюллера (тетратионатовый бульон Мюллера) Мел, стерилизованный сухим жаром, - 45 г Кальция карбонат (CaCO3 ) сухой стерильный - 25 г Мясопептонный бульон - 900 мл Раствор Люголя - 20 мл Натрия тиосульфат (Na2S2O3 х 5H2O) 50% стерильный раствор - 100 мл Приготовление: в стерильные флаконы помещают по 4,5 г мела, стерилизуют сухим жаром, после чего в каждый флакон наливают по 90 мл питательного бульона. Стерилизуют при 121 °С 30 мин. (pH 7,2 - 7,4). Затем ex tempore асептически добавляют в каждый флакон точно по 2 мл раствора Люголя и по 10 мл раствора натрия тиосульфата, хорошо смешивают и разливают по пробиркам. Готовая среда стерилизации не подлежит. Приготовление раствора Люголя: Калия йодид (KI) - 20 г Йод кристаллический (I2 ) - 25 г Вода дистиллированная - 100 мл Приготовление 50% раствора натрия тиосульфата В измерительный цилиндр насыпают 50 г натрия тиосульфата и добавляют воду до 100 мл, растворяют, переливают во флакон, стерилизуют текучим паром 30 мин. 2.2. Среда Кауфмана среда Мюллера (стерильная) - 500 мл желчь бычья (стерильная) - 250 мл бриллиантовый зеленый (0,1% водный раствор) - 50 мл Приготовление: ингредиенты смешивают, асептически разливают в стерильные пробирки по 10 мл, дополнительно не стерилизуют. Приготовление 20% желчного бульона бульон мясопептонный или Хоттингера - 800 мл желчь бычья нативная - 200 мл Приготовление: pH должен быть равен 7,6. Разливают по 50 мл во флаконы с поплавками. Стерилизуют текучим паром три дня по 30 мин. 2.3. Магниевая среда (или хлормагниевая среда) Среда состоит из трех растворов: Раствор I: пептон - 4,2 г натрия хлорид (NaCl) - 7,15 г калия дигидрофосфат (KH2 PO4 ) - 1,48 г дрожжевой диализат - 9 мл вода дистиллированная - 890 мл Раствор II: магния хлорид (MgCl2 х 6H2O) - 35,7 г вода дистиллированная - 90 мл Раствор III: бриллиантовый зеленый, 0,5% водный раствор - 0,9 мл Приготовление: все три раствора смешивают в указанных количествах, разливают в необходимых объемах в колбы, флаконы или пробирки, стерилизуют при 112 °С 30 мин. 3. Дифференциально-диагностические среды для пересевов со сред обогащения По степени подавления роста посторонней микрофлоры различают среды: - высокоселективные - висмут-сульфитный агар (ВСА); - среднеселективные - среда Плоскирева, слабощелочной питательный агар; - низкоселективные - среды Эндо, Левина. Среды Эндо, Левина, Плоскирева, ВСА выпускаются в сухом виде. Способ приготовления указан на этикетке. 3.1. Среды для первичной идентификации 3.1.1. Комбинированная среда по Олькеницкому выпускается в сухом виде. Способ приготовления указан на этикетке. Приготовление: Сухую питательную среду растворяют при нагревании и помешивании. Фильтруют через марлевый фильтр, устанавливают pH 7,2 - 7,4 и разливают в пробирки по 6 - 7 мл. Среду стерилизуют текучим паром 3 дня подряд по 20 мин. и скашивают, оставляя столбик 2 - 2,5 см. Готовая среда бледно-розового цвета. 3.1.2. Агар Клиглера Коммерческую сухую среду готовят в соответствии с указаниями на этикетке препарата. Готовая к употреблению среда имеет красновато-бурый или оранжево-красный цвет, при скашивании следует оставлять столбик высотой 2 - 2,5 см. 3.1.3. Среда Ресселя Приготовление среды Ресселя (сухой) указано на этикетке. 3.2. Среды и реактивы для биохимической дифференциации сальмонелл 3.2.1. Среды Гисса (среды с углеводами) Выпускаются коммерческие сухие среды с углеводами (глюкозой, лактозой, мальтозой, сахарозой и маннитом). Их приготовление указано на этикетке. 3.2.1. Реактив Орлиха (на индол) Взвешивают 5 г парадиметиламидобензальдегида в стеклянном стакане вместимостью 100 куб. см, помещают в коническую колбу вместимостью 200 куб. см и растворяют в 50 мл этилового спирта. С помощью мерного цилиндра вместимостью 100 мл медленно добавляют 50 мл концентрированной соляной кислоты. Раствор хранят в колбе с притертой пробкой при температуре 4 °С. 3.2.2. Реактив Ковача (на индол) В 75 мл амилового спирта растворяют 5 г парадиметиламидобензальдегида, затем медленно добавляют 25 мл концентрированной соляной кислоты. Реактив хранят в колбе с притертой пробкой из темного стекла при температуре 4 - 8 °С. 3.2.3. Приготовление индикаторной бумаги для определения сероводорода В 100 мл дистиллированной воды растворяют 20 г уксусно-кислого свинца и 1 г двууглекислого натрия. Этим раствором пропитывают полоски фильтровальной бумаги, высушивают их при температуре 18 - 23 °С и нарезают на узкие полоски. После приготовления бумага остается белой; при наличии сероводорода чернеет. 3.2.4. Агглютинирующие сальмонеллезные сыворотки Необходимые разведения сыворотки готовят перед использованием согласно прилагаемой к коробке инструкции. Протокол санитарно-гигиенического исследования тушек, мяса птицы и птицепродуктов. Оформление результатов лабораторного исследования продуктов должно производиться в виде протокола-отчета утвержденной формы. Протокол-отчет заключительной. состоит из трех частей: описательной, результативной и В описательной части указываются: Название лабораторной работы; Цель работы; Название и время поступления образца в лабораторию; вид и характер упаковки; кто, когда, откуда произвел выемку; масса (или количество экземпляров) каждого образца; бактериологические показатели и методы их определения. В результативной части приводятся данные бактериологического исследования. Результаты исследований оформляются в виде таблицы. Таблица 2.2. - Результат микробиологического контроля мяса птицы, потрохов Наименование Поставщик ОМЧ Наличие Заключение Подпись проб (КОЕ/г) сальмонелл в 25 г бактериолога продукта Среда ВСА накопления В заключении дается оценка микробиологичсекого качества исследуемого образца и пригодности его для питания. Отчет по лабораторной работе подписывается преподавателем. Контрольные вопросы 12. Как производится отбор образцов тушек, мяса птицы и птицепродуктов для лабораторного исследования? 13. Какие бактериологические показатели определяются при санитарно-микробиологическом исследовании тушек, мяса птицы и птицепродуктов? 14. Как определяется ОМЧ для тушек, мяса птицы и птицепродуктов? 15. Как определяется наличие бактерий рода Salmonella в тушках, мясе птицы и птицепродуктах? 16. Опишите этапы определения бактерий рода Salmonella в тушках, мясе птицы и птицепродуктах. Нарисуйте схему эксперимента. Вопросы СРС 1. 2. 2. 3. Основные пути загрязнения продуктов питания и продовольственного сырья. Виды заболеваний, предаваемых через пищевые продукты. Бактериальные пищевые интоксикации и токсикоинфекции. Санитарно-показательные микроорганизмы. Характеристика. Требования к СПМ. 4. Методы определения санитарно-показательных микроорганизмов. Индекс. Титр. 5. Характеристика основных групп санитарно-показательных микроорганизмов индикаторов фекального загрязнения. - Лабораторная работа № 3. Санитарно - микробиологическое исследование куриных яиц Цель занятий - Освоить методы санитарно микробиологического контроля куриных яиц. Задания: 1. Приготовить питательные среды для проведения микробиологического исследования яиц. 2. Произвести отбор проб, подготовить их для исследования и произвести посевы на питательные среды. 3. Определить ОМЧ, БКГП, сальмонеллы в яйцах. 4. Проанализировать результаты исследования, оценить качества яиц по микробиологическим показателям. 5. Ответить на контрольные вопросы. Яйцо птицы представляет собой сложный биологический комплекс, в который входят все необходимые для жизни организма питательные и биологически активные вещества, заключенные в защитные оболочки. При хранении яиц попавшие в них микроорганизмы могут размножаться и вызывать их порчу. Санитарно-микробиологическое исследование яиц проводят согласно ГОСТ 285882 и по ОСТ 49 197-83, Инструкции по санитарно — микробиологическому контролю тушек, мяса птицы, птицепродуктов, яиц и яйцепродуктов на птицеводческих и птицеперерабатывающих предприятиях 1990. Контроль распространяется на все соответствующие цехи производства яйцепродуктов птицеводческих и птицеперерабатывающих предприятий (птицефабрики, птицекомбинаты). Один из разделов включает санитарно-микробиологический контроль поступающего сырья (яиц куриных). Микробиологическое исследование проводят по эпидемиологическим показаниям при возникновении инфекционных заболеваний птиц и подозрении на контаминацию яиц патогенными микроорганизмами; при текущем санитарном надзоре птицеводческими хозяйствами. Основной задачей микробиологического контроля птицеперерабатывающего предприятия является обеспечение выпуска продукции высокого качества, безопасного в эпидемическом и эпизоотическом отношениях. Результаты микробиологического исследования качества готовой продукции являются ретроспективными и позволяют оценивать санитарно-гигиеническое благополучие предприятия, по ним судят о соблюдении технологических процессов. В случаях ухудшения микробиологических показателей готовой продукции контроль должен быть направлен на выявление источников и причин повышения микробной обсемененности с целью их ликвидации. Отбор проб. Для микробиологического анализа яиц, предназначенных для производства яйцепродуктов, отбирают из разных мест партии методом случайной выборки пробу в количестве 30 штук, а в других случаях — не меньше 5-10 яиц. Отобранные пробы упаковывают в чистую тару и транспортируют в условиях, исключающих их повреждение и вторичную контаминацию. Особенность санитарно-микробиологических исследований яиц и продуктов их переработки заключается в одновременном анализе микрофлоры на скорлупе и в содержимом яйца. Санитарно-микробиологическое исследование куриных яиц проводят следующими методами: 1) При микробиологическом исследовании содержимого яиц поверхность скорлупы яиц обмывают щелочным теплым (30 +/- 2) °С раствором 0,2% концентрации каустической соды или 0,5% кальцинированной соды в течение 1,5 - 2 мин. После мойки яйцо ополаскивают водопроводной водой, дают воде стечь, яйцо погружают в этиловый (70%) спирт, после смачивания спиртом обжигают пламенем. На остром конце яйца делают стерильным скальпелем отверстие диаметром около 1 см и тоже обжигают. Содержимое одного яйца или нескольких яиц выливают в широкогорлую колбу Эрленмейера и смешивают с помощью стерильных бус или палочками. Полученный гомогенат обрабатывают сразу. 2) При микробиологическом исследовании поверхности скорлупы яиц используют смывы, полученные методом тампона или ополаскивания, или измельчения. - При получении смыва методом тампона яйцо погружают в ступку, содержащую 10 мл стерильной водопроводной воды или стерильного физиологического раствора хлористого натрия, и с помощью стерильного тампона обмывают поверхность яйца в течение 2 - 3 мин. Яйцо удаляют, смыв используют для исследования. - При получении смыва методом ополаскивания в стерильную посуду или полиэтиленовый пакет наливают 10 мл стерильной водопроводной воды или стерильного физиологического раствора хлористого натрия и погружают яйцо. Затем осуществляют встряхивание в течение 3 - 5 мин. Предварительно посуду закрывают стерильной крышкой, верхнюю часть пакета достаточно сжимают, чтобы не допустить разлива жидкости. Размер пакета 15 х 25 см. Яйцо удаляют, смыв используют для исследования. - При получении смыва методом измельчения скорлупу и подскорлупные оболочки отделяют от содержимого яиц и помещают в стерильные банки. В последних измельчают стеклянными палочками, после чего встряхивают со стеклянными бусами в стерильной водопроводной воде или стерильном физиологическом растворе хлористого натрия. После отстаивания в течение 3 - 5 мин. надосадочную жидкость используют для исследования. Скорлупу и подскорлупные оболочки можно измельчать пестиком со стерильным стеклянным песком в ступках. На 90мл жидкости берется скорлупа от 3 яиц. Для исследования используют смыв без разведения или же готовят десятикратные разведения в зависимости от степени загрязнения поверхности скорлупы яиц. Математически поверхность яйца вычисляют по формуле: BхP S = П-------, 2 где S - площадь поверхности B - ширина P - длина окружности П - 3,14 МЕТОДЫ МИКРОБИОЛОГИЧЕСКОГО КОНТРОЛЯ Содержимое яиц, смывы с их скорлупы подвергают микробиологическому исследованию в соответствии с действующей нормативно-технической документацией на эти продукты. Согласно ГОСТу МРТУ при бактериологическом исследовании определяется: МАФАнМ (ОМЧ), бактерии группы кишечных палочек, наличие сальмонелл. В отдельных случаях исследуют яйца и яичные продукты на количественное содержание плесневых грибов. 1. Определение общего количества мезофильных аэробных и факультативноанаэробных микроорганизмов (МАФАнМ) - общее микробное число (ОМЧ) Общую бактериальную обсемененность поверхности и содержимого яиц количество МАФАнМ определяют общепринятыми методами путем посева конкретного объема в см3 или его 10-кратных разведений в мясопептонный агар. 10 мл яичной массы (пробы) с помощью стерильной пипетки переносят в колбу, содержащую 90 мл физиологического раствора хлористого натрия, и получают таким образом разведение 1:10 (разведение №1). После перемешивания 1 мл разведения №1 переносят с помощью пипетки в пробирку, содержащую 9 мл физиологического раствора, и получают таким образом разведение 1:100 (разведение №2). Подобным методом получают требуемое количество других разведений. Дальнейший ход исследований по определению микробного числа описаны в методике микробиологического исследования тушек птицы и птицепродуктов (лабораторная работа №2). 2. Определение бактерий группы кишечных палочек (БГКП) К колиформным бактериям относят аэробные и факультативно анаэробные не образующие спор Грам- палочки, сбраживающие лактозу с образованием кислоты и газа. Колиформы определяют по ГОСТ Р 50474-93 тремя методами: метод НВЧ и методы посева в (или на) агаризованные селективно-диагностические среды. Для проведения испытаний применяют среды: агар лактозный с бриллиантовым зеленым и феноловым красным, бульон лактозный с бриллиантовым зеленым и желчью, бульон Мак-Конки, среда Кесслера, среда Эндо. Посевы на агаризованных и жидких средах инкубируют при температуре 36±1 0С в течение 24–48 ч. Положительными считают посевы в жидкие среды, в которых имеет место интенсивный рост микроорганизмов, проявляющийся в помутнении среды, образовании газа, подкислении среды (изменении цвета). На агаризованных средах отмечают рост характерных колоний. Так, на среде Эндо колиформы образуют бледно-розовые или красные с металлическим блеском колонии. Ход определения Для выявления БГКП из проб яиц проводят посев 1 мл разведения 1:10 высевают в пробирки со средой Кесслер. Посевы культивируют в термостате при 37°С в течение 2448ч. Из пробирок с признаками роста: изменение цвета среды, помутнение, газообразование, делают высев на среду Эндо и выдерживают 24 ч при 37 0С. Затем посевы просматривают и отмечают рост колоний, характерных для БГКП. На среде Эндо бактерии этой группы образуют темно-красные колонии с металлическим блеском или розово-красные без блеска. Для окончательного заключения о присутствии в продукте БГКП не менее чем из трех из подозреваемых колоний готовят мазки, окрашенные по Граму: при микроскопии обнаруживают грамотрицательные палочки различной величины. 3. Определение бактерий из рода сальмонелл Для исследования яиц на сальмонеллы желток яиц. При исследовании желтков в стерильную посуду помещают 5 желтков (одна проба), их гомогенизируют и используют для посева. Дальнейший ход исследований по выявлению наличия сальмонелл описаны в методике микробиологического исследования тушек птицы и птицепродуктов (лабораторная работа №2). Микробиологические показатели яиц, их оценка представлены в таблице 3.1. Таблица 3.1 – Микробиологические показатели яиц Наимено Количество Масса продукта (г), в Приме вания мезофильных которой не допускаются чание продуктов аэробных и БГКП Патогенные факультативно(колиформы) микроорганизмы, анаэробных в т. ч. микроорганизмов, сальмонеллы КОЕ/г, не более Яйцо 5х102-5х103 0,1 25 В куриное желтках 5 диетическое яиц сальмонеллы не допускаются 4 5 Яйцо 5х10 -5х10 0,1-0,01 25 куриное столовое Примечание: БГКП - сбраживающие лактозу с образованием кислотного газа при 37 °С. При несоответствии яиц и яйцепродуктов требованиям по микробиологическим показателям их направляют на выработку термически обрабатываемых продуктов. Питательные среды: 1. Среды для определения ОМЧ. 1.1. 0,5% раствор кальцинированной соды. 1.2. Физиологический раствор. 1.3. Питательный агар. 2. Среды для обнаружения бактерий группы кишечных палочек (колиформных бактерий). 2.1. Среда Кесслер (с лактозой) К 1000 мл дистиллированной воды добавляют 10 г пептона и 50 мл стерильной бычьей желчи. Смесь нагревают на водяной бане при перемешивании 20 - 30 мин., затем фильтруют через ватно-марлевый фильтр, добавляют 2,5 г лактозы, доводят объем до 1000 мл. Устанавливают pH 7,4 - 7,6, используя 1 Н растворы NaOH или HCl и проверяя значения pH на потенциометре или универсальной бумагой. Добавляют 2 мл 1% водного раствора генцианового фиолетового, разливают по 10 мл в пробирки с поплавками. Стерилизуют 15 мин. при 121 °С. Готовая среда фиолетового цвета. 2.2. Агар Эндо. 3. Среды для обнаружения бактерий сальмонелл. 3.1. Среда Мюллера или магниевая. 3.2. ВСА. 3.3. Среда Олькеницкого. Протокол-отчет заключительной. состоит из трех частей: описательной, результативной и В описательной части указываются: Название лабораторной работы; Цель работы; Название и время поступления образца в лабораторию; кто, когда, откуда произвел выемку; масса (или количество экземпляров) каждого образца; бактериологические показатели и методы их определения. В результативной части приводятся данные бактериологического исследования. Результаты исследований оформляются в виде таблицы. Таблица 3.2. - Результат микробиологического контроля яиц Наименование Поставщик ОМЧ Титр Титр Заключение Подпись проб (КОЕ/г) БГКП сальбактериолога монелл В заключении дается оценка микробиологичсекого качества исследуемого образца и пригодности его для питания. Отчет по лабораторной работе подписывается преподавателем. Контрольные вопросы 1. Порядок отбора проб яиц и подготовка их для бактериологического исследования. 2. Какие бактериологические показатели определяются при санитарномикробиологическом исследовании яиц? 3. Как определяется ОМЧ в содержимом яиц? Нарисуйте схему эксперимента. 4. Как определяется наличие бактерий группы кишечных палочек в содержимом яиц? Техника посевов на питательные среды. Нарисуйте схему эксперимента. 5. Как определяется наличие бактерий рода Salmonella в в содержимом яиц Техника посевов на питательные среды. Нарисуйте схему эксперимента. 6. Каковы микробиологические показатели яиц? Вопросы для СРС 1. Яйца птиц. Экспертиза их качества 2. Обсеменение яиц микроорганизмами. Эндогенное обсеменение. Экзогенное обсеменение. 3. Развитие микроорганизмов в яйце при хранении. 4. Пороки и виды порчи яиц. 5. Санитарно-гигиенические требования при производстве яиц.