Химическая связь.
реклама

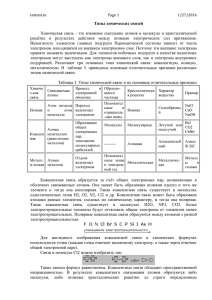
Химическая связь. В природе не существуют одиночные атомы. Все они находятся в составе простых и сложных соединений, где их объединение в молекулы обеспечивается образованием химических связей друг с другом. Образование химических связей между атомами – естественный, самопроизвольный процесс, так как при этом происходит понижение энергии молекулярной системы, т.е. энергия молекулярной системы меньше суммарной энергии изолированных атомов. Это движущая сила образования химической связи. Природа химических связей – электростатическая, т.к. атомы есть совокупность заряженных частиц, между которыми действуют силы притяжения и отталкивания, которые приходят в равновесие. В образовании связей участвуют неспаренные электроны, находящиеся на внешних атомных орбиталях (или готовые электронные пары) – валентные электроны. Говорят, что при образовании связей происходит перекрывание электронных облаков, в результате чего между ядрами атомов возникает область, где вероятность нахождения электронов обоих атомов максимальна. s, p - элементы d – элементы Валентыми являются электроны внешнего уровня Валентыми являются электроны внешнего уровня и d – электроны предвнешнего уровня Например, Например, Н +1)1e 1s1 Cr +24)2e)8e)8e+5e)1e - внешний уровень не завершён - 6 валентных электронов (5е+1е) - 1 валентный электрон O +8 )2e)6e 1s22s22p4 - внешний уровень не завершён - 6 валентных электронов Химическая связь - это взаимодействие атомов, осуществляемое путем обмена электронами. При образовании химической связи атомы стремятся приобрести устойчивую восьмиэлектронную (или двухэлектронную – Н, Не) внешнюю оболочку, соответствующую строению атома ближайшего инертного газа, т.е. завершить свой внешний уровень. Классификация химических связей. 1. По механизму образования химической связи. а) обменный, когда оба атома, образующие связь, предоставляют для неё неспаренные электроны. Например, образование молекул водорода Н2 и хлора Cl2 : б) донорно – акцепторный, когда один из атомов предоставляет для образования связи готовую пару электронов (донор), а второй атом – пустую свободную орбиталь. Например, образование иона аммония (NH4)+ (заряженная частица): 2. По способу орбиталей. а) перекрывания электронных σ - связь (сигма), когда максимум перекрывания лежит на линии, соединяющей центры атомов. Например, H2 σ(s-s) Cl2 σ(p-p) HCl σ(s-p) б) π - связи (пи), если максимум перекрывания не лежит на линии, соединяющей центры атомов. По способу достижения электронной оболочки. завершенной 3. Каждый атом стремится завершить свою внешнюю электронную оболочку, при этом способов достижения такого состояния может быть несколько. Признак сравнения Как достигается завершенная электронная Ковалентная Ионная неполярная полярная Обобществление Обобществление Полная электронов электронов электронов, оболочка ? образование Металлическая передача Обобществление электронов всеми атомами ионов в крист. решетке (заряженных частиц). Какие атомы участвуют? немет – немет 1) Немет-Немет1 мет +немет- В узлах находятся катионы и атомы металла. ЭО ЭО ЭО = ЭО Связь осуществляют свободно перемещающиеся в межузловом пространстве 2)Мет–немет электроны. ЭО ЭО ∆= ЭО1 – ЭО2 Примеры 1,7 0 простые вещества кислоты, оксиды – неметаллы. 1,7 0 соли, щелочи, оксиды простые щелочных металлов. металлы. вещества – Связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке. КОВАЛЕНТНАЯ СВЯЗЬ - это связь, возникающая между атомами за счет образования общих электронных пар (Например, H2, HCl, H2O, O2). По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной. А) КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ СВЯЗЬ (КНС) - образуют атомы одного и того же химического элемента неметалла (Например, H2, O2, О3). Механизм образования связи. Каждый атом неметалла отдает в общее пользование другому атому наружные не спаренные электроны. Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам. Рассмотрим механизм образования молекулы хлора: Cl2 – кнс. Электронная схема образования молекулы Cl2: Структурная формула молекулы Cl2: σ Cl – Cl , σ (p – p) - одинарная связь Демонстрация образования молекулы водорода Рассмотрим механизм образования молекулы кислорода: О2 – кнс. Электронная схема образования молекулы О2: Структурная формула молекулы О2: σ О=О π В молекуле кратная, двойная связь: Одна σ (p – p) и одна π (р – р) Демонстрация образования молекул кислорода и азота Б) КОВАЛЕНТНАЯ ПОЛЯРНАЯ СВЯЗЬ (КПС) - образуют атомы разных неметаллов, отличающихся по значениям электроотрицательности (Например, HCl, H2O). Встречаются исключения, когда ковалентную связь образуют атом неметалла и металла! Например, AlCl3, разница в электроотрицательности ∆ <1.7, т.е. ∆ = 3,16 (Cl) – 1,61(Al) = 1,55 Электроотрицательность (ЭО) - это свойство атомов одного элемента притягивать к себе электроны от атомов других элементов. Самый электроотрицательный элемент – фтор F Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют ряд электроотрицательности элементов, предложенный американским химиком Л. Полингом. Таблица. Электроотрицательности (ЭО) некоторых элементов (приведены в порядке возрастанияЭО). Элемент K Na Ca Al H Br N Cl O F ЭО 0.82 0.93 1 1.61 2.2 2.96 3.04 3.16 3.44 4.0 Механизм образования связи. Каждый атом неметалла отдает в общее пользование другому атому свои наружные не спаренные электроны. Образуются общие электронные пары. Общая электронная пара смещена к более электроотрицательному элементу. Рассмотрим механизм образования молекулы хлороводорода: НCl – кпс. Электронная схема образования молекулы НCl: Структурная формула молекулы НCl: σ Н → Cl , σ (s – p) - одинарная связь σ, смещение электронной плотности в сторону более электроотрицательного атома хлора (→) ИОННАЯ СВЯЗЬ (ИС) – образуется между атомами металлов и неметаллов, т.е. между атомами, резко отличающимися друг от друга по значениям электроотрицательности. (Например, NaCl, K2O, LiF) Механизм образования связи. Атом неметалла забирает наружные электроны у атома металла и превращается в анион (отрицательно заряженный ион). Атом металла теряет электроны и превращается в катион (положительно заряженный ион). Ионы связаны электростатическими силами. Происходит полная отдача (принятие) валентных электронов, перекрывание облаков отсутствует, обобществления электронов не наблюдается. Ионы Рассмотрим механизм образования молекулы фторида натрия: NaF – ис. Электронная схема образования молекулы NaF: Na +11)2ē)8ē)1ē F +9)2ē)7ē Na0 – 1ē → Na+1 атом ион натрия натрия F0 + 1ē → F-1 атом ион фтора фтора В результате образования связи электронная пара полностью сместилась к атому фтора, разноименно заряженные иона натрия и фтора притягиваются за счёт электростатического взаимодействия. Пример, механизм образования хлорида натрия СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА КОВАЛЕНТНОЙ И ИОННОЙ ХИМИЧЕСКОЙ СВЯЗИ