9 класс. Контрольная работа № 1 «Теория ЭД» I вариант. 1
реклама
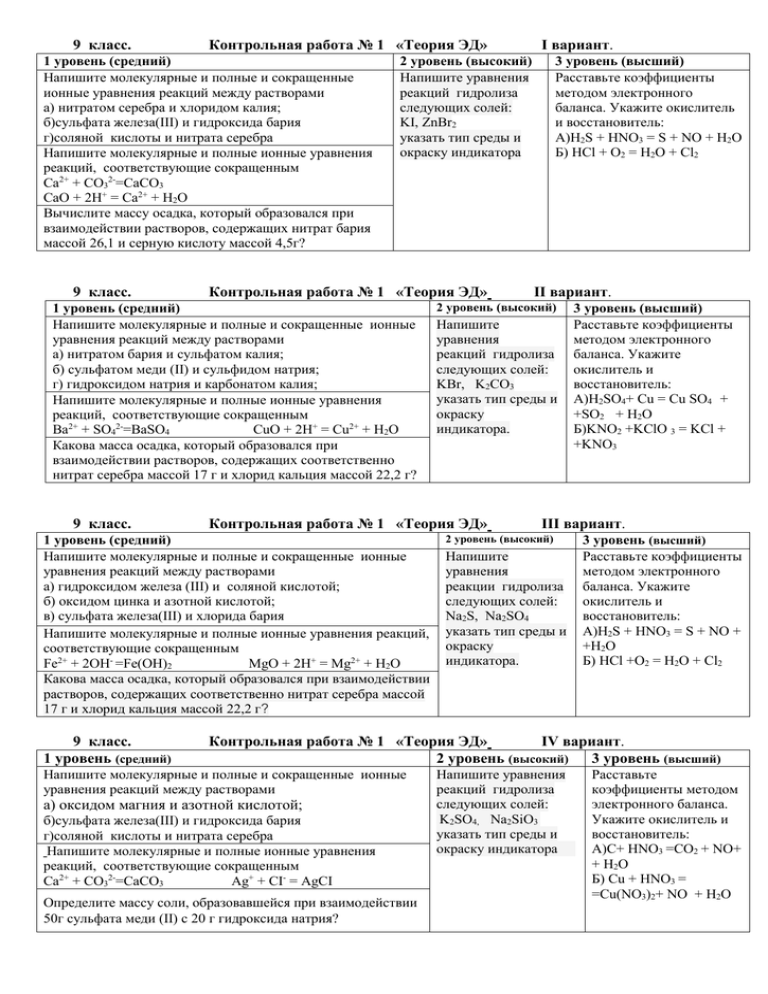
9 класс. Контрольная работа № 1 «Теория ЭД» 1 уровень (средний) Напишите молекулярные и полные и сокращенные ионные уравнения реакций между растворами а) нитратом серебра и хлоридом калия; б)сульфата железа(III) и гидроксида бария г)соляной кислоты и нитрата серебра Напишите молекулярные и полные ионные уравнения реакций, соответствующие сокращенным Ca2+ + CO32-=CaCO3 CaO + 2H+ = Ca2+ + H2O Вычислите массу осадка, который образовался при взаимодействии растворов, содержащих нитрат бария массой 26,1 и серную кислоту массой 4,5г? 9 класс. Контрольная работа № 1 «Теория ЭД» 1 уровень (средний) Напишите молекулярные и полные и сокращенные ионные уравнения реакций между растворами а) нитратом бария и сульфатом калия; б) сульфатом меди (II) и сульфидом натрия; г) гидроксидом натрия и карбонатом калия; Напишите молекулярные и полные ионные уравнения реакций, соответствующие сокращенным Ba2+ + SO42-=BaSO4 CuO + 2H+ = Cu2+ + H2O Какова масса осадка, который образовался при взаимодействии растворов, содержащих соответственно нитрат серебра массой 17 г и хлорид кальция массой 22,2 г? 9 класс. 3 уровень (высший) Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель: А)H2S + HNO3 = S + NO + H2O Б) HCl + O2 = H2O + Cl2 II вариант. 2 уровень (высокий) Напишите уравнения реакций гидролиза следующих солей: KBr, K2CO3 указать тип среды и окраску индикатора. Контрольная работа № 1 «Теория ЭД» 1 уровень (средний) Напишите молекулярные и полные и сокращенные ионные уравнения реакций между растворами а) гидроксидом железа (III) и соляной кислотой; б) оксидом цинка и азотной кислотой; в) сульфата железа(III) и хлорида бария Напишите молекулярные и полные ионные уравнения реакций, соответствующие сокращенным Fe2+ + 2OH- =Fe(OH)2 MgO + 2H+ = Mg2+ + H2O Какова масса осадка, который образовался при взаимодействии растворов, содержащих соответственно нитрат серебра массой 17 г и хлорид кальция массой 22,2 г? 9 класс. 1 уровень (средний) I вариант. 2 уровень (высокий) Напишите уравнения реакций гидролиза следующих солей: KI, ZnBr2 указать тип среды и окраску индикатора 3 уровень (высший) Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель: А)H2SO4+ Сu = Сu SO4 + +SO2 + H2O Б)KNO2 +KClO 3 = KCl + +KNO3 III вариант. 2 уровень (высокий) Напишите уравнения реакции гидролиза следующих солей: Na2S, Na2SO4 указать тип среды и окраску индикатора. 3 уровень (высший) Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель: А)H2S + HNO3 = S + NO + +H2O Б) HCl +O2 = H2O + Cl2 Контрольная работа № 1 «Теория ЭД» IV вариант. 2 уровень (высокий) 3 уровень (высший) Напишите молекулярные и полные и сокращенные ионные уравнения реакций между растворами а) оксидом магния и азотной кислотой; б)сульфата железа(III) и гидроксида бария г)соляной кислоты и нитрата серебра Напишите молекулярные и полные ионные уравнения реакций, соответствующие сокращенным Ca2+ + CO32-=CaCO3 Ag+ + CI- = AgCI Определите массу соли, образовавшейся при взаимодействии 50г сульфата меди (II) с 20 г гидроксида натрия? Напишите уравнения реакций гидролиза следующих солей: K2SO4, Na2SiO3 указать тип среды и окраску индикатора Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель: А)C+ HNO3 =CO2 + NO+ + H2O Б) Сu + HNO3 = =Cu(NO3)2+ NO + H2O 9 класс. Контрольная работа № 2 « Неметаллы и их соединения» 1 уровень (средний) Закончите уравнения реакций. H3PO4 + NaOH = NaOH + SiO2 = CaCO3 => Осуществите цепочку превращений. Si → SiO2 → Na2SiO3 → H2SiO3 → K2SiO3 Какой объем углекислого газа выделится при термическом разложении 9 кг известняка, содержащего 5% примесей. 9 класс. 2 уровень (высокий) Какой объем углекислого газа (н. у.) выделится при взаимодействии 15 г карбоната натрия, содержащего 15% примесей, с соляной кислотой? 2 уровень (высокий) Какой объем углекислого газа (н. у.) выделится при взаимодействии 15 г карбоната натрия, содержащего 15% примесей, с соляной кислотой? III вариант. 3 уровень (высший) При нейтрализации 9.8 г фосфорной кислоты гидроксидом кальция выделилось 15 г фосфата кальция. Какова массовая доля (в %) выхода соли от теоретически возможного? Контрольная работа № 2 « Неметаллы и их соединения» 1 уровень (средний) Закончите уравнения реакций. Pb + H2SO4 (конц.) = FeSO4 + KOH = Na2S + H2SO4 = Осуществите следующие превращения: N2 → NH3 → NO → NO2→ HNO3 → NaNO3 Какова масса оксида кальция, полученного при обжиге 500 г известняка, массовая доля примесей в котором составляет 20%? II вариант. 3 уровень (высший) При нейтрализации 294 г серной кислоты гидроксидом натрия выделилось 400 г сульфата натрия. Какова массовая доля (в %) выхода соли от теоретически возможного? Контрольная работа № 2 « Неметаллы и их соединения» 1 уровень (средний) Закончите уравнения реакций. Cu + HNO3 (разб.) = Na2SO3 + HCl = Н3РО4 + Сa(OH)2 = Осуществите следующие превращения: SO2 → SO3 → H2SO4 → K2SO4 → BaSO4 Определите массу оксида углеродаIV, образовавшегося при термическом разложении известняка массой 5 кг, содержащего 12 % примесей 9 класс. 3 уровень (высший) Вычислите массовую долю (в %) выхода хлорида аммония от теоретически возможного, если в реакцию с хлороводородом вступило 170 г аммиака и получено 500 г хлорида аммония. Контрольная работа № 2 « Неметаллы и их соединения» 1 уровень (средний) Закончите уравнения реакций. Cu + HNO3 (разб.) = Na2SO3 + HCl = Н3РО4 + Сa(OH)2 = Осуществите следующие превращения: SO2 → SO3 → H2SO4 → K2SO4 → BaSO4 Определите массу оксида углеродаIV, образовавшегося при термическом разложении известняка массой 5 кг, содержащего 12 % примесей 9 класс. 2 уровень (высокий) Какой объем сероводорода (н. у.) образуется при взаимодействии 19,36 г сульфида железа (II), содержащего 10% примесей, с соляной кислотой? I вариант. 2 уровень (высокий) Какой объем оксида углерода (IV) получится при сжигании 60 г этана, содержащего 9% примесей? IV вариант. 3 уровень (высший) Вычислите массовую долю (в%) выхода хлорида аммония от теоретически возможного, если в реакцию с хлороводородом вступило 170 г аммиака и получено 500 г хлорида аммония. 9 класс. Контрольная работа № 3 « Металлы и их соединения» 1 уровень (средний) Закончите уравнения реакций. Zn + HNO3 (разб.)= N2 + … Fe2O3 + C= CuCI2 +Mg = Составьте уравнения химических реакций, необходимых для осуществления превращений: Al AlCl3 Al(OH)3 Al2O3 KAlO2 Al(NO3)3. Рассчитайте массу металла, который можно получить из 16г оксида железа (III) алюмотермическим способом. 9 класс. 2 уровень (высокий) Напишите уравнения реакций взаимодействия железа с простыми веществами: кислородом, хлором, бромом, р-рами гидроксида калия и соляной кислоты. 2 уровень (высокий) Напишите уравнения реакций взаимодействия железа с бромом, серой, с р-рами: серной кислоты; сульфата меди (II). Контрольная работа № 3 « Mеталлы и их соединения» 1 уровень (средний) Закончите уравнения реакций. Pb + HNO3 (конц.) = Na2SiO3 + HCl = Н3РО4 + AgNO3 = Осуществите цепочку превращений. Ca Ca(OH)2 CaCO3 Ca(HCO3)2 CaCl2 Ca(NO3)2. Рассчитайте массу металла, который можно получить при взаимодействии углерода с 28,8 г оксида железа (II). 2 уровень (высокий) Напишите уравнения реакций взаимодействия алюминия: гидроксидом калия, хлоридом меди (II); бромоводородной кислотой; хлором II вариант. 3 уровень (высший) Какую массу железа можно получить из 960 г оксида железа (III) при восстановлении его оксидом углерода (II), если массовая доля выхода составляет 90%?. Контрольная работа № 3 « Mеталлы и их соединения» 1 уровень (средний) Закончите уравнения реакций. Cu + H2SO4 (конц.) = Fe2(SO3)3 + NaOH = Zn + CuCI2= Осуществите цепочку превращений. Ca Ca(OH)2 CaCO3 Ca(HCO3)2 CaCl2 Ca(NO3)2 Рассчитайте массу металла, который можно получить при взаимодействии углерода с 144 г оксида железа (II). 9 класс. 3 уровень (высший) При взаимодействии 12 г технического магния, содержащего 5% примесей, с избытком соляной кислоты, выделилось 10 л водорода (н.у.). Вычислите объемную долю выхода продукта реакции. Контрольная работа № 3 « Металлы и их соединения» 1 уровень (средний) Закончите уравнения реакций. Mg + HNO3 (разб.) = NH4NO3 + … Fe(OH)3 ==> Вa(NO3)2 + Na2SO4 = Осуществите цепочку превращений. Fe FeCl3 Fe(OH)3 Fe2O3 Fe FeCl2 Рассчитайте массу металла, который можно получить при взаимодействии углерода с 28,8 г оксида железа (II). 9 класс. 2 уровень (высокий) Напишите уравнения реакций взаимодействия алюминия со следующими ввами: хлором, разбавленной серной кислотой, кислородом , раствором сульфата меди (II). I вариант. III вариант. 3 уровень (высший) При взаимодействии 12 г технического магния, содержащего 5% примесей, с избытком соляной кислоты, выделилось 10 л водорода (н.у.). Вычислите объемную долю выхода продукта реакции. IV вариант. 3 уровень (высший) При взаимодействии 60г технического кальция, содержащего 2% примесей, с водой было получено 30л водорода (н.у.). Вычислите объемную долю выхода продукта реакции (в %) 9 класс. Контрольная работа № 4 «Органические соединения углерода» 1 уровень (средний) Cоставьте уравнения химических реакций по схеме генетической связи: 2 уровень (высокий) При пропускании 7 л этилена с водородом C2H6 → C2H4 → C2H5OH→ CH3CHO → над нагретым CH3 – COOH → CH2Cl–COOH →NH2CH2COOH катализатором Сколько всего изомеров класса циклоалканов, получили 6 л этана отвечающих составу С5Н10, составьте их (н.у.). Вычислите структурные формулы и назовите их объемную долю (в %) Определите объем углекислого газа и массу воды, выхода этана от образующихся при полном сгорании бензола теоретически массой 195 грамм. возможного. 9 класс. Контрольная работа № 4 «Органические соединения углерода» 1 уровень (средний) Cоставьте уравнения химических реакций по схеме генетической связи: 2 уровень (высокий) Вычислите массовую долю (в %) выхода СаС2→ C2H2 → C2H4 → C2H5OH → CH3CHO → бензола от - СH3 CH3–COOH → CH3–COOтеоретически Сколько всего изомеров класса алканов, отвечающих возможного, если составу С6Н14, составьте их структурные формулы и известно, что из 11,2 л назовите их ацетилена (н.у.) было Определите объем углекислого газа и массу воды, получено 10 г бензола. образующихся при полном сгорании этанола массой 184 грамм. 9 класс. 2 уровень (высокий) В лаборатории из 156 г бензола при CH3–COONa → CH4 → C2H2 → CH3CHO → CH3–COOH → реакции нитрования CH2Cl–COOH → NH2CH2COOH было получено 220 г Сколько всего изомеров класса алкенов, отвечающих нитробензола. Каков составу С5Н10, составьте их структурные формулы и выход нитробензола назовите их (в %) от Определите объем углекислого газа и массу воды, теоретически образующихся при полном сгорании этана массой 15 возможного? грамм. 2 уровень (высокий) Вычислите массовую долю (в % ) выхода СаСО3 → CaO → CaC2 → C2H2 → C6H6 → C6H5Cl → бензола от теоретически →C6H5OH → C6H2(NO3)3OH возможного, если Сколько всего изомеров класса алкинов, отвечающих известно, что из 11,2 л составу С5Н8, составьте их структурные формулы и ацетилена (Н. у.) было назовите их получено 10 г бензола Определите объем углекислого газа и массу воды, образующихся при полном сгорании пропанола массой 30 грамм. III вариант. 3 уровень (высший) Выведите молекулярную формулу вещества, состоящего из углерода, водорода и кислорода, массовые доли, которых равны 62%, 10,34 % и 27,66 % соответственно. Плотность паров вещества по азоту составляет 4,14. Контрольная работа № 4 «Органические соединения углерода» 1 уровень (средний) Cоставьте уравнения химических реакций по схеме генетической связи: II вариант. 3 уровень (высший) Выведите молекулярную формулу вещества, состоящего из углерода, водорода и кислорода, массовые доли, которых равны 62%, 10,34 % и 27,66 % соответственно. Плотность паров вещества по кислороду составляет 1,81. Контрольная работа № 4 «Органические соединения углерода» 1 уровень (средний) Cоставьте уравнения химических реакций по схеме генетической связи: 9 класс. I вариант. 3 уровень (высший) Выведите молекулярную формулу вещества, состоящего из углерода, водорода и хлора массовые доли, которых равны 37,5%, 6,25% и 56,25% соответственно. Плотность паров вещества по воздуху составляет 4,41. IV вариант. 3 уровень (высший) Выведите молекулярную формулу вещества, состоящего из углерода, водорода и кислорода, массовые доли, которых равны 0,545, 0,08 и 0,375 соответственно. Плотность паров вещества по кислороду составляет 2,75. 9 класс. КР №0-1 «Основные понятия химии» Определите массу, объем и число структурных частиц вещества: 5 моль карбоната калия Напишите три уравнения возможных химических реакций получения соли: сульфата кальция Составьте уравнения по схеме генетической связи: Cu → CuO → CuSO4 → Cu(OH)2 → CuO 4. Cоставьте формулы всех возможных солей, которые могут образоваться при взаимодействии фосфорной кислоты и гидроксида натрия, назовите их 5. Какой объём кислорода и воздуха расходуется на полное окисление 360 г пентана (С5H12) 1. 2. 3. 9 класс. КР №0-2 «Основные понятия химии» 1. 2. 3. Определите массу, объем и число структурных частиц вещества: 3,5 моль фосфата натрия Напишите три уравнения возможных химических реакций получения соли: нитрата натрия Составьте уравнения по схеме генетической связи: Zn→ZnO →ZnSO4 →Zn(OH)2 →Na2[Zn(OH)4] Cоставьте формулы всех возможных солей, которые могут образоваться при взаимодействии серной кислоты и гидроксида магния, назовите их 5. Какой объём кислорода и воздуха расходуется на полное окисление 22 г пропана (С3H8) 4. 9 класс. КР №0-3 «Основные понятия химии» 1. Определите массу, объем и число структурных частиц вещества: 7,5 моль сульфида железа II 2. Напишите три уравнения возможных химических реакций получения соли: хлорида кальция Составьте уравнения по схеме генетической связи: 3. P→ P2O5 → H3PO4 → Ca2(PO4)2 → CaSO4 Cоставьте формулы всех возможных солей, которые могут образоваться при взаимодействии 4. фосфорной кислоты и гидроксида калия, назовите их 5. Какой объём кислорода и воздуха расходуется на полное окисление 300 г этана (С2H6) 9 класс. КР №0-4 «Основные понятия химии» 1. Определите массу, объем и число структурных частиц вещества: 2,5 моль нитрата алюминия 2. Напишите три уравнения возможных химических реакций получения соли: фосфата кальция 3. Составьте уравнения по схеме генетической связи: S → SО2 →SО3→ Н2SО4 → Na2SO4 4. Cоставьте формулы всех возможных солей, которые могут образоваться при взаимодействии серной кислоты и гидроксида кальция, назовите их 5. Какой объём кислорода и воздуха расходуется на полное окисление 336 г бутана (С4H10) 9 класс. КР №0-5 «Основные понятия химии» 1. 2. 3. Определите массу, объем и число структурных частиц вещества: 1,5 моль силиката натрия Напишите три уравнения возможных химических реакций получения соли: сульфита натрия Составьте уравнения по схеме генетической связи: FeS2 →SO2 → SO3 → MgSO4 → BaSO4 Cоставьте формулы всех возможных солей, которые могут образоваться при взаимодействии соляной кислоты и гидроксида алюминия, назовите их 5. Какой объём кислорода и воздуха расходуется на полное окисление 360 г пентана (С5H12) 4. 9 класс. КР №0-6 «Основные понятия химии» 1. 2. 3. Определите массу, объем и число структурных частиц вещества: 0,5 моль нитрата серебра. Напишите три уравнения возможных химических реакций получения соли: нитрата железа II Составьте уравнения по схеме генетической связи: C → CO2 → CaCO3 → CO2 →H2CO3 Cоставьте формулы всех возможных солей, которые могут образоваться при взаимодействии азотной кислоты и гидроксида железа III, назовите их. 5. Какой объём кислорода и воздуха расходуется на полное окисление 22 г пропана (С3H8) 4.






