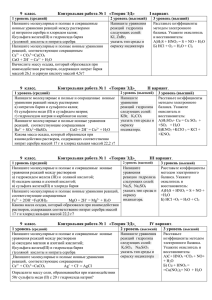
Тематическое планирование по химии в 9 классе. № Название
реклама

Тематическое планирование по химии в 9 классе. № 1 2 3 4 5 6 1 2 3 4 5 Название темы Задания I полугодие Характеристика химического элемента § 1-3 Металлы. Общие свойства. Получение. § 4-6, 8, 9,10 Коррозия металлов. Щелочные металлы. § 11 №1,2 стр.48 Щелочно-земельные металлы. § 12 №3,5 стр.56 Алюминий. § 13 №6 стр.62 Железо. § 14 №5,6 стр.68 II полугодие Неметаллы. Кислород. Водород. Галогены. § 15-20 №3 стр.75, №8 стр.83, №4 стр.86. Сера и её соединения. § 21-22 №1,3 стр.99, №4 стр.107 Азот. Фосфор. § 23-27 №2,4 стр.111, №2,7 стр.121, №2 стр.125 Углерод и его кислородные соединения. § 28-30 №5 стр.134, №7 стр.138, №4 Кремний. стр.144 Органические вещества. § 31-42 №1 стр.155, №4 стр.160, №5 стр.164, №1 стр.172, №3 стр.176, №1 стр.179 Контрольные работы за первое полугодие. Контрольная работа № 1. Тема: «Общая характеристика химических элементов. Периодический закон и периодическая система химических элементов Д.И.Менделеева». Задание 1. Расположите элементы в порядке уменьшения металлических свойств: литий, натрий, калий, рубидий. Выберите металл с наименее выраженными металлическими свойствами, запишите его оксид и гидроксид, укажите их характер и подтвердите уравнениями реакций свойства гидроксида (гидроксид рассмотрите с точки зрения ТЭД) . Задание 2. Определите тип химической связи в веществах: Cl2, PH3 , K2S, Al. Для вещества с ионной связью запишите механизм образования молекулы. Задание 3. Подтвердите уравнениями реакций амфотерность оксида и гидроксида цинка. Задание 4. Запишите уравнения реакций по схеме: S → SO2 → Na2SO3 → SO2 ↓ ↓ H2SO3 Ag2SО3 Задание 5. Задача. При взаимодействии алюминия массой 2,7 г с оксидом железа (II) получили 8 г железа. Рассчитайте массовую долю выхода железа от теоретически возможного. Контрольная работа № 2. Тема: «Металлы». Задание 1. Напишите уравнения реакций лития с кислородом, серой, водой и соляной кислотой. Для первого уравнения напишите электронный баланс, укажите окислитель и восстановитель. Задание 2. Напишите уравнения реакций гидроксида железа (II): а) с раствором серной кислоты, б) с водой и кислородом, в) разложения при нагревании. Для первой реакции приведите уравнение реакции в сокращенном ионном виде. Задание 3. Осуществите превращение: Al AlCl3 Al(OH)3 Al2O3 Задание 4. Предложите способ распознавания растворов хлорида натрия, хлорида бария и хлорида алюминия. Приведите необходимые уравнения реакций, укажите их признаки. Задание 5. Задача. Определите массу железа, которая может быть получена из 8 кг оксида железа (III), если выход реакции составляет 85% от теоретически возможного.