Документ 4529867
реклама

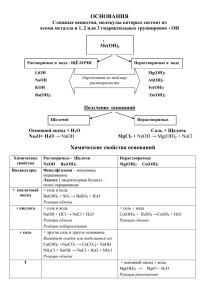
Тема: «Обобщение, систематизация и коррекция знаний по теме «Основные классы неорганических соединений» Цель : Обобщить знания об основных классах неорганических соединений; Закрепить знания о причинах многообразия веществ, о составе, химических свойствах и классификации неорганических соединений. Выявляя взаимосвязь веществ разных классов, умения составлять генетический ряд химического элемента, прогнозируя свойства входящего в него соединения; Активизировать познавательную деятельность учащихся на уроке. Оборудование: на столах учащихся : пробирки 1,2 с кислотой и основанием, стакан с I водой, сухие пробирки, дольки лимона и яблока, индикаторы, стеклянная палочка . на демонстрационном столе: NaOH, HСI, индикатор – фенолфталеин, лакмус, фарфоровая чашка, спиртовка, спички, штатив. Таблицы «Кислоты и названия их солей» ХОД УРОКА: I. Орг. момент II. Проверка домашнего задания индивидуально по карточкам - 3 человека; у доски - 2 человека; фронтальный опрос III. Перечислите классы неорганических веществ, которые мы знаем Задание№1 заполните таблицу, в соответствующие графы впишите формулы следующих соединений: HCl, MgCI2 , КОН, MgO, НN03, NaOH, H2SO4, AI2SO4, H3PO4, K2O,S0з, Fe(OH)2, С02, КНСОз, H2O. Оксиды Основания Кислоты Соли MgO основные KOH растворимые HCI-бескислород. MgCI2 средние K2O NaOH HNO3-одноосн., кислород. AI2SO4 SO3 кислотные Fe(OH)2-нерастворимые H2SO4-двухосновн.,кислор. KHCO3- кислые CO2 H3PO4 трёхосновн., кислор. H2O амфотерные (Ученик заполняет на доске, остальные в тетрадях. IV. Учитель Ученик - Оксиды бывают? Получение -основные, кислотные 4Na + 02 = 2Na20; 2S + 02 = 2S02 -Взаимодействует ли основной -Да Na20 + S0з = Na2S04 оксид с кислотным? Подтвердите. осн. -Основной с основным -Кислотный с кислотным В нашей таблице есть ещё один оксид. - H2O Взаимодействует с к.о.? + кислотн. = соль -Нет Na20 + MgO =/= S02 + CO2 =/= - Да H2O+ S0з = H2SO4 вывод: Взаимодействует с о.о.? -Такие вещества называются амфотерными Итак, из кислотных оксидов образуются кислоты. Какие они бывают? Из основных оксидов основания. Какие они бывают? Почему? - В быту, на улице, в доме встречаемся ли мы с кислотами и основаниями - Как определить и распознать кислоту и основания? Докажите на опыте, используя то, что есть на столе. (Л/о) Техника безопасности - На демонстрационном столе стоит кислота HCl и основание NaOH. Как из них получить соль? Проведите этот опыт. (Л/о) - Какие соли вы знаете? Придумайте формулы кислых солей и про верьте друг друга. -Да H2O+ Na20= NaOH вывод: -бескислородные, кислородосодержащие, одноосновные, многоосновные: двухосновные, трехосновные. - растворимыe щелочи : элементы I и II(Ca, Sr, Ba)группы H2O+ Na20= NaOH -нерастворимые все остальные FeО + H2O=/= - Да (фрукты, кислое молоко, кислотные дожди, мыло, порошок и др.) - индикатором - пробирки 1,2, раствор мыла, лимон. Рассказ о кислотных дождях. (сообщение ученика) - реакцией нейтрализации NaOH + HCl = 2NaCl + H2O + фенолфталеин (Малиновая окраска) выпаривание Средние, кислые. V. Мы рассмотрели все классы неорганических соединений. А существует ли между ними взаимосвязь и как она выражается? - (ответ учащихся) Для элементов P и Mg покажите переход превращений от одного класса к другому с помощью формул. Mg MgO MgCI2 Mg(OH)2 P P2O5 H3PO4 Mg3(PO4)2 VI. А теперь друг другу задайте пару элементов для вещественных превращений это задание на дом, а также параграф 27 (2.5.) Оценки за урок. Молодцы!