Общая и неорганическая химия дополнительная
реклама
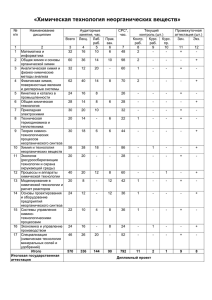
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ТОМСКИЙ ПОЛИТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ» «УТВЕРЖДАЮ» Проректор по ОМД А.И. Чучалин ______________________ «_____» _________ 20__ г. УЧЕБНЫЙ ПЛАН по дополнительной образовательной программе Летней школы «Общая и неорганическая химия» Цели обучения: 1. Знания и умения в области химии, достаточные для изучения общенаучных и специальных дисциплин, а также для решения профессиональных задач. 2. Готовность студентов воспринимать химическую терминологию, законы и закономерности протекания химических процессов. Соответствует квалификационным требованиям направлений 240100 – Химическая технология 241000 – Энерго- и ресурсосберегающие процессы в химической технологии, нефтехимии и биотехнологии 240700 – Биотехнология 240601 - Химическая технология материалов современной энергетики Категория слушателей - студенты первого курса испытывающих трудности в освоении курса «Общая и неорганическая химия» по ООП. Форма обучения – очная Срок обучения - 32 часа Режим занятий - 2-4 часа в день № Наименование разделов дисциплины 1. 2. Классификация неорганических соединений Строение вещества Закономерности протекания химических реакций Электрохимические процессы Растворы Свойства неорганических соединений Итоговый контроль 3. 4. 5. 6. в том числе Всего часов 2 6 4 4 6 8 2 ЛК 1 3 1,5 1 2 3 ЛБ Форма контроля ПР 1 3 2,5 3 4 5 Тест Тест Тест Тест Тест Тест Тест Итого 32 11 И.о. директора ИДНО Л.А. Баринова Проректор-директор ИФВТ А.Н. Яковлев Зав. кафедрой ОНХ А.П. Ильин 19 МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ТОМСКИЙ ПОЛИТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ» «УТВЕРЖДАЮ» Проректор по ОМД А.И. Чучалин ______________________ «_____» _________ 20__ г. Учебно-тематический план по дополнительной образовательной программе Летней школы «Общая и неорганическая химия» Цели обучения: 1. Знания и умения в области химии, достаточные для изучения общенаучных и специальных дисциплин, а также для решения профессиональных задач. 2. Готовность студентов воспринимать химическую терминологию, законы и закономерности протекания химических процессов. Соответствует квалификационным требованиям направлений 240100 – Химическая технология 241000 – Энерго- и ресурсосберегающие процессы в химической технологии, нефтехимии и биотехнологии 240700 – Биотехнология 240601 - Химическая технология материалов современной энергетики Категория слушателей - студенты первого курса химических направлений, испытывающих трудности в освоении курса «Общая и неорганическая химия» по ООП. Форма обучения - без отрыва от работы Срок обучения - 32 часа Режим занятий - 2-4 часа в день № Наименование разделов дисциплины и тем в том числе Всего часов ЛК 1. 1.1. 2. 2.1. 2.2. 2.3. 3. Классификация неорганических соединений Классификация, свойства и номенклатура неорганических соединений Строение вещества Строение атома, периодичность свойств элементов, простых и сложных веществ Химическая связь и строение молекул Комплексные соединения Закономерности протекания химических реакций ЛБ Форма контроля ПР 2 1 1 Тест 2 1 1 Тест 2 2 1 1 1 1 Тест Тест 2 6 4 3.1. 3.2. 3.3. 4. 4.1. 4.2. 4.3. 5. 5.1. 5.2. 5.3. 7. 7.1. 7.2. 7.3 2.2. Химическая термодинамика Химическая кинетика Равновесие Электрохимические процессы Окислительно-восстановительные реакции, метод полуреакций Направление протекания ОВР Электролиз растворов и расплавов веществ Растворы Способы выражения концентрации растворов Гидролиз (солей, солеподобных соединений, гидридов, соединений металлов в высоких степенях окисления) Произведение растворимости. Ионные реакции. Свойства неорганических соединений Взаимодействие простых веществ с водой, кислотами и щелочами. Кислотно-основные взаимодействия Окислительно-восстановительные взаимодействия Расчетные методы в неорганической химии Итоговый контроль Итого 2 1,5 0,5 4 1 0,5 1 1 0,5 Тест 1,5 Тест 0,5 1 Тест 2 Тест Тест Тест 2 6 2 1 2 1 1 Тест 2 8 0,5 1,5 Тест 2 1 1 2 1 1 2 1 1 2 2 32 2 11 И.о. директора ИДНО Л.А. Баринова Зав. кафедрой ОНХ А.П. Ильин 19 Тест Тест Тест Тест Тест УТВЕРЖДАЮ Проректор-директор ИФВТ _____________ А.Н. Яковлев «_____»_______________ 2012 РАБОЧАЯ ПРОГРАММА ДИСЦИПЛИНЫ Общая и неорганическая химия дополнительная образовательная программа Летней школы Соответствует квалификационным требованиям направлений 240100 – Химическая технология 241000 – Энерго- и ресурсосберегающие процессы в химической технологии, нефтехимии и биотехнологии 240700 – Биотехнология 240601 - Химическая технология материалов современной энергетики Категория слушателей - студенты первого курса испытывающих трудности в освоении курса «Общая и неорганическая химия» по ООП. НАПРАВЛЕНИЯ ПОДГОТОВКИ ООП 240100 – Химическая технология 241000 – Энерго- и ресурсосберегающие процессы в химической технологии, нефтехимии и биотехнологии 240700 – Биотехнология 240601 - Химическая технология материалов современной энергетики Вид учебной деятельности и временной ресурс: Семестр Летний Лекции 11 часов Лабораторные занятия нет Практические занятия 19 часов АУДИТОРНЫЕ ЗАНЯТИЯ 32 часа САМОСТОЯТЕЛЬНАЯ РАБОТА нет ИТОГО 32 часа ФОРМА ОБУЧЕНИЯ очная ВИД ПРОМЕЖУТОЧНОЙ АТТЕСТАЦИИ зачет (2 часа) ОБЕСПЕЧИВАЮЩЕЕ ПОДРАЗДЕЛЕНИЕ кафедра общей и неорганической химии ЗАВЕДУЮЩИЙ КАФЕДРОЙ_____________ А.П. Ильин 2012 г. 1. ЦЕЛИ ОБУЧЕНИЯ 3. 4. Знания и умения в области химии, достаточные для изучения общенаучных и специальных дисциплин, а также для решения профессиональных задач. Готовность студентов воспринимать химическую терминологию, законы и закономерности протекания химических процессов. 2. РЕЗУЛЬТАТЫ ОБУЧЕНИЯ По окончании изучения дисциплины «Общая и неорганическая химия» в летней школе студент будет: знать: - классификацию неорганических соединений; - электронное строение атомов; - основные типы химической связи и строение молекул; - строение и свойства координационных соединений; - основные закономерности протекания химических процессов; - химические свойства простых и сложных соединений; уметь: - связывать свойства веществ с электронным строением атомов; - определять термодинамические характеристики химических реакций; - определять возможность и направление протекания химических реакций; - производить количественные расчеты. владеть: - навыками систематизации свойств химических соединений. 3. СТРУКТУРА И СОДЕРЖАНИЕ ДИСЦИПЛИНЫ Раздел 1. Классификация неорганических соединений (2 часа) Простые вещества: металлы и неметаллы. Положение металлов и неметаллов в периодической системе. Изменение металлических свойств по периодам и группам. Оксиды. Классификация и номенклатура оксидов, способы их получения, химические свойства. Гидроксиды: кислотные, основные, амфотерные. Номенклатура, графические формулы, химические свойства. Изменение кислотно-основных свойств гидроксидов по периодам и группам. Соли: кислые, средние, основные. Раздел 2. Строение вещества (6 часов) 2.1. Строение атома, периодичность свойств элементов, простых и сложных веществ. (2 часа) Квантовые числа. Атомные орбитали, энергетические уровни и подуровни, основные принципы их заполнения: принцип наименьшей энергии, принцип Паули, правило Гунда. Электронные формулы атомов, валентные электроны. Явление «провала» электрона. Валентные возможности атомов. Связь электронного строения атома с его положением в периодической системе. Свойства атомов, периодически изменяющиеся в зависимости от атомного номера: радиусы атомов и ионов, энергия ионизации, сродство к электрону, электроотрицательность. 2.2.Химическая связь и строение молекул. (2 часа) Типы связей и влияние характера химической связи на химические свойства веществ. Энергия связи, длина связи. Ковалентная связь. Обменный и донорно-акцепторный механизмы образования ковалентной связи. Теория гибридизации и пространственная структура молекул. Метод молекулярных орбиталей (МО). Связывающие и разрыхляющие МО, последовательность их заполнения электронами. Объяснение свойств молекул методом МО. 2.3.Комплексные соединения. (2 часа) Строение комплексных соединений (КС), классификация и номенклатура КС. Поведение комплексных соединений в растворах, константы нестойкости КС. Рассмотрение химической связи в КС с точки метода валентных связей, теории кристаллического поля (ТКП). Объяснение на их основе координационных чисел комплексообразователей, формы, окраски и магнитных свойств комплексных соединений. Раздел 3. Закономерности протекания химических реакций (4 часа) 3.1. Химическая термодинамика. (2 часа) Энтальпия образования вещества и химической реакции. Закон Гесса и его следствия, термохимические расчёты. Энтропия. Закономерности изменения энтропии. Энергия Гиббса. Направление протекания химических реакций. 3.2. Химическая кинетика. (1,5 часа) Скорость химической реакции. Закон действия масс для скоростей простых и сложных реакций. Кинетические уравнения, порядок реакции и порядок по веществу. Константа скорости химической реакции. Энергия активации. Уравнение Аррениуса, методы расчета энергии активации. 3.3 Химическое равновесие. (0,5 часа) Обратимые и необратимые химические реакции. Закон действия масс для равновесия. Константа равновесия, ее связь с энергией Гиббса. Принцип Ле Шателье. Раздел 4. Электрохимические процессы (4 часа) 4.1. Окислительно-восстановительные реакции. (2 часа) Понятия: окислитель и восстановитель. Классификация ОВР. Метод полуреакций как способ уравнивания ОВР. Стандартные окислительно-восстановительные потенциалы, направление протекания ОВР. 4.2. Электролиз растворов и расплавов веществ. (2 часа) Порядок разрядки ионов на электродах. Электролиз с растворимым анодом. Количественные закономерности электролиза (законы Фарадея). Применение электролиза. Раздел 5. Растворы (6 часов) 5.1. Способы выражения концентрации растворов. (2 часа) Массовая доля растворённого вещества, молярная концентрация, молярная концентрация эквивалентов, титр, моляльность, молярные доли. Перерасчёт одного способа выражения концентрации в другой. 5.2. Гидролиз. (2 часа) Гидролиз солей, водородный показатель. Гидролиз солеподобных соединений, гидридов, металлов в высоких степенях окисления. 5.3. Произведение растворимости. Ионные реакции. (2часа) Теория электролитической диссоциации. Произведение растворимости малорастворимых электролитов. Ионные реакции. Раздел 6. Свойства неорганических соединений (8 часов) 6.1. Взаимодействие простых веществ с водой, кислотами и щелочами. (2 часа) Закономерности взаимодействия неметаллов (галогенов, халькогенов, пниктогенов) с водой, щелочами и кислотами (серной и азотной концентрированных). Закономерности взаимодействия металлов с водой, щелочами и кислотами (соляной, серной, азотной). 6.2. Кислотно-основные взаимодействия. (2 часа) Кислоты и основания Бренстеда-Лоури и Льюиса. Закономерности кислотно-основных взаимодействия бинарных и трехэлементных соединений. Закономерности изменения силы, устойчивости, окислительных свойств кислот кислородсодержащих и бескилорордных. 6.3. Окислительно-восстановительные взаимодействия. (2 часа) Закономерности окислительно-восстановительных взаимодействия простых, бинарных и трехэлементных соединений. Возможные, характерные и устойчивые степени окисления элементов. Связь положения элемента в Периодической системе, его характерных степеней окисления и продуктами окислительно-восстановительных взаимодействий. 6.4. Расчетные методы в неорганической химии. (2 часа) Стехиометрические расчеты по уравнениям реакций: Вычисление массы (объема) продукта реакции по известной массе (объему) одного из вступивших в реакцию веществ. Вычисление массы (объема) продукта реакции по известной массе (объему) исходного вещества, содержащего определенную долю примесей. Вычисление массы (объема), вступившего в реакцию вещества или полученного по реакции с раствором другого вещества с известной концентрацией. 4. ТЕХНОЛОГИИИ ОБУЧЕНИЯ Для изучения дисциплины «Общая и неорганическая химия» в Летней школе используются лекционно-практические занятия, во время которых преподаватель, опираясь на знания, полученные студентом во время основного обучения, излагает минимально необходимые теоретические сведения, и делает упор на решение практических задач и упражнений. Во время занятий студенты и преподаватель находятся в постоянном общении: преподаватель, являясь источником информации, постоянно контролирует качество её усвоения; студент, задавая вопросы, регулируя темп изложения, воспринимает информацию. Образовательные технологии, применяемые при освоении дисциплины ОНХ Вид ОД Метод акт. ОД IT -методы Работа в команде Проблемное обучение Контекстное обучение Обучение на основе опыта Индивидуальное обучение Междисциплинарное обучение Опережающая самостоятельная работа Лекция Практическое занятие + + + + + + + + + 5. СРЕДСТВА ТЕКУЩЕЙ И ИТОГОВОЙ ОЦЕНКИ КАЧЕСТВА ОСВОЕНИЯ ДИСЦИПЛИНЫ Для оценки знаний и умений студентов используется следующие виды контролей: 1. Текущий контроль знаний студентов, который осуществляется на практических занятиях; 2. Итоговый контроль. Общий рейтинг - 60 баллов: более 33 баллов зачтено 6. КОНТРОЛЬ РЕЗУЛЬТАТОВ ОБУЧЕНИЯ Контролирующие промежуточные знания, полученные студентами, материалы представлены тестами, содержащими 3-5 вопросов. Тестирование студентов проводится, по усмотрению преподавателя, либо в конце занятия, либо в начале следующего. За каждое промежуточное тестирование студент максимально может получить 3 балла. Итоговое тестирование проводится в конце летнего семестра. В состав билета включены вопросы, отражающие минимально необходимый уровень знаний студентов по предмету. 7. РЕЙТИНГ КАЧЕСТВА ОСВОЕНИЯ ДИСЦИПЛИНЫ. В соответствии с рейтинговой системой текущий контроль знаний студентов производится ежедневно в течение летнего семестра путем балльной оценки качества усвоения материала. Промежуточная аттестация (зачет) производится в конце работы Летней школы во время итогового тестирования. Итоговый рейтинг определяется суммированием баллов текущей оценки в течение семестра и баллов промежуточной аттестации. Максимальный итоговый рейтинг соответствует 60 баллам. Рейтинг-план дисциплины приводится в приложении. 8. УЧЕБНО-МЕТОДИЧЕСКОЕ И ИНФОРМАЦИОННОЕ ОБЕСПЕЧЕНИЕ ДИСЦИПЛИНЫ Для обеспечения дисциплины «Химия» разработаны: «Программа», «Учебный план», «Рейтинг-план», а также контролирующие материалы. На сайте библиотеки ТПУ представлены все учебно-методические материалы кафедры ОНХ, лекции по общей и неорганической химии, лабораторный практикум по общей и неорганической химии, индивидуальные домашние задачи, вопросы для самоподготовки к лабораторным и практическим занятиям и т.д. а) основная литература: 1. Угай Я.А. Общая и неорганическая химия. - М.: Высшая школа, 2007.- 526 с. 2. Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. - М.: Химия, 2006.- 632 с. 3. Ахметов Н.С. Общая и неорганическая химия.- М.: Высшая школа, 2005. – 679 с. 4. Степин Б.Д., Цветков А.А. Неорганическая химия.- М.: Высшая школа, 2005. – 607 с. 5. Стась Н. Ф. Справочник по общей и неорганической химии. Томск: ТПУ. - 2011. - 83 с. б) дополнительная литература: 1. Стась Н.Ф. Общая и неорганическая химия. Часть II. Неорганическая химия. – Томск: ТПУ, 2009. – 160 с. 2. Савельев Г.Г., Смолова Л.М. Общая и неорганическая химия. Ч. 1 Общая химия. – Томск: ТПУ, 2006. – 228 с. 3. Стась Н.Ф., Коршунов А.В. Решение задач по общей химии. – Томск: ТПУ, 2009. – 170 с. в) программное обеспечение и Internet-ресурсы: Материалы, размещенные на сайте кафедры общей и неорганической химии: http://portal.tpu.ru/departments/kafedra/onh Материалы, размещенные на сайте научной библиотеки: http://www.lib.tpu.ru/cgi-bin/zgate Материалы индивидуальных сайтов преподавателей http://portal.tpu.ru/SHARED/k/KNYAZEVA http://portal.tpu.ru/SHARED/v/VORONOVA http://portal.tpu.ru/SHARED/s/STANIF Программа составлена на основе Стандарта ООП в соответствии с требованиями ФГОС ВПО по направлениям: 240100 – Химическая технология, 241000 – Энерго- и ресурсосберегающие процессы в химической технологии, нефтехимии и биотехнологии, 240700 – Биотехнология, 240501 – Химическая технология материалов современной энергетики. Программа одобрена на заседании кафедры ОНХ Протокол № от «» мая 2012 г. Автор ______________ Е.М. Князева ДЕМОВЕРСИИ ЗАДАНИЙ ТЕКУЩЕГО КОНТРОЛЯ Контроль знаний студентов по теме «Классификация, свойства и номенклатура неорганических соединений» Вариант 1 № 1 2 3 4 5 6 Вопрос Формула высшего гидроксида хлора имеет вид Число металлов в ряду Br, Cu, Co, I, Sr равно Число оксидов в ряду соединений Cl2O, KMnO4, SO3, NH3, CuSO4, K2Cr2O7, NH4NO3, KO2, HF, O2F2, BaO2 равно NH4NO3 и K2Cr2O7, соответственно, называются Формула соединения, образующегося взаимодействии Ga + O2 = вид Формула соединения, образующегося взаимодействии Cl2O + NaOH = вид Критерии оценивания: ≥ 2 баллов < 2 баллов Ответ Макс. балл 0,5 0,5 0,5 0,5 при имеет 0,5 при имеет 0,5 «Зачтено» «Незачтено» Контроль знаний студентов по теме «Классификация, свойства и номенклатура неорганических соединений» Вариант 2 № 1 2 3 4 5 6 Вопрос Формула высшего оксида селена имеет вид Число неметаллов в ряду Br, Cu, Co, I, Sr равно Число солей в ряду соединений Cl2O, KMnO4, SO3, NH3, CuSO4, K2Cr2O7, NH4NO3, KO2, HF, O2F2, BaO2 равно KMnO4 и K2SO3, соответственно, называются Формула соединения, образующегося взаимодействии Ge + O2 = вид Формула соединения, образующегося взаимодействии Cl2O7 + NaOH имеет вид Критерии оценивания: ≥ 2 баллов < 2 баллов Ответ Макс. балл 0,5 0,5 0,5 0,5 при имеет 0,5 при = 0,5 «Зачтено» «Незачтено» Контроль знаний студентов по теме «Классификация, свойства и номенклатура неорганических соединений» Вариант 3 № 1 2 3 4 5 6 Вопрос Формула высшего оксида мышьяка имеет вид Число металлов в ряду Bа, S, Cd, I, Se равно Число кислот в ряду соединений HClO, KMnO4, SO3, HNO2, CuSO4, K2Cr2O7, HIO3, KO2, HF, O2F2, BaO равно K2CrO4 и K2SeO4, соответственно, называются Формула соединения, образующегося взаимодействии Ge + O2 = вид Формула соединения, образующегося взаимодействии I2O5 + NaOH = вид Ответ Макс. балл 0,5 0,5 0,5 0,5 при имеет 0,5 при имеет 0,5 Критерии оценивания: ≥ 2 баллов < 2 баллов «Зачтено» «Незачтено» Контроль знаний студентов по теме «Строение атома и периодичность свойств элементов» Вариант 1 № 1 2 3 4 5 6 Вопрос Полную электронную формулу 1s22s22p63s23p64s23d104p1 имеет атом Краткую электронную формулу [Ar] 4s24d7 имеет атом Пять атомных орбиталей находится на подуровне 1) s 2) p 3) d 4) f Число неспаренных электронов в атоме брома равно Общая формула высших оксидов химических элементов, валентные электроны которых имеют конфигурацию ns 2np3, имеет вид 1) ЭО2 2) Э2О5 3) ЭО3 4) Э2О3 Энергия ионизации атомов увеличивается в ряду 1) P, S, Cl 2) S, Se, Te 3) Te, Se, S 4) As, Se, Br Критерии оценивания: ≥ 2 баллов < 2 баллов Ответ Макс. балл 0,5 0,5 0,5 0,5 0,5 0,5 «Зачтено» «Незачтено» Контроль знаний студентов по теме «Строение атома и периодичность свойств элементов» Вариант 2 № 1 2 3 4 5 6 Вопрос Полную электронную формулу 1s22s22p63s23p64s23d3 имеет атом Краткую электронную формулу [Kr] 5s24d5 имеет атом Три атомных орбиталей находится на подуровне 1) s 2) p 3) d 4) f Число неспаренных электронов в атоме селена равно Общая формула высших оксидов химических элементов, валентные электроны которых имеют конфигурацию ns 2np3, имеет вид 1) ЭО2 2) Э2О5 3) ЭО3 4) Э2О3 Радиус атомов увеличивается в ряду 1) P, S, Cl 2) S, Se, Te 3) Te, Se, S 4) As, Se, Br Критерии оценивания: ≥ 2 баллов < 2 баллов Ответ Макс. балл 0,5 0,5 0,5 0,5 0,5 0,5 «Зачтено» «Незачтено» Контроль знаний студентов по теме «Строение атома и периодичность свойств элементов» Вариант 3 № 1 2 3 4 5 Вопрос Полную электронную формулу 1s22s22p63s23p64s23d8 имеет атом Краткую электронную формулу [Kr] 5s24d5 имеет атом Семь атомных орбиталей находится на подуровне 1) s 2) p 3) d 4) f Число неспаренных электронов в атоме сурьмы равно Общая формула высших оксидов химических элементов, валентные электроны которых имеют конфигурацию ns 2np2, имеет вид 1) ЭО2 2) Э2О5 3) ЭО3 4) Э2О3 Ответ Макс. балл 0,5 0,5 0,5 0,5 0,5 6 Электроотрицательность атомов увеличивается в ряду 1) P, S, Cl 2) S, Se, Te 3) Al, Ga, In 4) As, Gee, Ga Критерии оценивания: ≥ 2 баллов < 2 баллов 0,5 «Зачтено» «Незачтено» Контроль знаний студентов по теме «Химическая связь и строение молекул» Вариант 1 № 1 2 3 4 Вопрос Число соединений с ионным типом связи H2, H2O, СsI, Cl2, NO, HF, KF, K, CO2, LiCl равно Водородные связи образуются между молекулами H2, H2O, HCl, NO, N2H4 Кратность связи в молекуле N2 равна Тип гибридизации АО центрального атома в молекуле ClF5 Критерии оценивания: ≥ 2 баллов < 2 баллов Ответ Макс. балл 0,5 0,5 0,5 1,5 «Зачтено» «Незачтено» Контроль знаний студентов по теме «Химическая связь и строение молекул» Вариант 2 № 1 2 3 4 Вопрос Число соединений с ковалентным типом связи H2, H2O, СsI, Cl2, NO, HF, KF, K, CO2, LiCl равно Водородные связи образуются между молекулами O2, HBr, NO, N2H5OH, HF Кратность связи в молекуле O2 равна Тип гибридизации АО центрального атома в молекуле ClF3 Критерии оценивания: ≥ 2 баллов < 2 баллов Ответ Макс. балл 0,5 0,5 0,5 1,5 «Зачтено» «Незачтено» Контроль знаний студентов по теме «Химическая связь и строение молекул» Вариант3 № 1 2 3 4 Вопрос Число соединений с ионным типом связи H2, Na2O, СsCl, O2, CO, HF, KI, W, NO2, NaBr равно Водородные связи образуются между молекулами F2, H2O2, HF, CN, NH3 Кратность связи в молекуле S2 равна Тип гибридизации АО центрального атома в молекуле XeF4 Критерии оценивания: ≥ 2 баллов < 2 баллов «Зачтено» «Незачтено» Ответ Макс. балл 0,5 0,5 0,5 1,5 Контроль знаний студентов по теме «Комплексные соединения» № 1 2 3 4 Вопрос Степень окисления комплексообразователя в соединении К2[PtCl6] равна Лигандами в комплексе [PtCl6]2- являются Тип гибридизации орбиталей центрального атома в комплексе [PtCl6]2Комплексное соединение К2[PtCl6] является 1) диамагитным, окрашенным 2) парамагнитным, окрашенным 3) парамагнитным, неокрашенным 4) диамагнитным, неокрашенным Критерии оценивания: ≥ 2 баллов < 2 баллов Ответ Макс. балл 0,5 0,5 1 1 «Зачтено» «Незачтено» Контроль знаний студентов по теме «Химическое равновесие» Вариант 1 № 1 Вопрос Для обратимой реакции С(к) + CO2 2CO; Но = 172 кДж Выражение константы равновесия имеет вид 2 2 Увеличение температуры смещает равновесие Увеличение давления смещает равновесие Критерии оценивания: ≥ 2 баллов < 2 баллов Ответ Макс. балл 1 1 1 «Зачтено» «Незачтено» Контроль знаний студентов по теме «Основы термодинамики» Вариант 1 № 1 Вопрос Для обратимой реакции С(к) + CO2 2CO; Но = 172 кДж Выражение константы равновесия имеет вид 2 2 Увеличение температуры смещает равновесие Увеличение давления смещает равновесие Критерии оценивания: ≥ 2 баллов < 2 баллов «Зачтено» «Незачтено» Ответ Макс. балл 1 1 1 Контроль знаний студентов по теме «Электролиз» Вариант 1 № 1 2 3 Вопрос При электролизе водного раствора ZnSO4 на катоде протекает процесс на аноде протекает процесс масса металла, выделившегося на катоде за 2 часа при силе тока 5А и ƞ = 80% равна Критерии оценивания: ≥ 2 баллов < 2 баллов Ответ Макс. балл «Зачтено» «Незачтено» Контроль знаний студентов по теме «Способы выражения концентрации растворов» Вариант 1 № 1 1 2 Вопрос Масса вещества, содержащаяся в 2 л децимолярного раствора серной кислоты, равна Молярная концентрация 0,3 н раствора ортофосфорной кислоты равна Объем водорода, выделившегося при взаимодействии цинка с 500 мл 20% раствора соляной кислоты (ρ = 1,13 г/мл), равен Критерии оценивания: ≥ 2 баллов < 2 баллов «Зачтено» «Незачтено» Ответ Макс. балл 1 1 1 Итоговое тестирование по ОНХ 1. Установите соответствие А) Б) В) Г) фoрмула вещества NH4NO3 N2H4 HN3 NH2OH 1) 2) 3) 4) 5) 6) Название вещества гидразин аммиак нитрат аммония азотистоводородная кислота нитрит аммония гидроксиламин (1 балл) 2. Общая электронная формула (n-1)d ns относится к атомам 1) Mn, Tс, Re 2) Ti, Zr, Hf 3) V, Nb, Ta 4) Cr, Mo, W (1 балл) 3. Для молекулы IF5 характерно: 1) sp3d2 тип гибридизация атомных орбиталей йода 2) октаэдрическая форма молекулы 3) наличие π-связей 4) валентный угол равный 90о 5) наличие несвязывающих электронных пар 6) наличие ковалентных неполярных связей (1 балл) 4. Низкоспиновые, тетраэдрические, неокрашенные комплексы образует 1) хром 2) кобальт 3) цинк 4) марганец (1 балл) 5. Основные свойства наиболее выражены у оксида 1) Fe2O3 2) FeO 3) Cr2O3 (1 балл) 5 2 4) CrO3 6. Все металлы ряда взаимодействуют с соляной кислотой 1) Al, Zn, Fe 2) Ca, Cd, Cu 3) Ge, Sn, Pb 4) Cu, Ag, Au (1 балл) 7. Оксид железа (II) реагирует с каждым из двух веществ 1) водой и соляной кислотой 2) серной кислотой и водородом 3) медью и гидроксидом натрия 4) фосфорной кислотой и гидроксидом меди (II) (1 балл) 8. Продукт взаимодействия гидроксида натрия с оксидом хлора (I) 1) NaClO3 2) NaClO2 3) NaClO (1 балл) 4) NaClO4 9. Установите последовательность расположения кислот по увеличению силы 1) HClO3 2) HClO 3) HClO4 4) HClO2 (1 балл) 10. Формула пропущенного продукта взаимодействия KIO3 + KI + H2SO4 ______ + K2SO4 + H2O (1 балл) 11. В схеме превращений соединений железа: Fe формула вещества «Х3» _____________. NaOH 2О2 HCl X1 X2 H Х3 (2 балла) 12. Изменение энергии Гиббса реакции при 500 К ΔfН⁰, кДж/моль So, Дж/мольК ZnO(к) -350,6 43,6 + C(графит) 5,7 = Zn(к) 41,6 + CO(г) -110,5 197,5 имеет значение __________ кДж. (Запишите число с точностью до целых) (2 балла) 13. Масса гидроксида калия, необходимая для нейтрализации 100 мл 0,5 М раствора азотной кислоты, равна ____________ г. (Запишите число с точностью до десятых) (2 балла) 14. Закончите уравнение реакции, уравняйте методом полуреакций: K2Cr2O7 + H2О2 + H2SO4 Коэффициент перед окислителем равен ___. Итого: 18 баллов (2 балла) РЕЙТИНГ-ЛИСТ ДИСЦИПЛИНЫ «Общая и неорганическая химия» УТВЕРЖДАЮ Зав.кафедрой____ОНХ____ ______Ильин А.П.________ “ ____” ___06___________ 2012 г. Дисциплина Общая и неорганическая химия Вид учебной работы Число недель 2 Кафедра ОНХ Факультет ИФВТ Летний семестр 2011 /12 уч.г. Преподаватель: к.х.н., доцент Князева Елена Михайловна Лекции Практические (семинарские) занятия Лабораторные работы Аудиторные занятия 11 19 нет Самостоятельная работа нет нет нет 2 32 0 Итоговый контроль Общая трудоемкость № п/п Дни недели Лекции (тема) Часы Часы Практические (семинарские) занятия, (тема) А 1 1 2 1 3 4 2 3 Классификация, свойства и номенклатура неорганических соединений Строение атома, периодичность свойств элементов, простых и сложных веществ Химическая связь и строение молекул Комплексные соединения 5 3 Химическая термодинамика 6 4 Химическая кинетика. Равновесие 7 5 8 5 Окислительно-восстановительные реакции, метод полуреакций. Направление протекания ОВР Электролиз растворов и расплавов веществ 9 6 Способы выражения концентрации растворов 10 7 Гидролиз (солей, солеподобных соединений, гидридов, соединений металлов в высоких степенях окисления) 11 7 Произведение растворимости. Ионные реакции. 12 8 13 9 Взаимодействие простых веществ с водой, кислотами и щелочами. Кислотно-основные взаимодействия Рейтинг (балл) А 1 3 1 3 1 1 Классификация, свойства и номенклатура неорганических соединений Строение атома, периодичность свойств элементов, простых и сложных веществ Химическая связь и строение молекул Комплексные соединения 1 1 3 3 1 Химическая термодинамика 1 3 1,5 3 2 3 1 3 1 1 0,5 1 Химическая кинетика Равновесие Окислительно-восстановительные реакции, полуреакций. Направление протекания ОВР Электролиз растворов и расплавов веществ метод Способы выражения концентрации растворов 1 0,5 1 1 Гидролиз (солей, солеподобных соединений, гидридов, соединений металлов в высоких степенях окисления) Произведение растворимости. Ионные реакции. Взаимодействие простых веществ с водой, кислотами и щелочами. Кислотно-основные взаимодействия 2 3 3 1 1,5 1 1 3 3 3 14 9 Окислительно-восстановительные взаимодействия 15 10 Расчетные методы в неорганической химии 16 10 Итоговый контроль 1 Окислительно-восстановительные взаимодействия 1 3 2 2 ИТОГО 18 32 часа 60 РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА ПО КУРСУ № п/п Основная № п/п 1 2 3 4 5 Угай Я.А. Общая и неорганическая химия. - М.: Высшая школа,2007.- 526 с. Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. - М.: Химия, 2006.- 632 с. Ахметов Н.С. Общая и неорганическая химия.- М.: Высшая школа, 2005. - 679с. Степин Б.Д., Цветков А.А. Неорганическая химия.- М.: Высшая школа, 2005. Стась Н. Ф. Справочник по общей и неорганической химии. – Томск: ТПУ.– 2006 - 2011. - 73 с. 6 7 Стась Н.Ф., Коршунов А.В. Решение задач по общей химии. – Томск: ТПУ, 2009. – 170 с. Стась Н.Ф. Общая и неорганическая химия. Часть II. Неорганическая химия. – Томск: ТПУ, 2003. – 160 с. Савельев Г.Г., Смолова Л.М. Общая и неорганическая химия. Ч. 1 Общая химия. – Томск: ТПУ, 2006. – 228 с 1. 2. 3. 4. 6. Электронные образовательные ресурсы http://www.lib.tpu.ru/cgi-bin/zgate http://portal.tpu.ru/departments/kafedra/onh http://portal.tpu.ru/SHARED/k/KNYAZEVA http://portal.tpu.ru/SHARED/v/VORONOVA Лекции по химии в Power Point Дополнительная 8 Подпись лектора, составившего УМ карту Князева Е.М. «_____» _____06_______ 2012 г.