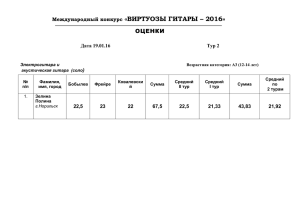
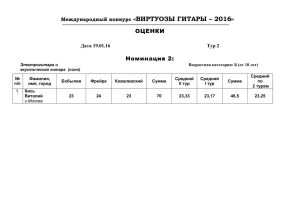
«Клуб веселых и находчивых химиков» Эльвира Цель: Задачи.
реклама

«Клуб веселых и находчивых химиков» (Интеллектуальная игра) Эльвира ВАЛИЕВА, учитель химии Актанышской средней школы №1 Цель: углубление знаний учащихся по химии, развитие интереса к предмету. Задачи. Проведение в занимательной форме смотра знаний школьников, активизации познавательной деятельности, применение знаний, полученных на уроках, в игровой ситуации, умения выделять главное и находить ответы на поставленные вопросы, закрепление умений и навыков в решении экспериментальных задач, знания правил ТБ. Мероприятие для учащихся IX–X классов. За месяц до проведения мероприятия команды получают задания: придумать название, эмблему, составить приветствие, кроссворд, подготовить музыкальный номер (песня, танцы, инсценировка по теме «Химические реакции»). Оформление зала. Над сценой гирлянды разноцветных шаров, плакаты с высказываниями ученых, писателей. Оборудование: стеклянные пластинки, стакан, асбестированная сетка, спички, керамическая плитка, лучинка, химический стакан на 100 мл, стеклянная палочка. Реактивы: растворы CuSO4, NaOH, BaCI2, H2SO4, FeCI3, Na2CO3, фенолфталиен, концентрированная соляная кислота, 10–25%ный раствор аммиака, дихромат аммония, гидрокарбонат натрия, сахар, спирт, речной песок, концентрированная серная кислота, сахарная пудра. Ход мероприятия. Вступительная часть. Ведущий. Добрый день, юные химики! Сегодня мы с вами проводим игру в виде химической эстафеты, где вы сможете показать и применять знания, полученные на уроках. Игра проводится в виде химической эстафеты. Также будет оцениваться поддержка команды от болельщиков, будьте активными. Судить нашу эстафету будет жюри. (Представление членов жюри.) Приветствие команд. (Команды в музыкальной или стихотворной форме приветствует соперников, жюри и болельщиков. Дарят свою эмблему жюри, объясняя ее смысл.) I тур. Разминка. Ответы на вопросы. Максимальная оценка за правильный ответ – 1 балл. 1. Какие металлы бегают по воде? (Щелочные) 2. Назовите металл, вызывающий «лихорадку». (Золото) 3. Белый зайчик прыгает по черному полю. (Мел) 4. Процесс распада электролита на ионы. (Электролитическая диссоциация) 5. Он входит в состав любого органического вещества. (Углерод) 6. В состав названия какого металла входит дерево? (Ник+ель) 7. Твердый углекислый газ. (Сухой лед) 8. Вещество, под действием которого лакмус синеет. (Щелочь) 9. Почему крапива жжется? (Содержит муравьиную кислоту) 10. Какое молоко не скиснет? (Известковое молоко) 11. Какой металл работал «птичкой» у фотографа? (Магний) 12. Горючий газ, используемый для сварки? (Ацетилен) 13. Какую воду можно замутить своим дыханием? (Известковую воду) 14. Сплав меди с оловом. (Бронза) 15. Самый активный галоген. (Фтор) 16. Простое вещество, применяемое в производстве спичек. (Фосфор) 17. Самый легкий металл. (Литий) 18. Какой металл называют металлом консервной банки? (Олово) II тур – игра «Что в имени твоем?» (За 2 минуты команды должны написать название элементов связанные с астрономией. За каждый правильный ответ 1 балл.) Ответ. Гелий – Солнце, селен – Уран, теллур – Земля, уран – Уран, нептуний – Нептун, плутоний –Плутон, палладий – астероид Паллада. III тур – «Угадайте вещество». (О каком элементе идет речь? Дается 5 подсказок. Если ответ дается после первой подсказки, команда получает 5 баллов. По мере прочтения последующих, число баллов уменьшается. У каждой команды право только на один ответ.) 1. Металл в чистом в виде тягучий вязкий красного, в изломе розового цвета. 2. Один из металлов, известных с глубокой древности, даже целый период истории человечества назван этим металлом. 3. По электропроводности металл занимает II место среди всех металлов после серебра. 4. Участвует в процессе фотосинтеза. 5. Входит в состав малахита. Ответ: медь. 1. Металл красивого белого цвета. 2. Сплавы этого металла с медью используют при чеканке медалей. 3. Металл убивает микроорганизмы в воде, поэтому такая вода, никогда не теряет свежести. 4. Этот элемент алхимики обозначали тонким спектром Луны и называли лунным металлом. 5. Металл применяется при изготовлении зеркал. Ответ: серебро. 1. Хрупкое вещество желтого цвета, легко плавится. 2. Страницы китайских рукописей впервые приготовлении пороха, в его состав входит этот элемент. известили о 3. Это одно из немногих, которыми уже несколько тысяч лет оперировали первые «химики». 4. Алхимики изображали этот элемент в виде огнедышащего дракона. 5. Бумага и резина, эбонит и спички, ткани и лекарства косметика и пластмассы, взрывчатка и краска, удобрения и ядохимикаты – для производства которых нужен элемент №16. Ответ: сера. Из этого вещества сделана начинка электронных устройств, 1. процессоры и чипы, флешки и сим карты. Это 2. вещество – твердое серо-стального цвета с металлическим блеском. 3. Часто используют для изготовления солнечных батарей. 4. Обладает полупроводниковым свойством. 5. Его соединение с кислородом имеется в составе клея. Ответ: кремний. IV тур. Конкурс капитанов (экспериментальный). (Опыты проводятся капитанами одновременно, и после проведения дается объяснение. Оценивается конкурс в 5 баллов.) I вариант. Даны реактивы: растворы CuSO4, NaOH, BaCI2, H2SO4, FeCI3, Na2CO3. Получите, используя выданные вам вещества, три осадка: голубой, белый и бурый (коричневый). Запишите уравнения реакций в молекулярном, полном и сокращенном ионном виде. II вариант. Даны реактивы: фенолфталиена. растворы Экспериментальным CuSO4, путем NaOH, BaCI2, осуществите H2SO4, следующие превращения, используя выданные вам реактивы: бесцветный раствор – раствор малинового цвета, бесцветный раствор – осадок белого цвета, голубой раствор – голубой осадок. Запишите уравнения реакций в молекулярном, полном и сокращенном ионном виде. V тур – «Простые вещи с точки зрения химии». Задание на смекалку. Ведущий задает вопросы. Чья команда поднимет руку, та и отвечает. За каждый правильный ответ – 1 балл. 1. Некоторый металл на морозе «заболевает: его серебристо-белые слитки сначала становятся тускло-серыми, а затем рассыпаются в серый порошок. Назовите металл. Как называется это явление? (Олово, оловянная чума.) 2. Что показывает проба, которую ставят на ювелирных изделиях в виде клейма? (Проба показывает, сколько единиц массы драгоценного металла содержится в 1000 единицах массы сплава.) 3. Какое химическое вещество, используемое в быту, опасно проливать на золотые украшения? (Капли йодной настойки, попадая на золотые украшения, оставляют на них темные пятна.) 4. Почему на жареном мясе образуется румяная корочка? (За румяный цвет корочки отвечают содержащиеся в продукте сахара, которые в процессе жарки карамели образуются.) 5. Как превратить слово «бал» в твердый серебристый металл с красноватым отливом? (Кобальт) 6. Почему ржавеет железо? (Во влажной среде образуется ржавчина – Fe 2O 3 • H 2О, иногда пишут просто Fe 2O 3.) 7. Почему, с точки зрения химии, разрыхлитель добавляют только в сухое тесто. (Сухой разрыхлитель смешивают с сухой мукой. Если предварительно растворить его в воде, то реакция пройдет в растворе и углекислый газ просто не попадет в тесто.) 8. Сжигая это элемент, люди с древних времен выкуривали насекомых из жилищ? (Сера) 9. Почему с течением времени серебряные ложки темнеют? (Под действием кислорода и сероводорода воздуха образуется черный осадок сульфида серебра. Реакция Ag + O2 + 2H2S = 2 Ag2S + 2H20.) 10. Почему при изжоге используют чайную соду? (Чайная сода взаимодействует с соляной кислотой желудка, выделяется углекислый газ, происходит реакция нейтрализации. NaHCO3+HCI=NaCI+CO2+H2O.) VI тур – «Я загадал вещество». (Капитан получает карточку с названием химического элемента, соседняя команда должна отгадать, что за элемент, задавая капитану разные вопросы, на которые он отвечает только «да» или «нет». Чем меньше задано вопросов, тем лучше. Выигрывает та команда, которая угадает химический элемент. Команда получает от 1 до 3 баллов.) VII тур – «Экспериментальный». (Показывается опыты учителем. Необходимо написать уравнения проведенной реакции. Каждое уравнение реакции оценивается 1 баллом.) 1-й опыт – «Дым без огня» (взаимодействие аммиака с кислотой). Подготовка. 2 стакана на 400 мл, стеклянные пластинки, концентрированная соляная кислота и 10 – 25%ный раствор аммиака. Техника безопасности. Опыт проводим в вытяжном шкафу из-за вредного воздействия аммиака на слизистые оболочки глаз и дыхательные пути. Выполнение. Один стакан ополаскиваем концентрированным раствором аммиака, другой – концентрированным раствором соляной кислоты. Закрываем стаканы стеклянными пластинками. Затем один стакан, придерживая стеклянную пластинку, переворачиваем и ставим на другой, закрытый стеклянной пластиной. Убираем пластинки и совмещаем горлышки стаканов. Вопросы учащимся. Почему при этой реакции образовался белый «дым»? Составьте уравнение реакции. 2-й опыт – «Извержение вулкана» (термическое разложение дихромата аммония). Подготовка. 3 г дихромата аммония, асбестированная сетка, спички. Выполнение. На асбестированную сетку помещаем 3 г дихромата аммония и подносим к нему горящую спичку. Вопросы учащимся. Составьте уравнение реакции. 3-й опыт – «Темно-серая змея» (превращение гидрокарбонатов в карбонаты). Подготовка. Керамическая плитка, лучинка, спички, 6 г гидрокарбоната натрия, 20 г сахара, спирт, речной песок. Выполнение. На керамическую плитку помещаем конусом речной песок и хорошо пропитываем его спиртом. Делаем углубление и помещаем туда 6 г гидрокарбоната натрия, 10 г сахара, предварительно растертые в порошок. Поджигаем спирт, из массы выползает «змея». Вопросы учащимся. Для чего речной песок пропитали спиртом? Почему образовалась змея? Составьте уравнение реакции. 4-й опыт – «Обугливание сахара под действием концентрированной серной кислоты». Подготовка. Химический стакан на 100 мл, стеклянная палочка, 10 мл концентрированной серной кислоты, 15 г сахарной пудры. Техника безопасности. Так как выделяющийся сернистый газ ядовит, опыт проводим под тягой. Выполнение. В стакан насыпаем 15 г сахарной пудры, приливаем 10 мл концентрированной серной кислоты и быстро перемешиваем стеклянной палочкой. После опыта стакан заливаем для нейтрализации раствором серы, а затем отработанные вещества сливаем в канализацию. Вопросы учащимся. Какова формула сахара? Как вы считаете, что за вещество черного цвета образовалось при взаимодействии серной кислоты и сахара? Какие газы выделились при взаимодействии концентрированной серной кислоты с углем? Составьте уравнение реакции. (После проведения всех опытов команды сдают свои листочки с уравнениями реакций и объяснениями.) Обсуждение с учителем. Вывод по I опыту. Всем известна пословица: «Нет дыма без огня», а, глядя на этот опыт, можно с ней поспорить. При взаимодействии аммиака с соляной кислотой происходит реакция, в результате которой из двух газообразных веществ образуются мелкие кристаллы хлорида аммония (нашатыря), которые образуют дым: NH3 + HCI = NH4CI. Значит дым без огня бывает. Вывод по II опыту. Реакция разложение дихромата аммония. При этом образуется оксид хрома (III) зеленого цвета, который образует «вулкан с кратером»: (NH4)2Cr2O7 = Cr2 O3 + N2 +4H2O. Вывод по III опыту. Сахар при нагревании плавится и обугливается, а гидрокарбонат натрия при нагревании легко разлагается, переходя в карбонат. При этом также выделяются углекислый газ и вода, поэтому наблюдается подъем черной массы – «змеи»: NaHCO3 = Na2 CO3 + CO2 + H2 O. Спиртом пропитали песок для того, чтобы выполнялось условие проведения реакции – нагревание. Вывод по IV опыту. Концентрированная серная кислота является сильным окислителем. Разрушает молекулы сахара. Отнимая от них воду, образуя чистый углерод, который окисляется серной кислотой, что приводит к выделению двух газов сернистого и углекислого, они и поднимают черную массу вверх. C12 H12 O11 =12 C+11H2O C+2H 2 SO4 = CO2 +2SO2 +2H2 O VIII тур. Домашнее задание – «Кроссворды». (Команды представляют составленные и красиво оформленные кроссворды (формат А2). Жюри оценивает правильность составления кроссворда и его оригинальность. Кроссворды сдаются жюри. При оценивании кроссвордов проводятся конкурс болельщиков. В это время команды готовятся к музыкальному заданию.) Конкурс болельщиков-химиков. (Болельщикам предлагаются названия веществ, принятые в технике, медицине или в быту, а они должны дать им химическое название, т.е. подобрать химические синонимы. Угадавший получает одну из букв, составляющих фразу «Учи химию!». Собрав все буквы, болельщики химики складывают эту фразу.) Примеры обиходных и химических названий. Бертолетова соль – хлорат калия, веселящий газ – оксид азота (I); гипс – дигидрат сульфата кальция, нашатырный спирт – гидроксид аммония, плавиковая кислота – фтороводородная кислота, мрамор – карбонат кальция, пирит – сульфид железа (II), питьевая сода – гидрокарбонат натрия, киноварь – сульфид ртути, негашеная известь – оксид кальция, царская водка – смесь соляной и азотной кислот, поваренная соль – хлорид натрия. IX тур – «Музыкальное задание». Команды должны подготовить песню, танец, инсценировку на тему «Химические реакции». Оценивается от 3 до 5 баллов. Подведение итогов Жюри подсчитывает сумму баллов и объявляет победителей. А также определяется лучший химик из команды (номинация «Серебряная пробирка») и лучший болельщик-химик (номинация «Зрительная симпатия»). Литература. 1. Артеменко А.И. Справочное руководство по химии. – М.: Высшая школа, 1990. 2. Денисова В.Г. Мастер-класс учителя химии. – М.: Глобус, 2010. 3. Мангутова Л.А. Популярная экология (Полезные советы в повседневной жизни). – Казань: Экоцентр, 1997. 4. Савина Л.В. Я познаю мир. – М.: АСТ, 1996. 5. Стрельникова Л.Н. Из чего все сделано? – М.: Яуза-пресс, 2011.