Изучение влияния боковой цепи аминокомпонента на
реклама
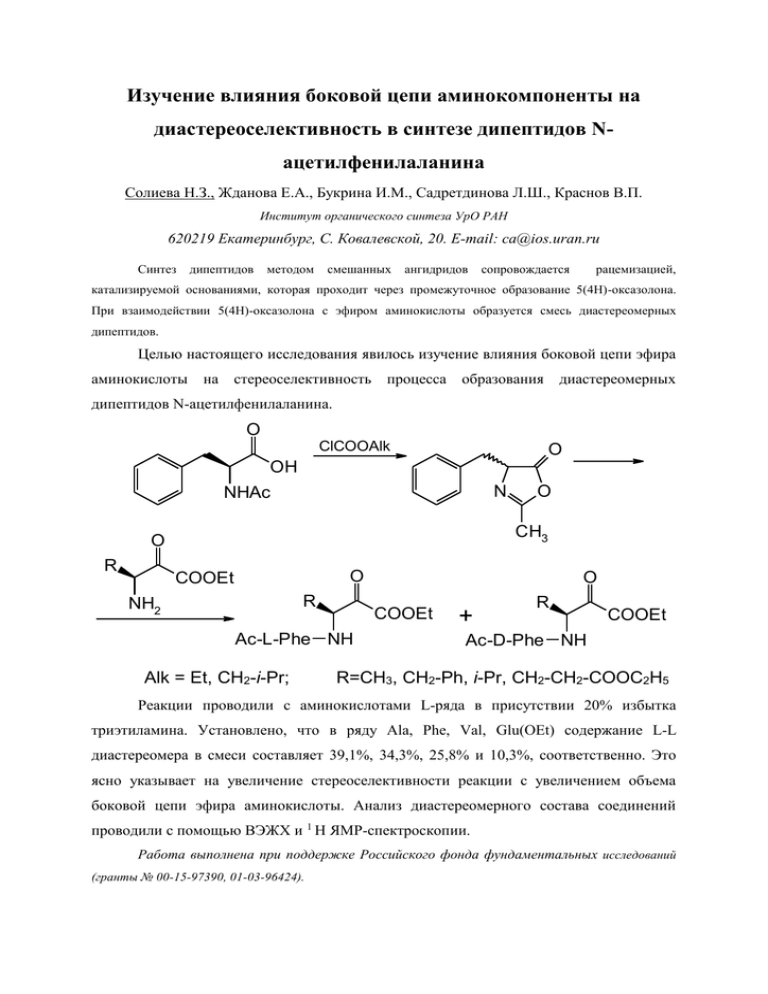
Изучение влияния боковой цепи аминокомпоненты на диастереоселективность в синтезе дипептидов Nацетилфенилаланина Солиева Н.З., Жданова Е.А., Букрина И.М., Садретдинова Л.Ш., Краснов В.П. Институт органического синтеза УрО РАН 620219 Екатеринбург, С. Ковалевской, 20. E-mail: ca@ios.uran.ru Синтез дипептидов методом смешанных ангидридов сопровождается рацемизацией, катализируемой основаниями, которая проходит через промежуточное образование 5(4Н)-оксазолона. При взаимодействии 5(4Н)-оксазолона с эфиром аминокислоты образуется смесь диастереомерных дипептидов. Целью настоящего исследования явилось изучение влияния боковой цепи эфира аминокислоты на стереоселективность процесса образования диастереомерных дипептидов N-ацетилфенилаланина. O ClCOOAlk O OH N NHAc CH3 O R O O COOEt R NH2 COOEt Ac-L-Phe NH Alk = Et, CH2-i-Pr; O + R COOEt Ac-D-Phe NH R=CH3, CH2-Ph, i-Pr, CH2-CH2-COOC2H5 Реакции проводили с аминокислотами L-ряда в присутствии 20% избытка триэтиламина. Установлено, что в ряду Ala, Phe, Val, Glu(OEt) содержание L-L диастереомера в смеси составляет 39,1%, 34,3%, 25,8% и 10,3%, соответственно. Это ясно указывает на увеличение стереоселективности реакции с увеличением объема боковой цепи эфира аминокислоты. Анализ диастереомерного состава соединений проводили с помощью ВЭЖХ и 1 Н ЯМР-спектроскопии. Работа выполнена при поддержке Российского фонда фундаментальных исследований (гранты № 00-15-97390, 01-03-96424).





