Приложение № 1 - Развитие фармацевтической и медицинской
реклама
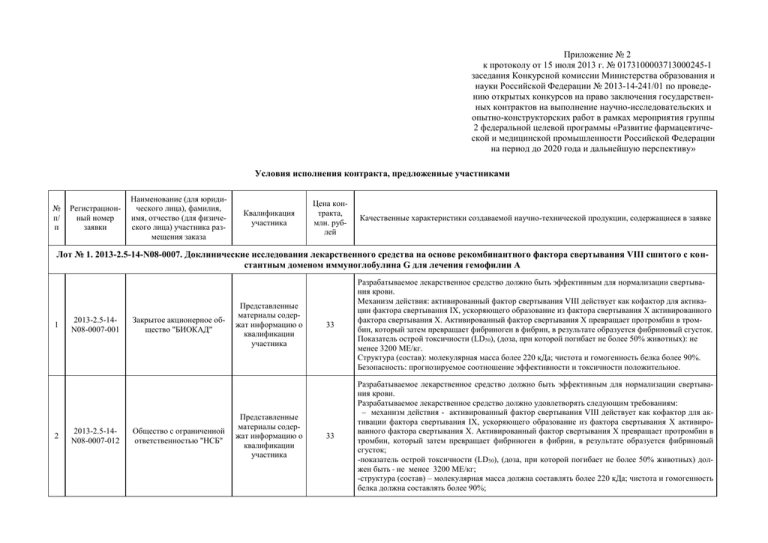
Приложение № 2 к протоколу от 15 июля 2013 г. № 0173100003713000245-1 заседания Конкурсной комиссии Министерства образования и науки Российской Федерации № 2013-14-241/01 по проведению открытых конкурсов на право заключения государственных контрактов на выполнение научно-исследовательских и опытно-конструкторских работ в рамках мероприятия группы 2 федеральной целевой программы «Развитие фармацевтической и медицинской промышленности Российской Федерации на период до 2020 года и дальнейшую перспективу» Условия исполнения контракта, предложенные участниками № п/ п Регистрационный номер заявки Наименование (для юридического лица), фамилия, имя, отчество (для физического лица) участника размещения заказа Квалификация участника Цена контракта, млн. рублей Качественные характеристики создаваемой научно-технической продукции, содержащиеся в заявке Лот № 1. 2013-2.5-14-N08-0007. Доклинические исследования лекарственного средства на основе рекомбинантного фактора свертывания VIII сшитого с константным доменом иммуноглобулина G для лечения гемофилии А 1 2 2013-2.5-14N08-0007-001 2013-2.5-14N08-0007-012 Закрытое акционерное общество "БИОКАД" Общество с ограниченной ответственностью "НСБ" Представленные материалы содержат информацию о квалификации участника Представленные материалы содержат информацию о квалификации участника 33 Разрабатываемое лекарственное средство должно быть эффективным для нормализации свертывания крови. Механизм действия: активированный фактор свертывания VIII действует как кофактор для активации фактора свертывания IX, ускоряющего образование из фактора свертывания X активированного фактора свертывания X. Активированный фактор свертывания X превращает протромбин в тромбин, который затем превращает фибриноген в фибрин, в результате образуется фибриновый сгусток. Показатель острой токсичности (LD50), (доза, при которой погибает не более 50% животных): не менее 3200 МЕ/кг. Структура (состав): молекулярная масса более 220 кДа; чистота и гомогенность белка более 90%. Безопасность: прогнозируемое соотношение эффективности и токсичности положительное. 33 Разрабатываемое лекарственное средство должно быть эффективным для нормализации свертывания крови. Разрабатываемое лекарственное средство должно удовлетворять следующим требованиям: – механизм действия - активированный фактор свертывания VIII действует как кофактор для активации фактора свертывания IX, ускоряющего образование из фактора свертывания X активированного фактора свертывания X. Активированный фактор свертывания X превращает протромбин в тромбин, который затем превращает фибриноген в фибрин, в результате образуется фибриновый сгусток; -показатель острой токсичности (LD50), (доза, при которой погибает не более 50% животных) должен быть не менее 3200 МЕ/кг; -структура (состав) – молекулярная масса должна составлять более 220 кДа; чистота и гомогенность белка должна составлять более 90%; - безопасность – прогнозируемое соотношение эффективности и токсичности должно быть положительным . Лот № 2. 2013-2.5-14-N08-0008. Доклинические исследования лекарственного средства на основе механизма интерференции РНК для лечения бронхиальной астмы 3 2013-2.5-14N08-0008-002 Федеральное государственное бюджетное учреждение Представленные "Государственный научный материалы содерцентр "Институт иммуно- жат информацию о логии" Федерального медиквалификации ко-биологического участника агентства 33 В процессе выполнения работ: 1) Будет выполнен аналитический обзор современной научно-технической, нормативной, методической литературы, затрагивающей научно-техническую проблему, исследуемую в рамках НИОКР. 2) Будет проведено патентное исследование в соответствии с ГОСТ 15.011-96. 3) Будет разработан лабораторный регламент получения лекарственного средства. 4) Будут получены опытные образцы лекарственного средства 5) Будет подана патентная заявка на лекарственное средство. 6) Будет разработана технология получения лекарственного средства. 7) Будут проведены доклинические исследования лекарственного средства, включающие в себя оценку специфической активности лекарственного средства на модели бронхиальной астмы у мышей. 8) Будут проведены доклинические исследования лекарственного средства, включающие в себя оценку безопасности разработанного лекарственного средства. 9) Будут проведены доклинические исследования фармакокинетики лекарственного средства с учетом пути введения и фармакологического действия вещества. 10) Будет разработан отчет о результатах доклинических исследований лекарственного средства 11) Будет разработан проект опытно-промышленного регламента получения лекарственного средства 12) Будет разработан проект фармакопейной статьи предприятия на лекарственное средство 13) Будет разработан проект протокола клинического исследования лекарственного средства для медицинского применения 14) Будет разработан проект брошюры исследователя Лот № 3. 2013-2.5-14-N08-0009. Доклинические исследования лекарственного средства – комбинированной профилактической вакцины против шигеллезной инфекции 4 2013-2.5-14N08-0009-003 Федеральное государственное бюджетное учреждение Представленные "Государственный научный материалы содерцентр "Институт иммуно- жат информацию о логии" Федерального медиквалификации ко-биологического участника агентства 33 При выполнении НИ0КР должна быть создана следующая научно-техническая продукция: 1. комбинированная противодизентерийная вакцина, состоящая из полисахаридного иммуногена S. flexneri и нативного низкотоксичного и низкопирогенного ЛПС S. sonnei, очищенных ферментативными и физико-химическими методами, с добавлением воды очищенной, апирогенной, натрия хлорида (ГОСТ 4233-78), натрия фосфата двузамещенного (ГОСТ 4172-76), натрия фосфата однозамещенного (ГОСТ 245-76). 2. В рамках НИОКР должны быть проведены доклинические исследования: специфической активности, безопасности, острой и хронической токсичности и др. иммунобиологического лекарственного средства на основе протективных антигенов возбудителя для профилактики инфекций, вызываемых шигеллами Зонне и Флекснера ( комбинированной вакцины против дизентерийной инфекции) - далее по тексту «лекарственное средство»; 3. При выполнении НИОКР должны быть получены следующие научно-технические результаты: 3.1. Отчет о НИОКР, содержащий в том числе: - Отчет о доклинических исследованиях; - Обзор и анализ современной научно-технической, нормативной, методической литературы, затрагивающей научно-техническую проблему, исследуемую в рамках НИОКР; - Отчет о патентных исследованиях. - Отчет о доклинических исследованиях лекарственного средства против дизентерийной инфекции. 3.2. Лабораторный регламент получения лекарственного средства против дизентерийной инфекции. 3.3.Акты о наработке опытных образцов для проведения доклинических исследований лекарственного средства против дизентерийной инфекции 3.4.Протоколы анализа образцов 3.5. При выполнении НИОКР должна быть создана следующая научно-техническая продукция: - Опытные образцы в количестве, достаточном для проведения доклинических и последующих клинических исследований лекарственного средства; - Проект опытно-промышленного регламента получения лекарственного средства; - Проект фармакопейной статьи лекарственного средства; - Проект протокола клинических исследований лекарственного средства для медицинского применения; - Проект брошюры исследователя; - Проект инструкции по применению лекарственного средства 5 2013-2.5-14N08-0009-013 Общество с ограниченной ответственностью "НСБ" Представленные материалы содержат информацию о квалификации участника 33 Разрабатываемое лекарственное средство должно быть эффективным при лечении инфекций, вызываемых дизентериями Зонне и Флекснера. Разрабатываемое лекарственное средство должно удовлетворять следующим требованиям: -по механизму действия – активировать системы адаптивного иммунитета; -по иммуногенности – стимулировать образование специфических антител (не менее чем в 4-5 раз) и протективный эффект in vivo на моделях инфекции (не менее чем в 4-5 раз); -по безопасности – прогнозируемое соотношение эффективности и токсичности должно быть положительным. В ходе выполнения НИОКР: -должен быть выполнен аналитический обзор современной научно-технической, нормативной, методической литературы, затрагивающей научно-техническую проблему, исследуемую в рамках НИОКР, включая подходы к оценке фармакологических, фармакокинетических и токсикологических исследований лекарственных средств, обосновывающий выбранные модели и методы (in vivo и in vitro) проведения доклинических исследований, их объем и продолжительность, в том числе, обзор научных информационных источников: статьи в ведущих зарубежных и российских научных журналах, монографии и патенты - не менее 50, научно-информационные источники за последние 5 лет; -должны быть наработаны опытные образцы лекарственного средства в количестве достаточном для проведения доклинических исследований, фармацевтической разработки и исследований стабильности; -должна быть разработана технология получения лекарственного средства; -должны быть проведены доклинические (экспериментальные) исследования: специфической активности, общей и специфической безопасности с учетом пути введения и фармакологического действия вещества Лот № 4. 2013-2.5-14-N08-0010. Доклинические исследования инновационного радиофармацевтического препарата, на основе аминокислоты, меченной 18F, для дифференциальной диагностики онкологических заболеваний методом позитронной эмиссионной томографии 6 2013-2.5-14N08-0010-014 федеральное государственное бюджетное учреждение Представленные "Российский научный центр материалы содеррадиологии и хирургичежат информацию о ских технологий" Миниквалификации стерства здравоохранения участника Российской Федерации 33 Разработка технологии получения радиофармацевтического препарата, представляющего собой аминокислоту, меченную 18F; оценка функциональной пригодности и безопасности радиофармацевтического препарата, представляющего собой аминокислоту, меченную 18F. Лот № 5. 2013-2.5-14-N08-0011. Доклинические исследования инновационного радиофармацевтического препарата, меченного 18F, для диагностики первичных и метастатических опухолей костей методом позитронной эмиссионной томографии 7 2013-2.5-14N08-0011-015 федеральное государственное бюджетное учреждение Представленные "Российский научный центр материалы содеррадиологии и хирургичежат информацию о ских технологий" Миниквалификации стерства здравоохранения участника Российской Федерации 33 Разработка технологии получения радиофармацевтического препарата, меченного 18F, для диагностики первичных и метастатических опухолей костей, меченную 18F; оценка функциональной пригодности и безопасности радиофармацевтического препарата, меченного 18F, для диагностики первичных и метастатических опухолей костей. Лот № 6. 2013-2.5-14-N08-0012. Доклинические исследования отечественного инновационного радиофармацевтического препарата на основе радионуклида галлий-68 для диагностики воспалительных заболеваний методом позитронной эмиссионной томографии 8 2013-2.5-14N08-0012-004 Общество с ограниченной ответственностью "ДИАМЕД" Представленные материалы содержат информацию о квалификации участника 33 Предметом темы являются доклинические исследования инновационного радиофармпрепарата для ПЭТ-диагностики воспалительных заболеваний «Цигалин, 68Ga», то есть предмет работы полностью соответствует целям лота. Основные характеристики: - механизм действия – накопление в очаге воспаления в количестве, превышающем накопление в интактных зонах, и достаточном для визуализации очага – достигается выбранным составом радиофармпрепарата; - радиохимическая чистота – не менее 90% - достигается способом приготовления радиофармпрепарата, который потенциально является предметом оформления РИД (заявки на патентование), поэтому сущность не описывается; - показатель острой токсичности (LD50), (доза, при которой погибает не более 50 % животных) должен быть менее 500 мг/кг – основное химическое соединение, использованное в составе препарата – натрия цитрат – является веществом, описанным в Государственной Фармакопее РФ и многократно использованным в составе известных лекарственных средств, пищевых добавок и продуктов; при концентрациях, используемых в составе исследуемого препарата LD50 не достигается; - соответствие требованиям не выше 4 категории радиационной опасности - «опасность для человека маловероятна» (НП 038-11) – для персонала гарантируется соблюдением нормативов НРБ99/2009 и ОСПОРБ-99/2010 при обращении с препаратом; максимально допустимые к введению пациентам дозы будут прогнозно оценены по результатам доклинических исследований. Более подробно представлено в Форме 3. Лот № 7. 2013-2.5-14-N08-0013. Доклинические исследования лекарственного средства на основе гидразинового производного полиалкиленгуанидина в ингаляционной форме для лечения грибковых пневмоний 9 2013-2.5-14N08-0013-016 Общество с ограниченной ответственностью "Санте Фарм" Представленные материалы содержат информацию о квалификации участника 33 Будут проведены доклинические исследования лекарственного средства направленные на изучение специфической фармакологической активности, безопасности, фармакокинетики лекарственного средства на основе гидразинового производного полиалкиленгуанидина в ингаляционной форме для лечения грибковых пневмоний. Будет разработан лабораторный регламент получения лекарственного средства и наработаны опытные образцы. При выполнении НИОКР будет разработана технология создания лекарственного средства, проведено ее масштабирование; будут разработаны и валидированы методы контроля и аналитической оценки качества лекарственного средства. В результате проведения НИОКР будут подготовлены проекты необходимых документов, таких как, проект протокола клинического исследования лекарственного средства, проект брошюры исследователя, отчет о доклинических исследованиях. Лот № 8. 2013-2.5-14-N08-0014. Доклинические исследования инновационного лекарственного средства на основе моноклонального антитела к рецептору фактора роста фибробластов для лечения онкологических заболеваний 10 2013-2.5-14N08-0014-006 Общество с ограниченной ответственностью "ОнкоМакс" Представленные материалы содержат информацию о квалификации участника 33 В доклинических исследованиях лекарственного средства на основе моноклонального антитела к рецептору фактора роста фибробластов для лечения онкологических заболеваний будут использоваться современные методы генной инженерии, культивирования эукариотических клеток, клеточной биологии, биохимии. В ходе выполнения проекта будет создана следующая научно-техническая продукция: -лабораторный регламент получения лекарственного средства; -опытные образцы лекарственного средства в количестве, достаточном для проведения доклинических исследований; -проект фармакопейной статьи или нормативной документации на лекарственное средство; -проект протокола клинического исследования лекарственного средства для медицинского применения; -проект брошюры исследователя; -проект инструкции по применению лекарственного средства; -проект досье на регистрацию; -отчет о результатах доклинического исследования. К работе будет привлечен квалифицированный коллектив исполнителей: 1 доктор медицинских наук и 4 кандидата наук. Лот № 9. 2013-2.5-14-N08-0015. Доклинические исследования лекарственного средства на основе комплекса бифидобактерий, лактобацилл и энтерококков с установленной последовательностью генома для лечения неспецифического язвенного колита 11 2013-2.5-14N08-0015-005 Федеральное государственПредставленные ное бюджетное учреждение материалы содернауки Институт общей ге- жат информацию о нетики им.Н.И. Вавилова квалификации Российской академии наук участника 33 - Смесь лиофилизированных пробиотических бактерий; - основной мишенью действия бактерий должны являться Toll-подобные рецепторы; - используемые в работе штаммы должны быть депонированы в коллекцию, осуществляющую патентное депонирование, в установленном порядке с указанием последовательности генома; - в геноме должны отсутствовать гены патогенности и трансмиссивные гены устойчивости к антибиотикам; - препарат должен оказывать ингибирующее действие на провоспалительные цитокины IL-1, IL-6, IL-8, ФНО-α и индуцировать продукцию противовоспалительного цитокина IL-10; - содержание бактерий при различных сроках хранения лекарственного средства должно быть не менее 107 КОЕ в одной доз препарата; - прогнозируемое соотношение эффективности и токсичности должно быть положительным. Лот № 10. 2013-2.5-14-N08-0016. Доклинические исследования комбинированного лекарственного средства на основе невирусных конструкций, кодирующих фактор роста гепатоцитов и ангиопоэтин 1, для лечения ишемии нижних конечностей 12 2013-2.5-14N08-0016-007 Федеральное государственное бюджетное образоваПредставленные тельное учреждение высматериалы содершего профессионального жат информацию о образования "Московский квалификации государственный универсиучастника тет имени М.В.Ломоносова" 32 Доклинические исследования будут проведены в объеме, достаточном для получения достоверных данных по безопасности и эффективности и обеспечивающем возможность проведения клинических исследований. Разрабатываемый лекарственный препарат предназначен для последующего проведения клинических исследований; организации производства и медицинского применения на территории Российской Федерации. Создаваемый лекарственный препарат на основе невирусных конструкций, несущих гены фактора роста гепатоцитов и ангиопоэтина 1, предназначен для стимуляции регенеративных процессов в тканях. При выполнении НИОКР будет: - Разработана технология получения генного лекарственного средства на основе плазмидных генетических конструкций, несущих гены факторов роста. - Разработан лабораторный регламент и проект опытно-промышленного регламента на производство лекарственного средства, а также проект фармакопейной статьи предприятия на лекарственное средство. Лот № 11. 2013-2.5-14-N08-0017. Доклинические исследования терапевтической вакцины на основе функционально значимых пептидных иммуногенов для лечения злокачественных опухолей 13 2013-2.5-14N08-0017-010 Закрытое акционерное общество "Эпитек" Представленные материалы содержат информацию о квалификации участника 33 В рамках проекта будут проведены доклинические исследования терапевтической пептидной вакцины для лечения и профилактики рецидивов и метастазирования злокачественных опухолевых заболеваний, произведенной на основе ВС-конъюгированных синтетических пептидов, соответствующих функционально значимым (протективным) эпитопам биомишеней EGFR, HER2, VEGFR, и индуцирующей в организме модельных животных антитела, специфичные к фрагментам рецепторов EGFR, HER2, VEGFR, которые ответственны за димеризацию рецепторов и/или связывание рецепторов с соответствующими лигандами. При выполнении работы будут получены следующие научно-технические результаты: отчет о результатах доклинических исследований; протоколы доклинических исследований лекарственного средства; данные об изучении стабильности лекарственного средства; отчет о фармацевтической разработке лекарственного средства; лабораторный регламент получения лекарственного средства; проект опытно-промышленного регламента получения лекарственного средства; проект нормативной документации (фармакопейной статьи предприятия) на лекарственное средство по установленной форме; проект протокола клинического исследования лекарственного препарата для медицинского применения; проект брошюры исследователя. Лот № 12. 2013-2.5-14-N08-0018. Доклинические исследования комбинированного лекарственного средства пролонгированного действия на основе ингибито- ров обратной транскриптазы для лечения синдрома приобретенного иммунодефицита 14 2013-2.5-14N08-0018-008 Закрытое акционерное общество "Производственнокоммерческая Ассоциация АЗТ" Представленные материалы содержат информацию о квалификации участника 32,5 Разрабатываемое лекарственное средство должно быть эффективным в терапии ВИЧ-инфекции и должно удовлетворять следующим требованиям: механизм действия - специфическое ингибирование действия обратной транскриптазы ВИЧ; структура – должно содержать два активных фармакологических вещества нуклеозидной природы; показатель IC50 должен составлять не более 1 μM; показатель острой токсичности (LD50), должен быть не менее 3000 мг/кг; безопасность – прогнозируемое соотношение эффективности и токсичности должно быть положительным. Лот № 13. 2013-2.5-14-N08-0019. Доклинические исследования инновационного препарата – синтетической пептидной вакцины против гепатита С Будет создан инновационный препарат вакцины против гепатита С на основе уникальных синтетических пептидных антигенов и фосфолипидных мицелл в качестве носителя с адъювантными свойствами и проведено доклиническое исследование этого препарата. 15 2013-2.5-14N08-0019-011 Федеральное государственное бюджетное учреждение Представленные "Научно-исследовательский материалы содеринститут биомедицинской жат информацию о химии имени В.Н. Орехоквалификации вича" Российской академии участника медицинских наук 33 Будет создана научно-техническая продукция: 1) лабораторный регламент получения пептидной вакцины против гепатита С; 2) лабораторно-экспериментальные серии пептидной вакцины против гепатита С в количестве, достаточном для проведения доклинических исследований лекарственных средств; 3) отчет об исследовании физико-химических свойств и условий хранения препарата вакцины; 4) отчет об исследовании биоэффективности вакцины; 5) отчеты о доклиническом исследовании вакцины; 6) отчеты об исследовании иммунологической безопасности вакцины; 7) проект опытно-промышленного регламента получения вакцины; 8) опытные серии препарата вакцины; 9) проект фармакопейной статьи на пептидную вакцину против гепатита С; 10) проект протокола клинического исследования вакцины; 11) проект брошюры исследователя; 12) проект инструкции по применению вакцины. Лот № 14. 2013-2.5-14-N08-0020. Доклинические исследования контрастного лекарственного средства на основе гадолиния для магнитно-резонансной диагностики 16 2013-2.5-14N08-0020-009 Общество с ограниченной ответственностью "МедКонтрастСинтез" Представленные материалы содержат информацию о квалификации участника 33 Использование разрабатываемого лекарственного средства должно приводить к получению контрастного изображения при проведении МРТ-диагностики. Разрабатываемое лекарственное средство должно удовлетворять следующим требованиям: - структура – должна представлять собой композицию на основе динатриевой соли гадопентетовой кислоты; Химическая формула: C14H18GdN3Na2O10 - механизм действия – увеличение контрастной разрешающей способности за счет влияния на скорость спин-решеточной релаксации, т.е. Т1-взвешенные последовательности; магнитнорезонансное контрастное средство на основе гадолиния при внутривенном введении вместе с током крови перемещается в исследуемый орган; - уровень ЛД50 (доза, при которой погибает не более 50% животных) - не менее 500 мг/кг; - стабильность – срок хранения не менее 5 лет; - безопасность – прогнозируемое соотношение эффективности и токсичности должно быть положи- тельным. 17 2013-2.5-14N08-0020-017 Представленные Общество с ограниченной материалы содерответственностью "Фармажат информацию о цевтический научный центр квалификации "ФармАксесс" участника 28 Будет создан инновационный лекарственный кандидат – контрастное средство на основе гадолиния для магнитно-резонансной диагностики, представляющее собой нековалентный комплекс динатриевой соли гадпентетовой кислоты и альфа-фетопротеина, обладающего онкоспецифичным гликозиллированием, обеспечивающее: 1. доставку контрастного вещества в раковые опухоли и метастазы в течение 5-11 часов после введения и пощволяющий выявлять и локализовывать при помощи МРТ опухоли и метастазы во всем организме, 2. снизить дозу гадолиния и его комплексов на единичное контрастирование, 3. исключить необходимость использования хирургических сложных техник введения препарата. Подписи: Заместитель Председателя Конкурсной комиссии: ________________ Е.Н. Грузинова Члены Конкурсной комиссии: _______________ Е.А. Алексеева ________________ Е.Б. Андреева ________________ В.Г. Дроженко _____________ С.А. Ирхин Секретарь Конкурсной комиссии: _______________ Е.М. Глухова Заказчик Заместитель Министра образования и науки Российской Федерации _______________ А.Б. Повалко





