Патофизиология сердечно-сосудистой системы. Часть II
реклама

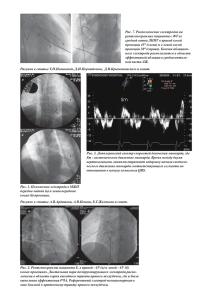
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «РОССИЙСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ ИМЕНИ Н.И. ПИРОГОВА МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ ________________________________________________________________________________ КАФЕДРА ПАТОФИЗИОЛОГИИ И КЛИНИЧЕСКОЙ ПАТОФИЗИОЛОГИИ ПАТОЛОГИЯ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ Часть II КОРОНАРНАЯ НЕДОСТАТОЧНОСТЬ ИШЕМИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА ИНФАРКТ МИОКАРДА Москва 2014 ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «РОССИЙСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ ИМЕНИ Н.И. ПИРОГОВА МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ КАФЕДРА ПАТОФИЗИОЛОГИИ И КЛИНИЧЕСКОЙ ПАТОФИЗИОЛОГИИ Рекомендуется учебно-методическим объединением по медицинскому и фармацевтическому образованию ВУЗов России в качестве учебного пособия для студентов медицинских ВУЗов. ПАТОЛОГИЯ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ Часть II КОРОНАРНАЯ НЕДОСТАТОЧНОСТЬ ИШЕМИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА ИНФАРКТ МИОКАРДА Методическая разработка для самостоятельной работы студентов лечебного и педиатрического факультетов. Под редакцией проф. Г.В. Порядина, проф. Ж.М.Салмаси. Составитель: доц. Н.И. Бережнова Москва 2014 Патология сердечно-сосудистой системы. Часть II. Коронарная недостаточность. Ишемическая болезнь сердца. Инфаркт миокарда. Учебнометодическая разработка для самостоятельной работы студентов 3-4 курсов лечебного, педиатрического и стоматологического факультетов. - М., РГМУ, 2014, 25 с. Данное пособие предназначается для работы, как в аудитории, так и во внеаудиторное время и направлено на изучение современных представлений о причинах и механизме развития коронарной недостаточности и ее видах. В данном методическом пособии изложены также современные данные литературы об этиологии, патогенезе, диагностике и принципах патогенетической терапии ишемической болезни сердца и острого инфаркта миокарда. Пособие составлено в соответствии с утверждённой МЗ РФ программой и новым учебным планом для высших медицинских учебных заведений. Под редакцией проф. Г.В. Порядина, проф. Ж.М.Салмаси. Составитель: доц. Н.И. Бережнова Подготовка издания: проф. Ж.М. Салмаси Российский Государственный медицинский университет, 2014. 2 ХАРАКТЕРИСТИКА КОРОНАРНОГО КРОВОТОКА Сердце кровоснабжается двумя коронарными артериями: левой и правой. Левая коронарная артерия делится на две большие ветви: переднюю нисходящую и огибающую артерии. Передняя нисходящая артерия кровоснабжает переднюю стенку левого желудочка и 2/3 межжелудочковой перегородки, а огибающая артерия – боковую стенку левого желудочка и часть задней стенки. Правая коронарная артерия кровоснабжает правый желудочек, заднюю и диафрагмальную области левого желудочка, заднюю треть межжелудочковой перегородки, а также атриовентрикулярный узел. Наиболее частой причиной нарушения коронарного кровотока является атеросклероз коронарных артерий. Чаще всего атеросклеротическим процессом повреждается передняя нисходящая (межжелудочковая) ветвь левой коронарной артерии, реже огибающая ветвь левой коронарной артерии и правая коронарная артерия. По мере прогрессирования атеросклероз поражает две и более ветвей коронарных артерий. В большей степени нарушению кровоснабжения подвержены субэндокардиальные слои миокарда, что обусловлено следующими причинами: 1. Коронарные сосуды и анастомозы между ними расположены в поверхностных (субэпикардиальных) слоях миокарда. В субэндокардиальных слоях существует анатомическая недостаточность коллатерального кровотока, так как сосуды носят концевой характер. 2. Кровоснабжение субэндокардиальных слоев осуществляется в период диастолы, так как в период систолы давление в полости левого желудочка превышает перфузионное давление и сосуды, кровоснабжающие миокард, пережимаются. Значительно чаще нарушается кровоснабжение миокарда левого желудочка, испытывающего более высокую нагрузку. ЛЖ преодолевает в систолу давление в аорте в 5 раз выше (120 мм рт.ст.), чем ПЖ в легочной артерии (25 мм рт.ст.). Особенности коронарного кровотока: 1. Высокий уровень экстракции кислорода в капиллярах сердца, составляющий 70-75% (для сравнения: в ткани головного мозга этот показатель составляет 25%, в почках – 10%). 2. Высокий базальный тонус коронарных сосудов, который в состоянии покоя обеспечивает коронарный кровоток на уровне 200-300 мл/мин, что составляет примерно 5% МОС (225 мл). Этот показатель определяется отношением перфузионного давления (разницы между давлением в аорте и правом предсердии) к сопротивлению интрамиокардиальных сосудов. Перфузионное давление в миокарде может понижаться при: - понижении давления в аорте; - окклюзии коронарных сосудов; - достижении предела вазодилатации коронарных сосудов; - синдроме обкрадывния, когда вследствие дилатации коронарных сосудов в здоровых участках миокарда падает перфузионное давление в зоне ишемии миокарда. 3 3. Высокий резерв коронарного кровообращения. Так, при физической нагрузке интенсивность коронарного кровотока может возрастать в 5 – 6 раз, достигая 1225 мл. Т.о., коронарный резерв составляет примерно 1000 мл (1225 мл при нагрузке минус 225 мл в покое). 4. фазовый характер коронарного кровотока. В период систолы он резко понижается (до 15% от общего), а в период систолы он возрастает (до 85% от общего). При тахикардии в результате укорочения диастолы ухудшается кровоснабжение миокарда. 5. Подчиненность коронарного кровотока метаболическим потребностям сердца и относительная независимость его от нервных регуляторных влияний. В условиях патологии эта подчиненность нарушается и повышается чувствительность к нервным импульсам. 6. Исключительно высокая чувствительность коронарных сосудов к понижению напряжения кислорода в крови. 7. Недостаточное развитие коллатеральных сосудов в миокарде. При неблагоприятных условиях коллатерали в сердце не могут компенсировать нарушение коронарного кровотока, поэтому коллатеральное кровообращение миокарда является функционально неполноценным. РЕГУЛЯЦИЯ КОРОНАРНОГО КРОВООБРАЩЕНИЯ 1. Миогенная ауторегуляция, обеспечивающая постоянство коронарного кровотока и его относительную независимость от изменений АД. Основу ее составляет эффект Бейлиса: при растяжении гладко-мышечных клеток коронарных сосудов возрастает сила их сокращения. 2. Метаболическая регуляция, подчиняющая коронарное кровообращение метаболическим потребностям сердца. Тонус коронарных сосудов зависит от соотношения метаболитов, обладающих вазодилататорным и вазоконстрикторным действием. В здоровом миокарде преобладает эффект вазодилататоров. Наиболее мощным вазодилататором является аденозин, образование которого возрастает при гипоксемии. Кроме аденозина, расширяющим сосуды действием обладают синтезируемые эндотелиоцитами оксид азота (NO) и простациклин (ПГI2). К вазодилататорам относятся также молочная кислота, ионы водорода, калия, ПГЕ. 3. Нервная регуляция. Симпатическая нервная система регулирует коронарный кровоток через адренорецепторы двух типов: -АР и -АР. При этом возбуждение 2-АР, преобладающих в коронарных сосудах, вызывает их расширение, а возбуждение 1-АР, расположенных преимущественно в субэпикардиальных сосудах миокарда, вызывает их спазм. Возбуждение холинорецепторов вызывает расширение коронарных сосудов. В регуляции тонуса коронарных сосудов принимают участие также субстанция Р и нейротензин, оказывающие сосудосуживающее действие. Нарушение коронарного кровотока по различным причинам приводит к развитию коронарной недостаточности. 4 КОРОНАРНАЯ НЕДОСТАТОЧНОСТЬ Коронарная недостаточность – это типовая форма патологии сердца, обусловленная несоответствием поступления кислорода к миокарду его метаболическим потребностям. Различают 2 формы коронарной недостаточности: 1. Абсолютную (коронарогенную), обусловленную действием коронарогенных факторов. Она возникает в случае первичного нарушения коронарного кровотока. К коронарогенным факторам относятся: понижение перфузионного давления и увеличение сопротивления коронарных сосудов в случае спазма их или поражения атеросклеротическим процессом. При этом развивается ишемия миокарда. 2. Относительную, возникающую в случае действия некоронарогенных факторов, значительно повышающих энергетические потребности миокарда. К таким факторам относятся: - увеличение числа сердечных сокращений (ЧСС), что наблюдается при повышении содержания в крови и миокарде катехоламинов; - повышение напряжения внутри стенок желудочков сердца (Т). Его величина (по закону Лапласа) определяется отношением произведения давления в полости желудочка (Р) на радиус полости (R) к толщине стенки соответствующего желудочка (L).Напряжение внутри стенок желудочка возрастает при повышении давления в полости желудочка, при дилатации полости, а также при понижении растяжимости стенок желудочка; - повышение сократимости миокарда. При относительной коронарной недостаточности интенсивность коронарного кровотока может возрастать, но все же оказывается недостаточной для возросшей потребности миокарда в кислороде. При ишемии наблюдается уменьшение доставки к миокарду не только кислорода, но и субстратов окисления, возникают антиоксидантный, гормональный и др. виды дефицитов. Кроме того, нарушается отток метаболитов, многие из которых являются токсичными. ОСНОВНЫЕ ФАКТОРЫ РАЗВИТИЯ ИШЕМИИ МИОКАРДА 1. Обтурационный механизм (уменьшение просвета коронарных артерий), причинами которого могут служить: - стенозирующий атеросклероз, который является причиной ишемии в 90% случаев (рис. 1); - тромбоз коронарных артерий (чаще всего является следствием атеросклероза); - эмболия коронарных артерий; - уменьшение просвета коронарных сосудов вследствие увеличения толщины их стенок при отеке (коронариите), гипертрофии гладкомышечных клеток сосудов, артериолосклерозе. 5 Рис. 1. Коронарограмма больного стенозирующим атеросклерозом. Слева стрелкой указано место сужения артерии. Справа - момент спазма коронарной артерии. 2. Ангиоспастический механизм – спазм коронарных сосудов, причинами которого могут служить: - возбуждение 1-АР на фоне блокады 2-АР; - увеличение синтеза вазоконстрикторов: эндотелина-I, ангиотензина-II, тромбоксана А2, серотонина и др. при понижении количества вазодилататоров: оксида азота (NO), простациклина, эндотелийгиперполяризующегофактора (ЭГПФ), брадикинина и др. 3. Компрессионный механизм (сдавление коронарных сосудов рубцами, опухолью). ИШЕМИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА Недостаточность коронарного кровообращения, вызванная окклюзией коронарных артерий сердца) именуется «ишемической болезнью сердца» (ИБС). Этиология ишемической болезни сердца В развитых странах эта болезнь является главной причиной смерти в зрелом возрасте. При ангиографии коронарных сосудов стенозирующий атеросклероз как минимум одной из главных коронарных артерий обнаруживается у 92% страдающих ИБС. Развитию атеросклероза коронарных артерий способствуют следующие факторы риска: 1. Нарушение метаболизма липидов в организме в сочетании с повреждением эндотелия при различных воздействиях: химическом, иммунных комплексов, цитотоксинов, вирусов, липидных перекисей. В месте повреждения эндотелия повышается склонность моноцитов к адгезии с последующим проникновением их в субэндотелий, где они преобразуются в макрофаги, захватывают проникающие туда же модифицированные атерогенные липопротеины низкой плотности (ЛПНП), являющиеся переносчиками эндогенного холестерина в ор6 ганизме. Перенасыщаясь холестерином, они превращаются в «пенистые» клетки и погибают, высвобождая в интиму свободный кристаллизованный холестерин, который формирует ядро атеросклеротической бляшки. Содержание в плазме атерогенных липопротеинов и холестерина при гиперлипидемиях значительно повышено. Моноциты/макрофаги и активированные при повреждении эндотелия тромбоциты выделяют факторы роста, вызывающие пролиферацию гладкомышечных клеток и соединительно-тканных элементов, создающих шапочку атеросклеротической бляшки, выступающую в просвет сосуда. О нарушении метаболизма липидов свидетельствует также понижение содержания в крови антиатерогенных липопротеинов высокой плотности (ЛПВП), которые удаляют из периферических клеток, в том числе, эндотелиоцитов, избыточный холестерин. В практической работе рассчитывают так называемый атерогенный индекс – это отношение содержания в плазме атерогенных ЛП к ЛПВП. При индексе выше 4,9 риск развития атеросклеротического поражения сосудов значительно возрастает. Неблагоприятную роль играет накопление особого ЛП, названного «а-малый» - ЛП (а), который, попадая в эндотелий и макрофаги, стимулирует в них накопление холестерина. 2. Артериальная гипертензия является важным фактором риска коронарного атеросклероза. Повышение АД выше160/90 мм.рт.ст. увеличивает риск развития атеросклероза у мужчин в возрасте 50-59 лет в 3 раза, а у женщин того же возраста – в 6 раз. 3. Курение в 2-6 раз увеличивает риск смерти от ИБС. 4. Избыточное питание, обычно сочетающееся с малоподвижным образом жизни, увеличивает риск возникновения коронарного склероза на 40%. 5. Сахарный диабет часто сопровождается развитием ИБС, к тому же в более раннем возрасте. У половины больных, страдающих при жизни сахарным диабетом, на аутопсии обнаружен тяжелый коронарный атеросклероз. 6. Стрессовые состояния, вызывающие выброс катехоламинов, спазмирующих сосуды, повышающих давление и стимулирующих липолиз с развитием гиперлипидемии. 7. Наследственность. При отягощенном ИБС семейном анамнезе вероятность развития коронарного атеросклероза в 9 раз выше. 8. Длительное применение некоторых синтетических прогестинов с контрацептивными целями у женщин. ПАТОГЕНЕТИЧЕСКИЕ ФАКТОРЫ ИБС 1. Органическая обструкция коронарной артерии атеросклеротическим процессом. При этом резкое ограничение коронарного кровотока обусловлено: - формированием атеросклеротической бляшки, воспалительного и фиброзного процессов в ней и последующим стенозированием артерий, при этом уровень критического стеноза составляет 75%. - формированием агрегатов тромбоцитов и затем тромба в области атеросклеротической бляшки. 2. Динамическая обструкция атеросклеротически измененных коронарных артерий вследствие развития энотелиальной дисфукции. У больных с ИБС ре7 гуляторные механизмы, обеспечивающие коронарную вазодилатацию, нарушаются, а вазоконстрикторные реакции начинают преобладать. Поврежденный эндотелий начинает меньше продуцировать основной вазодилатирующий фактор – NO. Практически все традиционные факторы риска развития ИБС (дислипидемия, артериальная гипертензия, сахарный диабет, курение, менопауза, мутации генов NO-синтазы и др.) четко ассоциированы с нарушением эндотелийзависимой вазодилатации. Главной причиной нарушения вазодилатации является уменьшение количества NO, так как большинство химических факторов, синтезируемых в эндотелии или циркулирующих с кровью, реализуют свое действие через экспрессию синтеза NO.Снижение количества оксида азота происходит как в результате снижения его продукции поврежденным эндотелием, так и ускоренной его деградации под действием свободных радикалов кислорода. Существенную роль в повреждении эндотелия может играть образующийся при реакции NO с супероксидным радикалом высокореактивный оксидант пероксинитрит, вызывающий пероксидацию липидов мембран эндотелиальных клеток. Нарушение продукции оксида азота (NO) способствует прогрессированию атеросклеротического процесса. NO является мультипотентной молекулой, которая ингибирует проникновение моноцитов в субэндотелиальное пространство, дифференциацию их в макрофаги с последующим преобразованием в «пенистые клетки»;тормозит продукцию провоспалительных цитокинов, уменьшает экспрессию молекул адгезии лейкоцитов, тормозит адгезию и агрегацию тромбоцитов и высвобождение из них ростовых факторов, ингибирует пролиферацию и миграцию в интиму гладкомышечных клеток сосудов. Важную роль в ослаблении способности сосудов к вазодилатации играет нарушение продукции эндотелием вазодилатирующего гиперполяризующего фактора, который также является мультипотентной молекулой, вызывающей эффекты, во многом сходные с эффектами оксида азота; а также снижение продукции эндотелием простациклина (ПГI2) – фактора, расширяющего сосуды и тормозящего агрегацию тромбоцитов. Преобладание вазоконстрикции коронарных сосудов, в первую очередь, обусловлено повышением синтеза эндотелиоцитами эндотелина-1, которому присущи следующие свойства: - сосудосуживающее действие (вазоконстрикторный эффект превышает таковой у ангиотензина-II в 10 раз); - стимуляция пролиферации гладкомышечных клеток; - стимуляция адгезии лейкоцитов к поверхности эндотелия; - ингибирование фибринолиза. Продукцию эндотелинов повышают катехоламины, АТ-II, серотонин, ИЛ1, гипоксия, ишемия, трансформирующий фактор роста. Вазоконстрикции коронарных сосудов способствует также активация местной ренин-ангиотензин-альдостероновой системы (РААС), так как эндотелий обладает собственным ангиотензинпревращающим ферментом – химазой, повышающим уровень АТ-II и снижающим количество вазодилататора бради8 кинина. Вазоконстрикцию могут вызывать высвобождаемые активированными тромбоцитами серотонин и тромбоксан А2. 3. Происходит активация прокоагулянтных свойств эндотелия. Этому способствуют следующие обстоятельства: - снижение синтеза эндотелием простациклина и оксида азота уменьшает способность эндотелия препятствовать повышенной адгезии и агрегации тромбоцитов. Активации адгезивно-агрегационной функции тромбоцитов способствует повышенная продукция эндотелием молекул адгезии, в том числе фактора Виллебранда, а также увеличение синтеза мощного проагреганта тромбоксана А2. - активация коагуляционного гемостаза с повышенным образованием нитей фибрина как по внешнему пути вследствие повышения выделения тканевого тромбопластина поврежденным эндотелием, так и по внутреннему механизму вследствие уменьшения синтеза антикоагулянтов тромбомодулина, гепаран-сульфата и протеина S. - понижение активности фибринолитической системы в результате уменьшения продукции эндотелиоцитами тканевого активатора плазминогена (ТПА) при увеличении синтеза ингибитора активатора плазминогена под влиянием цитокинов ИЛ-1 и ФНО, продуцируемых макрофагами в зоне атеросклеротического поражения артерий. Активация механизмов гемостаза с образованием и отложением тромботических масс на поверхности атеросклеротической бляшки приводит к более значительному сужению коронарных артерий, вплоть до критического, или к полной обтурации коронарного сосуда. МЕХАНИЗМЫ ИШЕМИЧЕСКОГО ПОВРЕЖДЕНИЯ МИОКАРДА. 1. Нарушается энергетическое обеспечение миокарда. Ухудшается снабжение миокарда кислородом, что приводит к нарушению образования энергии в митохондриях в связи с падением активности как окисления глюкозы, так и окисления жирных кислот. Накапливаются жирные кислоты, оказывающие детергентное действие на миокард. Неполностью метаболизированные продукты -окисления жирных кислот усиливают разобщение процессов гликолиза и окислительного декарбоксилирования, что еще больше нарушает образование АТФ. В результате содержание АТФ и КФ резко снижается и развивается основной метаболический признак ишемии миокарда – отставание скорости синтеза макроэргических соединений от потребности в них миокарда. Известно, что через несколько секунд после развития тотальной ишемии миокарда запасы КФ истощаются полностью, а через 40 мин запасы АТФ уменьшаются на 90%. Вследствие потери кардиомиоцитами изоэнзимов КФК нарушается транспорт АТФ к местам ее утилизации. 2. Нарушается электролитный баланс в кардиомиоцитах, что обусловлено нарушением энергетического обеспечения работы ионных насосов. В клетках миокарда накапливаются ионы натрия, вызывающие набухание клеток, а также ионы кальция, что приводит к развитию контрактуры сократительных клеток, понижению растяжимости миокарда, повышению напряжения в стенке миокар9 да, и, следовательно, повышению потребности миокарда в кислороде (замыкается порочный круг). 3. Повышенное содержание кальция в кардиомиоцитах активирует перекисное окисление липидов (ПОЛ) и фосфолипазы, повреждающие митохондрии и цитоплазматическую мембрану кардиомиоцитов. 4. Вследствие накопления лактата развивается метаболический ацидоз, активирующий лизосомальные гидролазы, повреждающие клетки миокарда. Кроме того, ионы водорода начинают конкурировать с кальцием за места связывания на тропонине, что угнетает сократительную функцию сердечной мышцы. 5. После восстановления коронарного кровотока (снятие спазма коронарных сосудов, лизирование тромба и т.д.) может развиться реперфузионное повреждение миокарда (см. метод. пособие «Молекулярные механизмы повреждения клеток». КЛИНИЧЕСКИЕ ФОРМЫ ИБС 1. Внезапная коронарная смерть (первичная остановка сердца) 2.Стенокардия 2.1.Стенокардия напряжения 2.2.Спонтанная стенокардия (стенокардия покоя) 3. Инфаркт миокарда 4. Постинфарктный кардиосклероз 5. Нарушения сердечного ритма (с указанием формы) 6. Сердечная недостаточность (с указанием формы и стадии). В настоящее время выделяют такие новые ишемические синдромы, как: «гибернация» миокарда, «оглушение» миокарда. Гибернирующий («спящий») миокард – это локальное снижение сократительной способности миокарда левого желудочка, вызванное его длительной гипоперфузией, которое полностью или частично ликвидируется после улучшения коронарного кровотока. Этот синдром характеризуется следующими особенностями: коронарный кровоток хронически снижен; отмечается хроническое нарушение сократительной функции миокарда в участках со сниженным миокардиальным кровотоком; жизнеспособность миокарда сохранена; продолжительность состояния гибернации от нескольких дней до нескольких месяцев и даже лет. Гибернация миокарда является приспособительной реакцией в ответ на хроническое снижение коронарного кровотока. Функция миокарда снижается, благодаря чему достигается равновесие между потребностью миокарда в кислороде и доставкой его с кровью. Описаны особенности метаболизма в миокарде при его гибернации. Вначале (приблизительно через первые 10 мин после развития ишемии) в клетках миокарда снижается содержание АТФ и креатинфосфата, кардиомиоциты переходят на анаэробный метаболизм, при этом в миокарде накапливается молочная кислота. При продолжающемся ограничении коронарного кровотока примерно через час анаэробный метаболизм постепенно уменьшается и прекращается, уровень креатинфосфата восстанавливается, а содержание АТФ далее прогрессивно не снижается. Гибернация миокарда вы10 является у 25-80% больных ИБС. Этот синдром может быть причиной рефрактерности к лечебным мероприятиям при сердечной недостаточности. Радикадьный метод лечения этого состояния – хирургическая реваскуляризация. «Оглушенный» миокард – это состояние, которое сохраняется после реперфузии миокарда несмотря на восстановление коронарного кровотока и отсутствие необратимых изменений в миокарде. Этот феномен может развиться у больных с нестабильной стенокардией; при раннем применении тромболитиков в остром периоде инфаркта миокарда; при хранении донорского сердца перед его трансплантацией; при наложении дистальных анастомозов во время аортокоронарного шунтирования. Патогенез этого состояния до конца не выяснен. В настоящее время существуют две популярные гипотезы, объясняющие механизм возникновения этого феномена: «кальциевая» гипотеза и «свободнорадикальная» гипотеза. Согласно «кальциевой» гипотезе имеют значение следующие механизмы: снижение чувствительности миокардиальных волокон к кальцию; перегрузка клеток миокарда кальцием; разобщение процессов возбуждения и сокращения вследствие нарушения функции саркоплазматического ретикулума; активация протеинкиназ, фосфолипаз и других катаболических ферментов. В соответствии со свободнорадикальной гипотезой «оглушение» миокарда вызывают свободные радикалы, образующиеся в начале реперфузии. Доказательством может служить положительный эффект применения антиоксидантов (СОД, каталаза), максимально выраженный при назначении их в первые минуты реперфузии. ОСТРЫЙ ИНФАРКТ МИОКАРДА Инфаркт миокарда – одна из клинических форм ишемической болезни сердца, характеризующаяся развитием локального (ограниченного) некроза миокарда вследствие остро возникшего несоответствия коронарного кровотока потребностям миокарда. Инфаркт миокарда (ИМ) является одним из наиболее частых проявлений ИБС и одной из наиболее частых причин смерти в развитых странах, причем около половины смертельных исходов приходится на первый час от начала заболевания. Заболеваемость ИМ значительно увеличивается с возрастом. В молодом и среднем возрасте мужчины болеют им значительно чаще женщин. У женщин в возрасте до 60 лет ИМ встречается в 4 раза реже, чем у мужчин. После наступления менопаузы различия в заболеваемости ИМ среди женщин и мужчин постепенно уменьшаются, а с 70-летнего возраста исчезают. Факторы риска развития ИМ полностью идентичны факторам риска ИБС. Уменьшение частоты развития ИМ обусловлено в первую очередь борьбой с такими факторами риска, как гиперхолестеринемия, артериальная гипертензия, курение. Основной причиной ИМ является атеросклероз коронарных артерий и развивающийся на этом фоне тромбоз артерии с развитием острой ишемии участка миокарда. Выраженный атеросклероз коронарных артерий обнаруживается у 95% больных, умерших от ИМ. У большинства больных (50-70%) отмечается стенозирующий атеросклероз 2-3 магистральных коронарных артерий, при 11 этом просвет артерий уменьшается более, чем на 75%. Примерно в 1,5-7% всех случаев ИМ причиной его развития является неатеросклеротическое поражение коронарных артерий: артерииты различной этиологии, травмы, амилоидоз, тромбоз in situ при тромбофилиях, врожденные аномалии коронарных артерий т.д.). В этих случаях ИМ является синдромом других заболеваний сердца и коронарных артерий, а не самостоятельной нозологической единицей. ПАТОГЕНЕЗ ИНФАРКТА МИОКАРДА Основой развития ИМ является патофизиологическая триада, включающая разрыв (надрыв) атеросклеротической бляшки, тромбоз и вазоконстрикцию. В большинстве случаев ИМ развивается при внезапно наступившем резком уменьшении коронарного кровотока вследствие тромботической окклюзии коронарной артерии, просвет которой значительно сужен предшествующим атеросклеротическим процессом. При внезапном полном закрытии просвета коронароной артерии тромбом в условиях отсутствия или недостаточного развития коллатералей развивается трансмуральный ИМ. При интермиттирующей тромботической окклюзии коронарной артерии (вследствие спонтанного или терапевтического тромболизиса) и существовавших ранее коллатералях формируется нетрансмуральный ИМ. В этом случае некроз располагается чаще всего в субэндокардиальных отделах или в толще миокарда, не достигая эпикарда. Нестабильность («уязвимость») атеросклеротической бляшки обусловлена развитием в ней асептического воспаления. Мощным стимулятором этого воспаления являются поступающие в бляшку модифицированные ЛПНП. Воспаление протекает при участии макрофагов и Т-лимфоцитов. Активированные Т-лимфоцитами макрофаги выделяют большое количество протеолитических ферментов (коллагеназа, желатиназа и др.), которые разрушают коллагеновые структуры фиброзной покрышки и резко снижают ее прочность. Под влиянием гамма-интерферона, выделяемого Т-лимфоцитами, уменьшается синтез коллагена, что также снижает прочность покрышки бляшки. Факторами дестабилизации бляшки могут служить такие факторы, как значительное повышение артериального давления, интенсивная физическая нагрузка. Разрыв (надрыв) или эрозия атеросклеротической бляшки активируют механизмы гемостаза с образованием тромба . Выделяют два типа тромбоза коронарных артерий при ИМ. Первый тип тромбоза развивается в 25% случаев – тромб формируется на поверхности атеросклеротической бляшки, выступающей в просвет сосуда, при ее поверхностном повреждении. В результате повреждения эндотелия происходит адгезия тромбоцитов при взаимодействии ГП-Ib на мембране активированных тромбоцитов с фактором Виллебранда – молекулой адгезии, продуцируемой эндотелиоцитами при их повреждении. Затем идет процесс агрегации тромбоцитов (соединение соседних тромбоцитов молекулами фибриногена, взаимодействующими с экспрессированными на мембране тромбоцитов ГП IIb/IIIa), выделение из тромбоцитов и других клеток стимуляторов агрегации (АДФ, тромбоксана А2, тромбина и т.д.), выделение медиаторов, вызывающих коронароспазм, и формирование тромба. Второй тип тромбоза наблюдается у 75% 12 больных и обусловлен разрывом бляшки, в результате чего кровь проникает внутрь бляшки, где взаимодействует с тканевым тромбопластином и коллагеном. Тромб вначале формируется внутри бляшки, заполняя ее объем, а затем распространяется в просвет сосуда. Рис 2. Патогенез острого инфаркта миокарда 13 В обтурации коронарной артерии огромную роль играет коронароспазм. Развитие его обусловлено дисфункцией эндотелия, которая приводит к снижению продукции вазодилататоров (оксида азота, простациклина, адреномедуллина, гиперполяризующего фактора) и значительному увеличению синтеза вазоконстрикторов (эндотелина, ангиотензина-II, серотонина, тромбоксана А2). Спазм увеличивает степень обструкции коронарной артерии, вызванной бляшкой и тромбом, и приводит к окклюзирующей обструкции, вызывающей некроз миокарда. ИМ является стрессовой реакцией, активирующей симпатоадреналовую систему. Выброс в кровь избытка катехоламинов повышает потребность миокарда в кислороде, способствует прогрессированию некроза. Кроме того, катехоламины усиливают агрегацию тромбоцитов и выделение вазоконстриктора тромбоксана А2. Большое значение в патогенезе ИМ имеет степень компенсации нарушенного коронарного кровотока коллатеральным кровообращением. Так, медленно развивающееся стенозирование эпикардиальных артерий может не приводить к развитию ИМ при хорошо развитой коллатеральной сосудистой сети в миокарде. Функциональная неполноценность коллатерального кровотока, как один из патогенетических механизмов, имеет большое значение у большинства молодых больных с недостаточным развитием у них коронарных анастомозов. Существенная роль в развитии ИМ принадлежит недостаточному ангиогенезу. НАРУШЕНИЕ ФУНКЦИЙ СЕРДЦА ПРИ ИНФАРКТЕ МИОКАРДА Развитие ИМ сопровождается нарушением систолической и диастолической функций сердца и ремоделированием левого желудочка. Степень выраженности этих изменений прямо пропорциональна величине зоны некроза сердечной мышцы. Происходит нарушение сократительной функции, т.к. некротизированный участок миокарда не участвует в сокращении сердца. Вскоре после развития ИМ в непораженной близлежащей зоне может наблюдаться гиперкинезия. Она обусловлена компенсаторными механизмами, включающими ативацию симпатической нервной системы и механизм Франка-Старлинга. Компенсаторная гиперкинезия миокарда постепенно снижается в течение 9-14 дней от начала ИМ. У некоторых больных уже в первые дни наблюдается снижение сократительной функции миокарда в периинфарктной зоне. Это может быть обусловлено предшествующей инфаркту обструкцией коронарной артерии, снабжающей кровью неинфарктные зоны миокарда левого желудочка, и недостаточно развитым коллатеральным кровотоком. При формировании острой аневризмы сердца может развиться парадоксальная пульсация – перемещение части крови во время систолы из левого желудочка в выбухающий аневризматический мешок, что ухудшает гемодинамику. Может также отмечаться замедление процессов сокращения по сравнению с неповрежденным миокардом (диссинхрония). Снижение фракции выброса (основного показателя нарушения систолической функции) происходит при нарушении сократимости более 10% массы миокарда. При нарушении сократимости более 15% массы миокарда наблюдается повышение конечно-диастолического объема (КДО) и давления (КДД) ле14 вого желудочка. При некрозе более 25% массы миокарда развивается левожелудочковая недостаточность, а при некрозе более 40% массы миокарда левого желудочка – кардиогенный шок. Нарушение диастолической функции сердца обусловлено снижением эластичности и растяжимости миокарда, что объясняется замедленным переходом ионов кальция из миофибрилл в саркоплазматический ретикулум в связи с дефицитом энергетических субстратов. В результате этого диастола левого желудочка становится неполноценной, т.к. миокард недостаточно релаксирует, вследствие чего повышается конечное диастолическое давление (КДД) и ухудшается коронарный кровоток. Нарушение диастолической функции наблюдается при поражении менее 10% массы миокарда левого желудочка. Ремоделирование левого желудочка заключается в растяжении миокарда как в области зоны некроза, так и в непораженных, жизнеспособных участках (т.е.развивается дилатация миокарда левого желудочка). Данный патологический процесс наиболее выражен при трансмуральном ИМ и обусловлен следующими факторами: истончением миокарда в зоне некроза; снижением тонуса миокарда в области некроза и в периинфарктной зоне; развитием состояния гибернации в периинфарктной зоне, активациеей циркулирующей и местной (кардиальной) РААС; активацией симпатоадреналовой системы; гиперпродукцией эндотелием эндотелина. Под влиянием указанных нейрогуморальных стимуляторов активируются факторы роста, повышается внутриклеточный синтез протоонкогенов, факторов ядерной транскрипции, что сопровождается гипертрофией кардиомиоцитов. При обширном трансмуральном некрозе ремоделирование миокарда развивается уже через 24 часа от начала инфаркта и может сохраняться несколько недель и даже месяцев. КЛИНИЧЕСКАЯ КАРТИНА ИНФАРКТА МИОКАРДА В клиническом течении ИМ выделяют 5 периодов: 1. Продромальный (прединфарктный) 2. Острейший период 3. Острый период 4. Подострый период 5. Постинфарктный период Продромальный (прединфарктный) период характеризуется нарастанием тяжести коронарной недостаточности, предшествующей развитию ИМ. Этот период может продолжаться от нескольких часов до одного месяца. Он наблюдается у 70-80% больных и протекает в виде одного из вариантов нестабильной стенокардии. Наиболее частым вариантом этого периода следует считать прогрессирующую стенокардию, т.е. речь идет о нарастании тяжести уже имеющейся стабильной стенокардии. Основными проявлениями этого периода являются: увеличение интенсивности и продолжительности загрудинных болей; расширение зоны распространения боли и области иррадиации боли; прогрессирующее снижение толерантности к физическим нагрузкам; резкое снижение эффективности нитроглицерина, принимаемого сублингвально; присоединение 15 к стенокардии напряжения стенокардии покоя; появление новых симптомов (одышка, нарушение ритма сердца, общая слабость, потливость). Острейший период – это период от момента возникновения ишемии миокарда до начала формирования очага некроза. Длительность острейшего периода колеблется от 30 мин до 2 ч. Развитию этого периода способствуют следующие провоцирующие факторы: интенсивная физическая нагрузка; стрессовая ситуация; переедание; выраженное переохлаждение или перегревание. Указанные факторы увеличивают потребность миокарда в кислороде, повышают АД, вызывают коронароспазм. Самым характерным клиническим признаком острейшего ИМ является болевой синдром, обладающий следующими характеристиками: у большинства больных боли чрезвычайно интенсивные, локализуются в загрудинной области, часто захватывают прекардиальную или всю переднюю поверхность грудной клетки; иррадиируют в левые руку, плечо и лопатку, в межлопаточную область, шею, нижнюю челюсть, ухо, глотку; продолжительность боли всегда больше 20-30 мин, иногда несколько часов; купируются наркотическими аналгетиками (введением морфина в/венно), использованием нейролептаналгезии, наркоза закисью азота. Во время болевого приступа больные испытывают чувство страха смерти, обреченности, тоски, могут быть беспокойны, возбуждены (развивается Status anginosus). Развитие болевого синдрома связывают с действием следующих факторов: а) понижением порога болевой чувствительности; б) острой дилатацией сердца; в) увеличением концентрации внеклеточного калия из-за потери его кардиомиоцитами; г) повышением концентрации таких медиаторов, как брадикинин, субстанция Р, серотонин, аденозин, гистамин и др.; д) развитием метаболического ацидоза. Однако до конца механизмы развития болевого синдрома еще не изучены. Очень велик диапазон степени выраженности боли – от незначительной у небольшого числа больных до чрезвычайно интенсивной у большинства больных. При этом локализация поражения миокарда, его распространенность и другие характеристики могут быть очень сходными. Кроме того, иногда (при атипичном течении) развивается безболевая форма ИМ. При осмотре обращают на себя внимание бледность, влажность кожи, цианоз губ, носа, ушей, подногтевых пространств. Развивающаяся в первые минуты брадикардия сменяется тахикардией. АД в первые минуты (иногда часы) повышается, а затем развивается гипотония со снижением систолического и пульсового давления. Характерно ослабление I тона над верхушкой сердца. В течение острого периода окончательно формируется очаг некроза с миомаляцией. Он продолжается от 2 до 10-14 дней. В остром периоде, как правило, исчезает боль. Сохранение боли может быть связано с расширением зоны некроза при прогрессирующем ИМ, увеличением периинфарктной ишемической зоны или присоединением фибринозного перикардита. При исследовании сердечно-сосудистой системы определяется учащенный пульс, сохраняется тенденция к снижению АД, тоны сердца приглушены, прослушивается систолический шум на верхушке. При обширном переднем трансмуральном ИМ про- 16 слушивается шум трения перикарда в зоне абсолютной тупости сердца, что обусловлено развитием фибринозного перикардита. Характерным для этого периода является развитие резорбционнонекротического синдрома со следующими признаками: 1) повышением температуры тела; 2) лейкоцитозом; 3) увеличением СОЭ; 4) обнаружением «биохимических признаков воспаления»; 5) появлением в крови биохимических маркеров гибели кардиомиоцитов. Субфебрильная температура отмечается на 2-3 день. Длительность повышения температуры составляет около 3-7 дней. Развитие нейтрофильного лейкоцитоза со сдвигом формулы влево обусловлено развитием ответа острой фазы. Лейкоцитоз развивается через 3-4 часа, достигает максимума на 2-4-ый день и сохраняется около 3-7 дней. Увеличение СОЭ отмечается со 2-3 дня, достигает максимума между 8-12 днями, затем постепенно снижается и через 3-4 недели нормализуется. Характерным для ИМ считается феномен «ножниц» между лейкоцитозом и СОЭ: в конце 1-ой – начале 2-ой недели количество лейкоцитов начинает снижаться, а СОЭ возрастает. В организме развивается ООФ, что подтверждается повышением содержания в крови медиаторов и белков ООФ. В крови появляются биохимические маркеры гибели кардиомиоцитов (см.раздел: Лабораторная диагностика). Подострый период характеризуется полным замещением некротических масс грануляционной тканью и соответствует времени формирования соединительнотканного рубца на месте очага некроза. При неосложненном течении ИМ подострый период продолжается от 6 до 8 недель. Общее состояние больного удовлетворительное, болевой синдром отсутствует. При исследовании сердечно-сосудистой системы выявляется нормализация ЧСС, АД, исчезновение систолического шума в области верхушки сердца. В подостром периоде исчезают проявления резорбционно-некротического синдрома. Постинфарктный период (период постинфарктного кардиосклероза) соответствует периоду полной консолидации рубца в очаге некроза и адаптации сердечно-сосудистой системы к новым условиям функционирования – выключению сократительной функции участка миокарда. Этот период продолжается на протяжении всей оставшейся жизни больного. Выделяют ближайший (2-6 месяцев) и отдаленный (после 6 месяцев) постинфарктный период. У большинства больных боли в области сердца отсутствуют. Однако нередко в дальнейшем вновь возобновляется стенокардия, которая беспокоила больного до развития ИМ. ЛАБОРАТОРНАЯ ДИАГНОСТИКА ИНФАРКТА МИОКАРДА 1. Данные лабораторного исследования периферической крови: нейтрофильный лейкоцитоз со сдвигом лейкоцитарной формулы влево, эозинопения, лимфопения, повышение СОЭ. 2. Данные биохимического исследования крови: - повышается содержание С-реактивного белка, гаптоглобина, ИЛ-1, ФНО вследствие развития ООФ; 17 - возрастает содержание глюкозы (активируется симпатическая нервная система и в крови повышается содержание адреналина); - развивается метаболический ацидоз (в крови накапливается молочная кислота, ионы водорода); - повышается содержание фибриногена, растет протромбиновый индекс, сокращается время свертывания (активируются механизмы гемостаза, возможно развитие ДВС-синдрома ); - развивается гиперкалиемия. 3. Определение содержания в крови биохимических маркеров гибели кардиомиоцитов. При ИМ из очага некроза в кровь поступает ряд белковых молекул – компонентов мышечных волокон (рис. 3). Рис. 3. Динамика гиперферментемии при инфаркте миокарда. Первым возрастает уровень в крови миоглобина, представляющего собой легкую цепь миозина. Повышение содержания миоглобина в крови начинается уже через 2 ч от начала развития некроза; максимальный уровень его наблюдается через 6–10 ч; длительность повышения содержания миоглобина в крови составляет около 2 суток. Специфичность определения высокого уровня миоглобина в крови при ИМ составляет 77-95% в первые 6 ч. Уровень миоглобина в крови может возрастать при ИМ в 10-20 раз. Повышается содержание в крови тропонинов Т и I. Чрезвычайно важно, что эти тропонины содержатся в миокарде в изоформах, структура молекул которых отличается от молекул этих белков в скелетных и гладких мышцах. В связи с этим определение содержания в крови только кардиальных тропонинов Т и I (с помощью моноклональных антител) является высокоспецифичным тестом для выявления некроза миокарда (специфичность составляет 90-100%). Возрастает активность общей кретинфосфокиназы и ее изоферментов. Известны три изофермента: КФК-ММ (мышечный), КФК-МВ (сердечный) и КФК-ВВ (мозговой). Повышение уровня в крови КФК-МВ считается высокоспецифичным для ИМ. 18 Происходит повышение активности в крови лактатдегидрогеназы (ЛДГ) и ее изоформ. В связи с отсутствием кардиоспецифичности общей ЛДГ предпочтение следует отдавать определению активности в крови уровня ЛДГ-1, т.к. миокард богат этим ферментом. Возрастает содержание в крови аспартатаминотрансферазы (АСТ) через 68 ч, максимум повышения наблюдается через 24-36 ч, при этом в период максимума уровень активности этого фермента превышает нормальный в 4-20 раз! Учитывая, что активность АСТ повышается и при других заболеваниях, в частности, при патологии печени, целесообразно определять одновременно активность в крови АСТ и АЛТ (содержание которой в печени значительно больше, чем в миокарде) и рассчитывать коэффициент де Ритиса (соотношение АСТ/АЛТ), который в норме составляет 1,33. При ИМ этот коэффициент превышает нормальную величину. ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ ЭКГ-диагностика ИМ. ЭКГ при ИМ формируется под влиянием трех зон, образующихся в миокарде: зоны некроза, зоны ишемического повреждения и зоны ишемии. В зоне некроза происходит гибель кардиомиоцитов, в результате чего нарушается процесс деполяризации миокарда желудочка и изменяется форма желудочкового комплекса QRS. Кардинальным признаком некроза является появление патологического зубца Q (ширина его превышает 0,03 с; а глубина больше ¼ амплитуды зубца R в том же отведении). Его появление обусловлено отсутствием вектора ЭДС процесса деполяризации в зоне некроза под активным положительным электродом. При нетрансмуральном инфаркте миокарда направление вектора деполяризации в противоположную активному электроду сторону приводит к углублению зубца Q, приобретению им характеристик патологического. Процесс деполяризации в сохранившемся под активным электродом миокарде приведет к формированию зубца R, амплитуда которого будет меньше, чем на более ранних (до развития ИМ) ЭКГ. Желудочковый комплекс приобретает форму типа QR, либо Qr. При трансмуральном ИМ зубец R в желудочковом комплексе не регистрируется вовсе вследствие прекращения процесса деполяризации под активным электродом на всем протяжении (от эндокарда до перикарда) что приведет к формированию желудочкового комплекса типа QS. Зона ишемического повреждения отражается на ЭКГ смещением интервала ST от изолинии либо кверху, либо книзу. В норме ST находится на изолинии, т.к. вся поверхность деполяризованного миокарда заряжена отрицательно и ЭДС равна нулю. Зона повреждения в результате гибели части кардиомиоцитов становится заряженной менее отрицательно (относительно положительно) по сравнению с окружающими участками миокарда. Т.о., вследствие возникающей разности потенциалов формируется ЭДС тока повреждения, вектор которой направлен всегда от (-) заряда к (+). При субэндокардиальной зоне повреждения интервала ST будет смещаться книзу от изолинии (депрессия ST), при субэпикардиальной либо трансмуральной – кверху (элевация ST). 19 Рис. 4. Типовые измения ЭКГ при инфаркте миокарда Зона ишемии вследствие замедления процесса реполяризации отражается на ЭКГ появлением «коронарного» зубца Т: положительного, высокого, симметричного, с заостренной вершиной - при субэндокардиальной ишемии и отрицательного, глубокого, симметричного – при субэпикардиальной или трансмуральной ишемии. Отрицательный «коронарный» зубец Т появляется вследствие изменения направления процесса реполяризации, который идет в этом случае от эндокарда к эпикарду ( нормальное его направление – от эпикарда к эндокарду). Острейшая стадия характеризуется появлением на ЭКГ куполообразного смещения интервала ST выше изолинии и слиянием его с зубцом Т (формируется монофазная кривая). На этой стадии может сформироваться некроз, что проявится патологическим зубцом Q. В острой стадии ИМ присутствуют все три зоны поражения, что отражается наличием на ЭКГ патологического зубца Q или QS, уменьшением амплитуды зубца R, куполообразным смещением интервала ST кверху от изолиии и отрицательным «коронарным» зубцом Т. Подострая стадия ИМ характеризуется следующими ЭКГ-признаками: наличием патологического зубца Q или QS, возвращением интервала ST к изолинии вследствие исчезновения зоны ишемического повреждения и отрицательным «коронарным» зубцом Т. В начале подострой стадии глубина отрицательного зубца Т увеличивается, что обусловлено переходом части мышечных волокон из состояния повреждения в состояние ишемии. Важнейшей особенностью острейшего, острого и подострого периодов ИМ являются дискордантные (реципрокные) изменения ЭКГ (в отведениях, отражающих противоположные по отношению к локализа20 ции инфаркта отделы миокарда, будет регистрироваться не элевация, а депрессия интервала ST, и будет формироваться не отрицательный «коронарный» зубец Т, а высокий положительный зубец Т. Рубцовая стадия характеризуется следующими ЭКГ-признаками: сохранением патологического зубца Q или QS (признака соединительнотканного рубца на месте некроза миокарда), который может наблюдаться на протяжении всей жизни больного ( глубина и ширина их постепенно могут уменьшаться, что объясняется стягиванием неповрежденных участков миокарда рубцовой тканью); расположением интервала ST на изолинии; отсутствием динамики изменений зубца Т, который может быть слабоотрицательным, сглаженным (изоэлектричным) или слабоположительным. Локализация ИМ устанавливается по обнаружению указанных ЭКГпризнаков в соответствующих отведениях. Дополнительные инструментальные методы диагностики Неинвазивные методы: 1) компъютерная томография, позволяющая обнаружить зоны ИМ, ишемии, тромбов, проходимость сосудов и т.д.; 2) эхокардиография, которая позволяет оценить функцию желудочков: а) систолическую – по скорости укорочения циркулярных волокон, передне-заднего размера желудочков; б) диастолическую – по скорости утончения стенки желудочков в диастолу, определить КДО, КДД, МО и т.д.; 3) фонокардиография + ЭКГ + сфигмограмма (проводится их сопоставление с целью оценки функции левого желудочка); 4) радиоизотопные методы с использованием меченых ионов таллия201, технеция-99 и др., позволяющие оценить перфузию миокарда (захват меченых ионов нормальными клетками пропорционален интенсивности кровотока, а «холодные» зоны – это зоны с нарушенной перфузией; 5) ядерномагнитный резонанс (ЯМР) и др. Инвазивные: 1) катетеризация полостей сердца; 2) ангиография с введением рентгеноконтрастных веществ и др. ОСЛОЖНЕНИЯ ИНФАРКТА МИОКАРДА Ранние осложнения: аритмии, острая левожелудочковая недостаточность с развитием отека легких, кардиогенный шок. Кардиогенный шок – крайняя степень левожелудочковой недостаточности, характеризующаяся резким снижением сократительной функции миокарда. Кардиогенный шок развивается примерно у 20% больных с ИМ. Выделяют следующие формы кардиогенного шока: рефлекторный; истинный кардиогенный; ареактивный; аритмический; из-за разрыва миокарда. Истинный кардиогенный шок, как правило, развивается при обширном трансмуральном ИМ, при величине зоны некроза равной или превышающей 40% массы миокарда левого желудочка. Основным патогенетическим фактором является снижение сократительной функции миокарда. Большую роль в снижении сократительной функции миокарда играет процесс его ремоделирования. При кардиогенном шоке развивается порочный круг, который усугубляет течение этого грозного осложнения. Начинается этот механизм с резкого сни21 жения систолической и диастолической функций миокарда левого желудочка. Выраженное падение ударного объема приводит к снижению давления в аорте и уменьшению коронарного перфузионного давления и, следовательно, к уменьшению коронарного кровотока, что еще больше нарушает функции миокарда. Острая левожелудочковая недостаточность. Основным патогенетическим фактором является снижение сократительной способности (систолическая дисфункция) и уменьшение податливости (диастолическая дисфункция) миокарда левого желудочка, что приводит к повышению давления в левом предсердии, а затем в сосудах малого круга. В ответ на рост давления в левом предсердии происходит спазмирование легочных артериол (рефлекс Китаева), что вначале в определенной мере предохраняет от переполнения малый круг, а в последующем усугубляет гипертензию в сосудах легких. Когда гидростатическое давление и легочных капиллярах начинает превышать коллоидноосмотическое, происходит пропотевание плазмы и скопление жидкости вначале в интерстиции легких, а затем в альвеолах. Возникает отек легких. Аритмии. Нарушения сердечного ритма и проводимости являются практически постоянным осложнением крупноочагового ИМ. Основными механизмами развития аритмий у больных ИМ являются: а) изменение электрофизиологических свойств миокарда в области поражения; б) электрическая негомогенность миокарда; в) появление эктопических очагов, потеря электрической стабильности; г) электролитный дисбаланс в миокарде (потеря кардиомиоцитами калия, магния, повышение уровня калия во внеклеточной среде); д) гиперкатехоламинемия; е) острая дилатация миокарда; ж) развитие феномена re-entry и высокая спонтанная диастолическая поляризация. Единичные циклы эктопического возбуждения или круговой волны приводят к экстрасистолии; длительный период деятельности эктопического очага или циркуляции круговой волны по миокарду приводят к развитию пароксизмальной тахикардии, трепетанию и мерцанию предсердий. Серьезное прогностическое значение имеет развитие мерцательной аритмии (особенно тахисистолической формы), которая вследствие ухудшения коронарного кровотока при укорочении диастолы усугубляет нарушение сократительной способности миокарда; кроме того, в результате уменьшения вклада левого предсердия в диастолическое наполнение левого желудочка, еще больше понижается сердечный выброс. Наиболее опасна ранняя фибрилляция желудочков (хаотическое подергивание отдельных волокон миокарда, отсутствие координированного сокращения желудочков), которая является основной причиной смерти больных ИМ. Поздние осложнения: 1. Формирование аневризмы сердца (происходит в 12-15% трансмурального ИМ). 2. Разрывы сердца: наружные, межжелудочковой перегородки; отрыв сосочковой мышцы с развитием недостаточности митрального клапана. 3. Тромбоэмболии, которые развиваются примерно у 1/10 перенесших ИМ (первое место занимает тромбоэмболия легочной артерии – ТЭЛА). 22 4. Постинфарктный аутоиммунный синдром Дресслера. Некроз миокарда, а также изменения в периинфарктной зоне приводят к появлению кардиальных аутоантигенов с последующим образованием аутоантител, усиливающих повреждение миокарда. Этот синдром развивается приблизительно у 34% больных на 2-8 неделе от начала ИМ. 1. - 2. 3. 4. 5. 6. 7. 8. 9. ПРИНЦИПЫ ПАТОГЕНЕТИЧЕСКОЙ ТЕРАПИИ ИНФАРКТА МИОКАРДА Купирование болевого синдрома: Обезболивание с помощью наркотических анальгетиков. Метод атаралгезии – сочетанного введения анальгетических и траквилизирующих средств (седуксена, реланиума), который применяется при интенсивном болевом синдроме, сопровождающемся выраженным возбуждением, чувством страха, внутреннего напряжения. Нейролептанальгезия, которая является наиболее эффективным методом обезболивания при ИМ. Испльзуется сочетанное внутривенное введение анальгетика фентанила и нейролептика дроперидола. Наркоз закисью азота, который применяется при непереносимости нейролептанальгезии и наркотических анальгетиков. Назначение нитратов, прежде всего нитроглицерина, с целью расширения коронарных сосудов, что способствует ослаблению болевого синдрома, а также снижению преднагрузки благодаря венодилатации. Оксигенотерапия. Ингаляция кислорода рекомендуется всем больным ИМ, особенно при болях, цианозе, одышке, левожелудочковой недостаточности, кардиогенном шоке. Более целесообразны ингаляции увлажненного кислорода. Тромболитическая терапия с целью восстановления магистрального коронарного кровотока. В связи с тем, что в большинстве случаев причиной развития ИМ является тромбоз пораженной атеросклеротическим процессом коронарной артерии, тромболитическая терапия, проведенная в первые 6 ч (до консолидации тромба) показана всем больным ИМ. Предупреждение тромбообразования. С этой целью назначают антикоагулянты (гепарин, гирудин) и антиагреганты (аспирин, тиклопидин). Понижение потребности миокарда в кислороде: уменьшение напряжения стенки желудочков (-адреноблокаторы, нитраты); уменьшение числа и силы сердечных сокращений (-адреноблокаторы); понижение пред- и постнагрузки с целью уменьшения производимой сердцем работы (ингибиторы АПФ и вазодилататоры). Ограничение размеров ИМ, что достигается путем ранней реваскуляризации с помощью тромболитической терапии и назначения периферических вазодилататоров, -адреноблокаторов, антагонистов кальция (дилтиазем), а также хирургических методов (чрескожной транслюминальной коронарной ангиопластики, аорто-коронарного шунтирования). Предупреждение опасных для жизни аритмий. В целях профилактики фибрилляции желудочков и других опасных аритмий применяют адреноблокаторы и магния сульфат. Лечение метаболическими кардиопротекрорами, которые улучшают метаболические процессы в миокарде, способствуют уменьшению зоны ишемии при ИМ, улучшают функциональное состояние миокарда. 23 1. 2. 3. 4. 5. 6. 7. РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА Основная литература Патологическая физиология (под редакцией А.Д. Адо, М.А. Адо, В.И. Пыцкого, Г.В. Порядина, Ю.А. Владимирова), Москва, 2000. Дополнительная литература Болезни сердца, И.С. Моисеев, А.В. Сумароков, Москва, 2001 Клиническая патофизиология, В.А. Алмазов, Н.Н. Петрищев и др., Москва, 1999 Лечение болезней внутренних органов, А.Н. Окороков, Москва, 2002 Диагностика внутренних органов, А.Н. Окороков, Москва, 2002 Тромбозы в кардиологии, Е.П. Панченко, А.Б. Добровольский, Москва, 1999 Электрокардиография, В.В. Мурашко, А.В. Струтынский, Москва, 1991 ОГЛАВЛЕНИЕ Характеристика коронарного кровотока Регуляция коронарного кровотока Коронарная недостаточность Патогенетические факторы развития ишемии миокарда ИБС (Определение, этиологические факторы) Патогенетические факторы ИБС Механизмы ишемического повреждения миокарда Клинические формы ИБС Инфаркт миокарда (Определение, этиологические факторы) Патогенез ИМ Нарушение функций сердца при ИМ Клиническая картина ИМ Лабораторная диагностика ИМ Инструментальные исследования Осложнения ИМ Принципы патогенетической терапии острого ИМ Рекомендуемая литература ПАТОЛОГИЯ СЕРДЕЧНО-СОСУДИСТОЙСИСТЕМЫ. ЧАСТЬ II. КОРОНАРНАЯ НЕДОСТАТОЧНОСТЬ ИШЕМИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА ИНФАРКТ МИОКАРДА Методические рекомендации для студентов Гарнитура Таймс Объем 2,5 уч.-изд. л. Тираж 600 экз. ГБОУ ВПО РНИМУ, Москва, 117437, Островитянова, 1. 4223 24 стр. 3 4 5 5 6 6 8 9 10 10 13 14 16 18 20 22 23