Задание к занятию №13 Тема: Исследование свойств α
реклама

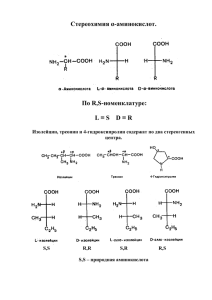
Задание к занятию №13 Тема: Исследование свойств α-аминокислот. Цель: Сформировать знания о строении и свойствах важнейших α-аминокислот, являющихся структурными компонентами белковых молекул, необходимых для понимания их метаболических превращений в биологических системах. Сделайте запись в рабочей тетради по плану: Дата Номер занятия Тема занятия Основные вопросы темы – это учебные вопросы занятия Краткое описание порядка выполнения лабораторных работ Учебные вопросы занятия: 1. Аминокислоты, входящие в состав белков. 1.1. Определение аминокислот и их классификация с учетом различных критериев: по химической природе радикала; количеству амино- и карбоксильных групп и содержащихся в структуре аминокислот других заместителей; расположению аминогруппы по отношению к карбоксильной группе; по кислотно-основным свойствам. 1.2. Биологическая классификация (заменимые и незаменимые α-аминокислоты). Медикобиологическое значение α-аминокислот. 2. Стереоизомерия α-аминокислот. Пары энантиомеров с одним и с двумя центрами хиральности. Способы разделения оптических изомеров. 3. Реакционные центры α-аминокислот как гетерофункциональных соединений. Биполярная структура, образование биполярных ионов. Нейтральные, кислые и основные α-аминокислоты. 4. Химические свойства аминокислот: 4.1. Кислотно-основные свойства α-аминокислот (амфотерность). Образование внутрикомплексных солей. Реакции этерификации и ацилирования. 4.2. Специфические реакции α-, β- и γ-аминокислот (образование пептидов, ненасыщенных кислот, лактамов, дикетопиперазинов). 4.3. Биологически важные реакции α-аминокислот. Реакции дезаминирования (внутримолекулярного и окислительного). Реакции гидроксилирования. Биосинтетические пути образования аминокислот из кетонокислот: реакции восстановительного аминирования и реакции трансаминирования. Взаимопревращения аминокислот: фенилаланин → тирозин; цистеин → цистин; пролин → гидроксипролин. 4.4. Декарбоксилирование α-аминокислот – путь к образованию биогенных аминов и биорегуляторов (коламин, гистамин, триптамин, серотонин, кадаверин, β-аланин, γаминомасляная кислота – ГАМК). 4.5. Реакции аминокислот с формальдегидом (формольное титрование) и азотистой кислотой (реакция Ван-Слайка), их практическое применение. 4.6. Качественные реакции на аминокислоты: нингидриновая, биуретовая, ксантопротеиновая. Рекомендованная литература: 1. Н.А.Тюкавкина, Ю.И.Бауков. Биологическая химия. Учебник для студентов медвузов, М., Медицина, 2008. 2. И.А.Братцева, В.И.Гончаров. Биологическая химия. Учебное пособие г.Ставрополь, 2008. 3. Руководство к лабораторным занятиям по биологической химии под ред. Н.А.Тюкавкиной. М. Медицина, 2009. 4. Лекционный материал. Дополнительная литература: 1. Общая химия. Учебник для медицинских вузов. (В.А.Попков, С.А.Пузанов), М, ГЭОТАР Медиа, 2007. 2. Химия. Основы химии живого. Учебник для студентов высших учебных заведений. (В.И.Слесарев), Санкт-Петербург, Химиздат, 2000. 3. Базы данных, информационно-справочные и поисковые системы интернет-ресурсов. Лабораторные работы. Опыт №1. – Реакция глицина с нингидрином. В пробирку поместите 4 капли 1% раствора глицина и 2 капли 0,1% раствора нингидрина. Содержимое пробирки осторожно нагрейте до появления сине-красной окраски. Опыт №2. – Реакция глицина с азотистой кислотой. В пробирку поместите 5 капель 1% раствора глицина и равный объем 5% раствора нитрита натрия. Добавьте 2 капли концентрированной уксусной кислоты и осторожно взболтайте смесь. Наблюдается выделение газа. Реакция используется для количественного определения аминогрупп в аминокислотах. Опыт №3. – Образование комплексной соли меди глицина. В пробирку поместите 1 мл 1% раствора глицина. Добавьте на кончике лопаточки сухой карбонат меди (II) и смесь нагрейте. Раствор окрашивается в синий цвет. Опыт №4. – Амфотерные свойства α-аланина. В первую пробирку поместите 5 капель 1% раствора α-аланина и добавьте по каплям 0,1% раствор хлороводородной кислоты, подкрашенной индикатором Конго в синий цвет (на общем столе), до появления розово-красной окраски. Во вторую пробирку поместите 5 капель 1% раствора α-аланина и по каплям добавьте 0,1% раствор гидроксида натрия, подкрашенный фенолфталеином, до исчезновения окраски. Вопросы по лабораторной работе: 1. Какими внешними признаками характеризуется реакция α-аминокислот с нингидрином? 2. Какое практическое применение имеет реакция α-аминокислот с нингидрином? 3. Напишите уравнение реакции взаимодействия глицина с формальдегидом. Каковы причины изменения окраски индикатора? 4. Какое практическое применение имеет реакция α-аминокислот с формальдегидом? 5. Напишите схему взаимодействия глицина с азотистой кислотой. Назовите образовавшиеся соединения. 6. Какое практическое применение имеет реакция аминокислот с азотистой кислотой? 7. Напишите реакцию взаимодействия глицина с карбонатом меди (II). 8. Какой цвет характерен для растворов комплексных солей меди? 9. Напишите уравнение реакции взаимодействия α-аланина с гидроксидом натрия. Почему изменяется окраска индикатора в ходе реакции? 10. Напишите уравнение реакции взаимодействия α-аланина с хлороводородной кислотой. Почему изменяется окраска индикатора в ходе реакции? 11. Почему α-аминокислоты способны взаимодействовать с кислотами и щелочами?