КОСТНОПЛАСТИЧЕСКИЕ КОМПОЗИЦИОННЫЕ МАТЕРИАЛЫ
реклама

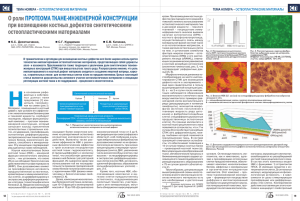
КОСТНОПЛАСТИЧЕСКИЕ КОМПОЗИЦИОННЫЕ МАТЕРИАЛЫ, ИСПОЛЬЗУЕМЫЕ В ТРАВМАТОЛОГИИ И ОРТОПЕДИИ И ДРУГИХ ОБЛАСТЯХ РЕКОНСТРУКТИВНОЙ ХИРУРГИИ М.В. Лекишвили1, Е.Д. Склянчук2, В.С. Акатов3, А.А. Очкуренко1, А.Ю. Рябов4, И.С. Фадеева3, Ю.Б. Юрасова5 ФГБУ «Центральный институт травматологии и ортопедии им. Н.Н. Приорова» МЗ РФ 1, МГМСУ им. А.И. Евдокимова2, Москва, Институт теоретической и экспериментальной биофизики РАН3, Пущино, Стоматологический центр «Интердентос» 4, Королев, Российская детская клиническая больница5 Москва, Россия Большое количество заболеваний и последствий травм костей скелета требуют обязательного восстановления их целостности. Часто необходимость проведения восстановительных костнопластических операций продиктована наличием грубых функциональных нарушений костей или развитием обширных послеоперационных костных дефектов. Для восполнения подобных дефектов наряду с металлоконструкциями бывают необходимыми костнопластические материалы, зачастую состоящие из биологически активных компонентов, обладающие необходимым набором различных свойств, влияющих на процессы костной регенерации (безопасность, остеоиндуктивность, остеокондуктивность и т.д.). Различные свойства костнопластических композиционных материалов могут определять рекомбинантные морфогенетические белки, антибиотики, антиоксиданты и т.д. Известно, что количество произведенных операций первичного и повторного протезирования имеет устойчивую тенденцию роста. При этом существует проблема сохранения стабильности эндопротезов крупных суставов в течение длительного времени. Анализ работ касающихся асептической нестабильности показал, что, несмотря на улучшение технологии операции эндопротезирования, качества материала для изготовления металлических имплантатов и их дизайна число случаев асептической нестабильности не только не уменьшается, но даже увеличивается. Одной из главных причин нестабильности эндопротезов является усиление интенсивности резорбции и, соответственно, потери костной ткани и механической прочности оставшейся костной ткани, контактирующей с эндопротезом. Сведения о механизмах потери костной ткани, прилежащей к эндопротезу, дают основание предполагать, что с помощью фармацевтических препаратов возможна коррекция нарушенных механизмов ремоделирования и снижение интенсивности остеолиза, влекущего за собой развитие асептической нестабильности. В этой связи несомненный интерес представляют искусственные синтетические соединения, относящиеся к классу бисфосфонатов (БФ). Одним из их основных биологических свойств является способность корректировать кальциевый обмен, предупреждая резорбцию костных тканей и кальцинацию костей за счет подавления активности остеокластов. Однако эффект, вызываемый БФ в непосредственном контакте с костной тканью и кровотоком биологических объектов, остается малоизученным. До сих пор остается неясно, можно ли повышать остеогенную активность костнопластических материалов, модифицируя их бисфосфонатами. Цель исследования – экспериментальная и клиническая оценка эффективности костных деминерализованных и композиционных костнопластических материалов, в которые введены субстанции, модулирующих активность остеокластов и остеобластов. В экспериментальных исследованиях использовали биокомпозиционные материалы на основе костного матрикса, в которые включали рекомбинантный морфогенетический белок ВМР-2, бисфосфонат (золедроновая кислота), антиоксиданты и антибиотики. Материал изучали в модели экспериментального эндопротезирования тазобедренного сустава у крыс, используя эндопротезы из нержавеющей стали и титанового сплава с покрытием. Быстро отвердевающий биокомпозиционный материал помещали на границе «кость-эндопротез». Для анализа остеоинтеграции применяли денситометрию и морфологический анализ участков ткани, пролегающих к эндопротезу. Проводили анализ и оценку результатов хирургического лечения более 850 детей и подростков в возрасте от 2 до 17 лет с использованием частично и полностью деминерализованных костных имплантатов (ДКИ), в виде пластин, стружки, блоков, чипсов. Сроки наблюдения составили от 1,5 до 15 лет. Представленный материал основан на данных, предоставленных пятью российскими детскими клиническими больницами (ДКБ): Воронежской областной № 2, Калининградской и Пензенской областных ДКБ, ДГКБ № 13 им. Н.Ф. Филатова г. Москвы, Республиканской больницы № 1 НМЦ Республики Саха (Якутия). Достаточное количество и разные формы ДКИ позволили использовать их для заполнения дефектов разных объемов и локализаций, вне зависимости от этиологии костной патологии. Высокие остеоиндуктивные свойства ДКИ позволило применить их в качестве местного стимулятора остеогенеза при оперативном лечении ложных суставов и дефектов, послеоперационных костных полостей и удлинении конечностей на фоне локальных диспластических поражений. Использование костнопластических материалов позволило отказаться или резко снизить использование костных аутотрансплантатов. Отсутствие гнойных осложнений у более чем 850 пациентов свидетельствует о стерильности и безопасности применяемых костных биопластических материалов, изготовленных по технологии ЦИТО. Использование ДКИ способствовало сокращению сроков госпитализации. Экспериментальные исследования в институте теоретической и экспериментальной биофизики РАН на животных, которым проводились подкожные эктопические пересадки материалов, содержащих рекомбинантные морфогенетические белки, показали значительные остеоиндуктивные потенции подобных имплантатов в сравнение с контролем. Местное использование в эксперименте золедроновой кислоты в незначительной концентрации приводило уплотнению костной ткани вокруг эндопротезов. Перспективы работы лаборатории «тканевой банк ЦИТО» в кооперации с МГМСУ им. А.И. Евдокимова, Институтом теоретической и экспериментальной биофизики РАН, стоматологическим центром «Интердентос» и Российской детской клинической больницей основаны на разработке и дальнейшем внедрении в клиническую практику новых костнопластических материалов. Так начаты исследования по созданию семейства биокомпозиционных костнопластических материалов, в состав которых входят рекомбинантные костные морфогенетические белки. Рассматриваются варианты производства костнопластических материалов на основе костного матрикса, в составе которых предложены природные или синтетические антиоксиданты, а также современные пролонгированные антибиотики. Без сомнения, перспективные направления потребуют значительных финансовых средств, тщательного экспериментального исследования и последующего анализа, комплекса различных экспертиз, государственной регистрации и т.д. Вместе с тем, мы надеемся на кооперацию с другими научно-исследовательскими учреждениями, прежде всего, с лечебными учреждениями травматологического и ортопедического профиля, для реализации наших замыслов в реальные, доступные для людей, эффективные костнопластические материалы. Тканевой банк ЦИТО снабжает костнопластическими материалами более 80 различных клиник на территории России и за рубежом. Качество и разнообразие материалов позволяют их с успехом использовать в широком диапазоне травматологии и ортопедии с обоснованным ожиданием положительного исхода лечения.