к оценке препаратов традиционной медицины растительного
реклама

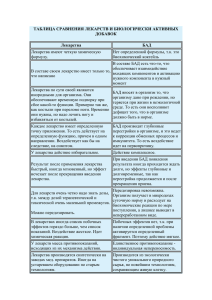
К ОЦЕНКЕ ПРЕПАРАТОВ ТРАДИЦИОННОЙ МЕДИЦИНЫ РАСТИТЕЛЬНОГО ПРОИСХОЖДЕНИЯ В АРМЕНИИ Амроян Э.А, Казарян Л., Айрапетян А.А., Мелконян Е.А., Габриелян Э.С. Известно, что около 80% населения развивающихся стран в системе первичной помощи прибегает к “народной” или “традиционной” медицине (ТМ). Согласно определению ВОЗ лекарства растительного происхождения (ЛРП), а также растительные биологически активные добавки (БАД) и гомеопатические лекарства (ГЛ) являются неотъемлемой частью ТМ (1). Лечение лекарственными растениями давно вышло за рамки традиционного “травоведения”(Herbalism), став научной теорией применения растительных продуктов и заняв прочное место в числе других терапевтических направлений медицины. Лекарствами растительного происхождения являются конечные продукты, содержащие в качестве активных ингредиентов один или несколько растительных экстрактов, настоек, масел, а также подвергнутый производственной обработке “растительный материал” (цельное растение или его части, свежий сок, смолы и т.д.), предназначенные для лечения, профилактики и диагностики заболеваний (2, 3, 4). Правовой статус и законодательный контроль в области ЛРП не развит в структурную контролирующую модель и варьирует в различных странах – от освобождения их от всех регуляторных требований, до применения однотипных с аллопатическими лекарствами регуляций. В одних странах они подлежат отдельной регистрации, в других они входят в состав пищи и не имеют терапевтических показаний. Неоднозначность оценки ЛРП наблюдается и в Европе (4). Так, в Германии и Франции стоимость основных фитопрепаратов возмещается фондами медицинского страхования. В Великобритании же основные фитопрепараты занесены в “Общий список продаж” (GSL) или маркированы как БАД, и их стоимость не возмещается медицинским страхованием. Сложилась ситуация, когда один и тот же фитопрепарат (например, гинкго) в Германии и Франции является лекарством с возмещаемой стоимостью, а в Великобритании и Нидерландах – продается как БАД. Препараты мяты могут быть отнесены как к пище (фиточаи), так и к лекарствам (2,3). Все это создает массу проблем при регуляторной оценке таких продуктов. Необходимо отметить, что в европейской системе здравоохранения усиливается ориентация на ЛРП. Так, например, в Германии, где еще в 1976г. парламент во втором Законе о лекарствах признал фитотерапию как самостоятельное терапевтическое направление, около 80% врачей регулярно назначают пациентам ЛРП (5). В Азии практикуется оба метода терапии – ортодоксальный (”западный”) и традиционный, но ни один из них не признан здесь универсальным. Огромный разрыв между аллопатическими лекарствами и препаратами ТМ, существующий в США, имеет исторические корни, а также обусловлен скептическим отношением американских врачей к ТМ и стремлением к высокотехнологичной медицине (6). Регулирование препаратов ТМ началось в РА с 1998г, в рамках Закона о лекарствах (7). Они регулируются как отдельные категории лекарств – ЛРП и ГЛ. В РА отсутствует национальная политика и законодательная база в области ТМ. Вследствие отсутствия Экспертного комитета при экспертизе ЛРП, ГЛ и БАД используются общепризнанные источники доказательной информации других стран – Британская растительная фармакопея, монографии ВОЗ по лекарственным растениям и др. На сегодня в РА зарегистрировано 93 ЛРП, из коих четыре – производства двух местных фирм, и 32 ГЛ, производимых в основном известными немецкими и австрийскими фирмами. Официально зарегистрировано также 68 растительных БАД, из коих шесть – местного производства. ЛРП и лекарственные растения продаются в аптеках наряду с аллопатическими лекарствами, а также могут приобретаться у лицензированных практиков, без ограничений. Насчитывается четыре местных производителя БАД. За редким исключением, это небольшие производства, которые не имеют развитой системы контроля качества, что ограничивает их возможности для производства безопасной и стандартизированной продукции. Силами экспертов НЦЭЛМТ в 2001г. составлен “Список основных лекарственных растений РА”, систематизированный по нозологическим группам и включающий 46 фармакопейных видов растительного сырья, одобренных для медицинского применения. На основе этого списка разработан “Национальный формуляр по растительным лекарствам”, который обобщает современный научно-практический опыт изучения и применения фитопрепаратов в медицине (8). “Список основных лекарств РА” включает одно растительное лекарство, а в “Список лекарств, отпускаемых без рецепта” входит 72 ЛРП. Формуляр также служит справочным материалом при проведении экспертизы ЛРП, ГЛ и БАД. Гомеопатические препараты в РА регулируются в соответствии с Директивой 2001/83/ЕС, согласно которой они делятся на две группы. 1. Традиционные гомеопатические препараты из стран ЕС для внутреннего и наружного использования, приготовленные согласно гомеопатическим фармакопеям, принятым в этих странах, в потенции не менее 4D (10-4), без терапевтических показаний, которые регистрируются путем “упрощенной процедуры”. 2. Остальные гомеопатические препараты, не соответствующие указанным выше требованиям, регистрируются по полной схеме, предъявляемой к аллопатическим лекарствам (9). Биологически активные добавки. По данным статистики, 70% населения развитых стран регулярно употребляют БАД, что по-видимому, является отражением новых веяний в здравоохранении конца ХХ-го столетия, когда востребованным оказался такой показатель, как “качество жизни” – концепция, включающая комплекс физиологического здоровья индивида, его психическое состояние, уровень личной независимости, социальные взаимоотношения, веру, близость к окружающей природе и т. д. Появившись на фармацевтическом рынке РА в 1994г., БАД реализовывались без всяких ограничений и контроля и находились в теневом секторе до 1996г. Главным источником распространения БАД в РА является сетевой маркетинг (83,4%), что приводит к агрессивному проталкиванию фирмами своей продукции на рынок. Распространена также порочная практика, когда известные врачи (профессора!) выступают на семинарах, организованных фирмами – производителями БАД, пропагандируя их продукцию. Как показали результаты исследования, проведенного НЦЭЛМТ в 2002г. методом опроса, 32,6% поликлинических врачей г. Еревана практиковали назначение БАД своим пациентам. Причем в 65,4% случаев БАД назначались вместе с лекарствами в качестве вспомогательного лечения; в 32,3% случаев БАД назначались для профилактики заболеваний; в 2,87% – использовались в качестве средств для похудания (10). Учитывая потенциальную опасность неконтролирумого применения БАД, Правительство РА в 2001г. приняло Постановление “О порядке государственной регистрации фармацевтических продуктов и утверждении размеров оплаты экспертизы государственной регистрации лекарств” (11). Экспертная оценка эффективности и безопасности ЛРП может отличаться от практики аллопатической медицины. Она основана на двух видах подтверждающей информации – научной, и основанной на традиционном (народном) использовании продукта. В РА при экспертизе ЛРП руководствуются рекомендациями ВОЗ, опубликованными в 2000г. (12). Основным правилом для оценки является традиционный опыт, который свидетельствует о длительном (по крайней мере несколько десятилетий) использовании продукта с его медицинскими, историческими и этническими свойствами. Длительное использование без осложнений обычно служит свидетельством его безопасности. Однако, описаны случаи ранее не подозреваемой токсичности, канцерогенности и тератогенности некоторых широко используемых растений – ингредиентов ЛРП. Оценка качества ЛРП включает ссылку на фармакопейную монографию растения, если таковая есть, и спецификацию конечного продукта. Соответствие растительного материала фармакопейным требованиям трудно оценить без подтверждения надлежащих условий производства, культивации и сбора растений, разработанных ВОЗ (13, 14). Надлежащая практика производства (GMP) для лекарственных растений включает все аспекты – от культивации до производства и контроля качества (персонал, растение, почва, санация помещений, оборудование и инструменты). Правила GMP призваны первично нивелировать риск, присущий фармацевтической продукции, который не может быть полностью предотвращен тестированием конечного продукта. Таким образом, GMP гарантирует качество ЛРП, поступающего на фармацевтический рынок. Прилагают также описание метода идентификации активного вещества и количественную оценку растительного материала. Если идентификация активного вещества невозможна, достаточно идентифицировать характеризующее (профильное) вещество, или смесь веществ (например, “хроматографический отпечаток”), чтобы гарантировать качество продукта. Обязательно подтверждение регуляторного статуса в стране происхождения препарата. Применяется также, принятая ВОЗ, система удостоверения качества препаратов, поступающих на международный рынок. Оценка эффективности обязательно включает ознакомление с обзором литературы, данные которой сопоставляются с авторитетными фармакопеями и формулярами, фармакопейными статьями ВОЗ, отчетами ESCOP (The Experiment Station Committee on Organization and Policy), GRAS-статусом (Generally Recognize as Safe), рекомендациями BgW (Федерального института санитарной защиты потребителей и ветеринарной медицины Германии) и др. Основной принцип оценки эффективности и безопасности препаратов ТМ состоит в том, что если продукт применялся в ТМ без видимого ущерба для здоровья, не следует принимать какихлибо ограничительных мер до тех пор, пока не появятся новые данные, требующие пересмотра оценки как эффективности, так и безопасности. Если токсикологическая опасность продукта известна, следует анализировать данные, касающиеся токсичности. При этом документально фиксируют оценку риска в зависимости от дозы, или независимо от нее. Документируется также потенциальная возможность использования продукта не по показаниям, злоупотребления или развития лекарственной зависимости. Показания к применению растительных препаратов ТМ требуют особых доказательств. Причем, для лечения небольших нарушений при неспецифических показаниях, или для профилактики возможно некоторое послабление требований, исходя из практики многовекового традиционного применения (традиционная Китайская медицина, Аюрведа, Шиддха, Унани и др.). В тех случаях, когда препарат не имеет истории применения в ТМ, а также для обоснования использования новых ингредиентов в комбинациях, “золотым стандартом” являются контролируемые клинические испытания, проведенные в рамках надлежащей клинической практики (GСP). При оценке гомеопатических лекарств используется положение ВОЗ о том, что ГЛ представляют собой особый вид препаратов, в которых главным компонентом традиционного способа лечения является процесс приготовления, состоящий из последовательного многократного разбавления. При условии, что препараты приготавливаются в соответствии с принципами, описанными в гомеопатических фармакопеях, и удовлетворяют требованиям безопасности, они оцениваются на основе “информации, подтверждающей традиционное использование” (12). Тем не менее, несмотря на волну популярности гомеопатии в Великобритании и в Индии, где рынок ГЛ растет на 25% в год, в авторитетном научном журнале “Lancet” появилась статья, в которой приводятся результаты пяти контролируемых клинических исследований, проводившихся в последние годы. В статье дается беспощадная характеристика: ”Гомеопатия – псевдомедицина. Эффективная, как плацебо, или, если хотите, как свежая вода” (15). Биологически активные добавки регулируются согласно Директиве 2002/46/ЕС, в которой содержатся: определение “БАД”, требования к упаковке, содержанию витаминов, минералов и других ингредиентов, рекламе и др. (16, 17). Отнесение продуктов к пище или медицинским продуктам является правом членов ЕС (решение Европейского суда от 9 июня 2005г.). Согласно директиве на упаковке БАД, среди прочих пунктов, обязательно наличие указания “Биологически активная добавка”, перечисление всех ингредиентов с указанием кодов (Е-число, “ароматизатор”, “антиоксидант” и т.д.), а также потенциальных аллергенов, информации о ГМО-происхождении ингредиентов и др. БАД могут включать только заявленные согласно Директиве витамины и минералы. Согласно этой же Директиве разрешено только три типа показаний по применению БАД: 1) восполнение дефицита питательных веществ; 2) благотворное действие на структуру или функции организма; 3) общеукрепляющее действие. Особо оговаривается, что БАД не предназначены для лечения или профилактики заболеваний. Побочные реакции препаратов ТМ. Использование растительных экстрактов основывается на исторической очевидности. Опыт поколений демонстрирует эффективность и безопасность ТМ. Имеется всеобщее убеждение, что эти натуральные препараты лишены побочных реакций (ПР). Многие ПР препаратов ТМ не регистрируются, т.к. основаны на личном опыте. При частоте ниже 1 на 1000 пациентов ПР могут не фиксироваться вплоть до выхода препарата на рынок. Мониторинг ПР традиционных препаратов очень затруднен по сравнению с ортодоксальными препаратами. Положение осложняется тем, что при наличии множества моно- и многокомпонентных препаратов, производители иногда, сохраняя фирменное название, меняют состав препарата. Нередко фито- и аллопатические ингредиенты смешиваются в одном лекарстве. Вариации метода производства фитопрепаратов также могут усложнить ПР-мониторинг одного и того же препарата. Контроль качестве не везде однозначен, что также может служить причиной ПР. Более того, традиционные фитопрепараты, обычно безрецептурные, выписываются всеми специалистами – аллопатами, гомеопатами и др., иногда не имеющими достаточных знаний об особенностях фитопрепаратов. Нет механизма, который бы обязал врачей проводить мониторинг ПР, у них нет мотивации делать это, и нет гарантии конфиденциальности для сообщений о ПР, тем более, что при мизерной доступности информации проявления ПР нередко интерпретируются как следствие врачебной небрежности (18). В РА в 1997г. учрежден Национальный центр по мониторингу побочных эффектов лекарств, сотрудничающий с головным центром ВОЗ в Швеции (Uppsala Monitoring Center), который мог бы взять на себя функцию фармаконадзора побочных эффектов ЛРП, ГЛ или БАД. Учитывая то обстоятельство, что фармаконадзор – трудная задача даже для развитых стран, в РА функцию сообщения о ПР ТМ можно было бы возложить, помимо врачей, также на аптечных провизоров. Участие потребителей в этом процессе представляется сомнительным, учитывая то, что в нашей стране они пока еще слабо организованы. Тем временем в КНР в 2002г. было получено более 9000 сообщений о ПР, вызванных препаратами традиционной китайской медицины, что более чем вдвое превосходит все сообщения, зарегистрированные с 1990гг. Особенно много сообщений, касающихся запрещенных БАД для похудания, “Li Da”, “Ян Фэй”, “Юй Шу”, “Жуйдемен”, сбора “Похудание растением QIAZI” и так называемых “тайских таблеток”, в которых были обнаружены структурно близкие амфетамину лекарства сибутрамин и мазиндол, а также контролируемое психотропное лекарство – метаквалон (19). Имеются сообщения о гепатотоксическом действии экстрактов и отваров германдера (Teucrium chamaedrys L., Teucrium scorodonia L.) при использовании его в качестве средства для похудания (20). Большую настороженность вызывает использование жень-шеня – частого ингредиента как БАД, так и ЛРП. Принятые в народной медицине в течение столетий показания (тонизирующее, иммуностимулирующее, противоопухолевое действие, сердечно-сосудистая патология, сексуальные проблемы) были верифицированы путем проведения семи контролируемых клинических испытаний. Систематизированный обзор результатов не выявил очевидности этих показаний в четырех испытаниях. В трех – была показана статистически подтвержденная достоверность (21). Исследователи из США, Гонконга и Нидерландов обнаружили противоречивые данные относительно фармакологического действия жень-шеня на рост сосудов. Описано как подавляющее рост действие, так и стимулирующее. Первое имеет важное значение для использования растения в онкологии, а второе – для лечения ран. Предполагается, что причиной может быть то, что в растениях из разных климатических зон преобладают различные активные компоненты, вызывая противоположные эффекты (22). Для БАД определенную опасность представляет заведомо неадекватная маркировка, вводящая в заблуждение потребителя. Следует учесть, что при отсутствии регуляторного контроля никто не может гарантировать, что польза от их использования в каждом конкретном случае превышает риск, т.к. эффективность и безопасность БАД, особенно многокомпонентных, пока еще объективно не доказаны. В процессе регистрации путем экспертизы создается возможность объективно оценить эффективность и безопасность БАД. Основными факторами риска для БАД являются: передозировка при неконтролируемом назначении, низкое качество растительного материала, ошибочная идентификация растения, вариабельность содержания активных ингредиентов, загрязнение тяжелыми металлами, нелегальное наличие аллопатических рецептурных лекарств, развитие взаимодействия с лекарствами и аллергические реакции, токсичность, характерная для некоторых растительных ингредиентов. Неуклонное увеличение потребительского рынка БАД, диктует необходимость информирования как специалистов здравоохранения, так и потребителей относительно всех положительных и отрицательных проявлений использования БАД (23, 24). Так, учитывая особенности всасывания и метаболизма, детей нельзя рассматривать как “маленьких взрослых” и экстраполировать на них данные, полученные у взрослых. Исходя из этого в информации о БАД необходимо наличие указания о нецелесообразности их применения у детей до 12 лет. Также, во избежание повторения трагической истории с талидомидом, не следует без консультации врача применять БАД беременным и кормящим грудью женщинам, так как при этом следует тщательно взвесить соотношение “польза/риск” для данного БАД в конкретном случае (25). В РА за последние пять лет не было допущено к регистрации девять БАД, в том числе: Mirra-M (“ZAO Mirra-M”, РФ), Animal Chews with Calcium и Adult chewable (“Vitamin World”, США), и др. Причиной отказа послужили отсутствие доказательств безопасности, наличие экзотических и не исследованных ингредиентов, превышение допустимых для БАД доз активных ингредиентов и др. Есть значительное противоречие между безопасностью БАД и степенью регуляторного контроля, который должен защитить потребителя. Так, комбинации безрецептурных аллопатических препаратов с БАД имеют не установленную эффективность и безопасность и неясный регуляторный статус. Потребитель не знает, что только аллопатический компонент комбинации имеет регуляторную оценку (был ранее зарегистрирован как отдельное лекарство). Введение четких регуляций в этой области является приоритетом (26). Взаимодействия. Не исключается возможность развития непредсказуемых взаимодействий ЛРП и БАД с другими лекарствами, при параллельном применении, что чревато ухудшением состояния больных (27). В таблице 1 приводятся некоторые, подтвержденные контролируемыми клиническими испытаниями взаимодействия, которые выявлялись при использовании растительных препаратов с аллопатическими лекарствами. Таблица 1. Случаи взаимодействия при использовании растительных препаратов с аллопатическими лекарствами (по Chavez et al., 2006). Ðàñòåíèå Àëëîïàòè÷åñêîå ëåêàðñòâî Ïîòåíöèàëüíàÿ ïðîáëåìà ãèíêãî íàòðèÿ âàëüïðîàò, òåìàçåïàì, àñïèðèí, òàìèïðèë Ãåíåðàëèçîâàííûå òîíèêîêëîíè÷åñêèå ñóäîðîãè ãèíêãî âàðôàðèí ãåìîððàãèè æåíü-øåíü ýñòðîãåíû, êîðòèêîñòåðîèäû ïîòåíöèðîâàíèå äåéñòâèÿ ëåêàðñòâ æåíü-øåíü ôåíåëçèí áåññîíèöà, ãîëîâíàÿ áîëü çâåðîáîé öèêëîñïîðèí, âàðôàðèí, èíãèáèòîðû ÂÈ×-ïðîòåàçû è òðàíñêðèïòàçû óãíåòåíèå äåéñòâèÿ ëåêàðñòâ çâåðîáîé àíòèäåïðåññàíòû èíãèáèòîðû îáðàòíîãî çàõâàòà ñåðîòîíèíà óñèëåíèå ñåðîòîíèíîâûõ ýôôåêòîâ çâåðîáîé âàðôàðèí èíäóêöèÿ ìåòàáîëèçìà âàðôàðèíà ÷åñíîê âàðôàðèí ãåìàòóðèÿ äîíã êâàé (ÁÀÄ) âàðôàðèí äâóêðàòíîå ïîâûøåíèå ïðîòðîìáèíîâîãî âðåìåíè Есть также наблюдения, указывающие на замедление свертывания крови и склонность к кровотечениям у оперированных пациентов, принимавших ЛРП в течение последних двух недель перед операцией. Врачи отмечают, что широко распространенные препараты ТМ на основе гинкго, эфедры или чеснока могут оказывать неблагоприятное влияние на кровеносную систему (выраженное замедление свертывания), а валериана и кава-кава усиливают действие анестетиков и затрудняют пробуждение после наркоза (27). Фальсификация препаратов ТМ. В январе 2007г. в БАД “Liviro3” (Ebek и FDA) был обнаружен незаявленный в качестве ингредиента тадалафил. В марте 2007г. фирма Barodon SF и Администрация по контролю пищи и лекарств США (FDA) оповестили о прекращении маркетинга БАД “V.MAX”, в котором был обнаружен незаявленный ингредиент – аминотадалафил, аналог тадалафила, ранее зарегистрированного в FDA в качестве лекарства для лечения эректильных расстройств. FDA предупредила потребителей о том, что при одновременном применении этих БАД с лекарствами, содержащими нитраты может развиться опасное для жизни понижение артериального давления. Такое же предупреждение касалось БАД “Rhino V Max” (Cosmos Trading, Inc. и FDA), а также нелегальных лекарств этого же направления, с недекларированными ингредиентами – “Zimaxx”, “Libidus”, “Neophase”, “Nasutra”, “Vigor-25”, “Actra-Rx”, и “4EVERON”, которые распространялись в Интернет в качестве БАД (28). Несовершенство местного законодательства создает лазейки для нелегальной доставки и продажи препаратов ТМ на фармацевтическом рынке страны. Использование современных методик и приборов, которыми располагает Лаборатория контроля качества лекарств НЦЭЛМТ при изучении идентичности, чистоты и количества ЛРП, ГЛ и БАД позволило выявить контрафактную продукцию. Так, при инспекции аптек было выявлено 13 случаев фальсификации растительных продуктов (29). В таблице 2 представлены примеры фальсификации. Таблица 2. Примеры фальсификации, выявленные в препаратах растительного происхождения и БАД в РА с 1997 по 2007гг. Ïðåïàðàò Ôîðìà âûïóñêà Ïðîèçâîäèòåëü, óêàçàííûé íà óïàêîâêå Ñòðàíà, óêàçàííàÿ íà óïàêîâêå Âèä ôàëüñèôèêàöèè ìàñëî îáëåïèõîâîå 30 ìë, ôëàêîí Àëòàé-ñåðâèñ Ðîññèÿ êîëè÷åñòâåííîå ñîäåðæàíèå ìåíåå 50% ìàñëî îáëåïèõîâîå 30 ìë, ôëàêîí Ñàäîâîä Ðîññèÿ îòñóòñòâèå àêòèâíîãî èíãðèäèåíòà ìàñëî êàìôîðíîå 30 ìë, ôëàêîí îòñóòñòâóåò Ðîññèÿ ìàðêèðîâêà ìàñëî êàìôîðíîå 30 ìë, ôëàêîí îòñóòñòâóåò Ðîññèÿ ìàðêèðîâêà ñïèðò êàìôîðíûé 30 ìë, ôëàêîí îòñóòñòâóåò Ðîññèÿ ìàðêèðîâêà íàñòîéêà ìÿòû 30 ìë, ôëàêîí îòñóòñòâóåò Ðîññèÿ ìàðêèðîâêà íå óêàçàí Ðîññèÿ îòñóòñòâèå àêòèâíîãî èíãðèäèåíòà øàëôåé ëèñò íàñòîéêà ïóñòûðíèêà 30 ìë, ôëàêîí Áîðèñîâñêèé çàâîä ìåäïðåïàðàòîâ Áåëàðóñü ìàðêèðîâêà íàñòîéêà âàëåðèàíû 30 ìë, ôëàêîí Áîðèñîâñêèé çàâîä ìåäïðåïàðàòîâ Áåëàðóñü ìàðêèðîâêà ñåíàäåêñèí òàáëåòêè Ãðóçáèîôàðìïðåïàðàòû Ãðóçèÿ ìàðêèðîâêà, ðàñïàäàåìîñòü ÁÀÄ Àíòèîêñ êàïñóëû Âèçèîí Ôðàíöèÿ óïàêîâêà, ìàðêèðîâêà ÁÀÄ Ñâåëòôîðì êàïñóëû Âèçèîí Ôðàíöèÿ óïàêîâêà, ìàðêèðîâêà, íåçàÿâëåííûé êîìïîíåíò ôåíîáàðáèòàë ÁÀÄ Éîíã-Ãàíã òàáëåòêè Ôåíã Òàé Èíä Êèòàé ìàðêèðîâêà, íåçàÿâëåííûé êîìïîíåíò òàäàëàôèë Учитывая вышеизложенное, в НЦЭЛМТ с применением нового метода собственной разработки была осуществлена экспертиза БАД “Yong Gang” (”Feng Tai Industry”, КНР) на наличие следующиx субстанций: варденафил, силденафил, тадалафил, тестостерон. В результате исследования в БАД было обнаружено 30-34мг тадалафила (содержание, превышающее в 1,5 раза лечебную дозу), не заявленного в качестве ингредиента ни на упаковке, ни в рекламныx материалаx. Кроме того, в рекламныx материалаx содержались недопустимые для БАД лечебные показания. Сообщения, полученные из разных стран о случаях фальсификации БАД определенных групп (25, 28), привели к необходимости специального контроля на наличие незаявленных ингредиентов со стороны Лаборатории контроля качества лекарств НЦЭЛМТ, с целью защиты местного рынка от фальсификации. Регулярно в процессе регистрации проводится контроль следующих групп ЛРП и БАД: 1) тонизирующие (обнаружены незаявленные эфедрин, антидепрессанты и тироидные гормоны); 2) седативные (фальсифицированы бензодиазепинами); 3) сахаропонижающие (обнаружены незаявленные оральные противодиабетические препараты); 4) для коррекции фигуры (выявлены незаявленные анаболические стероиды); 5) для похудания (обнаружены контролируемые лекарства); 6) для суставных проблем (выявлены кортикостероиды, аспирин, диклофенак натрия). Кроме проникновения фальсифицированных продуктов, имеется и другая угроза. Несовершенство регуляторного контроля и инспектирования создает возможность для использования ЛРП и БАД в качестве “носителей” агрессивного активного агента при биотерроризме (фармакотерроризме). Лабораторная идентификация ЛРП и БАД в процессе регистрации позволяет поставить заслон перед вторжением на фармацевтический рынок страны некачественных и фальсифицированных продуктов, а также предотвратить возможность использования БАД в случае биотерроризма. Таким образом, возможность самостоятельного и длительного использования растительных средств ТМ потребителями при крайне недостаточной информированности об этих продуктах, а также их агрессивном маркетинге, содержит определенный риск. Это касается как состава активных ингредиентов, которые могут включать неисследованные экзотические, токсические, сильнодействующие, вызывающие зависимость компоненты, так и возможности развития побочных эффектов и передозировки при неконтролируемом применении. Кроме того, не исключается возможность развития непредсказуемых взаимодействий препаратов ТМ с лекарствами и пищей. Определенную опасность представляет также заведомо неадекватная маркировка ЛРП и БАД, вводящая в заблуждение потребителя. Несмотря на в целом благоприятное влияние на организм, никто не может гарантировать, что польза от их использования в каждом конкретном случае превышает риск, т.к. эффективность и безопасность этих продуктов, особенно многокомпонентных, пока еще объективно не доказаны. Все это свидетельствует о необходимости совершенствования законодательного поля и регуляторного контроля препаратов ТМ в стране, что позволит защитить рынок и потребителя от некачественных и фальсифицированных продуктов. Неуклонное увеличение потребительского рынка препаратов ТМ также диктует необходимость информирования как специалистов здравоохранения, так и потребителей относительно всех положительных и отрицательных проявлений их использования. Адрес для корреспонденции: Эльмира Амроян, Научный центр экспертизы лекарств и медицинских технологий МЗ РА, ул. Московян 15, Ереван 0001, Республика Армения, тел. (+37410) 58 50 16-119, email: elmira@pharm.am Литература 1. Стратегия ВОЗ в области народной медицины 2002-2005гг. ВОЗ, Женева, 2002, 62 с. 2. European Medicine Evaluation Agency. Note for Quidance on Quality of Herbal Medicinal Products of the European Union. (EMEA/HMPWG/9/99), London, 1999. 3. Biffignandi P., Carletto L. The new attitude of the European regulatory authorities about herbal medicinal products. Drug Information Journal. 2000, 34:801-808. 4. Keller K. Herbal medicinal products in Germany and Europe: experiences with national and European assessment. Drug Information Journal. 1996, 130:933-948. 5. WHO Traditional Medicine – growing needs and potential. WHO, Geneva, May 2, 2002. 6. National Policy on Traditional Medicine and Regulation of Herbal Medicines. Report of a WHO Global Survey. WHO, Geneva, 2005. 7. Закон Республики Армения о лекарствах. Ереван, 1998. 8. Национальный формуляр по растительным лекарствам. АЛМТ МЗ РА, Ереван, «Акоп Мегапарт», 2001, 118 с. 9. European Commission: Directive 2001/83/EC. 10. Gabrielyan E.S. et al. The Regulation of Dietary Supplements in the Republic of Armenia. Drug Information Journal, FDA, 2002, Vol.36, 4:889-897. 11. “О порядке государственной регистрации фармацевтических продуктов и утверждении размеров оплаты экспертизы государственной регистрации лекарств”, Постановление правительства РА N347 от 25.04.2001. 12. WHO/EDM/TRM. General Guidelines for Methodologies on Research and Evaluation of Traditional Medicine. Annex V. Guidelines for Levels and Kinds of Evidence to Supports Claims for Therapeutic Goods. WHO, Geneva, 2000.1 13. WHO Guidelines on good manufacturing practices (GMP) for herbal medicines. WHO, Geneva, 2007. 14. WHO Guidelines on good agricultural and collection practices (GACP) for medicinal plants. WHO, Geneva, 2003. 15. Goldacre В. Benefits and risks of homoeopathy, The Lancet, 2007; 370:1672-1673. 16. EU Directive 2002/46/ЕС on food supplements. 17. The Regulatory Framework for Food Supplements in Europe, Brussels, Association of the European SelfMedication Industry (AESGP), 2007. 18. Rahman S.Z., Singhal K.C. Problems in Pharmacovigilance of medicinal products of herbal origin and means to minimize them. Uppsala-Reports 17, Jan.2003 Supplement. 19. WHO Warns on Unsafe Use of Alternative Medicines, Geneva, Jun 23, 2004. 20. WHO Signal, The Uppsala Monitoring Centre, WHO, Uppsala, March 2006. 21. Volger В.К., Pittler М.Н., Ernst Е. The efficacy of ginseng. A systematic review of randomised clinical trials. European Journal of Clinical Pharmacology, 1999 55:567-575. 22. International Team Shows Why Ginseng Has Opposing Health Effects. Massachusetts Institute of Technology Press release, August 30, 2004. 23. Bryan Q, Coleman L, Meisberger S, Copmann T. Issues in the Regulation of Dietary Supplements. Drug Information Journal, FDA, 2001, 35:529-538. 24. U.S. Congress Senate Bill S.784. Dietary Supplement Health and Education Act of 1994. 25. Dzulkifli Abdul Razak. Poison Control: Traditional Medicine and the Use of Steroids as Adulterants. The National Poison Centre at University Sains Malaysia. http://pm.usm.my/steroids/index.html. 26. Vickers A., Zollman C. Clinical Review of Complementary Medicine. Herbal Medicine. British medical Journal, 1999, 319:1050-1053. 27. Chavez M.L, Jordan M.A., Chavez P.I. Evidence-based drug–herbal interactions. Life Sciences, 2006, 78, 2146–2157. 28. FDA 2004, 2007 Safety Alerts for Drugs, Biologics, Medical Devices, and Dietary Supplements. http://www.fda.gov/medwatch/SAFETY/.htm#ActraRx, 29. Gabrielyan E. et al. The regulation of herbal medicinal products in Armenia Drug Information Journal, FDA, 2004, 38, 3:273-281.