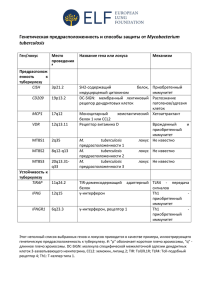
федеральное бюджетное учреждение науки «государственный
реклама

ФЕДЕРАЛЬНОЕ БЮДЖЕТНОЕ УЧРЕЖДЕНИЕ НАУКИ «ГОСУДАРСТВЕННЫЙ НАУЧНЫЙ ЦЕНТР ПРИКЛАДНОЙ МИКРОБИОЛОГИИ И БИОТЕХНОЛОГИИ» ФЕДЕРАЛЬНОЙ СЛУЖБЫ ПО НАДЗОРУ В СФЕРЕ ЗАЩИТЫ ПРАВ ПОТРЕБИТЕЛЕЙ И БЛАГОПОЛУЧИЯ ЧЕЛОВЕКА на правах рукописи ДЯТЛОВА ВАРВАРА ИВАНОВНА ПОЛУЧЕНИЕ РЕКОМБИНАНТНЫХ И СИНТЕТИЧЕСКИХ АНТИГЕНОВ MYCOBACTERIUM TUBERCULOSIS И ПЕРСПЕКТИВЫ ИХ ИСПОЛЬЗОВАНИЯ ДЛЯ СЕРОДИАГНОСТИКИ ТУБЕРКУЛЕЗА Специальность: 03.02.03 – микробиология. Диссертация на соискание ученой степени кандидата медицинских наук Научный руководитель: кандидат биологических наук Бикетов Сергей Федорович Оболенск – 2015 1 2 ОГЛАВЛЕНИЕ Введение..........................................................................................................................6 Актуальность темы исследования...............................................................................6 Степень разработанности темы исследования...........................................................8 Цели и задачи ................................................................................................................8 Научная новизна............................................................................................................9 Теоретическая и практическая значимость работы.................................................10 Методология и методы исследования.......................................................................11 Объекты исследования..............................................................................................11 Методы исследования...............................................................................................13 Личное участие автора в получении результатов....................................................28 Положения, выносимые на защиту............................................................................29 Степень достоверности и апробация результатов ...................................................29 Публикации..................................................................................................................30 Объем и структура диссертации................................................................................30 Основная часть............................................................................................................31 Глава 1. Обзор литературы.....................................................................................31 1. 1. Эпидемиологическая ситуация по туберкулезу в Российской Федерации....31 1. 2. Современные методы диагностики туберкулеза..............................................33 1.2.1. Современные методы иммунодиагностики туберкулеза.............................36 1. 2. 1. 1. Туберкулинодиагностика........................................................................36 1. 2. 1. 2. Методы детекции высвобождения гамма-интерферона......................37 1. 2. 1. 3. Иммуносеродиагностика........................................................................39 1. 3. Особенности гуморального иммунного ответа при туберкулезе...................44 1. 4. Антигены Mycobacterium tuberculosis, имеющие потенциал для серодиагностики туберкулеза........................................................................57 3 1.4.1. Критерии отбора антигенов M. tuberculosis для целей серодиагностики туберкулеза........................................................................57 1. 4. 2. Способы получения антигенных препаратов M. tuberculosis для целей серодиагностики туберкулеза.......................................................63 1. 4. 3. Белковые антигены M. tuberculosis, обладающие потенциалом для использования в серодиагностике туберкулеза.....................................67 1. 4. 3. 1. «RD1 белки» M. tuberculosis...................................................................67 1. 4. 3. 2. Другие потенциальные белковые антигены M. tuberculosis для целей серодиагностики туберкулеза......................................................70 1. 4. 4. Липидные и углеводные антигены M. tuberculosis. ..................................81 1. 4. 4. 1. Липоарабиноманнан (ЛАМ)...................................................................83 1. 4. 5. Конъюгаты белков M. tuberculosis с углеводными фрагментами ЛАМ...85 1. 4. 6. Мультиантигенные композиции, используемые в серодиагностике туберкулеза......................................................................86 Глава 2. Собственные исследования.....................................................................90 2. 1. Получение антигенов M. tuberculosis разными методами...............................90 2. 1. 1. Получение рекомбинантных белков M. tuberculosis в экспрессионной системе E.coli....................................................................90 2. 1. 2. Результаты химической конъюгации рекомбинантных белков с гексаарабинофуранозидом ЛАМ...................................................................92 2. 1. 3. Получение рекомбинантных белков M. tuberculosis в экспрессионной системе P. pastoris............................................................93 2. 2. Результаты иммуноферментного анализа (ИФА)............................................99 2. 2. 1. Результаты ИФА с белками M. tuberculosis, экспрессированными в системе E.coli.........................................................106 2. 2. 2. Результаты ИФА с конъюгатами белков M. tuberculosis, полученных в системе E. coli, с синтетическим гексаарабинофуранозидом ЛАМ.................................................................110 4 2. 2. 3. Результаты ИФА с белками M. tuberculosis, экспрессированными в системе P. pastoris.................................................111 2. 3. Сравнение диагностического потенциала рекомбинантных и синтетических антигенов M. tuberculosis.................................................112 2. 3. 1. Сравнение показателей эффективности применения в ИФА белков M. tuberculosis, полученных в E. coli, и их конъюгатов с гексаарабинофуранозидом ЛАМ...............................................................115 2. 3. 2. Сравнение результатов применения в ИФА аналогичных рекомбинантных белков M. tuberculosis, полученных в разных экспрессионных системах.............................................................................117 2. 3. 3. Сравнение результатов применения в ИФА трех вариантов одного белка M. tuberculosis, полученного разными методами................119 2. 4. Определение расчетных показателей эффективности мультиантигенных композиций, включающих антигены M. tuberculosis, использованные в работе...................................................120 Заключение.................................................................................................................125 Выводы.....................................................................................................................148 Практические рекомендации..................................................................................150 Перспективные направления дальнейшей разработки темы..............................150 Приложения................................................................................................................152 Приложение 1. Нуклеотидные последовательности праймеров, использованных в работе..............................................................................152 Приложение 2. Основные характеристики белков M. tuberculosis, использованных в работе..............................................................................153 Приложение 3. Гель – электрофореграмма образцов ДНК...................................154 Приложение 4. Гель - электрофореграммы белков M. tuberculosis, использованных в работе.............................................................................155 5 Приложение 5. Результаты иммуноблот анализа...................................................159 Принятые обозначения и сокращения.......................................................................160 Список литературы......................................................................................................164 Список иллюстративного материала.........................................................................208 6 ВВЕДЕНИЕ Актуальность темы исследования Одной из приоритетных задач отечественного здравоохранения является улучшение эпидемиологической ситуации по туберкулезу. По данным Всемирной организации здравоохранения (ВОЗ), Российская Федерация (РФ) входит в список 22 стран с высоким бременем туберкулеза, на которые приходится около 80% случаев данного заболевания в мире. Согласно ее оценке, до 20% новых случаев туберкулеза в России остаются недиагностированными в течение года [335]. При этом каждый невыявленный больной с активной формой туберкулеза ежегодно может заразить до 15 человек, а риск возникновения заболевания у тубинфицированных лиц составляет от 15 до 50% уже в течение первых двух лет после контакта с больным. Своевременное применение эффективных методов диагностики туберкулеза может способствовать снижению темпов распространения данного заболевания [29, 31, 223].Традиционные методы диагностики туберкулеза обладают рядом недостатков: длительность культурального цикла Mycobacterium tuberculosis, недостаточная чувствительность анализа мазков, неспецифичность радиологического анализа и туберкулиновых проб, трудности диагностики внелегочного туберкулеза и другие [223]. Методы диагностики туберкулеза, основанные на детекции реакций иммунитета, могут стать привлекательной альтернативой традиционным методам, так как позволяют в ранние сроки выявлять заболевание вне зависимости от локализации очага и распространенности инфекции [31, 108]. Одним из перспективных методов иммунодиагностики туберкулеза является серодиагностика. Она в отличие, например, от туберкулинодиагностики обладает способностью дифференцировать активный туберкулез от латентной инфекции или предшествующей вакцинации бациллой Кальметта-Герена (БЦЖ). 7 К ее преимуществам можно также отнести простоту, воспроизводимость, малую инвазивность методик, скорость исполнения анализов. Серодиагностические тест-системы, выполненные в формате иммунохроматографических (ИХ) тестов, за счет невысокой цены и возможности их применения без специализированных лабораторий и медицинского персонала, могут быть востребованы для скрининга населения на туберкулез в странах с низким уровнем медицины [15, 108]. При разработке серодиагностических тест-систем по выявлению туберкулеза необходим аргументированный выбор антигенных препаратов. Эффективность данных тестов также в значительной степени зависит от качества антигенов, входящих в их состав, что обусловлено, прежде всего, способом их производства. Например, применение дрожжевой системы экспрессии Pichia pastoris, в отличие от традиционно используемой бактериальной системы Escherichia coli, позволяет получать рекомбинантные белки M. tuberculosis в гликозилированной форме, что сближает их по структуре с нативными антигенами и обеспечивает эффективное взаимодействие данных антигенов со специфическими антителами в иммунологических анализах [185, 273]. Важной задачей при конструировании новых антигенов для серотестов является оптимизация композиции эпитопов для компенсации индивидуальной и региональной гетерогенности гуморального ответа больных туберкулезом [349]. Перспективными подходами для объединения нужных эпитопов из различных антигенов являются получение химерных белков, кодируемых слитными генами, а также химическая конъюгация белков с углеводными молекулами, например, с гексаарабинофуранозидом (Araf6) - основным эпитопом липоарабиноманнана (ЛАМ) [108, 126, 136]. Таким образом, наиболее актуальной задачей развития серодиагностики туберкулеза является создание новых антигенов, которые смогут обеспечить чувствительность и специфичность серотестов, требуемые для возможности их применения в качестве первичного дополнительного метода обследования населения на туберкулез. 8 Степень разработанности темы исследования Впервые серодиагностика туберкулеза была применена в конце 19 века С. Арлоингом, но показала низкую эффективность [46]. Интерес к разработке серологических тестов на туберкулез возобновился после внедрения в научную практику иммуноферментного анализа (ИФА) [55, 223]. Однако использование в ИФА грубых антигенных препаратов из культуры M. tuberculosis приводило к возникновению перекрестных реакций с сыворотками здоровых людей, и, следовательно, низкой специфичности анализов [170, 318]. Современные серотесты включают преимущественно хорошо очищенные нативные или рекомбинантные белковые, а также гликолипидные антигены M. tuberculosis [48, 236, 303]. В настоящее время на рынке представлено более 70 серодиагностических тестов на туберкулез, но, в связи с недостаточными показателями их чувствительности и специфичности, ни один из тестов не рекомендован ВОЗ для применения без учета результатов традиционных методов диагностики туберкулеза [44, 292, 334, 335]. Цели и задачи Цель исследования - получение рекомбинантных и синтетических антигенов Mycobacterium tuberculosis и оценка их потенциала для применения в серодиагностике туберкулеза. Задачи исследования: 1. Сформулировать критерии выбора антигенов Mycobacterium tuberculosis, пригодных для серодиагностики туберкулеза. 2. Применить системы экспрессии Escherichia coli, Pichia pastoris, а также методы химического синтеза и конъюгации для получения антигенов Mycobacterium tuberculosis. 3. Сформировать панели сывороток здоровых доноров и пациентов с диагнозом туберкулез из одного региона Российской Федерации. 9 4. Провести сравнительный анализ чувствительности и специфичности взаимодействия полученных антигенов Mycobacterium tuberculosis с сыворотками здоровых доноров и туберкулезных больных с помощью иммуноферментного анализа. 5. Установить перспективные комбинации рекомбинантных и синтетических антигенов Mycobacterium tuberculosis для серодиагностики туберкулеза с учетом данных об индивидуальной вариабельности антительного ответа при туберкулезной инфекции. Научная новизна Впервые показана возможность получения ряда антигенов Mycobacterium tuberculosis, а именно Rv0040c, Rv1837c, Rv1860, Rv2873, Rv1636 - Rv2185c и Rv2875, в экспрессионной системе Pichia pastoris с целью дальнейшего использования их в качестве основного компонента серодиагностического теста на туберкулез. Установлено, что серодиагностический потенциал белков, экспрессированных в дрожжевой системе Pichia pastoris, выше, чем у аналогичных белков, экспрессированных в системе Escherichia coli, что свидетельствует о том, что применение системы Pichia pastoris для получения антигенов Mycobacterium tuberculosis может повысить эффективность серодиагностики туберкулеза. Получены новые данные о конъюгатах рекомбинантных белков с углеводными молекулами, а именно показано, что химическое конъюгирование ряда белков Mycobacterium tuberculosis, экспрессированных в системе Escherichia coli, с синтетическим гексаарабинофуранозидом липоарабиноманнана приводит к повышению чувствительности ИФА с сыворотками больных туберкулезом. Результаты тестирования 24 антигенов Mycobacterium tuberculosis с сыворотками, полученными из Саратовской области, позволили выявить наиболее перспективные антигены для применения в серодиагностике туберкулеза на территории данного региона. 10 Определены перспективные комбинации рекомбинантных и синтетических антигенов Mycobacterium tuberculosis для эффективного выявления туберкулеза с помощью серодиагностики в конкретном регионе (Саратовской области). Теоретическая и практическая значимость работы Разработана научно обоснованная концепция получения рекомбинантных антигенов Mycobacterium tuberculosis, пригодных для использования в серодиагностике туберкулеза. Определена значимость различных способов гликозилирования (микробиологического и химического) белковых антигенов Mycobacterium tuberculosis для их иммунореактивности в серологических тестах, что расширяет представления о роли углеводных молекул в иммунном ответе при туберкулезе. Показана возможность использования дрожжевой системы экспрессии Pichia pastoris для получения рекомбинантных белков Mycobacterium tuberculosis, пригодных для серодиагностики туберкулеза. Установлено, что антигены, экспрессированные в Pichia pastoris, имеют более высокую иммунореактивность с сыворотками больных туберкулезом, чем антигены, экспрессированные в системе Escherichia coli. Применяемые в работе лабораторные методы для получения ряда антигенов Mycobacterium tuberculosis в дрожжевой системе экспрессии Pichia pastoris могут быть легко масштабированы, что создает основу для массового производства недорогих и эффективных туберкулезных серотестов. Установлено, что химическое конъюгирование рекомбинантных белков Mycobacterium с tuberculosis липоарабиноманнана является синтетическим перспективным гексаарабинофуранозидом методом повышения эффективности серодиагностики туберкулеза. Полученные данные о серодиагностическом потенциале различных рекомбинантных и синтетических антигенов Mycobacterium tuberculosis могут учитываться при разработке новых серотестов на туберкулез. 11 Подобрана мультиантигенная композиция из рекомбинантных и синтетических антигенов Mycobacterium tuberculosis, обладающая высокой прогностической эффективностью, для выявления больных туберкулезом в Саратовской области. Результаты работы были использованы при разработке иммунохроматографических тестов для серодиагностики микобактериозов, в частности, туберкулеза и лепры (акт внедрения от 1.12.2014 г.). Методология и методы исследования Работа выполнена в отделе иммунобиохимии патогенных микроорганизмов Федерального бюджетного учреждения науки «Государственного научного центра прикладной микробиологии и биотехнологии» (ФБУН ГНЦ ПМБ). Методология исследования была определена соответственно поставленной цели. Предметом исследования стали проблемы, связанные с получением антигенов M. tuberculosis разными способами и оценкой их потенциала для целей использования в серодиагностике туберкулеза. Объекты исследования Основными объектами исследования являлись сыворотки крови больных туберкулезом и здоровых БЦЖ-вакцинированных доноров из Саратовской области. Панель сывороток контрольной группы составляли образцы сывороток от 30 здоровых БЦЖ-вакцинированных доноров из Саратовской области. Все доноры из контрольной группы были пациентами неврологического отделения Медицинского учреждения здравоохранения «1-ой городской клинической больницы им. Ю. Я. Гордеева» города Саратова, не состоящими на учете в туберкулезном диспансере и не имеющими клинических признаков туберкулеза. В панель сывороток исследуемой группы входили образцы от 100 больных туберкулезом легких с подтвержденным диагнозом, полученные из Государственного учреждения здравоохранения «Областного клинического противотуберкулезного диспансера» Саратовской области. 12 68% доноров больных туберкулезом были мужчины. Средний возраст больных составил 39 (от 18 до 80) лет. 90% доноров исследуемой группы были вновь выявленными больными, остальные - имели рецидив хронического туберкулеза. Распределение доноров по диагностированным формам туберкулеза было следующее (рисунок 1): 76% - инфильтративная, 11% - диссеминированная, 5% фиброзно-кавернозная, 5% - очаговая формы туберкулеза, 2% - туберкулема, 1% цирротический туберкулез. У 30 больных был выявлен туберкулез легких в фазе распада. 54% из всех больных были бактериовыделителями. Для 27% больных диагноз был подтвержден бактериоскопией мазка мокроты с окраской по Цилю-Нильсену, для 44% - посевом мокроты на плотные питательные среды. У 27% доноров исследуемой группы было выявлено носительство штаммов M. tuberculosis с множественной лекарственной устойчивостью (МЛУ). Ни один донор не имел вирус иммунодефицита человека (ВИЧ) положительного статуса. От всех доноров получено информированное согласие на использование образцов крови в исследовании. Сыворотки были собраны в течение двух недель, разделены на аликвоты, хранились при температуре минус 80°С и использовались в течение одного года. Изменений в их активности при повторных контрольных анализах не наблюдалось. В качестве материалов исследования в работе также были использованы хромосома M. tuberculosis штамма H37Rv (ФБУН ГНЦ ПМБ); плазмиды pET32b(+), pPIC9 (Invitrogen, США), pPMC1fopL-ag85B-esat-6 (ФБУН ГНЦ ПМБ); штаммы E. coli BL21-CodonPlus(DE3)-RP (Novagen, Inc., США), E. coli TOP10’F, E. coli DH5α, P. pastoris KM71 и GS115 (Invitrogen, США). 13 5% Инфильтративный туберкулез легких 2% 5% Цирротический туберкулез легких 11% Диссеминированный туберкулез легких Фиброзно-кавернозный туберкулез легких Очаговый туберкулез легких 1% 76% Рисунок 1 - Туберкулема Распределение доноров исследуемой группы по диагностированным формам туберкулеза Методы исследования В работе использовали методы молекулярной биологии (полимеразная цепная реакция (ПЦР), электрофорез ДНК, молекулярное клонирование, методы выделения ДНК), микробиологии (культивирование E. coli, P. pastoris), биохимии (аффинная хроматография, определение концентрации белка, высаливание, диализ, электрофорез белков в полиакриламидном геле (ПААГ)), иммунохимии (иммуноблот, ИФА), химии (химический синтез и конъюгация), статистики (параметрические и непараметрические методы анализа данных, анализ кривых операционной характеристики (ROC (receiver-operating characteristic) анализ)). Полимеразная цепная реакция. Реакционная смесь для ПЦР (25мкл) включала 10мМ Трис-HCl (pH=8,3), 1,5мМ MgCl2, 50мМ KCL, 0,2мМ дезоксинулеотидтрифосфат диметилсульфоксид, 1ед. 400 нМ (дНТФ), Taq ДНК - олигонуклеотидов, полимеразы (Fermentas, 5% Литва). Хромосомную ДНК M. tuberculosis штамма Н37Rv добавляли из расчета 10 нг на 25 мкл реакционной смеси. 14 Параметры ПЦР реакций: начальная денатурация 95ºС-3мин, 30 циклов: денатурация 95ºС - 30с, отжиг 50 - 64ºС (в зависимости от нуклеотидного состава праймеров) - 30с, элонгация 72ºС - от 30с до 3мин (в зависимости от длины амплифицируемого фрагмента ДНК), завершающая элонгация 72ºС - 10мин. Гены белков Rv0222, Rv1860, Rv2875, Rv3425, Rv3872, Rv3875 амплифицировали с хромосомы M. tuberculosis штамма H37Rv методом ПЦР со специфическими праймерами (Синтол, Москва) (приложение 1). Размеры амплифицированных генов и их расположение в хромосоме M. tuberculosis штамма H37Rv указаны в приложении 2. Для амплификации гена rv1837c первоначально с хромосомы M. tuberculosis штамма H37Rv методом ПЦР с помощью праймеров For2,6kb и Rev2,6kb амплифицировали участок ДНК (2600 пар оснований (п. о.)), содержащий нуклеотидную последовательность гена rv1837c. Очищенный продукт ПЦР, 2600 п. о., использовали в качестве матрицы для амплификации гена rv1837c со специфическими праймерами. Кодирующая последовательность rv1886c-rv3875 амплифицировали с pPMC1fopL-ag85B-esat-6 (любезно предоставлена В.М.Павловым (ФБУН ГНЦ ПМБ)) методом ПЦР. Гены rv0040c, rv1636, rv2185c, rv1860, rv2873, rv2875 амплифицировали с хромосомы M. tuberculosis штамма H37Rv методом ПЦР со специфическими праймерами (приложение 1). Ген rv1837c амплифицировали с плазмиды pET32bRv1837c. Гены rv0040c, rv1860, rv2875 амплифицировали без сигнальных последовательностей. Длины сигнальных последовательностей в генах рассчитывали программой SignalP 3.0 Server [272], они составили для rv0040c – 96 п. о., rv1860 –117 п. о., rv2875 – 90 п. о. «Гистидиновые таги», состоящие из 6 нуклеотидных последовательностей гистидина, вносили в гены с их 5’ концов праймерами. Анализ соответствия длин полученных фрагментов размерам амплифицируемых генов проводили посредством электрофореза (приложение 3). 15 Электрофорез ДНК. Электрофорез ДНК проводили в 1-2% агарозном геле в однократном трис-ацетатном буфере (ТАЕ (40 мМ Трис HCl, рН=8,0; 1 мМ этилендиаминтетрауксусной кислоты (ЭДТА); 20 мМ ледяная уксусная кислота)). Детектировали результаты визуализизацией гелей, окрашенных бромистым этидием, в ультрафиолетовом излучении. Методы выделения ДНК. Выделение плазмидной ДНК производили набором AxyPrep plasmid miniprep kit, геномной ДНК - AxyPrep Multisource Genomic DNA Miniprep Kit, а очистку ДНК из растворов и гелей - AxyPrep DNA Gel Extraction Kit (Axygen BioScience, США). Молекулярное клонирование и трансформация клеток E. coli. Полученные ампликоны генов (rv0222, rv1860, rv2875, rv3425, rv3872, rv3875, rv1837c, rv1886c-rv3875), гидролизованные сначала ферментом NdeI в течение 3 часов при 37ºС в однократном буфере О (Fermentas, Литва), а затем ферментами XhoI (для Rv1860), либо HindIII (для остальных генов) в однократном буфере R (Fermentas, Литва) в течение 3 часов при 37ºС, вставили по сайтам рестрикции NdeI и XhoI, либо NdeI и HindIII в плазмиду pET32b(+), гидролизованную соответствующими ферментами, в открытую рамку считывания с кодирующей последовательностью шести гистидинов. Лигирование гидролизованных вектора и генов проводили в соотношении линеаризованных концов вектор: вставка - 1:5, в 10мкл реакционной смеси, содержащей 5 ед. Т4ДНК лигазы (Fermentas, Литва), в течение 1 часа при 22ºС. Полученными лигазными смесями трансформировали химически компетентные клетки E. coli штамма TOP10 методом «теплового шока» в течение 45с при 42ºС. Трансформанты растили на среде Луриа-Бертани (LB) с 100 мкг/мл ампициллина при 37ºС. Соответствие нуклеотидных последовательностей вставок в рекомбинантных плазмидах соответствующим генам белков подтверждали секвенированием данных плазмид с Т7 праймерами (приложение 1) на приборе MEGA Base750 (Amersham, Швеция). Выделенными рекомбинантными плазмидами трансформировали химически компетентные клетки E. coli штамма BL21-CodonPlus(DE3)-RP методом «теплового шока» в течение 45с при 42ºС. 16 Молекулярное клонирование и трансформация клеток P. pastoris. Вектор pPIC9 и гены rv0040c, rv1636, rv1837c, rv1860, rv2873, rv2875 гидролизовали ферментами рестрикции EcoRI и NotI в однократном буфере О (Fermentas, Литва) в течение 16 часов при 37ºС, затем проводили лигирование гидролизованных вектора и генов в соотношении линеаризованных концов вектор: вставка - 1:5, в 10 мкл реакционной смеси, содержащей 5 ед. Т4 ДНКлигазы (Fermentas, Литва), в течение 1 часа при 22ºС. Плазмиду pPIC9Rv1636 и ген rv2185с рестрицировали ферментами AvrII и NotI в буфере Tango (Fermentas, Литва) при 37ºС в течение 16 часов, затем линеаризованных плазмиды pPIC9Rv1636 и гена проводили лигирование rv2185с. Полученными лигазными смесями трансформировали химически компетентные клетки E. coli штамма DH5α методом «теплового шока» 45с при 42ºС. Схема рекомбинантной плазмиды pPIC9 с встроенным геном белка представлена на рисунке 2. Трансформанты растили на среде LB с 100 мкг/мл ампициллина при 37ºС. Выделенные из них плазмиды анализировали на наличие соответствующих вставок рестрикционным картированием по сайтам EcoRI и NotI, методом ПЦР с праймерами AOX1 5’ и AOX1 3’, а также секвенированием плазмид с AOX1 3’ и AOX1 5’ праймерами на приборе MEGA Base750 (Amersham, Швеция). Рекомбинантные плазмиды pPIC9Rv0040c, pPIC9Rv1837c, pPIC9Rv1860, pPIC9Rv2873, pPIC9Rv1636-Rv2185с линеаризовали ферментом SacI, а плазмиду pPIC9Rv2875 - ферментом SalI (так как сайт рестрикции SacI присутствовал в гене Rv2875). Клетки штаммов P. pastoris GS115 (для плазмид pPIC9Rv1636-Rv2185с и pPIC9Rv1837c) и KM71 (для остальных плазмид) трансформировали линеаризованными плазмидами методом электропорации на приборе MicroPulser (Bio-Rad Laboratories, Inc.,США) в 0,2 см кювете в растворе 1 М сорбитола при 4°С (напряжение – 2 кВ, длительность воздействия – 5 мс). На рисунке 3 представлена схема вставки гена белка в AOX1 и his4 локусы хромосомы P. pastoris. 17 Рисунок 2 - Конструкция рекомбинантной плазмиды pPIC9. Примечания: PAOX1 – промотор гена AOX1; 6•cat - нуклеотидная последовательность, соответствующая 6 гистидинам; ATG - точка начала транскрипции; SacI, SalI, EcoRI, NotI - сайты рестрикции; HIS4 - ген гистидинол дегидрогеназы в pPIC9, his4 - мутантный ген гистидинол дегидрогеназы в хромосоме P. pastoris; стоп стоп-кодон. Рисунок 3 - Схема вставки гена белка в AOX1 (а) и his4 (б) локусы хромосомы P. pastoris. Примечания: PAOX1 – промотор гена AOX1; 6•cat нуклеотидная последовательность, соответствующая 6 гистидинам; HIS4 - ген гистидинол дегидрогеназы в pPIC9, his4 - мутантный ген гистидинол дегидрогеназы в хромосоме P. pastoris; стоп - стоп-кодон; стрелки на рисунке (а) обозначают возможные позиции вставки гена. Селекцию трансформантов проводили на чашках с агаром с минимальной средой с декстрозой (minimal dextrose (MD)) (1,34% дрожжевой азотной основы (yeast nitrogen base (YNB)) (Invitrogen, США), 0,04% биотин (Sigma-Aldridge, 18 Германия), 2% глюкоза, 1,5% агар (Panreac, Испания)) - по росту без гистидина, затем на чашках с агаром с минимальной средой с метанолом (minimal methanol (MM)) (1,34% YNB, 0,04% биотин, 1% метанол, 1,5% агар) - по росту с метанолом. Подтверждали наличие генов в хромосомах трансформированных штаммов методом ПЦР с AOX1 5’ и AOX1 3’ праймерами (приложение 1). Экспрессия рекомбинантных белков M. tuberculosis в системе E. coli. Экспрессию белков проводили в штамме E. coli BL21-CodonPlus(DE3)-RP под индукцией 1мМ изопропил-β-D-галактопиранозид (ИПТГ) и селективным давлением антибиотиков в среде LB (1% триптон, 0,5% дрожжевой экстракт, 1% хлорид натрия). Трансформированные штаммы-продуценты рекомбинантных белков M. tuberculosis выращивали в 5 мл среды LB, содержащей 100 мкг/мл ампициллина, 34 мкг∕мл хлорамфеникола, ночь при 30°С, 250 об/мин до насыщения OD600=4. Затем 1 мл полученной ночной культуры вносили в 500 мл среды LB с ампициллином (100 мкг/мл), хлорамфениколом (34 мкг/мл), растили до достижения поздней логарифмической фазы около 2 часов при 37oC, затем добавляли ИПТГ до 1 мМ, фенилметилсульфонил флуорид (ФМСФ) до 1 мМ и инкубировали при 37oC, 250 об/мин, в течение 4 часов. Экспрессия рекомбинантных белков в системе P. pastoris. Для оценки экспрессирующей способности отобранных клонов, было проведено культивирование в «малом объеме». Отобранные клоны растили 48 часов при 30ºС, 250 об/мин в буферизированной среде с глицерином (buffered glycerolcomplex medium (BMGY)) (1% дрожжевой экстракт, 2% пептон, 100 мМ калийфосфатный буфер, pH=6,0, 1,34% YNB, 0,04% биотин, 1% глицерин), затем клетки переносили в буферизированную среду с метанолом (buffered methanolcomplex medium (BMMY)) (состав аналогичен BMGY, но глицерин заменен на 1% метанол) до OD600=1. В качестве ингибитора протеаз вносили в среду казаминовые кислоты (Becton Dickinson, США) до 1%. Культуру инкубировали 100 часов при 30ºС, 250 об/мин, отбирая пробы культуры (клетки и супернатант) и добавляя метанол до концентрации 1% в среде каждые 24 часа. Образцы клеток из 0,5 мл среды лизировали с помощью литиказы (Sigma-Aldrich, Германия) 19 (0,1 мг/мл) в лизирующем буфере (1 М сорбитол, 10 мМ Трис-HCl, рН=7,5, 10 мМ дитиотреитол (ДТТ), 10 мМ ЭДТА), а образцы супернатанта из 0,5 мл среды концентрировали высаливанием белков сульфатом аммония до насыщения 70%, затем осадок растворяли в 10 мкл однократного буфера для образцов (50 мМ Трис-HCl, 10% глицерин, 1% додецилсульфат натрия (ДСН), 0,0025% бромфеноловый синий, 100 мМ β-меркаптоэтанол). Образцы анализировали в ДСН-электрофорезе в 10-12% ПААГ и в иммуноблоте. Препаративное культивирование (объем среды 400 мл) проводили в соответствии с методикой для культивирования в «малом объеме». Электрофорез белков. Электрофорез белков проводили по методу Лэммли в 10-12% разделяющем полиакриламидном геле [171]. Образцы белков вносили в гель в однократном буфере для образцов (50 мМ Трис-HCl, рН=6,8, 10% глицерин, 2% ДСН, 0,02% бромфеноловый синий, 1% β-меркаптоэтанол). Визуализировали полосы белков в геле после окраски их PageBlue ProteinStain (Fermentas, Литва). Очистка белков из культуры E. coli. Очистку белков из культуры E. coli проводили методом металлхелатной хроматографии в денатурирующих условиях с 8 М мочевиной. Культуру собирали после 4 часов индукции, центрифугировали 2800g 15 мин, клетки ресуспендировали в буфере нанесения (50 мМ Трис-НСl, рН=8,0, 500 мМ NaCl, 8M мочевина, 10 мМ имидазол), вносили ФМСФ до 1 мМ, обрабатывали ДНКазой I (10000 ед./мл), лизоцимом (20 мг/мл) и озвучивали на дезинтеграторе UDM-10 («Techpan», Польша) при 44 кГц, 1,8 кВт, 10 раз по 30 с, при 0°С. Лизат клеток центрифугировали 37000 g 15мин. Наличие белка в лизате культуры клеток E. coli BL21-CodonPlus(DE3)-RP подтверждали ДСН - электрофорезом в 10-12% ПААГ, а присутствие полигистидинового тага – в иммуноблоте [16]. Супернатант после центрифугирования лизата клеток наносили на колонку (Amersham, Швеция) с 5 мл иминодиуксусной сефарозы (Iminodiacetic acid Sepharose, Sigma-Aldridge, Германия), предварительно насыщенной ионами никеля и уравновешенной буфером нанесения. Колонку промывали 10 объемами буфера нанесения, 3 20 объемами буфера с 60 мМ имидазола (50 мМ Трис-НСl, рН=8,0, 500 мМ NaCl, 8 M мочевина, 60 мМ имидазол), затем элюировали белки элюирующим буфером (50 мМ Трис-НСl, рН=8,0, 250 мМ имидазол, 8 M мочевина, 500мМ NaCl). Фракции анализировали электрофорезом в 10% ПААГ (приложение 4 рисунки А, Б, Е1). Очистка белков из культуры P. pastoris. Очистку белков из культуры P. pastoris проводили методом металлхелатной хроматографии в нативных условиях. На пятые сутки индукции культуру P. pastoris центрифугировали 3000g 15мин, отбирали супернатант. Высаливали белки из супернатанта сульфатом аммония (Panreac, Испания) до насыщения раствора 70%, центрифугировали полученный раствор 33000g 30мин, осадок растворяли в буфере нанесения (50 мМ Трис-НСl, 500 мМ KCl, 10 мМ имидазол, рН=8,0) в объеме, соответствующем 2/3 первоначально отобранного количества супернатанта культуры. Раствор наносили на колонку с иминодиуксусной сефарозой (Iminodiacetic acid Sepharose, Sigma-Aldridge, Германия), предварительно насыщенную ионами никеля и уравновешенную буфером нанесения. Промывали колонку 3 объемами колонки (15 мл) буфера нанесения и 10 мл буфера с 30 мМ имидазола (50 мМ Трис-НСl, рН=8,0, 500 мМ KCl, 30 мМ имидазол). Элюировали белки элюирующим буфером (50 мМ Трис-НСl, 500 мМ KCl, 300 мМ имидазол, рН=8,0). Полученные фракции анализировали ДСН-электрофорезом в 10% ПААГ (приложение 4 рисунки В, Г, Е2). Диализ белков. Белки диализовали против фосфатного буфера (137 мМ NaCl, 2,7 мМ KCl, 8 мМ Na2HPO4, 1,4 мМ KH2PO4, рН=7,4) с добавлением ФМСФ до 1мМ в течение 16 часов при 22°С. Определение концентрации белков. Концентрации белков определяли ДСН-электрофорезом в 10% ПААГ или по методу Лоури [16]. Концентрации очищенных белков высчитывали с помощью коэффициентов молярной экстинкции (абсорбции) согласно закону Бира [222]. Измерения проводились на спектрофотометре СФ-56 (ОКБ Спектр, Россия) на 280 нм против диализного буфера. 21 Формула, использованная для расчета концентраций: С=А/εL, (1) где С - концентрация белка, А - поглощение раствора при OD280, L - длина прохода луча (в стандартной кювете, равное 1 см) ε - коэффициент молярной экстинкции, равный сумме числа (n) трех аминокислот, триптофана (W), тирозина (Y) и цистеина (C), умноженных на коэффициенты: ε (280) = 5500nW+1490nY+ 125nC. Конъюгирование рекомбинантных (2) белков M. tuberculosis с гексаарабинофуранозидным фрагментом ЛАМ. Белки еRv0222, еRv2376c, еRv2875, еRv3875, еRv3881c, еRv1886c-Rv3875, полученные в системе E.coli, были ковалентно конъюгированы с синтетическим гексаарабинофуранозидом ЛАМ методом химической конъюгации в Федеральном бюджетном государственном учреждении науки Институте органической химии им. Н. Д. Зелинского Российской академии наук (ФБГУН ИОХ РАН) [1, 32]. На рисунке 4 представлено схематическое изображение строения гликоконъюгата белка с Araf6 ЛАМ. Рисунок 4 - Строение гликоконъюгата белка с гексаарабинофуранозидом ЛАМ. Примечания: 1 - гексаарабинофуранозид ЛАМ, 2 - агликон-спейсер, 3квадратная кислота. 22 Первоначально синтезировали гексаарабинофуранозид в виде гликозида с агликоном-спейсером, необходимым для удаления углеводного лиганда от носителя и эффективного связывания гликоконъюгата со специфическими антителами. Затем проводили конъюгирование гексасахарида с рекомбинантными белками M. tuberculosis, используя в качестве линкера фрагмент квадратной кислоты. Появление в ультрафиолетовом (УФ) спектре белка дополнительной интенсивной полосы поглощения подтверждало успешное конъюгирование его с гексасахаридом. Размеры конъюгатов анализировали электрофорезом (приложение 4 рисунок Д). Иммуноблот анализ. Белки, разделенные ДСН-электрофорезом в 10% ПААГ, переносили из геля на поливинилиденфторидную мембрану (SigmaAldridge, Германия) с помощью прибора для блота (Mini trans-blot electrophoretic transfer cell (Bio-Rad,США)). Мембраны блокировали 5% обезжиренным молоком (Sigma-Aldridge, Германия) в 50 мМ фосфатном буфере при 4°С в течение 16 часов. После трехкратного промывания отмывочным буфером (50 мМ фосфатный буфер (рН=7,4), инкубировали с 0,05% твин-20 (Sigma-Aldridge, моноклональными Германия)) антиполигистидиновыми мембраны мышиными антителами, меченными пероксидазой хрена (Monoclonal anti-polyhistidine peroxidase conjugate produced in mouse (Sigma-Aldridge, Германия)) в разведении 1:2000 в течение 2 часов при 37°C в 50 мМ фосфатном буфере с 0,05% твин-20, затем, после отмывания мембран их проявляли 1 мМ динитрометилбензидин ацетат (Sigma-Aldridge, Германия) с 10 мкл 33% Н2О2 в 10 мл в 50 мМ фосфатного буфера (рН=7,4). Результаты представлены на рисунках А и Б приложения 5. Иммуноферментный анализ (ИФА). Детектирование специфических антител против антигенов M. tuberculosis в сыворотках доноров проводили с помощью метода твердофазного гетерогенного непрямого ИФА. Оптимальные количества компонентов ИФА определяли титрованием по методу «шахматной доски» (checkerboard system) с разведением сывороток (больных или здоровых доноров) в одном направлении, а антигена или анти-IgG конъюгата в другом. Для анализа были выбраны наименьшие разведения 23 сывороток (1:100), антигенов (0,1-1 мкг на лунку) и пероксидазного конъюгата антител против IgG человека (1:10000) при которых обнаруживаются различия между образцами двух групп сравнения. Большие концентрации конъюгата и сывороток могли стать причиной повышения оптической плотности образца в лунке за счет фона, обусловленного неспецифическим взаимодействием их с планшетом, а меньшие – не обеспечить связывания всех активных центров антигенов, и, следовательно, не выявлять всех молекул антител [301]. Кроме бланк-контроля (одной лунки с исследуемым антигеном, но без внесения антител сывороток доноров) в качестве контролей ИФА использовали 5 сывороток (2 сыворотки здоровых и 3 больных пациентов), которые наносили на каждый планшет с каждым исследуемым антигеном для последующего сравнивания результатов, полученных на разных планшетах с одним антигеном. Белки иммобилизовали в 96-луночных планшетах средней сорбции (Medium binding F-bottom plate (Greiner bio-one, Германия [65])) в концентрации 0,1-1 мкг на лунку (таблица 1) в 50 мМ карбонатно-бикарбонатного буфера (35 мМ NaHCO3, 15 мМ Na2CO3, рН=9,6) при 4°С в течение 16 часов. После однократного отмывания лунок отмывочным буфером (50 мМ фосфатным буфером с 0,025% твин-20) в них вносили по 200 мкл 5% обезжиренного молока (Sigma-Aldridge, Германия) и инкубировали в течение 1 часа при 37°С, 250 об/мин. Промывали лунки дважды отмывочным буфером, затем в них вносили образцы сывороток, разведенные 1:100 в 50 мМ фосфатном буфере (рН=7,4), и инкубировали в течение 1 часа при 37°С, 250 об/мин. Отмывали планшеты четыре раза. В каждую лунку вносили пероксидазный конъюгат антител против IgG человека (Sigma-Aldridge, Германия) в разведении 1:10000, инкубировали в течение 1 часа при 37°С и 250 об/мин. Промывали планшеты отмывочным буфером 5 раз. Вносили субстрат, содержащий тетраметилбензидин (ФГУП ГНЦ «НИОПИК») и регистрировали оптическую плотность на приборе Model 680 (BioRad, США) при 450 нм после остановки реакции 1М H2SO4 [111, 301]. 24 Таблица 1 - Концентрации антигенов, использованные при постановке ИФА Антигены рRv0040с, рRv2873, еRv3875, еRv3881с еRv1837с, еRv1860,еRv2376с, еRv2376сAr, еRv3872,Rv3881сAr еRv0222, еRv1886с-Rv3875, еRv1886с-Rv3875Ar, еRv3425 рRv1636-Rv2185с, рRv1837с еRv0222Ar, рRv1860 еRv0040с, еRv2875Ar, еRv3875Ar еRv2875, рRv2875, еRv3874 Концентрация 0,001 г/л 0,002 г/л 0,003 г/л 0,004 г/л 0,005 г/л 0,007 г/л 0,01 г/л Статистический анализ данных. Для статистического анализа данных, полученных в ИФА, использовали общепринятые методы статистической обработки данных, описанные в книге С. Гланца «Медико-биологическая статистика» [7], а также программы MedCalc (MedCalc Software, Бельгия) и Microsoft Office Exel (Microsoft, США). Тип распределения значений в выборках (группах здоровых и больных) определяли с помощью теста Д’Агостино-Пирсона в программе MedCalc [77]. При распределении данных анализа с белками по нормальному закону в обеих выборках высчитывали параметрические критерии различий, в противном случае применяли непараметрический тест Манна-Уитни. Согласно центральной предельной теореме при большом размере выборки (n≥100), распределение значений в группе признавали нормальным вне зависимости от результатов теста Д’Агостино-Пирсона. Выборочное среднее и выборочное стандартное отклонение вычисляли с помощью программы Microsoft Exel по формулам: X= ∑X ∕ n; SD=√∑( X - X)²∕ n - 1, (3) где X - выборочное среднее значений OD450 для контрольной, либо исследуемой групп, X - значение OD450 для одного образца, n - объем выборки, SD - выборочное стандартное отклонение для группы. Для определения статистической значимости выявленных различий высчитывали стандартную ошибку разности выборочных средних по формуле: S Xб-Xз = √((nб - 1) SDб² + (nз - 1) SDз²)(1∕ nб + 1 ∕ nз) ∕ (nб + nз - 2), (4) 25 а затем критерий Стьюдента (t): t = Xб - Xз ∕ SXб-Xз, (5) где nб – численность больных, nз – численность здоровых. Число степеней свободы, ν, определяли как ν = (nб - 1) + (nз - 1). (6) Критерий Стьюдента направлен на оценку различий средних величин Xз и Xб обеих выборок, которые распределены по нормальному закону. Если при данном числе степеней свободы и уровне значимости α расчетное t > tα, то различия между группами признавались статистически значимыми. При 5% уровне значимости (p<0,05) отвергали нулевую гипотезу о том, что различие между генеральными совокупностями равно нулю (когда различие объясняется случайностью выборки), и принимали альтернативную гипотезу, признающую статистическую значимость различий между группами. Доверительный интервал разности истинных средних определяли по формуле: Xб-Xз - tα SXб-Xз < μб-μз< Xб-Xз + tα SXб-Xз. (7) Если при α=0,05 интервал разницы средних принимал положительные значения, следовательно, можно было заключить, что с вероятностью 95% истинное значение разницы средних лежало в диапазоне определяемых значений, то есть различия между группами были статистически значимы. Медиану (50-й перцентиль), значение признака, которое делит вариационный ряд выборки на две равные части, для каждой выборки определяли с помощью компьютерных программ. Непараметрический тест Манна—Уитни позволял установить различия между группами по разнице сумм рангов каждой группы. Критерий МаннаУитни, U, определяли по формуле: U = nбnз + ½(nх(nх+1)) - Тх, (8) где Тх-большая из двух ранговых сумм, соответствующая выборке с nх единиц. Для полученных значений критериев определяли уровни значимости различий. Чем ниже оказывалось U, тем выше достоверность различий между уровнями 26 признака в рассматриваемых выборках. При p (вероятности справедливости нулевой гипотезы) менее уровня значимости α=0,05 различия между группами здоровых и больных признавали статистически значимыми. На основании данных статистической обработки данных рассчитали два «отсекающих» значения cutoff: cutoff1, которое наиболее часто используется в научной литературе для вычисления значений чувствительности и специфичности анализов в регионах, эндемичных по туберкулезу [119, 146, 149, 179, 239, 241, 253] cutoff1 = Xз + 2SD (9) и показатель для неэндемичных по туберкулезу регионов [136, 145, 153, 163, 337] cutoff2 =Xз+ 3SD. (10) Сыворотки больных туберкулезом, значения OD450 для которых были больше или равны cutoff, определяли как истинно положительные (ИП), меньше cutoff – ложноотрицательные (ЛО). Сыворотки из контрольной группы, значения OD450 для которых были меньше cutoff, определяли как истинно отрицательные (ИО), а больше или равны cutoff – ложноположительные (ЛП). Чувствительность (Ч) и специфичность (С) анализов высчитывали по формулам: Ч = (ИП ∕ nб) х100%, С = (ИО ∕ nз) х 100%, (11) где nз и nб - объемы выборок контрольной и исследуемой групп, соответственно. Показатель отношение правдоподобия объединяет показатели чувствительности и специфичности и показывает насколько вероятность получить данный результат теста выше у больных, чем у здоровых пациентов. Положительное отношение правдоподобия (ОП+), отношение вероятности того, что положительный результат теста выявит наличие заболевания, к вероятности того, что он выявит отсутствие заболевания, или отношение истинно положительного уровня к ложно- положительному, и отрицательное отношение правдоподобия (ОП-), отношение вероятности того, что отрицательный результат теста выявит наличие заболевания, к вероятности того, что он выявит отсутствие заболевания, или отношение ложно- отрицательного уровня к истинно отрицательному, рассчитывали по формулам: 27 ОП+ = Ч ∕1 - С; ОП- = 1 - Ч ∕ С. (12) Значение ОП+ показывает во сколько раз вероятность положительного результата у больного выше, чем у здорового пациента. Чем больше значение ОП+ (>1) и меньше ОП- (<1), тем выше эффективность теста [101]. Диагностическая достоверность (диагностическая точность или эффективность) выражается в виде доли правильно классифицированных субъектов, или истинных результатов, из общего объема выборки. Диагностическая достоверность (ДД) зависит от распространенности заболевания, поэтому используется для сравнения результатов анализов для одной популяции, либо в комплексе с другими диагностическими критериями [277]. Ее рассчитывали так: ДД = (ИП+ИО) ∕ nб+nз. (13) Корреляционный анализ позволяет выявить взаимосвязь между изменением значений двух различных признаков. Сила этой связи выражается в значении коэффициента корреляции (Пирсона), который обозначается r. При r = 0 корреляция между значениями признаков отсутствует, r > 0 – связь между ними прямая, r < 0 – обратная. Статистическую значимость результатов анализа признавали при р < 0,05. Статистическая значимость различий в частотах истинных результатов между группами определяли с помощью критерия χ² (критерия Пирсона) с поправкой Йеитса на непрерывность (так как ν = 1), определяемого как χ²=∑(|О - Е|- ½)² ∕ Е, (14) где О - наблюдаемое число в клетке таблицы сопряженности, Е - ожидаемое число в той же клетке. Полученные значения критериев χ² сравнивали с критическими значениями χ² при степени свободы ν = 1 и определяли соответствующие уровни значимости статистических различий. При p<0,05 признавали статистическую значимость различий в частотах между двумя группами. ROC анализ используется для визуализации и анализа поведения диагностических систем [93]. Данный метод позволяет дифференцировать случаи 28 заболевания от нормальных показателей. Анализ ROC-кривых используется для сравнения эффективности двух и более диагностических тестов [105, 351]. Кривая ROC – это график зависимости истинно положительного уровня (чувствительности) от ложноположительного (1 - специфичность, или представительность) для различных возможных значений диагностического теста. Она демонстрирует зависимость между чувствительностью и специфичностью анализа (любое специфичности). повышение Чем чувствительности ближе кривая приводит расположена к к снижению оси ординат (чувствительность) и чем дальше от оси икс (представительность), тем более точным является тест. Точность теста определяется с помощью площади под ROC-кривой (ППК). Идеальный тест имеет значение ППК, равное 1. ППК, равное 0,5, означает, что тест является неэффективным. Чем ближе кривая к диагонали, соответствующей ППК = 0,5, тем ниже дифференцирующая способность теста между здоровыми и больными пациентами. С помощью параметра ППК можно сравнивать различные тесты между собой. ROC анализ позволяет определить оптимальный порог отсечения, или значение критерия, при котором сумма чувствительности и специфичности для данного теста максимальна. Данному критерию соответствует параметр индекс Юдена (Youden index), J, который рассчитывается по формуле: J = максимальные (чувствительность (К) + специфичность (К) - 1), (15) где К - выбранный программой критерий [341]. Графически J соответствует максимальному расстоянию по вертикали между ROC-кривой и диагональю. Индекс Юдена позволяет сравнивать эффективность различных тестов. Личное участие автора в получении результатов Соискатель составила план исследования, выполнила аналитический обзор литературы, получила 14 рекомбинантных белков M. tuberculosis в экспрессионных системах E. coli и P. pastoris, сформировала панели сывороток больных туберкулезом и здоровых доноров, провела ИФА и статистическую обработку экспериментальных данных. Конъюгаты рекомбинантных белков 29 M. tuberculosis с синтетическим гексаарабинофуранозидом ЛАМ получила совместно с Л. О. Кононовым, Н. М. Подвальным, П. И. Аброниной и Т. М. Мельниковой (ФБГУН ИОХ РАН). Секвенирование фрагментов рекомбинантных плазмид, а также хромосом рекомбинантных штаммов P. pastoris, несущих целевые гены проводила совместно с А. Г. Богуном (ФБУН ГНЦ ПМБ). Положения, выносимые на защиту: 1. Использование бактериальной (Escherichia coli) и дрожжевой (Pichia pastoris) систем экспрессии, а также химическое конъюгирование рекомбинантных белков с гексаарабинофуранозидом липоарабиноманнана позволяет получить антигены Mycobacterium tuberculosis, взаимодействующие с сыворотками больных туберкулезом. 2. Рекомбинантные антигены Mycobacterium tuberculosis, полученные в экспрессионной системе Pichia pastoris, обладают большей чувствительностью в ИФА с сыворотками больных туберкулезом, по сравнению с аналогичными антигенами, полученными в экспрессионной системе Escherichia coli. 3. Химическое конъюгирование ряда рекомбинантных белковых антигенов Mycobacterium tuberculosis, полученных в экспрессионной системе Escherichia coli, с синтетическим гексаарабинофуранозидом липоарабиноманнана приводит к повышению чувствительности ИФА с сыворотками больных туберкулезом. Степень достоверности и апробация результатов Достоверность результатов исследования обусловлена использованием в ней большого объема фактического материала, полученного с использованием методов молекулярной биологии, микробиологии, иммунологии и органической химии на современном сертифицированном оборудовании. Экспериментальные данные были статистически обработаны с помощью специализированных компьютерных программ и представлены в виде графиков и таблиц. Диссертация апробирована на заседании межлабораторного семинара ФБУН ГНЦ ПМБ (протокол № 38 от 14 ноября 2014 г.). 30 Результаты работы были доложены и обсуждены на Научно-практической школе-конференции молодых учёных и специалистов Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека Российской Федерации «Биологическая безопасность в современном мире» (21-22 апреля 2009 г., Оболенск) и на VII Всероссийской научно-практической конференции с международным участием «Молекулярная диагностика-2010» (24-26 ноября 2010 г., Москва). Публикации По теме диссертации опубликовано 5 печатных работ, из них 3 статьи опубликованы в рецензируемых научных изданиях и 2 тезиса – в материалах конференций. Объем и структура диссертации Основной текст диссертации изложен на 209 страницах машинописного текста и состоит из введения, основной части, включающей обзор литературы и собственные исследования, заключения и 5 приложений. Список литературы содержит 351 источник, в том числе 29 - отечественных и 322 - зарубежных авторов. Диссертация иллюстрирована 13 таблицами и 14 рисунками. 31 ОСНОВНАЯ ЧАСТЬ Глава 1. Обзор литературы 1. 1. Эпидемиологическая ситуация по туберкулезу в Российской Федерации Туберкулез распространение. относится Одна треть к заболеваниям, населения земного имеющим шара глобальное инфицирована M. tuberculosis и каждый год около 9 миллионов людей заболевают туберкулезом. Туберкулез второе место после ВИЧ/СПИД в структуре смертности от одного инфекционного агента. ВОЗ включила Российскую Федерацию в список из 22 стран с высоким бременем туберкулеза [335]. Согласно отчету Федерального центра мониторинга противодействия распространению туберкулеза в РФ в 2013 году общая распространенность туберкулеза составила 145,7, заболеваемость - 63, а смертность – 11,3 на 100 000 населения. Наиболее тяжелая эпидемическая ситуация по туберкулезу в 2013 году была в Дальневосточном, Уральском и Сибирском федеральных округах РФ [19, 21]. Высокий уровень заболеваемости туберкулезом в России обусловлен, прежде всего, наличием в стране большого резервуара туберкулезной инфекции, который поддерживается за счет значительной инфицированности населения [11, 29]. Негативное влияние на эпидемиологическую ситуацию по туберкулезу в России оказывает рост заболеваемости ВИЧ-инфекцией. Туберкулез является основной оппортунистической инфекцией у ВИЧ-инфицированных. Риск развития туберкулеза у данной категории людей превышает 10% в год, а запаздывание выявления заболевания и начала соответствующего лечения более чем на три недели после его активации является причиной 45-85% случаев летального исхода при сочетании двух инфекций [31, 49, 73, 296]. 32 В РФ наблюдается один из самых высоких темпов роста заболеваемости ВИЧ - инфекцией в мире. Более 10% новых случаев туберкулеза в России выявляется у ВИЧ-инфицированных людей [5, 9, 233]. Для туберкулеза у ВИЧ-инфицированных, как правило, характерны атипичные некавернозные легочные и внелегочные локализации, которые довольно сложно диагностируются классическими клиническими и лабораторными методами. Многокомпонентная превентивная терапия против туберкулеза у всех ВИЧ-инфицированных, особенно повторные курсы или пожизненная профилактика, практически не осуществимы. Кроме того, для ее назначения, согласно рекомендации программы ВОЗ по ВИЧ/СПИД, необходимо исключение активного туберкулеза для снижения риска развития лекарственной устойчивости у циркулирующих штаммов M. tuberculosis [78, 223]. Ухудшению эпидемиологической ситуации по туберкулезу в России способствуют пенитенциарных высокая распространенность учреждений, а также среди туберкулеза мигрантов среди и лиц социально дезадаптированных лиц. По данным Министерства здравоохранения РФ в 2011 году среди впервые выявленных больных туберкулезом 11,3% составили лица, зарегистрированные Федеральной службой исполнения наказания, 2,7% иностранные граждане, 2,2% - лица без определенного места жительства. Из 35 000 заключенных, больных туберкулезом, в 2011 году около 24% составляли носители штаммов M. tuberculosis с МЛУ и 17,5% имели сочетанную патологию ВИЧ и туберкулез (ВИЧ+ ТБ+) [12, 23]. Неполный охват населения профилактическими осмотрами (65,8% в 2013 году), запаздывание диагностики и низкая эффективность лечения больных туберкулезом с МЛУ также являются факторами, ассоциированными с ростом заболеваемости туберкулезом в России. При этом традиционные методы диагностики туберкулеза не обладают достаточной эффективностью для выявления данного заболевания на ранних стадиях, особенно у детей, у людей со сниженным иммунитетом и другими сопутствующими патологиями [21]. 33 Новые методы диагностики, основанные на детекции реакций иммунитета при туберкулезе, обладают рядом преимуществ, по сравнению с методами «золотого стандарта», и внедрение их в практику может внести вклад в улучшение эпидемиологической ситуации по туберкулезу в России [31]. 1. 2. Современные методы диагностики туберкулеза «Золотым стандартом» диагностики туберкулеза считается выявление M. tuberculosis при бактериоскопическом или культуральном исследованиях. Эти методы позволяют визуально обнаружить микобактерии в биологических жидкостях организма, однако, они не всегда эффективны. С помощью бактериоскопии мазка мокроты трудно отличить M. tuberculosis от других кислотоустойчивых бактерий. Кроме того, для детекции микобактерий в мазке необходимо не менее 105 бактерий на 1 мл образца, что возможно лишь для больных с массивным бактериовыделением. По данным зарубежных авторов, чувствительность данного метода для пациентов с легочным туберкулезом не превышает 50% [31, 85]. В РФ в 2011 году только 31,5% случаев впервые выявленного ЛТБ было подтверждено микроскопией мазка и лишь 43% - посевом мокроты, при рекомендуемых уровнях - 50% и 75%, соответственно [23]. Культуральный метод диагностики туберкулеза высокоспецифичен и позволяет определять чувствительность возбудителя к антибиотикам. Однако этот метод требует длительного ожидания (занимает 4-12 недель) и в части случаев оказывается безрезультатным [162]. Полуавтоматизированный радиометрический культуральный метод с использованием таких систем, как BACTEC TB-460, BACTEC MGIT 960 (Becton Dickinson, Sparks, MD) и MB/BacT (Organon Teknika), позволяет обнаружить возбудителя в более короткие сроки (10-20 дней), однако, достаточно дорог для повсеместного применения [6, 223]. Рентгенологическое обследование неспецифично и, по мнению некоторых авторов, не является экономически оправданным методом скрининга населения на туберкулез [330]. При сочетании туберкулеза с ВИЧ-инфекцией этот метод 34 часто дает атипичную картину, и в 10-20% изменения на рентгенограмме остаются в пределах нормы [31, 215]. Методы диагностики, основанные на ПЦР (Amplified Mycobacterium tuberculosis Direct Test, Gen-Probe; Amplicor, Roche; ProbeTec ET, BD Becton Dickinson, Sparks, MD) имеют высокую специфичность. В тоже время, чувствительность их, как правило, невысокая, что обусловлено трудностями амплификации олигобациллярных образцов, влияния ингибиторов, присутствующих в образцах, на течение реакции и другими факторами. С помощью ПЦР сложно дифференцировать M. tuberculosis от других представителей комплекса M. tuberculosis из-за высокого сходства их геномов. Также применение этих методов ограниченно относительно высокой стоимостью анализа, необходимостью наличия дорогостоящего оборудования и квалифицированных специалистов [31, 218, 223, 284]. Иммунодиагностика предоставляет новые возможности для улучшения диагностики туберкулеза. Она позволяет обнаружить активный туберкулезный процесс в организме на основании иммунологических признаков инфекции. Иммунодиагностика имеет перспективы для выявления туберкулеза в короткие сроки вне зависимости от локализации инфекции и формы заболевания [31]. Современные методы диагностики туберкулеза, основанные на реакциях клеточного и гуморального иммунитета, обладают чувствительностью и специфичностью, достаточными для дифференцирования активного туберкулеза от предшествующей вакцинации БЦЖ или контакта с непатогенными микобактериями (НМБ), а также от предыдущего инфицирования M. tuberculosis [102]. Преимуществами серодиагностических ИХ тест-систем на туберкулез является их простота, воспроизводимость, малая инвазивность, доступность для стран с низким уровнем жизни населения, а также возможность их использования даже в, так называемых, полевых условиях без наличия специализированных лабораторий и персонала [102, 292]. Преимущества и недостатки различных методов диагностики туберкулеза представлены в таблице 2. 35 Таблица 2 - Преимущества и недостатки различных методов диагностики туберкулеза [223] Методы Клинические признаки Кожный тест Рентгенография Бактериоскопия Культуральное исследование BACTEC ПЦР IGRA Иммуногистохимический Биосенсоры ИФА ИХ тесты Преимущества Быстрая диагностика Недостатки Неспецифичный, нерешающий Простой в исполнении, не Требует повторного визита; на требует оборудования результат влияют: БЦЖ, ВИЧ, контакт с НМБ Визуальный, определяет Неспецифичный, облучение палокализацию, циентов протяженность процесса Низкая стоимость, быстрый Низкая чувствительность Специфичный, позволяет определять устойчивость к антибиотикам Специфичный Трудности в сборе материала, длительный (4-8 недель), не всегда возможен Длительный (2-3 недели), дорого-стоящий, не всегда применим Относительно быстрый Относительно дорог, (5часов), необходимы специалисты, высокоспецифичный оборудование, де-тектирует латентный туберкулез Быстрый, воспроизводимый Необходимы оборудование, специалисты, дорогостоящий Высокочувствительный, Требуется подготовка биопсийисследование различных ного материала, подтверждение тканей результатов другими методами Быстрый (1-3 часа), Дорог для ежедневного чувствительный использования Быстрый (2 часа), Необходимо специальное воспроизводимый оборудование Очень быстрый (10 минут), Нет количественной характевоспроизводимый, не ристики, менее чувствительный, требует оборудования, по сравнению с ИФА специального обучения методу Примечания: IGRA – interferon gamma release assays - методы детекции высвобождения гамма-интерферона (γ-ИНФ) лимфоцитами. 36 1. 2. 1. Современные методы иммунодиагностики туберкулеза 1. 2. 1. 1. Туберкулинодиагностика Уже более ста лет туберкулинодиагностика остается единственным широко распространенным методом массовой диагностики туберкулеза. С целью выявления людей больных туберкулезом, лиц с повышенным риском развития заболевания или нуждающихся в ревакцинации, а также для мониторинга эпидемиологической ситуации по туберкулезу в России ежегодно проводится обследование детей, подростков и декретированного контингента с помощью пробы Манту (внутрикожным введением 2 ТЕ туберкулина ППД-Л и регистрацией размеров папулы через 72 часа) [18]. Патофизиологической основой туберкулиновой пробы является гиперчувствительность замедленного типа на вводимый внутрикожно неполный антиген-туберкулин. Гиперергическая реакция на туберкулин и вираж туберкулиновой пробы являются показаниями для дальнейшего обследования на туберкулез [294]. Несмотря на широкое распространение туберкулинодиагностики, у нее есть ряд существенных недостатков. Прежде всего, туберкулин содержит более 200 микобактериальных антигенов, многие из которых встречаются и у других микобактерий, в том числе и у вакцинного штамма M. bovis BCG. Проба Манту имеет низкую специфичность и дает возможности отличить активный туберкулез от вакцинации БЦЖ, предшествующего инфицирования M. tuberculosis или перекрестной реактивности с непатогенными микобактериями окружающей среды [247]. В тоже время, при некоторых патологиях туберкулиновая чувствительность у пациентов может полностью отсутствовать (туберкулиновая анергия). Туберкулиновая анергия характерна для больных с тяжелым прогрессирующим течением туберкулёза, при сочетании туберкулеза со злокачественными новообразованиями, острыми инфекционными заболеваниями, выраженными иммунодефицитами, а также для 15% пациентов с вновь выявленным 37 туберкулезом, у которых по мере стабилизации процесса реактивность восстанавливается [271]. Напротив, ложноположительные реакции могут быть проявлением поствакцинального иммунитета, возникать при контакте с нетуберкулезными микобактериями, а также при частой (более одного раза в год) постановке пробы («бустерный эффект») [204]. При постановке пробы и оценке результатов существенную роль играет человеческий фактор. Тест Манту довольно сложно выполнить правильно, так как небольшие вариации способа исполнения процедуры изменяют количество туберкулина, внесенное в кожу, и, следовательно, последующую величину реакции. Более того, измерения реакции крайне субъективны [204, 223]. По данным литературы, туберкулиновый кожный тест имеет чувствительность около 70% среди случаев подтвержденного активного туберкулеза, а у людей с ослабленным иммунитетом около 30% [223]. В исследовании А. Ф. Мейснер чувствительность туберкулинодиагностики среди детей составила 53,7% , а среди подростков – только 14,2% [14]. В настоящее время в РФ разрешен к применению «Диаскинтест» («Лекко», Россия), основанный на детекции реакции клеточного иммунного ответа организма на белки M. tuberculosis (ESAT-6, CFP-10). Он высокочувствителен (по данным литературы до 78,4% у взрослых и 90,5% у детей), однако, инвазивность метода, наличие противопоказаний, вероятность развития анергии также могут в некоторых случаях ограничить его применение [26]. 1. 2. 1. 2. Методы детекции высвобождения гамма-интерферона Современные методы диагностики туберкулеза, основанные на реакциях клеточного (Interferon Gamma Release Assays (IGRA)) и гуморального иммунитета (тесты ИФА, ИХ, иммунодот), могут стать привлекательной альтернативой пробе Манту, показывая более высокую эффективность выявления заболевания при отсутствии недостатков, присущих кожному тесту [64]. Методы IGRA (ELISPOT и QuantiFERON-TB) основаны на детекции высвобождения γ-ИНФ лимфоцитами при контакте с антигенами M. tuberculosis [298]. 38 Метод ELISPOT заключается в определении количества эффекторных Тлимфоцитов, секретирующих γ-ИНФ in vitro при контакте с антигенами M. tuberculosis. Этот метод обладает высокой чувствительностью, так как позволяет выявлять единичные Т-клетки, имевшие контакт с антигенами M. tuberculosis и, таким образом, диагностировать латентный туберкулез и туберкулез у пациентов со сниженным иммунитетом. Чувствительность метода, по оценкам разных авторов, может достигать 96% - среди пациентов с активным туберкулезом, 85% - при латентной инфекции и около 92% у ВИЧинфицированных туберкулезных больных. В новом поколении тестов ELISPOT T-SPOT.TB (Oxford Immunotec, Великобритания) в качестве антигенов, стимулирующих продукцию γ-ИНФ, используются белки (ESAT-6, CFP-10), отсутствующие в вакцинном штамме M. bovis BCG и у большинства нетуберкулезных микобактерий [172, 203]. Оригинальный QuantiFERON-TB и улучшенные его версии QuantiFERON-TB Gold (QFT-G) и QuantiFERON-TB Gold In-Tube (QFT-GIT) (Cellestis ltd., Австралия) – это диагностические препараты, которые посредством метода ИФА определяют уровень γ-ИНФ, высвобождающегося из Т-клеток цельной крови человека, инфицированного M. tuberculosis, в ответ на стимуляцию их туберкулином PPD, двумя (ESAT-6, CFP-10) или тремя (ESAT-6, CFP-10 и ТВ7.7) белками M. tuberculosis, соответственно [94, 234]. В работе G. Ferrara и соавторов тест QFT-G показал лучшую выявляемость туберкулеза (73%) среди больных активным внелегочным туберкулезом, по сравнению с пробой Манту (68%), однако, худшую, по сравнению с T-SPOT.TB (100%) с теми же образцами крови [96]. В связи с тем, что положительный результат тестов IGRA не позволяет различить латентный и активный туберкулезные процессы, специфичность методов, основанных на определении γ-ИНФ, при детекции активного туберкулеза может оказаться невысокой (по данным M. Sester - от 59% для TSPOT.TB и от 79% - для QFT-G). Методы IGRA, как правило, менее эффективны в случаях туберкулеза у детей и у людей с иммунодефицитами [64, 268]. 39 В развитых (неэндемичных) странах IGRA рекомендуются использовать для выявления латентного туберкулеза среди контактных лиц, так как эти методы более специфичны и информативны, по сравнению с пробой Манту. В странах, эндемичных по туберкулезу, в связи с высокой инфицированностью населения методы IGRA информативны в основном для целей мониторинга состояния ВИЧинфицированных лиц с высоким риском развития заболевания, например, при семейном контакте с больным туберкулезом, а также при общей оценке эпидемиологической ситуации по туберкулезу в различных популяциях [31]. К преимуществам вышеназванных методов можно отнести неинвазивность методики, объективность оценки результатов, доступность результатов в течение 24 часов, отсутствие влияния предыдущей вакцинации БЦЖ и контакта с нетуберкулезными микобактериями, высокая степень достоверности методов (р<0,01). Однако эти методы требуют наличия квалифицированных специалистов, дорогостоящего оборудования, свежих образцов крови с жизнеспособными лейкоцитами, что достаточно трудно выполнить в большинстве регионов с высокой распространенностью туберкулеза [39, 305]. 1. 2. 1. 3. Иммуносеродиагностика Серодиагностика туберкулеза берет свое начало в 1898 году, когда С. Арлоинг впервые использовал сыворотки больных туберкулезом пациентов в реакции гемагглютинации [46]. Однако этот метод не соответствовал в полной мере требованиям по чувствительности и специфичности, предъявляемым для диагностики туберкулеза в тот период. С внедрением в научную практику в 1971 году простого, воспроизводимого, высокочувствительного и недорогого метода ИФА интерес к серодиагностике туберкулеза в научных кругах снова возобновился. Метод ИФА позволяет регистрировать повышенный уровень антимикобактериальных антител у больных туберкулезом, по сравнению со здоровыми людьми [55, 223]. В ранних исследованиях гуморального иммунного ответа для выявления серореактивных M. tuberculosis, антител на использовались которые возникали грубые антигенные перекрестные реакции препараты у БЦЖ- 40 вакцинированных здоровых людей и у лиц, контактных по НМБ [170, 318]. Первыми очищенными антигенами, на которые тестировался антительный ответ, были белки, преобладающие в антигенном спектре туберкулина: 38 килодальтон (кДа), 30 кДа (Ag85B), 19 кДа, 14 кДа белки, а также гликолипид липоарабиноманнан (ЛАМ). Наиболее высокие значения чувствительности и специфичности выявлял 38 кДа антиген [36, 42, 350]. В последних исследованиях для оценки гуморального иммунитета у туберкулезных рекомбинантные больных белки, методом ИФА синтетические используют пептиды и преимущественно липидные антигены M. tuberculosis [48, 236, 303]. При создании серодиагностического теста важен аргументированный выбор класса детектируемых антител против антигенов, составляющих основу теста. Большинство исследователей гуморального иммунного ответа при туберкулезе отдают свое предпочтение определению противотуберкулезных IgG антител, так как их обнаруживают в крови пациентов в активную фазу туберкулеза в большем титре, чем другие классы иммуноглобулинов. Однако в некоторых исследованиях при объединении результатов ИФА тестов, определяющих IgG и IgА к одному антигену M. tuberculosis, наблюдается значительное увеличение общей чувствительности, по сравнению с результатами отдельных тестов. Определение IgM антител, несмотря на низкую частоту положительных реакций, также может внести вклад в улучшение общей чувствительности серодиагностического теста наряду с определением IgG и IgA у больных туберкулезом. Большинство коммерческих серодиагностических тестов детектирует все три класса антител [236]. Разработаны методики определения антител к антигенам M. tuberculosis не только в сыворотке крови, но и в моче, и в других биологических жидкостях [79,170]. Например, в моче определяют антитела против МРТ32, 81 кДа белка, ЛАМ, а в цереброспинальной жидкости (ЦСЖ) - 65 кДа, 14 кДа белки, CFP-10, CFP-21, MPT64, ESAT-6 и другие. Однако в настоящее время эти методы обладают меньшей эффективностью выявления туберкулеза, по сравнению с 41 определением антител в образцах сыворотки крови [56, 167, 168, 211, 279, 299, 300]. На основании результатов, полученных в исследованиях гуморального иммунитета при туберкулезе, разрабатываются тест-системы для серодиагностики. Данные о некоторых коммерческих серодиагностических тест-системах приведены в таблице 3. ИФА тест-системы позволяют обнаруживать антитела различных классов к одному или нескольким иммунодоминантным антигенам M. tuberculosis. Данный формат серологических тест-систем имеет преимущества при использовании его в лабораториях с большим количеством образцов, при этом он может быть полностью автоматизирован [44, 292]. Тест-системы для серодиагностики могут быть выполнены в виде ИХ теста, или стрип-теста. Главными преимуществами этих тестов являются их простота, скорость исполнения и невысокая цена. Этот формат, при условии высоких показателей чувствительности и специфичности, является оптимальным для скрининга населения в станах с низким уровнем жизни. На рисунке 5 представлен график сравнительной эффективности различных коммерческих тест-систем для диагностики туберкулеза. В настоящее время на территории РФ разрешены к применению в клинической практике Министерства здравоохранения Российской Федерации несколько серологических тестов на туберкулез: TB-Spot ver.2.0 (Span Diagnostics Ltd, Индия), iCHECK-TB (IND, Канада) и ИммуноХром-анти-МТ-Экспресс (ООО Прогрессивные Био-Медицинские Технологии, Россия). TB-Spot ver.2.0 позволяет обнаруживать антитела к антигенам M. tuberculosis (ЛАМ и 38 кДа белку) в 8085% случаев туберкулеза и имеет специфичность 95%. Другие два теста основаны на определении антител к антигенному комплексу M. tuberculosis А60 - их чувствительность составляет 70-80%, а специфичность - 80-100% среди различных групп туберкулезных больных на территории РФ [44, 292]. 42 Таблица 3 - Характеристики коммерческих тест-систем серодиагностики туберкулеза легких [44, 87, 96, 178, 203, 246, 263, 285, 292] Название теста Anda-TB Антигены А60 Detect-TB 5 н. у. Тип Ig A,G, M 3 рекомбинантных A,G, 2 синтетических M нативный A,G, рекомбинантный M Метод рекомбинантные G ИФА Omega Diagnostics Великобритания корднативные фактор, ТАТ, PGL-Tb1 Kp-90 нативный G ИФА Kyowa Medex, Япония A, G ИФА Kreatoch, Голландия ЛАМ G иммуMossman нодот Assodates, США ИХ тест ICT Diagnostics, Австралия ИХ тест Immuno Diagnostic, США ИХ тест Прогрессивные БиоМедицинские -Технологии, Россия ИХ тест IND, Канада Pahtozyme ЛАМ, Myco 38кДа Pahtozyme TB Complex Plus TB glycolipid assay TB enzyme immune assay MycoDotTB ICT-TB test Accuscreen Иммуно Хроманти-МТЭкспресс iCHECKTB TB-Spot ver.2.0 38кДа, 16кДа Источники антигенов нативный нативный 38 кДа, рекомбинантные 4н.у. н. у. н. у. G А60 нативный A, G, M А60 нативный ЛАМ, 38кДа нативный рекомбинантный A,G, M A,G, M G,M ИФА ИФА ИФА иммунодот Производитель, страна Anda Biological, Франция BioChemImmuno Systems, Канада Omega Diagnostics, Великобритания Span Diagnostics Ltd, Индия Примечания: н. у.- антиген M. tuberculosis не указан производителем, ТАТ - триацилтрегалоза, PGL-Tb1 - фенольный гликолипид. для 43 Рисунок 5 - График распределения коммерческих тест-систем по их диагностической эффективности при легочном туберкулезе [87] Данные об эффективности тестов в различных регионах существенно отличаются. Например, ИФА тест-система «Pathozyme TB complex plus», детектирующая антитела класса IgG к 38 кДа и 16 кДа белкам M. tuberculosis, выявляет туберкулез среди больных в Индии в 78%, а в Испании в 31% случаев. Эти различия, характеризующие географическую гетерогенность иммунного ответа на антигены M. tuberculosis, диктуют необходимость создания серодиагностических тестов для каждого отдельного региона с учетом эффективности составляющих его компонентов (антигенов) для данной популяции [145, 331]. Согласно рекомендации ВОЗ для замены методов «золотого стандарта» диагностики туберкулеза серологический тест должен обладать чувствительностью более 80% и специфичностью более 95% [334]. На рынке представлено большое число сертифицированных зарубежных тестов с соответствующими показателями эффективности (например, ИФА тесты: AndaTB IgG, SEVA TB ELISA Test (JB Trop Dis Res Centre, Индия), Mycowell (Span Diagnostics, Индия); иммуноспот: TB-Spot Ver 2.0, ИХ тесты: SD BIOLINE Ag 44 MPT64 Rapid (S.D. Bio Standard Diagnostic, Индия), TB SCREEN TEST (Bisen Индия), Biotech, ИммуноХром-анти-МТ-Экспресс), однако, заявленные производителями характеристики не всегда подтверждаются в независимых исследованиях. Ни один из существующих в настоящее время коммерческих тестов не может быть рекомендован для применения независимо от традиционных методов диагностики [44, 292, 334]. Несколько лет назад был запатентован новый иммунологический метод выявления туберкулеза «Antibodies from lymphocyte secretion», также называемый «Antibody in lymphocyte supernatant» (ALS), основанный на детекции с помощью ИФА антимикобактериальных антител, секретируемых активированными циркулирующими В-лимфоцитами и плазматическими клетками. По мнению автора патента, R. Raqib, антитело-продуцирующие клетки - короткоживущие и обнаруживаются в крови только в период активного заболевания, поэтому данный метод выявляет только активный туберкулез. Чувствительность ИФА с образцами ALS, детектирующими антитела к различным антигенам M. tuberculosis, достигает в некоторых случаях 93% при высокой специфичности. Данный метод имеет перспективы для использования в серодиагностике туберкулеза, в том числе у детей [244, 245, 248, 254]. 1. 3. Особенности гуморального иммунного ответа при туберкулезе Длительный период времени диагностика туберкулеза, основанная на измерении гуморального иммунного ответа, считалась неэффективной и неоправданной, так как основной механизм защиты организма против M. tuberculosis - это клеточно-опосредованный иммунитет. Тем не менее, гуморальный иммунитет является ранним «свидетелем» инфицирования M. tuberculosis, и при активном туберкулезном процессе в сыворотке крови больных туберкулезом обнаруживается повышенный титр противотуберкулезных антител [102, 240]. Принято решающую считать, роль в что клеточно-опосредованный развитии туберкулеза, так как иммунитет играет M. tuberculosis - 45 внутриклеточный патоген. При этом значение гуморального иммунитета практически не принимается во внимание в связи с принятой в середине 80-х годов 20 века Th1/Th2 парадигмой, поддерживающей представление о том, что формирование приобретенного иммунитета зависит от поляризации Т-клеток в Тхелперы(Th)-1 или Th2, доминировании одного типа иммунного ответа, например, клеточного в случае туберкулеза, и угнетении другого. Однако иммунитет против патогенных микроорганизмов является результатом не поляризации Th, а формируется, начиная с распознавания, презентации и представления антигена Т-клеткам. Дифференцировку вновь активированных нативных Т-клеток в зрелые Th1 или Th2 регулируют многие факторы: локальное цитокиновое микроокружение, наличие гормонов, тип антигенпрезентирующих клеток (АПК), стимулирующих Т-клетки, количество антигена и плотность Т – клеточных рецепторов (TCR), сила сигнала - суммарная аффинность связи TCR с антигеном. У человека, в отличие от инбредных мышей, нет строгого разделения профилей секретируемых цитокинов между Th1 и Th2. Например, Th1 могут секретировать интерлейкин (ИЛ)-10 и ИЛ-13. Главным отличием между популяциями клеток является секреция γ-ИНФ первым, а ИЛ-4 – вторым типами Т-хелперов. Экспериментальные исследования убедительно демонстрируют наличие взаимозависимости и синергии между клеточным и гуморальным иммунитетом. В течение развития инфекции внутриклеточный патоген M. tuberculosis может быть локализован и внеклеточно, например, в верхних отделах респираторного тракта в начале заболевания или при разрушении гранулем, и доступен для специфических антител. C. Lienhardt показано, что у контактных по туберкулезу Th1 ответ превалирует над Th2 ответом, при этом повышение активности Th2 у данной группы пациентов ассоциировано с высоким риском активации заболевания, при клиническом выздоровлении клеточное звено преобладает над гуморальным [30, 159, 183, 209]. иммунного ответа вновь 46 Антитела при туберкулезе играют важную роль в усилении иммунной защиты организма против M. tuberculosis. Они участвуют в нейтрализации токсинов (например, нейтрализуют токсический эффект корд-фактора), в реакциях опсонизации, активации комплемента по классическому пути, антителзависимой клеточной цитотоксичности, презентации антигена, способствуют фагосомально-лизосомальному слиянию, секреции цитокинов. Например, S. de Vallie`re показано, что антимикобактериальные антитела усиливают клеточный иммунитет против микобактерий, в том числе за счет стимулирования пролиферации CD4+ и CD8+ Т клеток и выброса ими γ-ИНФ [143, 312]. Кроме того, противотуберкулезные антитела препятствуют адгезии бактерий к клеткам тканей хозяина. В частности, в одном из исследований обработка фильтрата культуры M. tuberculosis, интраназально вводимого лабораторным мышам, антителами к поверхностному гликопротеину НВНА, участвующему в адгезии микобактерий к эпителиальным клеткам, позволила уменьшить обсемененность селезенки микобактериями [229]. Протективная роль антител в защите против M. tuberculosis, была описана еще в конце 19 века П. Паквиным и К. Фишем. Например, П. Паквин в 1897 году отмечал положительный эффект терапии туберкулезных больных лошадиными антитуберкулиновыми сыворотками [98, 113, 228]. В настоящее время также получены экспериментальные доказательства протективной роли антител в защите против микобактериальной инфекции [121]. В ряде исследований было продемонстрировано, что введение иммунокомпетентным мышам (дефицитным по В-клеткам или с тяжелым комбинированным иммунодефицитом (SCID)), инфицированным M. tuberculosis или M. bovis, моноклональных антител против некоторых антигенов M. tuberculosis (НВНА, 16кДа белок, Ag85A, Ag85B, МРТ83, ЛАМ), способствует снижению обсемененности тканей микобактериями и увеличению продолжительности жизни животных за счет уменьшения гранулематозного воспаления и некроза [30, 66, 112, 114, 174, 188, 229, 312]. 47 Данные, полученные A. M. Costello, свидетельствуют об участии антимикобактериальных антител (антител против ЛАМ и сониката культуры M. tuberculosis) в предотвращении развития диссеминированных форм туберкулеза у детей [74]. Гуморальный иммунитет может играть большую роль в защите против туберкулеза, чем предполагалось ранее. Так, например, в недавних исследованиях было показано, что в легких у больных туберкулезом людей обнаруживаются фолликулоподобные агрегаты, состоящие из В-клеток, а у больных обезьян - даже активированные В-клетки. По мнению авторов данных работ, В-клетки и противотуберкулезные антитела могут принимать участие в местном иммунитете в очаге инфекции и в стимуляции общего иммунитета в организме больного туберкулезом [197, 230, 306]. В формировании гуморального иммунного ответа при туберкулезе наблюдается тенденция к нарастанию титра и созреванию аффинности противотуберкулезных антител классов IgG и IgA при усилении активности туберкулезного процесса. При развитии вторичного туберкулеза титр данных антител и их аффинность значительно увеличиваются в связи с активацией механизма иммунологической памяти. В большинстве случаев, у пациентов с более выраженными поражениями тканей и тяжелым течением заболевания определяются более высокие уровни IgG антител против антигенов M. tuberculosis. Титры антител класса IgA также коррелируют с тяжестью процесса. Противотуберкулезные IgM антитела при активном туберкулезном процессе определяются редко. Вероятно, это связано с тем, что IgM синтезируются на ранних этапах развития инфекции, присутствуют в крови непродолжительное время и, как правило, в меньшей концентрации, чем IgG и IgA. Существует предположение о том, что наивные IgM могут связывать широкий спектр антигенов с низкой аффинностью, а зрелые IgG - напротив узкий круг антигенов, но с более высоким сродством к ним. Поэтому 48 большинство исследований гуморального иммунитета при туберкулезе сосредоточено на определении антител класса G или А [100, 324]. Однако в некоторых случаях именно IgM доминирует при ответе на определенные антигены при активном туберкулезном процессе. Например, при изучении гуморального иммунного ответа среди больных туберкулезом Бразилии, чувствительность теста, выявляющего анти-МРТ51 антитела класса IgM, оказалась значительно выше чувствительности теста, определяющего антиМРТ51 IgG, в тоже время среди анти-GlcB антител преобладали IgG [168]. В исследовании E. Gatner, было показано, что при туберкулезе повышен титр и антител класса IgE, однако, они находятся в сыворотке крови в основном в связанном состоянии в составе циркулирующих иммунных комплексов (ЦИК) [107]. После проведенного лечения антительный ответ на M. tuberculosis, как правило, угасает, однако, противотуберкулезные антитела могут персистировать в крови еще некоторое время [168, 275]. Например, в работе M.S. Imaz было выявлено угасание антительного ответа к белкам фильтрата культуры M. tuberculosis в течение 3 лет, а к белкам менее 20 кДа - в течение двух лет после начала химиотерапии [117, 140]. В исследовании S. Hu противотуберкулезные антитела обнаруживались в сыворотке больных до 3 месяцев после начала лечения, однако, уже через 9-12 месяцев они полностью исчезали [137]. Результаты работы J. M. Bezerra демонстрируют потенциальную клиническую ценность определения антимикобактериальных антител класса А для мониторинга эффективности терапии туберкулеза: у 40% наблюдаемых больных туберкулезом в ходе лечения отмечалось снижение титров IgA против гликолипидного и белковых антигенов M. tuberculosis, а к концу терапии 20% больных оказались серонегативными [54]. После начала химиотерапии уровень антимикобактериальных антител может возрастать в результате освобождения антигенов из убитых бактерий, при этом авидность данных антител в большинстве случаев снижается. Чем 49 продолжительнее течение заболевания, тем выше авидность антител, что указывает на созревание аффинности специфических антител в период активного туберкулезного процесса. По данным M. Lenka увеличение авидности специфических антител является лучшим индикатором активации заболевания, по сравнению с возрастанием титра данных антител у больных туберкулезом, особенно в случае рецидива заболевания [179, 180]. Характер иммунного ответа при туберкулезе зависит от природы антигенов M. tuberculosis и их свойств. Например, замечено, что гуморальный иммунный ответ формируется преимущественно на высокомолекулярные белки (38 кДа, 81кДа белки, 309 кДа белок (Rv3347), а Т-клеточный ответ - на низкомолекулярные белки (ESAT-6, CFP-10, TB7.7) [50, 57, 169, 170,180]. Антителообразование при туберкулезе могут стимулировать и выявлять различные компоненты микобактерий: белки, липиды, полисахариды. Некоторые исследователи полагают, что при определенных вариантах туберкулеза на гликолипидные антигены M. tuberculosis формируется более выраженный гуморальный ответ, чем на белковые антигены [102, 145]. Например, гликолипидные антигены обладают лучшей дифференцирующей способностью при серодиагностике в случаях ВИЧ - ассоциированной туберкулезной инфекции, внелегочного и «мазок-негативного» легочного туберкулеза. Вероятно, эти особенности обусловлены различиями в механизмах формирования иммунного ответа на антигены разной природы [199]. Липидные и полисахаридные антигены M. tuberculosis относятся к тимуснезависимым антигенам, которые презентируются незрелыми дендритными, В-клетками, тимоцитами TCRγδ и TCRαβ∕CD4-CD8- Т-лимфоцитам, а так же Тклеткам натуральным киллерам (НКТ) в комплексе с молекулой CD1. При этом одни антигены, такие как ЛАМ и глюкоза мономиколат, презентируются в комплексе с белками CD1 группы 1 (CD1a, CD1b, CD1c), а другие, галактоцерамиды, с CD1 группы 2 (CD1d). Активированные антигеном CD1-рестрицированные Т-клетки могут, как секретировать Th2-цитокины (ИЛ-4, ИЛ-13), стимулирующие активацию В- 50 клеток, так и непосредственно взаимодействовать CD1 ∕ CD21 - с экспрессирующими В-клетками маргинальной зоны селезенки, способствуя усилению антительного ответа на небелковые антигены [316]. CD1d - рестрицированные НКТ клетки стимулируют продукцию антител плазматическими клетками, переключение класса синтезируемых антител, а также способствуют формированию В-клеток памяти. Повышенная экспрессия CD1 на незрелых дендритных клетках предполагает, что CD1 - рестрицированные Т-клетки могут функционировать в более раннюю фазу иммунного ответа, чем главный комплекс гистосовместимости (ГКГС) - рестрицированные Т-клетки, а значит, CD1 опосредованная презентация антигенов служит основанием для возможности детекции микобактериальной инфекции вне зависимости от состояния Тклеточного иммунитета [28, 219, 237]. Белковые антигены традиционно презентируются на поверхности антигенпрезентирующих клеток (АПК) в комплексе с ГКГС II, специфическое взаимодействие с TCR CD4+ T клеток, способствует дифференциации Th0 в Th2, секреции последними ИЛ-4, стимуляции и активации В-клеток, и в дальнейшем продукции антимикобактериальных антител [271] . В течение туберкулезного процесса происходит изменение спектра антигенов, синтезируемых микобактериями в зависимости от стадии и степени распространенности заболевания. Следовательно, и антитела к разным антигенам микобактерий имеют разную динамику. Например, антитела к 16кДа белку определяются еще в латентную фазу заболевания, а антитела к 38кДа белку характерны для активного прогрессирующего туберкулезного процесса с деструктивным поражением тканей легких. F. Min показано, что при экспериментальном туберкулезе у макак резус антитела к CFP-10, ESAT-6, MPT64, Ag85B детектируются в крови больных животных уже с 4 недели после заражения, а к ТВ16.3, 14 и 38кДа белкам - только начиная с 6-8 недели [206]. 51 H. C. Koo были обнаружены различия в динамике анти-ESAT-6 и антиМРТ70 антител при экспериментальном бычьем туберкулезе у телят: антитела против ESAT-6 регистрировались уже на 4-12 неделях после заражения M. bovis, а антитела против МРТ70, наоборот, определялись только с 12 недели после заражения, достигая максимальных значений их титра на 20 неделе [161]. Похожие результаты были получены и в других исследованиях [97, 129, 192, 322]. В работах многих авторов антитела к антигенам M. tuberculosis детектируют не только в сыворотке крови, но и в других биологических средах организма: в ЦСЖ, плевральной, асцитической жидкостях и моче. Некоторые исследователи отмечают, что пик нарастания титра противотуберкулезных антител при туберкулезном менингите наблюдается раньше в ЦСЖ, чем в крови. Более того, уровень антител в ЦСЖ коррелирует с тяжестью клинических проявлений при туберкулезе [170]. В моче также обнаруживают IgA антитела к некоторым белковым и липидным антигенам M. tuberculosis (МРТ32, МРТ81, ЛАМ) [79, 168, 227]. Еще в 1980 году было показано, что отсутствие противотуберкулезных антител в сыворотке больных туберкулезом может быть обусловлено включением этих антител в состав ЦИК. В ЦИК могут входить иммуноглобулины всех классов, присутствующих в повышенных титрах у больных туберкулезом (IgG, IgA, IgM, IgE). Включение антител в ЦИК может повлиять на эффективность серодиагностики при туберкулезе. Например, в исследовании A. Raja и соавторов свободные антитела классов IgG, IgA и IgM против 16кДа белка M. tuberculosis были выявлены в 62%, 52% и 11% случаев легочного туберкулеза, соответственно, а связанные анти – 16 кДа антитела в составе ЦИК тех же классов в 97,5%, 100% и 45,3% случаев, соответственно. Большая или меньшая часть противотуберкулезных антител участвует в формировании ЦИК. Показано, что при начальных ограниченных формах туберкулеза ЦИК в крови, как правило, отсутствуют, а при прогрессировании заболевания их количество нарастает, и они оказывают иммунопатологическое 52 воздействие на течение туберкулезного процесса. В процессе лечения в составе ЦИК происходит постепенное снижение концентрации туберкулезных антигенов и повышение уровня антител, что может свидетельствовать об эффективности проводимой терапии [62, 242, 276]. Гуморальный ответ на антигены M. tuberculosis при туберкулезе гетерогенен. В зависимости от этнических и индивидуальных генетических особенностей организма, стадии и формы туберкулеза, сопутствующих заболеваний, а также региона проживания пациента выраженность гуморального ответа на одни и те же антигены может быть различна [191]. Прежде всего, гетерогенность гуморального иммунного ответа при туберкулезе обуславливают иммуногенетические различия больных туберкулезом. Например, полиморфизм системы человеческих лейкоцитарных антигенов (HLA) определяет различия в степени резистентности иммунной системы против туберкулеза. В исследованиях, проведенных как в России, так и в других странах, было показано, что фенотип HLA-DR2 ассоциирован с повышенной восприимчивостью к туберкулезу и измененными антительным и клеточным ответами при легочном туберкулезе [24, 290]. У больных туберкулезом, носителей DR2-антигена, наблюдается повышенный уровень противотуберкулезных антител класса IgG. Р. Selvaraj и соавторами выявлен повышенный титр антител к 38 кДа белку, 30/31 и 32/34 кДа белковым комплексам M. tuberculosis у DR2-позитивных, по сравнению с DR2негативными больными легочным туберкулезом. Также было показано, что фенотип HLA-DR2(DR15), ассоциирован с высоким титром антител к 38 кДа белку M. tuberculosis при туберкулезе [264, 266, 310]. Многие HLA-DR молекулы могут регулировать IgG и IgA антительные ответы на различные антигены M. tuberculosis. В одном из исследований было показано, что у больных туберкулезом с HLA-DR4 и HLA-DR6 наблюдается повышенный уровень анти-Ag85B антител класса IgG, по сравнению с HLA-DR1+ 53 пациентами, а анти-Ag85B антитела класса IgA присутствуют в крови HLA-DR1+ пациентов в более высоком титре, чем у HLA-DR1-[265]. По данным Л.И. Арчаковой наличие в генотипе у больного одного из трех вариантов сочетаний генов (HLA-DRB1*04 и HLA-DQB1*02, HLA-DRB1*16 и (или HLA-DQB1*03 HLA-DQB1*05)) предрасполагает к тяжелому прогрессирующему течению туберкулеза с доминированием гуморального иммунитета, а генотип только HLA-DQB1*03, напротив, ассоциирован с ограниченными формами туберкулеза и незначительным возрастанием титра противотуберкулезных антител в крови [2]. Повышенная восприимчивости к туберкулезу у различных этнических групп также связана с разными HLA-специфичностями: у русских с HLA-В5, -В14 и - В17, у канадцев - B8, у греков- B27, у египтян - A2 и B5. Сниженная восприимчивость к туберкулезу обнаружена, например, у афроамериканцев с HLA-DR6 [24]. В недавних работах были показаны аллельные различия гена HLA-DRB1 в различных популяциях, например, у больных туберкулезом жителей Тувы наиболее часто встречались генотипы HLA-DRB1*13 и *14, Сирии – его аллель *04, Ирана - *07, Китая и Индии - *15 [3, 8, 24, 27, 158, 235, 252]. Географическая обусловлена не гетерогенность только иммунного этногенетическими ответа чертами при туберкулезе популяции, но и особенностями циркулирующих в данном регионе штаммов M. tuberculosis, отличающихся по распространенности спектру туберкулеза, экспрессирующихся а также наличием белков, или уровнем отсутствием БЦЖ - вакцинирования населения в регионе. Существование географической гетерогенности антительного ответа при туберкулезе признают многие авторы [45, 136, 210, 258, 270, 308, 325]. Она может быть обусловлена распространением в разных регионах различных клинических изолятов M. tuberculosis. 54 В работе G. A. de Souza обнаружены разные паттерны экспрессии белков для гипо- и гипервирулентрных штаммов M. tuberculosis, принадлежащих к сполигосемейству Beijing. [286]. В исследовании G. Kumar при определении гуморального ответа на белки фильтрата культуры и цельноклеточные экстракты 39 клинических изолятов M. tuberculosis из 10 регионов Индии было выявлены различия в числе сывороток (чувствительности анализа), реагировавших с разными штаммами, что может говорить о разных антигенных профилях экспрессии у разных штаммов M. tuberculosis на одном этапе культивирования [164]. В регионах, эндемичных по туберкулезу, титр антител к M. tuberculosis специфичным антигенам у здорового населения значительно повышен. Так, например, в работе S. T. Hoff при тестировании слитого белка ESAT6-CFP10 методом ИФА с сыворотками жителей эндемичного региона (Эфиопии) среднее значение оптической плотности в группе здоровых доноров (0,238) было выше значений, полученных для группы больных туберкулезом (0,158) неэндемичного региона (Дании), что авторы связывали с высокой распространенностью латентного туберкулеза в первом случае [135]. Таким образом, при оценке гуморального иммунного ответа на антигены M. tuberculosis необходимо использовать сыворотки больных и здоровых доноров (в качестве отрицательных контролей) из одного региона. Иммунный ответ на M. tuberculosis различается у пациентов разного пола и возраста. Например, некоторые авторы отмечают наличие повышенной восприимчивости к туберкулезу у лиц женского пола до, а у лиц мужского пола после полового созревания. Данные наблюдения в литературе объясняются возможной протективной ролью женских половых гормонов, однако, истинная причина данного наблюдения пока не установлена [138]. Различия гуморального иммунного ответа при туберкулезе у пациентов разных возрастных групп достаточно хорошо изучены. У детей уровень продукции противотуберкулезных антител ниже, чем у взрослых, особенно младше 5 лет. Повышенные титры противотуберкулезных 55 антител встречаются в основном у детей старше 6 лет и, главным образом, при прогрессировании заболевания, либо уже при вторичном туберкулезе. Это может быть связано с тем, что титр антител класса G достигает значений взрослого лишь к 6 годам, а класса А - только в подростковом возрасте. Выраженность гуморального ответа у детей ассоциирована с уровнем обсемененности тканей M. tuberculosis и наличием деструктивных изменений тканей, редко встречающихся у детей младше 10 лет. Тем не менее, у детей, как и у взрослых, наблюдается индивидуальная гетерогенность распознавания антигенов M. tuberculosis в ИФА. В нескольких работах было отмечено, что у детей превалирует гуморальный ответ на цитозольные белки (в том числе на 65кДа белок), тогда как у взрослых он в основном направлен против секретируемых белков M. tuberculosis [309]. Согласно литературным данным, чувствительность серодиагностических тестов на туберкулез у детей варьирует от 14 до 85%, а специфичность от 86 до 100%. Широкая вариабельность данных значений обусловлена многими факторами: диагностическая точность диагностики зависит от возраста ребенка, времени проведения вакцинации БЦЖ, формы туберкулеза, изотипа антител, определяемого в исследовании, способом определения значения «cutoff». Тем не менее, многие авторы отмечают перспективы применения серодиагностики туберкулеза у детей, так как в сыворотках детей больных туберкулезом определяются повышенные, по сравнению со здоровыми детьми, титры антител против некоторых гликолипидных (PGL-Tb1, диацилтрегалоза (ДАТ)) и белковых (А60, 38 кДа, антигены комплекса Ag85) антигенов M. tuberculosis [33, 130]. С возрастом реактивность специфического противотуберкулезного иммунитета (клеточного и гуморального) угасает. У лиц, старше 60 лет, выраженность реакции на туберкулин ниже, чем у лиц молодого и среднего возраста. Реактивность пробы Манту в 65-74 года падает с 50% до 10%, а старше 95 лет - до 5%. В исследовании Н.А.Стоговой показано, что у больных туберкулезом пожилого возраста наблюдается иммунологическая недостаточность Т-звена 56 иммунитета, проявляющаяся абсолютным и относительным снижением Т-клеток, снижением числа Т-хелперов, при повышении Т-супрессоров, а также определяются повышенные концентрации ЦИК и молекул средней массы, по сравнению с показателями для пациентов молодого возраста. Титр противотуберкулезных антител у больных туберкулезом пожилого возраста, как правило, ниже, чем у молодых пациентов, однако, в данной работе параметры Вклеточного иммунитета у пациентов данных возрастных групп не отличались [22, 67]. Острой проблемой современного здравоохранения является сочетание туберкулеза и ВИЧ - инфекции. Туберкулез в данном случае может быть как первичным заболеванием, так и возникать на фоне сниженного иммунитета у пациента с ВИЧ - инфекцией. Особенностью взаимодействия M. tuberculosis и ВИЧ в организме человека является совместное ухудшение ими течения обоих патологий. ВИЧ приводит к снижению числа и активности CD4+ лимфоцитов, а, следовательно, уменьшению выработки ими ИЛ-2, γ-ИНФ и других факторов, способствуя размножению и диссеминации M. tuberculosis. А M. tuberculosis и его продукты, в свою очередь, активируют репликацию ВИЧ [115]. Несмотря на иммуносупрессию, у ВИЧ - положительных туберкулезных больных все же сохраняется диверсифицированный антительный репертуар, что дает возможность диагностировать туберкулез у ВИЧ-инфицированных пациентов, используя серологический подход, основанный на детекции антител против специфических антигенов M. tuberculosis. Данные, полученные разными авторами, свидетельствуют о том, что антитела к некоторым антигенам M. tuberculosis присутствуют в крови ВИЧинфицированных в повышенных титрах, причем эти значения не зависят от уровня CD4+ лимфоцитов [308]. Чувствительность серологических тестов, основанных на некоторых антигенах (например, MTB 81, MTB 51, ТВ 9.7 и другие), у ВИЧ+ТБ+ больных иногда оказывается даже выше, чем у ВИЧ-ТБ+. Эти данные определяют дополнительные преимущества серодиагностики, сравнению с традиционными методами диагностики туберкулеза [41, 278, 325]. по 57 1. 4. Антигены имеющие M. tuberculosis, потенциал для серодиагностики туберкулеза 1. 4. 1. Критерии отбора антигенов M. tuberculosis для целей серодиагностики туберкулеза При разработке серодиагностических тестов по выявлению туберкулеза необходим обоснованный выбор антигенных препаратов. Основными критериями их отбора могут служить следующие положения. Во-первых, кодирующие последовательности выбранных антигенов должны быть специфичны для комплекса M. tuberculosis. Во-вторых, специфические антитела против данных антигенов должны определяться при активном туберкулезном процессе в значительно более высоком титре, чем при латентной инфекции. Втретьих, сыворотки здоровых БЦЖ-вакцинированных людей, а также пациентов с ложноположительной реакцией на туберкулин должны проявлять минимальную реактивность в отношении выбранных антигенов. Важным критерием выбора антигенных препаратов является возможность выявления с помощью них случаев «мазок-негативного» легочного, внелегочного туберкулеза, а также туберкулеза у ВИЧ-инфицированных людей. Антигены, используемые в серодиагностике туберкулеза, можно классифицировать по локализации в клетке (внутриклеточные, поверхностные, секретируемые), по химической структуре (белки, липиды, полисахариды) или по выполняемым ими функциям (белки «теплового шока», фибронектин связывающие белки, переносчики фосфата и другие). Первые работы по изучению гуморального иммунного ответа на отдельные антигены M. tuberculosis, были посвящены, как правило, секретируемым белкам, таким как MPT70, MPT64 и белкам комплекса Ag85. Это было связано, прежде всего, с обнаружением этих антигенов в фильтрате культуры в большом количестве, а также тем, что секретируемые белки стимулируют выраженную ответную реакцию иммунной системы. Среди внутриклеточных белков наибольшее внимание было обращено на белки теплового шока, такие как HSP60, 58 HSP70, HSPX. Наиболее изучаемые мембранные антигены - это 19 и 38кДа липопротеины, а также ЛАМ [59,72, 255]. После расшифровки генома M. tuberculosis в 1998 году, стало возможным изучение структуры и свойств многих неизвестных ранее антигенов. Методом сравнительной геномики идентифицировано несколько «регионов различий» (RD1-16) между M. tuberculosis H37Rv и M. bovis BCG [63]. 16 RD кодируют около 100 белков M. tuberculosis (таблица 4). Таблица 4 - Видовая специфичность антигенов M. tuberculosis [213] Участок ОРС Rv обозначения M. tuber- M. afri- M. bovis генома culosis canum RD 1 9 Rv3871 – Rv3879c + + + RD 2 11 Rv1978-Rv1988 + + + RD 3 14 Rv1573-Rv1586c + + RD 4 3 Rv 0221- Rv0223c + RD 5 5 Rv 3117- Rv3121 + + RD 6 11 Rv1506c–Rv1516c + + RD 7 8 Rv2346c – Rv2353c + + RD 8 4 Rv0309-Rv0312 + + RD 9 7 Rv3617 – Rv3623 + RD 10 3 Rv1255c – Rv1257c + + RD 11 5 Rv3425- Rv3429 + + RD 12 4 Rv2072c- Rv2075c + + RD 13 16 Rv2645- Rv2660c + + ± RD 14 9 Rv1765c-Rv1773c + + + RD 15 15 Rv1963c- Rv1977 + + + RD 16 6 Rv3400-Rv3405c + + + M. bovis BCG ± ± ± ± Примечания: ОРС - открытая рамка считывания, «+/-» - присутствует/ удален; «±» - присутствует в некоторых субштаммах, RD – участок генома M. tuberculosis. В ходе продолжительного культивирования штамма M. bovis BCG in vitro (аттенуации) последовательно удалялись различные участки генома (RD, отдельные гены), появлялись дупликации (DU1, DU2-I, II, III, IV) и некоторые единичные нуклеотидные полиморфизмы (mmaA3, sigK), определяющие отличия субштаммов M. bovis BCG между собой (рисунок 6) [144]. 59 Рисунок 6 - Генеалогия вакцинных штаммов БЦЖ [144] M. bovis BCG Russia был получен в 1924 году. По сравнению с другими субштаммами M. bovis BCG, он имеет наибольшие сходства с первой международной вакциной БЦЖ. В геноме M. bovis BCG Russia обнаружены делеции RD1 и гена rv3698, дупликация DU2-I, а также инсерция в 5’ участке гена recA, приводящая к его инактивации, и, тем самым, содействующая высокой стабильности генома [155]. RD1 удален во всех вакцинных штаммах M. bovis BCG, но присутствует у микобактерий туберкулезного комплекса, включая все клинические изоляты M. tuberculosis и некоторые M. bovis. Существующие данные свидетельствуют о том, что RD1 отсутствует также в геномах большинства нетуберкулезных микобактерий. Данные факты предопределяют низкий уровень перекрестного реагирования на «RD1 белки» у БЦЖ-вакцинированных здоровых людей. В RD1 обнаружено 9 открытых рамок считывания, кодирующих 9 белков (Rv3871Rv3879c) [63]. Для серодиагностики туберкулеза наиболее важно определение заболевания на начальных этапах активации туберкулезного процесса. Спектр синтезируемых антигенов M. tuberculosis и антительный ответ на них меняется в зависимости от 60 стадии и формы заболевания. Так, например, повышенный титр анти – 14 кДа антител ассоциировано с хронической формой заболевания в большей степени, чем с активным туберкулезным процессом, антитела к ESAT-6 определяются уже в латентном периоде заболевания, но их титр существенно нарастает при активации туберкулеза. Высокий уровень анти – 32 кДа антител определяется на ранних стадиях диссеминирования, прогрессирования а антител заболевания против 38кДа до белка фазы – распада при и активном прогрессирующем кавернозном туберкулезе легких [61, 74, 84, 136, 258, 259]. В таблице 5 представлены наиболее эффективные серодиагностические маркеры туберкулеза при различных формах и стадиях заболевания. Таблица 5 - Перспективные серодиагностические маркеры туберкулеза при + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + Ссылки ТБ у детей + + + + + + + + + + + + + Внелегочный ТБ + ТБ+ВИЧ+ Активный ЛТБ 16кДа 38кДа Ag85В CFP-10 ЕSАТ-6 МРТ32 МРТ51 МРТ64 МТВ81 ТВ15.3 ТВ16.3 А60 ЛАМ Липидные антигены* Ранние стадии ТБ Формы туберкулеза/ антигены Латентная инфекция различных формах и стадиях заболевания 153, 251, 308 61, 74, 258 133, 308 163, 349 84, 119, 274 136, 258, 259 34, 278 147, 149 133, 257, 278 288, 325 325, 345 123, 156, 190 67, 349 54, 102, 146, 275 Примечания: * - корд-фактор, ДАТ, TAT, SL I, PGL-Tb1. 61 Главными критериями отбора антигенных препаратов для серодиагностики являются их чувствительность и специфичность. Эти показатели для тестов с одним антигеном могут значительно варьировать в регионах, отличающихся по уровню распространенности заболевания и у различных категорий больных. Географическая гетерогенность иммунного ответа при туберкулезе определяет различия в уровнях напряженности гуморального иммунного ответа на идентичные антигены M. tuberculosis у больных активным туберкулезом из разных стран (таблица 6). Сохранение диверсифицированного антительного репертуара у ВИЧинфицированных туберкулезных больных дает возможность диагностировать туберкулез, используя серологический подход, основанный на детекции антител к M. tuberculosis-специфичным антигенам [319]. Наиболее перспективными антигенами M. tuberculosis для целей серодиагностики туберкулеза у ВИЧ-инфицированных, по данным литературы, являются: Rv0222 [250], TB16.3, TB9.7 [325], 38 кДа, 19 кДа белки [319], Ag85В [308], МРТ51 [34], МТВ81 [257], MPT32 [279] и PGL-Tb1 [275]. В работе K.Weldingh M. tuberculosis - специфичные антигены TB16.3 и TB9.7 в ИФА реагировали более чем с 85% сывороток туберкулезных больных, коинфицированных ВИЧ, причем, чувствительность детекции анти - TB9.7 антител с сыворотками ВИЧ - положительных, в данном случае, оказалась выше (91%), чем с сыворотками ВИЧ - отрицательных туберкулезных больных (79%). Хотя разница не являлась статистически значимой (P=0,11), однако, эти результаты свидетельствуют о том, что обычно супрессированный антительный ответ у ВИЧ - положительных пациентов не препятствует хорошему распознаванию некоторых антигенов [325]. Более того, в нескольких работах было продемонстрировано, что антитела против MPT51 и МТВ81 детектируются в субклиническом периоде туберкулеза у ВИЧ - положительных в большем проценте случаев, чем у ВИЧ – отрицательных туберкулезных больных [41, 278]. 62 Таблица 6 - Серодиагностическая эффективность антигенов M. tuberculosis в разных странах Антиген Страна ВИЧ Контрольная Группа больных статус группа Rv0040с Китай 192; Б+К210; мп± Индия н.и. 103; мп± Rv0934 Китай 192; Б+К 210; мп± США 83; Б+К+ 54; м± Дания 32; Б± 48; мп± Гамбия ± 100; Б± 100; м+ Англия н.у. 25; н.у. 25; мп+ Rv1636 Китай 90; Б±К90; мп± Уганда н.у. 25; Б± 72; мп+ Дания 32; Б± 48; мп± Rv1837с Китай 192; Б+К210; мп± США 83; Б+К+ 54; м± Бразилия 49; Б±К49; мп+ Rv1860 Китай 192; Б+К210; мп± США 83; Б+К+ 54; м± Ч, % С, % 19 14,6 27,6 31,5 19 49 64 31,1 69 31 26,7 64,8 75,5 13,3 61,1 98,4 н.у. 97,4 100 100 50 88 96,7 100 97 99 100 65 99 98 Rv1886с Индия Китай Rv2031с Индия Китай Rv2185с Китай Дания Уганда Rv3874 Гамбия Китай Дания Rv3875 Гамбия Китай Rv3881с Китай Бразилия 67 22,9 62 17,1 45,6 55 93 63 21,4 18 67 13,3 26,7 30 99 97,4 100 99,5 100 100 97 55 97,4 100 51 99,5 95,8 96,5 ± ± - 150; н.у. 192; Б+К150; н.у. 192; Б+К90; Б±К32; Б± 25; Б± 100; Б± 192; Б+К32; Б± 100; Б± 192; Б+К192; Б+К86; К± 175; м+ 210; мп± 175; м+ 210; мп± 90; мп± 48; мп± 72; мп+ 100; м+ 210; мп± 48; мп± 100; м+ 210; мп± 210; мп± 300; мп± Ссылка, год 337, 2010 163, 2005 337, 2010 259, 2000 325, 2005 119, 2005 36, 1995 345, 2011 325, 2005 325, 2005 337, 2010 259, 2000 38, 2008 337, 2010 259, 2000 308, 2003 337, 2010 308, 2003 337, 2010 345, 2011 325, 2005 325, 2005 119, 2005 337, 2010 325, 2005 119, 2005 337, 2010 337, 2010 187, 2001 Примечания: «Б+» - БЦЖ-вакцинированные, «К+» - кожный тест с туберкулином положительный, «м+» - мазок-позитивный, «мп+» - мазок- и посев-положительные результаты, «мп±» - как «мп+», так и «мп-», н.у.- не указан. 63 Выявление внелегочного туберкулеза и туберкулеза у «мазок-негативных» пациентов с помощью серодиагностики могло бы дать ей дополнительные преимущества, по сравнению с другими методами. Некоторые белковые и гликолипидные антигены M. tuberculosis имеют потенциал для использования в серодиагностике туберкулеза у таких групп больных (например, МРТ64, PGLTb1, корд-фактор) [54, 131, 132]. В связи с наличием индивидуальной гетерогенности иммунного ответа при туберкулезе чувствительность серологических тестов на основе одного антигена, как правило, невысокая (не выше 75% даже в «мазок-позитивных» случаях туберкулеза). Повышения чувствительности теста можно достичь комбинацией нескольких наиболее иммуногенных в данном регионе антигенов. Так в работе A. Raja и соавторов чувствительность теста, определяющего антитела классов G и А к смеси из 4 белков M. tuberculosis (38 кДа, 30 кДа, 16 кДа и 27 кДа белков), превысила значения, полученные для каждого из этих белков отдельно и достигла 96%. Однако специфичность теста в данном случае оказалась ниже, чем с отдельными антигенами (85%) [241]. 1. 4. 2. Способы получения антигенных препаратов M. tuberculosis для целей серодиагностики туберкулеза Эффективность применения антигенных препаратов в серодиагностике зависит от их «качества», которое определяется, в том числе и способом их получения. Оптимальными структурными характеристиками, необходимыми для связывания противотуберкулезных антител в иммунных анализах, обладают нативные белки, выделенные из фильтрата культуры или цельноклеточного лизата M. tuberculosis [31, 259, 325]. Однако длительность культурального цикла M. tuberculosis, необходимость специализированных лабораторий и производств, имеющих разрешения для работы с микроорганизмами III группы патогенности, и строго контроля степени очистки препаратов от неспецифичных белков и других компонентов культуры M. tuberculosis затрудняют получение нативных микобактериальных белков в большом объеме для целей массовой диагностики [241]. 64 Данную проблему может решить использование рекомбинантных экспрессионных систем, например, E. coli. Ее преимуществами являются простота, доступность, быстрый рост культуры, высокая экспрессия чужеродных белков и другие. Однако, иммуногенность рекомбинантных микобактериальных белков, полученных в E. coli, как правило, снижена, что обусловлено отличиями в их строении от нативных белков M. tuberculosis [80, 259, 345]. В существующих системах экспрессии E. coli рекомбинантные белки не подвергаются посттрансляционным модификациям, в частности, гликозилированию. Это приводит к неправильному фолдингу белков, утрате их функций, в том числе нарушению связывания со специфическими антителами при отсутствии конформационных эпитопов [90, 176]. Кроме того, гликозилированы многие, главным образом, секретируемые и поверхностные белки M. tuberculosis (Rv0040c, Rv1860, Rv2873, Rv3763 и другие) [53, 81, 88, 198, 284, 329]. В некоторых патогенных штаммах E. coli все же были обнаружены гликозилированные (гептозными остатками) секретируемые белки (аутотранспортеры AIDA-I, TibA, Ag43) и соответствующие гликозилтрансферазы (Aah, TibC), однако, механизмы гликозилирования данных белков малоизучены [75]. В настоящее время разрабатываются методы экспрессии в E. coli N-гликозилированных использованием бактериальных хорошо и эукариотических охарактеризованной системы белков, с гликозилирования Campylobacter jejuni, но пока они недостаточно эффективны [225, 226, 311, 317, 321]. Гликозилированные рекомбинантные белки M. tuberculosis для целей серодиагностики, возможно, получать в таких экспрессионных системах как Pichia pastoris (в ней получены белки CFP32, Ag85B) [52, 273], Streptomyces lividans (MPT32) [103, 176] и Mycobacterium smegmatis (Rv3763, Rv3873) [81, 104]. Система P. pastoris является наиболее широко распространенным и изученным «инструментом» для получения гликозилированных белков. Она обладает способностью секретировать в среду функционально активные рекомбинантные белки в значительных концентрациях при незначительном 65 количестве собственных секретируемых белков. В данной системе белки подвергаются посттрансляционным модификациям, а именно формированию дисульфидных связей, ацетилированию, фосфорилированию, N- и O- гликозилированию, в частности, O-маннозилированию, которое осуществляется у дрожжей по тому же механизму, что и у M. tuberculosis [193]. О-маннозилирование – жизненно важный механизм гликозилирования белков, консервативный для грибов и эукариотов, также был обнаружен у M. tuberculosis. Исследования на моделях иммунодефицитных мышей выявили значительное снижение вирулентности у штамма M. tuberculosis с нарушенным механизмом О-маннозилирования. Предполагается, что поверхностные и секретируемые белки M. tuberculosis, связанные α1–2-маннобиозой, имитируют разветвленные маннозные мотивы внутриклеточных эукариотических белков не случайно, и могут иметь решающее значение для эффективного паразитирования в эукариотических клетках. В P. pastoris, как и в M. tuberculosis, Оманнозилированные гликаны, α - связанные с гидроксильной группой серина или треонина, образуют α1,2-связанные маннобиозу и маннотриозу (Manα1-2Manα12Manα1-Ser/Thr). Кроме того, в отличие от Saccharomyces cerevisiae, в P. pastoris происходит терминальное силилирование О-цепей подобное тому, которому подвергаются гликопротеины в клетках эукариот [89, 185]. Для P. pastoris, как правило, характерен высокоманнозный тип Nгликозилирования, связывая 8-14 остатков маннозы с амидным азотом аспарагина посредством двух молекул N-ацетилглюкозамина (сайты гликозилирования: аспарагин - любая аминокислота (кроме пролина) - серин/треонин). В отличие от Saccharomyces cerevisiae секретируемые белки P. pastoris не гипергликозилированы, также как и нативные белки M. tuberculosis [89, 185, 193, 284]. В тоже время, разными авторами показано, что антимикобактериальные антитела обладают большим сродством именно к гликозилированной форме некоторых антигенов M. tuberculosis [91, 109, 176]. 66 Кроме того, как M. tuberculosis, так и P. pastoris имеют ГЦ-богатый состав генома. Это сходство обеспечивает стабильность генов M. tuberculosis в геноме P. pastoris. Таким образом, белки, полученные в дрожжевой системе, обладают структурой, сходной с нативной, а, следовательно, более иммуногенны. Например, благодаря использованию дрожжевой системы P. pastoris удалось повысить чувствительность теста ИФА на основе рекомбинантного белка M. tuberculosis CFP32 с 34% (с CFP32, выделенным из E. coli) до 85% (с соответствующим белком, полученным в P. pastoris) [52]. Кроме рекомбинантных систем экспрессии для получения антигенных препаратов также эффективен химический синтез. Он имеет преимущества при производстве пептидов, являющихся линейными эпитопами антигенов, а также углеводных и липидных молекул. Например, в работе R. S. Kashyap синтетические пептиды белков комплекса Ag85 позволяли детектировать легочный и внелегочный туберкулез. А в исследовании A. Laszlo синтетический корд-фактор в ИФА реагировал с большим числом сывороток больных туберкулезом, чем его нативный аналог. D. Kaur показано, что химически синтезированные олигоарабинофуранозиды эффективно связывают в ИФА моноклональные анти-ЛАМ антитела. Синтетические антигены M. tuberculosis имеют перспективы для применения их в серодиагностике туберкулеза [151, 152, 177]. Систематизация антигенов M. tuberculosis по группам белков и небелковых (углеводные, липидные) антигенов при описании их характеристик в литературном обзоре представляется наиболее удобной, так как в ее основе лежат не только структурные отличия антигенов, но и разные механизмы развития иммунного ответа на них [219, 237, 271, 316]. 67 1. 4. 3. Белковые антигены M. tuberculosis, обладающие потенциалом для использования в серодиагностике туберкулеза 1. 4. 3. 1. «RD1 белки» M. tuberculosis Среди белковых антигенов M. tuberculosis, обладающих потенциалом для применения в серодиагностике туберкулеза, можно выделить 9 белков (Rv3871Rv3879c), кодируемых RD1 регионом микобактерий туберкулезного комплекса, который удален во всех субштаммах M. bovis BCG, в том числе в M. bovis BCG Russia (таблица 7). Таблица 7 - Видовая специфичность некоторых «RD белков» M. tuberculosis туберкулеза может использования быть МРТ64 Преимуществом CFP-10 Микобактерии туберкулезного комплекса M. tuberculosis + + + M. africanum + + + M. bovis + + + M. bovis BCG субштаммы Russia + Moreau + Tice + Tokyo + Danish Glaxo Montreal Pasteur Нетуберкулезные микобактерии M. abcessus M. avium - Штаммы микобактерий ESAT6 МРТ64 CFP-10 Штаммы микобактерий ESAT6 [43]. M. branderi - - - M. celatum M. chelonae M. fortuitum M. gordonii M.intracellulare M. kansasii M. malmoense M. marinum M. oenavense M.scrofulaceum M. smegmatis M. szulgai M. xenopi M. vaccae M. terrae + + + - + + + - - «RD1 в серодиагностике отсутствие белков» ложноположительных реакций, обусловленных перекрестным реагированием на антигены M. bovis BCG у 68 здоровых БЦЖ - вакцинированных людей. Среди белков, кодируемых RD1 регионом M. tuberculosis, наибольший интерес для целей серодиагностики представляют антигены PE35(Rv3872), PPE68(Rv3873), CFP-10(Rv3874) и ESAT-6 (Rv3875). Гены белков Rv3872 и Rv3873 относятся к мультигенному семейству РЕ/РРЕ. Оно насчитывает 176 ОРС белков, составляющих 10% протеома M. tuberculosis. Все белки этого семейства имеют высококонсервативные пролинглутамат (РЕ) и пролин-пролин-глутамат (РРЕ) N-терминальные домены, содержащие 110 и 180 аминокислотных остатков, соответственно [37]. Наличие данных гомологичных участков в структуре указанных RD1 белков, может обусловить перекрестные реакции организма у здоровых БЦЖ-вакцинированных людей, а также пациентов, контактировавших с нетуберкулезными микобактериями, и, таким образом, снизить специфичность иммунологического анализа. Например, L. M. Okkels показано, что пептид Rv3873118-135 на 78-89% идентичен последовательностям 9 РРЕ белков M. tuberculosis и M. bovis, а также 2-7 белков M. leprae, M. marinum, M. smegmatis [221]. Действительно, в работе А.В. Жердева и соавторов специфичность ИФА с Rv3873 оказалась невысока – при определении антител класса М - 63,5% (чувствительность - 62,5%), класса G 20,8% (чувствительность - 65,4%) [10]. Использование в ИФА только специфичных пептидов Rv3873, например, как в работе Jia-Nan Xu, может привести к повышению специфичности анализа, по сравнению с целым антигеном [340]. При оценке иммуногенности отдельных перекрывающихся пептидов Rv3872 в работе P. Mukherjee два из них, Р8 и Р9, оказались наиболее серореактивными и показали результаты в ИФА схожие с данными, полученными при оценке целого белка. Вместе Р8 и Р9 позволили выявить 94% (против 92% для Rv3872) случаев легочного и 90% (против 89%) внелегочного туберкулеза. Специфичность ИФА с Р8 и Р9 составила 100%, что оказалось на 5% выше результатов с целым белком [83, 210, 212]. Rv3874 (CFP-10) и Rv3875 (ESAT-6) – низкомолекулярные белки фильтрата культуры M. tuberculosis, кодируемые генами, относящимися к семейству esat6. 69 Белки, принадлежащие к указанному семейству, имеют гомологию с ESAT-6 в аминокислотной последовательности от 10 до 35%,а их ортологи встречаются у M. leprae, Staphylococcus aureus, Listeria monocytogenes и другие [110, 189, 323]. CFP-10 и ESAT-6 экспрессируются на ранних стадиях развития инфекции, формируют плотный 1:1 гетеродимерный комплекс ESAT-6/CFP-10, который секретируется во внеклеточное пространство благодаря системе ESX-1, при этом сам процесс секреции ассоциирован с патогенезом туберкулеза. ESAT-6 ингибирует антиген-презентирующую функцию макрофагов за счет уменьшения продукции ИЛ-12 посредством нарушения Toll-like рецептор 2 сигнального пути, угнетает Т-клеточный ответ, оказывает влияние на сигнальный путь Т-клеточного рецептора после ZAP70, снижает выработку γ-ИНФ, ИЛ-17, фактор некроза опухоли (ФНО), но не ИЛ-2. Действуя как цитолитический токсин, формирующий поры в мембранах клетки, он вызывает лизис эритроцитов, способствует проникновению M. tuberculosis в клетку, избегая фаголизосомы, и, таким образом, диссеминации патогена в организме [99, 122, 160, 260]. В исследованиях, направленных на измерение уровня IgG против перекрывающихся синтетических пептидов ESAT-6, наиболее выраженный антительный ответ был получен против С-концевого участка белка, как у экспериментальных, так и у естественно инфицированных животных. Более того, эти антитела детектировались уже на ранних этапах экспериментальной инфекции, что объяснялось быстрым увеличением числа ESAT-6-специфичных Bклеточных клонов в ходе течения заболевания. В недавних исследованиях в Канаде при сравнении антительного ответа на ESAT-6, 38кДа и 14 кДа (Rv0455c) белки M. tuberculosis у больных и здоровых пациентов, было обнаружено, что ESAT-6 не ассоциирован с активным туберкулезом, а только с факторами риска развития активного заболевания, либо с латентным туберкулезом [119]. В исследованиях, проведенных в Эфиопии, напротив, было показано, что повышенный титр анти-ESAT-6 прогрессирующего туберкулеза [84]. антител характерен для активного 70 При изучении антительного ответа на белки ESAT-6 и CFP-10 у больных и здоровых жителей высокоэндемичного региона, Гамбии, чувствительность теста с ESAT-6 составила 67%, а с CFP-10 - 63%, специфичности - 51% и 55%, соответственно. Почти у половины доноров контрольной группы, проживающих в Гамбии, обнаруживались антитела к данным белкам, в то время как в неэндемичных странах с ними реагировали менее 6% сывороток здоровых БЦЖвакцинированных доноров. Низкая специфичность тестов, по мнению авторов, объяснялась широкой распространенностью латентного туберкулеза в Гамбии [119]. CFP-10 - один из многообещающих антигенов M. tuberculosis для целей серодиагностики туберкулеза. В работе H. Zhang и соавторов серологический тест, основанный на CFP-10, выявил 78% случаев легочного, 65,6%-внелегочного туберкулеза, а специфичность теста составила 96,4% [349]. 1. 4. 3. 2. Другие потенциальные белковые антигены M. tuberculosis для целей серодиагностики туберкулеза Среди белков M. tuberculosis, гомологичных белкам M. bovis BCG, также есть антигены с высоким потенциалом для применения в серодиагностике туберкулеза. Важной характеристикой таких белков является наличие в их структуре иммунодоминантных эпитопов, специфичных для микобактерий туберкулезного комплекса. Антитела против данных антигенов появляются, либо значительно нарастает их титр (по сравнению с уровнем противотуберкулезных антител у здоровых БЦЖ-вакцинированных или инфицированных туберкулезом людей), только при активации заболевания. Потенциальные белковые серодиагностические маркеры туберкулеза относятся в основном к группам секретируемых белков M. tuberculosis, наиболее доступных для иммунной системы [196, 245]. Секретируемый белок M. tuberculosis Rv0040c (МТС28), с высоким содержанием остатков аланина и пролина, проявляет выраженную иммунологическую активность как в реакциях клеточного, так и гуморального иммунитета. Кодирующая последовательность этого антигена присутствует 71 только в геноме микобактерий туберкулезного комплекса, а также M. leprae, но не микобактерий окружающей среды, в том числе M. avium. МТС28 обнаруживают в фильтрате культуры M. tuberculosis на ранних стадиях развития инфекции. Он, как и многие внеклеточные белки M. tuberculosis, вызывает иммунный ответ у морских свинок, иммунизированных живыми, а не убитыми микобактериями. МТС28 имеет сигнальный пептид из 32 аминокислотных остатков на N-конце полипептида и секретируется во внеклеточное пространство в гликозилированной форме [198]. В работе X. Wu чувствительность серодиагностического теста, детектирующего анти-МТС28 антитела в сыворотках больных туберкулезом Китая, составила 19% [337]. В работе A. Kulshrestha, выполненной в Индии, антиМТС28 антитела выявляли только у 14,6% больных легочным и 13% внелегочным туберкулезом [163]. Белок Rv0222 (ECHA1), кодируемый RD4 регионом M. tuberculosis, является одним из многообещающих антигенов для серодиагностики туберкулеза. В работе I. Rosenkrandsa при изучении серодиагностического потенциала 47 «RD белков» M. tuberculosis, лучшим был признан именно Rv0222. Он выявил 82% больных туберкулезом среди доноров из Дании. В этом же исследовании, но с сыворотками больных туберкулезом высокоэндемичного региона, Уганды, чувствительность анализа с Rv0222, при сравнении с неэндемичным контролем (образцами от здоровых БЦЖ-вакцинированных доноров Дании), была 94%, а с эндемичным контролем (образцами от больных нетуберкулезными заболеваниями легких Гамбии) – только 36%. Значения чувствительности анализов, полученные при тестировании слитого белка ESAT-6-CFP-10 и 38кДа белка с теми же сыворотками, были значительно ниже (75% и 26%, и 27% и 0%, соответственно). Кроме того, чувствительность ИФА с Rv0222 была выше в группе ВИЧ – инфицированных (43%), чем в группе не инфицированных ВИЧ жителей Уганды (30%) [250]. Rv0934 (38 кДа белок, PstS1) является одним из наиболее иммуногенных антигенов M. tuberculosis. Это периплазматический фосфатсвязывающий липопротеин, принимающий участие в активном транспорте неорганического 72 фосфата через плазматическую мембрану микобактерий. Он синтезируется микобактериями в гликозилированной форме. В работе C. Espitia удаление углеводных остатков у данного гликопротеина привело к утрате его антигенности, что было, вероятно, связано с изменением конформации и потерей эпитопа ТВ72 [91]. 38 кДа белок широко применяется в исследованиях гуморального иммунитета при туберкулезе и составляет основу большинства коммерческих серодиагностических тестов [243, 263, 267]. Антительный ответ на 38 кДа белок ассоциирован с активным прогрессирующим туберкулезным процессом [258, 261, 274]. Специфичность тестов, основанных на Rv0934, как правило, высокая - от 88 до 100%, чувствительность, напротив, варьирует в широких пределах для различных групп пациентов. Так, для «мазок – положительных» туберкулезных больных она составляет 36 - 89%, для «мазок - отрицательных» – 16 - 54%, а для пациентов с внелегочным туберкулезом – 12 - 56%. Антительный ответ к 38 кДа белку детектируют и у детей и ВИЧ-инфицированных больных туберкулезом (чувствительность 37 - 77,4% и 38 - 73%, соответственно) [67, 145, 191, 309]. Как отмечают многие исследователи, 38 кДа белок наиболее эффективен для серодиагностики в сочетании с другими иммунодоминантными белками [337]. Так в работе M. Amicosante и соавторов при комбинации 38 кДа антигена с 34 кДа белком, чувствительность теста составила 86%, а специфичность около 100% даже в сравнении с больными нетуберкулезными заболеваниями легких контрольной группы [40, 67]. Также удачными оказались сочетания 38 кДа белка с 16 кДа белком, МРТ51, Ag85B, Rv3425, ЛАМ [241, 267, 349]. Rv1636 (ТВ15.3) и Rv2185c (ТВ16.3) относят к группе консервативных гипотетических белков M. tuberculosis. Эти белки определяются только в мембранной фракции и цельноклеточном лизате штамма H37Rv. Тем не менее, Y. Y. Bahk выделил Rv1636 из фильтрата культуры вирулентного К-штамма M. tuberculosis (семейство Beijing), но не штаммов H37Rv и CDC1551. Таким образом, вариабельность штаммов в локализации Rv1636 может повлиять на 73 различия в доступности белка для иммунной системы и, следовательно, выраженности гуморального ответа организма на него [47, 200]. ТВ15.3 и ТВ16.3 применяются в качестве серомаркеров туберкулеза как в эндемичных, так и неэндемичных по данному заболеванию регионах [325]. В работе L. Zhang из 21 антигена M. tuberculosis, исследованного в ИФА с сыворотками больных туберкулезом Китая, белок TB16.3 оказался лучшим серомаркером туберкулеза (чувствительность - 45,6%, специфичность – 100%) [345]. Чувствительность анализов с белком TB15.3 составила 31,1%, специфичность – 96,7%. Схожие результаты были получены для белков TB16.3 и TB15.3 другим автором, K. Weldingh, с сыворотками больных туберкулезом неэндемичного региона (Дании): чувствительность - 55% и 31%, специфичность – 100% и 97%, соответственно. Более того, свыше 30% тестируемых сывороток больных туберкулезом Дании распознавались четырьмя (TB16.3, TB15.3, TB9.7, TB51) из 35 исследованных антигенов M. tuberculosis. Среди пациентов из эндемичного по туберкулезу региона (юго-восточная часть Африки) теми же четырьмя антигенами выявлялись сыворотки 65% больных туберкулезом. Наиболее распознаваемым антигеном в ИФА в обоих случаях также был белок TB16.3. В анализах с TB16.3 выявлено 93%, а TB15.3 – 69% больных. Также с помощью данных антигенов в ИФА было определено более 41% случаев внелегочного и «мазок-негативного» легочного туберкулеза [325]. Rv1837c (МТВ81, GlcB, 81∕88кДа белок) - 81кДа малат-синтетаза, участвующая в глиоксилатном цикле, обеспечивающем выживаемость M. tuberculosis в неблагоприятных условиях в организме хозяина. GlcB стимулирует выраженный гуморальный иммунный ответ при туберкулезе [169, 258, 259]. K. M. Samanich показано, что анти-МТВ81 антитела обнаруживаются на ранних стадиях заболевания еще до появления анти-38кДа антител и сохраняются при прогрессирующем течении туберкулеза с кавитарными поражениями тканей, даже когда анти-38кДа антитела уже не определяются [258]. GlcB является серомаркером туберкулеза и у ВИЧ - инфицированных пациентов. При использовании его в серодиагностике туберкулеза у жителей 74 Уганды и Южной Африки, чувствительность ИФА для ВИЧ+ТВ+ оказалась выше (92%), чем для ВИЧ-ТВ+ пациентов (56%) [133]. K. K. Singh и соавторы методом ИФА детектировали анти - GlcB антитела у 70% ВИЧ-ТВ+ и 79% ВИЧ+ТВ+ пациентов. Этим же исследователям удалось выявить антитела против GlcB и MPT-51 в сыворотках, полученных от ВИЧ - инфицированных пациентов, еще до клинического проявления туберкулеза (чувствительность составила 81% и 86%, соответственно). Эти антигены, по мнению авторов, могут быть использованы как маркеры латентной туберкулезной инфекции у ВИЧ - инфицированных [27, 278]. В работе X. Wu МТВ81 выявил в ИФА, согласно расчетам по cutoff, только 26,7% из 210 ВИЧ-ТБ+ больных, ложноположительный результат был получен только для 1% из 192 здоровых БЦЖ-вакцинированных доноров. По результатам ROC анализа эти цифры составили 62,4% и 11,5%, соответственно [337]. Rv1860 (MPT32, Apa, DPEP, 45/47 кДа) – секретируемый белок M. tuberculosis, а также M. leprae. Он является фибронектин - связывающим белком и, вероятно, способствует инвазии микобактерий в эпителиальные и шванновские клетки [128]. Существуют данные о том, что МРТ32 секретируется M. tuberculosis уже на ранних этапах развития заболевания, в том числе в период внеклеточной репликации микроорганизма до инфицирования им макрофага. В нативном МРТ32 α-1,2-О-маннозилированы как N- так и С-концы полипептидной цепи, и именно углеводные мотивы МРТ32 обеспечивают повышенную иммуногенность данного гликопротеина. M. Lara было показано, что дегликозилирование МРТ32 приводит к потере белком способности к связыванию специфических антител [53, 88, 176, 258]. МРТ32 распознается сыворотками больных туберкулезом как с ранними некавитарными, так и уже с кавитарными поражениями легких, а, следовательно, имеет высокий потенциал для использования его в серодиагностике туберкулеза. В работе K. M. Samanich применение нативного МРТ32 в ИФА обеспечило выявление 69% ВИЧ-ТБ+, и 19% ВИЧ+ТБ+ пациентов, специфичность составила 98% [259]. В исследовании X. Wu чувствительность серодиагностики с МРТ32 для ВИЧ-ТБ+ была лишь 13,3%, специфичность - 98%. При исследовании 75 гуморального иммунитета при туберкулезе в работе K. K. Singh анти-МРТ32 антитела были обнаружены в сыворотке крови больных в 68% случаев, в моче - в 64% и при комбинировании результатов анализов - в 77% [279, 337]. Rv1886c (Ag85B, МРТ59, 30кДа белок) относится к группе антигенов комплекса Ag85 (Ag85A (MPT44, Rv3804c), Ag85B, Ag85C (MPT45, Rv0129с) и Ag85D (MPT-51, Rv3803c)), которые составляют до 30% секретируемых белков M. tuberculosis. Они принадлежат к семейству некаталитических α∕β - гидролаз, способных связывать фибронектин. Представители этого семейства обладают миколилтрансферазной активностью, необходимой для биогенеза димиколат трегалозы (корд-фактора), доминантной структуры, ответственной за поддержание целостности клеточной стенки микобактерий и выживаемости патогена внутри макрофага [328]. Белки Ag85А и Ag85B стимулируют клеточный иммунный ответ в организме и активируют механизмы противотуберкулезной защиты. Они входят в состав некоторых противотуберкулезных вакцин (HyVac1 (Ag85B и ESAT-6), HyVac4 (Ag85B и TB10.4), MVA85A (Ag85A) и другие), которые после успешного проведения клинических испытаний могут быть использованы на практике [150,175, 282]. По мнению многих авторов, Ag85B является одним из наиболее серореактивных белков M. tuberculosis [173, 194, 261]. Чувствительность тест систем, основанных на Ag85B, колеблется от 41% до 94%. В исследовании, проведенном в Индии, Ag85B, полученный из фильтрата культуры M. tuberculosis, был использован при определении антител разных классов у больных легочным туберкулезом. Чувствительность теста составила 76,4%, 14,8% и 14,3%, а специфичность 99%, 96,7% и 92% для IgG, IgA и IgM, соответственно. Комбинация результатов ИФА по определению анти-Ag85B антител классов А и G позволила повысить чувствительность теста до 71% [184]. Ag85B эффективный серомаркер туберкулеза у ВИЧ - инфицированных. В Уганде с помощью Ag85B было выявлено 92% ВИЧ+ТБ+ больных, а в ЮАР – 72% [133]. Серологические тесты, созданные на основе Ag85B, как правило, не обладают высокой специфичностью. Это связано с перекрестной реактивностью 76 антигенов комплекса Ag85 с антигенами других микобактерий. Решением этой проблемы может быть использование в серодиагностике не всего белка, а только его эпитопов. Так, при использовании лишь одного иммунодоминантного пептида A25 с сыворотками больных туберкулезом, удалось достичь чувствительности теста равную чувствительности в анализе с целым белком Ag85B (около 60%), а также высокую специфичность (97%). А использование всего 6 иммунодоминантных пептидов Ag85B оказалось достаточным для выявления туберкулеза у 82% больных Индии. В работе G. Kumar белки Ag85A, Ag85B и Ag85C показали в ИФА чувствительность 44,6%, 34% и 80,9%, и специфичность 55,6%, 74,1% и 40,7% соответственно. Чувствительность тестов ИФА на основе Ag85D достигает 71%, а специфичность около 95% [165]. Ген белка Rv1980c (MPT64) относится к RD2 региону M. tuberculosis, который присутствует в геноме M. bovis BCG Russia, но отсутствует в геномах многих других субштаммов M. bovis BCG, M. leprae и большинства нетуберкулезных микобактерий. В исследовании M. Kalra, выполненном в Индии, при оценке серодиагностического потенциала белка МРТ64 в комбинации с тремя другими «RD белками» (ESAT-6, CFP-10, CFP-21), общая чувствительность теста составила 52%, еще 38% больных удалось выявить при применении дополнительного метода детекции данных антигенов в составе ЦИК. В работе M. C. Kaisermann анти-МРТ64 антитела класса A были обнаружены в плевральном выпоте 72% больных туберкулезным плевритом Бразилии, специфичность теста составила 96% [147, 149]. Rv2031с (16 кДа антиген) является цитозольным регуляторным белком (фактором вирулентности), специфичным для микобактерий туберкулезного комплекса. Его кодирующая последовательность идентична генам белка теплового шока млекопитающих Hsp16.3 (Acr) и α - кристаллина (белку, участвующему в поддержании прозрачности хрусталика глаза). Этот антиген не детектируется в экспоненциальную фазу роста M. tuberculosis, но синтезируется в избытке в стационарную фазу и при неблагоприятных условиях, таких как гипоксия, недостаток питательных веществ, низкий рН, накопление токсичных 77 продуктов. Было показано, что микобактерии, лишенные гена rv2031с, не могут расти в макрофагах. Rv2031c относится к группе белков, кодирующихся DosR регулоном. Экспрессия данной группы белков ассоциирована с латентной инфекцией [251]. У больных туберкулезом в крови обнаруживается повышенный титр антител против 16 кДа белка. A. Raja и соавторы, используя ИФА тесты, детектирующие анти – 16 кДа антитела классов IgG, IgA и IgM в сыворотках мазок - и культуропозитивных больных туберкулезом детей, получили чувствительность тестов 62%, 52% и 11%, специфичность – 100%, 97% и 95%, соответственно, а комбинация всех трех изотипов иммуноглобулинов позволила получить чувствительность 83% и специфичность 93% [241]. Другие исследователи, используя рекомбинантный 16 кДа белок, получили несколько худшие результаты, они выявили IgG у 34%, IgA – у 19% и IgM - у 3% больных [138]. В ретроспективном исследовании M. F. Rabahi повышенный титр IgM против 16 кДа белка определялся в сыворотке пациентов еще за год до виража туберкулиновой пробы. Таким образом, 16 кДа белок является серомаркером латентной туберкулезной инфекции и может выявлять лица, имеющие высокий риск активации заболевания [238]. Тем не менее, в недавней работе A. Kaushik, выполненной в Индии, чувствительность ИФА детекции IgG и IgA против 16кДа белка в группе пациентов с легочным туберкулезом была 73,8-81,2% для разных категорий больных, в группе больных с внелегочным туберкулезом- 42,8-63,3%, специфичность составила 94,7% [153]. Rv2376c (МТВ12, CFP2) - низкомолекулярный секретируемый белок, составляющий значительную часть фильтрата культуры M. tuberculosis. Он играет важную роль в провоспалительном ответе на ранних стадиях развития туберкулеза легких у человека, индуцируя секрецию ФНО, ИЛ-6, но не γ-ИНФ. Эти данные могут свидетельствовать о важной роли МТВ12 в иммунопатогенезе туберкулеза у человека. В работе G. Zhang для ИФА с МТВ12 была получена чувствительность 24,4%, специфичность - 94,4%. В исследовании J. S. Lee 78 чувствительность ИФА с МТВ12 составила 53% (специфичность 95,4%), а в комбинации с 38 кДа белком 73% (специфичность 95,4%) [179, 343]. Rv2873 (MPТ83/MTB83) и Rv2875 (MPТ70/MTB70) – высокогомологичные белки, относящиеся к генетическому семейству MPT70/MPT83 комплекса M. tuberculosis. Представители указанного комплекса отличаются по уровню экспрессии данных белков, что обусловлено наличием мутаций в положительном (sigK (сигма фактор К)) или отрицательном (rskA) регуляторах транскрипции генов. Для M. tuberculosis характерен низкий базальный уровень активации генов mpt83 и mpt70 и выраженная их индукция при инфицировании макрофага [68, 315]. M. bovis имеет постоянно высокий уровень экспрессии данных белков в связи с мутацией в rskA (антисигма К фактор). В ходе длительных пассажей M. bovis BCG в sigK появилась точечная мутация, приведшая к редуцированной экспрессии некоторыми субштаммами M. bovis BCG белков МРТ83 и МРТ70. Сохранение высокой экспрессии данных белков в ряде субштаммов M. bovis BCG (Russia, Moreau, Sweden, Tokyo) связывают с риском развития БЦЖ - остита у детей до года как осложнение БЦЖ-вакцинации. Это обусловлено гомологией данных белков с остеобластспецифическим фактором II, или периостином, участвующим в регуляции роста костной ткани [68, 134, 295, 307, 315]. МРТ83, в отличие от МРТ70, имеет типичный липопротеиновый участок и уникальную вставку из 35 аминокислот на N-конце полипептида с сайтом гликозилирования. МРТ83 связан с клеточной стенкой, а МРТ70 - растворимый секретирующийся белок [327, 329]. МРТ83 и МРТ70 показали свою эффективность в качестве серомаркеров бычьего туберкулеза у животных. В работе S. Liu гибридный белок, содержащий МРТ70, МРТ83 и ESAT-6, применявшийся для серодиагностики бычьего туберкулеза, позволил выявить 69,4% больных туберкулезом коров, ложноположительный результат был лишь у 4% здоровых животных. Подобный химерный белок ESAT-6/МРТ70/МРТ83, полученный I. Souza, показал в 79 диагностике бычьего туберкулеза методом ИФА чувствительность - 83,2% и специфичность - 86,5% [186, 288]. После работы R. Colangeli (1999 год), где чувствительность ИФА с Rv2875 у ВИЧ-инфицированных туберкулезных больных составила лишь 10%, на протяжении около десяти лет в литературе практически не встречались данные об определении потенциала Rv2873 и Rv2875 для использования в серодиагностике туберкулеза у людей [71]. Вероятно, это было обусловлено представлением о слабо выраженном гуморальном ответе при туберкулезе на МРТ83 и МРТ70 в связи с низкой экспрессией их M. tuberculosis, обнаруженной в исследовании in vitro. Однако в работе G.C. Ireton за 2010 год было показано, что у 55-74% исследованных больных туберкулезом определялись высокие титры антител против Rv2875, а чувствительность анализа с Rv2873 в работе L. Zhang за 2011 год составила 34,4%. Специфичность анализов в обоих случаях была более 90% [141, 345]. Кодирующая последовательность белка Rv3425 (PPE57) располагается в RD11 регионе генома M.tuberculosis. Этот регион отсутствует в геноме M. bovis и многих субштаммов M. bovis BCG. Белок Rv3425 экспрессируется M. tuberculosis H37Rv во время экспоненциального роста in vitro. J. Wang и соавторы обнаружили, что PPE57 стимулировал как Th1, так и Th2 типы иммунного ответа в моделях мышей, что проявлялось повышением концентрации γ-ИНФ в спленоцитах, стимулированных этим антигеном, и выраженным IgG1 антительным ответом. В исследованиях гуморального иммунитета при туберкулезе отмечается иммунодоминантная роль Rv3425. Он распознается сыворотками больных как легочным, так и внелегочным туберкулезом. H. Zhang и соавторами были обнаружены анти - Rv3425 антитела класса IgG у 70% больных легочным и 59,4% внелегочным туберкулезом, специфичность теста составила 100% [344]. В работе S. L. Zhang и соавторов Rv3425 показал чувствительность 45,8%, меньшую, чем ЛАМ (55,9%), однако, большую, чем 38кДа белок (37,3%) с теми же образцами. Мультиантигенный ИФА тест, включающий три этих антигена, показал 80 чувствительность для выявления легочного туберкулеза 89,8%, а внелегочного 26,7%. Специфичность теста была 93% [349]. Белок Rv3881c (МТВ48) является одним из наиболее иммуногенных белков M. tuberculosis. Его кодирующая последовательность высококонсервативна для геномов M. tuberculosis и M. bovis и отсутствует в геномах M. avium и M. leprae. Зрелая форма этого белка обнаруживается как в цитоплазме, так и в фильтрате культуры M. tuberculosis. В работе S. Kunnath-Velayudhan среди 484 протестированных в ИФА белков M. tuberculosis МТВ48 оказался лучшим серомаркером туберкулеза с сыворотками больных туберкулезом из разных регионов. В исследовании, проведенном в Китае, чувствительность теста ИФА с МТВ48 составила 74,4%, а в Уганде, Бразилии и Филиппинах только 47%, 33% и 32%, соответственно [166]. В работе X. Wu при исследовании серодиагностического потенциала 17 антигенов M. tuberculosis, только 26,7% сывороток больных туберкулезом было выявлено ИФА с помощью данного антигена, однако, почти для половины из них (46,4%) были получены высокие значения OD490, превышающие среднее OD490 контрольной группы плюс шесть стандартных отклонений [337]. Белок МТВ48 также применялся для серодиагностики в составе различных антигенных коктейлей. Одним из наиболее перспективных из них в настоящее время, согласно данным литературы, можно считать химерный белок TbF6, включающий МТВ8, 38 кДа белок, CFP-10 и МТВ48. Использование TbF6, совместно с МРТ32, в ИФА с сыворотками больных туберкулезом из разных стран позволило достичь чувствительности серодиагностики более 85,7% [292]. Антиген А60 – это термостабильный полуочищенный липополисахариднобелковый комплекс (106–107 Да), экстрагированный из M. bovis BCG и содержащий около 30 компонентов. Он неспецифичен для микобактерий, так как продуцируется коринебактериями и нокардиями [67, 314]. Этот антиген, преимущественно в нативной форме, является основой нескольких коммерческих серодиагностических тест-систем. 81 В исследовании K. T. Luh при использовании его в ИФА он позволил выявить 76,2% пациентов с активным туберкулезом легких и 59% пациентов с внелегочным туберкулезом [190]. Измерение анти-А60 IgM более достоверно для пациентов с первичным активным туберкулезом, а IgG - для больных со вторичным активным туберкулезом. Чувствительность детекции IgG и IgM против А60 у детей из Индии в работе S. Gupta была аналогична чувствительности диагностики у взрослых. При определении анти-А60 IgA и IgM антител в указанной работе общие чувствительность и специфичность теста составили 76% и 92%, соответственно [82, 123]. В исследовании, проведенном в Иране, показатели чувствительности серодиагностики с сыворотками детей данного региона при определении анти-А60 IgA, IgG и IgM составили 29,4%, 37,3% и 70,6%, специфичности – 97,5%, 95% и 62,5%, соответственно [156]. 1. 4. 4. Липидные и углеводные антигены M. tuberculosis Оболочка микобактерий содержит значительные количества разнообразных липидных молекул, многие из которых ассоциированы с их вирулентностью и патогенностью. Наиболее иммуногенными среди липидов M. tuberculosis являются липогликаны (ЛАМ), сульфатиды (SLI, SLII), производные - эфиры трегалозы (корд-фактор, PGL-Tb1). Титр IgG антител против липидных антигенов M. tuberculosis существенно возрастает в активную фазу туберкулезной инфекции и быстро снижается во время проведения противотуберкулезной терапии. Гуморальный ответ на липидные антигены M. tuberculosis так же, как и на белковые антигены, является гетерогенным [102]. Серологические тесты, основанные на липидных антигенах M. tuberculosis, обладают высокой эффективностью выявления туберкулеза, так как они более стабильны, воспроизводимы, и, как правило, имеют низкий уровень перекрестной реактивности, по сравнению с серотестами, включающими только белки M. tuberculosis. В работе J. He, антитела IgG к корд-фактору (трегалоза-6,6-димиколат) были детектированы методом ИФА у 81% мазок - позитивных больных 82 туберкулезом и только у 4% здоровых доноров, чувствительность данного теста для мазок - негативных туберкулезных больных составила 70% [131, 195]. Другим автором были выявлены антитела к 6 производным трегалозы у 91,5% из 924 госпитализированных и у 93,3% из 210 вновь выявленных туберкулезных больных [102]. Чувствительность серологических тестов с ДАТ колеблется от 11% до 88%, а с TAT - от 51% до 93% [31]. В одном из исследований при сравнении в ИФА серодиагностической эффективности четырех липидных антигенов M. tuberculosis (корд-фактора, ДАТ, TAT и SL I), наилучшие показатели чувствительности (81% при детекции IgG, 66% - IgА) и специфичности (77,6% - IgG и 87% - IgА) были получены для SL I [146]. В работе J. M. Bezerra PGL-Tb1 оказался лучшим серомаркером туберкулеза, по сравнению со слитым белком TbF6/DPEP и белковым препаратом из сониката (ультразвукового дезинтеграта) культуры M. tuberculosis. Анти PGL-Tb1 антитела класса А были выявлены у 88% больных (независимо от результатов бактериоскопии мазка мокроты) и ни у одного здорового пациента из контрольной группы, при этом в ходе лечения титры данных антител снижались [54]. Многие данные свидетельствуют о высокой эффективности серологических тестов, основанных на гликолипидных антигенах M. tuberculosis, при выявлении туберкулеза у ВИЧ-инфицированных. В работе N. Simonney при исследовании диагностического потенциала PGLTb1 методом ИФА, чувствительность теста с сыворотками ВИЧ-положительных (76,8%) оказалась выше, чем с сыворотками ВИЧ-отрицательных (58,9%) туберкулезных больных, специфичность составила около 94%. Для ВИЧ положительных туберкулезных больных при всех формах туберкулеза чувствительность ИФА была идентична, и уровень антител к гликолипиду не коррелировал с уровнем CD4+ клеток, результатами теста Манту, возрастом или обнаружением бактерий в мазке. 83 Эффективным серомаркером туберкулеза у ВИЧ-инфицированных также является липидный антиген ДАТ [275]. 1. 4. 4. 1. Липоарабиноманнан (ЛАМ) Липоарабиноманнан (ЛАМ) является одним из основных структурных компонентов оболочки M. tuberculosis. Это фактор вирулентности M. tuberculosis, который обеспечивает выживаемость микобактерий в макрофагах и оказывает иммуносупрессивный эффект на Т-клеточное звено противотуберкулезного иммунитета. Наличие последних эффектов ЛАМ связывают с его формой ManLAM, включающей маннозные фрагменты (кэпы) на терминальных участках боковых ветвей арабинанового домена [61]. Однако в недавнем исследовании было показано, что маннозные кэпы в ЛАМ не влияют ни на вирулентность M. tuberculosis in vivo, ни на взаимодействие патогена с макрофагами in vitro [35]. Существует предположение, что маннозные кэпы в ManLAM маскируют терминальные арабинофуранозидные фрагменты (Araf) от иммунной системы хозяина, в частности, от взаимодействия с антителами [152]. Арабинановый арабинофуранозиловый домен остов ЛАМ с содержит терминальными α-(1→5)-связанный разветвленным гексаарабинофуранозидом (Araf6) и линейным тетраарабинофуранозидом (Araf4) [61]. Арабинаны признаются главными В-клеточными иммуногенами ЛАМ и арабиногалактана (АГ). Показано, что они утрачивают антигенность при обработке арабиназами [208]. Терминальные нередуцированные мотивы арабинановой цепи (Araf) ЛАМ являются основными эпитопами для связывания антител. В работе D. Kaur моноклональные анти-ЛАМ антитела CS-35 реагировали в ИФА с AraLAM, ManLAM и АГ, но не связывались ни с липоманнаном, ни с АГ, полученным из мутантных штаммов, дефектных по синтезу арабинана или только Araf6 фрагментов. В данном исследовании при тестировании эффективности связывания в ИФА различных синтетических олиго -Araf с CS-35, «лучшим» 84 эпитопом для анти-ЛАМ антител был признан Araf6 метил гликозид разветвленной структуры [152]. Araf6 имеет перспективы для использования его в диагностике или в качестве компонента гликопротеиновых вакцин против туберкулеза [125, 148, 152, 304]. Определение анти-ЛАМ антител достаточно часто используется в серодиагностике туберкулеза. Чувствительность тестов на основе ЛАМ варьирует от 21,5% до 89% среди ВИЧ-ТВ+ и от 7 до 40% среди ВИЧ+ТВ+ [67]. В работе S.L. Zhang анти-ЛАМ антитела были выявлены методом ИФА у 55,9% «мазокпозитивных», 19,4% «мазок-негативных» больных легочным туберкулезом и у 20% больных внелегочным туберкулезом, тогда как для 38 кДа белка эти значения составляли 37,3%, 9,7% и 0%, соответственно [349]. ЛАМ является основой многих коммерческих серодиагностических тестсистем. При исследовании гуморального ответа у ВИЧ-отрицательных больных туберкулезом Танзании, Ганы и Таиланда с помощью теста MycoDot (Mossman Associates, США) анти-ЛАМ IgG антитела были обнаружены в 33%, 56%, и 63% случаев туберкулеза, соответственно. ИФА тест Pathozyme-Myco G (Omega Diagnostics Ltd, Alloa, Scotland), детектирующий антитела к двум антигенам M. tuberculosis, ЛАМ и 38кДа белку, показывает чувствительность до 71% при специфичности 100% [178, 246, 263, 285]. В связи с тем, что ЛАМ активно экскретируется с мочой (от 0,5 до нескольких сотен нанограмм на 1 мл мочи), разработано несколько уринарных тестов, детектирующих ЛАМ (Alere Determine TB LAM Ag, Alere, США). В исследовании P. Daley чувствительность подобного теста оказалась низкой (20%), однако, одинаковой как у ВИЧ+ТВ+, так и ВИЧ-ТВ+ пациентов, т.е. ВИЧ статус не влиял на секрецию ЛАМ у туберкулезных больных [79]. В работе R. Wood ЛАМ определялся в моче у 16,1% пациентов до третьей недели химиотерапии [333]. В исследованиях, проведенных в Танзании, была 85 обнаружена прямая корреляция между уровнем выделения почками ЛАМ и бактериовыделением [285]. 1. 4. 5. Конъюгаты белков M. tuberculosis с углеводными фрагментами ЛАМ Одним из способов усовершенствования серодиагностических тестов, выявляющих туберкулез, является создание полиэпитопных химерных антигенов путем химической конъюгации белков с углеводными молекулами. Иммуногенность ЛАМ обеспечивается, главным образом, его арабинановым компонентом [208]. В исследовании B. Hamasur олигосахаридные фрагменты арабиноманнана, выделенные из ЛАМ штамма M. tuberculosis H37Rv, были ковалентно конъюгированы с белками фильтрата культуры M. tuberculosis штамма Harlingen (Ag85B и 75кДа), а также с тетанус токсином (в качестве контроля для углеводного компонента конъюгатов). Лабораторные животные (мыши, кролики, морские свинки) были иммунизированы данными конъюгатами, а затем инфицированы M. tuberculosis. Все конъюгаты индуцировали высокие титры IgG антител против углеводного компонента ЛАМ, а также обеспечивали протективный эффект против M. tuberculosis (дозозависимое уменьшение бактериальной нагрузки в селезенке и легких, потери веса и увеличение продолжительности жизни), по сравнению с неиммунизированными животными, что тоже могло быть обусловлено действием специфических антител [126]. Основными эпитопами для связывания анти-ЛАМ антител являются терминальные гексаарабинофуранозидные фрагменты (Araf6) ветвей арабинановой цепи ЛАМ [69]. В работе D. Kaur было показано, что химически синтезированные олигоарабинофуранозиды, в частности, Araf6 разветвленной структуры (2(β-D-Araf-(1→2)-α-D-Araf)-(1→3 и 5)-α-D-Araf-(1→5)-α-D-Araf-OCH3), эффективно связываются в ИФА с моноклональными анти-ЛАМ антителами [152]. 86 В работе М. Tong мультиплексный и ИФА анализы с синтетическим Araf6, конъюгированным с БСА, выявили высокую дискриминирующую способность (между случаями туберкулеза и отсутствия заболевания) данного антигена (ППК в ROC анализе составила 0,9), а чувствительность и специфичность были 75% и 89%, соответственно [304]. Таким образом, синтетическим применение конъюгатов гексаарабинофуранозидом белков ЛАМ M. tuberculosis может с способствовать повышению чувствительности серодиагностики туберкулеза с одним антигеном. 1. 4. 6. Мультиантигенные композиции, используемые в серодиагностике туберкулеза Антительный ответ во время туберкулезной инфекции направлен против многих микобактериальных антигенов [191]. Однако в зависимости от стадии и формы туберкулеза, а также иммуногенетических особенностей организма набор антигенов M. tuberculosis, на которые формируется антительный ответ, различается у каждого пациента. Вследствие этого, как отмечают многие авторы, серодиагностический тест, основанный на одном антигене, не может быть высокочувствительным [108, 191]. Одним из путей повышения эффективности серодиагностики туберкулеза является создание композиции (коктейля) из нескольких иммунодоминантных антигенов M. tuberculosis. При включении в него антигенов M. tuberculosis только с высокой специфичностью можно достичь увеличения чувствительности диагностики при минимальном числе ложноположительных результатов. Применение в ИФА мультиантигенного коктейля имеет ряд преимуществ, по сравнению с анализом с одним антигеном. Во-первых, при использовании в ИФА антигенного коктейля уменьшается влияние неспецифического связывания на результаты измерений, а, следовательно, предотвращается возможное снижение диагностической точности исследования, обусловленное измерением в анализе фонового излучения. 87 Во-вторых, высокого уровня сывороточной реактивности к одному из антигенов достаточно для получения положительного результата в ИФА для всего коктейля. В-третьих, низкий уровень сывороточной реактивности в ИФА на один антиген на фоне общего реагирования сыворотки на несколько антигенов в коктейле становится неявным, при этом специфичность диагностики повышается. Однако, по мнению M. L Gennaro, в зависимости от числа антигенов в составе коктейля и общего количества белка, вносимого в лунку планшета, в ИФА может наблюдаться снижение общей расчетной чувствительности [108]. В работе S.L. Zhang представлен вариант коктейля, включающего антигены Rv3425, ЛАМ и 38 кДа белок. Комбинация трех данных антигенов в одном тесте позволила повысить чувствительность серодиагностики с одним антигеном с 20,635,3% до 61,8% для легочного и внелегочного туберкулеза, специфичность при этом снизилась только на 3,5-7% [349]. Из 21 протестированного в ИФА антигена L. Zhang было отобрано 5 антигенов (Rv2031c, Rv2185c, Rv2537c, Rv2785c, Rv3354) со специфичностью 100%. Эти белки вошли в состав антигенного коктейля, который показал в ИФА с 150 сыворотками больных туберкулезом и 150 сыворотками здоровых людей значения чувствительности (76%) и специфичности (96 - 98%) [345]. Объединение различных антигенов в единый коктейль может повлиять на их стабильность в смеси и, следовательно, на эффективность взаимодействия со специфическими антителами. Возможным вариантом решения этой проблемы является создание гибридных белков, состоящих из наиболее иммуногенных белков M. tuberculosis, либо только из иммунодоминантных эпитопов этих белков [165, 210, 340]. В работе R. L. Houghton комбинация химерного белка TbF6 (CFP-10, MTB8, MTB48, 38 кДа белки M. tuberculosis) с DPEP (МРТ32) позволила выявить 86% больных туберкулезом популяции из Бразилии, 75% - из Турции, 71,2% из Южной Африки. Данный коктейль позволил выявить не только легочный, но и внелегочный туберкулез [136, 320, 338]. 88 Гибридный белок CFP-10-ESAT-6 высокоэффективен в серодиагностике туберкулеза. В работе J.-N. Xu данный белок выявил 65% (специфичность 91,4%), а слитый белок CFP-10-ESAT-6-РРЕ68’, содержащий пептид РРЕ68’ (домен белка РРЕ68) – 73,3% больных туберкулезом (специфичность - 94,3%). Химерные белки, содержащие только высокоспецифичные пептиды иммунодоминантных белков M. tuberculosis, имеют перспективы стать лучшими серомаркерами туберкулеза [116, 210, 269, 186, 340]. В недавнем исследовании с помощью 2 химерных белков, состоящих из 3 (38кДа-ESAT6-CFP10) и 4 (Mtb8.4MPT64-TB16.3-Mtb8) антигенов M. tuberculosis было выявлено более 85% случаев легочного и около 75% внелегочного туберкулеза (при специфичности 90%) [95]. Также, по данным литературы, высоким потенциалом для применения в серодиагностике туберкулеза обладают такие химерные белки как 38kDa-ESAT-6, Ag85B-HBHA и другие [132, 338]. Одним из вариантов генетической конъюгации микобактериальных антигенов является слитый белок Ag85B-ESAT-6, он включает в себя последовательности двух высокоиммуногенных секретируемых белков M. tuberculosis. Антиген Ag85B-ESAT-6 имеет перспективы для использования его в качестве вакцины у людей. Группа исследователей под руководством P. Andersen уже продемонстрировала возможность использования его в качестве вакцины на мышах: Ag85B-ESAT-6 стимулировал выраженный дозозависимый иммунный ответ и индуцировал высокий уровень протекции сравнимый с БЦЖ. Данный белок имеет потенциал для применения его и в серодиагностике туберкулеза [175]. В таблице 8 представлены результаты тестирования различных вариантов мультиантигенных композиций (коктейлей) в серодиагностике туберкулеза. На основании вышеизложенного можно заключить, что серодиагностика является перспективным методом для выявления туберкулеза, однако, для утверждения ее в качестве стандарта необходимо значительное повышение чувствительности и специфичности существующих серологических тестов. Наибольшей эффективностью для обнаружения туберкулеза будут обладать 89 серотесты, основанные на мультиантигенных композициях, включающих иммунодоминантные белковые и гликолипидные антигены M. tuberculosis. Таблица 8 - Эффективность серодиагностики туберкулеза при использовании различных вариантов мультиантигенных композиций Чувствительность, % Все ЛТБ ВТБ м+ м- С,% 38 кДа, MTB48, CFP-10/ESAT-6 87,6 90,8 84,7 - 65,9 338 Rv3425, ЛАМ, 38 кДа 61,8 89,8 43,5 26,7 93 38кДа, Ag85B, 16кДа, МРТ51 84,4 91 78 - 93,9 241 MTB8/38kDa/CFP-10/MTB48 71,5 78 54 - 98 136 MTB8/38kDa/CFP-10/MTB48, MPT32 79,8 85,7 64 - 98 136 38 кДа,16 кДа, Ag85B 54 64 50 49 96 139 38 кДа, 16 кДа - 31 0 8,3 97,9 145 38 кДа, ЛАМ - 41,3 0 0 97,9 145 ESAT-6, CFP-10, Ag85A, Ag85B, Ag85C - 51,1 - 0 85,2 165 ESAT-6, CFP-10, CFP-21, MPT-64 52 77 97 - 43 Ссылка Мультиантигенные композиции 349 149 Примечания: через дефис указаны гибридные белки, ЛТБ – легочный туберкулез, «м+/-» - мазок-положительные /отрицательные случаи ЛТБ, ВТБ - внелегочный туберкулез, С – специфичность. 90 Глава 2. Собственные исследования 2. 1. Получение антигенов M. tuberculosis разными методами 2. 1. 1. Получение рекомбинантных белков M. tuberculosis в экспрессионной системе E.coli В данной работе мы получили в экспрессионной системе E. coli восемь рекомбинантных белков M. tuberculosis (еRv0222, еRv1837c, еRv1860, еRv2875, еRv3425, еRv3872, еRv3875, еRv1886с-Rv3875), в том числе один гибридный белок. Гены белков Rv0222 (786 п. о.), Rv1860 (975 п. о.), Rv2875 (581 п. о.), Rv3425 (528 п. о.), Rv3872 (297 п. о.), Rv3875 (285 п. о.) амплифицировали с хромосомы M. tuberculosis штамма H37Rv. При амлификации гена rv1837с хромосомы M. tuberculosis H37Rv в ПЦР образовались неспецифические продукты реакции. В связи с этим использовали двухэтапную схему амплификации. Первоначально амплифицировали участок ДНК M. tuberculosis штамма H37Rv, 2600 п. о., содержащий последовательность гена rv1837c (2223 п. о.). Затем очищенный ПЦР продукт, 2600 п. о., использовали в качестве матрицы для амплификации гена rv1837c со специфическими праймерами. Кодирующая последовательность белка Rv1886c-Rv3875 (1143 п. о. (855 п. о+ 285 п. о.)) амплифицировали с плазмиды pPMC1-FL-ag85B-esat-6, любезно предоставленной Т.Б. Кравченко и В.М. Павловым (ФБУН ГНЦ ПМБ). Между генами белков Rv1886c и Rv3875 была расположена генетическая последовательность, кодирующая аминокислоту серин [13]. Гены белков вставили в плазмиду pET32b(+) между сайтами рестрикции NdeI в позиции 639 и либо XhoI в позиции 158 (для гена rv1860), либо HindIII в позиции 173 (для остальных генов). Все гены клонировали в открытую рамку 91 считывания с нуклеотидной последовательностью шести аминокислотных остатков гистидина в позициях 140-157. Экспрессия белков проводили в штамме BL21-CodonPlus(DE3)-RP E. coli под индукцией ИПТГ и селективным давлением антибиотиков. Оптимальный уровень экспрессии белков был достигнут через 4 часа индукции для всех рекомбинантных белков. Все белки экспрессировались в нерастворимой форме в тельцах включения. Молекулярные массы белков определялись по ДСН - электрофорезу в 10 12% ПААГ в сравнении с маркерами молекулярной массы белков (приложение 4 рисунки Е1 и Е2). Молекулярные массы белков в большинстве случаев соответствовали расчетным данным, определенным исходя из аминокислотного состава (приложение 2): еRv0222 (268 аа) – 29 кДа, еRv1837c (747 аа) – 82 кДа, еRv2875 (199 аа) – 22 кДа (18 кДа), еRv3425 (182 аа) – 21 кДа, еRv3872 (105 аа) – 12 кДа, еRv3875 (101 аа) – 10 кДа (20 кДа), еRv1886с-Rv3875 (395 аа) – 40 кДа. Для белка еRv3875 как в ДСН-электрофорезе, так и в иммуноблоте была обнаружена полоса 20 кДа, которая по молекулярной массе соответствовала димеру указанного белка (10 кДа). Белок еRv1860 (45/47 кДа комплекс) в данных исследованиях обнаруживался в виде 2 полос – 45 и 52 кДа, при расчетной молекулярной массе 30 кДа. Существование подобного аберрантного миграционного поведения для данного белка отмечалось и другими авторами. Его объясняют присутствием в белках ригидных терминальных участков полипептидной цепи богатых пролином (или коротких повторяющихся мотивов (КПМ)) [176,198]. Для белков еRv2875, еRv1860, еRv0040с в ДСН-электрофорезе и иммуноблоте наблюдалось наличие двух полос белка, отличающихся на 4-6 кДа, что соответствовало расчетным молекулярным массам сигнальных пептидов в составе полипептидных цепей (приложение 4 рисунок Е1 , для белка еRv0040с полосы в ДСН - электрофорезе 28 и 32 кДа). 92 Концентрации белков определяли по ДСН - электрофорезу, сравнивая с бычьим сывороточным альбумином. Они составили для еRv0222 - 0,4 г/л, еRv1837c - 0,05 г/л, еRv1860c - 0,2 г/л, еRv2875 – 0,8 г/л, еRv3425 - 0,4 г/л, еRv3872 – 0,8 г/л, еRv3875 - 1 г/л, еRv1886c-Rv3875 - 0,1 г/л. Очистку белков проводили металлхелатной хроматографией в денатурирующих условиях. Клеточные стенки E. coli разрушали ультразвуком. Целевые белки солюбилизировали в растворе с 8 М мочевиной и полученную суспензию наносили на колонку, содержащую иминодиуксусную сефарозу, насыщенную ионами никеля. Элюирование белков происходило при концентрации имидазола в элюирующем буфере 250 мМ. При ренатурации белков еRv1886c-Rv3875 и еRv3875 в состав диализного буфера вносили ДТТ до 1 мМ и глицерин до 3%, что позволило снизить агрегацию белка и повысить процент выхода целевого продукта. В состав диализного буфера также вносили ФМСФ до 1 мМ в качестве ингибитора протеаз. Концентрации очищенных белков после диализа, а также других использованных в ИФА белков высчитывали с помощью коэффициентов молярной экстинкции. Коэффициенты экстинкции составили: ε(еRv0222) = 14060 М-1см-1, ε(еRv1837c) = 77860 М-1см-1, ε(еRv1860) = 30440 М-1см-1, ε(еRv2875) = 5360 М-1см-1, ε(еRv3425) = 39970 М-1см-1, ε(еRv3872) = 1280 М-1см-1, ε(еRv3875) = 18350 М-1см-1, ε(Rv1886c-Rv3875) = 24750 М-1см-1, ε(Rv2376c) = 6970 М-1см-1, 93530 М-1см-1, ε(Rv0040c) = ε(Rv3874) = 6970 М-1см-1, ε(Rv3881c) = 40210 М-1см-1. Концентрации белков составили: еRv0222 – 0,5 г/л, еRv1837c - 0,1 г/л, еRv1860 – 0,3 г/л, еRv2875 – 1,1 г/л, еRv3425 - 0,2 г/л, еRv3872 – 0,8г/л, еRv3875 1 г/л, еRv1886c-Rv3875 - 0,25 г/л, еRv0040с – 0,3 г/л, еRv2376с - 0,6 г/л, еRv3874 0,5 г/л, еRv3881с - 0,3 г/л. 2. 1. 2. Результаты химической конъюгации рекомбинантных белков M. tuberculosis с гексаарабинофуранозидом ЛАМ В ФБГУН ИОХ РАН получили 6 конъюгатов белков с синтетическим гексаарабинофуранозидом ЛАМ (еRv0222Аr, еRv2376cАr, еRv2875Аr, еRv3875Аr, 93 еRv3881cАr, еRv1886c-Rv3875Аr). Гексасахарид Araf6 в структуре гликоконъюгатов пространственно удален от молекулы белков посредством агликона-спейсера для целей эффективного связывания данного эпитопа со специфическими антителами [1, 32]. Концентрации белков составили: еRv0222Аr - 0,15 г/л, еRv1886c-Rv3875Аr 0,6 г/л, еRv2376cАr - 0,6 г/л, еRv2875Аr - 0,17 г/л, еRv3875Аr - 0,16 г/л, еRv3881cАr - 0,3 г/л. Полученные конъюгаты были стабильны в водных растворах и хранились в замороженном виде. Данные белки использовались в ИФА наряду с другими исследуемыми антигенами. 2. 1. 3. Получение рекомбинантных белков M. tuberculosis в экспрессионной системе P. pastoris В данной работе мы впервые получили шесть рекомбинантных белков M. tuberculosis, в том числе один химерный белок, в экспрессионной системе P. pastoris (рRv0040с, рRv1837c, рRv1860, рRv2873, рRv2875, рRv1636-Rv2185с). Гены указанных выше белков были клонированы в плазмиду pPIC9 в открытую рамку считывания с α-фактором (сигнальной последовательностью, обеспечивающей секрецию белка в P. pastoris). При амплификации генов с хромосомы M. tuberculosis штамма H37Rv с 5’ концов в состав генов с помощью праймеров вносили нуклеотидную последовательность CATCATCACCATCACCAT, соответствующую 6 аминокислотным остаткам гистидина, с 3’ конца – терминаторные кодоны (TAA, TAG или TGA) (приложение 1). Кодирующая последовательность химерного белка рRv1636Rv2185с (894 п. о.) содержала нуклеотидные последовательности генов rv1636 (438 п. о.) и rv2185с (432 п. о.), разделенные последовательностью CCTAGG, соответствующей сайту AvrII. Несмотря на рекомендации производителя системы P. pastoris использовать при экспрессии секретируемых белков как нативные сигнальные последовательности, так и α-фактор в составе плазмиды pPIC9, в нашей работе кодирующие последовательности лидерных пептидов белков Rv0040с (96 п. о.), Rv1860 (117 п. о.), Rv2875 (90 п. о.) были удалены на стадии амплификации генов. 94 Этому было несколько причин. Во-первых, как указывают многие авторы, αфактор обеспечивает лучшую экспрессию белка в P. pastoris, по сравнению с нативными лидерными пептидами [249]. Во-вторых, наличие двух лидерных последовательностей в белке может привести к нарушению процессинга и фолдинга белка. Еще один фактор, обусловивший удаление сигнальных пептидов, это размещение нуклеотидной последовательности 6 остатков гистидина на 5’конце генов белков, то есть, отщепление нативного сигнального пептида могло бы повлечь за собой потерю полигистидинового тага, расположенного на N-конце полипептидной цепи, и, следовательно, невозможность очистки его из культуры с помощью аффинной хроматографии. Размеры сигнальных пептидов определялись программой SignalP 3.0 Server [272] и сверялись с данными литературы и баз данных [181, 287]. Отщепление α-фактора от белка осуществляется в два этапа. На первом этапе продукт гена kex2 разрывает связь между аргинином и глутамином в участке, соответствующем позиции 1204 в плазмиде pPIC9, а затем продукт гена ste13 разрушает дублированную последовательность глутаминаланин. Белок Rv2873 - поверхностный липопротеин M. tuberculosis, связанный с клеточной стенкой посредством липидного якоря. Программой SignalP 3.0 Server участок белка Rv2873 (33 аминокислотных остатка) также определился как трансмембранный якорь. В связи с этим, ген данного белка был клонирован в плазмиду PIC9 полностью (663 п. о.). Кроме того, M. Harboe опубликованы данные о том, что у кроликов, иммунизированных 13 и 20-мерными пептидами Nконца полипептидной цепи Rv2873, в части случаев образуютя антитела к сигнальному пептиду данного белка [127]. Рекомбинантные плазмиды pPIC9Rv0040c, pPIC9Rv1837c, pPIC9Rv1860, pPIC9Rv2873, pPIC9Rv1636-Rv2185с были линеаризованы ферментом рестрикции SacI для дальнейшего встраивания генетических конструкций в области генов AOX1 (для GS115) и aox1:ARG4 (для KM71) хромосомы P. pastoris. Рекомбинантная плазмида pPIC9Rv2875 была линеаризована рестрикционным ферментом SalI, что обеспечило вставку гена rv2875 в his4 участок хромосомы 95 P. pastoris. Трансформация линеаризованными P. pastoris плазмидами обеспечивает стимулирование рекомбинации и правильное встраивание генов в хромосому P. pastoris. Клетки штамма GS115 P. pastoris были трансформированы плазмидами pPIC9Rv1837c и pPIC9Rv1636-Rv2185с методом электропорации. Трансформанты были высеяны на минимальную среду с глюкозой (MD), а затем колонии пересеяны на чашку со средой MM (минимальной среде с метанолом) и MD. В клетках GS115, трансформированных рекомбинантными плазмидами pPIC9, линеаризованными по сайту рестрикции SacI, осуществляется вставка гена в одной из трех областей локуса AOX1 (AOX1 промотора, терминатора транскрипции, либо 3’AOX1). В результате клетки синтезируют алкогольоксидазу I (продукт гена AOX1), обеспечивающую метаболизм метанола в качестве единственного источника углерода, и формируется фенотип His+Mut+. Однако в 535% случаев возможно вытеснение гена AOX1 у His+ трансформантов, тогда формируется фенотип His+Muts (в отсутствии алкогольоксидазы I клетки плохо утилизируют метанол и медленно растут на среде MM). В данном случае для дальнейшего анализа были отобраны колонии, которые с одинаковой интенсивностью росли как на среде с глюкозой, так и на среде с метанолом, т.е. имели фенотип His+Mut+. Клетки штамма KM71 P. pastoris были трансформированы плазмидами pPIC9Rv0040c, pPIC9Rv1860, pPIC9Rv2873, pPIC9Rv2875 также методом электропорации, но высевались только на среду MD, так как в данном штамме возможен только фенотип His+Muts. Для каждого штамма было отобрано по 10 колоний, из которых были выделены хромосомы для проведения генетического анализа. ПЦР анализ выделенных хромосом с 5’AOX1, 3’AOX1 и α-factor праймерами (приложение 1) подтвердил наличие и правильное расположение соответствующих генов в геноме P. pastoris. Секвенирование хромосом «положительных» клонов, отобранных по данным ПЦР, подтвердило соответствие генетических последовательностей вставок генам белков для большинства анализированных колоний. 96 Для экспрессии белков отбирали по одной колонии каждого штамма и растили в среде с глицерином (BMGY) до достижения клетками лог-фазы. Глицерин в составе BMGY (а также глюкоза в составе MD) способствовал депрессии промотора АОХ во время интенсивного роста клеток дрожжей, что препятствовало селекции неэкспрессионных мутантных клонов. Затем клетки переносили в среду с индуктором экспрессии белка, метанолом (BMMY). Для всех штаммов при культивировании поддерживали в среде концентрацию метанола 1% [70]. В состав сред входили калий-фосфатный буфер (рН=6,0), обеспечивающий поддержание оптимального рН среды, а также пептон и дрожжевой экстракт, стабилизирующие белки в среде и уменьшающие протеолиз. В качестве ингибитора внеклеточных протеаз в среду вносили казаминовые кислоты (Becton Dickinson, США) до 1% [231]. При наращивании культуры P. pastoris мы использовали соотношение объемов среды/колбы 1:5-1:7, изолируя среду в колбе от воздуха в качалке двуслойным стерильным марлевым лоскутом, и ежедневно вносили в среду деионизованную воду 10% от объема среды (вычислено по данным ежедневного измерения изменений количества среды в процессе аналитической экспрессии в «малом объеме»). Экспрессия рекомбинантных белков в P. pastoris проводилась в одинаковых условиях: состав сред (в том числе рН буфера (рН=6,0)), интенсивность перемешивания (250 об/мин), температура (30°С), время культивирования (100 часов) были идентичны. Образцы культуры отбирали каждые 24 часа и анализировали в ДСН-электрофорезе и иммуноблоте. ДСН-электрофорез супернатанта и лизата клеток P. pastoris показал, что все рекомбинантные белки секретировались в среду. Концентрации целевых белков в среде определяли по ДСН-электрофорезу. Они составили: рRv0040c - 0,6 г/л, рRv1837c - 0,05 г/л, рRv1860 - 0,8 г/л, рRv2873 - 0,05 г/л, рRv2875 - 0,5 г/л, рRv1636-Rv2185с - 0,1 г/л. 97 Кроме указанных белков, в плазмиду pPIC9 было последовательно клонировано три гена M. tuberculosis (rv3874, rv3875, rv2031c). Плазмида pPIC9Rv3874-Rv3875-Rv2031с была линеаризована ферментом SacI и трансформирована в хромосому P. pastoris штамма КМ71 (генетическая вставка была подтверждена ПЦР и секвенированием хромосомы). Однако в ДСНэлектрофорезе в ПААГ с образцами супернатанта культуры было обнаружено 2 полосы 26 и 28 кДа, что, вероятно, соответствует сумме расчетных молекулярных масс Rv3875 (10 кДа + 2 кДа (1 сайт гликозилирования)) и Rv2031c (16 кДа), а в иммуноблоте соответствующих полос не было обнаружено. В рамках данной работы мы также клонировали ген белка Rv0934 в хромосому P. pastoris как штамма KM71, так и GS115. Секвенирование хромосом полученных штаммов подтвердило правильное расположение гена в хромосоме P. pastoris, а также соответствие нуклеотидной последовательности вставки гену rv0934. Культуру растили как на минимальной среде с глюкозой (BMG), так и на среде с метанолом (BMM). Однако экспрессия белка (при двух вариантах температурного режима - 30°С и 20°С) не была обнаружена, и в иммуноблоте с образцами супернатанта и клеточного лизата культуры отсутствовала полоса около 40 кДа, соответствующая белку Rv0934. Гены двух секретируемых белков, Rv0129с и Rv3803с, были клонированы в плазмиду PIC9, а затем в хромосому P. pastoris без нативных лидерных последовательностей (соответствие гена и правильное расположение в геноме P. pastoris подтверждено секвенированием хромосом). Однако, ни в ДСНэлектрофорезе, ни в иммуноблоте полос, соответствующих данным белкам не было обнаружено. Также отсутствовала, либо была крайне низкой экспрессия белка Rv3425 в P. pastoris. При N-маннозилировании белков в P. pastoris к каждому сайту гликозилирования (аспарагин-X-серин/треонин, где Х-любая аминокислота кроме пролина) присоединяется в среднем от 8 до 14 остатков маннозы, что соответствует примерно 1,4-2,5кДа. 98 В аминокислотных последовательностях изучаемых белков обнаружено 1 (Rv1636, Rv1837с, Rv2873), 2 (Rv2875) или 3 (Rv0040с, Rv1860) сайтов Nгликозилирования, что предполагает увеличение молекулярной массы белков, по сравнению с расчетными данными на 1,4-7,5 кДа. Также в P. pastoris возможно Оманнозилирование белков. Расчетные молекулярные массы белков, полученные исходя из аминокислотного состава, были: рRv0040с (292 аа) – 30,4 кДа, рRv1837c (755 аа) – 82,2 кДа, рRv1860 (300 аа) – 30,5 кДа, рRv2873 (234 аа) – 23,8 кДа, рRv2875 (177 аа) - 18 кДа, рRv1636-Rv2185с (306 аа) – 33,6 кДа. В нашей работе молекулярные массы белков, полученные по данным ДСНэлектрофореза в 10-12% ПААГ, отличаются от расчетных значений. Возрастание молекулярных масс для белков рRv1837c (88 кДа), рRv1636-Rv2185с (36 кДа), рRv2873 (26/52 кДа) и рRv2875 (23 кДа) в электрофорезе на 2-8 кДа, по сравнению с расчетными значениями, можно объяснить гликозилированием данных белков. После высаливания и очистки белка рRv2873 из супернатанта культуры P. pastoris, на ДСН-электрофорезе была обнаружена дополнительная полоса, соответствующая молекулярной массе димера указанного белка (52 кДа). В ДСН-электрофорезе белка рRv1860 была обнаружена полоса около 55 кДа. Полученные данные можно объяснить замедленной миграцией белка в ПААГ, как и в случае аналогичного белка, экспрессированного в E. coli, а также N-маннозилированием 3 сайтов гликозилирования при отсутствии лидерного пептида [176]. Для рRv0040с в ДСН-электрофорезе в 10% ПААГ была обнаружена полоса около 65кДа, вероятно, соответствующая массе димера белка и 6 гликозилированных остатков [198]. Для форсирования и облегчения процесса очистки белка за счет уменьшения объема супернатанта, удаления пептона, солей фосфатного буфера, а также для создания оптимального рН белкового раствора, обеспечивающего связывание белков с сефарозой, белки из супернатанта культуры P. pastoris сначала высаливали сульфатом аммония при насыщении 70%, а затем осадок, содержащий целевые белки, растворяли в буфере нанесения в объеме, 99 соответствующем 2/3 от первоначального объема среды. Очистку белков проводили методом металлхелатной хроматографии. В качестве носителя использовали иминодиуксусную сефарозу, насыщенную ионами никеля. Конечные концентрации белков после очистки и диализа определяли с помощью коэффициентов молярной экстинкции, как описано выше. Коэффициенты экстинкции: ε(рRv0040с) = 20340 М-1см-1, ε(рRv1837c) = 79140 М1 см-1, ε(рRv1860) = 31720 М-1см-1, ε(рRv2873) 6760 = М-1см-1, ε(рRv2875) = 6640 М-1см-1, ε(рRv1636-Rv2185с) = 32430 М-1см-1. Концентрации белков составили: рRv0040c - 0,6 г/л, рRv1837c - 0,2 г/л, рRv1860 – 1,2 г/л, рRv2873 - 0,2 г/л, рRv2875 – 0,8 г/л, рRv1636-Rv2185с - 0,1 г/л. 2. 2. Результаты иммуноферментного анализа (ИФА) В настоящей работе для оценки диагностического потенциала рекомбинантных и синтетических антигенов M. tuberculosis мы использовали твердофазный гетерогенный вышеуказанной методике, непрямой условия ИФА. Анализ проведения выполнялся анализов, реактивы по и оборудование во всех случаях были одинаковыми. В таблице 1 указаны концентрации антигенов в ИФА. Статистический анализ данных ИФА проводился согласно стандартным статистическим методам, описанным в книге С. Гланца «Медико-биологическая статистика» [7], с использованием компьютерных программ MedCalc (MedCalc Software, Бельгия) и Microsoft Office Exel (Microsoft, США). Результаты статистической обработки данных, полученных в ИФА с исследуемыми антигенами, представлены в таблицах 9 и 10. Нормальное распределение данных было выявлено в обеих группах (больных и здоровых) для анализов с белками, экспрессированными в P. pastoris, а также для конъюгированного белка еRv1886c-Rv3875Аr. После логарифмирования данных нормальное распределение было получено в обеих выборках также еще для 4 белков (еRv0040c, еRv0222Аr, еRv2376cАr и еRv3874). Нормальное распределение только в группах здоровых было получено для всех белков, за исключением еRv3425 и еRv3881с. Так как группа больных включает 100 большое число значений (n=100), то согласно центральной предельной теореме распределение значений в данной группе можно считать нормальным. Таким образом, параметрические критерии значимости были рассчитаны для анализов с белками, для которых данные распределены по нормальному закону, то есть со всеми, кроме еRv3425 и еRv3881с. Таблица 9 - Результаты статистического анализа данных ИФА Антигены еRv0040c рRv0040c еRv0222 еRv0222Аr еRv1837с рRv1837с еRv1860 рRv1860 еRv2376c еRv2376cАr рRv2873 еRv2875 еRv2875Аr рRv2875 З X Б З Б З Б З Б З Б З Б З Б З Б З Б З Б З Б З Б З Б З Б З Б 0,451 0,595 0,952 1,272 0,304 0,486 0,56 0,894 0,366 0,554 0,744 1,122 0,399 0,75 0,613 1,084 0,54 0,673 0,627 0,9 0,986 1,129 0,376 0,64 0,496 0,871 0,543 0,96 SD 0,137 0,29 0,177 0,283 0,079 0,235 0,125 0,349 0,093 0,26 0,221 0,332 0,098 0,476 0,196 0,42 0,13 0,235 0,153 0,317 0,217 0,317 0,105 0,372 0,104 0,499 0,14 0,369 Min-Max 0,303-0,751 0,246-1,753 0,664-1,358 0,601-1,86 0,203-0,508 0,2-1,167 0,371-0,814 0,352-1,838 0,252-0,602 0,246-1,7 0,484-1,217 0,508-2,086 0,256-0,632 0,253-2,383 0,43-1,133 0,284-2,054 0,39-0,882 0,372-1,317 0,459-0,983 0,427-1,853 0,45-1,362 0,478-2,135 0,236-0,587 0,241-1,766 0,303-0,701 0,161-2,38 0,355-0,822 0,118-1,909 М tp; Xб-Xз 0,417 0,497 0,937 1,286 0,294 0,431 0,532 0,832 0,343 0,469 0,728 1,104 0,395 0,576 0,596 1,06 0,499 0,601 0,581 0,805 0,986 1,11 0,37 0,497 0,508 0,72 0,51 0,923 (95%ДИ) 2,6в; 0,144 (0,35-0,252) 5,8а ;0,32 (0,211-0,428) 4,1а; 0,182 (0,095-0,268) 5,1а; 0,334 (0,205-0,463) 3,8а;0,187 (0,092-0,284) 5,9а;0,379 (0,251-0,506) 4а; 0,351 (0,178-0,525) 6а; 0,471 (0,314-0,628) 3б; 0,133 (0,044-0,222) 4,5а;0,273 (0,154-0,392) 2,3в ;0,143 (0,02-0,266) 3,8а;0,264 (0,128-0,4) 4а; 0,375 (0,193-0,557) 5,7а; 0,419 (0,274-0,566) Up 1028в 531a 664а 562a 595a 524a 712а 436a 981б 653а 1094в 708а 765a 497a Продолжение таблицы 9 101 Продолжение таблицы 9 Антигены еRv3425 еRv3872 еRv3874 еRv3875 еRv3875Аr еRv3881с еRv3881сАr рRv1636 Rv2185c еRv1886cRv3875 еRv1886cRv3875Аr З X Б З Б З Б З Б З Б З Б З Б З Б З Б З Б З Б 0,335 0,503 0,218 0,368 0,493 0,852 0,188 0,335 0,403 0,817 0,29 0,399 0,429 0,654 0,808 1,174 0,279 0,45 0,42 0,702 SD 0,082 0,225 0,053 0,237 0,116 0,435 0,056 0,232 0,097 0,505 0,069 0,165 0,1 0,224 0,205 0,374 0,089 0,248 0,111 0,287 Min-Max 0,253-0,53 0,245-1,395 0,14-0,384 0,152-1,46 0,303-0,793 0,315-2,412 0,101-0,322 0,112-1,302 0,234-0,689 0,289-2,291 0,223-0,439 0,203-1,004 0,308-0,643 0,378-1,335 0,451-1,271 0,574-2,137 0,185-0,52 0,15-1,46 0,3-0,675 0,321-1,864 М 0,306 0,45 0,206 0,267 0,475 0,744 0,176 0,253 0,387 0,612 0,263 0,346 0,415 0,627 0,804 1,158 0,258 0,417 0,399 0,673 tp ;Xб-Xз Up (95%ДИ) -* 658а 3,4б; 0,15 (0,063-0,236) 4,5а; 0,359 (0,2-0,518) 3,4б; 0,147 (0,062-0,232) 4,5а; 0,413 (0,23-0,597) -* 645а 5,3а; 0,225 (0,142-0,309) 5,4а ;0,366 (0,231-0,5) 3,7а; 0,171 (0,079-0,262) 5,2а; 0,281 (0,175-0,387) 481а 580a 654a 550a 817б 579a 839б 496а Примечания: З - группа здоровых; Б - группа больных туберкулезом; X - выборочное среднее; Xб-Xз – разница выборочных средних; М - медиана; Min –Max - минимальное и максимальное значения; а - р<0,0005; б - р<0,005; в - р<0,05;*- отсутствует нормальное распределение значений в группе здоровых. 95% доверительный интервал (ДИ) разницы истинных средних ни в одном случае не включал ноль, т.е. между группами существовали различия при уровне статистической значимости 0,05. Значения критерия Стьюдента во всех случаях соответствовали вероятности справедливости нулевой гипотезы, p<0,05, следовательно, различия между выборочными средними обеих групп были статистически значимы. Для выявления уровней значимости различий между группами для анализов с белками еRv3425 и еRv3881с, а также для сравнения данных в работе был использован непараметрический тест Манна-Уитни. Во всех случаях значения 102 критерия U соответствовали p<0,05, что свидетельствует о статистической значимости различий между группами. Таким образом, все изученные рекомбинантные белки M. tuberculosis достоверно выявляли туберкулез в ИФА. Для определения силы взаимосвязи между уровнями реактивности сывороток больных туберкулезом против различных антигенов (значений OD450 в ИФА) и клиническими характеристиками пациентов (пол, возраст, диагноз, результаты бактериоскопии мазка мокроты, наличие распада в легочной ткани, рецидива) был использован корреляционный анализ. Прямая достоверная корреляция, соответствующая р < 0,05, была выявлена между наличием диагноза «фиброзно-кавернозный туберкулез легких» и повышенной реактивностью сывороток против eRv3875 (r = 0,19, 95% ДИ = 0,006 - 0,37), eRv1860 (r = 0,19, 95% ДИ = 0,007 - 0,37), еRv3874 (r = 0,36, 95% ДИ = 0,18 - 0,52); рецидивом заболевания и антительным ответом против eRv1860 (r = 0,22, 95% ДИ = 0,03 - 0,39); а также наличием распада легочной ткани и ответом против eRv0040с (r = 0,29, 95% ДИ = 0,1 - 0,46). В таблице 10 приведены результаты статистической обработки данных ИФА с использованием двух вариантов «отсекающих» значений. Наряду с cutoff2, равного сумме среднего OD450 контрольной группы плюс три стандартных отклонения, мы использовали для расчетов также вариант cutoff1, определяемый как среднее OD450здоровых+2SD. Последний вариант «отсекающего» значения сравнительно серодиагностического часто используется потенциала антигенов в литературе M. tuberculosis при в оценке регионах, эндемичных по туберкулезу [119, 146, 149, 179, 239, 241, 253]. На основании специфичность и этих данных диагностическая были рассчитаны достоверность чувствительность, анализов со всеми использованными в работе антигенами. Чувствительность анализов со всеми исследованными антигенами варьировала от 19 до 60% (cutoff1), от 5% до 46% (cutoff2). Наименьшие и наибольшие показатели чувствительности были получены для белков, экспрессированных в P. pastoris, рRv2873 и рRv2875, соответственно. 103 Таблица 10 - Статистические показатели, рассчитанные на основании двух еRv0040c рRv0040c еRv0222 еRv0222Аr еRv1837с рRv1837с еRv1860 рRv1860 еRv2376c еRv2376сАr рRv2873 еRv2875 еRv2875Аr рRv2875 еRv3425 еRv3872 еRv3874 еRv3875 еRv3875Аr еRv3881с еRv3881сАr рRv1636 – Rv2185c еRv1886c Rv3875 еRv1886cRv3875Аr Расчет по cutoff1 (%) Ч,% С,% ДД,% χ² Cutoff2 Антигены Cutoff1 вариантов «отсекающих» значений Расчет по cutoff2 (%) Ч,% С,% ДД,% χ² 86,7 96,7 93,3 96,7 90 96,7 93,3 93,3 90 93,3 100 100 100 100 90 93,3 93,3 96,7 96,7 93,3 90 93,3 40,7 58,5 57,7 62,3 53 56,9 57,7 63,8 44,6 53 37,7 56,2 63 69,2 53,9 50 62,3 50 62,3 51,5 59,2 55,4 1,7г 17а 14,3а 20,7а 9б 15,7а 14,3а 20а 4,2в 10,8б 5,2в 17,3а 23,8а 31а 9,6б 8,7б 18,4а 10,5б 20,7а 9,7б 13,7а 12,5а 19 26 28 42 20 23 38 42 16 21 5 24 43 46 28 31 41 25 39 23 34 23 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 37,6 43 44,6 55,4 38,4 40,7 52,3 55,4 35,4 39,2 26,9 41,5 56,1 58,5 44,6 46,9 54,6 42,3 53 40,7 49,2 40,7 5,2в 8,2б 9,1б 16,7а 5,6в 6,9в 13а 16,7а 4,1в 6в 0,5г 7,3в 17,3а 19,4а 9,1б 10,5б 16а 7,7б 14,9а 6,9в 12а 6,9в 0,457 48 90 57,7 12,5а 0,546 26 100 43 8,2б 0,642 59 90 66,1 20,3а 0,753 42 100 55,4 16,7а 0,725 1,306 0,462 0,81 0,552 1,186 0,595 1,005 0,8 0,933 1,42 0,586 0,704 0,823 0,499 0,324 0,725 0,3 0,597 0,428 0,629 1,218 27 47 47 52 42 45 47 55 31 41 19 43 52 60 43 37 53 36 52 39 50 44 0,862 1,483 0,541 0,935 0,645 1,407 0,693 1,201 0,96 1,086 1,637 0,691 0,808 0,963 0,581 0,377 0,841 0,356 0,694 0,497 0,729 1,423 Примечания: а - р<0,0005; б - р<0,005; в - р<0,05; г - р<0,5; χ² - критерий Пирсона. Специфичность при расчете по cutoff2 во всех случаях составляла 100%, а по cutoff1 колебалась в пределах 86,7-100%. Специфичность 100% по cutoff1 была выявлена для белков еRv2875, рRv2875, еRv2875Ar и рRv2873. 104 Диагностическая достоверность отражает долю истинных результатов из общего объема выборки, а, следовательно, эффективность теста. Значения данного показателя в работе варьировали от 37,7% до 69,2% (cutoff1), от 26,9% до 58,5% (cutoff2). Лучшие значения диагностической достоверности были получены для анализов с белком рRv2875, а худшие - с рRv2873с при обоих вариантах расчета [105, 351]. При оценке статистической значимости различий в частотах между группами был использован критерий χ² с поправкой Йеитса. В большинстве случаев уровень статистической значимости различий оказался низким, p<0,05, что подтверждает значимость различий в частотах между выборками. Однако для анализов с еRv0040c (cutoff1) и рRv2873 (cutoff2), была получена только 0,5% значимость различий, что свидетельствует об отсутствии достоверности различий в частотах между выборками при данных значениях чувствительности и специфичности, то есть о низкой эффективности теста. Результаты ROC анализа представлены в таблице 11. В ROC анализе результаты ИФА были представлены в виде графика, позволяющего визуально (или посредством сопоставления значений показателя ППК для них) оценить эффективность анализов с различными антигенами, сравнить результаты тестов для аналогичных белков, полученных разными способами. Кроме того, в ROC анализе, на основании установленных «оптимальных критериев» («порогов отсечения») были определены значения показателей чувствительности и специфичности для ИФА со всеми антигенами. В таблице 11 указаны «оптимальные критерии» (К), а также соответствующие им индексы Юдена (J) для каждого анализа. Чувствительность анализов, соответствующая «оптимальному критерию», варьировала от 31% (рRv2873) до 69% (еRv1886c Rv3875Аr), специфичность от 70% (еRv0040c) до 100% (еRv2875Аr). Наиболее высокий индекс Юдена был получен для белка рRv2875 (0,613), низкий - для рRv2873 (0,277). Диагностическая достоверность анализов, определенная по данным, соответствующим выбранному критерию К, была от 46,9% (для рRv2873) до 73,8% (для рRv2875). 105 Таблица 11 - Результаты ROC анализа Антигены еRv0040c рRv0040c еRv0222 еRv0222Аr еRv1837с рRv1837с еRv1860 рRv1860 еRv2376c еRv2376cАr рRv2873 еRv2875 еRv2875Аr рRv2875 еRv3425 еRv3872 еRv3874 еRv3875 еRv3875Аr еRv3881с еRv3881сАr рRv1636Rv2185c еRv1886cRv3875 еRv1886cRv3875Аr J К Ч, % С, % χ² ДД, % ОП+/ ОП- ППК 1,93/0,6 6,5/0,39 5,2/0,53 8,85/0,44 4,3/0,63 5,4/0,51 8,1/0,49 5,1/0,37 3,9/0,68 7,35/0,55 9,3/0,71 14,4/0,54 -/0,48 10,2/0,34 2,5/0,53 6/0,64 5,1/0,37 4,7/0,59 16,8/0,46 11,7/0,63 15/0,52 5,6/0,49 0,657 0,823 0,779 0,813 0,802 0,841 0,763 0,855 0,673 0,782 0,635 0,768 0,745 0,832 0,781 0,785 0,807 0,782 0,817 0,728 0,84 0,807 0,28 0,55 0,42 0,523 0,33 0,44 0,47 0,547 0,29 0,423 0,277 0,447 0,52 0,613 0,357 0,333 0,547 0,37 0,527 0,357 0,467 0,46 0,468 1,176 0,414 0,758 0,551 1,052 0,522 0,825 0,655 0,834 1,279 0,523 0,701 0,746 0,408 0,307 0,591 0,256 0,573 0,429 0,629 1,087 58 65 52 59 43 54 54 68 39 49 31 48 52 68 59 40 68 47 56 39 50 56 70 90 90 93,3 90 90 93,3 86,7 90 93,3 96,7 96,7 100 93,3 76,7 93,3 86,7 90 96,7 96,7 96,7 90 6,2в 25,8а 15а 23,3а 9,6б 16,4а 19а 25,7а 7,6в 15,6а 9,6б 17,7а 23,9а 32,5а 10,4б 10 б 25,7а 11,8б 23,1а 12,2а 19,2а 17,9а 0,413 0,368 58 83,3 14,2а 63,8 3,48/0,5 0,721 0,49 0,518 69 80 20,7а 71,5 3,45/0,39 0,836 60,7 70,7 60,7 66,9 54,6 62,3 63 72,3 50,8 59,2 46,9 59,2 63 73,8 62,3 53 72,3 57 65,4 52,3 60,7 63,8 Примечания: а -р<0,0005; б - р<0,005; в - р<0,05; J - индекс Юдена; К (критерий) - оптимальное «отсекающее» значение в ROC анализе. С помощью таблиц сопряженности 2х2 определялись значения критериев χ² с поправкой Йеитса для результатов анализов со всеми белками. Полученные значения критерия во всех случаях соответствовали р<0,05, что подтверждает значимость различий в частотах между двумя группами. 106 Кроме того, в ROC анализе были определены показатели отношения правдоподобия для соответствующих выбранных значений чувствительности и специфичности. Значения ОП+ были > 1,93, а ОП- < 0,71, что свидетельствует об эффективности тестов при выбранных показателях. С помощью ROC анализа были вычислены значения ППК. Наиболее высокое значение ППК было для ROC-кривой, построенной на основании данных анализа с белком рRv1860 (0,855), низкое - с рRv2873 (0,635). Таким образом, наибольшей диагностической точностью среди всех анализов обладал тест с белком рRv1860. 2. 2. 1. Результаты ИФА с белками M. tuberculosis, экспрессированными в системе E. coli В нашей работе мы использовали 12 рекомбинантных белков M. tuberculosis (еRv0040с, еRv0222, еRv1837c, еRv1860, еRv2376с, еRv2875, еRv3425, еRv3872, еRv3874, еRv3875, еRv3881с, еRv1886c-Rv3875), полученных в системе E.coli, в ИФА с сыворотками больных туберкулезом легких и здоровых жителей Саратовской области. Данные, полученные в ИФА, представлены в виде точечной диаграммы на рисунке 7 (А, Б). Показатели чувствительности для анализов с белками, экспрессированными в E.coli, варьировали от 27% до 53% при расчете по cutoff1 и от 16% до 41% cutoff2. В обоих случаях наибольшие показатели чувствительности были получены для белка еRv3874. Также высокие значения чувствительности для cutoff1 были получены для белков еRv1860 (47%), еRv0222 (47%) и слитого белка еRv1886c-Rv3875 (48%). Специфичность анализов с данными белками составила 90-93,3%. Однако при расчете статистических показателей по cutoff2 значения чувствительности для анализов с последними двумя белками (28% и 26%, соответственно) оказались существенно ниже значений для анализов с еRv1860 (38%) и еRv3874 (41%). 107 Рисунок 7 (А, Б) - Точечная диаграмма результатов ИФА с антигенами M. tuberculosis, полученными в экспрессионной системе E.coli, и их конъюгатами с гексаарабинофуранозидом ЛАМ. Примечания: красной чертой обозначены значения cutoff1, синей – выборочные средние для групп. 108 Наиболее низкие значения чувствительности анализов были получены с белками еRv0040c и еRv2376c (27% и 31% - cutoff1, 19% и 16% - cutoff2, соответственно). При расчете специфичностей анализов на основании cutoff2 значение показателя 100% было получено во всех случаях, а на основании cutoff1 - только для еRv2875. Диагностическая достоверность была минимальна для анализов с белками еRv0040с (40,7%) при расчете по cutoff1 и с еRv2376с (35,4%) - cutoff2, а максимальна - для еRv3874 при обоих вариантах расчета (62,3% и 54,6%, соответственно). Чувствительность анализа с еRv1886c-Rv3875 оказалась на 13% выше (cutoff1), чем для еRv3875, однако, снижение специфичности (на 6,7%) для анализа со слитым белком обусловило незначительный прирост в его диагностической достоверности, по сравнению с еRv3875 (на 7,7%). Кривые ROC представлены на рисунке 8 (А, Б, В). В ROC анализе чувствительность ИФА с белками, экспрессированными в E.coli, была от 39% (еRv2376с, еRv3881c) до 68% (еRv3874), специфичность от 70% (еRv0040c) до 100% (еRv2875). Диагностическая достоверность анализов, определенная по данным, соответствующим выбранному критерию, была от 50,3% (для еRv2376c) до 72,3% (для еRv3874). В ROC анализе значение ОП+ для ИФА с еRv0040с составило 1,93, что говорит о том, что вероятность истинно положительного результата выше вероятности ложноположительного результата менее чем в два раза, то есть эффективность теста с данным белком мала. Наибольшее значение ППК среди рекомбинантных неконъюгированных белков было получено для еRv3874 (0,807), наименьшее - для еRv0040с (0,657). Значение ППК для анализа еRv1886c-Rv3875 оказалось ниже, чем для еRv3875, что говорит о меньшей диагностической точности анализа со химерным белком, по сравнению с еRv3875. 109 Рисунок 8 (А, Б, В) – ROC - кривые для анализов с белками M. tuberculosis, полученными в системе E.coli, и их конъюгатами с гексаарабинофуранозидом ЛАМ. Примечание: в скобках указаны значения ППК. 110 2. 2. 2. Результаты ИФА с конъюгатами белков M. tuberculosis, полученных в системе E. coli, с синтетическим гексаарабинофуранозидом ЛАМ В данной работе в ИФА было использовано 6 химических конъюгатов рекомбинантных белков M. tuberculosis с синтетическим гексаарабинофуранозидом ЛАМ (еRv0222Аr, еRv2376сАr, еRv2875Аr, еRv3875Аr, еRv3881сАr, еRv1886c-Rv3875Аr). Результаты ИФА представлены на рисунке 7 (А, Б). Наименьшие показатели чувствительности для анализов с конъюгированными белками были получены согласно расчетам по cutoff1 и cutoff2 для белка еRv2376сАr (41% и 21%, соответственно), а наибольшие - для еRv1886c-Rv3875Аr (59%) и еRv2875Аr (43%), соответственно. Специфичность анализов составляла от 90% (еRv1886c-Rv3875Аr) до 100% (еRv2875Аr) (cutoff1) и 100% (cutoff1) во всех случаях. Диагностическая достоверность была максимальна для анализов с белком еRv1886c-Rv3875Ar (66,1%) при расчете по cutoff1 и с еRv2875Ar (56,1%) - cutoff2, а минимальна для еRv2376сAr при обоих вариантах расчета (53% и 39,2%, соответственно). Результаты ROC анализа представлены на рисунке 8 (А, Б, В). По результатам ROC анализа значения показателей чувствительности для тестов с конъюгатами варьировали от 49% (еRv2376сAr) до 69% (еRv1886cRv3875Ar), специфичности от 80% (еRv1886c-Rv3875Ar) до 100% (еRv2875Ar) и диагностической достоверности от 59,2% (еRv2376сAr) до 71,5% еRv1886cRv3875Ar. Наибольшее значение ППК среди анализов с конъюгированными белками было получено для теста с еRv3881сAr (0,84), наименьшее – с еRv2875Ar (0,745). Значение ППК для еRv1886c-Rv3875Ar (0,836) было выше, чем для еRv3875Ar (0,817). Прирост диагностической достоверности для еRv1886c-Rv3875Аr, по сравнению с еRv3875Аr, в связи со снижением специфичности для слитого белка, был незначительный (на 2,4-6,1% по всем вариантам расчета). 111 2. 2. 3. Результаты ИФА с белками M. tuberculosis, экспрессированными в системе P. pastoris В данной работе 6 рекомбинантных белков M. tuberculosis (рRv0040с, рRv1837c, рRv1860, рRv2875, рRv2873, рRv1636-Rv2185с), экспрессированных в системе P. pastoris, были использованы в ИФА с сыворотками больных туберкулезом и здоровых жителей Саратовской области. Данные, полученные в ИФА для рекомбинантных белков M. tuberculosis, представлены на рисунке 9. Как при расчетах статистических показателей по cutoff1 и cutoff2, так и в ROC анализе наибольшие значения чувствительности (60%, 46% и 68%) и диагностической достоверности (69,2%, 58,5% и 73,8%) были получены в тесте с белком рRv2875, а наименьшие - с рRv2873 (чувствительность - 19%, 5% и 31%, диагностическая достоверность – 37,7%, 26,9% и 46,9%, соответственно). Специфичность анализов с белками, полученными в дрожжевой системе, при расчете по cutoff составляла 93,3 - 100%, а в ROC анализе - 86,7 - 96,7%. В ROC анализе одни из лучших значений чувствительности и диагностической достоверности были получены также для анализов с рRv0040с (65% и 70,7%), рRv1860 (68% и 72,3%, соответственно). Чувствительность теста с рRv2873 в ROC анализе оказалась значительно выше (31%), чем при расчетах по cutoff (19% и 5%), при этом значение «оптимального критерия», полученного в данном анализе, соответствовало среднему OD450здоровых+1,35SD, а значение ОП+ было близко ложноположительного использование к 10, что результата рRv2873 в свидетельствует в составе тестах с о низкой рRv2873. мультиантигенного вероятности Таким коктейля образом, может способствовать повышению чувствительности серодиагностического теста без снижения специфичности. Значения показателей ОП+ (10,2) и ОП- (0,34), полученные для анализов с белком рRv2875, указывают на возможную высокую достоверность тестов ИФА с данным белком в качестве антигена. На рисунке 10 (А, Б) представлены ROC-кривые и указаны соответствующие значения ППК для анализов с антигенами, полученными в P. pastoris. Наиболее высокое значение 112 ППК было получено для ROC-кривой, построенной на основании данных анализа с белком рRv1860 (0,855), наименьшее – с рRv2873 (0,635). Рисунок 9 - Точечная диаграмма результатов ИФА с антигенами M. tuberculosis, полученными в разных экспрессионных системах. Примечания: красной чертой обозначены значения cutoff1, синей – выборочные средние для анализа с одним антигеном. 2. 3. Сравнение диагностического потенциала рекомбинантных и синтетических антигенов M. tuberculosis В настоящей работе методом ИФА оценивался диагностический потенциал 24 рекомбинантных и синтетических антигенов M. tuberculosis. Благодаря использованию в ИФА аналогичных антигенов M. tuberculosis, полученных тремя «способами», и одного набора сывороток мы смогли сравнить преимущества 113 разных вариантов белков для целей серодиагностики и определить наиболее оптимальный из них в каждом случае. Рисунок 10 (А, Б) - ROC - кривые для анализов с белками M. tuberculosis, полученными в разных экспрессионных системах. Примечания: в скобках указаны значения ППК. Статистический анализ данных ИФА проводили с использованием трех методов расчетов показателей эффективности применения антигенов в серодиагностике: с учетом двух вариантов «отсекающих значений» для эндемичных (cutoff1) и неэндемичных (cutoff2) по туберкулезу регионов, а также по ROC-кривым. Все указанные варианты анализа результатов ИФА используются в литературе для оценки серодиагностического потенциала антигенов M. tuberculosis [119, 146, 149, 179, 239, 241, 253]. На рисунке 11 представлена диаграмма распределения значений диагностической достоверности анализов со всеми антигенами, вычисленных разными методами статистического анализа. В следующих подглавах будут изложены результаты сравнения данных, полученных в ИФА. 114 Рисунок 11 - Диаграмма значений диагностической достоверности ИФА с антигенами M. tuberculosis, рассчитанных разными методами статистического анализа 115 2. 3. 1. M. tuberculosis, Сравнение результатов полученных в применения и E. coli, в их ИФА белков конъюгатов с гексаарабинофуранозидом ЛАМ В данной работе было проведено сравнение результатов ИФА с 6 белками M. tuberculosis (еRv0222, еRv2376с, еRv2875, еRv3875, еRv3881с, еRv1886cRv3875), экспрессированными в E. coli, и химическими конъюгатами данных белков с гексаарабинофуранозидным фрагментом ЛАМ (еRv0222Аr, еRv2376сАr, еRv2875Аr, еRv3875Аr, еRv3881сАr, еRv1886c-Rv3875Аr). Парное сравнение результатов статистического анализа данных ИФА выявило возрастание значений показателей чувствительности (в среднем на 10,3% (5-16%) - при расчете по cutoff1, и на 13,2% (5-19%) –cutoff2) и диагностической достоверности (в среднем на 8% (4,6-11,5%) - cutoff1, и на 10,1% (3,8-14,6%) – cutoff2) анализов с конъюгатами относительно неконъюгированных форм вышеуказанных белков. Наибольший прирост значений данных показателей наблюдался для анализов с белками еRv3875Аr (cutoff1) и еRv2875Аr (cutoff2). Специфичность анализов с конъюгатами, как правило, оставалась в пределах ± 3,3%, по сравнению с показателями для неконъюгированных белков. Химическая конъюгация белков еRv3875 и еRv1886с-Rv3875 позволила повысить чувствительность анализа на 16% (cutoff1и cutoff2) и 11% (cutoff1, или 14% cutoff2), соответственно, без снижения специфичности. На рисунке 12 представлено схематическое изображение данных, полученных в ИФА как с рекомбинантными белками M. tuberculosis, так и с их конъюгатами с одной панелью сывороток больных туберкулезом. В ROC анализе также отмечалось увеличение чувствительности (в среднем на 8,7% (4-11%)) и диагностической достоверности (в среднем на 7,2% (3,8-8,4%)) анализов для конъюгированных белков. Для белков еRv3875Аr и еRv1886сRv3875Аr прирост неконъюгированной показателей формой, чувствительности, составил 9% достоверности – на 8,4% и 7,7%, соответственно. и по 11%, сравнению а с их диагностической 116 . Рисунок 12 - Лепестковая диаграмма сравнения данных ИФА с рекомбинантными белками M. tuberculosis, полученными в системе E. coli, и их конъюгатами. Примечания: окружностями красного цвета обозначены границы cutoff1 для анализов с рекомбинантными белками (внутренний круг) и их конъюгатами (внешний круг) белками. 117 Возрастание ППК наблюдалось в большинстве случаев (на 0,034-0,115), однако, для белка Rv2875Аr было выявлено незначительное снижение значения данного показателя (на 0,023). По результатам статистического анализа данных можно заключить, что в большинстве случаев химическая конъюгация рекомбинантных белков M. tuberculosis, экспрессированных в E. coli, с фрагментом ЛАМ обеспечила повышение эффективности выявления туберкулеза. 2. 3. 2. Сравнение результатов применения в ИФА аналогичных рекомбинантных белков M. tuberculosis, полученных в разных экспрессионных системах Четыре рекомбинантных белка M. tuberculosis (Rv0040с, Rv1837с, Rv1860, Rv2875), полученные как в экспрессионной системе E. coli, так и P. pastoris, были использованы в качестве антигенов в ИФА с сыворотками больных туберкулезом и здоровых пациентов. Сравнение результатов ИФА с указанными антигенами выявило повышение значений чувствительности (в среднем на 12% (3-20%) - при расчете по cutoff1, и на 9% (3-22%) –cutoff2) и диагностической достоверности (в среднем на 10,2% (4-17,8%) - cutoff1, 6,95% (2,3-17%) – cutoff2) у белков, полученных в дрожжевой системе, по сравнению с белками, экспрессированными E. coli. Специфичность оставалась, как правило, неизменной, а в случае анализа с рRv0040с она оказалась выше на 10%, чем в анализе с еRv0040с. На рисунке 13 представлено схематическое изображение данных, полученных в ИФА с белками, экспрессированными как в E. coli, так и в P. pastoris с одной панелью сывороток больных туберкулезом. ROC анализ также показал возрастание значений чувствительности (в среднем на 9% (4-14%)) и диагностической достоверности (в среднем на 10,4% (7,7-14,6%)) для рекомбинантных белков, экспрессированных в P. pastoris, по сравнению с белками, экспрессированными в E. coli. Значение ППК для ROCкривых в случае белков, полученных в P. pastoris, было выше (на 0,039 - 0,166), чем для аналогичных белков, полученных в системе E. coli. 118 Рисунок 13 - Лепестковая диаграмма сравнения данных ИФА с белками M. tuberculosis, полученными в разных экспрессионных системах. Примечания: внутренний круг обозначает cutoff1 для анализов с белками, экспрессированными в системе E. coli, внешний – в системе P. pastoris, по кругу указаны номера сывороток, на вертикальной оси отложены соответствующие значения OD450. Для рRv0040с значение ППК оказалось на 0,166 пунктов выше, чем для еRv0040с, что может свидетельствовать о более высокой дифференцирующей способности анализа с рекомбинантным белком, полученным в дрожжевой системе. 119 По результатам статистического анализа данных можно заключить, что в ряде случаев рекомбинантные белки M. tuberculosis, экспрессированные в системе P. pastoris, могут быть более эффективны в серодиагностике туберкулеза, чем аналогичные белки, экспрессированные в системе E. coli. 2. 3. 3. Сравнение результатов применения в ИФА трех вариантов одного белка M. tuberculosis, полученного разными методами Белок M. tuberculosis Rv2875 был получен в двух экспрессионных системах (E. coli - еRv2875 и P. pastoris - рRv2875), а также был создан конъюгат белка еRv2875 с гексаарабинофуранозидом ЛАМ (еRv2875Ar). Чувствительность ИФА с белком рRv2875, экпрессированным в P. pastoris, оказалась на 17% и 22% (cutoff1 и cutoff2, соответственно) выше, чем для аналогичного белка, полученного в E. coli. Химическая конъюгация белка еRv2875 с Araf6 ЛАМ, позволила повысить чувствительность анализа на 9% и 19%, соответственно. Учитывая отличия в наборе сывороток, которые реагировали в ИФА с различными вариантами антигена Rv2875, можно предположить, что конъюгация белка рRv2875 с Araf6 ЛАМ могла бы способствовать дополнительному повышению чувствительности анализа с указанным белком (по расчетам до 76% (cutoff1) и 64% (cutoff2)). В ROC анализе было выявлено повышение показателей эффективности (чувствительности на 20%, диагностической достоверности на 14,6%) для теста с рRv2875, по сравнению с еRv2875, а также низкий ОП- (0,34), который указывает на минимальную вероятность ложноотрицательных результатов для анализа с рRv2875. Кроме того, значение показателя ППК для анализа с белком, полученным в дрожжевой системе, было на 8,3% выше, чем для еRv2875. В анализе с белком Rv2875Ar еRv2875, был слабо прирост значений показателей, по сравнению с выражен (повышение чувствительности на 4%, диагностической достоверности на 3,8%, а специфичности на 3,3%), а значение ППК оказалось даже ниже значения для еRv2875. Одним из объяснений снижения ППК может служить повышение уровня неспецифического связывания сывороток здоровых людей после конъюгирования антигена с фрагментом ЛАМ. 120 2. 4. Определение расчетных показателей эффективности мультиантигенных композиций, включающих антигены M. tuberculosis, использованные в работе Гуморальный ответ во время туберкулезной инфекции направлен против многих антигенов M. tuberculosis, однако, в зависимости от стадии, формы туберкулеза и иммуногенетических особенностей организма каждый пациент имеет индивидуальный профиль антимикобактериальных антител [191]. В нашей работе мы также выявили наличие индивидуальной гетерогенности при распознавании сыворотками больных туберкулезом разных антигенов M. tuberculosis. На рисунке 14 представлено графическое изображение различий в реактивности сывороток больных туберкулезом с разными антигенами M. tuberculosis. Из рисунка видно, что во всех сыворотках больных туберкулезом определялись диагностически значимые титры антимикобактериальных антител к тем или иным антигенам M. tuberculosis, использованным в ИФА. При расчете статистических показателей по cutoff1 все 100 сывороток реагировали в ИФА с тем или иным антигеном, 3 из них - со всеми 24 антигенам, а 4 сыворотки содержали антитела только к одному антигену (еRv0222Ar, еRv3874, еRv3875Ar или еRv1886c-Rv3875Ar). Сыворотки, содержащие антитела ко всем исследуемым антигенам, принадлежали донорам с диагнозом «инфильтративный туберкулез легких в фазе распада». Можно предположить, что повышенная внеклеточная репликация M. tuberculosis, наблюдаемая исследователями в очагах распада тканей легких при туберкулезе, ассоциирована с увеличением секреции микобактериальных антигенов, и, следовательно, более высокому титру специфических антител [258]. Сыворотки, в которых определялись антитела только к одному антигену, принадлежали вновь выявленным больным с диагнозом «инфильтративный туберкулез легких» без признаков распада и отрицательными результатами бактериоскопии мазка мокроты и культурального исследования. Возможно, у данных пациентов заболевание протекало на начальных стадиях, поэтому были выявлены антитела именно к ранним 121 секретируемым белкам M. tuberculosis, Rv3874 и Rv3875 (последний белок также входил в состав слитого белка еRv1886c-Rv3875). Рисунок 14 - Гетерогенность распознавания антигенов M. tuberculosis сыворотками больных туберкулезом. Примечания: красным обозначены ячейки с OD450 ≥ cutoff2, оранжевым - с OD450 ≥ cutoff1, но < cutoff2, не окрашены ячейки со значением OD450 < cutoff1. При расчете по cutoff2 у 96% сывороток выявлялись антитела хотя бы к одному антигену, ни одна сыворотка не содержала антитела ко всем антигенам и 8 сывороток реагировали только с одним антигеном (рRv0040с, еRv0222Ar, рRv2875, еRv3425, еRv3872, еRv3874 (две сыворотки) или еRv3875Ar). Несмотря на то, что в 100% сывороток (при расчете по cutoff1, или 96% - по cutoff2) присутствовали антитела к тем или иным антигенам, использованным в работе, ни один из 24 анализов не позволил с помощью только одного антигена 122 выявить более 60% больных (по cutoff1 или 46% - по cutoff2). Комбинация из нескольких антигенов в одном серодиагностическом тесте может позволить компенсировать отсутствие антител к одному из антигенов в коктейле наличием антител к другому антигену, и тем самым повысить общую чувствительность анализа, по сравнению с анализом с одним антигеном. В данной работе расчетным путем были определены предполагаемые значения общей чувствительности анализов с двумя антигенами из числа исследованных. Для расчета эффективности антигенных коктейлей из нескольких вариантов аналогичных белков, полученных разными способами, были выбраны антигены, обладающие лучшими показателями диагностической достоверности. Например, из трех аналогичных белков еRv2875, еRv2875Ar, рRv2875 для расчета антигенного коктейля был выбран рRv2875. В таблице 12 представлены расчетные данные суммарной чувствительности ИФА с двумя антигенами. Большинство максимальных значений общей чувствительности было получено в сочетании с белком рRv2875 (74-85%). Из 14 отобранных антигенов лучшие показатели суммарной чувствительности (более 80%) были получены для 8 пар антигенов. Наиболее высокое значение чувствительности было получено для пары еRv3875Ar + рRv2875 (85%), при этом суммарная специфичность данного коктейля составила 96,7%, и показатель его диагностической достоверности был также самый высокий (87,7%) среди других вариантов (таблица 12). По данным литературы, антигенные коктейли, применяемые для серодиагностики туберкулеза, включают, как правило, более двух антигенов [136, 139, 145, 149, 165, 241, 338, 349]. На основании данных, представленных в рисунке 14, нами были определены наиболее эффективные варианты антигенных использованных в коктейлей работе. из Вычисление трех антигенов показателей M. tuberculosis, чувствительности и специфичности для трехантигенного коктейля, как и для коктейля, содержащего два антигена (таблица 13) производилось на основании данных расчетов по cutoff1. 123 Таблица 12 - Расчетная чувствительность серодиагностического теста с двумя антигенами M. tuberculosis еRv0222Ar рRv1837c рRv1860 еRv2376cAr рRv2873 рRv2875 еRv3425 еRv3872 еRv3874 еRv3875Ar еRv3881cAr рRv1636-Rv2185c еRv1886c-Rv3875Ar рRv0040c еRv0222Ar рRv1837c рRv1860 еRv2376сAr рRv2873 рRv2875 еRv3425 еRv3872 еRv3874 еRv3875Ar еRv3881сAr рRv1636Rv2185с еRv1886cRv3875Ar рRv0040c Антигены 47 75 57 66 70 50 67 69 69 72 74 76 56 75 52 73 78 69 59 78 70 66 80 69 70 71 57 73 45 59 66 49 63 68 65 72 73 76 53 66 78 59 55 71 58 68 74 70 74 78 79 61 70 69 66 71 41 56 74 56 53 68 68 58 68 50 59 49 58 56 19 62 57 49 63 63 62 48 67 78 63 68 74 62 60 78 76 80 85 83 64 69 70 68 74 56 57 78 43 55 63 71 59 67 69 66 65 70 53 49 76 55 37 64 66 58 66 72 80 72 74 68 63 80 63 64 53 74 71 70 74 69 73 78 68 63 85 71 66 74 52 72 73 76 70 76 79 58 62 83 59 68 71 72 50 76 56 71 53 61 68 48 64 67 66 70 73 76 44 82 73 80 82 64 69 84 66 65 77 65 78 82 73 80 82 64 69 84 66 65 77 - 65 78 59 Примечания: данные указаны в процентах, курсивом обозначены значения чувствительности для анализа с одним антигеном, максимальные значения в ряду подчеркнуты, значения более 80% выделены жирным шрифтом. Наиболее высокие значения показателей чувствительности (92%) были получены для сочетания антигенов рRv2875 + еRv3875Ar с еRv3874 или с еRv3425. Однако специфичность анализа для последнего варианта коктейля (90%) была ниже, чем для первого (93,3%). Таким образом, наиболее высокой диагностической достоверностью (92,3%), а значит и эффективностью в серодиагностике туберкулеза может обладать тест, основанный на сочетании трех антигенов: рRv2875, еRv3875Ar и еRv3874. 124 Таблица 13 - Расчетная эффективность применения различных мультиантигенных композиций в серодиагностике туберкулеза Мультиантигенная композиция Чувстви- Специ- ДД тельность фичность рRv2875 + еRv3874+ еRv3875Ar 92% 93,3% 92,3% рRv2875 + еRv3425+ еRv3875Ar 92% 90% 91,5% еRv0222Ar + рRv2875 + еRv3874 91% 93,3% 91,5% рRv2875 + еRv3875Ar + еRv3881сAr 91% 90% 90,8% рRv2875+ еRv3874+ еRv1886c-Rv3875Ar 91% 90% 90,8% рRv2875 + еRv3872+ еRv3875Ar 90% 93,3% 90,8% еRv0222Ar +рRv1860+ еRv3874 89% 93,3% 90% рRv0040с + рRv2875 + еRv3875Ar 88% 96,7% 90% еRv2376сAr + рRv2875+ еRv3875Ar 88% 93,3% 89,2% еRv0222Ar + рRv1837с+е Rv3874 88% 93,3% 89,2% еRv2875Ar + еRv3874+ еRv1886c-Rv3875Ar 88% 90% 88,5% рRv2873 + рRv2875 + еRv3875Ar 86% 96,7% 88,5% еRv2875Ar +еRv3874 + еRv0222Ar 85% 93,3% 86,9% еRv0222Ar + еRv3874 + еRv1886c-Rv3875Ar 85% 90% 86,1% еRv0222Ar + еRv3874 + еRv1837с 82% 90% 83,8% еRv0222Ar +еRv3874 + еRv1860 81% 93,3% 83,8% еRv2875Ar + еRv3874 + еRv3875Ar 81% 93,3% 83,8% еRv0222Ar + еRv3874 + еRv1860 81% 93,3% 83,8% еRv2875Ar+еRv0222Ar+еRv1886c-Rv3875Ar 79% 90% 81,5% еRv2875 Ar + еRv3425+ еRv3875Ar 79% 90% 81,5% еRv2875 Ar + еRv3875Ar + еRv3881сAr 77% 90% 80% еRv2875Ar + еRv0222Ar+еRv1860 76% 93,3% 80% еRv2376сAr + еRv2875Ar + еRv3875Ar 75% 93,3% 79,2% еRv2875Ar + еRv3872 + еRv3875Ar 73% 93,3% 77,7% 125 ЗАКЛЮЧЕНИЕ Около одной трети населения планеты инфицировано M. tuberculosis. Риск активации туберкулеза у данных лиц в течение первых 5 лет после заражения составляет 5%. Кроме того, этот показатель существенно возрастает при наличии у таких людей сопутствующей патологии, прежде всего иммунодефицитов. Высокие темпы распространения ВИЧ-инфекции и штаммов M. tuberculosis с МЛУ создают в России предпосылки для ухудшения эпидемиологической ситуации по туберкулезу. Решающее значение в борьбе с туберкулезом имеет ранняя достоверная диагностика заболевания, способствующая снижению риска передачи инфекции восприимчивым лицам [23, 25, 51, 217, 302, 335]. Стандартные методы диагностики туберкулеза имеют ряд недостатков, например, таких, как низкая чувствительность микроскопии мазка мокроты у олигобациллярных больных, длительный период роста культуры M. tuberculosis при посеве на твердые питательные среды, неспецифичность рентгенографии, высокая стоимость молекулярных методов детекции микобактерий и ложноположительные реакции при туберкулинодиагностике [51]. К преимуществам серодиагностических тест-систем, детектирующих специфические антитела против антигенов M. tuberculosis, можно отнести их простоту, воспроизводимость, малую инвазивность, возможность выявления заболевания вне зависимости от локализации очага и распространенности инфекции, а также доступность для стран с низким уровнем жизни населения. Однако для утверждения серодиагностики в качестве стандарта необходимо значительное повышение чувствительности и специфичности существующих серодиагностических тестов [15, 108, 334]. Учитывая актуальность проблемы туберкулеза в нашей стране и необходимость повышения выявляемости заболевания на ранних этапах диагностического поиска, нами была поставлена задача - оценить возможности применения серодиагностики для скрининга туберкулеза в одном из регионов РФ. С целью реализации поставленной задачи мы применили метод ИФА для 126 определения уровней антительного ответа против 24 рекомбинантных и синтетических антигенов M. tuberculosis у больных туберкулезом и здоровых жителей Саратовской области. Статистическая обработка данных ИФА позволила сравнить показатели эффективности анализов с различными антигенами M. tuberculosis, в том числе с аналогичными антигенами, полученными разными методами, и выявить потенциальные серомаркеры активного туберкулеза. На первом этапе выполнения работы, на основании данных, полученных из научной литературы, нами был очерчен круг антигенов, имеющих перспективы для применения в серодиагностике туберкулеза. Обоснованием выбора антигенов служило соответствие их характеристик заявленным критериям, таким как: специфичность антигена для возбудителя туберкулеза, достоверно более высокая реактивность сывороток больных туберкулезом с выбранными антигенами при активном, чем при латентном туберкулезном процессе, отсутствие ложноположительных реакций на исследуемые антигены у здоровых БЦЖвакцинированных антигенов для людей, доказанная серодиагностики эффективность туберкулеза в применения регионах с данных высокой инфицированностью населения M. tuberculosis, а также у различных категорий больных, в том числе при сочетании туберкулеза с ВИЧ-инфекцией. В список антигенов M. tuberculosis, выбранных нами для получения и дальнейшего использования в ИФА, входили как белки, так и гликолипид ЛАМ (а именно его гексаарабинофуранозидный фрагмент). Среди отобранных нами белков были антигены (Rv3872, Rv3874, Rv3875), кодируемые генами «RD1 региона», отсутствующего в геномах M. bovis BCG и многих нетуберкулезных микобактерий. Серодиагностика туберкулеза, основанная на определении антител против «RD1 белков», может обладать высокой специфичностью в связи с отсутствием у здоровых БЦЖ- вакцинированных людей перекрестной реакции на указанные антигены [63]. Выбранные для исследования антигены относились, главным образом, к группе секретируемых белков M. tuberculosis (Rv0040с, Rv0129с, Rv1837с Rv1860, Rv1886с, Rv2376с, Rv2875, Rv3803с, Rv3872, Rv3874, Rv3875, Rv3881с), которые 127 наиболее доступны для клеток иммунной системы и, вероятно, раньше других вызывают антительный ответ в организме больного активным туберкулезом [99, 150, 176, 198]. Меньшее количество антигенов принадлежало к группам мембранных (Rv0934, Rv2873) и внутриклеточных белков M. tuberculosis (Rv0222, Rv1636, Rv2185с, Rv2031с, Rv3425). В научной литературе для всех указанных выше антигенов M. tuberculosis были представлены доказательства их иммунодоминантности в гуморальном иммунитете при активном туберкулезе [67, 133, 138, 191, 250, 325, 344, 345]. Разными авторами было показано, что серодиагностика туберкулеза, основанная на выявлении антител против некоторых из выбранных нами антигенов M. tuberculosis (например, Rv0934, Rv1636, Rv1837с, Rv2185с) эффективна в случаях (таких как олигобациллярный легочный, внелегочный и сочетанный с ВИЧ-инфекцией туберкулез), когда традиционная диагностика туберкулеза малоинформативна [67, 133, 191, 258, 309, 325]. Использование указанных белков может определять преимущества серодиагностики перед другими методами диагностики. Важным этапом выполнения работы являлся выбор способа получения антигенов M. tuberculosis для дальнейшего использования в ИФА. Несмотря на высокую чувствительность серотестов, основанных на нативных антигенах, выделенных из культуры микобактерий, получение данных препаратов для целей серодиагностики не представляется целесообразным в связи с длительностью и сложностью культивирования M. tuberculosis [241, 257, 259]. В связи с этим для получения антигенов M. tuberculosis было решено использовать рекомбинантные экспрессионные системы или химический синтез. Преимуществами экспрессионной системы E. coli являются ее относительная простота, коммерческая доступность, быстрый рост культуры и потенциально высокие уровни экспрессии рекомбинантных белков [52, 345]. В данной работе экспрессионная система E. coli была использована нами для получения 8 рекомбинантных белков M. tuberculosis (еRv0222, еRv1837c, 128 еRv1860, еRv2875, еRv3425, еRv3872, еRv3875, еRv1886с-Rv3875), в том числе одного химерного белка. Экспрессия белков проводилась в штамме E. coli BL21CodonPlus(DE3)-RP под индукцией ИПТГ и селективным давлением антибиотиков. Все белки экспрессировались в тельцах включения и, благодаря наличию в структуре белков полигистидиновых тагов, внесенных в кодирующие последовательности белков методом генетической инженерии, были очищены из лизатов культуры E. coli металлхелатной хроматографией в денатурирующих условиях. При анализе полученных рекомбинантных белков в ДСН-электрофорезе в 10-12% ПААГ для еRv1860 (45/47кДа комплекс) была обнаружена аномально замедленная миграция (кажущаяся молекулярная масса белка была 45/52 кДа при расчетных значениях 33,5 кДа). Аналогичные результаты были получены и другими авторами как для нативного, так и рекомбинантного Rv1860. Подобное аберрантное миграционное поведение объясняется присутствием в полипептидной цепи белка ригидных терминальных участков, богатых пролином [92, 176, 198]. Низкая электрофоретическая подвижность наблюдалась в исследованиях как для 45кДа, так и для 47кДа (гликозилированной) форм белка Rv1860, полученного в Streptomyces lividans, что, таким образом, опровергало мнение об участии посттрансляционных модификаций, таких как гликозилирование, в данном феномене [176]. Незрелые белки Rv2875, Rv1860, Rv0040с в M. tuberculosis содержат сигнальные пептиды, которые отщепляются специфическими протеазами при процессинге белка. Кодирующие последовательности сигнальных пептидов данных белков при клонировании их в E. coli, в отличие от получения в P. pastoris, не удалялись. Сопоставляя расчетные размеры сигнальных пептидов и различия в молекулярных массах белков на ДСН-электрофорезе, можно сделать предположение о том, что наличие двух форм белков, отличающихся друг от друга на 4-6кДа, обусловлено нарушениями процессинга микобактериальных белков в E. coli. Антитела к сигнальным пептидам белков, как правило, не 129 образуются, поэтому их сохранение не должно было повлиять на результаты ИФА. В частности, в работе H. G. Wiker было обнаружено пять В-клеточных эпитопов в зрелом белке Rv2875 (MPT70), но ни одного в области его сигнального пептида. На основании полученных данных можно предположить целесообразность производства белков M. tuberculosis в системе E. coli без нативных сигнальных пептидов [329]. Одним из методов усовершенствования антигенных препаратов для серодиагностики туберкулеза является внесение в их структуру дополнительных эпитопов из других антигенов M. tuberculosis методом химической конъюгации [208]. Основным эпитопом ЛАМ для специфических антител при туберкулезе является его литературы терминальный конъюгаты гексаарабинофуранозид химически (Araf6). синтезированных По данным с бычьим Araf6 сывороточным альбумином позволяют эффективно выявлять случаи туберкулеза в ИФА [69, 126, 304]. В рамках нашей работы с целью внесения дополнительных эпитопов в структуру антигена и повышения чувствительности серодиагностики с одним антигеном сотрудниками ФБГУН ИОХ РАН было получено 6 гликоконъюгатов (еRv0222Аr, еRv2376сАr, еRv2875Аr, еRv3881сАr, еRv3875Аr, еRv1886c- Rv3875Аr) рекомбинантных белков M. tuberculosis, экспрессированных в системе E. coli, с синтетическим Araf6 ЛАМ. При синтезе было использовано несколько подходов (метод дифференциации гидроксильных групп арабинофуранозы, преспейсерный подход), позволяющих значительно сократить время и средства, необходимые для получения гликоконъюгатов, что может иметь большое значение при производстве серотестов для массового обследования населения на туберкулез[1, 32]. Рекомбинантные белки M. tuberculosis, полученные в экспрессионной системе E. coli, как правило, отличаются по структуре от их нативных аналогов. Одним из основных недостатков экспрессионной системы E. coli является отсутствие в ней посттрансляционных модификаций рекомбинантных белков, в 130 частности, гликозилирования [118]. Многие, главным образом, секретируемые и поверхностные, белки M. tuberculosis гликозилированы, преимущественно Оманнозилированы (Rv0040c, Rv1860, Rv2873, Rv3763 и другие) [53, 81, 88, 198, 284, 329]. Данная модификация играет важную роль в формировании нативной конформации и стабильности молекулы белка, а также в процессах молекулярного распознавания, клеточной адгезии и во взаимодействии с антителами. Кроме того, человеческие антитела, в отличие от мышиных, в период прогрессирования гликозилированные естественного заболевания конформационные эпитопы туберкулезом на распознают нативных белках M. tuberculosis [90, 176, 262]. В связи с вышеизложенным, нами была поставлена задача - получить гликозилированные рекомбинантные белки M. tuberculosis для дальнейшей оценки их серодиагностического потенциала с помощью ИФА [80]. Для достижения поставленных целей нами была выбрана система Pichia pastoris, как наиболее простой, дешевый, хорошо изученный «инструмент» получения рекомбинантных белков в большом объеме, которые секретируются в культуральную среду в нативной конформации (что позволяет избежать этапа рефолдинга белка) при незначительном количестве собственных белков. Белки в P. pastoris подвергаются посттрансляционным модификациям, в частности, Оманнозилированию, характерному для M. tuberculosis, что дает возможность получать белки по структуре близкие к нативным белкам микобактерий [193]. В системе P. pastoris нами было получено 7 антигенов M. tuberculosis Rv0040с, Rv1837с, Rv1860, Rv2873, Rv2875, Rv1636, Rv2185с - два последних в составе химерного белка рRv1636-Rv2185с. Секрецию белков в культуральную среду обеспечил сигнальный пептид (α-фактор), генетическая последовательность которого содержится в плазмиде pPIC9. Кодирующие последовательности нативных сигнальных пептидов секретируемых белков M. tuberculosis были удалены на этапе амплификации генов с хромосомы M. tuberculosis с целью достижения более эффективной секреции их клетками P. pastoris и сохранения полигистидинового участка на N - конце полипептидной цепи. 131 Экспрессия рекомбинантных белков проводилась в штаммах P. pastoris KM71 (фенотип His+Muts) и GS115 (His+Mut+). Условия культивирования во всех случаях были одинаковыми (состав сред, температурный режим, скорость перемешивания, время культивирования и другое). При этом уровень экспрессии в культуре P. pastoris для разных белков варьировал от 0,05 г/л (рRv1837с) до 0,8 г/л (рRv1860). Отсутствие экспрессии в P. pastoris при данных условиях культивирования было обнаружено для белков Rv0129с, Rv0934, Rv3425 и Rv3803с (при наличии подтверждений правильного расположения соответствующих генов в хромосоме P. pastoris и роста трансформированных клонов в среде с метанолом). Вероятно, экспрессия белков была минимальной, что может быть обусловлено, например, нестабильностью белка в среде или его протеолизом под действием дрожжевых протеаз. Однако точная причина отсутствия экспрессии данных белков в P. pastoris нами не установлена. Крайне низкая экспрессия рекомбинантного белка в P. pastoris, либо ее отсутствие при подтвержденном правильном расположении его гена в хромосоме дрожжей может быть связана с неблагоприятными для них условиями культивирования. Для повышения выхода белка при культивировании рекомбинантных штаммов P. pastoris возможно применение различных способов оптимизации экспрессии. Одним из них является предупреждение протеолитической деградации рекомбинантных белков. P. pastoris секретирует в среду сравнительно небольшое количество эндогенных белков. Однако среди них все же есть белки, обладающие протеолитической активностью, например, субтилисин (сериновая протеаза), секретирующийся в минорных количествах в среду с метанолом при культивировании P. pastoris [256]. С большей вероятностью протеолиз секретируемых белков может возникнуть при лизисе клеточных мембран и высвобождении вакуолярных протеолитических ферментов (таких, как протеиназы А и В, карбоксипептидаза У, 132 аминопептидаза) в среду при ферментации в культуре высокой плотности. Причинами повреждения дрожжевых клеток может быть нехватка питательных веществ, а также смена источника углерода, нагревание, изменение рН среды, влияние токсических веществ и другое. Снизить активность протеаз можно с помощью таких веществ как ФМСФ (ингибирует протеиназу B, карбоксипептидазу У), пепстатин (протеиназу А), E-64 (цистеиновые протеазы) и другие. Насыщение среды азотом, например, добавление дрожжевого экстракта или аминокислот, может также значительно снизить деградацию и повысить экспрессию белка. В качестве ингибитора внеклеточных протеаз P. pastoris мы использовали казаминовые кислоты (солянокислотный гидролизат казеина) до 1% в среде [280]. Для оптимизации экспрессии гетерологичных белков в P. pastoris необходим индивидуальный подбор условий культивирования рекомбинантных штаммов P. pastoris. Например, изменение рН среды может обеспечить его стабильность, а закисление среды до рН=3,0 - снизить активность многих протеаз, не оказав негативного влияния на рост клеток P. pastoris [60, 342]. Изменение температурного режима культивирования также влияет на экспрессию белка. Например, понижение температуры культуры до 20°С снижает активность большинства протеаз, и, по некоторым данным, способствует увеличению продукции рекомбинантного белка, что может быть связано с более эффективным фолдингом белка и повышением жизнеспособности клеток при более низкой температуре [289, 297]. Z. Li отмечает уменьшение формирования димеров и агрегации белка при культивировании P. pastoris при температуре 23°С. А неправильно свернутые и агрегированные белки более подвержены протеолитической деградации. Повышение температуры культивирования выше 32°С может привести к гибели клеток P. pastoris [182]. Однако в нашей работе, несмотря на попытки оптимизировать экспрессию белка Rv0934 в дрожжевой системе за счет использования двух штаммов P. pastoris (GS115 и KM71), двух вариантов сред с рН=6,0 или рН=3,0 и двух 133 температурных режимов (20°С или 29°С), ни в супернатанте культуры P. pastoris, ни в лизате клеток дрожжей белок так и не был обнаружен. Допустимо предположить, что нативный лидерный пептид Rv0934, который не был удален из гена rv0934 при клонировании, затруднил его секрецию P. pastoris, и белок подвергся расщеплению внутриклеточными протеазами дрожжей. Интенсивное перемешивание культуры обеспечивает лучшую аэрацию среды, что имеет критическое значение для роста дрожжей и продукции ими рекомбинантного белка. Метаболизм метанола клетками требует повышенного содержания кислорода в среде. Также при выращивании культуры высокой плотности поддержание определенной концентрации растворенного кислорода в среде имеет критическое значение. Повышение скорости перемешивания (до 300 об/мин) может способствовать большей доступности кислорода для клеток [76, 313]. Для культивирования культуры P. pastoris используют объем среды, составляющий 1/10 объема колбы, что также увеличивает контактную поверхность среды с кислородом. Однако при таких условиях наблюдается испарение жидкости концентрирование во среды. время Мы в культивирования нашей работе и, таким образом, использовали меньшее соотношение объемов среды/колбы (1:5-1:7), при этом повысив аэрацию среды (за счет двухслойных марлевых лоскутов в качестве «пробок») и компенсируя потери жидкости при испарении. Концентрация содержания метанола в среде является ведущим параметром, определяющим интенсивность экспрессии белка P. pastoris [281]. Метанол является не только индуктором экспрессии белка, но и единственным источником углерода и энергии для жизнедеятельности клеток [313]. Однако при избыточном содержании метанола и кислорода в среде аккумулируются формальдегид и свободные радикалы в токсичных для клеток дрожжей концентрациях [293]. Кроме того, высокая концентрация метанола ингибирует рост дрожжевых клеток, а низкая - может быть недостаточна для индукции экспрессии целевого белка [201, 281]. Согласно собственным наблюдениям, а также руководствуясь данными 134 литературы, мы выбрали концентрацию индуктора экспрессии белка, метанола, 1% как наиболее оптимальную для получения рекомбинантных белков при данных условиях культивирования. Сохранение постоянной концентрации метанола в среде позволяет обеспечить более высокий выход белка, по сравнению с колебаниями концентрации при дробном внесении субстрата (один раз в 24 часа). Применение систем, поддерживающих постоянство содержания кислорода и метанола в среде, является оптимальным способом для получения высокого выхода белка [120, 207]. Для всех белков, полученных в P. pastoris, в денатурирующем электрофорезе в ПААГ было выявлено возрастание молекулярных масс на 2-8кДа (примерно соответствующее числу сайтов N-гликозилирования), по сравнению с расчетными значениями, что может свидетельствовать о гликозилировании белков в P. pastoris. Для белка рRv1860 так же, как и в случае аналогичного белка, экспрессированного в E. coli, была обнаружена замедленная миграция в ПААГ при ДСН-электрофорезе, что связано с наличием богатых пролином ригидных участков на конце полипептидной цепи (коротких повторяющихся мотивов (КПМ)). Кроме того, КПМ иногда принимают участие в неспецифическом связывании белков друг с другом, что может объяснитьолигомеризацию белка рRv0040c [154, 198, 332]. Гомодимер белка рRv2873 обнаруживался только после высаливания его из культуральной среды, а иммуноблот образца супернатанта культуры P. pastoris до высаливания выявлял только мономер рRv2873. Вероятно, увеличение концентрации белка и влияние космотропных агентов (остаточный сульфат аммония (по данным литературы до 0,3М), сульфат натрия, хлорид калия и другие) после высаливания способствовали возникновению и поддержанию межмолекулярных взаимодействий между двумя молекулами белка [58]. Тем не менее, расхождение значений кажущихся и расчетных молекулярных масс белков 135 (как для мономеров, так и гомодимеров) может указывать на гликозилирование и олигомеризованных белков. Одним из перспективных подходов для объединения эпитопов из различных антигенов является получение химерных белков, кодируемых слитными генами [136]. В настоящей работе было создано два генетически слитых белка, один из них был экспрессирован в P. pastoris (рRv1636-Rv2185с), другой - в E. coli (еRv1886с-Rv3875). Последний был также конъюгирован с Araf6 ЛАМ (еRv1886сRv3875Ar). Ренатурация белка еRv1886с-Rv3875 после хроматографии в денатурирующих условиях потребовала внесения в диализный раствор стабилизирующих компонентов (ДТТ, глицерин). Белок рRv1636-Rv2185с секретировался непосредственно в культуральную среду, что позволило проводить очистку белка в нативных условиях и с помощью диализа удалить лишь некоторые компоненты элюирующего буфера из раствора белка. Для P. pastoris характерно низкое содержание в среде протеаз. Тем не менее, при экспрессии химерного белка рRv3874-Rv3875-Rv2031с в P. pastoris наблюдалась его N-терминальная деградация. Это, вероятно, было связано с отщеплением первого антигена из-за диссоциации комплекса Rv3874-Rv3875 в составе химерного белка вследствие ацетилирования N-конца Rv3875. Комплекс Rv3874-Rv3875 (CFP-10-ESAT-6) имеет высокий потенциал для применения его в серодиагностике туберкулеза, поэтому проблема получения его в дрожжевой системе, возможно, требует отдельного изучения [202, 220]. Применение в работе протеаза - дефицитных штаммов P. pastoris (SMD1163, SMD1165, SMD1168), подбор оптимальных линкеров, а также модификация или удаление специфических протеолитических сайтов может снизить вероятность деградации слитого белка при получении в дрожжевой системе [124, 224, 347, 348]. С другой стороны, при секретируемом варианте экспрессии необходимо учитывать факторы среды (рН, содержание нейтральных солей, температуру культивирования и другие.), влияющие на растворимость гибридного белка и 136 стабильность его в растворе. Следовательно, при создании химерных рекомбинантных белков необходим индивидуальный подбор систем экспрессии, а также оптимизация условий его получения для каждого белка. Оценка серодиагностического потенциала антигенов M. tuberculosis проводилась методом ИФА с сыворотками больных легочным туберкулезом и здоровых жителей Саратовской области. Территориальное ограничение при формировании панелей сывороток в пределах одного региона РФ было продиктовано представлением о географической гетерогенности гуморального иммунного ответа при туберкулезе [45, 136, 191, 210, 258, 270, 308, 325]. Согласно данной гипотезе эффективность выявления больных туберкулезом с помощью одного теста в разных регионах может существенно отличаться ввиду особенностей иммуногенетики циркулирующих в регионе разных этнических штаммов групп, M. tuberculosis по различий спектру экспрессирующихся белков, неодинаковых уровней инфицированности населения M. tuberculosis и охвата жителей региона БЦЖ-вакцинацией (таблица 6) [191]. По данным отчета Федерального государственного бюджетного учреждения «Центральный научно-исследовательский институт организации и информатизации здравоохранения» Министерства здравоохранения РФ на 2012 год значения основных статистических показателей по туберкулезу, таких, как заболеваемость, распространенность, смертность, доли больных с МЛУ и ВИЧ, охват профилактическими осмотрами, для Саратовской области были близки к средним значениям по сране. В частности, общая заболеваемость туберкулезом по области в 2012 году – 61,5 против 68,1 (по России), а распространенность – 153,4 против 157,7 на 100000 населения [20]. Активный миграционный процесс может оказать влияние на стабильность тех характеристик региона, которые определяют его географическую специфичность. В Саратовской области наблюдается невысокий уровень миграционных потоков – 1,1% (28 тыс. прибывших из других регионов и стран за 2012 год), тогда как, например, в Московской области этот показатель - 3,2% (222 тыс. человек) [4]. Таким образом, устойчивые усредненные статистическими 137 показатели по туберкулезу в Саратовской области позволяют экстраполировать данные, получаемые в исследовании, на весь регион и, вероятно, частично и на другие регионы РФ со схожими эпидемиологическими характеристиками, по крайней мере, с точки зрения подхода к выполнению работы и сравнения данных. Тем не менее, для каждого региона подобные исследования должны проводиться отдельно. Для целей исследования из лечебных учреждений Саратовской области было получено 100 сывороток от доноров, больных туберкулезом легких, и 30 – от здоровых БЦЖ-вакцинированных людей. Донорами сывороток были лица обоих полов старше 18 лет. Во многих исследованиях, посвященных оценке серодиагностического потенциала антигенов M. tuberculosis, так же, как и в нашей работе, использовались только две группы сравнения (больные туберкулезом и здоровые) и схожие объемы выборок, в том числе в составе неравных групп [45, 136, 216, 258, 270, 325, 346]. Для стран с большим резервуаром латентного туберкулеза наиболее значимым является раннее выявление больных в период активации заболевания, в том числе у больных с хроническим течением инфекции. С этой целью панель сывороток больных включала сыворотки как от вновь выявленных больных, так и от больных с рецидивом заболевания. Среди диагнозов доноров сывороток исследуемой группы большую часть составлял инфильтративный туберкулез легких, однако, в 5% случаев был зарегистрирован фиброзно-кавернозный туберкулез, что может говорить о позднем выявлении заболевания. Важным аспектом применения серодиагностических систем на практике является возможность туберкулеза легких. диагностировать В нашей случаи работе олиго- только 54% и абациллярного больных были бактериовыделителями. При этом все сыворотки пациентов с отрицательными результатами бактериоскопии мазка (73% доноров) или посева мокроты (56% доноров) реагировали в ИФА хотя бы с одним антигеном M. tuberculosis, что может свидетельствовать об эффективности серодиагностики в подобных, трудно выявляемых традиционными методами диагностики, случаях туберкулеза. 138 При проведении иммуноанализа необходимо аргументированно подходить к выбору класса детектируемых антител. В связи с тем, что антимикобактериальные антитела класса G обнаруживаются в периферической крови больных туберкулезом более продолжительное время и в большей концентрации, чем антитела других классов, а также обладают высоким сродством к антигенам M. tuberculosis, мы отдали свое предпочтение определению в ИФА именно IgG [100, 324]. Твердофазный гетерогенный непрямой ИФА выполняли согласно стандартным методикам, описанным в научной литературе для аналогичных исследований [44, 86, 111, 135, 291, 301, 336]. Анализы со всеми изучаемыми антигенами M. tuberculosis проводились в одинаковых условиях (с теми же реактивами, оборудованием, методиками и исполнителем), что уменьшало влияние дополнительных факторов на результаты работы. Кроме того, на каждый планшет вносили 5 контрольных сывороток для последующего сравнения данных, полученных на разных планшетах с одним антигеном. Перед проведением ИФА были определены оптимальные концентрации антигенов для нанесения на планшет (таблица 1), обеспечивающие связывание максимального числа специфических антител из сывороток, и, таким образом, способствующие более четкому разграничению «положительных» и «отрицательных» сывороток. Статистический анализ данных проводился с помощью стандартных методов с применением специализированных компьютерных программ. Согласно данным статистического анализа все использованные нами антигены M. tuberculosis достоверно выявляли туберкулез (различия между средними значениями OD450 для групп здоровых и больных были статистически значимы (p<0,05)). Корреляционный анализ в большинстве случаев не выявил взаимосвязи между повышенными уровнями реактивности сывороток больных туберкулезом против различных антигенов (значений OD450 в ИФА) и клиническими характеристиками их доноров (пол, возраст, диагноз, результаты бактериоскопии мазка мокроты, наличие распада в легочной ткани, рецидива). Несмотря на 139 обнаружение прямой достоверной (p<0,05) корреляции между диагнозом «фиброзно-кавернозный туберкулез легких» и повышенной реактивностью сывороток против eRv3875, eRv1860 и еRv3874, рецидивом заболевания - и eRv1860, а также распадом легочной ткани у доноров и высоким титром антител против eRv0040с, малые объемы выборок сравнения данных, использованные для анализа (5-30 образцов), не позволяли судить о закономерности выявленных взаимосвязей для популяции в целом. Вычисление показателей эффективности применения антигенов для целей серодиагностики туберкулеза таких, как чувствительность, специфичность, диагностическая достоверность, осуществлялось тремя методами: с помощью расчета двух видов «отсекающих значений» (применяемых в эндемичных (по cutoff1) и неэндемичных (по cutoff2) регионах по туберкулезу), а также посредством ROC анализа. Все указанные варианты расчетов результатов ИФА используются в научной литературе для оценки серодиагностического потенциала антигенов M. tuberculosis [119, 146, 149, 179, 239, 241, 253]. Чувствительность анализов со всеми исследованными белками варьировала от 19 до 60% (при расчете по cutoff1) или от 5% до 46% (cutoff2), а диагностическая достоверность (доля истинных результатов из общего объема выборки, эффективность теста) - 37,7% до 69,2% (cutoff1), от 26,9% до 58,5% (cutoff2.). Наименьшие и наибольшие значения обоих показателей были получены для белков, рRv2873 и рRv2875, соответственно. Специфичность анализов с указанными белками составила 100%. Интересно, что по данным литературы на протяжении последних десятилетий серодиагностический потенциал указанных белков изучался, главным образом, в отношении бычьего туберкулеза [71, 141, 345]. Это было, вероятно, связано с данными о низкой экспрессии Rv2873 (МРТ83) и Rv2875 (МРТ70) M. tuberculosis (показано в исследовании in vitro), и вследствие этого предполагаемым слабо выраженным гуморальным ответом на них при туберкулезе [71, 134, 186, 327, 329]. Тем не менее, в недавнем исследовании G.C. Ireton (2010 года) среди 42 рекомбинантных антигенов M. tuberculosis, 140 использованных ИФА с сыворотками больных туберкулезом легких из разных популяций, Rv2875 оказался одним из лучших серомаркеров заболевания, выявив 74% больных туберкулезом из Бразилии и 55% - из Индии. Чувствительность ИФА с Rv2873 с сыворотками больных туберкулезом в работе L. Zhang (2011 год) составила 34,4% [141, 345]. Таким образом, данные, полученные как в нашей работе, так и зарубежными авторами, могут поставить под сомнение представление о низкой экспрессии генов mpt83 и mpt70 в M. tuberculosis, и, следовательно, минорной продукции белков Rv2873 и Rv2875. Действительно, было показано, что, для M. tuberculosis характерен низкий базальный уровень активации генов mpt83 и mpt70, но индуцирование их экспрессии при инфицировании M. tuberculosis макрофага [134, 315]. Кроме того, в исследованиях разных авторов показано, что МРТ70 и МРТ83 вызывают Т-клеточный ответ у больных активным туберкулезом, а предварительная иммунизация лабораторных мышей МРТ83 обеспечивает протективный эффект (меньшую обсемененность легких и селезенки M. tuberculosis) при экспериментальном туберкулезе [150, 214]. В соответствии с представленными данными можно сделать вывод о том, что для активации туберкулезного процесса характерно повышение продукции белков Rv2873 и Rv2875, а также формирование гуморального иммунного ответа на указанные антигены. Следовательно, обнаружение в крови больного антител против Rv2873 и Rv2875 может указывать на наличие туберкулезной инфекции. С другой стороны, все доноры сывороток в детстве были иммунизированы субштаммом M. bovis BCG Russia, для которого характерна высокая экспрессия белков МТВ83 регистрировании и МТВ70 у [315]. больных в Однако ИФА предположение поствакцинальных о возможном анти-Rv2873 и анти-Rv2875 антител нам представляется маловероятным, прежде всего, в связи с отсутствием высоких титров указанных антител у здоровых БЦЖ- вакцинированных доноров. При сопоставлении показателей серодиагностической эффективности рRv2873 и рRv2875, полученных в экспрессионной системе P. pastoris, возникает вопрос о причинах столь выраженных различий в значениях чувствительности 141 анализов с ними, притом, что гены mpt83 и mpt70 объединены в составе одного оперона под общим промотором, предполагая схожую интенсивность их экспрессии, а сами белки имеют высокую гомологию. Объяснением результатов, с одной стороны, могут служить различия в доступности белков для иммунной системы, в связи с тем, что Rv2875 (МРТ70/МТВ70) – секретируемый, а Rv2873 (МРТ83/МТВ83) – мембранный белки M. tuberculosis. С другой стороны, некоторыми авторами были получены доказательства различий в динамике антиRv2873 и анти-Rv2875 антител при экспериментальном бычьем туберкулезе. Например, K.P.Lyashchenko и соавторами антитела против МТВ83 были определены в крови больных животных уже на 4 неделе, а против МРВ70 - только на 18-22 неделях после заражения M. bovis [192, 322, 339]. Таким образом, если подобная стадийность в проявлении гетерогенности гуморального ответа против указанных белков существует и при туберкулезе у людей, тогда различия в полученных нами результатах ИФА с рRv2873 и рRv2875 могут быть связаны с разными сроками взятия образцов крови у пациентов после возникновения заболевания. Тем не менее, мы не можем отрицать вероятность нарушения процессов связывания специфических антител с эпитопами белка рRv2873 из-за структурных отличий белка от его нативного аналога (например, изменения конформации белка вследствие образования его димера или избыточного гликозилирования). Для установления истинной причины выявленных различий, возможно, необходимы дополнительные исследования, в том числе с применением нативного белка MPT83. С помощью ROC анализа мы смогли не только определить значения необходимых статистических показателей, но и визуально сравнить результаты ИФА, представленные в виде ROC-кривых для анализов с каждым антигеном. Основной количественной характеристикой ROC-кривой является ППК. При сравнении значений данного показателя, полученного для анализов с разными белками, мы обнаружили, что лучшей диагностической точностью, то есть способностью разграничивать случаи туберкулеза и его отсутствия, обладал тест с рRv1860 (ППК = 0,855), а белки, полученные в системе E. coli, были менее 142 пригодны для целей серодиагностики, по сравнению с аналогичными белками, полученными в P. pastoris, или с конъюгатами данных белков с углеводным фрагментом ЛАМ. Другие показатели, рассчитанные в ROC анализе, в целом соответствовали результатам стандартного статистического анализа. Тем не менее, с помощью ROC были выявлены и некоторые дополнительные данные. Например, в ROC анализе на основании оптимального «порога отсечения» были определены существенно более высокие, по сравнению с расчетами по cutoff1 и cutoff2 значения чувствительности и диагностической достоверности для белка рRv2873, а высокое значение ОП+ для данных расчетов указывает на низкую вероятность ложноположительных результатов для теста с рRv2873, что позволяет использовать его для серодиагностики в сочетании с другими антигенами. Посредством ИФА нами был оценен серодиагностический потенциал 12 рекомбинантных антигенов M. tuberculosis (еRv0040с, еRv0222, еRv1837c, еRv1860, еRv2376с, еRv2875, еRv3425, еRv3872, еRv3874, еRv3875, еRv3881с, еRv1886c-Rv3875), полученных в системе E. coli. Среди них 3 антигена (еRv3872, еRv3874, еRv3875) относились к группе так называемых «RD1 белков». Их гены отсутствуют в геномах всех субштаммов M. bovis BCG и многих нетуберкулезных микобактерий, что предопределяет возможность получения высокоспецифичного диагностического теста, основанного на определении гуморального ответа против «RD1 белков» [63]. В нашей работе специфичность анализов с данными белками была в пределах 86,7 - 100% при разных вариантах расчета. Снижение специфичности в случае анализов с «RD1 белками» может быть обусловлено перекрестной реактивностью организма на гомологичные участки, присутствующие в структуре разных белков, относящихся к одним и тем же семействам, PE/PPE (как Rv3872 (PE35)) и ESAT6 (как Rv3874 (CFP-10) и Rv3875 (ESAT-6)), но продуцируемых как M. tuberculosis, так и другими микроорганизмами [110]. Среди 12 антигенов, экспрессированных в E. coli, лучшие показатели чувствительности и диагностической достоверности были получены именно в 143 анализах с белком еRv3874. Согласно данным научной литературы многие исследователи также признают CFP-10 одним из наиболее перспективных антигенов для целей серодиагностики туберкулеза [349]. Белки Rv0222 и Rv3425 также относят к «RD белкам», но регионы RD4 и RD11, в которых соответственно расположены их гены, присутствуют в геноме M. bovis BCG Russia, и, следовательно, на данные белки может возникать перекрестная реакция у здоровых БЦЖ-вакцинированных людей [155, 250, 349]. Тем не менее, специфичности анализов с еRv0222 и еRv3425 в нашей работе были достаточно высокими, более 90% (при стандартных вариантах расчета показателей). Значения чувствительности анализов с еRv0222 и еRv3425 были средними, однако, при включении их в состав мультиантигенного коктейля в сочетании с такими белками как рRv1860, рRv2875, еRv3874, согласно проведенным расчетам, можно значительно повысить общую чувствительность анализа за счет компенсации индивидуальной гетерогенности гуморального ответа при туберкулезе на разные белки M. tuberculosis. Шесть рекомбинантных белков M. tuberculosis (еRv0222, еRv2376с, еRv2875, еRv3875, еRv3881с, еRv1886c-Rv3875), полученных в E. coli, были ковалентно конъюгированы с синтетическим Araf6 ЛАМ. Полученные конъюгаты были использованы в ИФА наряду с неконъюгированными формами указанных антигенов. Сравнение показателей эффективности антигенов для целей серодиагностики показало, что конъюгация белков с главным эпитопом ЛАМ позволяет выявить в ИФА дополнительно от 5 до 16% больных (при расчете по cutoff1 или 5 - 19% –cutoff2) без существенного снижения специфичности анализа. Наибольший прирост значений показателей чувствительности и диагностической достоверности наблюдался для анализов с белками еRv3875Аr и еRv2875Аr. Сравнение результатов ИФА с еRv1886c-Rv3875 и еRv1886c-Rv3875Аr показало, что химическое конъюгирование гибридных белков с эпитопом ЛАМ также приводит к повышению эффективности серодиагностики, как и в случае с отдельными белками. 144 В рамках данной работы была также исследована эффективность использования в ИФА белков Rv0934 и Rv1980c (получены в E. coli) и их конъюгатов с Araf6 ЛАМ, однако, анализ проводился с сыворотками из другого региона (г. Москва). Возрастание чувствительности для конъюгированных антигенов, по сравнению с неконъюгированными составило 13% и 11%, соответственно. Таким образом, «химическое гликозилирование» рекомбинантных белков M. tuberculosis углеводным фрагментом ЛАМ является одним из перспективных методов для усовершенствования серодиагностических тестов, выявляющих туберкулез. Многие значимые для серодиагностики, главным образом, секретируемые белки M. tuberculosis в нативных условиях подвергаются гликозилированию. Наличие маннозных остатков в гликопротеинах M. tuberculosis обеспечивает формирование конформационных эпитопов и эффективное связывание специфических антител [91, 109, 176]. С целью получения гликозилированных белков M. tuberculosis мы использовали дрожжевую систему P. pastoris. Шесть антигенов M. tuberculosis, экспрессированных P. pastoris, а именно, рRv0040с, рRv1837c, рRv1860, рRv2875, рRv2873, рRv1636-Rv2185с, были тестированы в ИФА с сыворотками больных туберкулезом и здоровых людей. На основании результатов анализов было проведено парное сравнение статистических показателей для четырех белков (Rv0040с, Rv1837c, Rv1860, Rv2875), полученных как в системе P. pastoris, так и E. coli. Во всех случаях значения чувствительности и диагностической достоверности анализов были выше у белков из дрожжевой системы. Наиболее заметное повышение значений данных показателей наблюдалось для рRv0040с. С помощью ИФА был оценен серодиагностический потенциал трех вариантов белка Rv2875 (еRv2875, рRv2875 и еRv2875Аr), что позволило сравнить эффективность всех трех методов получения антигена, использованных в нашей работе, для целей серодиагностики. Возрастание чувствительности анализа с еRv2875 после его конъюгирования с Araf6 было менее значительным, чем после «смены» системы экспрессии на P. pastoris. На основании результатов 145 сопоставления наборов сывороток, которые реагировали в ИФА с различными вариантами антигена Rv2875, можно предположить, что конъюгация белка рRv2875 с фрагментом ЛАМ могла бы способствовать дополнительному повышению чувствительности анализа с указанным белком (согласно расчетам на 16% (cutoff1) и 18% (cutoff2)). Тем не менее, данное предположение может учитываться только после его экспериментального подтверждения. В отличие от белков рRv0040с, рRv1860 и рRv2875, смена экспрессионной системы (с E. coli на P. pastoris) при получении антигена Rv1837с (МРТ81) не привела значительному улучшению показателей эффективности анализа. Чувствительность анализа с рRv1837с, по сравнению с еRv1837с, возросла на основании расчетов по cutoff1,2 только на 3% (хотя по результатам ROC анализа эта цифра была все же выше – на 11%). Статистический анализ данных ИФА с рRv1837с, несмотря на такие предрасполагающие факторы, как размер белка (747аа), обуславливающий большое число линейных эпитопов в его структуре, а также получение белка P. pastoris в растворимой и, вероятно, гликозилированной формах, не выявил ожидаемого высокого серодиагностического потенциала рRv1837с для выявления туберкулеза (диагностическая достоверность была от 40,7% до 62,3% - согласно разным методам расчета). Возможным объяснением таких результатов, может быть наличие перекрестно-реагирующих анти-МРТ81 антител у доноров из контрольной группы или неспецифичности экспрессии указанного белка для M. tuberculosis при тех стадиях и формах туберкулеза, которые были у доноров, больных туберкулезом. В нескольких работах показано, что МРТ81 является серомаркером туберкулеза на ранних стадиях заболевания, причем у ВИЧ-инфицированных людей анти-МРТ81 антитела обнаруживаются за годы до манифестации клинических проявлений туберкулеза [133, 169, 278]. С другой стороны, в исследовании X. Wu результаты тестирования белка МРТ81 с сыворотками больных туберкулезом и здоровых ВИЧ-отрицательных доноров были схожи с результатами, полученными в нашей работе [337]. 146 В нашем исследовании, несмотря на то, что все сыворотки больных туберкулезом распознавали в ИФА те или иные антигены M. tuberculosis, ни один из 24 анализов не позволил с помощью только одного антигена выявить более 60% больных. Это было обусловлено индивидуальной гетерогенностью гуморального ответа при туберкулезе, которая проявлялась различным профилем антимикобактериальных антител у каждого пациента (рисунок 14). Комбинация из нескольких иммунодоминантных антигенов M. tuberculosis в составе одного серодиагностического теста может позволить компенсировать различия в антительным ответе при туберкулезе у разных людей. В нашей работе мы расчетным путем установили наиболее эффективные сочетания антигенов M. tuberculosis, использованных в работе. Наиболее эффективными коктейлями для серодиагностики туберкулеза по данным расчетов среди рассмотренных пар белков можно признать комбинацию рRv2875 + еRv3875Ar (чувствительность - 85%, диагностическая значимость 87,7%), а среди сочетаний трех белков рRv2875 + еRv3875Ar + еRv3874 (чувствительность - 92%, диагностическая значимость - 92,3%) (таблицы 12 и 13). На возможную эффективность комбинации антигенов Rv2875 и Rv3875 для серодиагностики указывают результаты работ нескольких авторов, в которых анти-Rv3875 антитела детектировались у животных в ранние сроки после экспериментального заражения M. bovis, при этом их титр значительно снижался к моменту обнаружения в крови анти-Rv2875 антител [97, 192, 129,161]. Таким образом, для компенсирования индивидуальной гетерогенности противотуберкулезного гуморального ответа, обусловленной различиями в сроках проведения серодиагностики после возникновения заболевания, при составлении коктейлей необходимо учитывать различия в динамике антител против разных антигенов M. tuberculosis. Одним из способов объединения антигенов в коктейль является создание химерных полиэпитопных молекул методами генетической инженерии. В нашей работе было создано два химерных белка: рRv1636-Rv2185с и еRv1886с-Rv3875. На основании результатов статистического анализа мы смогли сравнить 147 серодиагностический потенциал белка еRv3875 и его «генетического конъюгата» еRv1886с-Rv3875. Сравнение показало, что, несмотря на некоторое повышение чувствительности анализа со слитым белком (на 13%), снижение его специфичности (на 6,7%) за счет перекрестно-реагирующих эпитопов Rv1886с в его составе обусловило в целом незначительный прирост диагностической достоверности (на 7,7%) для белка еRv1886с-Rv3875 по отношению к еRv3875. Аналогичные результаты были получены при сопоставлении результатов и для конъюгатов указанных белков с фрагментом ЛАМ, еRv3875Ar и еRv1886сRv3875Ar. Объяснением небольшого прироста чувствительности анализа после «объединения» Rv3875 и Rv1886с в составе одной молекулы может служить присутствие в большинстве сывороток, реагирующих с еRv3875, анти-Rv1886с антител. Снижение общей специфичности анализа является одним из главных недостатков применения гибридных белков в ИФА. Решением этой проблемы может стать объединение в составе химерных молекул только высокоспецифичных эпитопов иммунодоминантных белков M. tuberculosis. Например, было обнаружено, что такие пептиды, как Р8 и Р9 из Rv3872, РРЕ68’ из Rv3873 или А25 из Ag85B обладают высокой специфичностью, а также иммуногенностью. Для одного из них, РРЕ68’, было показано, что включение его в состав слитого белка CFP-10-ESAT-6 позволяет повысить чувствительность анализа с CFP-10-ESAT-6 без снижения специфичности [165, 210, 340]. В связи с актуальностью проблемы туберкулеза для нашей страны и необходимостью повышения выявляемости данного заболевания на ранних этапах диагностического поиска, нами была поставлена задача - оценить возможности применения серодиагностики для скрининга туберкулеза на примере одного из регионов РФ. С целью реализации поставленной задачи мы применили метод ИФА для определения уровней антительного ответа против 24 рекомбинантных и 148 синтетических антигенов M. tuberculosis с сыворотками больных туберкулезом и здоровых доноров. На первой стадии выполнения работы, нами был очерчен круг антигенов, имеющих перспективы для применения в серодиагностике туберкулеза. Обоснованием выбора антигенов служило соответствие их характеристик заявленным критериям. В список антигенов M. tuberculosis, выбранных нами для получения и дальнейшего использования в ИФА, входили как белки, так и гликолипид ЛАМ. Важным этапом выполнения работы являлся выбор способа получения антигенов M. tuberculosis. Учитывая недостатки культурального метода получения нативных антигенов M. tuberculosis, нами было принято решение использовать рекомбинантные экспрессионные системы (E. coli и P. pastoris), а также химический синтез. Полученные в ходе работы рекомбинантные белки M. tuberculosis, а также их конъюгаты с синтетическим гексаарабинофуранозидом ЛАМ были использованы в ИФА с одним набором сывороток. Статистическая обработка результатов ИФА позволила сравнить показатели эффективности анализов с различными антигенами M. tuberculosis, в том числе с аналогичными антигенами, полученными разными методами, и выявить потенциальные серомаркеры активного туберкулеза и их сочетания (композиции) для использования в иммунодиагностике туберкулеза. Результаты анализа показали, что смена экспрессионной системы с E. coli на P. pastoris при получении антигенов, а также химическая конъюгация рекомбинантных белков с эпитопом ЛАМ являются эффективными способами для усовершенствования серотестов на туберкулез. Выводы 1. Определены основные критерии выбора диагностически значимых антигенов Mycobacterium tuberculosis для серодиагностики, которые включают: специфичность антигена для возбудителя туберкулеза, способность индуцировать высокую продукцию антител на этапе активации туберкулеза, отсутствие или 149 низкий уровень антител, специфичных к антигену у здоровых БЦЖ- вакцинированных людей. 2. Создано 14 штаммов-продуцентов белков Mycobacterium tuberculosis, из которых 8 являются штаммами Escherichia coli, экспрессирующими белки Rv0222, Rv1837c, Rv1860, Rv2875, Rv3425, Rv3872, Rv3875 и Rv1886с-Rv3875, и 6 - штаммами дрожжей Pichia pastoris, синтезирующими белки Rv0040c, Rv1837c, Rv1860, Rv2873, Rv2875 и Rv1636-Rv2185c. 3. Из всех использованных в работе антигенов Mycobacterium tuberculosis наибольшим потенциалом для применения в серодиагностике туберкулеза в формате ИФА обладает белок рRv2875, экспрессированный в Pichia pastoris (обеспечивает диагностическую достоверность анализа - 69,2%), а также белок еRv3874, экспрессированный в Escherichia coli (обеспечивает диагностическую достоверность анализа – 62,3%) и конъюгат белка еRv1886c-Rv3875, экспрессированного в Escherichia coli, с синтетическим гексаарабинофуранозидом липоарабиноманнана (обеспечивает диагностическую достоверность анализа – 66,1%). 4. Продукция рекомбинантных антигенов Mycobacterium tuberculosis в дрожжевой системе экспрессии Pichia pastoris, по сравнению с традиционно применяемой бактериальной системой экспрессии Escherichia coli, способствует повышению чувствительности ИФА с сыворотками больных туберкулезом до 20%. 5. Химическое конъюгирование ряда рекомбинантных белковых антигенов Mycobacterium с tuberculosis липоарабиноманнана приводит синтетическим к повышению гексаарабинофуранозидом чувствительности ИФА с сыворотками больных туберкулезом до 16%. 6. Согласно расчетам, основанным на данных об уровне сероконверсии больных туберкулезом на различные антигены Mycobacterium tuberculosis, наиболее высокой достоверность анализа эффективностью (обеспечивает 92,3%) серодиагностике - в диагностическую может обладать 150 мультиантигенный тест, включающий композицию из трех белков: еRv3874, еRv3875Ar и рRv2875. Практические рекомендации Для получения белков M. tuberculosis, пригодных для серодиагностики туберкулеза, целесообразно применение дрожжевой системы экспрессии P. pastoris. Для увеличения иммунореактивности рекомбинантных белков M. tuberculosis с сыворотками больных туберкулезом обосновано использование химической конъюгации антигенов с синтетическим гексаарабинофуранозидом ЛАМ. Для повышения эффективности статистической обработки данных, получаемых в ИФА при тестировании антигенов M. tuberculosis с сыворотками здоровых и больных туберкулезом доноров, рекомендовано применение ROC анализа. Перспективные направления дальнейшей разработки темы Дальнейшая разработка темы исследования может быть направлена на поиск новых антигенов M. tuberculosis, а также их сочетаний, обладающих высоким потенциалом для серодиагностики туберкулеза. Результатом указанной работы может стать создание серологического теста на туберкулез. Процесс изучения серодиагностического потенциала антигенов M. tuberculosis, по нашему мнению, может быть усовершенствован за счет увеличения размеров и числа панелей сывороток, используемых в исследовании, в том числе благодаря включению дополнительных контрольных образцов от больных с нетуберкулезными заболеваниями легких, а также расширением «географии» исследований с использованием сывороток из других регионов РФ. Важным направлением разработки данной темы может стать продолжение работы по изучению влияния различных способов получения антигенов M. tuberculosis на эффективность их применения в серодиагностике туберкулеза. 151 Тяжелая эпидемиологическая ситуация по ВИЧ/СПИД в России, а также высокий риск активации туберкулеза у ВИЧ-инфицированных людей диктует необходимость изучения особенностей гуморального ответа при туберкулезе у больных с сочетанием указанных патологий с целью дальнейшей разработки специальных тест-систем для таких категорий пациентов [5, 9]. Для дальнейшей разработки темы исследования могут быть востребованы такие современные методы, как чип-технология и мультиплексный анализ. Одним из направлений для их применения может быть изучение динамики антимикобактериальных антител на разных стадиях и при разных формах туберкулеза, а также выявление возрастных, половых, а также обусловленных сопутствующими патологиями различий гуморального иммунитета при туберкулезе. Полученные данные позволят аргументировано подходить к созданию серодиагностических тестов для выявления заболевания. Кроме того, некоторые исследователи рекомендуют использование данных технологий непосредственно для серодиагностики туберкулеза [106, 142, 157, 205, 232, 304, 326]. Главной проблемой применения серодиагностики для выявления туберкулеза является практическая неосуществимость создания «идеального» теста, обладающего 100% чувствительностью и специфичностью. Одним из решений данной проблемы, на наш взгляд, может быть разработка для этих целей двух вариантов тестов: «высокочувствительного», выявляющего наибольшее число больных, для использования на первом этапе диагностического поиска, и «высокоспецифичного», отсекающего ложноположительные результаты, на следующем этапе. 152 ПРИЛОЖЕНИЯ Приложение 1. Нуклеотидные последовательности праймеров, использованных в работе НазваНазвание Сайты Нуклеотидные последовательности праймеров ние гена праймера рестрикции rv0040c rv0222 rv1636 rv2185с rv1837c rv1860 rv1886crv3875 rv2873 rv2875 rv3425 rv3872 rv3875 Fp0040EH Rp0040N for0222 rev0222 Fp1636EH R1636AN F2185A Rp2185N For 2,6kb Rev 2,6kb For81N Rev81H Fp1837EH Rp1837N For1860N Rev1860X Fp1860EH Rp1860N F85bN REsatH F2873E R2873NH fp2875EH rev2875 N For70N Rev70H for3425N rev3425H For3872N Rev3872H FesatN ResatH T7For T7Rev 5’ AOX1 3’ AOX1 α-Factor EcoRI NotI NdeI HindIII EcoRI NotI, AvrII AvrII NotI NdeI HindIII EcoRI NotI NdeI XhoI EcoRI NotI NdeI HindIII EcoRI NotI EcoRI NotI NdeI HindIII NdeI HindIII NdeI HindIII NdeI HindIII - 5'-aaa-gaattc-catcatcaccatcaccat-gatcccctgctgccaccg-3’ 5'-aaa-gcggccgc-ctagcgcggcgggactgg-3’ 5'-aaa-catatg-agcagcgaaagcgacg-3' 5'-aaa-aagctt-ggtgcccgtccaacggg-3' 5'-aaa-gaattc-catcatcaccatcaccat-atgagcgcctataagaccg-3’ 5’-aaa-gcggccgc-cta-cctagg-ggtggtgtgcacgatcag-3’ 5’-aaa-cctagg-atggcggacaagacgacacaga-3’ 5'-aaa-gcggccgc-tcagccctcgactcgtttc-3’ 5'-cttctgagccgctagccgagta-3' 5'-gtcgccggatgtagtagtcgt-3' 5'-aaa-catatg-acagatcgcgtgtcg-3' 5'-aaa-aagctt-gcgggccgcatcgtcac-3' 5'-aaa-gaattc-catcatcaccatcaccat-atgacagatcgcgtgtcgg-3’ 5'-aaa-gcggccgc-ctagcgggccgcatcgtc-3’ 5'-aaa-catatg-catcaggtggaccccaa-3' 5'-aaa-ctcgag-ggccggtaaggtccgctgc-3' 5'-aaa-gaattc-catcatcaccatcaccat-gatccggagccagcgccc-3’ 5'-aaa-gcggccgc-tcaggccggtaaggtccgc-3' 5'-aaa-catatg-ttctcccgtccgggtctg-3' 5'-aaa-aagctt-tgcgaacataccagtgac-3' 5'-aaa-gaattc-atgatcaacgttcaggcc-3' 5'-aaa-gcggccgc-ttaatggtgatggtgatgatgctgtgccgggggc-3' 5’-aaa-gaattc-catcatcaccatcaccatgcaggcgatctggtgggc-3’ 5’-aaa-gcggccgc-ttacgccggcattagcacg-3’ 5-aaa-catatg-aaggtaaagaacacaattgc-3 5-aaa-aagctt-cgccggcattagcacgct-3 5'-aaa-catatg-catccaatgataccagcg-3' 5'-aaa-aagctt-cccgcccctgtagatctg-3' 5'-aaa-catatg-gaaaaaatgtcacatgatcc-3' 5'-aaa-aagctt-ttcggcgaagacgccggc-3' 5’-aaa-catatg-acagagcagcagtggaa-3’ 5-aaa-aagctt-tgcgaacatcccagtgacg-3’ 5'-taatacgactcactataggg-3' 5'-gctagttattgctcagcgg-3' 5’-gactggttccaattgacaagc-3’ 5’-gcaaatggcattctgacatcc-3’ 5’-tactattgccagcattgctgc-3’ Примечание: сайты рестрикции выделены жирным шрифтом. 153 Приложение 2. Основные характеристики белков M. tuberculosis, Название белка Синоним белка Назва Начало Длина М, ПП, -ние гена в ген, кДа аа гена геноме п.о. H37Rv еRv0040c рRv0040c еRv0222 еRv0222Ar рRv1636Rv2185c MTC28 mtc28 EchA1 echa1 ТВ15.3 ТВ16.3 tb15.3 tb16.3 еRv1837с рRv1837с еRv1860 рRv1860 еRv1886cRv3875 еRv1886cRv3875Ar еRv2376c еRv2376cAr рRv2873 еRv2875 еRv2875Ar рRv2875 еRv3425 еRv3872 еRv3874 еRv3875 еRv3875Ar еRv3881с еRv3881cAr MPT81, 81/88кДа MPT32, 45/47кДа Ag85B ESAT6 Ag85B ESAT6 MTB12, CFP12 MPT83 MPT70 glcb PPE57 PE35 CFP10 ESAT-6 ppe57 pe35 esxb esxa MTB48 mtb48 apa fbpb esxa fbpb esxa cpf2 mpt83 mpt70 Гистаг использованных в работе 42433 42530 265507 265507 1842451 2447066 930 834 786 786 438 432 324 292 276 276 306 28/32 65 29 30 36 С N C C N 2084759 2084759 2107736 2107853 2135010 4352609 2135010 4352609 2655612 2655612 3183905 3187030 3187030 3187120 3842239 4350745 4352274 4352609 4352609 4360546 4360546 2223 2223 975 858 858 285 858 285 504 504 660 579 579 489 528 297 300 285 285 1380 1380 755 755 339 300 396 82 88 45/52 55 40 C N C N C 396 41 C 182 182 234 207 207 177 190 113 114 109 109 474 474 18 19 26/52 18/22 19/23 23 21 12 12 10/20 11 60 61 C C N C C N C C C C C C C Примечания Форма 28кДа без ЛП Нет ЛП, димер, 3 с. г. Конъюгат с Araf6 Пролин и аргинин между Rv1636 и Rv2185с; 1 с. г. 1 с. г. Форма 45кДа без ЛП Нет ЛП, 1 с. г. Серин между Rv1886c и Rv3875 Конъюгат с Araf6 Конъюгат с Araf6 Моно-, димер, 1 с. г. Форма 18 кДа без ЛП Конъюгат с Araf6 Нет ЛП; 2 с. г. Моно- и димер белка Конъюгат с Araf6 Конъюгат с Araf6 Примечания: белки, полученные автором, выделены жирным шрифтом; аа – аминокислоты; Гистаг – расположение полигистидинового участка в белке; N/C локализация гистидинового тага на N- или C- концах полипептида; ЛП – лидерный пептид; ПП – полипептид; с. г. - сайт N-гликозилирования; М – молекулярный масса белков; п. о. – пара оснований. 154 Приложение 3. Гель-электрофореграмма образцов ДНК Рисунок - Гель-электрофореграмма ампликонов генов белков M. tuberculosis в 2% агарозном геле. Примечания: 1-8 – ампликоны, полученные в ПЦР из рекомбинантных плазмид pET32b, содержащих гены белков M. tuberculosis, с Т7 праймерами; 9-17 – ампликоны с хромосомы H37Rv M. tuberculosis со специфическими праймерами для клонирования в pPIC9; 1 - rv0222, 2 - rv1837с, 3 - rv1860, 4 - rv2875, 5 - rv3425, 6 - rv3872, 7 - rv3875, 8 - rv1886с- rv3875, 9 - rv0040с, 10 - rv1837с, 11 - rv1860, 12 - rv2873, 13 - rv2875, 14 - rv0934, 15 - rv0129с, 16 - rv3881с, 17 - rv3803с, 18 - rv3425, 19 - rv1886с-rv3875; М1 - маркер «GeneRuler 1 kb DNA Ladder» (Fermentas, Литва) – 250, 500, 750, 1000, 1500, 2000, 2500, 3000, 3500, 4000, 6000, 8000, 10000 п. о.; М2 - маркер «GeneRuler 50 bp DNA Ladder» (Fermentas, Литва) – 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1000 п. о. 155 Приложение 4. Гель-электрофореграммы белков M. tuberculosis, использованных в работе Условные обозначения для всех рисунков приложений 4 и 5: М1 окрашенный маркер молекулярной массы белков SM1811 (PageRuler Plus Prestained Protein Ladder, Fermentas, Литва (11, 17, 28, 36, 55, 72, 95, 130, 250 кДа)), М2 - неокрашенный маркер молекулярной массы белков SM0661 (PageRuler Plus Unstained Protein Ladder, Fermentas, Литва (10, 15, 20, 25, 30, 40, 50, 60, 70, 85, 100, 120, 150, 200 кДа)). Рисунок А. - Гель-электрофореграмма белков M. tuberculosis из культуры рекомбинантных штаммов E. coli BL21-CodonPlus(DE3)-RP до и после индукции ИПТГ. Примечания: «до» - образцы лизатов клеток E. coli (на 0,2 мл культуры) до индукции ИПТГ, «2-4ч» – время отбора образцов культуры после внесения в нее ИПТГ. 156 Рисунок Б - Электрофореграмма белка Rv0222 до и после очистки его из культуры клеток E. coli BL21-CodonPlus(DE3)-RP. Примечания: 1 - образец лизата клеток до индукции (на 0,1 мл культуры), 2 – образец через 4 часа после начала индукции (на 0,1 мл), 3 – образец после озвучивания клеток в 8 М мочевине, 4 элюат после нанесения на хроматографическую колонку образца 3 (проскок), 5-6 элюат с 200 мМ имидазола, 7-8 – элюат с 250 мМ имидазола. Рисунок В - Электрофореграмма белков супернатанта культуры P. pastoris. Примечания: образцы после высаливания 70% сульфатом аммония из 0,2 мл среды на 4 день индукции, 1 - рRv1860, 2 - рRv0040с, 3 - рRv2875, 4 - рRv2873, 5 рRv1837с, 6 - Rv1636-2185с. 157 Рисунок Г – Электрофореграмма белка рRv1860 на разных этапах элюирования с колонки при металлхелатной хроматографии (10% ПААГ). Примечания: 1 - элюат с 60 мМ имидазола, 2 - с 250 мМ имидазола, 3 - с 300 мМ имидазола, 4 - с 500 мМ имидазола, 5 - с 1М имидазола. Рисунок Д - Электрофореграмма рекомбинантных белков M. tuberculosis и их химических конъюгатов с Araf6 ЛАМ. Примечания: 1 - еRv0222Ar; 2 еRv0222; 3 - еRv2875Ar; 4 - еRv2875; 5 - еRv3875Ar; 6 - еRv3875. 158 Рисунок Е (Е1 и Е2) – Электрофореграммы рекомбинантных белков M. tuberculosis, экспрессированных в E. coli и P. pastoris (10% ПААГ). Примечания: 1 - еRv1837с, 2 - еRv1886с-Rv3875, 3 - еRv3875, 4 - еRv3872, 5-еRv3425, 6 - еRv0222, 7 - еRv3881с, 8 - еRv3874, 9 - еRv2376с, 10 - еRv0040с, 11 -еRv0934, 12 - еRv1980, 13 - рRv1636-Rv2185с, 14 - рRv2873, 15 - рRv2875, 16-еRv2875, 17 - рRv1860, 18 - еRv1860, 19 - рRv1837с, 20 - еRv1837с, 21 рRv0040с. 159 Приложение 5. Результаты иммуноблот анализа Рисунок А – иммуноблот белков M. tuberculosis после очистки из культуры E. coli. Рисунок Б - иммуноблот белков M. tuberculosis из супернатанта культуры P. pastoris. Примечания: 1 - еRv0040с, 2 - еRv3874, 3 - еRv2376с, 4 - еRv3881с, 5 еRv0222, 6 - еRv3425, 7 - еRv3872, 8 - еRv3875, 9 - еRv1886с-Rv3875,10 - рRv1636Rv2185с, 11 - рRv2873, 12 - рRv2875, 13 - еRv2875, 14 - рRv1860, 15 - еRv1860, 16 - рRv1837с, 17 - еRv1837с, 18 - рRv0040с; при постановке иммуноблота использовали моноклональные антиполигистидиновые мышиные антитела, меченные пероксидазой хрена (Monoclonal anti-polyhistidine peroxidase conjugate produced in mouse (Sigma-Aldridge, Германия)). 160 ПРИНЯТЫЕ ОБОЗНАЧЕНИЯ И СОКРАЩЕНИЯ Список русскоязычных сокращений АА – аминокислотные остатки. АГ - арабиногалактан. АПК - антигенпрезентирующие клетки. БЦЖ - бацилла Кальметта-Герена (вакцина из M. bovis BCG). ВАК - Высшая аттестационная комиссия. ВИЧ - вирус иммунодефицита человека. ВИЧ+ТБ+ - ВИЧ-положительные туберкулезные больные. ВИЧ-ТБ+ - ВИЧ-отрицательные туберкулезные больные. ВОЗ - Всемирная организация здравоохранения. ВТБ - внелегочный туберкулез. Г- гуанин. ГКГС - главный комплекс гистосовместимости. ДАТ – диацилтрегалоза. ДД - диагностическая достоверность. ДИ - доверительный интервал. ДНК - дезоксирибонуклеиновая кислота. дНТФ – дезоксинулеотидтрифосфат. ДСН - додецилсульфат натрия. ДТТ – дитиотреитол. ИЛ – интерлейкин. γ-ИНФ - гамма интерферон. ИО – истинно отрицательный. ИП – истинно положительный. ИПТГ - изопропил-β-D-галактопиранозид. ИТЛ - инфильтративный туберкулез легких. ИФА – иммуноферментный анализ. ИХ - иммунохроматографический. кДа – килодальтон. 161 КПМ - короткие повторяющиеся мотивы. ЛАМ – липоарабиноманнан. ЛО – ложноотрицательный. ЛП – ложноположительный. ЛТБ - легочный туберкулез. М – медиана. МЛУ - множественная лекарственная устойчивость. НКТ клетки - натуральные киллеры Т-клетки. НМБ - нетуберкулезные микобактерии. ОП- - отрицательное отношение правдоподобия ОП+- положительное отношение правдоподобия ОРС - открытая рамка считывания. П. о. - пара оснований. ПААГ - полиакриламидный гель. ППК - площадь под кривой ROC. ПЦР - полимеразная цепная реакция. РФ - Российская Федерация. С – специфичность. ТАТ - триацилтрегалоза. ТБ – туберкулез. Трис - трис(гидроксиметил)аминометан. УФ – ультрафиолет. ФГБУН ИОХ РАН - Федеральное государственное бюджетное учреждение науки Институт органической химии им. Н. Д. Зелинского Российской академии наук; ФМСФ – фенилметилсульфонил флуорид. ФНО - фактор некроза опухоли. Ц – цитозин. ЦИК - циркулирующие иммунные комплексы. ЦСЖ - цереброспинальная жидкость. 162 Ч – чувствительность. ЭДТА - этилендиаминтетрауксусная кислота. ЭК – экспрессионная кассета. Список англоязычных сокращений ALS (antibody in lymphocyte supernatant) - метод детекции антител из лимфоцитов. Аr – обозначение химических конъюгатов белков. Araf6 – гексаарабинофуранозид. BCG -Bacillus Calmette—Guérin. BMGY (buffered glycerol-complex medium) - буферизированная среда с глицерином. BMMY (buffered methanol-complex medium) - буферизированная среда с метанолом. CD (cluster of differentiation) - кластер дифференцировки. Cutoff - «отсекающее» значение. HLA (human leucocyte antigens) - человеческие лейкоцитарные антигены. J - индекс Юдена. MD (minimal dextrose) – минимальная среда с декстрозой. MM (minimal methanol) - минимальная среда с метанолом. Cutoff - «отсекающее» значение. Е – обозначены белки, полученные в экспрессионной системе E. coli. E. coli - Escherichia coli. ELISPOT (enzyme-linked immunospot) - иммуноферментный иммуноспот. ESAT-6 (early secretory antigen target 6) – 6 кДа ранний секретируемый белок. HLA (human leukocyte antigen) - человеческий лейкоцитарный антиген. Ig A, G, E, M (immunoglobulin) - иммуноглобулин классов A, G, E, M. IGRA (Interferon Gamma Release Assays) - методы детекции высвобождения γИНФ. LB (Luria-Bertani или Lysogeny broth medium) - среда Луриа-Бертани. M. avium- Mycobacterium avium. 163 M. bovis - Mycobacterium bovis. M. bovis BCG – штамм M. bovis Bacillus Calmette-Guerin. M. leprae - Mycobacterium leprae. M. smegmatis - Mycobacterium smegmatis. M. tuberculosis - Mycobacterium tuberculosis. OD450 (optical density) - оптическая плотность, регистрируемая при 450 нм. р – обозначены белки, полученные в экспрессионной системе P. pastoris. PGL-Tb1 - фенольный гликолипид. P. pastoris - Pichia pastoris. PPD (purified protein derivative) - очищенный белковый дериват фильтрата культуры. SL - сульфолипид. QFT-G - QuantiFERON-TB Gold QFT-GIT - QuantiFERON-TB Gold In-Tube r - коэффициент корреляции Пирсона. RD (the region of difference) – «регион различий» в M. tuberculosis. ROC (Receiver-operating characteristic) - функциональная характеристика приемника. Rv - обозначение белка по классификации Rv. SCID (severe combined immunodeficiency) – тяжелый комбинированный иммунодефицит. SD (standard deviation) - стандартное отклонение. t - критерий Стьюдента. TCR (T cell receptor) - Т -клеточный рецептор. Th (T helper cells) - клетки Т- хелперы. YNB (yeast nitrogen base) - дрожжевая азотная основа. U - критерий Манна-Уитни. 164 СПИСОК ЛИТЕРАТУРЫ 1. Абронина, П. И. Синтез гексасахаридных фрагментов арабинанов клеточной стенки Mycobacterium tuberculosis в виде гликозидов с фунционализованным агликоном и неогликоконъюгатов на их основе / П. И. Абронина, Л. О. Кононов, Н. М. Подвальный, В. И. Торгов, А. И. Зинин, В. В. Качала, Т. М. Мельникова // Тезисы доклада на Всероссийской конференции по органической химии, посвященной 75-летию со дня основания ИОХ РАН. М., 2009. - С. 80. 2. Арчакова, Л. И. Совершенствование иммуногенетических факторов в терапии на формировании основе туберкулеза изучения легких: автореферат диссертации доктора медицинских наук: 14.00.26 // Арчакова Людмила Ивановна. – СПб., 2009.- С. 1-38. 3. Балпанова, Г. Т. Генетические маркеры инфекционных заболеваний / Г. Т. Балпанова, А. А. Шортанбаев, Д. Ж. Талгатбекова // Вестник КазНМУ. – 2013. - №5. – С. 1 - 5. 4. Статистический бюллетень Федеральной службы государственной статистики (Росстат) «Численность и миграция населения Российской Федерации в 2012 году» - выпуск 2013 г. [Электронный ресурс]. // Росстат. – М., 2013. – Режим доступа: http://www.gks.ru/bgd/regl/b13_107/Main.htm 5. Справка Федерального научно-методический центра по профилактике и борьбе со СПИДом ФБУН ЦНИИЭ Роспотребнадзора «ВИЧ-инфекция в Российской Федерации в 2013 г». [Электронный ресурс] // ФБУН ЦНИИЭ Роспотребнадзора. – М., 2013. - Режим доступа: http://www.aidsvolgograd.ru/index_htm_files/hivrussia.pdf 6. Возякова, Т. Р. Метод ускоренной диагностики туберкулеза / Т. Р. Возякова, О. Е. Стебловская, В. Н. Максимова // Здравоохранение Чувашии: ежеквартальный научно-практический журнал. - 2010. - № 2. - С. 21 - 26. 7. Гланц, С. Медико-биологическая статистика. Пер. с англ. / С. Гланц. - М.: Практика, 1999. - 460 с. 165 8. Гончарова, И. А. Геномные основы предрасположенности к инфекционным заболеваниям / И. А. Гончарова, М. Б. Фрейдин, А. А. Рудко, О. В. Напалкова, О. В. Колоколова, Э. А. Ондар, Л. Е. Дунаева, Е. В. Белобородова, В. П. Пузырев // Вавиловский журнал генетики и селекции. – 2006. – Т. 10 № 3.- С. 540 - 552. 9. Дементьева, Л. А. Особенности развития ситуации по ВИЧ-инфекции в Российской Федерации / Л. А. Дементьева // Справочник заведующего клинико-диагностической лабораторией. - 2011.- № 9.- С. 9 - 15. 10. Жердев, А. В. Сравнительная характеристика рекомбинантных белков Mycobacterium tuberculosis в серодиагностике туберкулеза / А. В. Жердев, А. А. Мартьянов, В. Г. Авдиенко, С. С. Бабаян, В. Я. Гергерт, А. С. Калюкина, Д. К. Лауринавичуте, Н. В. Позднякова, А. Н. Федоров, Е. С. Северин, Е. А. Панферцев, С. Ф. Бикетов, Н. А. Бызова, Б. Б. Дзантиев // Физиология и патология иммунной системы. – 2006. - Т. 9. - C. 3 - 8. 11. Капков, Л. П. Значение показателей резервуара бациллярных больных туберкулезом органов дыхания в оценке эпидемической ситуации по туберкулезу / Л.П. Капков // Проблемы туберкулеза и болезней легких. 2007. - № 1. - C. 17-22. 12. Кононец, А. С. Лекарственно-устойчивый туберкулез легких в исправительных учреждениях уголовно-исполнительной системы / А. С. Кононец // Проблемы туберкулеза и болезней легких. – 2008.-№12. - С. 60-63. 13. Кравченко, Т. Б. Клонирование и экспрессия протективных антигенов Mycobacterium tuberculosis Ag85 и ESAT-6 в клетках Francisella tularensis 15/10 / Т. Б. Кравченко, M. E. Платонов, Г. М. Вахрамеева, В. А. Баннов, Т. Ю. Кудрявцева, А. Н. Мокриевич, В. М. Павлов // Биохимия. – 2007. - Т. 72. №7. – С. 905 - 914. 14. Мейснер, А. Ф. Туберкулинодиагностика у детей. Скрытая (латентная) туберкулезная инфекция? / А. Ф. Мейснер, Е. С. Овсянкина, Л. Б. Стахеева // Проблемы туберкулеза и болезней легких. — 2008. — № 6. — С. 29-32. 166 15. Морозова, Т. И. Иммуноферментный и иммунохроматографический анализы в дифференциальной диагностике туберкулеза и онкологических заболеваний органов дыхания / Т. И. Морозова, Т. Ю. Салина, И. И. Завалева // Проблемы туберкулеза и болезней легких.- 2003. - №4 - С. 20-21. 16. Остерман, Л. А. Методы исследования белков и нуклеиновых кислот: электрофорез и ультрацентрифугирование / Л. А. Остерман. - М.: Наука, 1981.-288 с. 17. Подвальный, Н. М. Циклизация 1,2-(метил)ортобензоата P-D- арабинофуранозы с помощью бромида магния / Н. М. Подвальный, А. И. Зинин, П. И. Абронина, В. И. Торгов, Л. О. Кононов // Известия академии наук. Серия химическая.- 2009. - С. 472 -473. 18. Приказ Минздрава РФ № 109 от 21.03.2003 «О совершенствовании противотуберкулезных мероприятий в Российской Федерации». Приложение 4. Инструкция по применению туберкулиновых проб [Электронный ресурс]. // Ресурсный центр по изучению политики в сфере туберкулеза. – Режим доступа: http://tbpolicy.ru/documents/ index.php?id=17&page=40. 19. Система инфекционного контроля в противотуберкулезных учреждениях: руководство / под ред. Л. С. Федоровой. – Тверь: ООО «Издательство «Триада». - 2013. – 192 с. 20. Ситуация по туберкулезу в Приволжском Федеральном округе в 2012 году. Отчет Федерального центра мониторинга противодействия распространению туберкулеза в РФ [Электронный ресурс]. // ФГБУ «ЦНИИОИЗ» Минздрава РФ.– Режим доступа: http://mednet.ru/images/stories/files/CMT/2012tvs5_privolzhskiy_cfo.pdf 21. Ситуация по туберкулезу и работе противотуберкулезной службы Российской Федерации в 2013 году. Отчет Федерального центра мониторинга противодействия распространению туберкулеза в РФ [Электронный ресурс]. // ФГБУ «ЦНИИОИЗ» Минздрава РФ. – Режим http://www.mednet.ru/images/stories/files/CMT/Tb_rf_2013_2.pdf доступа: 167 22. Стогова, Н. А. Особенности иммунитета и иммунологической реактивности у больных туберкулезным плевритом пожилого и старческого возраста / Н. А. Стогова, Н. С. Тюхтин, А. В. Лушникова // Проблемы туберкулеза и болезней легких. - 2008. - № 4.- С. 21 - 24. 23. Туберкулез в Российской Федерации 2011 г. Аналитический обзор статистических показателей, используемых в Российской Федерации и в мире. – М., 2013. – 280 с. 24. Туберкулез: руководство для врачей / под ред. А. Г. Хоменко. М.:Медицина, 1996. – 496 с. 25. Федеральные клинические рекомендации по диагностике и лечению латентной туберкулезной инфекции у детей: под ред. В. А. Аксеновой [Электронный ресурс]. // Информационный ресурс Российского общества фтизиатров.– Режим доступа: http://roftb.ru/netcat_files/userfiles/lti.pdf. 26. Филлипов, А. В. Диаскинтест - новый метод выявления туберкулеза / А. В. Филлипов, Л. В. Слогоцкая, Я. А. Кочетков // Туберкулез и болезни легких. 2011.- № 6.-С.17-22. 27. Фрейдин, М. Б. Сравнительный анализ структуры наследственной компоненты подверженности туберкулезу у тувинцев и русских / М. Б. Фрейдин, А. А. Рудко, О. В. Колоколова, Э. А. Ондар, А. К. Стрелис, В. П. Пузырев // Молекулярная биология. - 2006. - Т. 40. - №2. - С. 252 - 262. 28. Хаитов, P. M. Иммунология: учебник / P. M. Хаитов, Г. Л. Игнатьева, И. Г. Сидорович. - М.: Медицина, 2000. – 432 с. 29. Хоменко, А. Г. Современные тенденции в распространении туберкулеза в России / А. Г. Хоменко // Русский медицинский журнал. – 1998. – Т. 77. - № 17. –С. 1121-1125. 30. Abebe, F. The protective role of antibody responses during Mycobacterium tuberculosis infection / F. Abebe, G. Bjune // Clinical and experimental immunology. - 2009. - V. 157.- N. 2. - P. 235–243. 168 31. Abebe, F. Progress in serodiagnosis of Mycobacterium tuberculosis infection / F. Abebe, C. Holm-Hansen, H. G. Wiker, G. Bjune // Scandinavian journal of immunology – 2007. - V. 66. - N. 2-3. – P. 176–191. 32. Abronina, P. I. Formation of orthoester-linked D-arabinofuranose oligosaccharides and their isomerization into the corresponding glycosides / P. I. Abronina, S. L. Sedinkin, N. M. Podvalnyy, K. G. Fedina, A. I. Zinin, V. I. Torgov, L. O. Kononov // Tetrahedron Lett. - 2011.- V. 52. - P. 1794-1796. 33. Achkar, J. M. Antibody responses to mycobacterial antigens in children with tuberculosis: challenges and potential diagnostic value / J. M. Achkar, A. Ziegenbalg // Clinical and Vaccine Immunology. – 2012. – V. 19. - N. 12. P. 1898–1906. 34. Achkar, J. M. Mycobacterium tuberculosis malate synthase - and MPT51-based serodiagnostic assay as an adjunct to rapid identification of pulmonary tuberculosis / J. M. Achkar, Y. Dong, R. S. Holzman, J. Belisle, I. S. Kourbeti, T. Sherpa, R. Condos, W. N. Rom, S. Laal // Clinical and Vaccine Immunology. - 2006. - V. 113. - P. 1291–1293. 35. Afonso-Barroso, A. Lipoarabinomannan mannose caps do not affect mycobacterial virulence or the induction of protective immunity in experimental animal models of infection and have minimal impact on in vitro inflammatory responses / A. Afonso-Barroso, S. O. Clark, A. Williams, G. T. Rosa, C. Nóbrega, S. SilvaGomes, S. Vale-Costa, R. Ummels, N. Stoker, F. Movahedzadeh, P. van der Ley, A. Sloots, M. Cot, B. J. Appelmelk, G. Puzo, J. Nigou, J. Geurtsen, R. Appelberg // Cellular Microbiology. - 2013. - V. 15. - N. 4. - P. 660–674. 36. Ahmad, A. Diagnosis of tuberculosis by using ELISA to detect 38 kda mycobacterial antigen in the patients / A. Ahmad, S. Afghan, C. Raykundalia, D. Catty // Journal of Islamic academy of sciences. -1995. - V. 8. - N. 4. - P. 155-160. 37. Akhter, Y. The PE/PPE multigene family codes for virulence factors and is a possible source of mycobacterial antigenic variation: perhaps more? / Y. Akhter, M. T. Ehebauer, S. Mukhopadhyay, S. E. Hasnain // Biochimie. - 2012.- V. 94. N. 1. - P. 110-116. 169 38. Almeida, C. M. C. Humoral immune responses of tuberculosis patients in Brazil indicate recognition of Mycobacterium tuberculosis MPT-51 and GlcB / C. M. C. Almeida, A. C. Vasconcelos, A. Kipnis, A. L. Andrade, A. P. Junqueira-Kipnis // Clinical and vaccine immunology.- 2008.- V. 15. - N. 3. - P. 579–581. 39. Al-Orainey, I. O. Diagnosis of latent tuberculosis: Can we do better? / I. O. AlOrainey // Ann. Thorac Med. - 2009. - V. 4. - N. 1. - P. 5–9. 40. Amicosante, M. Evaluation of a novel tuberculosis complex-specific 34 kDa protein in the serological diagnosis of tuberculosis / M. Amicosante, S. Barnini, V. Corsini, G. Paone, C. A. Read Jr, P. L. Tartoni, M. Singh, C. Albera, A. Bisetti, S. Senesi, M. Campa, C. Saltini // Eur. Respir. J. – 1995. –V. 8.- N.12.–P. 2008–2014. 41. Amicosante, M. Sensitivity and specificity of a multi-antigen ELISA test for the serological diagnosis of tuberculosis / M. Amicosante, M. Houde, G. Guaraldi, C. Saltini // Int. J. Tuberc. Lung Dis. – 1999. - V. 3. - N. 8. – P. 736-740. 42. Andersen, A. B. Structure and mapping of antigenic domains of protein antigen b, a 38,000-molecular-weight protein of Mycobacterium tuberculosis / A. B. Andersen, E. B. Hansen // Infection and immunity. - 1989. - V. 57. - N. 8.P. 2481–2488. 43. Andersen, P. Specific immune-based diagnosis of tuberculosis. Review / P. Andersen, M. E. Munk, J. M. Pollock, T. M. Doherty // Lancet. - 2000. - V. 356. P. 1099–1104. 44. Anderson, B. L. Assessment of three commercially available serologic assays for detection of antibodies to Mycobacterium tuberculosis and identification of active tuberculosis / B. L. Anderson, R. J. Welch, C. M. Litwin // Clinical and vaccine immunology. - 2008. - V. 15. - N. 11. - P. 1644–1649. 45. Araujo, L. S. Assessment of the IgA immunoassay diagnostic potential of the Mycobacterium tuberculosis MT10.3-MPT64 fusion protein in tuberculous pleural fluid / L. S. Araujo, R. M. Moraes, A. Trajman, M. H. Fe´res Saad // Clinical and vaccine immunology. - 2010. - V. 17. - N. 12. - P. 1963–1969. 46. Arloing, S. Agglutination de bacille de la tuberculose vraie / S. Arloing // Comptes Rendues de l'Academie de Sciences.- 1898. - V. 126. – P. 1398-1400. 170 47. Bahk, Y. Y. Antigens secreted from Mycobacterium tuberculosis: identification by proteomics approach and test for diagnostic marker / Y. Y. Bahk, S. A. Kim, J. S. Kim, H. J. Euh,G. H. Bai, S. N. Cho, Y. S. Kim // Proteomics.- 2004. - V. 4. N. 11. - P. 3299-3307. 48. Banerjee, S. Serodiagnosis of tuberculosis using two ELISA systems / S. Banerjee, S. Gupta, N. Shende, S. Kumar, B. C. Harinath // Indian journal of clinical biochemistry. -2003.- V. 18. - N. 2. - P. 48-53. 49. Barnes, P. F. Tuberculosis in patients with human immunodeficiency virus infection / P. F. Barnes, A. B. Block, P. T. Davidson, D. E. J. Snider // New Engl. J. Med. -1991. - V. 324. - P. 1644–1650. 50. Bassey, E. O. T-cell response to mycobacterial proteins: a comparative study of tuberculous and control immunoblots of Mycobacterium tuberculosis and M. bovis BCG / E.O. Bassey, P. F. Life, D. Catty, J. S. Gaston, D. S. Kumararatne // Tuber. Lung. Dis. -1996. - V. 77. - P. 146–153. 51. Beck, S. T. Humoral response to low molecular weight antigens of Mycobacterium tuberculosis by tuberculosis patients and contacts / S. T. Beck, O. M. Leite, R. S. Arruda, A. W. Ferreira // Braz. J. Med. Biol. Res. -. 2005. - V. 38. - N. 4.- P. 587-596. 52. Benabdesselem, C. Enhanced patient serum immunoreactivity to recombinant Mycobacterium tuberculosis CFP32 produced in the yeast Pichia pastoris compared to Escherichia coli and its potential for serodiagnosis of tuberculosis / C. Benabdesselem, D. M. Fathallah, R. C. Huard, H. Zhu, M.A. Jarboui, K. Dellagi, J. L. Ho, R. M. Barbouche // Journal of clinical microbiology. – 2006. - V. 44. P. 3086–3093. 53. Benz, I. Never say never again: protein glycosylation in pathogenic bacteria / I. Benz, M. A. Schmidt // Mol. Microbiol. - 2002. - V. 45. - P 267–276. 54. Bezerra, J. M. A Study of IgA antibody response to different Mycobacterium tuberculosis antigens in the diagnosis and monitoring of pulmonary tuberculosis / J. M. Bezerra, S. T. Beck, K. A. Kanunfre, O. M. Leite, A. W. Ferreira // The Brazilian journal of infectious diseases. – 2009. - V. 13. - N. 1. - P. 53-58. 171 55. Bhatia, A. S. Immunodiagnosis of tuberculosis: an update / A. S. Bhatia, S. Kumar, B. C. Harinath // Indian journal of clinical biochemistry.-2003.- V. 18. - N. 2. - P. 1-5. 56. Boehme, C. Detection of mycobacterial lipoarabinomannan with an antigencapture ELISA in unprocessed urine of Tanzanian patients with suspected tuberculosis / C. Boehme, E. Molokova, F. Minja, S. Geis, T. Loscher, L. Maboko, V. Koulchin, M. Hoelscher // Trans. R. Soc. Trop. Med. Hyg. - 2005. – V.99. - N. 12. - P. 893-900. 57. Boesen, H. Human T-cell responses to secreted antigen fractions of Mycobacterium tuberculosis / H. Boesen, B. N. Jensen, T. Wilcke, P. Andersen // Infect. Immun. -1995. – V. 63.- P. 1491–1497. 58. Bondos, S. E. Detection and prevention of protein aggregation before, during, and after purification / S. E. Bondos, A. Bicknell // Analytical Biochemistry. – 2003. – V. 316. – P. 223–231. 59. Bothamley, G. H. Serodiagnostic value of the 19 kilodalton antigen of Mycobacterium tuberulosis in Indian patients / G. H. Bothamley, H. V. Batra, V. Ramesh, A. Chandramuki, J. Ivanyi // Eur. J. Clin. Microbiol. Infect. Dis. -1992. – V. 11.- P. 6–10. 60. Brierley, R. Production of insulin-like growth factor-1 in methylotrophic yeast cells / R. A. Brierley, G. R. Davis, G. C. Holtz // United States Patent 5324639.-1994. 61. Briken, V. Mycobacterial lipoarabinomannan and related lipoglycans: from biogenesis to modulation of the immune response / V. Briken, S. A. Porcelli, G. S. Besra, L. Kremer // Molecular microbiology.-2004.- V. 53. - N. 2. - P. 391–403. 62. Brostoff, J. Immune complexes in the spectrum of tuberculosis / J. Brostoff, L. Lenzini, P. Rottoli, L. Rottoli // Tubercle. -1981. –V. 62. - N. 3. - P. 169-173. 63. Brusasca, P. N. Immunological characterization of antigens encoded by the RD1 region of the Mycobacterium tuberculosis genome / P. N. Brusasca, R. Colangeli, K. P. Lyashchenko, X. Zhao, M. Vogelstein, J. S. Spencer, D. N. Mcmurray, M. L. Gennaro // Scand. J. Immunol. - 2001.- V. 54. - P. 448-452. 172 64. Cerezales, M. S. Diagnosis of tuberculosis infection using interferon-γ-based assays / M. S. Cerezales, J. B. Domnguez // Enferm. Infec. Microbiol. Clin. – 2011. - V.29. –Supl 1:26-33. 65. Certification for medium binding F-bottom plate of Greiner bio-one, Germany / [Электронный ресурс] – Режим доступа: http://www.greinerbioone.com/UserFiles/File/QM_QS/ISO%209001 -E.pdf. 66. Chambers, M. A. Antibody bound to the surface antigen MPB83 of Mycobacterium bovis enhances survival against high dose and low dose challenge / M. A. Chambers, D. Gavier-Wid, R. G. Hewinson // FEMS Immunology and medical microbiology. -2004. - V. 41. – P. 93–100. 67. Chan, E. D. Immunologic diagnosis of tuberculosis: a review / E. D. Chan, L. Heifets, M. D. Iseman // Tubercle and Lung Disease. – 2000. - V.80. - N. 3. – P. 131–140. 68. Charlet, D. Reduced expression of antigenic proteins MPB70 and MPB83 in Mycobacterium bovis BCG strains due to a start codon mutation in sigK / D. Charlet, S. Mostowy, D. Alexander, L. Sit, H. G. Wiker, M. A. Behr // Molecular microbiology. - 2005. - V. 56. - N. 5. - P.1302–1313. 69. Chatterjee, D. Structural features of the arabinan component of the lipoarabinomannan of Mycobacterium tuberculosis / D. Chatterjee, C. M. Bozic, M. McNeilS, P. J. Brennan // The journal of biological chemistry. - 1991. - V. 266. - N. 15. - P. 9652-9660. 70. Clare, J. Expression of tetanus toxin fragment C / J. Clare, K. Sreekrishna, M. Romanos // Methods in molecular biology.– 1998. – V. 103. - P.193-208. 71. Colangeli, R. Humoral immune responses to multiple antigens of Mycobacterium tuberculosis in tuberculosis patients co-infected with the human immunodeficiency virus / R. Colangeli, A. Antinori, A. Cingolani, L. Ortona, K. Lyashchenko, G. Fadda, M. L. Gennaro // Int. J. Tuberc. Lung. Dis. – 1999.- V. 3. - N. 12. – P.1127-1131. 72. Cole, R. A. Clinical evaluation of a rapid immunochromatographic assay based on the 38 kDa antigen of Mycobacterium tuberculosis on patients with pulmonary 173 tuberculosis in China / R. A. Cole, H. M. Lu, Y. Z. Shi, J. Wang, T. De-Hua, A. T. Shou // Tubercle Lung Dis. -1996.- V. 77. - P. 363–368. 73. Corbett, E. L. The growing burden of tuberculosis global trends and interactions with the HIV / E. L. Corbett, C. J. Watt, N. Walker, B. G. Williams, M. C. Raviglione, С. Dye // Epidemic. Arch. Intern. Med. – 2003. - V. 163. - N. 9. – P. 1009-1021. 74. Costello, A. M. Does antibody to mycobacterial antigens, including lipoarabinomannan, limit dissemination in childhood tuberculosis? / A. M. Costello, A. Kumar, V. Narayan, M. S. Akbar, S. Ahmed, C. Abou-Zeid, G. A. Rook, J. Stanford, C. Moreno // Trans. R. Soc. Trop. Med. Hyg. – 1992. - V. 86. N.6. - P. 686-692. 75. Côté, J. P. Glycosylation of the Escherichia coli TibA self-associating autotransporter influences the conformation and the functionality of the protein / J. P. Côté, M. È. Charbonneau, M. Mourez // PLoS One. - 2013. - V. 8. - N. 11.e80739. 76. Cunha, A. E. Methanol induction optimization for scFv antibody fragment production in Pichia pastoris / A. E. Cunha, J. J. Clemente, R. Gomes, F. Pinto, M. Thomaz, S. Miranda, R. Pinto, D. Moosmayer, P. Donner, M.J. Carrondo // Biotechnol bioeng. – 2004.- V. 86. - P. 458–467. 77. D'Agostino, R. B. Tests for Normal Distribution. Goodness-Of-Fit Techniques / edited by R. B. D'Agostino, M. A. Stepenes // Statistics: a series of textbooks and monographs. - New York: M. Decker, Inc., 1986. – P. 367-420. 78. Daley, C. L. The typically 'atypical' radiographic presentation of tuberculosis in advanced HIV disease / C. L. Daley // Tuber. Lung. Dis. – 1995.- V.76. – P. 475-476. 79. Daley, P. Blinded evaluation of commercial urinary lipoarabinomannan for active tuberculosis: a pilot study / P. Daley, J. S. Michael, P. Hmar, A. Latha, P. Chordia, D. Mathai, K. R. John, M. Pai // The international journal of tuberculosis and lung disease. - 2009. - V.13. - N.8. – P. 989-995. 174 80. Daly, R. Expression of heterologous proteins in Pichia pastoris: a useful experimental tool in protein engineering and production / R. Daly, M. T. W. Hearn // Journal of molecular recognition. -2005.- V. 18. - P. 119–138. 81. Daugelat, S. The RD1 proteins of Mycobacterium tuberculosis: expression in Mycobacterium smegmatis and biochemical characterization / S. Daugelat, J. Kowall, J. Mattow, D. Bumann, R. Winter, R. Hurwitz, S. H. Kaufmann // Microbes Infect. - 2003. – V.5. - N.12. -P. 1082-1095. 82. Delacourt, C. Value of ELISA using antigen 60 for the diagnosis of tuberculosis in children / C. Delacourt, J. Gobin, J. L. Gaillard, J. de Blic, M. Veron, P. Scheinmann // Chest. – 1993. – V.104. - P. 393-398. 83. Demangel, C. Cell envelope protein PPE68 contributes to Mycobacterium tuberculosis RD1 immunogenicity independently of a 10-kilodalton culture filtrate protein and ESAT-6 / C. Demangel, P. Brodin, P. J. Cockle, R. Brosch, L. Majlessi, C. Leclerc, S. T. Cole // Infection and immunity. – 2004. - V. 72. - N. 4. P. 2170–2176. 84. Demissie, A. Recognition of stage-specific mycobacterial antigens differentiates between acute and latent infections with Mycobacterium tuberculosis / A. Demissie, E. M. Leyten, M. Abebe, A. Aseffa, G. Abate, H. Fletcher, P. Owiafe, P. C. Hill, R. Brookes,. G. Rook, A. Zumla, S. M. Arend, Klein M., T. H. Ottenhoff, P. Andersen, T. M. Doherty, VACSEL Study Group // Clin. Vaccine Immunol. 2006.- V. 13.- P. 179–186. 85. Desikan, P. Sputum smear microscopy in tuberculosis: Is it still relevant? / P. Desikan // Indian. J. Med. Res. – 2013.- V.137. - N.3. - P. 442–444. 86. Dijkman, R. Human Coronavirus NL63 and 229E seroconversion in children / R. Dijkman, M. F. Jebbink, N. Bahia El Idrissi, K. Pyrc, M. A. Müller, T.W. Kuijpers, H. L. Zaaijer, L. van der Hoek // J. Clin. Microbiol. -2008.- V.46. - N.7.- P. 2368. 87. Dinnes, J. A systematic review of rapid diagnostic tests for the detection of tuberculosis infection / J. Dinnes, J. Deeks, H. Kunst, A. Gibson, E. Cummins, N. Waugh, F. Drobniewski, A. Lalvani // Health Technol. Assess.-2007.- V.11. - N.3.P. 40. 175 88. Dobos, K. M. Evidence for glycosylation sites on the 45-kilodalton glycoprotein of Mycobacterium tuberculosis / K. M. Dobos, K. Swiderek, K.-H. Khoo, P. J. Brennan, J. T. Belisle // Infection and immunity. -1995. -V. 63. - N. 8 - P. 2846– 2853. 89. Duman, J. G. O-Mannosylation of Pichia pastoris cellular and recombinant proteins / J. G. Duman, R. G. Miele, H. Liang, D. K. Grella, K. L. Sim, F. J. Castellino, R. K. Bretthauer // Biotechnol. Appl. Biochem. -1998.- V. 28.P. 39-45. 90. Endo, T. Dystroglycan glycosylation and its role in α-dystroglycanopathies / T. Endo // Acta Myologica. – 2007. – V. 26. - P. 165-170. 91. Espitia, C. Identification, isolation and partial characterization of Mycobacterium tuberculosis glycoprotein antigens / C. Espitia, R. Mancilla // Clin. Exp. Immunol. -1989.- V.77.- P. 378-383. 92. Espitia, C. Antigenic and structural similarities between Mycobacterium tuberculosis 50- to 55-Kilodalton and Mycobacterium bovis BCG 45- to 47kilodalton antigens / C. Espitia, R. Espinosa, R. Saavedra, R. Mancilla, F. Romain, A. Laqueyrerie, C. Moreno // Infection and immunity. – 1995. -V. 63. - N. 2. - P. 580–584. 93. Fawcett, T. An introduction to ROC analysis / Fawcett T. // Pattern recognition letters.- 2006. - V. 27. – P. 861–874. 94. Felber, A. Weakly positive tests and chronologic variation of the QuantiFERON assay: A retrospective appraisal of usefulness / A. Felber, W. Graninger. // Tuberculosis. - 2013. -V. 93. - N. 6. - P. 647-653. 95. Feng, X. Enhanced serodiagnostic utility of novel Mycobacterium tuberculosis polyproteins / X. Feng, B. Xiu, K. Chen, X. Yang, H. Zhang, J. Yue, Y. Tan, H. Li, R. A. Nicholson, A. W. Tam, P. Zhao, L. Zhang, J. Liu, X. Song, G. Wang, H. Zhang // J. Infect. – 2013. – V. 66. - N. 4.- P. 366-375. 96. Ferrara, G. Use in routine clinical practice of two commercial blood tests for diagnosis of infection with Mycobacterium tuberculosis: a prospective study / G. Ferrara, M. Losi, R. D'Amico, P. Roversi, R. Piro, M. Meacci, B. Meccugni, I. M. 176 Dori, A. Andreani, B. M. Bergamini, C. Mussini, F. Rumpianesi, L. M. Fabbri, L. Richeldi // Lancet. - 2006. – V. 367. - N. 9519. - P. 1328-1334. 97. Fifis, T. Cellular and humoral immune responses of cattle to purified Mycobacterium bovis antigens / T. Fifis, L. A. Corner, J. S. Rothel, P. R. Wood // Scand. J. Immunol. -1994.- V. 39.- P. 267–274. 98. Fisch, C. The antitoxic and bactericidal properties of the serum of horses treated with Koch’s new tuberculin / C. Fisch // JAMA. -1897.- V. 29. - P. 882–889. 99. Fortune, S. M. Mutually dependent secretion of proteins required for mycobacterial virulence / S. M. Fortune, A. Jaeger, D. A. Sarracino, M. R. Chase, C. M. Sassetti, B. R. Bloom, E. J. Rubin // Proc. Natl. Acad. Sci. USA.- 2005. – V. 102. - N. 30. - P. 10676-10681. 100. Frank, S. A. Immunology and evolution of infectious disease / S. A. Frank. Princeton, N.J: Princeton University Press, 2002. - V.39-40. - 359 p. 101. Fritz, J. M. Examining diagnostic tests: an evidence-based perspective / J. M. Fritz, R. S. Wainner // Phys. ther.- 2001. - V.81. -P.1546-1564. 102. Fujita, Y. Diverse humoral immune responses and changes in IgG antibody levels against mycobacterial lipid antigens in active tuberculosis / Y. Fujita, T. Doi, K. Sato, I. Yano // Microbiology. -2005. - V.151. - P. 2065–2074. 103. Gamboa-Suasnavart, R. A. The O-mannosylation and production of recombinant APA (45/47 KDa) protein from Mycobacterium tuberculosis in Streptomyces lividans is affected by culture conditions in shake flasks / R. A. GamboaSuasnavart, N. A. Valdez-Cruz, L. E. Cordova-Dávalos, J. Martínez-Sotelo, L. Servín-González, C. Espitia, M. A. Trujillo-Roldán // Microbial cell factories. 2011. - V.10. -P. 110. 104. Garbe, T. Expression of the Mycobacterium tuberculosis 19-Kilodalton antigen in Mycobacterium smegmatis: immunological analysis and evidence of glycosylation / T. Garbe, D. Harris, M. Vordermeier, R. Lathigra, J. Ivanyi, D. Young // Infection and immunity. -1993.- V. 61. - N. 1. - P. 260-267. 105. Gardner, I. A. Receiver-operating characteristic curves and likelihood ratios: improvements over traditional methods for the evaluation and application of 177 veterinary clinical pathology tests / Gardner I. A., M. Greiner // Veterinary clinical pathology. - 2006.- V.35. - P. 8-17. 106. Gaseitsiwe, S. Pattern recognition in pulmonary tuberculosis defined by high content peptide microarray chip analysis representing 61 proteins from M. tuberculosis / S. Gaseitsiwe, D. Valentini, S. Mahdavifar, I. Magalhaes, D. F. Hoft, J. Zerweck, M. Schutkowski, J. Andersson, M. Reilly, M. J. Maeurer // PLoS ONE. - 2008. - V. 3. - N. 12.- e3840. 107. Gatner, E. M. Circulating immunoglobulin levels in patients with pulmonary tuberculosis with special reference to IgE / E. M. Gatner, V. Msibi, J. Dauth // Tubercle. - 1982. - V. 63. - N. 2. - P. 113-117. 108. Gennaro, M. L. Immunologic diagnosis of tuberculosis / M. L. Gennaro // Clinical infectious diseases. – 2000. – V.30. – S. 243–246. 109. Gevorkian, G. Peptide mimotopes of Mycobacterium tuberculosis carbohydrate immunodeterminants / G. Gevorkian, E. Segura, G. Acero, J. P. Palma, C. Espitia, K. Manoutcharian, L. L´ Opez-Mar´in // Biochem. J. -2005. -V. 387. - P. 411–417. 110. Gey van Pittius, N. C. Letter to the editor. ESAT-6 and CFP-10: what is the diagnosis? / N. C. Gey van Pittius, R. M. Warren, P. D. van Helden // Infection and immunity. - 2002. - V. 70. - N. 11. - P. 6509–6511. 111. Gibbs, J. Effective blocking procedures ELISA technical bulletin / J. Gibbs // Corning incorporated life sciences. - 2001.- N. 3. – P. 1-6. 112. Glatman-Freedman, A. The role of antibody-mediated immunity in defense against Mycobacterium tuberculosis: advances toward a novel vaccine strategy / A. Glatman-Freedman // Tuberculosis. - 2006. - V. 86. - N. 3-4. - P. 191-197. 113. Glatman-Freedman, A. Serum therapy for tuberculosis revisited: reappraisal of the role of antibody-mediated immunity against Mycobacterium tuberculosis / A. Glatman-Freedman, A. Casadevall // Clinical Microbiology Reviews. - 1998. - V. 11. - N. 3. - P.514–532. 114. Glatman-Freedman, A. Clearance and organ distribution of Mycobacterium tuberculosis lipoarabinomannan (LAM) in the presence and absence of LAM- 178 binding immunoglobulin / A. Glatman-Freedman, A. J. Mednick, N. Lendvai, A. Casadevall // M. Infect. Immun. - 2000. – V. 68. - P. 335-341. 115. Goletti, D. Effect of Mycobacterium tuberculosis on HIV replication. Role of immune activation / D. Goletti, D. Weissman, R. W. Jackson, N. M. Graham, D. Vlahov, R. S. Klein, S. S. Munsiff, L. Ortona, R. Cauda, A. S. Fauci // J. Immunol. – 1996. - V. 157. - P. 1271-1278. 116. Gomara, M. J. Synthetic peptides for the immunodiagnosis of human diseases / M. J. Gomara, I. Haro // Current medicinal chemistry. - 2007. - V.14. - P.531–546. 117. Gomez, M. P. Analysis of LAM and 38kDa antibody levels for diagnosis of tb in a case-control study in West Africa / M. P. Gomez, S. Donkor, I. M. Adetifa, M. O. C. Ota, J. S. Sutherland // ISRN immunology. –V. 2012. -Article ID 237823.- P. 16. 118. Gopal, G. Strategies for the production of recombinant protein in Escherichia coli / G. Gopal, A. Kumar // Protein J. -2013.- V. 32. – P. 419-425. 119. Greenaway, C. Humoral response to Mycobacterium tuberculosis antigens in patients with tuberculosis in the Gambia / C. Greenaway, C. Lienhardt, R. Adegbola, P. Brusasca, K. McAdam, D. Menzies // The International journal of tuberculosis and lung disease. – 2005. – V. 9. - N. 10. - P.1112–1119. 120. Guarna, M. M. On-line monitoring and control of methanol concentration in shake-flask cultures of Pichia pastoris / M. M. Guarna, G. J. Lesnicki, B. M. Tam, J. Robinson, C. Z. Radziminski, D. Hasenwinkle, A. Boraston, E. Jervis, R. T. MacGillivray, R. F. Turner, D. G. Kilburn // Biotechnol Bioeng. -1997.- V.56. - P. 279–286. 121. Guirado, E. Passive serum therapy with polyclonal antibodies against Mycobacterium tuberculosis protects against post-chemotherapy relapse of tuberculosis infection in SCID mice / E. Guirado, I. Amat, O. Gil, J. Díaz, V. Arcos, N. Caceres, V. Ausina, P. J. Cardona // Microbes Infect. - 2006. - V.8. - P. 1252–1259. 122. Guo, S. The CFP10/ESAT6 complex of Mycobacterium tuberculosis may function as a regulator of macrophage cell death at different stages of tuberculosis infection 179 / S. Guo, R. Xue, Y. Li, L. Ren, J. J. Xu // Med. hypotheses. - 2012. –V. 78. - N. 3. -P. 389-392. 123. Gupta, S. Serological diagnosis of childhood tuberculosis by estimation of mycobacterial antigen 60-specific immunoglobulins in the serum / S. Gupta, R. Bhatia, K. K. Datta // Tuber. Lung. Dis. - 1997.- V. 78. - P. 21–27. 124. Gustavsson, M. Stable linker peptides for a cellulose-binding domain–lipase fusion protein expressed in Pichia pastoris / M. Gustavsson, J. Lehtio, S. Denman, T. T. Teeri, K. Hult, M. Martinelle // Protein Eng. - 2001. - V. 14. - P. 711–715. 125. Hamasur, B. Synthesis and immunologic characterization of Mycobacterium tuberculosis lipoarabinomannan specific oligosaccharide-protein conjugates / B. Hamasur, G. Källenius, S. B. Svenson // Vaccine. - 1999. - V. 17. - P.2853– 2861. 126. Hamasur, B. Mycobacterium tuberculosis arabinomannan–protein conjugates protect against tuberculosis / B. Hamasur, M. Haile, A. Pawlowski, U. Schröder, A. Williams, G. Hatch, G. Hall, G. Källenius, S. B. Svenson // Vaccine. -2003.V.21 - P. 4081–4093. 127. Harboe, M. Generation of antibodies to the signal peptide of the MPT83 lipoprotein of Mycobacterium tuberculosis / M. Harboe, A. O. Whelan, G. Ulvund, J. McNair, J. M. Pollock, R. G. Hewinson, Wiker H.G.. // Scand. J. Immunol. – 2002. – V.55. - N. 1. - P.82-87. 128. Harboe, M. Secreted proteins of Mycobacterium leprae / M. Harboe, H. G. Wiker // Scand. J. Immunol. - 1998.- V.48. –P. 577–584. 129. Harboe, M. Protein G based enzyme linked immunosorbent assay for anti-MPB70 antibodies in bovine tuberculosis / M. Harboe, H. G. Wiker, J. R. Duncan, M. M. Garcia, T. W. Dukes, C. Turcotte, S. Nagai // J. Clin. Microbiol. - 1990.- V.28. P. 913–921. 130. Havlir, D. V. Human immune response to Mycobacterium tuberculosis antigens / D. V. Havlir, R. S. Wallis, H. Boom, T. M. Daniel, K. Chervenak, J. J. Ellner // Infect. Immun.- 1991.- V. 59. -P. 665-670. 131. He, H. Rapid serodiagnosis of human mycobacteriosis by ELISA using cord factor (trehalose-6,69-dimycolate) purified from Mycobacterium tuberculosis as antigen / 180 H. He, S. Oka, Y. K. Han, Y. Yamamura, E. Kusunose, M. Kusunose, I. Yano // FEMS Microbiol. Immunol. - 1991.- V.3. - P. 201–204. 132. He, X.Y. Assessment of five antigens from Mycobacterium tuberculosis for serodiagnosis of tuberculosis / X. Y. He, J. Li, J. Hao, H. B. Chen, Y. Z. Zhao, X. Y. Huang, K. He, L. Xiao, L. P. Ye, Y. M. Qu, L. H. Ge // Clinical and vaccine immunology. – 2011. -V. 18. - N. 4. - P. 565–570. 133. Hendrickson, R. C. Mass spectrometric identification of Mtb81, a novel serological marker for tuberculosis / R. C. Hendrickson, J. F. Douglass, L. D. Reynolds, P. D. McNeill, D. Carter, R. L. Houghton // J. Clin. Microbiol.- 2000. V. 38. - N. 6. – P. 2354-2361. 134. Hewinson, R. G. Molecular characterization of MPT83: a seroreactive antigen of Mycobacterium tuberculosis with homology to MPT70 / R. G. Hewinson, S. L. Michell, W. P. Russell, R. A. Mcadam, W. R. Jacobs Jr. // Scandinavian journal of immunology. - 1996. - V. 43. - P. 490–499. 135. Hoff, S. Evaluation of Mycobacterium tuberculosis–specific antibody responses in populations with different levels of exposure from Tanzania, Ethiopia, Brazil, and Denmark / S. T. Hoff, M. Abebe, P. Ravn, N. Range, W. Malenganisho, D. S. Rodriques, E. G. Kallas, C. Søborg, T. M. Doherty, P. Andersen, K. Weldingh // Clinical infectious diseases. - 2007 .- V. 45. - P. 575–582. 136. Houghton, R. L. Use of multiepitope polyproteins in serodiagnosis of active tuberculosis / R. L. Houghton, M. J. Lodes, D. C. Dillon // Clin. Diagn. Lab. Immunol. - 2002. - V. 9. - N. 4. - P. 883–891. 137. Hu, S. Dynamic observation on duration of TB antibody positive in patients in patients formally as pulmonary tuberculosis / S. Hu, J. Ding, X. Zeng // Chinese journal of public health. - 2008. – V.24. – P. 667-668. 138. Imaz, M. S. Evaluation of the diagnostic value of measuring IgG, IgM and IgA antibodies to the recombinant 16-kDa antigen of Mycobacterium tuberculosis in childhood tuberculosis / M. S. Imaz, M. A. Domini, E. Zerbini, M. D. Sequeira, M. J. Spoletti, A. A. Etchart, H. J. Pagano, E. Bonifasich, N. Diaz, J. D. Claus, M. Singh // Int. J. Tuberc. Lung. Dis. - 2001. – V. 5. - P. 1036-1043. 181 139. Imaz, M. S. Serodiagnosis of tuberculosis: specific detection of free and complexdissociated antibodies anti-mycobacterium tuberculosis recombinant antigens / M. S. Imaz, M. F. Schmelling, S. Kaempfer, R. Spallek, M. Singh // The Brazilian journal of infectious diseases. – 2008. - V. 12. - N. 3. - P. 234-244. 140. Imaz, M. S. Antibody response to culture filtrate antigens of Mycobacterium tuberculosis during and after treatment of tuberculosis patients / M. S. Imaz, E. Zerbini // Int. J. Tuberc. Lung. Dis. - 2000. – V. 4. - N. 6.- P. 562-569. 141. Ireton, G. C. Identification of Mycobacterium tuberculosis antigens of high serodiagnostic value / G. C. Ireton, R. Greenwald, H. Liang, J. Esfandiari, K. P. Lyashchenko, S. G. Reed // Clinical and vaccine immunology. – 2010. - V. 17. - N. 10. - P. 1539–1547. 142. Johnston, J. A. Multiplex immunoassay for serological diagnosis of Mycobacterium bovis infection in cattle / J. A. Johnston, W. C. Davis, S. A. Olwill, J. Clarke // Clinical and vaccine immunology. – 2008. - V. 15. - N. 12. - P. 1834– 1838. 143. Joller, N. Antibody – Fc receptor interactions in protection against intracellular pathogens / N. Joller, S. S. Weber, A. Oxenius // European journal of immunology. - 2011. -V. 41. - N. 4. – P. 889–897. 144. Joung, S. M. BCG vaccine in Korea / S. M. Joung, S. Ryoo // Clin. Exp. Vaccine. Res. - 2013. - V. 2. - N. 2. - P. 83-91. 145. Julian, E. Comparison of antibody responses to a potential combination of specific glycolipids and proteins for test sensitivity improvement in tuberculosis serodiagnosis / E. Julian, L. Matas, J. Alcaide, M. Luquin // Clin. Diagn. Lab. Immunol. - 2004. - V. 11. - N. 1. - P. 70–76. 146. Julian, E. Serodiagnosis of tuberculosis: comparison of immunoglobulin A (IgA) response to sulfolipid I with IgG and IgM responses to 2,3-diacyltrehalose, 2,3,6triacyltrehalose, and cord factor antigens / E. Julian, L. Matas, A. Perez, J. Alcaide, M. A. Lanéelle, M. Luquin // J. Clin. Microbiol. - 2002. - V. 40. - P. 3782–3788. 147. Kaisermann, M.C. IgA antibody responses to Mycobacterium tuberculosis recombinant MPT-64 and MPT-10.3 (Rv3019c) antigens in pleural fluid of 182 patients with tuberculous pleurisy / M. C. Kaisermann, I. G. Sardella, A. Trajman, L. Coelho, S. Kämpfer, M. Singh, M. H. Saad // Int. J. Tuberc. Lung. Dis. - 2005. – V.9. - N. 4. - P.461-466. 148. Kallenius, G. Mycobacterial glycoconjugates as vaccine candidates against tuberculosis / G. Kallenius, A. Pawlowski, B. Hamasur, S. B. Svenson // Trends in microbiology. - V. 16. - N. 10. - P. 456-462. 149. Kalra, M. Utility of a combination of RD1 and RD2 antigens as a diagnostic marker for tuberculosis / M. Kalra, G. K. Khuller, A. Grover, D. Behera, A. Wanchu, I. Verma // Diagnostic microbiology and infectious disease. – 2010. – V. 66. - N. 2. – P. 153-161. 150. Kao, F. F. The secreted lipoprotein, MPT83, of Mycobacterium tuberculosis is recognized during human tuberculosis and stimulates protective immunity in mice / F. F. Kao, S. Mahmuda, R. Pinto, J. A. Triccas, N. P. West, W. J. Britton // PLoS ONE. - 2012.- V. 7. - N. 5. - e34991. 151. Kashyap, R. S. Diagnosis of tuberculosis infection based on synthetic peptides from Mycobacterium tuberculosis antigen 85 complex / R. S. Kashyap, S. D. Shekhawat, A. R. Nayak, H. J. Purohit, G. M. Taori, H. F. Daginawala // Clin. Neurol. Neurosurg. – 2013. – V. 115. - N. 6.- P. 678-683. 152. Kaur, D. Characterization of the epitope of antilipoarabinomannan antibodies as the terminal hexaarabinofuranosyl motif of mycobacterial arabinans / D. Kaur, T. L. Lowary, V. D. Vissa, D. C. Crick, P. J. Brennan // Microbiology. -2002.- V.148. - P. 3049–3057. 153. Kaushik, A. Diagnostic potential of 16 kDa (HspX, α-crystalline) antigen for serodiagnosis of tuberculosis / A. Kaushik, U. B. Singh, C. Porwal, S. J. Venugopal, A. Mohan, A. Krishnan, V. Goyal, J. N. Banavaliker // Indian. J. Med. Res. – 2012. – V.135. - P. 771-777. 154. Kay, B. K. The importance of being proline: the interaction of proline-rich motifs in signaling proteins with their cognate domains / B. K. Kay, M. P. Williamson, M. Sudol // The FASEB journal. - 2000. - V. 14. – P. 231-241. 183 155. Keller, P. M. Tuberculosis vaccine strain Mycobacterium bovis BCG Russia is a natural recA mutant / P. M. Keller, E. C. Böttger, P. Sander // Microbiology. 2008. – V.8. – P.120. 156. Khalilzadeh, S. Serodiagnosis of tuberculosis in children using A60 antigen / S. Khalilzadeh, M. Yazdanpanah, M. Hosseini, N. Baghaie, A. Akbar Velayati, M. Reza Masjedi // Tanaffos. – 2002. - V. 1. - N. 2.- P. 15-19. 157. Khan, I. H. Profiling antibodies to Mycobacterium tuberculosis by multiplex microbead suspension arrays for serodiagnosis of tuberculosis / I. H. Khan, R. Ravindran, J. Yee, M. Ziman, D. M. Lewinsohn, M. L. Gennaro, J. L. Flynn, C. W. Goulding, K. DeRiemer, N. W. Lerche, P. A. Luciw // Clin. Vaccine Immunol. 2008. – V.15.- P.433-438. 158. Khomenko, A. G. Tuberculosis in patients with various HLA phenotypes / A. G. Khomenko, V. I. Litvinov, V. P. Chukanova, L. E. Pospelov // Tubercle. -1990.V.71. - P. 187-192. 159. Kidd, P. Th1/Th2 balance: the hypothesis, its limitations, and implications for health and disease / P. Kidd // Altern med rev.- 2003. – V.8. - N.3. - P. 223-246. 160. Kinhikar, A. G. Potential role for ESAT6 in dissemination of M. tuberculosis via human lung epithelial cells / A. G. Kinhikar, I. Verma, D. Chandra, K. K. Singh, K. Weldingh, P. Andersen, T. Hsu, W. R. Jacobs, S. Laal // Mol. Microbiol. – 2010. - V. 75. - N. 1.- P. 92–106. 161. Koo, H. C. Use of rMPB70 protein and ESAT-6 peptide as antigens for comparison of the enzyme-linked immunosorbent, immunochromatographic, and latex bead agglutination assays for serodiagnosis of bovine tuberculosis / H. C. Koo, Y. H. Park, J. Ahn, W. R. Waters, M. V. Palmer, M. J. Hamilton, G. Barrington, A. A. Mosaad, K. T.Park, W. K. Jung, I. Y. Hwang, S. N. Cho, S. J. Shin, W. C. Davis // Journal of clinical microbiology.- 2005.- V. 43. - N. 9.- P. 4498–4506. 162. Kothadia, S. N. Evaluation of direct microscopy as a screening test in the diagnosis of pulmonary tuberculosis / S. N. Kothadia, S. Deshmukh, A. M. Saoji // Indian J Pathol Microbiol. - 1990.- V. 33. - P. 68–73. 184 163. Kulshrestha, A. Expression and purifcation of recombinant antigens of Mycobacterium tuberculosis for application in serodiagnosis / A. Kulshrestha, A. Gupta, N. Verma, S. K. Sharma, A. K. Tyagi, V. K. Chaudhary // Protein expression and purification. – 2005. – N. 44. – P. 75–85. 164. Kumar, G. Whole cell & culture filtrate proteins from prevalent genotypes of Mycobacterium tuberculosis provoke better antibody & T cell response than laboratory strain H37Rv / G. Kumar, H. Shankar, M. Chahar, P. Sharma, V. S. Yadav, D. S. Chauhan, V. M. Katoch, B. Josh // Indian. J. Med. Res. - 2012. - V. 135. - P. 745-755. 165. Kumar, G. Serodiagnostic efficacy of Mycobacterium tuberculosis 30/32-kDa mycolyl transferase complex, ESAT-6, and CFP-10 in patients with active tuberculosis / G. Kumar, P. K. Dagur, B. Joshi // Arch of immunology and experimental therapy. - 2010. – V. 58. - N. 1. – P. 57-65. 166. Kunnath-Velayudhan, S. Dynamic antibody responses to the Mycobacterium tuberculosis proteome / S. Kunnath-Velayudhan, H. Salamon, H. Y. Wang, A. L. Davidow, D. M. Molina, V. T. Huynh, D. M. Cirillo, G. Michel, E. A. Talbot, M. D. Perkins, P. L. Felgner, X. Liang, M. L. Gennaro // PNAS.– 2010. - V. 107. - N. 33. – P. 14703–14708. 167. Kunter, E. The value of pleural fluid anti-A60 IgM in BCG vaccinated tuberculous pleurisy patients / E. Kunter, K. Cerrahoglu, A. Ilvan, T. Isitmangil, O. Turken, O. Okutan, Z. Kartaloglu, S. Cavuslu // Clin. Microbiol. Infect.- 2003.- V. 9.- N. 3. P. 212-220. 168. Kurian, S. M. Immune response to Mycobacterium tuberculosis culture filtrate antigen in cured spinal tuberculosis patients and their spouses / S. M. Kurian, P. Selvaraj, A. M. Reetha, N. Charles, A. A. Mathan, P. R. Naryanan // Ind. J. Tub. 2001.- V.48. - N. 3. - P. 3-7. 169. Laal, S. Surrogate marker of preclinical tuberculosis in human immunodeficiency virus infection: antibodies to an 88-kDa secreted antigen of Mycobacterium tuberculosis / S. Laal, K. M. Samanich, M. G. Sonnenberg, J. T. Belisle, J. 185 O'Leary, M. S. Simberkoff, S. Zolla-Pazner // J. Infect. Dis. - 1997. - V.176. - P. 133–143. 170. Laal, S. Human humoral responses to antigens of Mycobacterium tuberculosis: immunodominance of high-molecular-mass antigens / S. Laal, K. M. Samanich, M. G. Sonnenberg, S. Zolla-Pazner, J. M. Phadtare, J. T. Belisle // Clinical and diagnostic laboratory immunology. - 1997. -V. 4. - N. 1. - P. 49–56. 171. Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4 / U. K. Laemmli // Nature.- 1970. - V.227. - P. 680–685. 172. Lalvani, A. Rapid detection of Mycobacterium tuberculosis infection by enumeration of antigen-specific T cells / A. Lalvani, A. A. Pathan, H. McShane, R. J. Wilkinson, M. Latif, C. P. Conlon, G. Pasvol, A.V. Hill // Am. J. Respir. Crit. Crit. Care Med. - 2001.- V.163. - P. 824-828. 173. Landowski, C. P. Combinatorial use of antibodies to secreted mycobacterial proteins in a host immune system-independent test for tuberculosis / C. P. Landowski, H. P. Godfrey, S. I. Bentley-Hibbert, X. Liu, Z. Huang, R. Sepulveda, K. Huygen, M. L. Gennaro, F. H. Moy, S. A. Lesley, M. Haak-Frendscho // Journal of clinical microbiology.- 2001. - V. 39. - N. 7. - P. 2418–2424. 174. Lang, М. Do CD1-restricted T cells contribute to antibody-mediated immunity against Mycobacterium tuberculosis? / М. Lang, A. Glatman-Freedman // Infect. Immun. – 2006. - V. 74. - N. 2 - P. 803-809. 175. Langermansa, J. A. M. Protection of macaques against Mycobacterium tuberculosis infection by a subunit vaccine based on a fusion protein of antigen 85B and ESAT-6 / J. A. M. Langermansa, T. M. Doherty, R. A. W. Vervenne, T. van der Laan, K. Lyashchenko, R. Greenwald, E. M. Agger, C. Aagaard, H. Weiler, D. van Soolingen, W. Dalemans, A. W. Thomas, P. Andersen // Vaccine. 2005. – V. 3 – P. 2740–2750. 176. Lara, M. Expression, secretion, and glycosylation of the 45- and 47-kDa glycoprotein of Mycobacterium tuberculosis in Streptomyces lividans / M. Lara, L. Servı´n-Gonza´lez, M. Singh, C. Moreno, I.Cohen, M. Nimtz, C. Espitia // Applied and environmental microbiology. - 2004. - V. 70. - N. 2. - P. 679–685. 186 177. Laszlo, A. Evaluation of synthetic pseudo cord-factor-like glycolipids for the serodiagnosis of tuberculosis / A. Laszlo, H. H. Baer, M. B. Goren, V. Handzel, L. Barrera, I. N. de Kantor // Res. Microbiol.- 1992. – V. 143. - N. 2. – P. 217-223. 178. Lawn, S. D. Evaluation of a commercial immunodiagnostic kit incorporating lipoarabinomannan in the serodiagnosis of pulmonary tuberculosis in Ghana / S. D. Lawn, E. H. Frimpong, E. Nyarko // Trop. Med. Int. Health. - 1997. –V. 2. - P. 978–981. 179. Lee, J. S. Diagnosis of pulmonary tuberculosis using MTB12 and 38-kDa antigens / J. S. Lee, E. K. Jo, C. H. Song // Respirology. - 2008. - V.13. - P. 432–437. 180. Lenka, M. Changes in avidity and level of immunoglobulin G antibodies to Mycobacterium tuberculosis in sera of patients undergoing treatment for pulmonary tuberculosis / M. Lenka, P. Arias-Bouda, S. Kuijper, A. Van Der Werf, L. N. Nguyen, H. M. Jansen, A. H. J. Kolk // Clinical and vaccine immunology. 2003. - V. 10. - N. 4. - P. 702-709. 181. Lew, J. M. TubercuList - 10 years after / J. M. Lew, A. Kapopoulou, L. M. Jones, S. T. Cole // Tuberculosis (Edinb). - 2011. - V. 91. - N. 1. - P. 1-7. 182. Li, Z. Low-temperature increases the yield of biologically active herring antifreeze protein in Pichia pastoris / Z. Li, F. Xiong, Q. Lin, M. d'Anjou, A. J. Daugulis, D. S.C. Yang, C. L. Hew. // Protein expression and purification. - 2001. - V. 21. - N. 3. - P. 438–445. 183. Lienhardt, C. Active tuberculosis in Africa is associated with reduced Th1 and increased Th2 activity in vivo / C. Lienhardt, A. Azzurri, A. Amedei, K. Fielding, J. Sillah, O. Y. Sow, B. Bah, M. Benagiano, A. Diallo, R. Manetti, K. Manneh, P. Gustafson, S. Bennett, M. M. D'Elios, K. McAdam, G. Del Prete // Eur. J. Immunol. - 2002. - V. 32.- P. 1605-1613. 184. Lim, J. H. Purification and immunoreactivity of three components from the 30 ∕ 32-kilodalton antigen 85 complex in Mycobacterium tuberculosis / J. H. Lim , J. K. Park , E. K. Jo // Infect. Immun.- 1999. - V. 67. - P. 6187–6190. 185. Liu, C.-F. Bacterial protein-O-mannosylating enzyme is crucial for virulence of Mycobacterium tuberculosis / C.-F. Liu, L. Tonini, W. Malaga, M. Beau, A. Stella, 187 D. Bouyssié, M. C. Jackson, J. Nigou, G. Puzo, C. Guilhot, O. Burlet-Schiltz, M. Rivièrea // PNAS. - 2013. - V. 110. - N. 16. - P. 6560–6565. 186. Liu, S. A novel fusion protein-based indirect enzyme-linked immunosorbent assay for the detection of bovine tuberculosis / S. Liu, S. Guo, C. Wang, M. Shao, X. Zhang, Y. Guo, Q. Gong // Tuberculosis. - 2007. - V. 87. - P. 212–217. 187. Lodes, M. J. Serological expression cloning and immunological evaluation of Mtb48, a novel Mycobacterium tuberculosis antigen / M. J. Lodes, D. C. Dillon, R. Mohamoth, C. H. Day, D. R. Benson, L. D. Reynolds, P. D. McNeill, D. P. Sampaio, Y. A. W. Skeiky, R. Badaro, D. H. Persing, S. G. Reed, R. L. Houghton // Journal of clinical microbiology. - 2001.- V. 39. - N. 7. - P. 2485–2493. 188. Lopez, Y. Induction of a protective response with an IgA monoclonal antibody against Mycobacterium tuberculosis 16 kDa protein in a modell of progresive pulmonary infection / Y. López, D. Yero, G. Falero-Diaz, N. Olivares, M. E. Sarmiento, S. Sifontes, R. L. Solis, J. A. Barrios, D. Aguilar, R. Hernández-Pando, A. Acosta // Int. J. Med. Microbiol.- 2009. - V.15. - P. 1229–1237. 189. Louise, R. Antigen discovery and tuberculosis vaccine development in the postgenomic era / R. Louise, V.Skjøt, E. M. Agger, P. Andersen // Scand. J. Infect. Dis. - 2001. – V.33. - N.9. - P. 643-647. 190. Luh, K. T. Tuberculosis antigen A60 serodiagnosis in tuberculous infection: application in extrapulmonary and smear-negative pulmonary tuberculosis / K. T. Luh, C. J. Yu, P. C. Yang, L. N. Lee // Respirology. – 1996. – V. 1. – P. 145–151. 191. Lyashchenko, K. Heterogeneous antibody responses in tuberculosis / K. Lyashchenko, R. Colangeli, M. Houde, H. Jahdali, D. Menzies, M. L. Gennaro // Infection and immunity. – 1998. - V. 66. - N. 8. - P. 3936–3940. 192. Lyashchenko, K. P. Diversity of antigen recognition by serum antibodies in experimental bovine tuberculosis / K. P. Lyashchenko, J. M. Pollock, R. Colangeli, M. L. Gennaro // Infection and immunity. - 1998. - V. 66. - N. 11. – P. 5344–5449. 193. Macauley-Patrick, S. Heterologous protein production using the Pichia pastoris expression system / S. Macauley-Patrick, M. L. Fazenda, B. McNeil, L. M. Harvey // Yeast. – 2005. – V. 22. – P. 249–270. 188 194. Macedo, G. C. Human T cell and antibody-mediated responses to the Mycobacterium tuberculosis recombinant 85A, 85B, and ESAT-6 antigens / G. C. Macedo, A. Bozzi, H. R. Weinreich, A. Bafica, H. C. Teixeira, S. C. Oliveira // Clinical and developmental immunology. - V. 2011. - Article ID 351573. - P. 1-10. 195. Maekura, R. Clinical evaluation of rapid serodiagnosis of pulmonary tuberculosis by ELISA with cord factor (trehalose-6,6’-dimycolate) as antigen purified from Mycobacterium tuberculosis / R. Maekura, M. Nakagawa, Y. Nakamura, T. Hiraga, Y. Yamamura, M. Ito, E. Ueda, S. Yano, H. He, S. Oka, K. Kashima, I. Yano // American review of respiratory disease. - 1993. - V. 148. - N. 4. - P. 997– 1001. 196. Maekura, R. Clinical evaluation of anti-tuberculous glycolipid immunoglobulin G antibody assay for rapid serodiagnosis of pulmonary tuberculosis / R. Maekura, Y. Okuda, M. Nakagawa, T. Hiraga, S. Yokota, M. Ito, I. Yano, H. Kohno, M. Wada, C. Abe, T. Toyoda, T. Kishimoto, T. Ogura// Journal of clinical microbiology. 2001. - V. 39. - N. 10. - P. 3603–3608. 197. Maglione, P. J. How B cells shape the immune response against Mycobacterium tuberculosis / P. J. Maglione, J. Chan // Eur. J. Immunol. - 2009. - V. 39. - P.676– 686. 198. Manca. C. MTC28, a novel 28-kilodalton proline-rich secreted antigen specific for the Mycobacterium tuberculosis complex / C. Manca, K. Lyashchenko, R. Colangeli, M. L. Gennaro // Infection immunology. - 1997. – V. 65. - N. 12. - P. 4951-4957. 199. Manivannan, S. Role of complement activation andantibody in the interaction between Mycobacterium tuberculosis and human macrophages / S. Manivannan, V. N. Rao, V. D. Ramanathan // Indian. J. Exp. Biol. - 2012. – V. 50. - N. 8. - P. 542-550. 200. Mattow, J. Comparative proteome analysis of culture supernatant proteins from virulent Mycobacterium tuberculosis H37Rv and attenuated M. bovis BCG Copenhagen / J. Mattow, U. E. Schaible, F. Schmidt, K. Hagens, F. Siejak, G. 189 Brestrich, G. Haeselbarth, E. C. Miller, P. R. Jungblut, S. H. Kaufmann // Electrophoresis. – 2003. – V. 24. – P. 3405–3420. 201. Mayson, B. E. Effects of methanol concentration on expression levels of recombinant protein in fed-batch cultures of Pichia methanolica / B. E. Mayson, D. G. Kilburn, B. L. Zamost, C. K. Raymond, G. J. Lesnicki // Biotechnology and bioengineering. – 2003. – V. 81. – P. 291-298. 202. Meher, A. K. Mycobacterium tuberculosis H37Rv ESAT-6–CFP-10 complex formation confers thermodynamic and biochemical stability / A. K. Meher, N. C. Bal, K. V. R. Chary, A. Arora // FEBS journal. – 2006. - V. 273. – P. 1445–1462. 203. Meier, T. Sensitivity of a new commercial enzyme-linked immunospot assay (T SPOT-TB) for diagnosis of tuberculosis in clinical practice / T. Meier, H. P. Eulenbruch, P. Wrighton-Smith, G. Enders, T. Regnath // European journal of clinical microbiology and infectious diseases. – 2005. - V. 24. - N.8. - P. 529–536. 204. Menzies, D. Interpretation of repeated tuberculin tests. Boosting, conversion, and reversion / D. Menzies // Am. J. Respir. Crit. Care Med. – 1999. – V. 159. – P. 15– 21. 205. Mezzasoma, L. Antigen microarrays for serodiagnosis of infectious diseases / L. Mezzasoma, T. Bacarese-Hamilton, M. Di Cristina, R. Rossi, F. Bistoni, A. Crisanti // Clinical chemistry. - 2002. – V. 48. - N. 1. - P. 121–130. 206. Min, F. Serum antibody responses to 10 Mycobacterium tuberculosis proteins, purified protein derivative, and old tuberculin in natural and experimental tuberculosis in rhesus monkeys / F. Min, Y. Zhang, R. Huang, W. Li, Y. Wu, J. Pan, W. Zhao, X. Liu // Clinical and vaccine immunology. - 2011. - V. 18. - N. 12. - P. 2154–2160. 207. Minning, S. Optimization of the high-level production of Rhizopus oryzae lipase in Pichia pastoris / S. Minning, A. Serrano, P. Ferrer, C. Solá, R. D. Schmid, F. Valero // J. Biotechnol. - 2001. – V. 86. - P. 59–70. 208. Misaki, A. Structural and immunochemical studies on D-arabino-D-mannans and D-mannans of Mycobacterium tuberculosis and other mycobacterium species / A. 190 Misaki, I. Azuma, Y.Yamamura // J. Biochem. - 1977. – V. 82. - N.6.- P. 1759– 1770. 209. Mosmann, T. R. Two types of murine helper T cell clone. I. Definition according to profiles of lymphokine activities and secreted proteins / T. R. Mosmann, H. Cherwinski, M. W. Bond, M. A. Giedlin, R. L. Coffman // J. Immunol. - 1986. – V. 136. - N. 7. – P. 2348-2357. 210. Mukherjee, P. The RD1-encoded antigen Rv3872 of Mycobacterium tuberculosis as a potential candidate for serodiagnosis of tuberculosis / P. Mukherjee, M. Dutta, P. Datta, A. Dasgupta, R. Pradhan, M. Pradhan, M. Kundu, J. Basu, P. Chakrabarti // Clin. Microbiol. Infect. - 2007. - V. 13. - P. 146–152. 211. Mukherjee, S. Potential serological use of a recombinant protein that is a replica of a Mycobacterium tuberculosis protein found in the urine of infected mice / S. Mukherjee, N. Daifalla, Y. Zhang, J. Douglass, L. Brooks, T. Vedvick, R. Houghton, S. G. Reed, A. Campos-Neto // Clin. Diagn. Lab. Immunol. - 2004. -V. 11 - P. 280–286. 212. Mukhopadhyay, S. The PE and PPE proteins of Mycobacterium tuberculosis / S. Mukhopadhyay, K. N. Balaji // Tuberculosis. - 2011. - V. 91. - P. 441– 447. 213. Mustafa, A. S. Recombinant and synthetic peptides to identify Mycobacterium tuberculosis antigens and epitopes of diagnostic and vaccine relevance / A. S. Mustafa // Tuberculosis. - 2005. - V. 85. - P. 367–376. 214. Mustafa, A. S. Comparison of antigen-specific T-cell responses of tuberculosis patients using complex or single antigens of Mycobacterium tuberculosis / A. S. Mustafa, H. A. Amoudy, H. G. Wiker, A. T. Abal, P. Ravn, F. Oftung, P. Andersen // Scand. J. Immunol. - 1998. – V. 48. – P. 535–543. 215. Nakata, K. Mycobacterium tuberculosis enhances human immunodeficiency virus-1 replication in the lung / K. Nakata, W. N. Rom, Y. Honda, R. Condos, S. Kanegasaki, Y. Cao // Am. J. Respir. Crit. Care Med. - 1997. - V. 155. - P. 996– 1003. 216. Narayana, Y. Differential B-cell responses are induced by Mycobacterium tuberculosis PE antigens Rv1169c, Rv0978c, and Rv1818c / Y. Narayana, B. 191 Joshi, V. M. Katoch, K. C. Mishra, K. N. Balaji // Clinical and vaccine immunology. – 2007. - V. 14. - N. 10. - P. 1334–1341. 217. Nayak, S. Mantoux test and its interpretation / S. Nayak, B. Acharjya // Indian dermatol. online J. - 2012.- V. 3. - N. 1. – P. 2–6. 218. Neu, N. Diagnosis of pediatric tuberculosis in the modern era / N. Neu, L. Saiman, P. San Gabriel, S. Whittier, C. Knirsch, C. Ruzal-Shapiro, P. Della-Latta // Pediatr. Infect. Dis. J. - 1999. - V. 18. - P. 122–126. 219. Nguyen, T. K. A. The mycobacterial glycolipid glucose monomycolate induces a memory T cell response comparable to a model protein antigen and no B cell response upon experimental vaccination of cattle / T. K. A. Nguyen, A. Koets P., W. J. Santema, W. vanEden, V. P. M. G. Rutten, I. V. Rhijn // Vaccine. -2009. – V. 27. - N. 35. - P. 4818–4825. 220. Okkels, L. CFP10 discriminates between nonacetylated and acetylated ESAT-6 of Mycobacterium tuberculosis by differential interaction / L. Okkels, E. C. Muller, M. Schmid, I. Rosenkrands, S. H. E. Kaufmann, P. Andersen, P. R. Jungblut // Proteomics. – 2004. - V. 4. - P. 2954–2960. 221. Okkels, L. M. PPE protein (Rv3873) from DNA segment RD1 of Mycobacterium tuberculosis: strong recognition of both specific T-cell epitopes and epitopes conserved within the PPE family / L. M. Okkels, I. Brock, F. Follmann, E. M. Agger, S. M. Arend, T. H. M. Ottenhoff, F. Oftung, I. Rosenkrands, P. Andersen // Infect. Immun. – 2003. - V. 71. - P. 6116-6123. 222. Pace, C. N. How to measure and predict the molar absorption coefficient of a protein / C. N. Pace, F. Vajdos, L. Fee, G. Grimsley, T. Gray // Prorein Science. – 1995. - V. 4. – P. 2411-2423. 223. Palomino, J. C. / Palomino J. C., Leao S. C., Ritacco V. (Editors) // Tuberculosis 2007. From basic science to patient care. TuberculosisTextbook.com. - First Edition, 2007. – P. 53-230. 224. Pan, W. Fusion of two malaria vaccine candidate antigens enhances product yield, immunogenicity, and antibody-mediated inhibition of parasite growth in vitro / W. 192 Pan, D. Huang, Q. Zhang, L. Qu, D. Zhang, X. Zhang, X. Xue, F. Qian // J. Immunol. - 2004. - V. 172. - P. 6167–6174. 225. Pandhal, J. Systematic metabolic engineering for improvement of glycosylation efficiency in Escherichia coli / J. Pandhal, P. Desai, C. Walpole, L. Doroudi, D. Malyshev, P. C. Wright // Biochemical and biophysical research communications. - 2012. - V. 419. - P. 472–476. 226. Pandhal, J. Inverse metabolic engineering to improve Escherichia coli as an Nglycosylation host / J. Pandhal, L. B. A. Woodruff, S. Jaffe, P. Desai, S. Y. Ow, J. Noirel, R. T. Gill, P. C. Wright // Biotechnol. Bioeng. - 2013. - V. 110. - P. 2482– 2493. 227. Papiha, S. S. HLA and circulating immunoglobulin levels in Indian patients with pulmonary tuberculosis / S. S. Papiha, J. Wentzel, F. Behjati, S. S. Agarwal // Tubercle. – 1985. - V. 66. - P. 25-33. 228. Paquin, P. Further report of cases treated with anti-tubercle serum / P. Paquin // JAMA. – 1897. - V. 29. - P. 98–99. 229. Pethe, K. The heparin-binding hemagglutinin of M. tuberculosis is required for extrapulmonary dissemination / K. Pethe, S. Alonso, F. Biet, G. Delogu, M. J. Brennan, C. Locht, F. D. Menozzi // Nature. – 2001.- V. 412. - P. 190–194. 230. Phuah, J. Y. Activated B cells in the granulomas of nonhuman primates infected with Mycobacterium tuberculosis / J. Y. Phuah, J. T. Mattila, P. L. Lin, J. L. Flynn // Am. J. Pathol. - 2012. – V. 181. - P. 508–514. 231. Pichia expression kit: a manual of methods for the expression of recombinant proteins in Pichia pastoris// Invitrogen. Catalog no. K1710–01. – P. 1-68. 232. Planatscher, H. Systematic reference sample generation for multiplexed serological assays / H. Planatscher, S. Rimmele, G. Michel, O. Po¨tz, T. Joos, N. Schneiderhan-Marra // Scientific reports. - 2013. - V. 3. - N. 3259. - P. 1-5. 233. Platt, L. HIV in the European region: using evidence to strengthen policy and programs / L. Platt, E. Jolley, V. Hope, A. Latypov, F. Hickson, L. Reynolds, T. Rhodes // Human development sector dept. Policy brief. - Washington D. C.: World Bank, 2013. 193 234. Porsa, E. Comparison of a new ESAT-6/CFP-10 peptide-based gamma interferon assay and a tuberculin skin test for tuberculosis screening in a moderate-risk population / E. Porsa, L. Cheng, M. M. Seale, G. L. Delclos, X. Ma, R. Reich, J. M. Musser, E. A. Graviss // Clinical and vaccine immunology. – 2006. - V. 13. N. 1. - P. 53–58. 235. Pospelov, L. E. Genetic HLA markers associated with pulmonary tuberculosis in the Barum-Khemchiksky District, Republic of Tyva / L. E. Pospelov, A. G. Matrakshin, A. F. Malenko, I. G. Udina; V. I. Gergert; A. L. Pospelov; M. M. Kyzyl-ool; A. A. Zhachin // Problems of tuberculosis and pulmonary diseases. – 2007. - V. 6. - P. 62–64. 236. Pottumarthy, S. A comparison of seven tests for serological diagnosis of tuberculosis / S. Pottumarthy, V. C. Wells, A. J. Morris // Journal of clinical microbiology. - 2000. - V. 38. - N. 6. - P. 2227–2231. 237. Prasad, G. B. K. S. Immunoprophylactic mechanisms of glycolipid antigens in tuberculosis / G. B. K. S. Prasad, P. S. Bisen, N. J. Zacharia, R. Dubey, R. P. Tiwari // Advances in biomedical research. - 2010. – V. 1. - P. 407-416. 238. Rabahi, M. F. Humoral response to HspX and GlcB to previous and recent infection by Mycobacterium tuberculosis / M. F. Rabahi, A. P. Junqueira-Kipnis, M. C. Dos Reis, W. Oelemann, M. B. Conde // BMC Infect Dis. - 2007. - V. 7. - P. 148. 239. Radhakrishnan, V. V. Diagnostic significance of circulating immune complexes in patients with pulmonary tuberculosis / V. V. Radhakrishnan, A. Mathai, P. Sundaram // J. Med. Microbiol. - 1992. - V. 36. – P. 128-131. 240. Raja, A. Immunology of tuberculosis. Review article / A. Raja // Indian J. Med. Res. - 2004. – V. 120. – P. 213-232. 241. Raja, A. Improved diagnosis of pulmonary tuberculosis by detection of antibodies against multiple Mycobacterium tuberculosis antigens / A. Raja, U. D. Ranganathan, R. Bethunaickan // Diagnostic microbiology and infectious disease. 2008. - V. 60. – P. 361–368. 194 242. Raja, A. Characterization of mycobacterial antigens and antibodies in circulating immune complexes from primary tuberculosis / A. Raja, P. R. Narayanan, R. Mathew, R. Prabhakar // Lab. Clin. Med. - 1995. – V. 5. - P. 581–587. 243. Raju, R. Diagnostic role of the antibody response to the 38 kDa, 16 kDa proteins and lipoarabinomannan of Mycobacterium tuberculosis / R. Raju, S. Suneetha, K. Sagili, M. C. Vani, V. Saraswathi, A. V. Satyanarayana, L. M. Suneetha // Indian journal of clinical biochemistry. - 2005. – V. 20. - N. 1. – P. 123-128. 244. Raqib, R. Detection of antibodies secreted from circulating Mycobacterium tuberculosis-specific plasma cells in the diagnosis of pediatric tuberculosis / R. Raqib, D. Mondal, M. A. Karim, F. Chowdhury, S. Ahmed, S. Luby, A. Cravioto, J. Andersson, D. Sack // Clinical and vaccine immunology. – 2009. - V. 16. - N. 4. - P. 521–527. 245. Raqib, R. Rapid diagnosis of active tuberculosis by detecting antibodies from lymphocyte secretions / R. Raqib, J. Rahman, A. K. M. Kamaluddin, S. M. M. Kamal, F. A. Banu, S. Ahmed, Z. Rahim, P. K. Bardhan, J. Andersson, D. A. Sack // The journal of infectious diseases. - 2003. - V. 188. - P. 364–70. 246. Ratanasuwan, W. Evaluation of the MycoDot test for the diagnosis of tuberculosis in HIV seropositive and seronegative patients / W. Ratanasuwa, J. K. Kreiss, C. M. Nolan, B. A. Schaeffler, S. Suwanagool, S. Tunsupasawasdikul, C. Chuchottaworn, W. Dejsomritrutai, H. M. Foy // Int. J. Tuberc. Lung. Dis. - 1997.V. 1. – P. 259–264. 247. Ravn, P. Prospective evaluation of a whole-blood test using Mycobacterium tuberculosis-specific antigens ESAT-6 and CFP-10 for diagnosis of active tuberculosis / P. Ravn, M. E. Munk, A. B. Andersen, B. Lundgren, J. D. Lundgren, L. N. Nielsen, A. Kok-Jensen, P. Andersen, K. Weldingh // Clin. Diagn. Lab. Immunol. - 2005. - V. 12. - N. 4. - P. 491–496. 248. Rekha, R. S. Validation of the ALS assay in adult patients with culture confirmed pulmonary tuberculosis / R. S. Rekha, S. M. M. Kamal, P. Andersen, Z. Rahim, I. Hoq, G. Ara, J. Andersson, D. Sack, R. Raqib // PLoS ONE. - 2011. - V. 6. - N. 1. - e16425. 195 249. Romanos, M. A. Foreign gene expression in yeast: a review / M. A. Romanos, C. A. Scorer, I. J. Clare // Yeast. - 1992. - V. 8. - P. 423-488. 250. Rosenkrandsa, I. Identification of Rv0222 from RD4 as a novel serodiagnostic target for tuberculosis / I. Rosenkrandsa, C. Aagaard, K. Weldingh, I. Brock, M. H. Dziegiel, M. Singh, S. Hoffa, P. Ravne, P. Andersen // Tuberculosis. - 2008. - V. 88. - P. 335–343. 251. Roupie, V. Immunogenicity of eight dormancy (DosR) regulon encoded proteins of Mycobacterium tuberculosis in DNA vaccinated and TB infected mice / V. Roupie, M. Romano, L. Zhang, H. Korf, M. Young, L. Kees, L. M. C. Franken, T. H. M. Ottenhoff, M. R. Klein, K. Huygen // Infection and immunity. - 2007. – V. 75. - N. 2. - P. 941-949. 252. Rudnev, S. G. On the relative risk concept and TB morbidity in Russia: linking population genetics and epidemiological studies / S. G. Rudnev, R. P. Selitskaya, M. N. Boldyreva // Russ. J. Numer. Anal. Math. Modelling. – 2009. - V. 24. - N. 4. - P. 377–384. 253. Sachan, A. S. Diagnostic significance of antigen A - 60 by ELISA test in pulmonary tuberculosis / A. S. Sachan, R. K. Gupta, D. Gupta, K. D.Gautam // Ind. J. Tub. - 1994. - V. 4. - P. 239-244. 254. Sack, D. A. Use of antibodies from lymphocyte secretion to diagnose active infection / D. A.Sack, R. Raquib // United States Patent. Patent No: US7638271 B2. Patent date: Dec. 29, 2009. 255. Sada, E. Detection of lipoarabinomannan as a diagnostic test for tuberculosis / E. Sada, D. Aguilar, M. Torres, T. Herrera // Journal of clinical microbiology. – 1992. - V. 30. - N. 9. - P. 2415-2418. 256. Salamin, K. Secretion of an endogenous subtilisin by Pichia pastoris strains GS115 and KM71 / K. Salamin, D. Sriranganadane, B. Le´chenne, O. Jousson, M. Monod // Applied and environmental microbiology. - 2010. - V. 76. - N. 13. - P. 4269–4276. 196 257. Samanich, K. Homogeneity of antibody responses in tuberculosis patients infection and immunity / K. Samanich, J. T. Belisle, S. Laal // Infection and immunity. – 2001. - V. 69. - P. 4600–4609. 258. Samanich, K. M. Delineation of human antibody responses to culture filtrate antigens of Mycobacterium tuberculosis / K. M. Samanich, J. T. Belisle, M. G. Sonnenberg, M. A. Keen, S. Zolla-Pazner, S. Laal // The journal of infectious diseases. - 1998. - V. 178. - P. 1534–1538. 259. Samanich, K. M. Serodiagnostic potential of culture filtrate antigens of Mycobacterium tuberculosis / K. M. Samanich, M. A. Keen, V. D. Vissa, J. D. Harder, J. S. Spencer, J. T. Belisle, S. Zolla-Pazner, S. Laal // Clin. Diagn.Lab. Immunol.- 2000. – V. 7. - N. 4. - P. 662–668. 260. Samten, B. Mycobacterium tuberculosis ESX-1 system-secreted protein ESAT-6 but not CFP10 inhibits human T-cell immune responses / B. Samten, X. Wang, P. F. Barnes // Tuberculosis. – 2009. – V. 89. - Suppl 1:S74-6. 261. Sánchez-Rodríguez, C. An IgG antibody response to the antigen 85 complex is associated with good outcome in Mexican Totonaca Indians with pulmonary tuberculosis / C. Sánchez-Rodríguez, C. Estrada-Chávez, J. García-Vigil, F. Laredo-Sánchez, J. Halabe-Cherem, A. Pereira-Suárez, R. Mancilla // Int. J. Tuberc. Lung. Dis. – 2002. - V. 6. - N. 8. -P. 726-712. 262. Saxena, U. Antigenic epitopes on Mycobacterium tuberculosis recognized by antibodies in tuberculosis and mouse antisera / U. Saxena, R. K. Saxena // FEMS Microbiol. Immunol. – 1991. - V. 76. - P. 7–12. 263. Selma, W. B. Rapid detection of immunoglobulin G against Mycobacterium tuberculosis antigens by two commercial ELISA kits / W. B. Selma, H. Harizi, M. Marzouk, I. Ben Kahla, F. Ben Lazreg, A. Ferjeni, I. Harrabi, A. Abdelghani, M. Ben Said, J. Boukadida // Int. J. Tuberc. Lung. Dis. - 2010. – V. 14. - N. 7. - P. 841–846. 264. Selvaraj, P. Role of human leucocyte antigen (HLA) and non-HLA genes in susceptibility or resistance to pulmonary tuberculosis leading article / P. Selvaraj // Ind. J. Tub. – 2000. - V. 47. - P. 133. 197 265. Selvaraj, P. HLA-DR phenotypes and IgG, IgA and IgM antibody responses to Mycobacterium tuberculosis culture filtrate and 30 kDa antigens in pulmonary tuberculosis / P. Selvaraj, A. Raja, S. M. Kurian, K. R. Uma Devi, P. R. Narayanan // Current science. - 2004. – V. 87. - N. 6. - P. 771-775. 266. Selvaraj, P. Influence of HLA-DR2 phenotype on humoral immunity and lymphocyte response to Mycobacterium tuberculosis culture filtrate antigens in pulmonary tuberculosis. / P. Selvaraj, H. Uma, A. M. Reetha, T. Xavier, R. Prabhakar, P. R. Narayanan // Indian journal of medical research. - 1998. – V. 107. - P. 208-217. 267. Senol, G. Humoral immune response against 38-kDa and 16-kDa mycobacterial antigens in tuberculosis / G. Senol, O. F. Erer, Y. A. Yalcin, M. Coskun, A. T. Gu¨ndu¨z, C. Bicmen., M. Ertas, S. A. O¨zkan // Eur. Respir. J. -2007. - V. 29. P. 143–148. 268. Sester, M. Interferon-gamma release assays for the diagnosis of active tuberculosis: a systematic review and meta-analysis / M. Sester, G. Sotgiu, C. Lange, C. Giehl, E.Girardi, G. B. Migliori, A. Bossink, K. Dheda, R. Diel, J. Dominguez, M. Lipman, J. Nemeth, P. Ravn, S. Winkler, E. Huitric, A. Sandgren, D. Manissero // Eur. Respir. J. - 2011. - V. 37. - P. 100-111. 269. Shen, G. Peptide-based antibody detection for tuberculosis diagnosis / G. Shen, D. Behera, M. Bhalla, A. Nadas, S. Laal // Clinical and vaccine immunology. - 2009. V. 16. - N. 1. - P. 49–54. 270. Shin, A. R. Improved sensitivity of diagnosis of tuberculosis in patients in Korea via a cocktail enzyme-linked immunosorbent assay containing the abundantly expressed antigens of the K strain of Mycobacterium tuberculosis / A. R. Shin, S. J. Shin, K. S. Lee, S.-H. Eom, S.-S. Lee, B.-S. Lee, J.-S. Lee, S. N. Cho, H.-J. Kim // Clinical and vaccine immunology. - 2008. - V. 15. - N. 12. - P. 1788–1795. 271. Shiratori, B. Understanding tuberculosis - global experiences and innovative approaches to the diagnosis. Chapter 17. Immunological diagnosis of active and latent tuberculosis. Edited by Dr. P.-J. Cardona / B. Shiratori, H. Saitoh, U. R. Siddiqi, J. Zhao, H. Chagan-Yasutan, M. Usuzawa, C. Nakajima, Y. Suzuki, T. 198 Hattori // Published online. Available at www.intechopen.com – 2012. –P. 353378. 272. SignalP 3.0 server //available at www.cbs.dtu.dk/services/SignalP-3.0. 273. Yan, L. Heterologous expression of Mycobacterium tuberculosis Ag85B in Pichia pastoris / L. Yan, P. Jian-Hong, M. Li-Xin, J. Wep, Q. Xue-Ju, L. Jun-Yan // Wuhan university journal of natural science. – 2005. - V. 10. - P. 602-606. 274. Silva, V. M. Factors associated with humoral response to ESAT-6, 38 kDa and 14 kDa in patients with a spectrum of tuberculosis / V. M. Silva, G. Kanaujia, M. L. Gennaro, D. Menzies // Int. J. Tuberc. Lung. Dis. - 2003. - V. 7. - N. 5. - P. 478484. 275. Simonney, N. B-cell immune responses in HIV positive and HIV negative patients with tuberculosis evaluated with an ELISA using a glycolipid antigen / N. Simonney, P. Chavanet, C. Perronne // Tuberculosis. - 2007. - V. 87. – P. 109–122. 276. Simonney, N. Analysis of circulating immune complexes (CICs) in childhood tuberculosis: levels of specific antibodies to glycolipid antigens and relationship with serum antibodies / N. Simonney, A. Bourrillon, P. H. Lagrange // Int. J. Tuberc. Lung. Dis. - 2000. – V. 4. - P. 152–160. 277. Šimundić, A. M. Measures of diagnostic accuracy: basic definitions / A. M. Šimundić // The journal of the international federation of clinical chemistry and laboratory medicine. - 2008. - V. 19. - N. 4. - P. 1-9. 278. Singh, K. K. Antigens of Mycobacterium tuberculosis recognized by antibodies during incipient, subclinical tuberculosis / K. K. Singh, Y. Dong, J. T. Belisle, J. Harder, V. K. Arora, S. Laal // Clinical and diagnostic laboratory immunology. – 2005. – V. 12. - N. 2. - P. 354-358. 279. Singh, K. K. Combined use of serum and urinary antibody for diagnosis of tuberculosis / K. K. Singh, Y. Dong, L. Hinds, M. A. Keen, J. T. Belisle, S. ZollaPazner, J. M. Achkar, A. J. Nadas, V. K. Arora, S. Laal // J. Infect. Dis. - 2003. – V. 188. - N. 3. - P. 371-377. 280. Sinha, J. Causes of proteolytic degradation of secreted recombinant proteins produced in methylotrophic yeast Pichia pastoris: case study with recombinant 199 ovine interferon-T / J. Sinha, B. A. Plantz, M. Inan, M. M. Meagher // Biotechnology and bioengineering. -2005. - V. 89. - N. 1. - P. 102-112. 281. Sinha, J. Improved production of recombinant ovine interferon-γ by Mut+ strain of Pichia pastoris using an optimized methanol feed profile / J. Sinha, B. A. Plantz, W. Zhang, M. Gouthro, V. Schlegel, C. P. Liu, M. M. Meagher // Biotechnol. Prog. - 2003. – V. 19. - P. 794–802. 282. Skeiky, Y. A. Non-clinical efficacy and safety of HyVac4:IC31 vaccine administered in a BCG prime-boost regimen / Y. A. Skeiky, J. Dietrich, T. M. Lasco, K. Stagliano, V. Dheenadhayalan, M. A. Goetz, L. Cantarero, R. J. Basaraba, P. Bang, I Kromann, J. B. McMclain, J. C. Sadoff, P. Andersen // Vaccine. – 2010. - V. 28. - P. 1084–1093. 283. Smith, G. T. O-linked glycosylation sites profiling in Mycobacterium tuberculosis culture filtrate proteins / G. T. Smith, M. J. Sweredoski, S. Hess // J. Proteomics. 2014. – V. 97. – P. 296-306. 284. Smith, K. C. Detection of Mycobacterium tuberculosis in clinical specimens from children using a polymerase chain reaction / K. C. Smith, J. R. Starke, K. Eisenach, L. T. Ong, M. Denby // Pediatrics. - 1996. - V. 97. - P. 155–160. 285. Somi, G. R. Evaluation of the MycoDot test in patients with suspected tuberculosis in a field setting in Tanzania / G. R. Somi, R. J. O’Brien, G. S. Mfinanga, Y. A. Ipuge // Internetional journal of tuberculosis and lung diseases. – 1999. – V. 3. - P. 231–238. 286. Souza, G. A. Using a label-free proteomics method to identify differentially abundant proteins in closely related hypo- and hypervirulent clinical Mycobacterium tuberculosis Beijing isolates / G. A. Souza, S. Fortuin, D. Aguilar, R. H. Pando, C. R. E. McEvoy, P. D. van Helden, C. J. Koehler, B. Thiede, R. M. Warren, H. G. Wiker // Mol. Cell Proteomics. - 2010. - V. 9. – P. 2414-2423. 287. Souza, G. A. Bacterial proteins with cleaved or uncleaved signal peptides of the general secretory pathway / G. A. Souza, N. A. Leversen, H. Målen, H. G. Wiker // Journal of proteomics. – 2011. - V. 75. - N. 2. - P. 502–510. 200 288. Souza, I. IF. Screening of recombinant proteins as antigens in indirect ELISA for diagnosis of bovine tuberculosis / I. IF. Souza, E. S. Melo, C. A. Ramos, T. A. Farias, A. L. Osório, K. S. Jorge, C. E. Vidal, A. S. Silva, M. R. Silva, A. O. Pellegrin, F. R. Araújo // SpringerPlus. - 2012. - V. 1. - N. 77. - P. 1-6. 289. Sreekrishna, K. Strategies for optimal synthesis and secretion of heterologous proteins in the methylotrophic yeast Pichia pastoris / K. Sreekrishna, R. G. Brankamp, K. E. Kropp, D. T. Blankenship, J. T. Tsay, P. L. Smith, J. D. Wierschke, A. Subramaniam, L. A. Birkenberger // Gene. - 1997. - V. 190. - N. 1. P. 55-62. 290. Sriram, U. HLA-DR2 subtypes & immune responses in pulmonary tuberculosis / U. Sriram, P. Selvaraj, S. M. Kurian, A. M. Reetha, P. R. Narayanan // Indian. J. Med. Res. - 2001. – V. 113. - P. 117-124. 291. Srivastava, S. K. A. 16 kDa heat shock protein from heat-inactivated Mycobacterium tuberculosis is a homodimer – suitability for diagnostic applications with specific llama VHH monoclonals / S. K. Srivastava, V. J. B. Ruigrok, N. J. Thompson, A. K. Trilling, A. J. R. Heck, C. van Rijn, J. Beekwilder, M. Jongsma // PLOS ONE. - 2013. – V. 8. - N. 5. - e64040. 292. Steingart, K. R. Serological tests for the diagnosis of active tuberculosis: relevance for India. Review article / K. R. Steingart, A. Ramsay, D. W. Dowdy, M. Pai // Indian. J. Med. Res. - 2012. – V. 135. - P. 695-702. 293. Stratton, J. High cell-density fermentation. In Higgins DR & Cregg JM (eds) Pichia Protocols / J. Stratton, V. Chiruvolu, M. Meagher // Humana Press, Totowa (New Jersey). - 1998. - P. 107–120. 294. Succi, M. The challenge of diagnosing tuberculosis in children / M. Succi // Rev. Paul. Pediatr. – 2014. – V. 32. - N. 1. – P. 2-3. 295. Sutcliffe, I. C. Lipoproteins of Mycobacterium tuberculosis: an abundant and functionally diverse class of cell envelope components / I. C. Sutcliffe, D. J. Harrington // FEMS Microbiology Reviews. – 2004. – V. 28. - P. 645–659. 296. Syed Ahamed Kabeer, B. Role of interferon gamma release assay in active tb diagnosis among HIV infected individuals / B. Syed Ahamed Kabeer, R. 201 Sikhamani, S. Swaminathan, V. Perumal, P. Paramasivam, A. Raja // PLOS ONE – 2009. - V. 4. - N . 5. - e5718. 297. Takahashi, K. Effects of site-directed mutagenesis in the cysteine residues and the N-glycosylation motif in recombinant Der f 1 on secretion and protease activity / K. Takahashi, T. Takai, T. Yasuhara, T. Yokota, Y. Okumura // Int. Arch. Allergy Immunol. - 2001. - V. 124. - N. 4. - P. 454-460. 298. Teixeira, H. C. Immunological diagnosis of tuberculosis: problems and strategies for success / H. C. Teixeira, C. Abramo, M. E. Munk // J. Bras. Pneumol. – 2007. V. 33. - N. 3. - P. 323-334. 299. Tessema, T. A. Circulating antibodies to lipoarabinomannan in relation to sputum microscopy, clinical features and urinary anti-lipoarabinomannan detection in pulmonary tuberculosis / T. A. Tessema, G. Bjune, B. Hamasur, S. Svenson, H. Syre, B. Bjorvatn // Scand. J. Infect. Dis. - 2002. - V. 34. - N. 2. - P. 97-103. 300. Tessema, T. A. Diagnostic evaluation of urinary lipoarabinomannan at an Ethiopian tuberculosis centre / T. A. Tessema, B. Hamasur, G. Bjune, S. Svenson, B. Bjorvatn // Scand. J. Infect. Dis. - 2001. - V. 33. - N. 4. - P. 279-284. 301. The ELISA Guidebook / Edited by J. R. Crowther // Springer. - 2000. – 436 p. 302. The new profile of drug-resistant tuberculosis in Russia: a global and local perspective: summary of a joint workshop. Drug-resistant tuberculosis in the Russian Federation // Institute of medicine of the national academies and Russian academy of medical science. - Washington D. C.: National academies press, 2011. – P. 29-37. 303. Tiwari, R. P. Glycolipids of Mycobacterium tuberculosis strain H37Rv are potential serological markers for diagnosis of active tuberculosis / R. P. Tiwari, D. Tiwari, S. K. Garg, R. Chandra, P. S. Bisen // Clinical and diagnostic laboratory immunology. - 2005. - V. 12. - N. 3. - P. 465–473. 304. Tong, М. A multiplexed and miniaturized serological tuberculosis assay identifies antigens that discriminate maximally between TB and non-TB sera / М. Tong, C. E. Jacobi, F. M. van de Rijke, S. Kuijper, S. van de Werken, T. L. Lowary, C. H. Hokke, B. J. Appelmelk, N. J. D. Nagelkerke, H. J. Tanke, R. P. M. van Gijlswijk, 202 J. Veuskens, A. H. J. Kolk, A. K. Raap // Journal of immunological methods. – 2005. – V. 301. - N. 1-2. - P. 154–163. 305. Trajman, A. Interferon-gamma release assays versus tuberculin skin testing for the diagnosis of latent tuberculosis infection: an overview of the evidence / A. Trajman, R. E. Steffen, D. Menzies // Pulmonary medicine. – 2013. - Article ID 601737. - P. 1-11. 306. Ulrichs, T. Human tuberculous granulomas induce peripheral lymphoid folliclelike structures to orchestrate local host defense in the lung / T. Ulrichs, G. A. Kosmiadi, V. Trusov, S. Jorg, L. Pradl, M. Titukhina, V. Mishenko, N. Gushina, S. H. Kaufmann // J. Pathol. - 2004. - V. 204. - P. 217–228. 307. Ulstrup, J. C. Relationship of secretion pattern and MPB70 homology with osteoblast-specific factor 2 to osteitis following Mycobacterium bovis BCG vaccination / J. C. Ulstrup, S. Jeansson, H. G. Wiker, M. Harboe // Infection and immunity. – 1995. - V. 63. - N. 2. - P. 672–675. 308. Uma Devi, K.R. Antibody response to Mycobacterium tuberculosis 30 and 16 kDa antigens in pulmonary tuberculosis with human immunodeficiency virus coinfection / K. R. Uma Devi, B. Ramalingam, A. Raja // Diagnostic microbiology and infectious disease. - 2003.- V. 46. – P. 205–209. 309. Uma Devi, K. R. Specific and early detection of IgG, IgA and IgM antibodies to Mycobacterium tuberculosis 38kDa antigen in pulmonary tuberculosis / K. R. Uma Devi, B. Ramalingam, P. J. Brennan, P. R. Narayanan, A. Raja // Tuberculosis (Edinb). – 2001. - V. 81. - P. 249–253. 310. Uma, H. Antibody and lymphocyte responses to Mycobacterium tuberculosis culture filtrate antigens in active and quiescent (cured) pulmonary tuberculosis / H. Uma, P. Selvaraj, A. M. Rectha, T. Xavier, R. Prabhakar, P. R. Narayanan // Ind. J. Tub. - 1999. - V. 46. - P. 21. 311. Valderrama-Rincon, J. D. An engineered eukaryotic protein glycosylation pathway in Escherichia coli / J. D. Valderrama-Rincon, A. C. Fisher, J. H. Merritt, Y. Y. Fan, C. A. Reading, K. Chhiba, C. Heiss, P. Azadi, M. Aebi, M. P. DeLisa // Nat. Chem. Biol. - 2012. – V. 8. - N. 5. - P. 434-436. 203 312. Vallie`re, S. Enhancement of innate and cell-mediated immunity by antimycobacterial antibodies / S. de Vallie`re, G. Abate, A. Blazevic, R. M. Heuertz, D. F. Hoft // Infection and immunity. - 2005. - V. 73. - N. 10. - P. 6711– 6720. 313. Vasala, A. A new wireless system for decentralised measurement of physiological parameters from shake flasks / A. Vasala, J. Panula, M. Bollók, L. Illmann, C. Hälsig, P. Neubauer // Microbial. cell factories. - 2006. - V. 5. - P. 8. 314. Verma, R. K. Antibodies to mycobacterial antigens for diagnosis of tuberculosis / R. K. Verma, A. Jain // FEMS. Immunology and medical microbiology. – 2007. – V. 51. – P. 453–461. 315. Veyrier, F. Evolution of the mycobacterial SigK regulon / F. Veyrier, B. Saı¨dSalim, M. A. Behr // Journal of bacteriology. – 2008. - V. 190. - N. 6. - P. 1891– 1899. 316. Vincent, M. S. Understanding the function of CD1-restricted T cells / M. S. Vincent, J. E. Gumperz, M. B. Brenner // Nature immunology. - 2003. – V. 4. - N. 6. – P. 517-523. 317. Wacker, M. N-linked glycosylation in Campylobacter jejuni and its functional transfer into E. coli / M. Wacker, D. Linton, P. G. Hitchen, M. Nita-Lazar, S. M. Haslam, S. J. North, M. Panico, H. R. Morris, A. Dell, B. W. Wren, M. Aebi // Science. - 2002. - V. 298. - N. 5599. - P. 1790–1793. 318. Wadhwa, A. Opportunities for improved serodiagnosis of human tuberculosis, bovine tuberculosis, and paratuberculosis / A. Wadhwa, G. J. Hickling, S. Eda // Veterinary medicine international. – 2012. - V. 2012. - P. 1-13. 319. Wanchu, A. Advances in serology for diagnosing TB in the HIV Infected / A. Wanchu // Indian. J. Chest. Dis. Allied. Sci. - 2005. - V. 47. - P. 31-37. 320. Wang, X. Serological diagnosis of tuberculosis using proteins expressed from the region of difference 1 (RD1) and RD2 of Mycobacterium tuberculosis as antigens / X. Wang, X. Li, H. Niu // African journal of microbiology research. – 2012. - V. 6. - N. 38. - P. 6698-6703. 204 321. Wang, Z. Global identification of prokaryotic glycoproteins based on an Escherichia coli proteome microarray / Z. Wang, R. Deng, H.-W.Jiang, S. Guo, H. Le, X. Zhao, C. Chen, J. Zhang, S. Tao // PLOS ONE. – 2012. – V. 7. - N. 11. e49080. 322. Waters, W. R. Early antibody responses to experimental Mycobacterium bovis infection of cattle / W. R. Waters, M. V. Palmer, T. C. Thacker, J. P. Bannantine, H. M. Vordermeier, R. G. Hewinson, R. Greenwald, J. Esfandiari, J. McNair, J. M. Pollock, P. Andersen, K. P. Lyashchenko // Clin. Vaccine. Immunol. - 2006. - V. 13. - P. 648–654. 323. Way, S. S. The Mycobacterium tuberculosis ESAT-6 homologue in Listeria monocytogenes is dispensable for growth in vitro and in vivo / S. S. Way, C. B. Wilson // Infection and immunity. – 2005. - V. 73. - N. 9. - P. 6151–6153. 324. Wedemayer, G. J. Structural insights into the evolution of an antibody combining site / G. J. Wedemayer, P. A. Patten, L. H. Wang, P. G. Schultz, R. C. Stevens // Science. - 1997. - V. 276. - P. 1665–1669. 325. Weldingh, K. Assessing the serodiagnostic potential of 35 Mycobacterium tuberculosis proteins and identification of four novel serological antigens / K. Weldingh, I. Rosenkrands, L. M. Okkels, T. M. Doherty, P. Andersen // Journal of clinical microbiology. – 2005. - V. 43. - N. 1. - P. 57–65. 326. Whelan, C. Immunoassay for serological diagnosis of Mycobacterium bovis infection in cattle / C. Whelan, E. Shuralev, G. O'Keeffe, P. Hyland, H. F. Kwok, P. Snoddy, A. O'Brien, M. Connolly, P. Quinn, M. Groll, T. Watterson, S. Call, K. Kenny, A. Duignan, M. J. Hamilton, B. M. Buddle, J. A. Johnston, W. C. Davis, S. A. Olwill, J. Clarke // Clinical and vaccine immunology. - 2008. - V. 15. - N. 12. P. 1834–1838. 327. Wiker, H. G. MPB70 and MPB83 – major antigens of Mycobacterium bovis / H. G. Wiker // Scandinavian journal of immunology. – 2009. – V. 69. - P. 492–499. 328. Wiker, H. G. The antigen 85 complex: a major secretion product of Mycobacterium tuberculosis / H. G. Wiker, M. Harboe // Microbiological reviews. – 1992. - V. 56. - N. 4. - P. 648-661. 205 329. Wiker, H. G. Immunochemical characterization of the MPB70/80 and MPB83 proteins of Mycobacterium bovis / H. G. Wiker, K. P. Lyashcenko, A. M. Aksoy, K. A. Lightbody, J. M. Pollock, S. V. Komissarenko, S. O. Bobrovnik, I. N. Kolesnikova, L. O. Mykhalsky, M. L. Gennaro, M. Harboe // Infect. Immun. 1998. - V. 66. - N. 4.- P. 1445–1452. 330. Wilcke, J. T. R. Diagnostic strategy for pulmonary tuberculosis in a low-incidence country: results of chest X-ray and sputum cultured for Mycobacterium tuberculosis / J. T. R. Wilcke, A. Kok-Jensen // Respiratory medicine. - 1997. V. 91. - N. 5. – P. 281-285. 331. Wilkinson, R. J. Evaluation of the recombinant 38-kilodalton antigen of Mycobacterium tuberculosis as a potential immunodiagnostic reagent / R. J. Wilkinson, K. Haslov, R. Rappuoli, F. Giovannoni, P. R. Narayanan, C. R. Desai, H. M. Vordermeier, J. Paulsen, G. Pasvol, J. Ivanyi, M., Singh // J. Clin. Microbiol. - 1997. - V. 35. - P. 553–557. 332. Williamson, M. P. The structure and function of proline-rich regions in proteins / M. P. Williamson // Biochem J. - 1994. – V. 297. – P. 249-260. 333. Wood, R. Lipoarabinomannan in urine during tuberculosis treatment: association with host and pathogen factors and mycobacteriuria / Wood R., K. Racow , L. G. Bekker, K. Middelkoop, M. Vogt, B. N. Kreiswirth, S. D. Lawn // BMC Infectious diseases. - 2012. – V. 12:47. 334. World Health Organization 2011. Commercial serodiagnostic tests for diagnosis of tuberculosis: policy statement. WHO/HTM/TB/2011.5. - Geneva, 2011. 335. World Health Organization. Global tuberculosis report 2013. WHO/HTM/TB/2013.11. - Geneva, 2013. 336. Wu, Q. A study on the methods for early serological diagnosis of leprosy and their potential use / Q. Wu, X. Li, Y. Yin, H. Shu, W. Wei, Q. Liu, G. Ye // Int. J. Lepr. other mycobact. Dis. - 1999. - V. 67. - N. 3. - P. 302-305. 337. Wu, X. Comparison of antibody responses to seventeen antigens from Mycobacterium tuberculosis / X. Wu, Y. Yang, J. Zhang, B. Li, Y. Liang, C. Zhang, M. Dong. // Clinica Chimica Acta. - 2010. - V. 411. - P. 1520–1528. 206 338. Wu, X. Humoral immune responses against the Mycobacterium tuberculosis 38kilodalton, MTB48, and CFP-10/ESAT-6 antigens in tuberculosis / X. Wu, Y. Yang, J. Zhang, B. Li, Y. Liang, C. Zhang, M. Dong, H. Cheng, J. He // Clinical and vaccine immunology. - 2010.- V. 17. - N. 3. - P. 372–375. 339. Xiao, G. Operon information improves gene expression estimation for cDNA microarrays / G. Xiao, B. Martinez-Vaz, W. Pan, A. B. Khodursky // BMC Genomics. – 2006. – V.7:87. – P. 1-11. 340. Xu, J. N. Serodiagnosis efficacy and immunogenicity of the fusion protein of Mycobacterium tuberculosis composed of the 10-kilodalton culture filtrate protein, ESAT-6, and the extracellular domain fragment of PPE68 / J. N. Xu, C. Jian-Ping, C.Da-Li // Clinical and vaccine immunology. – 2012. – V. 19. - N. 4. - P. 536–544. 341. Youden, W. J. An index for rating diagnostic tests / W. J. Youden // Cancer. 1950. - V. 3. - P. 32-35. 342. Zeng, S. R. Expression and identification of a small recombinant beefy meaty peptide secreted by the methylotrophic yeast Pichia pastoris / S. R. Zeng, Y. P. Wang, Y. Q. Yang, J. Zhang // African journal of microbiology research. - 2010. V. 4. - N. 24. - P. 2754-2762. 343. Zhang, G. Screening and assessing 11 Mycobacterium tuberculosis proteins as potential serodiagnostical markers for discriminating tb patients from BCG vaccines / G. Zhang, L. Zhang, S. Hu // Genomics proteomics bioinformatics. 2009. - V. 7. - N. 3. - P. 107-115. 344. Zhang, H. PPE protein (Rv3425) from DNA segment RD11 of Mycobacterium tuberculosis: a potential B-cell antigen used for serological diagnosis to distinguish vaccinated controls from tuberculosis patients / H. Zhang, J. Wang, J. M. Zhang, Y. Yang, Y. Chen, H. Wang // Clin. Microbiol. Infect. - 2007. – V. 13. - P. 139145. 345. Zhang, L. Serodiagnostic value of 23 Mycobacterium tuberculosis proteins and a novel protein combination / L. Zhang, Y. Sun, G. Zhang, G. Li, B. Li, X. Cheng // African journal of microbiology research. – 2011. - V. 5. - N. 26. - P. 4569-4576. 207 346. Zhang, M. M. Identification of RD5-encoded Mycobacterium tuberculosis proteins as B-cell antigens used for serodiagnosis of tuberculosis / M. M. Zhang, J. W. Zhao, Z. Q. Sun, J. Liu, X. K. Guo, W. D. Liu, S. L. Zhang // Clinical and developmental immunology.- 2012. - V. 6. - N. 38. - P. 6698 - 6703. 347. Zhang, Q. Influence of deleting 9 amino acid residues at N-terminus on immunogenicity of a Plasmodium falciparum chimeric protein / Q. Zhang, W. Pan, L. Qu, X. Xue // Acta Biochim biophys sinica. - 2003. – V. 35. – P. 345–349. 348. Zhang Q. Changing the N-terminal sequence protects recombinant Plasmodium falciparum circumsporozoite protein from degradation in Pichia pastoris / Q. Zhang, F. Ding, X. Xue, X. Xu, W. Pan // Applied microbiology and biotechnology. - 2008. - V. 78. - N. 1. – P. 139-145. 349. Zhang, S. L. Development and evaluation of a novel multiple-antigen ELISA for serodiagnosis of tuberculosis / S. L. Zhang, J. W. Zhao, Z. Q. Sun, E. Z. Yang, J. H. Yan, Q. Zhao, G. L. Zhang, H. M. Zhang, Y. M. Qi, H. H. Wang, Q. W. Sun // Tuberculosis. – 2009. – V. 89. - P. 278–284. 350. Zhou, A. T. Detection of pulmonary and extrapulmonary tuberculosis patients with the 38-kilodalton antigen from Mycobacterium tuberculosis in a rapid membranebased assay / A. T. Zhou, W.-L. Ma, P.-Y. Zhang, R. A. Cole // Clinical and diagnostic laboratory immunology. -1996. – V. 3. - N. 3. - P. 337–341. 351. Zweig, M. H. Receiver-operating characteristic (ROC) plots: a fundamental evaluation tool in clinical medicine / M. H. Zweig, G. Campbell // Clinical chemistry. -1993. - V. 39. - P. 561-577. 208 СПИСОК ИЛЛЮСТРАТИВНОГО МАТЕРИАЛА Рисунки Рисунок 1. Распределение доноров исследуемой группы по диагностированным формам туберкулеза. – С. 13. Рисунок 2. Конструкция рекомбинантной плазмиды pPIC9 – С.17. Рисунок 3. Схема вставки гена белка в AOX1 (а) и his4 (б) локусы хромосомы P. pastoris – С.17. Рисунок 4. – Строение гликоконъюгата белка с гексаарабинофуранозидом ЛАМ - С. 21 Рисунок 5. График распределения коммерческих тест-систем по их диагностической эффективности при легочном туберкулезе – С.43 Рисунок 6. Генеалогия вакцинных штаммов БЦЖ – С. 59. Рисунок 7 (7А, 7Б). Точечная диаграмма результатов ИФА с антигенами M. tuberculosis, полученными в экспрессионной системе E.coli, и их конъюгатами с гексаарабинофуранозидом ЛАМ – С.107. Рисунок 8 (8А, 8Б, 8В). ROC - кривые для анализов с белками полученными M. tuberculosis, в системе E.coli, и их конъюгатами с гексаарабинофуранозидом ЛАМ – С. 109. Рисунок 9. Точечная диаграмма результатов ИФА с антигенами M. tuberculosis, полученными в разных экспрессионных системах - С. 112. Рисунок 10 (10А, 10Б). ROC - кривые для анализов с белками M. tuberculosis, полученными в разных экспрессионных системах - С. 113. Рисунок 11. Диаграмма значений диагностической достоверности ИФА с антигенами M. tuberculosis, рассчитанных разными методами статистического анализа – С. 114. Рисунок 12. Лепестковая диаграмма сравнения данных ИФА с рекомбинантными белками M. tuberculosis, полученными в системе E. coli, и их конъюгатами – С. 116 Рисунок 13. Лепестковая диаграмма сравнения данных ИФА с белками M. tuberculosis, полученными в разных экспрессионных системах – С. 118 209 Рисунок 14. Гетерогенность распознавания антигенов M. tuberculosis сыворотками больных туберкулезом – С. 121. Таблицы Таблица 1. Концентрации антигенов, использованные при постановке ИФА - С. 24. Таблица 2. Преимущества и недостатки различных методов диагностики туберкулеза – С. 35. Таблица 3. Характеристики коммерческих тест-систем для серодиагностики туберкулеза легких – С. 42 Таблица 4. Видовая специфичность антигенов M. tuberculosis – С. 58. Таблица 5. Перспективные серодиагностические маркеры туберкулеза при различных формах и стадиях заболевания – С. 60. Таблица 6. Серодиагностическая эффективность антигенов M. tuberculosis в разных странах – С. 62. Таблица 7. Видовая специфичность некоторых «RD белков» M. tuberculosis - С. 67. Таблица 8. Эффективность серодиагностики туберкулеза при использовании различных вариантов мультиантигенных композиций – С. 89. Таблица 9. Результаты статистического анализа данных ИФА - С. 100-101. Таблица 10. Статистические показатели, рассчитанные на основании двух вариантов «отсекающих» значений – С. 103. Таблица 11. Результаты ROC анализа – С. 105. Таблица 12. Расчетная чувствительность серодиагностического теста с двумя антигенами M. tuberculosis. – С. 123. Таблица 13. Расчетная эффективность применения различных мультиантигенных композиций в серодиагностике туберкулеза. – С. 124.