2H2O → 2H2 + O2 - chemistry
реклама

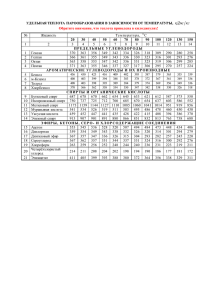
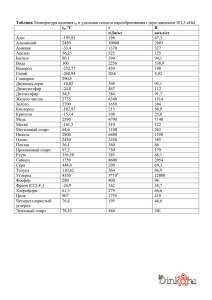
ВОДОРОД Получение I. В промышленности 1) Электролиз воды или водных растворов солей: 2H2O → 2H2 + O2 2) Пропускание паров воды над раскалённым коксом или железом (при t): 3) Конверсия с водяным паром при 1000 °C: 4) Каталитическое окисление кислородом (при t): 5) Крекинг и риформинг углеводородов в процессе переработки нефти. II. В лаборатории 1) Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную серную кислоту: 2) Взаимодействие кальция с водой: 3) Гидролиз гидридов: 4) Действие щелочей на цинк или алюминий: 5) С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода. Химические свойства I. Взаимодействие с простыми веществами 1. С активными металлами с образованием гидридов Гидриды – солеобразные, твѐрдые вещества, легко гидролизуются: 2. С неметаллами А) с галогенами (элементы VIIА группы) (при hν) Б) с халькогенами (элементы VIА группы) (при t) (при t) В) с элементами VА группы (t,p,Fe, обратимая реакция) P + H2 ≠ Г) с элементами IVА группы (при t) Si + H2 ≠ II. Взаимодействие со сложными веществами 1. С оксидами металлов (получение металлов – пирометаллургия) (при t) 2. С органическими веществами: А) гидрирование непредельных углеводородов алкен + Н2 = алкан алкин + 2Н2 = алкан // алкин + H2 = алкен алкадиен + 2Н2 = алкан // алкадиен + Н2 = алкен бензол + 2Н2 = циклогексан циклоалкан + Н2 = алкан Б) восстановление альдегидов и кетонов до спиртов альдегид + Н2 = первичный спирт кетон + Н2 = вторичный спирт В) получение анилина из нитробензола (водород может быть атомарным)