Министерство образования Российской Федерации Ростовский государственный университет Е.Б.Цупак
реклама

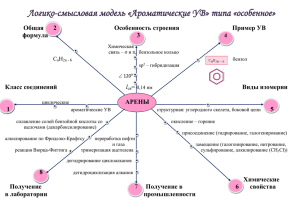
Министерство образования Российской Федерации Ростовский государственный университет Е.Б.Цупак МЕТОДИЧЕСКИЕ УКАЗАНИЯ к спецкурсу “Методы синтеза органических соединений” Методы получения галогенопроизводных Ростов-на-Дону 2001 2 Галоген является самой простой функциональной группой. Она состоит из одного атома. Атом галогена может быть введен в органическую молекулу с помощью различных реакций, в частности, путем замещения водорода или какой-либо функциональной группы, посредством присоединения к непредельным соединениям галогенсодержащих молекул. СИНТЕЗ ГАЛОГЕНОПРОИЗВОДНЫХ С ПОМОЩЬЮ РЕАКЦИЙ ЗАМЕЩЕНИЯ ВОДОРОДА Прямое галогенирование алифатических и ароматических соединений требуют подбора принципиально разных условий проведения реакции по причине различий в их электронном характере и химических свойствах. В ряду алифатических соединений условия успешного проведения реакции галогенирования существенно зависят от активности галогена и от того, с какой группой соседствует алкильный радикал, повергаемый превращению. Так, известное взаимодействие метана с хлором, протекающее по свободнорадикальному механизму, приводит к образованию продуктов разной степени замещенности. CH 4 Cl2, hν CH 3Cl + CH 2Cl2 + CHCl3 + CCl4 Еще более сложная смесь галогенидов образуется при хлорировании гомологов метана. Это можно объяснить тем, при больших величинах средней скорости реакции хлорирования разница в скоростях замещения водорода при третичном, вторичном и первичном С-атоме нивелируется (при 200 0С – 1:3,9:5,1). Реакция алканов с бромом протекает более избирательно (отношение скоростей реакции при 200 0 С 1:32:1600). Таким образом, на фоне менее энергичного, чем с хлором, взаимодействия с бромом разница в скоростях замещения водорода при 3 третичном, вторичном и первичном атоме углерода проявляется более контрастно. Получение фтор- и йодалканов действием соответствующих галогенов на предельные углеводороды провести не удается. При действии фтора происходит разрушение молекулы парафина, йод, напротив, не обладает достаточной активностью и в реакцию не вступает. Поэтому прямое галогенирование алканов в лабораторных условиях не считается эффективным способом получения алкилгалогенидов. В тех случаях, когда галогенируемый алкил связан с группировкой, снижающей энергию связи С-Н, реакция протекает более избирательно. Это имеет место, в частности, когда в качестве такой группировки выступает винил (аллильное галогенирование), арил или гетарил (бензильное галогенирование). . CH 2 CH 3 _ H CH 2 CH 2 Н . CH 2 . . Н . Н Следует отметить, что превращение при этом может быть осуществлено не только действием такого активного реагента, как хлор, но также бромом или N-бромсукцинимидом (NBS). O CH 3 X CCl4 CH 2Cl (Br) X= Cl2; Br 2; N Br O Реакцию, однако, не всегда удается остановить на стадии монозамещения. 4 CH 3 CHBr 2 Br 2 hν CH 3 CHBr 2 80 % Региоспецифичность хлорирования наблюдается при взаимодействии на свету кумола с хлором, разбавленным СО2. Это объясняется тем, что замещение протекает при бензильном С-атоме, который одновременно является третичным. CH 3 CH 3 Cl2 C H C Cl CO2, h,ν CH 3 CH 3 100 % Для хлорирования толуола хлором разработана также методика с использованием добавки 1 % пентахлорида фосфора, выполняющего роль катализатора. Хлорирование метильной группы 2-хинальдина протекает с высоким выходом (86 %) в четыреххлористом углероде при 60 o С в результате действия на 3 моль хинальдина 4 моль хлора в присутст- вии карбоната натрия. 4 Cl2, N a 2CO3 3 N CH 3 CCl4, 60 o С 3 N CH 2Cl Аллильные соединения удобно бромировать действием NBS в кипящем четыреххлористом углероде с добавкой в некоторых случаях органических перекисей, служащих источниками радикалов. CH 2 CH CH 3 N BS CCl4 CH 2 CH CH 2Br 5 Прямое галогенирование алканов по третичному атому углерода можно вести в присутствии катализаторов - кислот Льюиса. Превращение в этом случае, как считают, идет по ионному механизму, что связывают с возможностью образования устойчивого катиона карбония. R 3C H + AlCl3 R 3C + [HAlCl3] Этим способом удается осуществить, например, дибромирование адамантана. Br Br 2 Br BBr 3 79 % Галогенирование α-углеродного атома альдегидов, кетонов, карбоновых кислот, нитроалканов протекает, как правило, легко и достаточно избирательно. Это, вероятно, обусловлено способностью указанных соединений к таутомерным кето-енольным превращениям. R CH 2 C X O R CH C X OH В молекуле енола присутствует олефиновая связь С=С, которая и является местом атаки молекулы галогенирующего реагента. Реакция лишь формально представляется как замещение, но протекает по пути присоединения-отщепления, синхронно или последовательно. 6 + Br 2 R CH C X X R CH C O Br H Br - HBr X R OH CH C Br + Br 2 Br R Br CH C O X O - HBr H В качестве реагентов применяют раствор хлора или брома в уксусной кислоте, хлороформе, диметилформамиде (ДМФА), воде а также такие галогенирующие агенты как SO2Cl2, SeOCl3, и пербромидные соединения органических аммониевых солей N (CH 3)3 Br 3 N H Br 3 1,4-Диацетилбензол действием хлора в хлороформе легко превращается в дихлорацетильное производное. COCH 3 COCH 2Cl Cl2 CH Cl3 COCH 3 COCH 2Cl 82 % Для бромирования дорогостоящих или труднодоступных метилкетонов используют бром в момент его образования в результате окислительно-восстановительного взаимодействия бромоводородной кислоты с броматом калия. Реакцию ведут в уксуснокислом растворе. 7 5Br + BrO3 3Br2 + +6H 3H2O COCH3 COCH2Br CH3 CH3 CH3 CH3 Cl Cl 94 % Для хлорирования карбоновых кислот, имеющих более низкую способность к енолизации, чем оксосоединения, хорошие результаты дает метод Геля-Фольгарда-Зелинского. C 4H 9CH 2COOH Br 2 PCl3 C 4H 9CHCOOH Br 85 % Метод заключается в том, что часть кислоты превращают в ее галогенангидрид, который более легко образует енол. С этой целью в реакционную смесь добавляют каталитические количества подходящего реагента (PCl5, PCl3, PBr5, SOCl2). R CH 2 O C R CH 2 C OH Br O Cl OH R CH C Cl O R CH C Cl Образующийся α-бромзамещенный хлорангидрид вступает в обменное взаимодействие с исходной кислотой, давая при этом искомый продукт, а возникающий одновременно с ним хлорангидрид подвергается бромированию и процесс продолжается далее. 8 Br R CH O + R C Cl CH2 C O R OH CH2 C O Cl Br + R CH O C OH α-Бромкарбоновые кислоты могут быть получены с высоким выходом из простых жирных кислот также при взаимодействии их с бромом в слегка разбавленной полифосфорной кислоте. С целью введения атома галогена в ароматическое кольцо используют, как правило, условия подходящие для успешного протекания реакции электрофильного замещения. Такие условия подразумевают генерирование в реакционной смеси промежуточных частиц, в состав которых входит галоген, несущий на себе положительный заряд. Чаще всего это достигается использованием кислот Льюиса, таких как галогениды железа (III), алюминия (III) и др. Последние, присоединяя молекулу галогена, образуют комплекс, в котором связь галоген-галоген сильно поляризована за счет перехода электронной пары одного из атомов брома на d-орбиталь иона металла. При этом положительно заряженный бром оказывается на внешней сфере комплекса. F eBr 4 Br Этот комплекс выполняет роль электрофила в ходе атаки ароматической молекулы. По степени каталитической активности кислоты Льюиса можно расположить в ряд: FeBr3 > AlBr3 > ZnBr2 > SbBr3 > CuBr2 > PBr3 Кроме кислот Льюиса в качестве катализаторов могут применяться другие соединения, обладающие нуклеофильным характером и способные, благодаря этому, поляризовать молекулу галогена. К ним относятся вода, диоксан и др. Эти соединения, однако, обладают меньшей катали- 9 тической активностью, чем кислоты Льюиса, потому что в генерируемой ими электрофильной частице положительный заряд делокализован между атомами галогена и кислорода во внутренней сфере комплекса. .. H 2O .. + Br .. H 2O .. .... Br .... Br H 2O .. Br Br .... Br Легкость галогенирования определяется строением ароматической системы, характером заместителей в ней и типом галогена. Бензол и его гомологи весьма легко подвергаются хлорированию и бромированию в кольцо в результате действия галогена в присутствии чугунных стружек. Fe Cl2 F eCl3 Cl2 F eCl4 . Cl Фтор взаимодействует с бензолом активно и неоднозначно, поэтому фторбензол чаще получают из солей арендиазония по реакции Шимана, с которой мы познакомимся позже. Для успешного проведения йодирования аренов реакцию ведут в присутствии окислителей (HNO3, HgO и др.), которые необходимы для удаления образующего в ходе реакции сильного восстановителя - йодоводорода, так как его накопление в реакционной смеси способствует протеканию обратной реакции. Ar H + I2 Ar I + HI В числе других условий генерирования электрофильного йода следует назвать применение ацилгипойодитов. При взаимодействии молекулярного йода с серебряными солями карбоновых кислот происходит отрыв йодид-аниона от молекулы йода катионом серебра и стабилизация катиона йодония карбоксилат-ионом. При этом активность реагента тем выше, чем меньше основность аниона кислоты. 10 O O + I2 R C O + R C Ag AgI O I Результативность ацилгипойодитного способа иллюстрируется следующим примером: вератрол с высоким выходом превращается в 4-йод1,2-диметоксибензол при действии йода и трифторацетата серебра в хлороформе при комнатной температуре. OCH 3 OCH 3 OCH 3 I 2, CF 3COOAg OCH 3 CH Cl3 90 % I Многоядерные конденсированные арены галогенируются, как правило, более легко, чем бензол. Так, бромирование нафталина протекает в отсутствие катализатора при действии брома в четыреххлористом углероде при 60 0С; замещение направляется в α-положение. Проведение реакции при более высокой температуре приводит к возникновению обоих изомеров бромонафталина. Br Br 2 CCl4, 60 o C При хлорировании и бромировании гомологов бензола в ароматическое кольцо соблюдаются правила ориентации, согласно которым алкильные заместители направляют электрофильную атаку преимущественно в орто- и пара-положения. Другие заместители, являющиеся более сильными донорами электронов, нежели алкильные группы (NH2, OH), настолько облегчают электрофильную атаку ароматического ядра, 11 что галогенирование гладко протекает в присутствии мало активных катализаторов (воды, диоксана) или вовсе без них. Так, анилин при действии брома в водном растворе превращается в 2,4,6-триброманилин. NH 2 NH 2 Br Br Br 2 H 2O Br Для получения изомерных моноброманилинов реакцию ведут в специальных условиях: орто-броманилин синтезируют в диоксане действием комплекса диоксандибромид, для получения пара-броманилина анилин сначала превращают в N-ациламиносоединение (часто действием уксусного ангидрида или пара-толуолсульфохлорида), которое подвергают бромированию и затем полученный пара-бром-N-ациланилин гидролизуют. NH 2 NH 2 O O Br Br 2 (CH 3CO)2O NHCOCH 3 NHCOCH 3 Br 2 NH 2 H 2O C2H 5OH , H 2O Br Br Получение мета-броманилина прямым галогенированием можно осуществить, лишь в условиях, когда анилин участвует в реакции в аммониевой форме. Выходы при этом не превышают 50%. 12 NH 3 AlCl4 NH 2 NH 2 NH 2 NH 2 11 % Br Br AlCl3, H Cl Br 2 + AlCl3 Br 50 % 25 % В молекулу анилина удается с высоким выходом ввести йод действием молекулярного йода в водном растворе гидрокарбоната натрия. Еще один класс ароматических соединений, обладающих высокой электронной плотностью в кольце, составляют фенолы. Бром в воде переводит фенол сначала в 2,4,6-трибромфенол, затем в тетрабромциклогексадиенон. OH OH + _3 3 Br 2 O Br Br H Br Br Br + Br 2 _ H Br Br Br Br пара-Бромфенол получают в результате действия брома на фенол в растворе четыреххлористого углерода, тогда как орто-изомер удается синтезировать путем проведении реакции при -78 оС в среде третичного бутиламина. OH OH OH Br 2 Br 2 CCl4 tre t - BuN H 2, Br _ 78o C Br мета-Бромфенол можно синтезировать в условиях сильно кислой среды, когда, гидроксил, превращаясь в положительно заряженную 13 группу гидроксония, меняет свою ориентирующую способность. Так, пара-бромфенол претерпевает перегруппировку в мета-положение при нагревании (100 оС) в автоклаве с 2 эквивалентами AlCl3 в жидком бромоводороде. OH OH 2 моль AlCl3 ж. HBr, 100o C Br Br Галогенирование ароматического ядра, содержащего электроноакцепторный заместитель, протекает труднее, чем галогенирование бензола. При этом галоген направляется преимущественно в мета-положение. Так, для бромирования нитробензола требуется, кроме активного катализатора (FeBr3), высокая температура. NO2 NO2 Br 2 F e, 145 oС Br Удовлетворительные результаты по проведению йодирования ароматических соединений с пониженной электронной плотностью получены при использование йода в 20 %-ном олеуме. NO2 NO2 I 2, 20 %-олеум I Учитывая, что кислоты Льюиса способны образовывать комплексы с электроноакцепторными функциональными группами, являющимися 14 мета-ориентантами (COOH, CHO, CN и др.), в реакции галогенирования рекомендуется применять более одного эквивалента катализатора. Ароматические гетероциклы также могут быть подвергнуты прямому галогенированию. Условия для успешного проведения реакции определяются электронным характером конкретного соединения. π-Избыточные гетарены, особенно пиррол и фуран, настолько легко галогенируются, что действие брома в воде или йода в присутствии йодида калия на пиррол приводит к тетразамещению, а фуран при взаимодействии с бромом или хлором в четыреххлористом углерода превращается в 2,5-дигалогенфуран. Возможно, что вследствие диенового характера гетероцикла здесь на первой стадии имеет место реакция присоединения-отщепления. Второй бром вступает, вероятно, по механизму электрофильного замещения. O H + Br2 H O Br Br CCl4 Br O Br O _ HBr Br2 Br Поэтому для синтеза, например, α−бромфурана на фуран действуют диоксандибромидом при 0 0С. В этих условиях реакция направляется по пути электрофильного замещения. O O O Br 2 O Br 0 oC Фурановое ядро, стабилизированное электроноакцепторными заместителями (-COOH, -COR), замещается бромом в α-положение. 15 α- Бромтиофен получают действием брома на тиофен в бензольном растворе в присутствии оксида ртути. Для синтеза α-хлортиофена применяют сульфурилхлорид (SO2Cl2). Пиррольное кольцо в молекуле индола легко бромируется в положение 3 действием пербромида гидробромида пиридиния. NH Br Br 3 N N H H Галогенирование моноядерных π-дефицитных гетероциклов протекает весьма трудно. Пиридин подвергается бромированию в положение 3 в результате действия брома в присутствии железа лишь при 200-300 0 С. Это обусловлено, вероятно, тем, что изначальная π-дефицитность гетерокольца усиливается за счет связывания основного атома азота с кислотой реакционной среды. Это еще больше понижает восприимчивость гетерокольца к электрофильной атаке. F eBr 3 N .. Br [F eBr 4] Br N. N F eBr 3 По этой же причине при действии на хинолин брома в сернокислом растворе в присутствии сульфата серебра замещение протекает в бензольном кольце, но не в пиридиновом (реакция Дебишера-Уотерса). Основным продуктом реакции является 5-бромохинолин. 16 Br Br 2 + H 2SO4, Ag2SO4 N N N Br (следы) Для бромирования гетерокольца хинолиновой молекулы реакцию ведут в присутствии пиридина. Роль пиридина заключается, вероятно, в том, что он как более сильное основание, чем хинолин, создает в реакционной среде достаточно высокую концентрацию свободных молекул хинолина, способных воспринимать атаку брома в гетерокольцо (реакция Эйча). Br 2 N Br N N СИНТЕЗ ГАЛОГЕНОПРОИЗВОДНЫХ ПУТЕМ ЗАМЕЩЕНИЯ ФУНКЦИОНАЛЬНЫХ ГРУПП Для получения галогенопроизводных можно использовать реакции замещения не только водорода, но также некоторых функциональных групп. Одной из таких групп является гидроксил, поэтому спирты и фенолы весьма часто применяются в качестве исходных соединений для получения органических галогенидов. Галоген в превращении участвует в виде нуклеофильной частицы. Условия для проведения реакции подбирают с учетом таких факторов, как строение субстрата, легкость ухода гидроксила, возможность протекания конкурирующих превращений (перегруппировки карбокатионов, реакции элиминирования...). Предложено несколько механизмов замещения спиртового гидроксила в зависимости от строения молекулы. Считают, что в первичных 17 спиртах гидросил замещается по бимолекулярному (синхронному) механизму, в третичных - главным образом, по мономолекулярному (диссоциативному). Вторичные спирты реагируют по обоим механизмам. Так, 1-пентанол при действии HBr дает только один продукт - 1бромопентан (SN2). CH 3 CH 2 CH 2 CH 2 CH 2 OH HBr CH 3 CH 2 CH 2 CH 2 CH 2 Br Напротив, 2-пентанол превращается при действии бромоводородной кислоты в два продукта: 2- и 3-бромопентан с выходами соответственно 86% и 14% на превращенный спирт. Этот факт объясняют тем, что в ходе реакции некоторая часть молекул после протонирования гидроксильной группы, не успев подвергнуться нуклеофильной атаке по механизму SN2, диссоциирует с образованием 2-карбокатионов. Одна часть катионов карбония, будучи атакована нуклеофилом, превращается в 2бромопентан, другая претерпевает прототропную перегруппировку, в результате которой возникает 3-карбокатион. Из последнего образуется 3-бромопентан. +H CH 3 CH CH 2 CH 2 CH 3 OH _ H 2O CH 3 CH CH 2 CH 2 CH 3 CH 3 CH CH 2 CH 2 CH 3 H + Br O H + Br CH 3 CH CH 2 CH 2 CH 3 Br CH 3 CH 2 CH CH 2 CH 3 + Br 86 % CH 3 CH 2 CH CH 2 CH 3 Br 14 % Особенно часто такие перегруппировки наблюдаются тогда, когда они приводят к возникновению более устойчивого карбокатиона по 18 сравнению с предшествующим, например, перегруппировка первичного катиона во вторичный (третичный) или вторичного в третичный. Синтез галогенопроизводных удобно осуществлять действием на спирты галогеноводородными кислотами, среди которых первое место по надежности результатов занимает бромоводородная кислота. HBr применяется либо непосредственно в виде азеотропа с водой, либо генерируется в ходе реакции из бромида калия и серной кислоты в водном растворе. Для превращения спиртов в хлориды нередко применяется соляная кислота. Однако, будучи более слабой кислотой, чем бромоводородная, она легко реагирует лишь с третичными спиртами. Взаимодействие ее со вторичными спиртами и тем более с первичными требует применения катализаторов - кислот Льюиса (обычно это хлорид цинка). Получение йодопроизводных в результате действия на спирты йодоводородной кислоты не дает положительных результатов, вероятно, потому что образующийся в ходе реакции йодоводород, будучи сильным восстановителем, превращает йодопроизводное в алкан. ROH HI H 2O RI HI I2 RH Для получения йодопроизводных на спирты действуют трийодидом фосфора, который получают непосредственно в реакционной установке путем прибавления к красному фосфору раствора йода в соответствующем спирте. Для синтеза йодалканов из спиртов применяют также йодид метилтрифеноксифосфония - [(C6H5O)3PCH3]I; в ряде случаев предпочтительным оказывается использование системы йодид натрия (или калия) + ортофосфорная кислота. Следует отметить, что для синтеза галогенопроизводных спирты весьма часто обрабатывают галогенидами фосфора PCl3 , PCl5 , PBr3 , PBr5 или тионилхлоридом (SOCl2). 19 Фенольный гидроксил более прочно, чем спиртовый, связан с углеродной частью молекулы, и его замещение галогеном происходит лишь под действием высоко активных реагентов: пентахлорид фосфора, хлортрифенилфосфоний хлорида. Ph Ph P Cl Cl Ph Иногда возникает потребность замены одного галогена на другой. Это превращение осуществляют, действуя на галогенопроизводное галогенидом щелочного металла. Так, для замещения хлора йодом в алифатических соединениях используют реакцию Финкельштейна, которую проводят путем кипячения хлоралкана с йодидом натрия в ацетоновом растворе. Эта реакция обратима, но поскольку образующийся хлорид натрия, в отличие от йодида натрия, нерастворим в ацетоне, он выпадает в осадок и равновесие реакции смещается вправо. R Cl + NaI ацетон R I + NaCl Замещение одного галогена другим в ароматическом ряду возможно при том условии, что арильное ядро активировано электроноакцепторными заместителями. Реакция идет по механизму ароматического бимолекулярного нуклеофильного замещения (процесс А-Е). Так, 2,4динитро-фторбензол получают, нагревая соответствующий хлорид с фторидом калия. 20 Cl Cl F NO 2 NO 2 NO 2 O N NO 2 KF ... NO 2 O Для синтеза галогенаренов в качестве исходных соединений весьма широко используются соли арилдиазония, получаемые из первичных ариламинов. Замещение диазогруппы хлором или бромом проводят в условиях реакции Зандмейера, прибавляя к раствору диазониевой соли растворы соответствующих галогенидов натрия и меди (I). При этом происходит одноэлектронное восстановление катиона диазония солями меди (I), выполняющими роль катализатора, после чего атом галогена занимает место ушедшей в виде молекулы азота диазониевой группы. + CuCl Ar N 2 Ar . + Cl + CuCl2 CuCl2 CuCl2 Ar . Ar Cl + N2 + CuCl + CuCl2 Наряду с солями меди (I) могут применяться и другие одноэлектронные окислители: соли железа (II) и олова (II), аскорбиновая кислота. Превращение солей диазония в йодпроизводные, напротив, не требует участия катализатора, т.к. сам йодид-ион является сильным одноэлектронным восстановителем и способен выполнять роль переносчика электрона. 21 Ar N N + I Ar N N Ar + Ar + N N + N2 ArI + + I ArI I + Ar N N ArI I Ar I Ar N N I2 Фторарены получают из солей диазония с помощью реакции Шимана, которая состоит в термическом разложении твердых тетрафторборатов диазония. Для получения тетрафторбората диазония к диазораствору прибавляют HBF4 или ее соль и выпавший осадок отфильтровывают. Предполагают, что реакция Шимана идет по йонному механизму. Ar N 2 X + BF 4 _ X Ar N 2 BF 4 нагревание _ N 2, BF 3 Ar F СИНТЕЗ ГАЛОГЕНОПРОИЗВОДНЫХ С ПОМОЩЬЮ РЕАКЦИЙ ПРИСОЕДИНЕНИЯ Галогенопроизводные жирного ряда весьма часто синтезируют путем присоединения галогенсодержащих соединений к кратным углеродуглеродным связям. Простейший случай можно ппредставить схемой CH 2 CH 2 + HHa l CH 3 CH 2 Ha l Когда речь идет о несимметрично замещенных олефинах возможна различная ориентация присоединения. Например, из пропена в результате присоединения бромоводорода могут быть получены как первичный, так и вторичный бромистый пропил. Это определяется условиями проведения реакции. В большинстве случаев реакции присоединения проводят в кислой среде, что предполагает протекание превращения по электрофильному механизму. В соответствии с этим на одной из стадий 22 процесса промежуточно возникают карбокатионы; среди них большей стабильностью обладает тот, у которого имеется больше возможностей делокализации положительного заряда. CH 3 CH CH 2 + H +H CH 3 CH CH 3 (А) CH 3 CH 2 CH 2 + Br (Б) CH 3 CH CH 3 + Br CH 3 CH 2 CH 2 Br Br В рассматриваемом случае более устойчивым оказывается катион А, в котором положительный заряд делокализован с участием трех атомов углерода за счет положительного индуктивного эффекта двух соседних метильных групп. Этот катион и определяет строение образующегося продукта присоединения. Катион Б, в котором делокализация заряда возможна лишь на двух С-атомах, более богат энергией. Следовательно, его образование менее выгодно. Эта закономерность известна как Правило Марковникова. Активность галогеноводородов в реакциях электрофильного присоединения напрямую связана с силой соответствующих кислот HI > HBr > HCl При проведении реакции в газовой фазе в качестве катализаторов применяют кислоты Льюиса, образующие с галогеноводородами высоко ионизированные соединения AlX 3 + HX [AlX 4] H 23 Олефиновые соединения, имеющие при двойной связи заместители с явно выраженными отрицательными электронными эффектами (например -CF3) или те, которые могут прибрести такой эффект в результате координации с кислотами (например, группы CHO, COOH и др.), обусловливают обратную по сравнению с правилом Марковникова ориентацию присоединения. CF 3 CH CH 2 CH 2 CH C O + +H OH CF 3 CH 2 CH 2X HX OH CH 2 CH C OH CH 2 CH C OH OH + Cl O CH 2 CH 2 C OH Cl Бромоводород может быть присоединен к несимметричному алкену против правила Марковникова. Для этого реакцию ведут в присутствии перекисных соединений (перекись трет-бутила, перекись бензоила и др.). Пероксиды в результате гомолитической диссоциации образуют свободнорадикальные частицы, которые генерируют атомы брома, отщепляя от молекул бромоводорода атомы водорода, обладающие свойствами свободных радикалов. R O O R . R O + HBr 2R O R OH + Br . Атомы брома в результате атаки кратной связи олефина могут образовать два углеродцентрированных радикала, из которых более устойчивый определит строение продукта присоединения. Таковым оказывается радикал А, обладающий большей возможностью делокализации неспаренного электрона. 24 CH 3 CH CH 2 . + Br . (A) CH 3 CH CH 2 Br +R OH _ RO + Br . . (Б) CH 3 CH CH 2 Br . +R CH 3 CH 2 CH 2 Br _ OH RO . CH 3 CH CH 3 Br В синтезах галогенопроизводных с помощью реакций присоединения к кратным связям кроме галогеноводородов могут быть использованы также галогены, галогеналканы, галогенацилы. Присоединение галогенов протекает легко и приводит к образованию виц- дигалогенопроизводных. CH 2 CH CH 2Br Br 2 CCl4, 0..._5 oC CH 2 CH CH 2Br Br Br 98 % Галогеналканы и галогенацилы удается ввести в реакцию в присутствии катализаторов - кислот Льюиса. Последние обеспечивают высокую поляризацию связи С-галоген в молекуле реагента аналогично тому, как это происходит в условиях реакции Фриделя-Крафтса. AlCl3 + R Cl [AlCl4] R Используя галогеналканы, среди которых наиболее легко вступают в реакцию третичные, синтезируют новые производные предельных углеводородов; из галогенацилов получают галогенкетоны. CH 3 CH 2 CH 2 + Cl C CH 3 CH 3 AlCl3 _ 20 o C CH 3 CH 2 CH 2 C CH 3 Cl CH 3 86 % 25 ЛИТЕРАТУРА 1. Бюлер К., Пирсон Д.//Органические синтезы. - М.: Мир, 1973. Ч.1. - С. 374-468. 2. Вейганд-Хильгетаг //Методы эксперимента в органической химии. - М.: Химия, 1969. - С. 90-120, 132-186, 191-197, 202-229, 247-253. 3. Общая органическая химия. - М.: Химия, 1982. - Т.1. - С. 622656. 4. Горелик М.В., Эфрос Л.С. Основы химии и технологии ароматических соединений. - М.: Химия, 1992.-640с. 5. Агрономов А.Е. Избранные главы органической химии. - М.: Химия, 1990.-560с. 6. Марч Дж. Органическая химия. - М.: Мир. -1988. - Т. 1-4.