электрохимическая интеркаляция водорода в
реклама
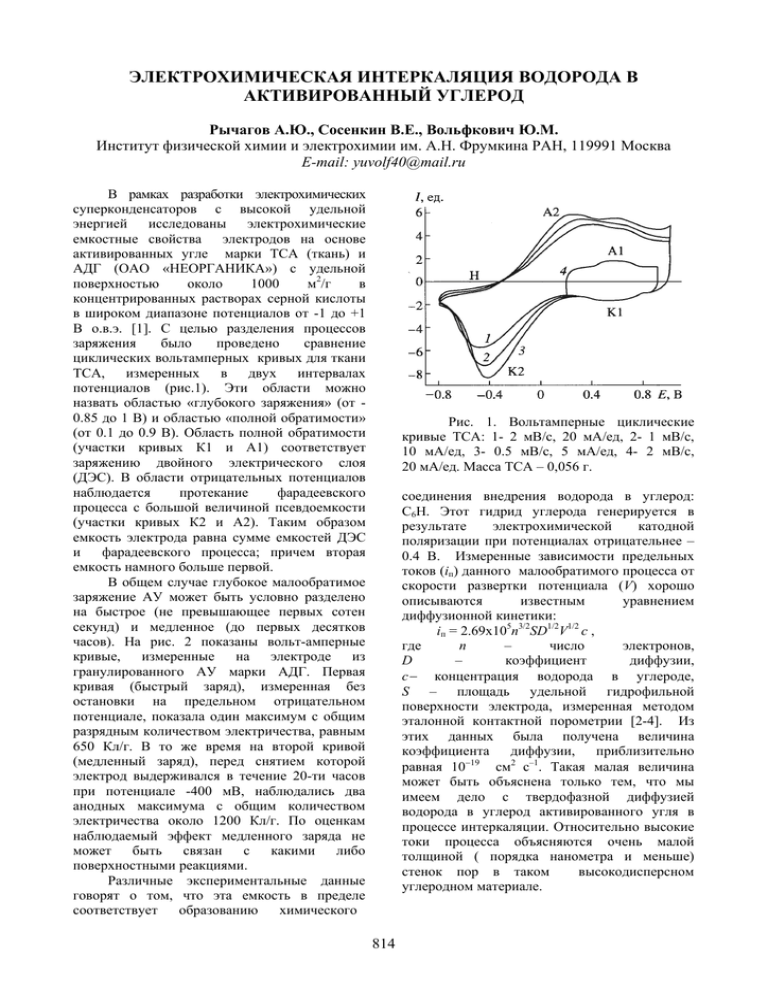
ЭЛЕКТРОХИМИЧЕСКАЯ ИНТЕРКАЛЯЦИЯ ВОДОРОДА В АКТИВИРОВАННЫЙ УГЛЕРОД Рычагов А.Ю., Сосенкин В.Е., Вольфкович Ю.М. Институт физической химии и электрохимии им. А.Н. Фрумкина РАН, 119991 Москва E-mail: yuvolf40@mail.ru В рамках разработки электрохимических суперконденсаторов с высокой удельной энергией исследованы электрохимические емкостные свойства электродов на основе активированных угле марки ТСА (ткань) и АДГ (ОАО «НЕОРГАНИКА») с удельной поверхностью около 1000 м2/г в концентрированных растворах серной кислоты в широком диапазоне потенциалов от -1 до +1 В о.в.э. [1]. С целью разделения процессов заряжения было проведено сравнение циклических вольтамперных кривых для ткани ТСА, измеренных в двух интервалах потенциалов (рис.1). Эти области можно назвать областью «глубокого заряжения» (от 0.85 до 1 В) и областью «полной обратимости» (от 0.1 до 0.9 В). Область полной обратимости (участки кривых К1 и А1) соответствует заряжению двойного электрического слоя (ДЭС). В области отрицательных потенциалов наблюдается протекание фарадеевского процесса с большой величиной псевдоемкости (участки кривых К2 и А2). Таким образом емкость электрода равна сумме емкостей ДЭС и фарадеевского процесса; причем вторая емкость намного больше первой. В общем случае глубокое малообратимое заряжение АУ может быть условно разделено на быстрое (не превышающее первых сотен секунд) и медленное (до первых десятков часов). На рис. 2 показаны вольт-амперные кривые, измеренные на электроде из гранулированного АУ марки АДГ. Первая кривая (быстрый заряд), измеренная без остановки на предельном отрицательном потенциале, показала один максимум с общим разрядным количеством электричества, равным 650 Кл/г. В то же время на второй кривой (медленный заряд), перед снятием которой электрод выдерживался в течение 20-ти часов при потенциале -400 мВ, наблюдались два анодных максимума с общим количеством электричества около 1200 Кл/г. По оценкам наблюдаемый эффект медленного заряда не может быть связан с какими либо поверхностными реакциями. Различные экспериментальные данные говорят о том, что эта емкость в пределе соответствует образованию химического Рис. 1. Вольтамперные циклические кривые ТСА: 1- 2 мВ/с, 20 мА/ед, 2- 1 мВ/с, 10 мА/ед, 3- 0.5 мВ/с, 5 мА/ед, 4- 2 мВ/с, 20 мА/ед. Масса ТСА – 0,056 г. соединения внедрения водорода в углерод: С6Н. Этот гидрид углерода генерируется в результате электрохимической катодной поляризации при потенциалах отрицательнее – 0.4 В. Измеренные зависимости предельных токов (iп) данного малообратимого процесса от скорости развертки потенциала (V) хорошо описываются известным уравнением диффузионной кинетики: iп = 2.69х105n3/2SD1/2V1/2 с , где n – число электронов, D – коэффициент диффузии, с− концентрация водорода в углероде, S – площадь удельной гидрофильной поверхности электрода, измеренная методом эталонной контактной порометрии [2-4]. Из этих данных была получена величина коэффициента диффузии, приблизительно равная 10−19 см2 с–1. Такая малая величина может быть объяснена только тем, что мы имеем дело с твердофазной диффузией водорода в углерод активированного угля в процессе интеркаляции. Относительно высокие токи процесса объясняются очень малой толщиной ( порядка нанометра и меньше) стенок пор в таком высокодисперсном углеродном материале. 814 Рис. 2. Вольтамперные кривые: 1–быстрый и 2–медленный заряд электрода при скорости развертки потенциала 1 мВ/с. Рис. 3. Зависимость разрядной емкости от величины тока циклирования в интервале потенциалов: 1–от 0.0 до 1.0 В, 2– от -0.2 до 1.0 В. Подтверждением существования предельных диффузионных токов в области малообратимых процессов является скачек емкости на кривой зависимости анодной емкости от заряд-разрядного тока при гальваностатических измерениях (рис.3). Данный скачек наблюдается только для случая, когда нижняя граница интервала потенциалов оказывается отрицательнее 0.1 В. Независимость величины тока от глубины заряда (конечного потенциала) может говорить об анодных (разрядных) ограничения данного процесса. Для данного случая предельный ток анодной реакции приблизительно равен 10-7 А/см2 истинной поверхности. Еще одним важным фактором, подтверждающим существование данного интеркаляционного соединения является резкое повышение электросопротивления электрода в процессе глубокого катодного заряжения, установленное импеданстым методом. Литература 1. Рычагов А.Ю., Вольфкович Ю.М., Электрохимия, 2009; 45: 323. 2. Volfkovich Yu.M., Bagotzky V.S., Sosenkin V.E., Blinov I.A. In: Colloid and Surfaces A: Physicochemical and Engineering Aspects. 2001; 187-188: 349. 3. Volfkovich Yu.M., Blinov I.A., Sakar A. US Patent 7,059,175 (2006). 4. www.porotech.net. 815











