Электролиз водных растворов солей
реклама

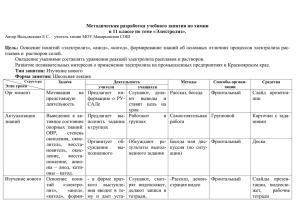
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «ОМСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ» КАФЕДРА ХИМИЯ ЛАБОРАТОРНАЯ РАБОТА «Электролиз водных растворов солей» Работу выполнил студент гр. _______ ф-т ____________ Ф.И.О. _________________________________________________ Дата выполнения работы: «___» _____________20__г. Работу проверил преподаватель: / «___» _____________20__г. Оценка: Цель работы: Экспериментально исследовать электролиз заданных растворов: определить порядок разрядки веществ на катоде и аноде, установить разницу протекания процесса электролиза с инертным и активным анодом. Сопоставить результаты эксперимента с теоретическими данными. Научиться записывать схемы электролиза и уравнения анодных и катодных процессов. ОПЫТ 1. ЭЛЕКТРОЛИЗ РАСТВОРА ИОДИДА КАЛИЯ Построение гипотезы: 1. Электролиз это _____________________________________________________________________ 2. Катод – это электрод___________________________________________________________________ 3. Анод – это электрод___________________________________________________________________ 4. Электродами могут быть: а)_____________________________________________________________ б)____________________________________________________________ 5. Нерастворимые электроды - это ________________________________________________________ 6. В зависимости от ионов, присутствующих в растворе написать конкурирующие процессы: а) на катоде: а1)____________________________________________________________________________________ а2)____________________________________________________________________________________ а3)____________________________________________________________________________________ б) на аноде: б1)____________________________________________________________________________________ б2)____________________________________________________________________________________ б3)____________________________________________________________________________________ 7. Написать уравнение диссоциации иодида калия в водном растворе___________________________ 8. Какой процесс будет протекать на катоде при электролизе водного раствора иодида калия и почему________________________________________________________________________________ 9. Какой процесс будет протекать на аноде при электролизе водного раствора иодида калия и почему________________________________________________________________________________ 10. Запишите суммарное уравнение электролиза водного раствора иодида калия__________________ Методика выполнения опыта Электролиз водного раствора иодида калия можно провести в электролизере (рис.1). В всех опытах электролизер заполняют на 1/2 его объема. Электролизер и электроды перед каждым опытом промывают водопроводной, а затем дистиллированной водой. В стеклянный сосуд электролизера налейте до метки раствор иодида калия и добавьте по 5-6 капель фенолфталеина и крахмала. Опустите в электролизер графитовые электроды, присоединённые к источнику постоянного Рис. 1. Схема лабораторного электролизера; тока. Включите выпрямитель в сеть. Через 1 – источник постоянного тока; некоторое время отметьте изменение цвета 2 - графитовые электроды; 3 - электролит раствора в катодном и анодном пространстве электролизера. По окончании опыта анод протрите сначала раствором тиосульфата натрия, а затем промойте дистиллированной водой. 2 Отметьте свои наблюдения: 1. Изменился ли цвет раствора прикатодном пространстве________________________________ а) Если да, то на какой цвет_________________________________________________________ б) Объясните, почему изменился цвет раствора__________________________________________ написать уравнение реакции 2. Изменился ли цвет раствора прианодном пространстве_________________________________ а) Если да, то на какой цвет__________________________________________________________ б) Объясните почему изменился цвет раствора__________________________________________ написать уравнение реакции Вывод:_________________________________________________________________________ подтвердилась ли в ходе эксперимента выдвинутая гипотеза ОПЫТ 2. ЭЛЕКТРОЛИЗ РАСТВОРА ХЛОРИДА ОЛОВА Построение гипотезы: 1. В какой последовательности выделяются на катоде металлы из смеси солей цинка, серебра (I) и олова (II); написать уравнение реакций___________________________________________________ а) ___________________________________________________________________________________ б)_____________________________________________________________________________________ в)____________________________________________________________________________________ 2. Написать уравнение диссоциации соли хлорида олова _________________________________ 3. Какой процесс будет протекать на катоде при электролизе водного раствора хлорида олова (II) и почему________________________________________________________________________________ 4. Какой процесс будет протекать на аноде при электролизе водного раствора хлорида олова (II) и почему________________________________________________________________________________ 5. Запишите суммарное уравнение электролиза водного раствора хлорида олова _________________________________________________________________________________ 6. Написать уравнение взаимодействия иодида калия с хлором________________________________ Методика выполнения опыта В стеклянный сосуд электролизера налейте до метки раствор хлорида олова. Опустите в электролизер графитовые электроды, присоединённые к источнику постоянного тока. Включите выпрямитель в сеть. Через 4-5 мин после пропускания электрического тока выньте анод из электролизера, прибавьте в анодное пространство по 3-4 капли растворов иодида калия и крахмала. Отметить свои наблюдения 1. Что выделяется на катоде________________________________________________________ написать уравнение реакции 2. Изменился ли цвет раствора прианодном пространстве________________________________ 3. Объясните почему цвет раствора крахмала изменился_________________________________ Вывод:__________________________________________________________________________ подтвердилась ли в ходе эксперимента выдвинутая гипотеза 3 ОПЫТ 3. ЭЛЕКТРОЛИЗ РАСТВОРА СУЛЬФАТА НАТРИЯ Построение гипотезы: 1. В какой последовательности будут выделяться металлы в свободном виде из смеси расплава солей меди (II), алюминия (II), свинца (II), магния и натрия; написать уравнения реакции: а)__________________________________________________________________________________ б)__________________________________________________________________________________ в)__________________________________________________________________________________ г)__________________________________________________________________________________ д)__________________________________________________________________________________ 2. Написать уравнение диссоциации сульфата натрия _________________________________ 3. Какой процесс будет протекать на катоде при электролизе водного раствора сульфата натрия и почему________________________________________________________________________________ 4. Какой процесс будет протекать на аноде при электролизе водного раствора сульфата натрия и почему________________________________________________________________________________ 5. Запишите суммарное уравнение электролиза водного раствора сульфата натрия ______________________________________________________________________________________ Методика выполнения опыта В конической колбе смешайте раствор сульфата натрия с нейтральным раствором лакмуса. Перелейте полученный раствор в электролизер. Опустите в электролизер графитовые электроды, присоединённые к источнику постоянного тока. Включите выпрямитель в сеть. 1. Изменился ли цвет раствора прикатодном пространстве и почему___________________________ 2. Изменился ли цвет раствора прианодном пространстве________________________________ Вывод:_________________________________________________________________________ подтвердилась ли в ходе эксперимента выдвинутая гипотеза ОПЫТ 4. ЭЛЕКТРОЛИЗ РАСТВОРА СУЛЬФАТА МЕДИ С ИНЕРТНЫМ И РАСТВОРИМЫМ АНОДОМ Построение гипотезы: 1. Инертный электрод - это_______________________________________________________________ 2. Растворимый электрод – это____________________________________________________________ 3. Имеются следующие электроды: графитовый, угольный, платиновый, железный, медный, свинцовый. Какие из этих электродов могут быть использованы: а) как инертные аноды___________________________________________________________________ перечислить б) как растворимые аноды________________________________________________________________ перечислить 4. Написать уравнение диссоциации сульфата меди __________________________________________ 5. Какой процесс будет протекать на катоде при электролизе водного раствора сульфата меди (II) и почему________________________________________________________________________________ ______________________________________________________________________________________ 6. Какой процесс будет протекать на аноде при электролизе водного раствора сульфата меди (II) и почему________________________________________________________________________________ ______________________________________________________________________________________ 7. Запишите суммарное уравнение электролиза водного раствора сульфата меди (II) с инертным электродом____________________________________________________________________________ ______________________________________________________________________________________ 4 8. Какой процесс будет протекать на катоде и аноде при электролизе водного раствора сульфата меди (II) с медным анодом и почему____________________________________________________________ ______________________________________________________________________________________ 9. Запишите суммарное уравнение электролиза водного раствора сульфата меди (II) с медным анодом________________________________________________________________________________ ______________________________________________________________________________________ Методика выполнения опыта В стеклянный сосуд электролизера налейте до метки раствор сульфата меди. Опустите в электролизер графитовые электроды, присоединённые к источнику постоянного тока. Включите выпрямитель в сеть. Через несколько минут прекратите электролиз. Отметить свои наблюдения: Что произошло на катоде__________________________________________________________ Изменился ли цвет раствора прианодном пространстве________________________________ Поменяйте полюса так, чтобы анодом стал катод, покрытый слоем металлической меди. Снова пропускайте электрический ток. Отметить свои наблюдения: Что наблюдается на катоде?_________________________________________________________ Что происходит на аноде?__________________________________________________________ Вывод:_________________________________________________________________________ подтвердилась ли в ходе эксперимента выдвинутая гипотеза ОПЫТ 5. ЭЛЕКТРОЛИТИЧЕСКОЕ ПОЛУЧЕНИЕ МЕДИ (МЕДНЕНИЕ) Построение гипотезы: 1. Даны водные растворы солей меди (), свинца (), олова (), алюминия, магния, цинка, калия. Какие из этих солей могут быть использованы в качестве катодного покрытия изделия ________________________________________________________________________________ перечислить 2. Выход по току – это_____________________________________________________________ 3. Масса, образующегося при электролизе вещества пропорциональна______________________ 4. Вычислить количество серебра, выделившегося при пропускании через раствор нитрата серебра() тока силой 5А в течение 10 мин._____________________________________________________ 5. Какой объем водорода (н.у) выделится на катоде, если пропускать через раствор иодида калия ток силой в 4А в течение 15 мин._____________________________________________________________ 6. Сколько времени нужно пропускать ток силой в 2А через раствор соли никеля(), чтобы покрыть металлическую пластинку площадью 200 см2 слоем никеля, толщиной 0,01 мм, если плотность никеля 8,9г/см3. Выход по току составляет 90%. Методика выполнения опыта 1. Вычислите силу тока, при которой плотность тока отвечала бы заданной в работе 200 А/м 2. Для этого измерьте площадь катода (цинковой пластинки) и используйте формулу J=ik·S, где: ik - катодная плотность тока, S - площадь катода.___________________________________________ 2. Подготовка к меднению: - механическая обработка: тонкую цинковую пластинку (длиной 3–4 см и шириной 1-2 см) с прикрепленной к одному концу медной проволокой очистите наждачной 5 бумагой; - обезжиривание: с помощью пинцета опустите очищенную пластинку на 1–2 минуты в 15%-ный раствор щелочи, а затем, не касаясь руками пластинки, промойте ее дистиллированной водой из промывалки; - травление: с помощью пинцета опустите обезжиренную пластинку на 1–2 минуты в 2 М раствор HCl для освобождения поверхности металла от оксидов, а затем, не касаясь руками пластинки, промойте ее дистиллированной водой из промывалки и положите на фильтровальную бумагу. 3. Определите массу цинковой пластинки до электролиза, взвесив с точностью до 0,001 г.__________ 4. В электролизер (химический стакан) налейте электролит для меднения (СuSO4·7 H2O 200 г/л, NaSO4 ·10 H2O 30 г/л; NaCl 10 г/л, Н3BO3 30 г/л или серная кислота, добавлять по каплям до нужного значения рН). В целях получения раствора с определенным значением рН в пределах 5,0 - 5,5 в электролит вводят борную или серную кислоту. Для повышения электропроводности к раствору прибавляют сульфат натрия, а для повышения растворимости анодов добавляют в небольших количествах хлорид натрия. 5. Погрузите в электролит медную и цинковую пластинки, присоединенные с помощью проводов к источнику постоянного тока. Включите выпрямитель в сеть. Задайте рассчитанную силу тока. Электролиз проводите в течение 10-15 минут. После этого отключите источник постоянного тока и выньте пластины из раствора. По окончании электролиза катод промойте проточной и дистиллированной водой, просушите фильтровальной бумагой. 6. Определите массу цинковой пластинки после электролиза, взвесив с точностью до 0,001 г.__________. Результаты занесите в табл.1. 7. Рассчитайте теоретическую массу меди, которая должна выделиться на катоде_____________________________________________________________________________ 8. Рассчитайте выход по току _______________________________________________________ Время электролиза, c. Сила тока, A Масса цинковой пластинки для меднения, г до после электроли электролиза за Масса медного покрытия, определенная экспериментально, г Масса медного покрытия, рассчитанная теоретически, г Выход по току, % Вывод:_____________________________________________________________________________ __________________________________________________________________________________ 6 КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАНИЯ 1. Из каких веществ обычно делают инертные аноды? ______________________________________________________________________________________ 2. Из каких веществ состоят растворимые аноды? ______________________________________________________________________________________ 3. Что происходит при электролизе с растворимым анодом? ______________________________________________________________________________________ 4. Как по положению металла в электрохимическом ряду напряжений определить какие продукты образуются на катоде при электролизе водных растворов солей? ______________________________________________________________________________________ ______________________________________________________________________________________ 5. Какие процессы протекают на электродах при электролизе раствора хлорида никеля (II), в случае: а)никелевого анода; б) угольного анода. ______________________________________________________________________________________ ______________________________________________________________________________________ 6. В какой последовательности выделяются на катоде металлы при электролизе раствора, содержащего ионы Zn2+, Ag+, Sn2+? ______________________________________________________________________________________ 7. Какие металлы можно получить путем электролиза из водных растворов их солей? ______________________________________________________________________________________ Какие металлы нельзя получить таким способом? ______________________________________________________________________________________ 8. Написать уравнения электродных процессов, протекающих при электролизе водных растворов а) H2SO4, б) Pb(NO3)2 с платиновыми электродами. ______________________________________________________________________________________ ______________________________________________________________________________________ 9. Написать уравнения электродных процессов, протекающих при электролизе водных растворов а) BaCl2, б) Ni(NO3)2 с угольными электродами. ______________________________________________________________________________________ ______________________________________________________________________________________ 10. Написать уравнения электродных процессов, протекающих при электролизе водных растворов а) FeCl3, б) Ca(NO3)2 с инертным анодом. ______________________________________________________________________________________ ______________________________________________________________________________________ 11. При электролизе раствора сульфата никеля током 10 А в течение 5 часов (электроды угольные) на катоде выделилось 50 г. никеля. Какой продукт образуется на аноде и в каком количестве? Вычислить выход никеля по току. ______________________________________________________________________________________ ______________________________________________________________________________________ ______________________________________________________________________________________ 12. Какой промежуток времени следует пропускать ток силой 0,5 А через раствор нитрата серебра для выделения 0,27 г. серебра? ______________________________________________________________________________________ ______________________________________________________________________________________ ______________________________________________________________________________________ 7 Приложение 1. Стандартные электродные потенциалы в водных растворах по водородной шкале Электрод Электродный процесс Е0, В Электрод Электродный процесс Е0, В Si+ / Si K+ / K Ba2+ / Ba Ca2+ / Ca Na+ / Na Mg2+ / Mg Al3+ / Al Mn2+ / Mn Zn2+ / Zn Si+ + e– = Si K+ + e – = K Ba2+ + 2e– = Ba Ca2+ + 2e– = Ca Na+ + e– = Na Mg2+ + 2e– = Mg Al3+ + 3e– = Al Mn2+ + 2e– = Mn Zn2+ + 2e– = Zn –3,045 –2,925 –2,900 –2,870 –2,714 –2,370 –1,70 –1,180 –0,763 Pb2+ / Pb 2H+ / H2 Cu2+ / Cu Ag+ / Ag Hg2+ / Hg Au3+ / Au O2 / OH– 2J– / J2 NO3– / N2O4 –0,126 0 0,337 0,799 0,854 1,500 0,401 0,530 0,800 Cr3+ / Cr Cr3+ + 3e– = Cr –0,740 NO3– / HNO2 Fe2+ / Fe Co2+ / Co Fe2+ + 2e– = Fe Co2+ + 2e– = Co –0,440 –0,403 2 Br– / Br2 2 Cl– / Cl2 Pb2+ + 2e– = Pb 2 H+ + 2e– = H2 Cu2+ + 2e– = Cu Ag+ + e– = Ag Hg2+ + 2e– = Hg Au3+ + 3e– = Au O2 + 2H2O + 4e– = 4OH– 2 J– – 2e– = J2 + 4H + 2NO3– + 2e– = =N2O4 + 2H2O 3H+ + NO3– + 2e– = =HNO2 + H2O 2 Br– – 2e– = Br2 2Cl– –2e– = Cl2 8 0,940 1,070 1,360