elektroliz_11_klassx
реклама

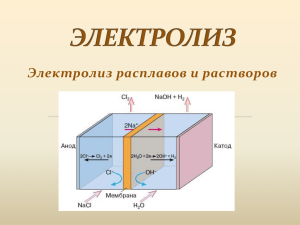
Муниципальное общеобразовательное учреждение средняя общеобразовательная школа №2 городского округа город Буй Костромской области Методическая разработка урока по теме «Электролиз» 11 класс Автор: Розенман Елена Александровна учитель химии МОУ СОШ №2 г. Буй Костромской области Буй 2015 г. Технологическая карта урока по химии в 11 классе «Электролиз» Тип урока Цели Методы обучения Оборудование Ожидаемый результат Этапы урока 1.Орг. момент Слайд 1.2 2. Изучение нового Слайд 3.4 Изучение нового материала Дать понятие об электролизе как окислительновосстановительном процессе, происходящем под действием электрического тока На примере электролиза растворов и расплавов солей показать взаимосвязь условий протекания реакций и их результатов Охарактеризовать роль и значение электролиза в промышленности Подготовить обучающихся к решению заданий по теме «Электролиз» ЕГЭ Частично-поисковый, наглядный (использование презентации) Проектор, компьютер Учащиеся должны знать и понимать: определения понятий «электролиз», «катод», «анод» области применения электролиза Учащиеся должны уметь: составлять уравнения электролиза расплавов и растворов солей Содержание деятельности Содержание деятельности учащихся учителя Сообщение темы и цели урока, объяснение порядка работы на уроке. Формулирование понятий Запись определений в рабочей «электролиз», «катод», тетради «анод» Обсуждение процессов, происходящих на угольных электродах, помещенных в расплав иодида калия Слайд 5,6 Беседа по вопросам: 1. Какие частицы находятся в расплаве иодида калия? KI → K+ + I− 2. Как движутся ионы под действием электрического тока? 3. Какие процессы происходят с ионами на катоде и аноде? Катод (−) Анод (+) + 0 − К +1e → К 2I -2e → I20 4. Каков результат ОВР, протекающей на электродах? Уравнение реакции электролиза расплава хлорида натрия: электролиз Закрепление материала 2КI → 2К + I2 Выполнение упр. в рабочей тетради – уравнение электролиза расплава солей бескислородных Слайд 7 Обсуждение Постановка проблемы: что изменится, если эксперимента. проводить электролиз не расплава, а раствора иодида калия. Видеоэксперимент– электролиз раствора иодида калия Слайд 8,9,10,11,12,13,14 Разбор катодных и Беседа по вопросам: анодных процессов 1. Какие ионы находятся в растворе иодида калия? растворах KI → K+ + I− и молекулы воды 2. Что происходит в растворе электролита под действием электрического тока? Катод (−) Анод (+) + K I− Н2О Н2О 3. Какие процессы происходят с ионами на катоде и аноде? Запись процессов согласно правилам учебника Катод (−) Н2О + 2е → Н2 + 2ОН− Анод (+) 2I− -2e → I20 4. Каков результат ОВР, протекающей на электродах? Уравнение электролиза раствора Постановка проблемы: как будет проходить иодида калия: электролиз электролиз раствора соли 2Н2О + 2I− → Н2 + 2ОН− + I2 кислородсодержащей электролиз кислоты. 2Н2О + 2КI → Н2 + 2КОН + I2 Слайд 15 результатов Составление уравнения электролиза раствора сульфата меди (II) Катод (−) Cu2+ +2e → Cu0 Анод (+) 2Н2О − 4е → О2 + 4Н+ Закрепление материала электролиз 2CuSO4 + 2Н2О →2Cu + О2 + 2H2SO4 Выполнение упр. в рабочей тетради Формулирование выводов – уравнение электролиза раствора о прохождении солей кислородных кислот электролиза расплавов и растворов солей, применение электролиза. Слайды 16-21 3. Контроль знаний Слайд 22 Знакомство с областями Запись в тетрадь применения электролиза. презентации по слайдам Выполнение упражнения Выполнение упражнений по на экране проектора как изученной теме по карточкам пример 4. Подведение Индивидуальное задание итогов. Домашнее для сдающих ЕГЭ: задание выбрать из вариантов КИМов задания об электролизе и решить их. Учебная литература О.С. Габриелян. Учебник для общеобразовательных учреждений. ХИМИЯ. Профильный уровень. 11 класс. – М.: Дрофа, 2012 Приложение 1. Тест по теме «Электролиз» Вариант 1 1. При электролизе водных растворов каких солей на аноде может быть получен кислород? а) Mg(NO3)2 б) BaCl2 в) СuSO4 г) NaBr 2. Формула соли, при электролизе водного раствора которой на катоде выделяется водород а) ZnCl2 б) FeSO4 в) СuBr2 г) Са(NO3)2 3. Щелочь можно получить путем электролиза раствора а) ZnSO4 б) KCl в) СuBr2 г) AgNO3 4. Установите соответствие между формулой вещества и продуктом, выделяющимся на катоде при электролизе водного раствора вещества: Формула вещества Продукт на катоде А) CuBr2 1) H2 Б) NaCl 2) металл В) K2SO4 3) H2 + металл Г) AgNO3 4) O2 5) H2O 6) галоген А Б В Г Тест по теме «Электролиз» Вариант 2 1. При электролизе водных растворов каких солей на аноде может быть получен галоген? а) Сr2(SO4)2 б) KBr в) СuCl2 г) Na2SO3 2. Формула соли, при электролизе водного раствора которой на катоде выделяется металл а) BaNO3)2 б) K2SO3 в) Сu(NO3)2 г) NaBr 3. Кислоту можно получить путем электролиза раствора а) ZnSO4 б) NaCl в) KBr г) ZnCl2 4. Установите соответствие между формулой вещества и продуктом, выделяющимся на аноде при электролизе водного раствора вещества: Формула вещества Продукт на аноде А) Na2SO4 1) H2 Б) BaCl2 2) галоген В) CuBr2 3) S Г) AgNO3 4) O2 5) металл 6) CO2 А Б В Г Ответы 1 Вариант 1 а, в Вариант 2 б, в 2 г в 3 б а 4 2112 4224 Взято: http://pandia.ru/text/79/039/57300.php