Химические источники тока Гальванические элементы — это
реклама
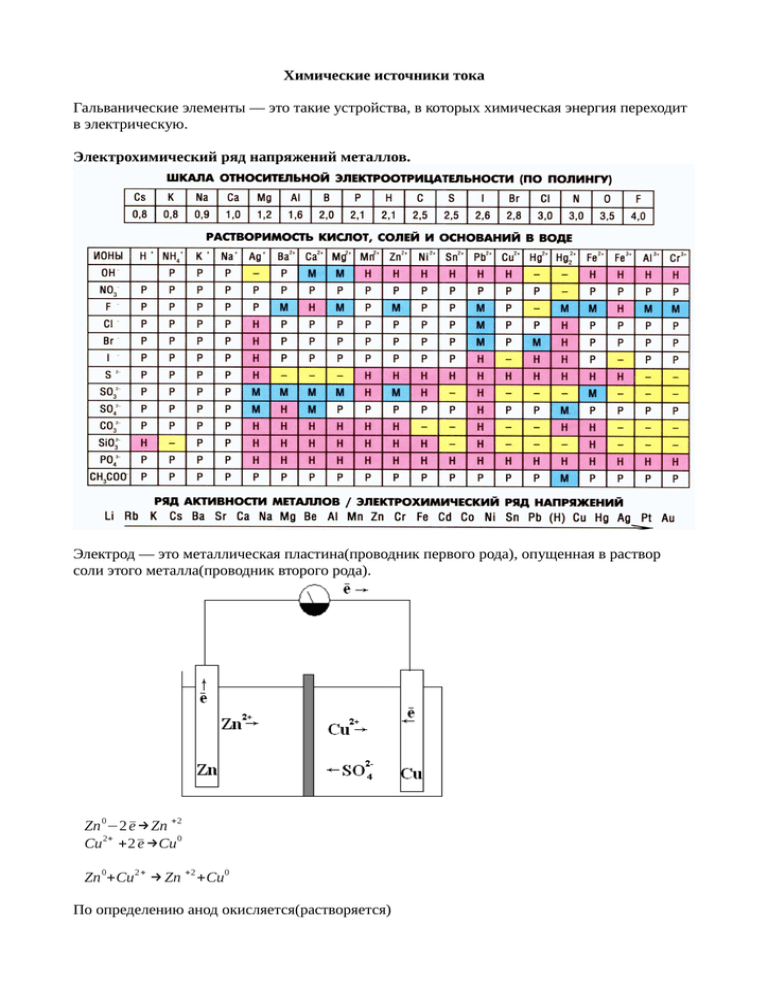
Химические источники тока Гальванические элементы — это такие устройства, в которых химическая энергия переходит в электрическую. Электрохимический ряд напряжений металлов. Электрод — это металлическая пластина(проводник первого рода), опущенная в раствор соли этого металла(проводник второго рода). Zn 0−2 ̄e →Zn +2 2+ 0 Cu +2 ̄e →Cu 0 Zn +Cu 2+ → Zn +2 +Cu 0 По определению анод окисляется(растворяется) На катоде происходит восстановление катионов. Анодом является тот электрон, который имеет меньшее значение стандартного электронного потенциала. анод (-) Zn | ZnSO 4 Схема гальванического элемента катод ( ZnCl 2 , Zn(NO 3 )2 || CuSO 4 | Cu (+) (-) - означает, что ̄e бегут к меди Гальванический элемент перестает работать, когда пластина полностью растворяется в растворе. Стандартные электронные потенциалы. (стандартные водородный электрод) ЭДС =Eкатод −Eфнод ЭДС =0.34−(−0.76)=1 Влияние концентрации электролита на значение электронного потенциала. Уравнение Нернста E=E 0 + 0.059 lgC n n — количество отданных или принятых электронов. C — концентрация электронов (моль / л) Задание: 1. Гальванический элемент состоит из серебряного электрода, погруженного в раствор AgNO 3 с концентрацией 1 М , и стандартного водородного электрода. Написать уравнения электродных процессов и суммарной реакций, вычислить ЭДС. H2 | H 2 SO 4 | Pt (H 2 ) | (H + ) | 0 + 1 H 2 −2 ̄ e →2 H 0 + 0 2 Ag +1 ̄e → Ag H 20+ 2Ag + =2H + +2Ag 0 ЭДС =0.80 — 0=0.80 В AgNO 3 | Ag( + ) 2. Гальванический элемент составлен из стандартного цинкового электрода, и хромового электрода, погруженных в раствор соли Cr 3+ . При какой концентрации Cr 3+ ЭДС этого электролита равен 0. 0.06 −0.76=−0.74+ lgC 3 −0.02=0.02 lgC −1=lg C C=10−1 3. Составьте схемы двух гальванических элементов, в одном и которых медь служила бы катодом, а в другом — анодом. Написать уравнение реакции и вычислить стандартный ЭДС. (-) Cu | CuSO5 | AgNO 3 | Ag анод катод Cu− −2 ̄e →Cu+2 1 Ag + −1 ̄e → Ag0 2 Cu 0+ 2Ag + =Cu 2+ +2Ag 0 ЭДС =0.80−0.34=0.46 (+)











