Гальванический элемент
реклама

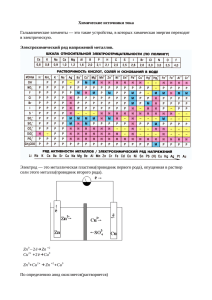
Гальванический элемент Гальванический элемент (химический источник тока) – устройство, которое позволяет превращать энергию химической реакции в электрическую работу. По принципу работы различают первичные (разовые), вторичные (аккумуляторы) и топливные элементы. Гальванический элемент состоит из ионпроводящего электролита и двух разнородных электродов (полуэлементов), процессы окисления и восстановления в гальваническом элементе пространственно разделены. Положительный полюс гальванического элемента называется катодом, отрицательный - анодом. Электроны выходят из элемента через анод и движутся во внешней цепи к катоду. Правила записи: слева располагается электрод, имеющий более отрицательный потенциал (анод), справа - катод; растворы отделяются вертикальной пунктирной линией, если они контактируют друг с другом, и двумя вертикальными линиями, если между ними находится солевой мостик; одна вертикальная линия означает границу раздела фаз, вертикальная пунктирная линия мембрана. Медно-цинковый элемент. Медно-цинковый элемент (элемент Даниэля) состоит из двух полуэлементов (или электродов): I - цинковая пластинка погружена в раствор ZnSO4, II - медная пластинка - в раствор CuSO4. Полуэлементы соединены ионным мостиком III. При замыкании внешней цепи IV на аноде происходит окисление цинка: Zn - 2е = Zn2+ На катоде - восстановление ионов меди: Cu2+ + 2е = Cu За счет окислительно-восстановительной реакции по внешней цепи течет поток электронов от цинкового электрода к медному, а по ионному мостику движутся сульфат-ионы. Цинковый электрод постепенно растворяется, на медном выделяется металлическая медь. Схеме элемента запишется так: анод(-) Zn ZnSO4 CuSO4 Cu катод(+) Электродвижущая сила гальванического элемента Полная схема гальванического элемента с учетом внешней цепи, состоящей, например, из медного провдника, будет: анод(-) Cu Zn ZnSO4 CuSO4 Cu катод(+) На каждой межфазной границе существует скачок электрического потенциала. Это контактный потенциал в месте сопрокосновения меди и цинка к, абсолютные электродные потенциалы Zn и Cu на границе металл-раствор, диффузионный потенциал Д на границе, разделяющей растворы. Применение ионного мостика делает диффузионный потенциал пренебрежимо малым и его можно считать равным нулю. Если отсчитывать абсолютный электродный потенциал, полагая положительным переход от раствора к металлу, то для электродвижущей силы ЭДС данного гальванического элемента можно написать равенство: Е = Cu - Zn + к а для гальванического элемента, содержащего металлы 1 и 2: Е = 1 - 2 + 12 Электродные потенциалы Абсолютные электродные потенциалы определить очень трудно. Но, т.к. абсолютные электродные потенциалы входят в выражение для ЭДС с разными знаками, то их можно заменить величинами, отличающимися от них постоянными слагаемыми. Вместо абсолютного скачка потенциала на границе металл-раствор удобно использовать ЭДС элемента, состоящего из данного электрода и другого электрода, который во всех случаях должен быть одним и тем же. В качестве такого электрода сравнения принят стандартный водородный электрод. Электродным потенциалом называется величина, равная ЭДС гальванического элемента, составленного из данного электрода и стандартного водородного электрода. ЭДС электрохимического элемента равна разности электродных потенциалов: Е= 1- 2 Электродный потенциал электрода считается положительным, если в гальваническом элементе со стандартным водородным электродом данный электрод является катодом, и отрицательным - если анодом.