Календарно-тематическое планирование курса химии 11 класса
реклама
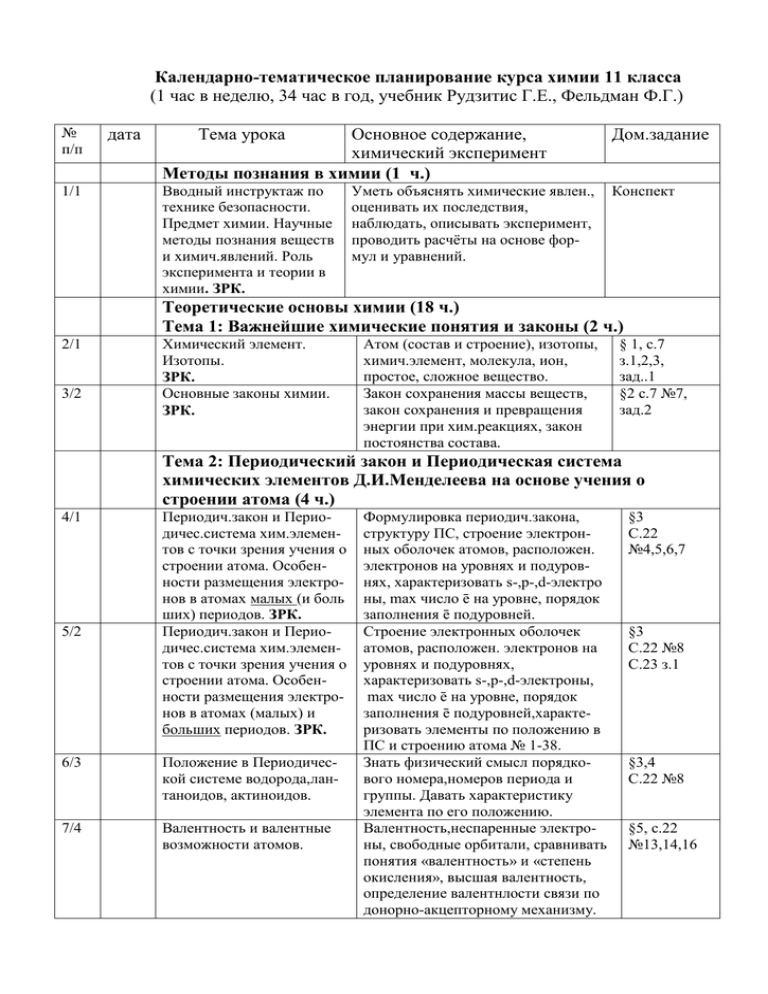
Календарно-тематическое планирование курса химии 11 класса (1 час в неделю, 34 час в год, учебник Рудзитис Г.Е., Фельдман Ф.Г.) № п/п 1/1 дата Тема урока Основное содержание, химический эксперимент Методы познания в химии (1 ч.) Дом.задание Вводный инструктаж по технике безопасности. Предмет химии. Научные методы познания веществ и химич.явлений. Роль эксперимента и теории в химии. ЗРК. Конспект Уметь объяснять химические явлен., оценивать их последствия, наблюдать, описывать эксперимент, проводить расчёты на основе формул и уравнений. Теоретические основы химии (18 ч.) Тема 1: Важнейшие химические понятия и законы (2 ч.) 2/1 3/2 Химический элемент. Изотопы. ЗРК. Основные законы химии. ЗРК. Атом (состав и строение), изотопы, химич.элемент, молекула, ион, простое, сложное вещество. Закон сохранения массы веществ, закон сохранения и превращения энергии при хим.реакциях, закон постоянства состава. § 1, с.7 з.1,2,3, зад..1 §2 с.7 №7, зад.2 Тема 2: Периодический закон и Периодическая система химических элементов Д.И.Менделеева на основе учения о строении атома (4 ч.) 4/1 5/2 Периодич.закон и Периодичес.система хим.элементов с точки зрения учения о строении атома. Особенности размещения электронов в атомах малых (и боль ших) периодов. ЗРК. Периодич.закон и Периодичес.система хим.элементов с точки зрения учения о строении атома. Особенности размещения электронов в атомах (малых) и больших периодов. ЗРК. 6/3 Положение в Периодической системе водорода,лантаноидов, актиноидов. 7/4 Валентность и валентные возможности атомов. Формулировка периодич.закона, структуру ПС, строение электронных оболочек атомов, расположен. электронов на уровнях и подуровнях, характеризовать s-,p-,d-электро ны, max число ē на уровне, порядок заполнения ē подуровней. Строение электронных оболочек атомов, расположен. электронов на уровнях и подуровнях, характеризовать s-,p-,d-электроны, max число ē на уровне, порядок заполнения ē подуровней,характеризовать элементы по положению в ПС и строению атома № 1-38. Знать физический смысл порядкового номера,номеров периода и группы. Давать характеристику элемента по его положению. Валентность,неспаренные электроны, свободные орбитали, сравнивать понятия «валентность» и «степень окисления», высшая валентность, определение валентнлости связи по донорно-акцепторному механизму. §3 С.22 №4,5,6,7 §3 С.22 №8 С.23 з.1 §3,4 С.22 №8 §5, с.22 №13,14,16 Тема 3: Строение вещества (6 ч.) 8/1 Основные виды химической связи 9/2 Типы кристаллических решёток и свойства веществ. 10/3 Причины многообразия веществ. Дисперсные системы. ЗРК. 11/4 12/5 Решение задач на растворы 13/6 Практическая работа №1 14/7 Контрольная работа №1 «Теоретические основы химии». Определение связи, виды связи, меха низм их образования, причина хим. активности – незавершен.внеш.слоя. Пути завершения:обобщение неспар. ē или полный переход ē.Катионы, анионы. Вещества молекулярного и немолекулярного строения, типы решёток, зависимость свойств от состава и строения,определять тип крист.реш. Аллотропия, изомерия, изотопия, гомология Общая характеристика и классификация дисперсных систем.Истинный раствор, коллоидный р-р, золь, гель, способы выражения концентрации: массовая доля, молярная концентрация. Приготовление растворов с заданной молярной концентрацией. По темам 1,2,3 §6 с.41 №2,3,4 §8 с.41 №7,8 С.42 з.1 §9 с.41 №9, с.42 з.3 §10 с.41 №10,11 §10 с.38, С.42 з.4 С.42 Не задано Тема 4: Химические реакции (6 ч.) 15/1 16/2 17/3 18/4 19/5 20/6 21/7 Классификация химических реакций. ЗРК. Окислительно-восстановительные реакции. Скорость химических реакций. Практическая работа №2 ЗРК. Химическое равновесие и условия его смещения. ЗРК. Электролитическая диссоциация. Л.О.№1 Проведение реакций ионного обмена. ЗРК. Гидролиз. Л.О.№2 Определение характера среды раствора. Контрольная работа №2 Признаки классификации хим.реак-й, §11 задачи на тепловой эффект. Окислитель, восстановитель, метод электронного баланса. Скорость гомогенной и гетерогенной реакции, факторы влияющие на скорость, сущность катализа. Катализато ры и ингибиторы, ферменты. Обратимость х.р., хим.равновесие, зависимость х.равновесия от tº, р, концентрации вещ-в, принцип ЛеШателье, произв-во серной к-ты (показать способы смещения хим. равновесия и подбора условий). Электролит,неэлектролит, электр. Диссоциация. Реакции ионного обмена.Сильные и слабые электролиты. По тетради Водородный показатель (рН),определение среды раствора. §18 с.74 №4,6,7,8 По теме 4 Не задано §12 с.62 №2,5 С.63 з.1,2 §13,14 §15,17 С.68 №2,3,4 С.74 №2(2) «Химические реакции». Неорганическая химия (13 ч.) Тема 5: Металлы (6 ч.) Металлы. Электрохимический ряд напряжения металлов. Л.О.№3 Знакомство с образцами металлов и их рудами. ЗРК. Общие способы получения металлов. Коррозия металлов и её предупреждение. Анализ к/р. Положение Ме в П.С., строение атомов, М.связь, мет.крис. решётка, общие физ.св-ва, общие хим.св-ва. Запись урав.реакций в молекулярном и ОВ виде. С.77-79 Получение Ме восстановлением С, Н2, СО, более активным металлом, электрическим током. Задачи на практич. выход от теор. Знать причины коррозии, её типы и способы защиты от коррозии. §19 с.88 №5 §20 24/3 Электролиз расплавов и растворов солей §19 25/4 Обзор металлов главных подгрупп (А-групп). Обзор металлов побочных подгрупп (Б-групп). Сплавы металлов. Л.О.№4 Взаимодействие цинка и железа с раствором кислот и щелочей. 26/5 Оксиды и гидроксиды металлов. ЗРК 27/6 Контрольная работа №3 «Металлы». Электролиз. Особенности электролиза расплавов и растворов. Катодные и анодные процессы. Области применения металлов глав. подгрупп 1-3 групп. Общая хар-ка металлов по положению в П.С.,строению атома, хим.св-ва, запись уравнений хим.реакций. Области применения металлов побоч. подгрупп П.С. Общая характеристика по положению, строение атома, прогноз химических свойств, запись уравнений хим.реакций. Уметь называть вещества, определять принадлежность веществ к различным классам, объяснять зависимость свойств веществ от их состава и строения. По теме 5 22/1 23/2 §21,29 с.98 №1-4,зад.1 §22-28 §21,29 Повт.параг. 19-29 Тема 6: Неметаллы (6 ч.) 28/1 29/2 30/3 Обзор неметаллов. ЗРК. Л.О.№5 Знакомство с образцами неметаллов и их природными соединениями. Л.О.№6 Распознавание хлоридов. Соединения неметаллов (оксиды и кислородсодержащие кислоты). Л.О.№7 Распознавание сульфатов. ЗРК. Водородные соединения Понятие «вещества молекулярного и немолекулярного строения». Общие химич.свойства неметаллов. §30 Уметь называть вещества, определять принадлежность веществ к различным классам, объяснять зависимость свойств веществ от их состава и строения. §31,33 Водородные соединения: состав и §32 31/4 32/5 33/6 34/7 неметаллов. Контрольная работа №4 по теме « Неметаллы». Практическая работа №3 «Идентификация неорганических веществ». Бытовая химическая грамотность Обобщение материала. Химия и окружающий мир. свойства. Уметь применять знания, умения и навыки, полученные при изучении темы «Неорганическая химия». Знать основные правила ТБ. Уметь проводить химический эксперимент. Уметь соблюдать правила безопасности при использовании бытовой химии (СМС и ВМС). Не задано Не задано §34 Не задано