s-Элементы II группы
реклама
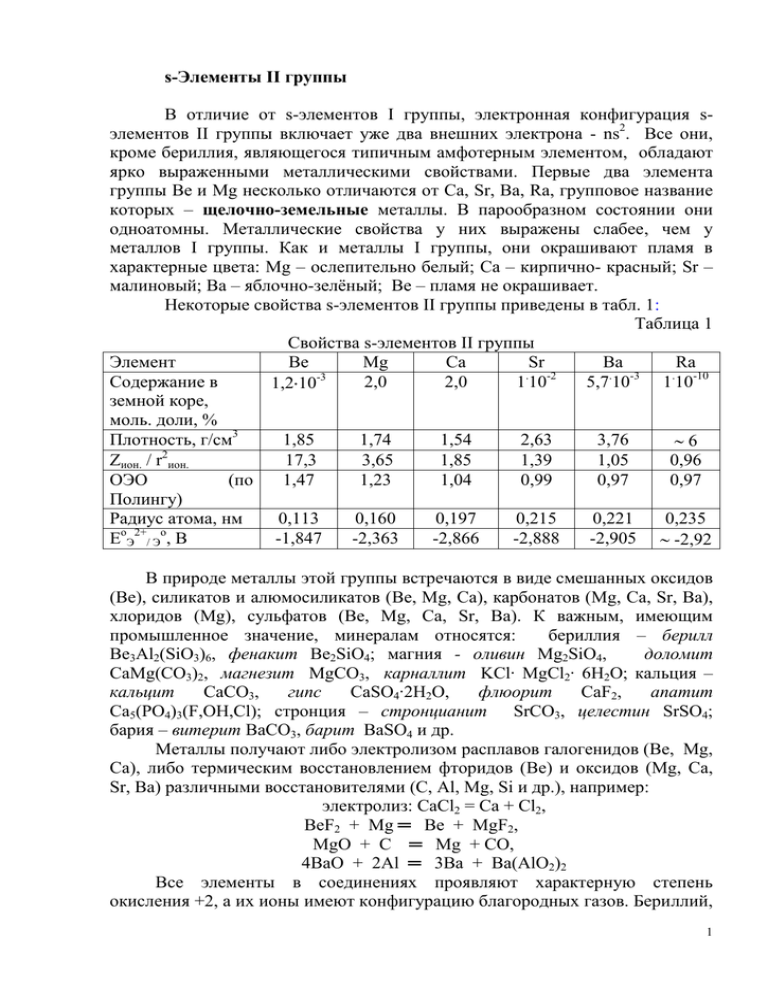
s-Элементы II группы В отличие от s-элементов I группы, электронная конфигурация sэлементов II группы включает уже два внешних электрона - ns2. Все они, кроме бериллия, являющегося типичным амфотерным элементом, обладают ярко выраженными металлическими свойствами. Первые два элемента группы Bе и Mg несколько отличаются от Ca, Sr, Ba, Ra, групповое название которых – щелочно-земельные металлы. В парообразном состоянии они одноатомны. Металлические свойства у них выражены слабее, чем у металлов I группы. Как и металлы I группы, они окрашивают пламя в характерные цвета: Mg – ослепительно белый; Ca – кирпично- красный; Sr – малиновый; Ba – яблочно-зелёный; Be – пламя не окрашивает. Некоторые свойства s-элементов II группы приведены в табл. 1: Таблица 1 Свойства s-элементов II группы Элемент Be Mg Ca Sr Ba Ra . -2 . -3 . -3 Содержание в 2,0 2,0 1 10 5,7 10 1 10-10 1,2 10 земной коре, моль. доли, % Плотность, г/см3 1,85 1,74 1,54 2,63 3,76 6 2 Zион. / r ион. 17,3 3,65 1,85 1,39 1,05 0,96 ОЭО (по 1,47 1,23 1,04 0,99 0,97 0,97 Полингу) Радиус атома, нм 0,113 0,160 0,197 0,215 0,221 0,235 o 2+ о E Э /Э , В -1,847 -2,363 -2,866 -2,888 -2,905 -2,92 В природе металлы этой группы встречаются в виде смешанных оксидов (Be), силикатов и алюмосиликатов (Be, Mg, Ca), карбонатов (Mg, Ca, Sr, Ba), хлоридов (Mg), сульфатов (Be, Mg, Ca, Sr, Ba). К важным, имеющим промышленное значение, минералам относятся: бериллия – берилл Be3Al2(SiO3)6, фенакит Be2SiO4; магния - оливин Mg2SiO4, доломит CaMg(CO3)2, магнезит MgCO3, карналлит KCl∙ MgCl2∙ 6H2O; кальция – кальцит CaCO3, гипс CaSO4∙2H2O, флюорит CaF2, апатит Ca5(PO4)3(F,OH,Cl); стронция – стронцианит SrCO3, целестин SrSO4; бария – витерит BaCO3, барит BaSO4 и др. Металлы получают либо электролизом расплавов галогенидов (Be, Mg, Ca), либо термическим восстановлением фторидов (Be) и оксидов (Mg, Ca, Sr, Ba) различными восстановителями (С, Al, Mg, Si и др.), например: электролиз: CaCl2 = Ca + Cl2, BeF2 + Mg ═ Be + MgF2, MgO + C ═ Mg + CO, 4BaO + 2Al ═ 3Вa + Ba(AlO2)2 Все элементы в соединениях проявляют характерную степень окисления +2, а их ионы имеют конфигурацию благородных газов. Бериллий, 1 ядро которого слабо экранировано, отличается от остальных металлов. Во всех его соединениях химические связи в большей или меньшей степени ковалентны, причем у галогенидов доля ковалентности связи значительна (так, электропроводность жидкого BeCl2 почти в 1000 раз меньше, чем у жидкого NaCl). У бериллия, как и у Li, отношение Zион./r2ион., характеризующее поляризующее действие иона и называемое “ионным” потенциалом (удельным зарядом), выше по сравнению с остальными элементами группы. Чем выше это отношение, тем резче проявляется у элемента тенденция к образованию ковалентных связей. Магний в этом ряду занимает промежуточное положение. Отношение к простым окислителям. С водородом металлы, кроме бериллия, взаимодействуют при нагревании, образуя гидриды состава ЭН2. Ca, Sr, и Ba вступают в реакцию с водородом при температуре 500-150 оС, соответственно, а ионный, термически устойчивый MgH2 получают при повышенных температурах и давлении. Полимерные гидриды бериллия (BeH2)n и магния (MgH2)n синтезируют косвенным путем из бериллий- и магнийорганических производных. Гидриды ЭН2 являются сильными восстановителями; при нагревании разлагаются на элементы, легко окисляются на воздухе и разлагаются водой, например: BaH2 = Ba + H2 - при нагреве, СаН2(к) + О2(г) = Са(ОН)2(к), СаН2(к) +2Н2О(ж) = Са(ОН)2(ж) + 2Н2(г). На воздухе и в кислороде при нагревании металлы сгорают с образованием оксидов ЭО, основные свойства которых в группе резко усиливаются от Be к Ra. Оксиды металлов, кроме Bе, взаимодействуют с водой (мелкораздробленный оксид магния слабо) и образуют гидроксиды. В кислотах растворимы все оксиды; в щелочах только оксид бериллия, что указывает на его амфотерные свойства. При сплавлении BeO с кислотными и основными оксидами идут реакции, например: BeO + SiO2 ═ BeSiO3, Na2O + BeO ═ Na2BeO2. Оксид магния на воздухе постепенно поглощает влагу и углекислый газ, переходя в Mg(OH)2 и MgCO3. На практике оксиды бериллия и магния обычно получают термическим разложением их гидроксидов и солей. Взаимодействием оксидов стронция и бария с кислородом могут быть получены соответствующие пероксиды. При повышенных температурах они разлагаются: < 600oC BaO + ½ O2 BаO2 > 800oC Эта реакция использовалась в промышленности для получения кислорода из воздуха (метод Брина). 2 Пероксид бериллия неизвестен; пероксиды кальция и магния могут быть получены взаимодействием соответствующего гидроксида с концентрированным раствором пероксида водорода. Однако они малоустойчивы и получение их в чистом виде затруднено. Достаточно чистый ВаО2 получают при высушивании продукта взаимодействия гидроксида бария с пероксидом водорода: Ва(ОН)2 + Н2О2 = ВаО2 + 2Н2О. Пероксиды щелочно-земельных металлов кристаллические вещества, в воде трудно растворимы; в результате гидролиза дают щелочную реакцию, кислотой разлагаются с выделением слабой кислоты - пероксида водорода: ВаО2 + 2Н2О = Ва(ОН)2 + Н2О2, ВаО2 + Н2SО4 = Н2О2 + ВаSО4 . При взаимодействии с другими неметаллами s-элементы II группы образуют: с азотом - нитриды Э3N2, причём нитриды щелочно-земельных металлов являются ионными кристаллами; с галогенами – хорошо растворимые в воде, кроме фторидов Mg – Ba, галогениды ЭГ2, из них BeCl2 – полимерное вещество; c cерой – сульфиды ЭS; с углеродом – метаниды Э2C и ацетилиды ЭС2. Для магния и щелочно-земельных металлов известны силициды. Нидриды, сульфиды, карбиды, силициды при действии воды разлагаются: Э3N2 + 6H2O ═ 3Э(OH)2 + 2NH3, ЭS + 2H2O ═ Э(ОН)2 + H2S, Be2С + 4H2O ═ 2Be(OH)2 + CH4, CaC2 + 2H2O ═ Ca(OH)2 + C2H2, Mg2Si + 4H2O ═ 2Mg(OH)2 + SiH4. Отношение к сложным окислителям. Реакция металлов с водой с образованием гидроксидов и выделением водорода: Э + 2H2O ═ Э(ОН)2 + H2 термодинамически возможна для всех s-элементов II группы, однако бериллий и магний из-за оксидной пленки устойчивы к холодной воде; при нагревании же магний растворяется в ней. На практике гидроксиды получают косвенным путем. Основные свойства гидроксидов в группе усиливаются: если Be(OH)2 и Mg(OH)2 cлабые нерастворимые основания, то Sr(OH)2 и Ba(OH)2 являются щелочами. Гидроксид бериллия амфотерен; поведение его по отношению кислотам и щелочам можно представить следующей схемой: H+ H+ [Be(OH)4]2- [Be(OH)2] [Be(H2O)4]2+ OHOHГидроксид бериллия, как и карбонат, хорошо растворим в концентрированных растворах карбонатов s-элементов I группы и аммония с образованием комплексных бериллатов: Be(OH)2 + 2(NH4)2CO3 ═ (NH4)2[Be(CO3)2] + 2NH3 + 2H2O, 3 а гидроксид магния - в растворах солей аммония: Mg(OH)2 + 2NH4Cl ═ MgCl2 + 2NH4ОН, поскольку образующийся гидроксид аммония более слабое основание, чем гидроксид магния. Гидроксиды s-элементов II-группы при нагревании, в отличие от гидроксидов щелочных металлов (кроме лития), разлагаются на оксид и воду. Металлы IIA группы легко растворяются в разбавленных кислотахнеокислителях, если при этом не образуются малорастворимые соли (фториды, фосфаты) по общей схеме: Be + H2SO4 + 4H2O ═ [Be(H2O)4]SO4 + H2 Концентрированные азотная и серная кислоты пассивируют бериллий. Разбавленная азотная кислота может быть восстановлена до аммиака, например: 4Mg + 10HNO3 ═ 4 Mg(NO3)2 + NH4NO3 + 3H2O Растворы сильных щелочей растворяют только бериллий c образованием гидроксобериллат-ионов, устойчивых в водных растворах только при избытке щелочи: Be + 2NaOH + 2H2O ═ Na2[Be(OH)4] + H2 Вследствие относительно высокого поляризующего действия иона 2+ Bе , и в меньшей мере иона Mg2+, их соли подвергаются гидролизу: [Be(H2O)4]2+ + H2O ═ [Be(OH)(H2O)3]+ + H3O+ Гидроксоаквокомплексы бериллия способны к полимеризации с образованием многоядерных комплексов. Соли магния при взаимодействии с карбонатами щелочных металлов и аммония образуют трудно растворимые гидроксокарбонаты: 2MgCl2 + Na2CO3 + 2H2O ═ (MgOH)2CO3 + 2NaCl + 2HCl В водных растворах ионы Э2+ находятся в виде бесцветных тетра- и гексаквокомплексов [Э(H2O)n]2+, где “n”= 4 или 6, которые могут входить в состав кристаллогидратов: BeSO4.4H2O, MgCl2.6H2O, CaCl2.6H2O, SrCl2.6H2O и др. Из-за высокой химической активности применение Ca, Sr, и Ba как металлов невелико: их используют в качестве восстановителя в процессах получения ряда редких металлов, специальных сплавов, а также применяют в электровакуумной промышленности для поглощения газов (геттеры – газопоглотители (в переводе с английского)). Бериллий как хороший замедлитель и отражатель нейтронов используется в атомной энергетике, из него изготовляют контейнеры для урана-238, а высокая проницаемость для рентгеновских лучей позволяет применять его для изготовления “окошек” в рентгеновских трубках. Поскольку бериллий очень хрупок, изделия из него получают методом порошковой металлургии; как легирующая добавка он вводится в состав различных сплавов. Так, бериллиевые бронзы (сплавы на основе меди, содержащие до 2,5% Ве) обладают хорошей механической прочностью, устойчивостью против усталости, износа, коррозии. 4 Магний входит в состав многих сплавов, широко используемых в качестве конструкционных материалов. Важной областью применения магния является защита металлов от коррозии (протекторная защита). Как восстановитель он используется для магнийтермического получения бора, а также титана, циркония, ванадия и других металлов. Соединения s-элементов II группы широко применяются в промышленности, технике, лабораторной практике. Оксид бериллия, как и бериллий, находит применение в атомной энергетике (отражатель и замедлитель нейтронов в реакторах), а так же, как и оксид и магния, используется в качестве огнеупорных материалов и изделий из них. Оксид магния, кроме того, широко используется как наполнитель резиновых изделий и исходное сырьё для получения магнезиального цемента (цемента Сореля), использующегося в качестве вяжущего материала. Получают его смешением концентрированного раствора хлорида магния и оксида магния: MgO + MgCl2 + Н2O = 2MgOHCl Образующийся хлорид гидроксомагния при затвердевании полимеризуется в цепи типа – Mg – O –Mg – O – Mg – . Оксид кальция (негашеная или жженая известь) в промышленности получают термическим разложением карбоната кальция; при взаимодействии его с водой образуется гидроксид кальция (гашеная известь). При смешивании гашеной извести с едким натром в отношении 2:1 получают натровую (натронную) известь, использующуюся, например, в лабораторной практике для поглощения СО2. При действии хлора на гашеную известь получают так называемую хлорную или белильную известь, которую следует рассматривать как смешанную соль хлороводородной и хлорноватистой кислот CaOCl2 : Cl2 + Ca(OH)2 = CaCl(ClO) + H2O На базе карбоната и сульфата кальция готовят ряд строительных материалов (известковое молоко, гипс, алебастр и др.). Гипс – CaSO4∙2H2O и продукт его термической обработки алебастр – CaSO4∙0,5H2O используются в качестве вяжущих. Силикаты и алюмосиликаты кальция являются основой портландцементов. Перхлорат магния Mg(ClO4)2, хлориды кальция CaCl2 и CaCl2.6H2O входят в состав охлаждающих смесей, а также используются для осушки газов и поддержания постоянной влажности в замкнутом пространстве. Сульфаты, хроматы, манганаты бария являются пигментными материалами, а фосфаты и нитраты кальция используют в качестве удобрений. 5








