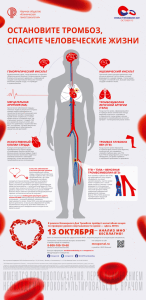
ФГБУ Новосибирский научно
реклама

ФГБУ «Новосибирский научно – исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина » Минздрава России На правах рукописи Елесин Дмитрий Анатольевич Сравнение результатов катетерной и торакоскопической аблации фибрилляции предсердий после не эффективной эндокардиальной изоляции легочных вен 14.01.26 – сердечно-сосудистая хирургия Диссертация на соискание ученой степени кандидата медицинских наук Научный руководитель: д.м.н проф. Покушалов Е.А. Новосибирск – 2014 ОГЛАВЛЕНИЕ Список условных сокращений...............................................................................4 Введение…………………………………………………………………………...6 Глава 1. Современные методы катетрной и хирургической аблации в лечении пациентов с фибрилляцией предсердий………………………………………..12 1.1. Механизмы развития фибрилляции предсердий......................................12 1.2. Катетерные технологии в лечения пациентов с фибрилляцией предсердий………………………………………………….……………………14 1.3. Осложнения катетерной аблации фибрилляции предсердий.....................26 1.4. Хирургические методы лечения фибрилляции предсердий......................29 Глава2. Материал и методы исследования.........................................................45 2.1. Дизайн исследования.....................................................................................45 2.2. Общая характеристика клинического материала…………………………49 2.3. Технология хирургической (торакоскопической) аблации........................53 2.4. Технология катетерных аблаций………………………………….…….….55 2.5. Имплантация аппарата для непрерывного подкожного мониторирования ЭКГ..........................................................................................................................62 2.6. Методики статистического анализа..............................................................63 Глава 3. Интраоперационный эффект катетерной и хирургической аблации.64 3.1. Конечные точки при хирургической и катетерной аблации..……………64 3.2. Феномен купирования………………………………………………………65 Глава 4. Отдаленный эффект торакоскопической и катетерной аблаций…...........................................................................................................…73 4.1. Антиаритмический эффект…………………………………………………73 2 4.2. Процент фибрилляции предсердий через 12 месяцев после оперативного лечения (AF Burden)……………………………………………………………..79 4.3. Аритмогенные эффекты…………………………………………………….80 4.4. Неблагоприятные события (осложнения)....................................................81 Глава 5. Обсуждение полученных результатов………………………………..83 Выводы…………………………………………………………………………...94 Практические рекомендации……………………………………………………95 Список литературы…………………………………...………………………….97 3 СПИСОК УСЛОВНЫХ ОБОЗНАЧЕНИЙ ААT антиаритмическая терапия ААП антиаритмические препараты АВК атрио-венозный контакт АВС атриовентрикулярное соединение АНС автономная нервная система ВНС вегетативная нервная система ВПВ верхняя полая вена ВСЭФИ внутрисердечное электрофизиологическое исследование ВЧС высокочастотная стимуляция ГС ганглионарные сплетения ИКМ имплантируемый кардиомонитор ИУЛВ изоляция устьев легочных вен КА катетерная аблация КС коронарный синус ЛВ легочные вены ЛЖ левый желудочек ЛП левое предсердие МК митральный клапан МПП межпредсердная перегородка НПВ нижняя полая вена ПП правое предсердие ПТ предсердная тахикардия ПФП пароксизмальная фибрилляция предсердий ПерсФП персистирующая фибрилляция предсердий РЧА радиочастотная аблация СР синусовый ритм СУ синусовый узел СФПЭ сложные фрагментированные предсердные электрограммы 4 ТК трикуспидальный клапан ТП трепетание предсердий ТСП транссептальная пункция ТЭ тромбоэмболии УЛВ устья легочных вен ФВ ЛЖ фракция выброса левого желудочка ФК функциональный класс ФП фибрилляция предсердий ХА хирургическая аблация ХМ холтеровское мониторирование ЧСС частота сердечных сокращений ЭГ электрограмма ЭКГ электрокардиография ЭКС электрокардиостимуляция ЭФИ электрофизиологическое исследование ЭХОКГ эхокардиография 5 ВВЕДЕНИЕ Актуальность проблемы Фибрилляция предсердий (ФП) считается одной из самых распространенных аритмий в мире (до 34 % всех нарушений ритма), которая приводит к ухудшению гемодинамики, снижению толерантности к физической нагрузке, ухудшает качество жизни человека. По данным Фрамингемского исследования, распространенность ФП достигает 0,5 % у пациентов в возрасте 50 – 59 лет, 4 % у пациентов старше 60 лет и до 15 % – у пациентов старше 70 лет [106]. Наиболее частыми последствиями фибрилляции предсердий являются инсульты, в результате тромбоэмболии с типичной локализацией источника тромбоза в ушке левого предсердия. Частота развития инсульта достигает 5 – 9,6 % в год среди пациентов группы риска, принимающих аспирин [50]. Наличие ФП увеличивает риск развития ХСН с 3,2 % до 20,6 % у мужчин и с 2,9 % до 26,0 % у женщин. Фибрилляция предсердий может появиться и на поздних стадиях развития ХСН, и является одним из проявлений тяжести поражения сердца. В настоящее время лечение фибрилляции предсердий включает: использование антиаритмических препаратов, радиочастотную катетерную аблацию, имплантацию ЭКС с антитахикардитическими режимами и классическую хирургическую процедуру «Лабиринт» с ее модификациями [3,4]. Однако, в лечении пациентов с фибрилляцией предсердий на первое место часто выходит медикаментозная терапия. Все антиаритмические препараты обладают проаритмогенной активностью даже в средних терапевтических дозах (примерно 10 % для каждого препарата, из которых 2 % составляют тахиаритмии типа torsades de pointes). С целью профилактики риска тромбоэмболических осложнений всем пациентам необходим прием антикоагулянтной терапии, которая снижает его в среднем на 68 %, но связана с возможностью развития (примерно, 1 – 2% в год) [106]. 6 жизнеугрожающих кровотечений Таким образом, терапия фибрилляции предсердий сводится к приведению сердечного ритма к нормоформе с помощью медикаментов, либо имплантации ЭКС с созданием искусственной атриовентрикулярной блокады. Подобная тактика является паллиативной и не устраняет фибрилляцию предсердий. В связи с этим сохраняются все негативные последствия ФП: инсульты, кровотечения, ХСН. В настоящее время разработаны методики радикального лечения ФП с использованием радиочастотной катетерной аблации. Тем не менее, средняя эффективность операции, по данным ряда авторов, составляет от 45 % до 75 % с учетом большого количества повторных процедур от 25 % до 40 % [1, 7, 8, 59, 118, 117, 124]. Электрическая реконнекция одной или более легочных вен (ЛВ) является частой находкой среди пациентов, которые возвращаются на повторную процедуру аблации после первичной катетерной (КА) или хирургической аблации (ХА) ФП [73]. На сегодняшний день отсутствуют клинические маркеры, которые могут указывать на наиболее целесообразный подход для пациентов с рецидивом ФП. Значение ХА в этой ситуации не было оценено. Кроме того, существует только одно рандомизированное исследование, сравнивающее КА и ХА в качестве первичной процедуры аблации ФП с эффективностью 36,5 % и 65,6 %, соответственно [17]. Данная совокупность, определяя актуальность проблемы и сформировала цель, которая легла в основу настоящего исследования. Цель исследования Целью этого проспективного рандомизированного исследования было сравнение эффективности и безопасности катетерной аблации с хирургической (торакоскопической) аблацией в лечении пароксизмальной и персистирующей фибрилляции предсердий после неэффективной изоляции легочных вен. В соответствии с целью исследования были определены следующие задачи: 7 1. Разработать методологический подход к торакоскопической аблации (изоляция правых и левых легочных вен одним коллектором, анатомическая аблация ганглионарных сплетений в области устьев легочных вен, создание радиочастотных линий по крыше и нижней стенке левого предсердия (Box lesion)) у пациентов с пароксизмальной и персистирующей формой фибрилляции предсердий после неэффективной катетерной аблации. 2. Провести оценку эффективности торакоскопического метода радиочастотной аблации в сравнении с катетерной аблацией (реизоляция легочных вен, анатомическая радиочастотная аблация ганглионарных сплетений левого предсердия) фибрилляции предсердий после неэффективной катетерной аблации. 3. Провести оценку безопасности торакоскопического метода аблации в сравнении с катетерной аблацией фибрилляции после неэффективной катетерной аблации. 4. Оценить количество эпизодов фибрилляции предсердий в послеоперационном периоде у пациентов из групп торакоскопической и катетерной аблации. 5. Оценить риск аритмогенных эффектов торакоскопического метода аблации по сравнению с катетерным методом аблации фибрилляции предсердий (левопредсердные ТП,ПТ). Научная новизна В ходе исследования впервые: 1. Будет разработан методологический подход к торакоскопической аблации (изоляция правых и левых легочных вен одним коллектором, анатомическая аблация ганглионарных сплетений в области устьев легочных вен, создание радиочастотных линий по крыше и нижней стенке левого предсердия (Box lesion)) фибрилляции предсердий у пациентов с пароксизмальной и персистирующей формой фибрилляции предсердий после неэффективной катетерной аблации. 8 2. Будет проведена оценка эффективности торакоскопического метода радиочастотной аблации в сравнении с катетерной аблацией (реизоляция легочных вен, анатомическая радиочастотная аблация ганглионарных сплетений левого предсердия) фибрилляции предсердий после неэффективной катетерной аблации. 3. Будет проведена оценка безопасности торакоскопического метода радиочастотной аблации в сравнении с катетерной аблацией фибрилляции предсердий после неэффективной катетерной аблации. 4. Будет оценено количество эпизодов фибрилляции предсердий (AF Burden) в послеоперационном периоде у пациентов из групп торакоскопической и катетерной аблации. 5. Будет оценен риск аритмогенных эффектов торакоскопического метода аблации, по сравнению с катетерным методом аблации фибрилляции предсердий (левопредсердные ТП, ПТ). Научно – практическая значимость В результате исследования определен подход к лечению ФП у пациентов после неэффективной катетерной аблации. Впервые доказана его клиническая эффективность, позволяющая достичь значительного положительного результата у 81 % пациентов с пароксизмальной ФП (ПФП) и персистирующей формами ФП (ПерсФП) после неэффективной катетерной аблации по сравнению с повторной катетерной аблацией (47 %). Получены новые научные знания о торакоскопическом подходе лечения ФП. Положения, выносимые на защиту Торакоскопическая аблация может быть методом выбора у пациентов с фибрилляцией предсердий после неэффективной катетерной аблации. 9 Эффективность торакоскопической аблации фибрилляции предсердий превышает таковую у катетерной после безуспешной эндокардиальной процедуры. Внедрение результатов исследования ФБГУ «Новосибирский НИИПК им. академика E.H. Мешалкина» Минздрава РФ располагает наибольшим в нашей стране опытом выполнения хирургической (торакоскопической) аблации у пациентов с ФП, что позволило сформировать собственные позиции в отношении преимуществ и недостатков различных модификаций этой операции. Основные положения и результаты диссертационной работы внедрены в повседневную клиническую практику кардиохирургических отделений ФБГУ «Новосибирский НИИПК им. академика E.H. Мешалкина» Минздрава РФ. Полученные данные используются в лекциях и на практических занятиях кафедры сердечно − сосудистой хирургии ФПК Новосибирского государственного медицинского университета. Полученные результаты исследования позволили сделать данную операцию более эффективной способствовать и безопасной, улучшению (торакоскопического) лечения что результатов ФП и более в целом будет хирургического широкому внедрению торакоскопической процедуры в кардиохирургических центрах России. Личный вклад Автор лично проводил обследование и отбор больных с фибрилляцией предсердий для процедуры торакоскопической аблации, принимал непосредственное участие в операциях, занимался предоперационной подготовкой и послеоперационным лечением больных, осуществлял диспансерное обследование и лечение в отдаленном послеоперационном периоде. Автор провел анализ клинических, лабораторных, инструментальных, электрофизиологических данных 64 пациентов; лично 10 провёл статистический анализ и интерпретацию данных, опубликовал эти результаты в центральной печати. Публикации и апробация работы По теме диссертации опубликовано 5 статей в центральных медицинских журналах и сборниках научных работ. Основные положения диссертации доложены на: - X международном славянском конгрессе по электростимуляции и клинической электрофизиологии сердца «Каридиостим», Санкт-Петербург, 2012. - I Российском конгрессе с международным участием по миниинвазивной и робот − ассистированной хирургии , Новосибирск, 2013. XI международном славянском конгрессе по электростимуляции и клинической электрофизиологии сердца «Каридиостим», Санкт − Петербург, 2014. постерный доклад на ежегодном съезде торакальных хирургов, Бостон (США). В рамках образовательного цикла «Восходящие звезды», проходящего на базе ФГБУ «ННИИПК 2014 г. произведено им. акад. ознакомление Е.Н. Мешалкина», молодых в июне специалистов кардиохирургического профиля регионов Сибири и Дальнего Востока с современным состоянием проблемы хирургического лечения фибрилляции предсердий. Объем и структура диссертации Диссертация состоит из введения, обзора литературы, главы с описанием клинического материала и методов исследования, главы собственных исследований и обсуждения полученных результатов, выводов и практических рекомендаций. Диссертация изложена на 117 страницах машинописного текста. Указатель литературы содержит 10 отечественных и 173 зарубежных источников. Работа иллюстрирована 6 таблицами и 33 рисунками. 11 ГЛАВА 1. СОВРЕМЕННЫЕ ХИРУРГИЧЕСКОЙ АБЛАЦИИ МЕТОДЫ В ЛЕЧЕНИИ КАТЕТЕРНОЙ ПАЦИЕНТОВ И С ФИБРИЛЛЯЦИЕЙ ПРЕДСЕРДИЙ (ОБЗОР ЛИТЕРАТУРЫ) Фибрилляция предсердии (ФП) является наиболее распространенной сердечной аритмией в клинической практике. Учитывая неутешительную эффективность и побочные эффекты, связанные с фармакологической терапией ФП, требуются новые методы лечения. За последнее десятилетие прогресс в понимании механизмов ФП в сочетании с совершенствованием методов катетерной аблации, стимулировали развитие хирургической и катетерной аблации в лечении ФП [179]. 1.1 Механизм развития фибрилляции предсердий До недавнего времени, множественные фокусные источники или гипотеза множественных триггеров была доминирующей моделью, описывающей механизм ФП [104]. Эта модель описывает ФП как несколько одновременно возникающих кругов ре – ентри. Количество триггеров в любой момент времени зависит от скорости проведения, массы предсердия и рефрактерного периода в различных частях предсердий. Фибрилляция предсердий усугубляется путем замедления проводимости, увеличения массы предсердий и короткого рефрактерного периода. Это создает теоретическую основу для катетерной и хирургической аблации с целью компартментализации левого предсердия (ЛП) [20]. С 1990-х годов становилось все более ясно, что некоторые формы ФП (особенно пароксизмальная ФП), вызванные эктопией, чаще всего происходят из мышечных муфт, располагающихся в устьях легочных вен (УЛВ). Стало также очевидным, что ФП может быть устранена аблацией этих триггеров. Дальнейшие исследования показали, что линейные воздействия, как и те, которые выполняются при хирургической процедуре Maze, часто являются аритмогенными из – за прорывов аблационных линий. В дополнение 12 к действующей в качестве источника триггера при ФП, ЛВ – ЛП соединения также оказались важным субстратом для поддержания более устойчивых форм ФП. Эти результаты способствовали картированию и аблации отдельных эктопических очагов и изоляции ЛВ, а не компартментализации левого предсердия. Аритмогенные очаги были также выявлены в других структурах сердца [20, 29, 59, 58, 76, 80, 91, 113]. В дополнение к этим моделям ФП, была проделана важная работа на моделях животных и человека по определению роли вегетативной нервной системы (ВНС) в возникновении и поддержании ФП у некоторых людей. Парасимпатические ганглионарные сплетения (ГС) расположены рядом с устьями ЛВ и могут являться мишенью для аблации. Автономные факторы также были вовлечены в создание сложных фракционированных предсердных электрограмм (СФЭ), являющихся потенциально важным субстратом ФП [68, 69, 98, 99, 132, 143, 159, 160, 161, 162, 181, 182]. Sharifov с соавт. сообщили, что сочетание инфузии изопротеренола и ацетилхолина является наиболее эффективным, чем ацетилхолин в индукции ФП [158]. Клинически, изменения вегетативного тонуса с привлечением как симпатической, так и парасимпатической нервной системы показали влияние на индукцию пароксизмальной ФП [15]. Эти результаты показали, что одновременное влияние симпатической и парасимпатической (симпатовагальной) системы носит профибриллирующий характер. Кроме того, имеются данные о повышенной симпатической с персистирующей формой ФП иннервации [57], предсердий предположив, что у больных потенциал измененного вегетативного субстрата может служить частью субстрата предсердий для поддержания ФП. Несмотря на эти предположения, механизмы ФП все еще остаются не полностью выясненными. В настоящее время широко признается, что для развития ФП требуется инициирующий фактор и анатомический субстрат, а также непосредственное участие ЛВ. Таким образом, доказано существование теории эктопического фокуса и множественных волн ре – ентри, а следовательно, оправдание для 13 различных и даже поэтапных подходов к аблации у пациентов с различными формами ФП. Кроме того, многочисленные механизмы могут сосуществовать друг с другом и меняться по мере прогресса пациентов от пароксизмальной к персистирующей ФП из – за ремоделирования ЛП [153, 20, 176]. С учетом успеха хирургических методов лечения ФП были разработаны несколько методик катетерной аблации ФП. 1.2. Катетерные технологии в лечении фибрилляции предсердий Остиальная изоляция устьев ЛВ (segmental ostial PV – isolation) заключается в локальных РЧ воздействиях на уровне анатомического устья ЛВ в областях имеющих электрическую активность (спайки легочных вен), что свидетельствует о роли этих участков в виде зон «входа» возбуждения в вену или «выхода» из нее [61, 60, 116]. Миокардиальные волокна, окружающие устья ЛВ, не являются непрерывными, а следовательно, нет необходимости выполнять циркулярную аблацию ЛВ. Сегменты, где присутствует мускулатура могут быть идентифицированы с помощью сигналов деполяризации высокой частоты, зафиксированных с помощью катетеров с несколькими парами электродов (катетер Lasso) или даже обычных катетеров. Выявленные сигналы могут быть успешно устранены путем аблации. Обычно только 25 % окружности ЛВ имеют такие волокна и достаточно от 1 до 5 радиочастотных аппликаций для полной изоляции ЛВ [60]. Таким образом, потенциалы аритмогенной вены могут быть выявлены и изолированы. В тех случаях когда нет эктопии, эмпирическая сегментарная изоляция левой и правой верхних ЛВ и левой нижней ЛВ может быть успешно выполнена, так как они являются наиболее распространенными источниками аритмий, которые вызывают ФП (рисунок 1,2). 14 Рисунок 1. Остиальная изоляция устьев ЛВ с использованием электрода Lasso – 2515 (Biosense Webster, США). 15 Рисунок 2. Фрагмент изоляции устья ПВЛВ. А − диагностический катетер Lasso расположен в устье ПВЛВ (отмечается высокоамплитудная активность муфты ЛВ); А – перед изоляцией; В – ПВЛВ изолирована (на катетере Lasso – стрелками показана собственная спайковая активность муфты ЛВ). Частые рецидивы проведения в устье ЛВ после данной процедуры подразумевали Cappato важную выявил роль «электрически – неактивного» восстановление проведения в 80 % миокарда. сегментарно изолированных устьев ЛВ [22]. Это стимулировало появление новой технологии циркулярной изоляции всех ЛВ вне зависимости от их электрической активности. Таким образом, антральная изоляция ЛВ, заключающаяся в электрической диссоциации устьев ЛВ от миокарда ЛП, впоследствии стала основной методикой аблации ФП [20, 178]. Циркулярная изоляция устьев ЛВ (circumferential ostial PV – isolation) Методика изоляции заключается в создании циркулярной линии на уровне устья вне зависимости от локализации участков «входа» с использованием катетера Lasso, который являлся не только диагностическим катетером, но и анатомическим ориентиром устья ЛВ [117; 125]. 16 В настоящее время – изоляция устьев легочных вен (ИУЛВ), при которой воздействие направлено на изоляцию триггерной и фокусной активности в устьях является «золотым стандартом» хирургического лечения ФП [59, 125]. Изоляция ЛВ сама по себе может быть достаточной стратегией для лечения пароксизмальной ФП у пациентов без значительных структурных заболеваний сердца, подтверждая это теми фактами, что большинство рецидивов после этой процедуры связаны с электрическим восстановлением проведения между ЛП и одной или более ЛВ [178, 28, 100, 121]. Однако, процедура изоляции ЛВ обеспечивает неутешительные результаты в других популяциях пациентов с ФП (т.е. постоянная ФП, ФП с застойной сердечной недостаточностью и ФП со структурным заболеванием сердца) [178, 81, 116], так как механизмы возникновения и поддержания ФП у пациентов могут отличаться. В настоящее время большинство исследователей используют различные методики для изоляции электрически активных легочных вен в левом предсердии или модификации левопредсердного субстрата вокруг ЛВ. Oral с соавт. сравнил две группы пациентов с сегментарной и циркулярной аблацией устьев легочных вен [117]. Эффективность в группе циркулярной аблации составила 88 % по сравнению с 67 % сегментарной аблацией легочных вен в период наблюдения 164 ± 100 дней, и небольшим количеством пациентов (по 40 пациентов в каждоий группе). Lemola исследовал две стратегии в лечении пациентов после неэффективной сегментарной РЧ изоляции устьев ЛВ: создание повторной циркулярной изоляции или дополнительных линий в ЛП, выявлено преимущество первого направления [96]. В то же время, обобщенный опыт всех Lasso − технологий (более 300 операций) свидетельствует о сохранении синусового ритма на фоне антиаритмических препаратов у 89 % пациентов и не более чем у 50 % без медикаментозной терапии [52]. Циркулярная аблация имела все же три ограничения [101]: 17 1) сниженный, но сохраняющийся риск стенозов устьев легочных вен; 2) невозможность эндовенозной изоляции узких вен (диаметром менее 10 мм); 3) трудности аблации в венах с анатомическими особенностями (единый коллектор, раннее ветвление вены, добавочная средняя ЛВ). Цикулярная паравенозная аблация (circumferential paraostial PV – isolation) Появление навигационной системы СARTO с высокой разрешающей пространственной способностью (менее 1 мм) позволило создавать непрерывные радиочастотные (РЧ) воздействия и, тем самым, проводить циркулярную изоляцию ЛВ на уровне миокарда предсердий, отступив от устья не менее 5 мм, что открыло новую эпоху технологиий СARTO (рисунок 3) [14, 126, 127]. Рисунок 3. (антральная изоляция УЛВ) 3D – анатомические изображения изоляции устьев легочных вен отдельными коллекторами. А – задняя проекция; Б – передняя проекция. Пионером этого направления стала Миланская школа электрофизиологии во главе с Carlo Pappone. Анатомическая близость устьев нижних и верхних вен, а также добавочные вены маленького диаметра делали удобной их совместную циркулярную изоляцию, что привело к появлению методики коллекторной циркулярной изоляции [107]. Процедура 18 полностью устраняла риск стенозов ЛВ и позволяла проводить изоляцию вен любой формы и диаметра [131]. В то же время отмечалось появление в качестве аритмогенного осложнения левопредсердных тахикардий в 10 % – 40 % случаев, что объяснялось появлением нескольких крупных изолированных областей в предсердной стенке [25, 33, 58]. Ouyang F. предложил для этой процедуры технологию двух Lasso, которые позиционировались в ипсилатеральных устьях ЛВ [128]. Возникновение изолинии на электрограммах обоих электродов свидетельствовало об изоляции коллектора. В исследовании 2004 года 560 пациентов были рандомизированы в группы циркулярной РЧ изоляции устьев ЛВ и той же методики, дополненной двумя линиями по крыше ЛП и в области митрального перешейка (рисунок 4) [122]. Рисунок 4. (циркулярная изоляция УЛВ) 3D – анатомические изображения аблационных линий. А – коллекторная изоляция. Б – В – создание межколлекторной линии по крыше левого предсердия, аблация левопредсердного «перешейка» от фиброзного кольца митрального клапана до нижнего полюса левого коллектора А, Б – задняя проекция; В – передняя проекция. 19 Рецидив ФП соответственно, наблюдался в то время у 14,3 % как и 12,9 % возникновение больных (NS) послеоперационных трепетаний предсердий (ТП) отмечено у 10 % и 3,9 % соответственно (снижение в 2,6 раза). Полная двухлетняя свобода от ФП составила 80 % при несущественной разнице между пароксизмальной (81 %) и хронической (76 %) формами [131]. Время операции, картирования и рентгеноскопии составили 162, 75 и 29 минут соответственно. Таким образом, классическая процедура Рappone проявила наименьший проаритмический эффект [131]. С другой стороны, если дополнительные линии не полноценны, риск проаритмий еще более усиливается [159]. Аблация митрального перешейка вносит дополнительные трудности в 40 – 60 % процедурах. В качестве критериев блокады перимитрального истмуса предложены: линия двойных потенциалов, удвоение локального времени проведения с абсолютными значениями более 150 мс при электрокардиостимуляции (ЭКС) из коронарного синуса (КС). Однако в 15 – 25% случаев сохраняются «шунтирующие» волокна вдоль коронарного синуса, что требует орошаемой аблации со стороны КС [27, 77]. По данным C. Pappone, до 90 % послеоперационных левопредсердных трепетаний были связаны с реактивацией митрального истмуса [130]. Chae S. с соавторами также показал, что около 90 % всех предсердных макро ре – ентри такикардий связаны с прорывами в предыдущих линиях аблации и распространенность этих аритмий может быть снижена за счет ограничения проведения числа линейных линейных воздействий, воздействий и подтвержденного изоляции легочных вен блока при первоначальной процедуре [25]. Тем не менее, линейные воздействия в левом 20 предсердии все еще остаются трудно выполнимыми и очень часто трудно добиться полного блока проведения по созданным линейным воздействиям. Сохраняющиеся прорывы проведения могут вызывать атипичное трепетание предсердий, частота которого варьирует от 2,6 % до 31 % [53]. Ouyang с соавт. сообщили о своем опыте у 41 пациента, которым была выполнена циркулярная изоляция ЛВ с использованием техники двойного Lasso под контролем системы «CARTO». Эффективность данной методики составила 95 % в 6 − месячный период наблюдения [123]. Таким образом, данная процедура претерпела множество модификаций и является достаточно эффективным методом катетерной аблации, но она не может обеспечить полной и долгосрочной свободы от ФП. Аблация ганглионарных сплетений левого предсердия (GP-ablation) Во многих экспериментальных и клинических исследованиях показана роль автономной нервной системы в индукции и поддержании ФП [41, 88]. В связи с этим, одним из потенциальных методов лечения ФП является радиочастотная аблация (РЧА) ганглионарных сплетений левого предсердия. Эффективность анатомического подхода уже доказана в ряде клинических исследований. Однако эффективность селективного поиска и аблации ГС остается неясной. Таким образом, еще один дополнительный метод лечения ФП (или, возможно, альтернативный) заключается в аблации ганглионарных сплетений ЛП. Впервые Ernst с соавт. показали, что электроанатомическое создание расширенных радиочастотных воздействий технически осуществимо только в правом предсердии [48]. Кроме того, эффективность воздействия в правом предсердии не подавляла идиопатическую ФП 21 у большинства пациентов. Тем не менее, в 2000 году Pappone с соавт. представили новый анатомический подход к циркулярной радиочастотной аблации устьев легочных вен с использованием 3D электроанатомической карты ЛП. Техника заключалась в нанесении нескольких РЧ аппликаций вокруг устьев ЛВ. Эффективность составила 85 % в течение 9 месяцев без стенозов легочных вен или тромбоэмболических осложнений [125]. Pappone с соавт. сообщили, что при линейной аблации УЛВ у 100 пациентов (в серии из 297 последующих случаев) наблюдалось замедление частоты синусового ритма (СР) или же замедление ЧСС при ФП [129]. При продолжении процедуры аблации эти эффекты исчезали. При 12 – месячном наблюдении было показано, что у 34,4 % пациентов, у которых проявилась описанная вагусная реакция, в 99 % случаев не отмечалось рецидивов ФП, а у остальных пациентов (без описанной вагусной реакции) лишь в 88 % отсутствовали рецидивы аритмии. В недавнем исследовании 60 пациентов с пароксизмальной и персистирующей формой ФП, у 33 из них была проведена стандартная изоляция УЛВ и аблация ГС в антруме ЛВ, а у 27 из этих пациентов – лишь изоляция ЛВ [161]. При недолговременном наблюдении, 91 % пациентов из первой группы не имели рецидивов ФП по сравнению с 71 % пациентов из второй группы. Выявление ГС может привести к улучшению результатов аблации, с учетом важной роли вегетативной нервной системы в запуске и/или поддержании ФП, по крайней мере у некоторых пациентов [161, 129]. Ганглионарные сплетения располагаются в эпикардильных жировых подушках полости ЛП. Эндокардиальная РЧ аблация ГС определяется с помощью высокочастотной стимуляции, на основании вагусного ответа. 22 Конечной точкой аблации является устранение вагусного ответа при высокочастотной стимуляции. В 2004 году Platt [135] впервые сделал попытку оценить возможности аблации ГС как самостоятельного метода лечения пациентов с ФП, не изменяя электрических свойств легочных вен. Для локализации расположения скоплений ганглионарных сплетений оценивали вагусную реакцию при высокочастотной стимуляции. У пациентов с пароксизмальной и хронической формой ФП удалось сохранить синусовый ритм в 84 % случаев в период наблюдения 6 месяцев. Последующей информации относительно результатов дальнейшего наблюдения этой группы пациентов в доступной литературе нет. В своем исследовании Lemery [95] повторил данное исследование. Однако результат через 8 месяцев наблюдения оказался не столь оптимистичен. У пациентов с пароксизмальной и персистирующей формой ФП эффективность составила только 50 %. При этом, в исследовании, с целью определения локализации ганглионарных сплетений скоплений, использовались различные уровни ВЧС эндокардиальной поверхности миокарда. Scanavacca выполнил поиск ГС скоплений с помощью высоко частотной стимуляции (ВЧС) как со стороны эндокарда, так и со стороны эпикарда [155]. В результате чего радиочастотная аблация была выполнена с обеих сторон. Интересно, что вагальная реакция была получена только у 7 из 10 пациентов (70 %), и только 1 (10 %) пациент проявил вагусную реакцию во время РЧА воздействия в областях, выявленных с помощью ВЧС. Интересно, что далеко не у всех пациентов удалось зарегистрировать вагусную реакцию с помощью ВЧС на участках, интенсивно иннервируемых автономной нервной системой. Важно отметить, что у пациентов, у которых 23 не было реакции на ВЧС, стандартная изоляция ЛВ в последствии привела к вегетативной денервации. Все эти данные говорят о низкой чувствительности метода ВЧС с целью выявления скоплений ГС и объясняет крайне низкую эффективность, полученную в данном исследовании, только 2 (29 %) пациента были свободны от рецидивов ФП в течение 8 месяцев наблюдения (рисунок 5). Рисунок 5. 3D − изображение левого предсердия в процеccе аблации ГС в задней (A) и передней (B) проекциях. A – аблация ГС в области левого верхнего и левого нижнего ганглионарных сплетений. В – аблация ГС в области правого верхнего и нижнего ганглионарных сплетений. Розовые маркёры – устья лёгочных вен, коричневые – радиочастотные аппликации, желтые – места с выраженной вагусной реакцией (брадикардия, асистолия), бежевый – момент купирования в области правой нижней легочной вены. ИУЛВ в сочетании с аблацией ганглионарных сплетений ЛП При циркулярной изоляции легочных вен воздействию подвергаются те места в ЛП, в которых сосредоточено максимальное количество ганглионарных сплетений, и случайно полученная автономная вегетативная денервация предлагается как способ оценки терапевтического эффекта 24 у пациентов с фибрилляцией предсердий [129, 161, 17]. Хотя изолированная аблация ганглионарных сплетений приносит противоречивые клинические результаты при пароксизмальной форме фибрилляции предсердий [83, 102], сочетание аблации ГС и ИЛВ увеличивает длительность свободы от ФП при катетерной аблации (эндокардиальной) [103,174] и при мини – инвазивной хируругической аблации (эпикардиальной) [16, 183]. С тех пор, как при обычной процедуре ИЛВ пересекаются 3 из 4 главных ГС, а также связка Маршала, возможно, что вегетативная денервация ГС играет главную роль в эффективности процедуры изоляции легочных вен. Katritsis и соавторы провели рандомизированное исследование, в котором сравнивали эффективность ИЛВ и сочетание ИЛВ с аблацией ГС у пациентов с пароксизмальной формой ФП [85]. Сочетание аблации ГС привело к лучшим результатам (83,5 % против 60,6 % свободы от ФП в течение 1 года наблюдения, приблизительно для 20 % пациентов процедура была повторной) (рисунок 6) [66]. А В Рисунок 6. 3 – D реконструкция ЛП. Изоляция устьев легочных вен в сочетании с анатомической аблацией ганглионарных сплетений (А – передняя поверхность, В – задняя поверхность). Изоляция ЛВ может быть достигнута сегментарным, циркулярным, либо антральным подходами с использованием различных методов визуализации, таких как рентгеноскопия, трехмерные электроанатомические карты (3 – D отображения), чреспищеводной эхокардиографии (TEE) и внутрисердечной эхокардиографии (ICE). Многие практикующие врачи перед процедурой используют данные компьютерной томографии (КТ) или магнитно – 25 резонансной томографии (МРТ). Эти методы используются в различных сочетаниях по усмотрению оператора и учреждения, чтобы исключить наличие тромба в ЛП, оценить анатомию ЛП и устьев ЛВ, простоту построения 3 – D карты, помощь в транссептальной пункции и облегчения манипуляций катетером во время процедуры. Поэтапный подход в использовании комбинации из нескольких стратегий аблации (изоляция ЛВ, линеийных воздеийствиий, и сочетание ИЛВ с аблацией ГС) показала высокую эффективность в купировании постоянной формы ФП [62]. Большое количество нерандомизированных исследований показали эффективность одной процедуры аблации у пациентов с пароксизмальной ФП между 38 – 78 %, в среднем 60 % [20]. У пациентов с ПерсФП эффективность после первой процедуры аблации варьировала от 22 – 45 %, в среднем 30 %, а у пациентов со смешанными типами ФП от 16 – 84 %. Повторные процедуры аблации были выполнены примерно в 25 % случаев, повысив эффективность на 10 – 20 % [20]. Учитывая все более возрастающий интерес к катетерной аблации вследствие ее эффективности в сравнении с медикаментозной терапией и безопасности по данным многоцентровых исследований, в российских клинических рекомендациях по диагностике и лечению пациентов с фибрилляцией предсердиий впервые отмечено, что катетерная аблация может являться первой линией терапии при изолированной ФП (класс рекомендаций I, уровень С), а при наличии гипертензии, ИБС, СН – второй линией терапии (класс IIА, уровень В) [3]. Однако в европейских рекомендациях также отмечено, что катетерная аблация фибрилляции предсердий может являться первой линией терапии (класс рекомендаций IIb, уровень С) [20]. 1.3. Осложнения катетерной аблации фибрилляции предсердий Основной риск осложнений при катетерной аблации ФП составляет приблизительно 6 %. Эти осложнения развиваются в результате тромбоэмболии, прямого и термического повреждения структур сердца [115]. 26 Сосудистые осложнения, в том числе бедренные гематомы, забрюшинные кровотечения и бедренные псевдоаневризмы являются наиболее частыми побочными эффектами аблации ФП [20]. Наиболее грозным осложнением аблации в ЛП является развитие предсердно-пищеводного практически в 100 % свища, случаев. летальность Точная которого частота данного достигает осложнения неизвестна, но риск примерно < 0,25 %. Связано это с расположением пищевода кзади от ЛП. Мониторинг температуры пищевода для предотвращения повреждения является важным во время аблации, но трудновыполнимым при аблации ФП. Эти методы включают МРТ/КТ, электроанатомическое построение, использование внутрипищеводного датчика температуры, приема бария, внутрисердечного ЭХО, снижение мощности и продолжительности радиочастотных аппликаций. Однако, ни один из этих методов не показал снижения клинически значимых повреждений пищевода, так как все они ограничены и частота этих осложнений является чрезвычайно редкой [20]. Данное осложнение обычно проявляется в период от 2 до 4 недель после процедуры с лихорадкой, ознобом и неврологической симптоматикой. Эффективным методом диагностики является МРТ или КТ. Эндоскопии следует избегать, так как вдувание воздуха в пищевод приводит к вторичному попаданию воздушных эмболов [20]. Частота стенозов устьев ЛВ составляет 1 – 38 %. Причинами этих больших изменений являются: метод скрининга (обычный против симптоматического), различия в методике аблации и определения стенозов [20]. В начале развития эпохи катетерной аблации ФП, не было известно, что радиочастотная энергия выполняемая в ЛВ приведет к стенозам. Опыт и улучшение рентген − изображений привело к снижению частоты этого осложнения. В настоящее время, стеноз определяется как процент сужения 27 просвета ЛВ: мягкий < 50 %, умеренный 50 – 70 % и тяжелый > 70%. Симптомами стеноза ЛВ могут быть кашель, кровохарканье, одышка, боль в грудной клетке и инфекция легких [43, 152]. Тем не менее, степень тяжести стеноза ЛВ не всегда коррелирует с симптомами. Тяжелая или даже полная окклюзия ЛВ может протекать бессимптомно, в связи с компенсационным расширением ипсилатеральных вен. Методы исследования включают КТ, МРТ, ЧП ЭХО и легочную венографию [20]. Риск развития тромбоэмболий при катетерной аблации ФП составляет 0 – 7 % [20, 23]. Как правило, они развиваются в течение первых 24 часов с высокой степенью риска в первые 2 недели после аблации [115]. В качестве объяснения данного осложнения можно предположить: радиочастотная аблация вызывает трансмуральное повреждение стенки миокарда и активирует внешний каскад свертывания крови, что может привести к системной тромбоэмболии [115], тромбы могут развиваться на проводниках или катетерах, расположенных в ЛП и смещаться при их манипуляции [18]. Внутрисердечное ЭХО позволило выявить тромбы ЛП в 10 % случаев при катетерной аблации ФП [148]. Эти данные привели к более агрессивному протоколу антикоагулянтной терапии у пациентов с ФП и активированным временем свертывания до 350 – 400 секунд. Вероятность тампонады сердца составляет 2 – 6 %. Риск тампонады сердца значительно выше электрофизиологических необходимость при аблации процедурах непрерывного введения ФП, чем при других по нескольким причинам: антикоагулянтов во время процедуры, двойной транссептальной пункции и обширной аблации и манипуляции в ЛП [20]. Другие факторы риска включают линейные аблации и высокую мощность аблации [72]. Измерение прямого артериального давления, наличие эхокардиографии и внутрисердечного ЭхоКГ являются важными инструментами для быстрого выявления тампонады сердца. 28 Тампонада обычно легко устраняется пункцией перикарда и введением протамина. Тем не менее, в редких случаях требуется хирургическое ушивание места перфорации [19]. Повреждение диафрагмального нерва является редким осложнением катетерной аблации ФП и составляет 0 – 0,48 %. 1.4 Хирургические методы лечения фибрилляции предсердий Накопление знаний о причинах развития ФП и интенсивные экспериментальные исследования в Вашингтонском университете (St. Louis) под руководством James L. Cox в 1987 привели к переломной точке в хирургическом лечении ФП, которой явилась операция «лабиринт» (Maze procedure) [35]. Операция была электрофизиологически обоснована и анатомически ориентирована, основана на теории множественных кругов macro re − entry, формирующихся вокруг анатомических образований (устьев легочных вен и коронарного синуса, верхней и нижней полых вен, ушек предсердий, отверстий атриовентрикулярных клапанов). В основу была положена концепция изоляции этих образований и прерывание путей проведения вдоль митрального и трикуспидального клапанов. Первая операция у больного с ФП была выполнена J. Сох 25 сентября 1987 года [36]. Смысл операции заключался в создания серии разрезов стенки предсердий с последующим ее сшиванием (техника «cut and sew» или «разрезать – и − сшить») для разрыва всех потенциально возможных кругов «re – entry». Электрический импульс, выходя из любой точки предсердия, не мог вернуться в эту же точку без пересечения линии (принцип лабиринта). Хирургически был создан один маршрут следования импульса от синусового узла к атриовентрикулярному с многочисленными тупиками по пути, при 29 этом волна возбуждения распространялась по лабиринту, постепенно охватывая весь предсердный миокард (рисунок 7). Рисунок 7. Схема движения электрического импульса по предсердиям при выполнении процедуры maze [Cox J., Schuessler R., D’Agostino H. Jr et al., 1991]. SAN – сино-атриальный узел; RAA – ушко правого предсердия; PVs – площадка легочных вен; LAA – ушко левого предсердия; AVN – атрио-вентрикулярный узел. Однако, как выяснилось впоследствии, механизм работы процедуры основывался не только на прерывании всех потенциально возможных кругов macro re − entry. Важными факторами, купирующими ФП оказались уменьшение критической массы предсердного миокарда при выполнении его фрагментации, парциальная денервация, связанная с отсечением площадки легочных вен и редукция полости предсердий, как следствие вовлечения части ткани в швы. Первые сообщения о хороших непосредственных результатах лечения ФП с использованием операции «лабиринт» были сделаны Сох J.L. в 1991 году [35]. Из дальнейших сообщений было видно, что в серии из 346 пациентов успешное восстановление CP достигалось в 99 % случаев и лишь у 2 % пациентов требовалась длительная терапия антиаритмиками после операции. 30 Однако исследование пациентов, подвергшихся операции «лабиринт», в отдаленном периоде выявило две основные послеоперационные проблемы: 1) развитие дисфункции синусового узла (СУ), что требовало либо имплантации ЭКС, либо, в более легких случаях, ограничивало физическую активность пациентов из − за невозможности генерировать соответствующую нагрузке синусовую тахикардию; случаи послеоперационных дисфункций ЛП. 2) Рисунок 8. Двухмерное схематическое изображение процедуры maze I. (Предсердия разделены в сагиттальной плоскости, и передняя половина предсердия помещается выше. На правом рисунке представлена поверхность МПП со стороны правого предсердия. Стрелки обозначают направление движения импульса, идущего от синоатриального узла) [Cox J., Schuessler R., D’Agostino H. Jr et al., 1991]. Первоначальная процедура maze I включала несколько разрезов вокруг СУ, один из которых был расположен непосредственно впереди перехода верхней полой вены (ВПВ) в правом предсердии (ПП), то есть через область синусовой тахикардии (рисунок 8) [57]. Подозрение, что этот разрез мог препятствовать возникновению в соответствующих ситуациях синусовой тахикардии после операции, не возникало до клинического использования процедуры maze по следующим причинам. Во − первых, на начальных этапах факт неспособности генерировать 31 синусовую тахикардию в соответствующих ситуациях после операции не был замечен, а во – вторых, область синусовой тахикардии в правом предсердии не была идентифицирована у людей, пока процедура «лабиринт» не вошла в клиническую практику. В дальнейшем стало очевидным, что этот разрез был наиболее вероятной причиной, в результате которой синусовая тахикардия не развивалась при максимальной нагрузке у ряда пациентов. Процедура maze I была усовершенствована – были исключены разрезы вокруг СУ. При этом, стало необходимым добавить противоразрез на передней стенке ПП, чтобы предотвратить круг re − entry, развивающийся вокруг его основания. Разрез, который ранее продолжался от основания отсеченного ушка ПП через межпредсердную перегородку (МПП) и затем поперек купола ЛП к основанию его ушка, также должен был быть модифицирован. Так, чтобы синусовый импульс мог проходить вперед, поперек ЛП, и чтобы не возникало круга re − entry вокруг отверстия ВПВ, было необходимо переместить разрез купола ЛП слегка назад и закончить его правый конец в середине отверстия ВПВ (рисунок 9) [57]. Главная проблема этой модификации процедуры состояла в том, что необходимо выполнить полный поперечной разрез ВПВ, чтобы получить достаточную экспозицию левого предсердия. Рисунок 9. Двухмерное схематическое изображение процедуры maze II. (Предсердия разделены в сагиттальной плоскости, и передняя половина предсердия помещается выше. На правом рисунке представлена поверхность МПП со стороны правого предсердия. 32 Стрелки обозначают направление движения импульса, идущего от синоатриального узла) [Cox J., Schuessler R., D’Agostino H. Jr et al., 1991]. Комбинация состоящая из перемещения разреза купола ЛП назад с добавлением переднего противоразреза ПП решила проблему фрагментации вокруг СУ, особенно через область синусовой тахикардии, и также предотвратила круги re − entry вокруг основания ПП или отверстия ВПВ. Таким образом, maze II соответствовал maze I в эффективности предотвращения ФП и имел теоретическое преимущество в связи с тем, что присутствовало меньше неблагоприятных эффектов на СУ и внутрипредсердную проводимость. К сожалению, с этой модификацией были связаны существенные новые технические проблемы. Поскольку положение разреза купола ЛП определяет позицию разреза МПП, то перемещение первого разреза назад, также смещает и разрез МПП. Это делает экспозицию разрезов ЛП чрезвычайно трудной. Фактически, после этих модификаций, единственный способ получать адекватную экспозицию ЛП состоял в том, чтобы отсечь ВПВ и отодвинуть ПП вперед. Важно отметить, что как при maze I, так и при maze II, два разреза заканчиваются в области устья ВПВ (рисунки 8 и 9) [57]. Фактически, невозможно зашить два разреза без сужения дистального участка ВПВ. Таким образом, для закрытия этих разрезов необходимо использовать заплаты. При завершении операции maze II было необходимо закрыть два продольных разреза в дистальной части ВПВ, сначала в один из них вшивалась заплата, а затем сшивались разделенные участки ВПВ, все это выполнялось на 2−3 см участке ВПВ. Обширные операционные манипуляции, проводимые в ограниченной области устья ВПВ, делала процедуру технически сложной и отнимающей много времени. Кроме того, операция maze II не устраняла частые послеоперационные дисфункции ЛП. В результате требовались дальнейшие модификации этой технологии. 33 Первоначальные исследования на животных, оценивающие эффекты процедуры maze I на предсердные потоки крови, выявили, что множественные атриотомные разрезы не вызывали ранней или поздней ишемии миокарда предсердий [165, 63, 36]. Поэтому очевидное нарушение функции левого предсердия у некоторых пациентов после операции побудило к поиску других причин. Поскольку была зарегистрирована нормальная функция ПП у всех пациентов, как в раннем, так и позднем послеоперационном периоде, наиболее вероятным объяснением нарушения функции ЛП была задержка внутрипредсердного проведения. Связь между нарушением внутрипредсердной проводимости и отсутствием функции ЛП можно объяснять следующим образом. Обычно, синусовый импульс образуется около вершины правого предсердия и быстро распространяется (в течение примерно 40 мсек) по пучку Бахмана, толстому пучку предсердных мышечных волокон, идущих от области СУ к вершине ЛП [21]. Это быстрое достижение синусовым импульсом ЛП позволяет двум предсердиям активироваться практически одновременно сверху донизу, что обеспечивает наиболее эффективное изгнание крови из предсердий в соответствующие желудочки. Пучок Бахмана либо рассекается, или включается в шов разреза крыши ЛП при процедурах maze I и maze II соответственно. Поэтому импульс от синусового узла не может так же быстро, как в норме, достичь ЛП. Действительно, после maze I и maze II у некоторых пациентов синусовому импульсу требуется до 150 мсек для того, чтобы достичь ЛП. Если атриовентрикулярный интервал у таких пациентов также составляет около 150 мсек, то синусовый импульс достигает ЛП и ЛЖ практически одновременно. В результате, они и сокращаются одновременно и, поэтому, эффективного предсердного сокращения не происходит. В то время, как активация ПП предшествует на 150 мсек сокращению правого желудочка (ПЖ), и функция ПП оказывается нормальной. 34 Чтобы преодолеть проблему удлиненной межпредсердной проводимости, процедура maze II была модифицирована. Разрез крыши ЛП больше смещался назад, что в свою очередь, привело к смещению предсердной септотомии также назад (рисунок 10). Эта довольно незначительная модификация, которая была названа maze III привела к нескольким техническим и функциональным усовершенствованиям процедуры. Во-первых, предсердную септотомию, располагающуюся теперь сзади ВПВ, можно превосходно было выполнять с левой стороны сердца. Кроме того, при процедуре maze III только один разрез распространялся до устья ВПВ, поэтому не было необходимости использовать перикардиальную заплату. Таким образом, новая модификация процедуры позволила устранить хронотропную некомпетентность синусового узла и дисфункцию левого предсердия, а также стала более простой в техническом отношении. Рисунок 10. Двухмерное схематическое изображение процедуры maze III. (Предсердия разделены в сагиттальной плоскости, и передняя половина предсердия помещается выше. На правом рисунке представлена поверхность МПП со стороны правого предсердия. Стрелки обозначают направление движения импульса, идущего от синоатриального узла) [Cox J., Schuessler R., D’Agostino H. Jr et al., 1991]. 35 Процедура maze III (cut and sew), являясь золотым стандартом, содержит ряд моментов, которые ограничили использование этой операции в настоящее время. Операция технологически сложна, не все хирурги могут её выполнять. Значительное увеличение времени аноксии миокарда ограничивает её выполнение у пациентов высокого риска с выраженной систолической дисфункцией миокарда и рядом сопутствующей патологии. Существует достаточно высокий риск такого специфического осложнения как кровотечение. Перечисленные негативные эффекты технологии ‘cut and sew' способствовали активному поиску альтернативных методик. Первым реализованным подходом к решению этой проблемы было появлению ряда модифицированных методик, которые имели под собой определенную научно-экспериментальную базу. Zoltan Szaley с соавт. (1999) разработали мини − вариант операции maze III. Цель этой операции состояла в том, чтобы уменьшить время пережатия аорты, минимизировать ущерб для важных структур, например огибающей коронарной артерии и коронарного синуса, но тем не менее прервать наиболее частые цепи re – entry. Чтобы уменьшить операционный риск, время пережатия аорты и время ИК, не выполнялись следующие разрезы по сравнению с операцией maze III: эндокардиальный разрез к трехстворчатому и митральному кольцам, а также разрезы МПП. Таким образом, значительно сокращалось время ИК и пережатия аорты (рисунок 11 a, b). Хотя и не выполнялись все разрезы, предложенные J. Сох, 90 % пациентов в группе мини-лабиринт с диаметром ЛП < 70 мм имели CP через год после операции [167]. 36 Рисунок 11 (a). Разрезы (пунктирная линия) по схеме мини-maze (правые отделы). (a) Продольный разрез правого предсердия; (b) Т − образный разрез от продольного разреза в проекции канюли НПВ по латеральной стенке правого предсердия до правой АV борозды; (с) Резекция ушка правого предсердия; Рисунок 11 (b.) Разрезы (пунктирная линия) по схеме мини − maze (левые отделы). (d) Резекция ушка левого предсердия; (e) Циркулярный разрез вокруг легочных вен; (f) Разделение мостика ткани между резецированным ушком и изолированной площадкой легочных вен [Szalay Z.A. et al,1999]. 37 RAA – ушко правого предсердия; TV – трикуспидальный клапан; FO - овальная ямка; CS коронарный синус; VCS - верхняя полая вена; VCI - нижняя полая вена; LAA – ушко левого предсердия; СХ – огибающая артерия; MV - митральный клапан; LSPV, левая верхняя легочная вена; LIPV – левая нижняя легочная вена; RSPV – правая верхняя легочная вена; RIPV – правая нижняя легочная вена. Вторым подходом к решению проблемы сложности классической процедуры и ее травматичности было использование альтернативной технологии создания подобных линий, как и при выполнении процедуры maze III. Несмотря на появившиеся публикации японских авторов, которые уже имели опыт замещения части классических разрезов криодеструкцией, [90] на лидирующие позиции в качестве альтернативы стала выходить радиочастотная аблация. К интраоперационному использованию РЧ – энергии хирургов подтолкнули клинические исследования М. Наissaguere с соавт. (1994 – 1996) Применение радиочастотной энергии для репликации процедуры maze в эксперименте на открытом сердце (рисунок 12) было выполнено Arif Elvan, что позволило уменьшить возможность индуцирования ФП и ее продолжительность при возникновении [46, 47]. М. Наissaguere одним из первых использовал идею профессора J. Сох о создании электрически изолированных зон предсердий, т.е. уменьшения критической массы предсердия и выполнил трансвенозную модификацию операции maze. Катетерной РЧ – аблации были подвергнуты 78 пациентов с ФП сроком от 2 – х до 30 мес. с использованием монопополярных электродов с температурным контролем. Накопленный за 3 года опыт позволил авторам уменьшить время флюороскопии с 300 мин до 75 мин. Однако, несмотря на меньшую травматичность, данная процедура была в 2 38 раза менее эффективна, чем операция maze на открытом сердце, и нецелесообразна при наличии у больного сочетанной клапанной патологии. Рисунок 12. Локализация эпикардиальных линий РЧ – аблации (верхний рисунок). A – линия вокруг ушка ПП; B – линия вокруг ушка ЛП; C – линия в поперечном синусе; D – линия располагающаяся от середины ВПВ к линии А; E – линия по латеральной поврехности от ВПВ к НПВ. Область (заштрихованная зона) эндоваскулярной аблации в коронарном синусе (нижний рисунок) [Elvan A. et al. 1995]. LAA – ушко левого предсердия; IVC – нижняя полая вена; RAA – ушко правого предсердия; SVC – верхняя полая вена; MV – митральный клапан; CS – коронарный синус; TV – триуспидальный клапан; PV – легочные вены, AVN – атриовентрикулярный узел. Несмотря на наличие работ подтверждающих эффективность монополярной аблации и возможность достижения трансмуральности [170], существует ряд факторов, ограничивающих ее широкое использование. Нет четких критериев длительности воздействия монополярным электродом в каждой точке его приложения. Аблация с помощью монополярных электродов является более “хирург – зависимой”, чем биполярная, так как отсутствует эффективный контроль трансмуральности создаваемых повреждений, а эффект оценивается только визуально по изменяющемуся цвету эндокарда. Известный способ стимуляции ЛВ также не позволяет 39 судить о создании «хорошей зоны» коагуляционного некроза тканей, т.к. при радиочастотном воздействии может наступать временный электрофизиологический блок проведения с последующим восстановлением нормальной проводимости [112]. Следует еще отметить, что результат полной пенетрации предсердной ткани при использовании монополярной аблации зависит от анатомических особенностей пациента и в 25 % случаев не позволяет достигать трансмуральности в наиболее толстой зоне левопредсердного истмуса [40]. Еще одним негативным моментом использования монополярного электрода, является отсутствие строгой направленности радиочастотной энергии, что может приводить к повреждению соседних анатомических структур во время аблации [93] и прежде всего пищевода, огибающей артерии и коронарного синуса [54, 105, 163]. Описаны способы профилактики этих осложнений – так Mohr F.W. предлагал проводить марлевый тампон в косой синус перикарда [105], Khargi K. рекомендовал во время аблации приподнимать пинцетом зону наиболее тесного предлежания левого предсердия к пищеводу [87]. Все перечисленные выше проблемы монополярной аблации дали серьезный толчок для разработки биполярных устройств и развития этой технологии. В 2002 году S. Prasad с соавт. впервые продемонстрировали преимущества биполярной аблации в эксперименте на животных [145, 146]. Технология биполярной аблации впервые была реализована в клинической практике в 2002 году компанией AtriCure. Появление биполярных аблационных зажимов вывело процедуру РЧА у пациентов с ФП на совершенно новый уровень. Была разработана технология, которая замещала стандартные разрезы операции maze III аблационными линиями, созданными биполярным зажимом, и впоследствии была названа процедурой maze IV [51, 37]. В 2008 году Benussi S. была описана технология полной левопредсердной биполярной аблации. Основным ключевым моментом 40 процедуры является выполнение линии к митральному клапану с использованием только биполярного зажима. Технология направлена на предупреждение оценивается повреждения коронарография огибающей пациентам, артерии. особенно Предварительно необходимо быть осторожным при левом доминантном типе кровотока. Интраоперационно, на параллельном ИК, до пережатия аорты, инспектируют маргинальные ветви огибающей артерии и правой коронарной артерии, используя 20 мм иглу для подкожных инъекций. Её втыкают в заднюю стенку левого предсердия непосредственно над коронарным синусом, отмечая таким образом середину области атриовентрикулярной борозды свободной от коронарных артерий. Далее, после окклюзии идентифицируется игла, аорты которая и открытия удаляется, а левого предсердия, биполярный зажим позиционируется по месту инъекции иглы. Выполнение этой технологии с использованием только биполярного зажима имеет биполярная два аблация с обоснования: электрофизиологическое – полная достоверным достижением трансмуральности; экономическое – возможность использования только одно аблационного устройства [13]. Одним из основных моментов, который возник после появления биполярной РЧА, был вопрос о сопоставимости результатов процедуры maze III ‘cut – and − sew’ и РЧ биполярной аблации по схеме maze IV. Два основных опубликованных исследования окончательно не прояснили ситуации. Коллектив из Вашингтонского университета под руководством Damiano R. провели анализ результатов 242 пациентов (154 выполнена Cox − maze III ‘cut and sew’ и 88 Cox − maze IV с использованием AtriCure bipolar). Они не получили достоверных различий в сроке пребывания больных в палате реанимации и госпитализации, также не было получено достоверных различий в 30 – дневной смертности, имплантации стимулятора, риске инсульта и выживаемости. Свобода от ФП была более 90 % в обеих группах в течение года. Значительно дольше было время 41 пережатия аорты при процедуре Cox − maze III. Напротив, Stulak J. и коллеги из клиники Мейо показали сопоставимость результатов к 6 месяцам (91 % для maze III и 87 % для РЧ – аблации) и значительную разницу свободы от ФП через 12 месяцев (91 % для maze III и 76 % для РЧ – аблации) c дальнейшим снижением эффективности процедуры аблации (свобода от ФП к 15 месяцу составила всего 62 %) [166]. Однако следует отметить, что оба исследования не были рандомизированными со сравнением групп пациентов оперированных в разные временные промежутки. Классическая процедура лабиринт (Maze III) и ее модификации являлись золотым стандартом в хирургическом медикаментозно − рефрактерной лечении фибрилляции симптоматической предсердий. Несмотря на высокую эффективность, данная процедура не получила широкого применения вследствие технической сложности, большой инвазивности процедуры и использовании искусственного кровообращения [12]. Менее травматичные оперативные вмешательства были внедрены в результате расширения знаний о патофизиологии ФП, а так же развития аблационных методик и устройств, которые заменяют оригинальную технику “разрез – шов”. Wolf и соавторы разработали методику, при которой изоляция ЛВ и РЧА ганглионарных сплетений левого ЛП выполняется через двусторонний торакотомный доступ [177]. Торакоскопическая процедура менее инвазивна, снижает количество периоперационных осложнений и дискомфорт пациента. РЕЗЮМЕ Таким образом, в настоящее время существует целый ряд различных подходов к аблации ФП. Эффективность одной процедуры катетерной аблации составляет приблизительно 60 % для пароксизмальной ФП (ПФП) и 40 % для персистирующей ФП (ПерсФП) [24, 170]. На сегодняшний день является актуальной необходимость повторных процедур, особенно при непароксизмальных формах ФП, когда одна 42 процедура РЧ аблации ЛВ недостаточна для поддержания СР [22, 28, 94]. Рецидивы ФП или предсердных тахикардий после первичных процедур аблации ФП требуют повторных процедур у 20 – 40 % пациентов [89]. Поскольку ранние рецидивы ФП и/или развитие предсердной тахикардии встречаются довольно часто в течение первых двух или трех месяцев после аблации ФП, и они могут проходить спонтанно, существует общее мнение, что повторные аблации следует проводить как минимум через 3 месяца после первичной процедуры [114, 150]. Некоторые пациенты испытывают высоко симптоматичные предсердные нарушения ритма, не поддающиеся лечению антиаритмическими препаратами или препаратами, замедляющими атриовентрикулярное проведение. Большинство исследований показывают, что у пациентов с неэффективной первичной попыткой аблации, при повторной процедуре выявляется восстановленное проведение в первично изолированных ЛВ. Таким образом электрическая реконнекция одной или более ЛВ является частой находкой среди пациентов, которые возвращаются на повторную процедуру аблации после первичной катетерной или хирургической процедуры аблации ФП [73]. Катетерная радиочастотная изоляция устьев легочных вен с денервацией ганглионарных сплетений считается в настоящее время «золотым стандартом» интервенционного лечения ФП у пациентов без структурной сердечной патологии. Однако и ее эффективность не является абсолютной, так как этот вид операции сопровождается большим числом повторных вмешательств и риском проаритмогенных и кардиальных осложнений. На сегодняшний день отсутствуют клинические маркеры, которые могут указывать на наиболее целесообразный подход для пациентов с рецидивом ФП. Ряд исследований продемонстрировал, что эффективность антиаритмических препаратов (ААП) по сравнению с повторной аблацией у пациентов после неэффективной первичной аблации в течении первого года наблюдения по данным имплантированного 43 кардиомонитора (ИКМ) составляет 27 % и 58 %, соответственно [193, 141]. Значение ХА в этой ситуации не было оценено. Кроме того, существует только одно рандомизированное исследование, сравнивающее КА и ХА в качестве первичной процедуры аблации ФП с эффективностью 36,5 % и 65,6 %, соответственно [17]. Таким образом, целью данного проспективного рандомизированного исследования явилось сравнение эффективности и безопасности катетерной и хирргической аблации в лечении пациентов с ПФП и ПерсФП после первичной неэффективной эндокардиальной изоляции ЛВ. 44 ГЛАВА 2. МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ 2.1. Дизайн исследования Всем пациентам с симптоматической пароксизмальной фибрилляцией предсердий или персистирующей фибрилляцией предсердий была выполнена первичная эндокардиальная аблация ФП с января 2011 года по ноябрь 2011 года в Федеральном Государственном учреждении Новосибирский НИИ патологии кровообращения имени академика Е. Н. Мешалкина». Из 192 пациентов, 77 (40 %) имели рецидивы ФП и показания к повторной аблации. Из этих пациентов, 64 (83 %) пациента c симптоматической ФП, после «слепого» периода (пароксизмальная ФП была зарегистрирована у 59 % пациентов и персистирующая ФП у 41 %) были включены в данное исследование и рандомизированы (торакоскопической) аблациии (n = 32) в группу или хирургической катетерной аблации (n = 32; рисунок 13). 13 пациентов не подошли по критериям включения или не дали свое согласие на участие в исследовании. 192 пациента с симптоматической ПФП/ПерсФП после первичной ИЛВ 77 пациентов с рецидивирующей формой ФП Не соответствуют критериям включения (n=13) 64 пациента с симптоматической ПФП/ПерсФП, после неэффективной РЧА Рандомизация Группа ХА (n=32) - 20 ПФП - 12 ПерсФП Группа КА (n=32) - 18 ПФП - 14 ПерсФП Рисунок 13. Дизайн исследования 45 Клиническая часть исследования включает анализ данных 64 пациентов, оперированных по поводу рецидива фибрилляции предсердий после первой неэффективной катетерной аблации за период с 2011 по 2013 годы в Федеральном патологии Государственном кровообращения учреждении имени академика Новосибирской Е. Н. НИИ Мешалкина». Неэффективная первичная процедура аблации ФП расценивалась при наличии рецидива ФП/ТП/ПТ после трех месяцев послеоперационного наблюдения (слепой период/blanking period). Первой группе пациентов (n = 32) была выполнена торакоскопическая аблация с использованием видео − ассистента, второй группе пациентов (n = 32) выполнена радиочастотная катетерная реизоляция легочных вен. Критерии включения: пациенты с симптоматичной пароксизмальной или персистирующей формой фибрилляции предсердий после первичной неэффективной катетерной аблации; Критерии исключения: 1. пациенты с застойной сердечной недостаточностью; 2. тромбоз левого предсердия (ЛП); 3. фракция выброса ≤ 35 %; 4. диаметр ЛП более 65 мм; 5. хирургически некорригированный врождённый или приобретённый клапанный порок сердца; 6. значимые стенозы коронарных артерий, трансмуральный инфаркт миокарда в анамнезе, ишемическая кардиомиопатия; 7. пациенты с перенесенными открытыми вмешательствами на грудной клетке; 8. тиреотоксикоз; 9. острая соматическая патология (обострение язвенной болезни желудка, острый холецистит, острый панкреатит, обострение бронхиальной астмы и т.д.). 46 Этапы исследования (табл. 1): I – дооперационный: до катетерной аблации, до торакоскопической аблации; II – интраоперационный: внутрисердечное электрофизиологическое исследование (ЭФИ) и эндокардиальное картирование во время катетерной аблации; III – ранний послеоперационный: 5 − 25 дней после операции; IV – отдалённый послеоперационный: 1 год после операции. Таблица 1 Методы исследования, применяемые на каждом этапе I этап II этап III, IV этап ЭКГ ЭФИ ЭКГ Рентгенография органов Торакоскопическая аблация ЭХОКГ грудной клетки Картирование ХМ ЭХОКГ Радиочастотная аблация Аппарат ХМ длительного Тиреоидные тесты (ТТГ, подкожного Т3, Т4) мониторирования ЧП − ЭХОКГ ЭКГ Коронарография До операции всем пациентам выполнялись электрокардиография, рентгенография органов грудной клетки, трансторакальная эхокардиография (ЭХОКГ), суточное мониторирование ЭКГ, гормональный анализ тиреоидной функции (с ультразвуковым исследованием щитовидной железы и консультацией эндокринолога). Чреспищеводная эхокардиография проводилась для точной оценки размера предсердных камер, а также для исключения тромбоза левого предсердия. Коронароангиография выполнялась всем пациентам старше 45 лет для исключения асимптомного атеросклероза 47 коронарных артерий, либо при предъявлении жалоб на характерные стенокардитические боли. В процессе работы использовали следующие классификации ФП. Классификация АССF/АНА/HRS, 2011 год [49]: 1. Пароксизмальная – длительность менее 7 дней, спонтанное купирование. 2. Персистирующая – длительность более 7 дней, эффективная медикаментозная или электрическая кардиоверсия. 3. Длительно-персистирующая (постоянная) – ФП, существующая в течение 6 месяцев и более, без появления спонтанных эпизодов синусового ритма и требующая кардиоверсии для его восстановления. Классификация пароксизмальной формы ФП по Levy S [97]: I. Первый симптоматический пароксизм ФП: А – самостоятельно купировавшийся; В – требующий кардиоверсии. II. Многократные эпизоды ФП без антиаритмической терапии (ААТ) (за исключением использования бета-адреноблокаторов или антагонистов кальция): А – асимптомные; В – менее 1 симптоматической атаки за 3 месяца; С – более 1 симптоматической атаки за 3 месяца. III. Многократные эпизоды ФП, несмотря на блокаторы натриевых или калиевых каналов): А – асимптомные; В – менее 1 симптоматической атаки за 3 месяца; С – более 1 симптоматической атаки за 3 месяца. 48 Классификация пароксизмальной формы ФП по Levy S [10,70] Первый симптоматический пароксизм ФП: I. А – самостоятельно купировавшийся; В – требующий кардиоверсии. Многократные эпизоды ФП без антиаритмической терапии II. (ААТ) (за исключением использования бета-адреноблокаторов или антагонистов кальция): А – асимптомные; В – менее 1 симптомной атаки за 3 месяца; С – более 1 симптомной атаки за 3 месяца. III. Многократные эпизоды ФП, не смотря на лекарственную терапию (блокаторами натриевых или калиевых каналов): А – асимптомные, В – менее 1 симптомной атаки за 3 месяца, С – более 1 симптомной атаки за 3 месяца. 2.2. Общая характеристика клинического материала Среднее время от первичной аблации до рандомизации составило 7,2 ± 2,4 месяца (медиана = 7) и 7,1 ± 2,1 месяц (медиана = 7) в группах ХА и КА, соответственно (p = 0,18). Подкожный кардиомонитор был имплантирован до рандомизации в день первичной процедуры аблации. Общая характеристика пациентов двух групп и анализ сопутствующей патологии приведены в таблице 2. Достоверных отличий в дооперационных характеристиках пациентов двух групп не выявлено. 49 Таблица 2 Общая характеристика пациентов двух групп и анализ сопутствующей патологии ХА (n=32) 56 ± 7 23/9 20/12 13 (40%) 3 (9%) 3 (9%) 55 ± 5 46 ± 5 5.2 ± 2.1 1.7 ± 0.9 28 ± 6 35.1±33.7 0.6 ± 0.8 Возраст, лет Пол (М/Ж), n ПФП/ПерсФП Гипертензия, n (%) Сахарный диабет, n (%) Перенесенный инсульт, n (%) ФВ ЛЖ, % ДЛП,мм Продолжительность ФП, лет Количество принимаемых ААП, n ИМТ,кг/м2 Процент ФП (AF burden), % CHADS2 score КА (n=32) 57 ± 7 25/7 18/14 11 (34%) 4 (12%) 2 (6%) 57 ± 6 45 ± 7 4.9 ± 1.9 1.6 ± 0.8 28 ± 5 39.1±32.1 0.6 ± 0.9 P 0.58 0.60 0.18 0.32 0.60 0.52 0.36 0.48 0.12 0.62 0.83 0.62 0.58 Жалобы пациентов при поступлении систематизированы в таблице 3. Большинство пациентов предъявляли жалобы на перебои в работе сердца (n=46;71,8 %) и одышку при физической нагрузке (n=38; 59,3 %). Таблица 3 Характеристика жалоб пациентов двух групп Клинический признак, n=64 Перебои в работе сердца, % 71,8 (46) Пароксизмы учащённого сердцебиения, % 62,5 (40) Одышка, % 59,3 (38) Отёки на ногах, % 4,6 (3) Кардиалгии, % 20,3 (13) Эхокардиография проводилась на аппарате «Vivid 7D» (GE, US) из стандартных позиций, суточное мониторирование – на комплексе холтеровского мониторирования «Кардиотехника − 4000» (ИНКАРТ, Санкт – Петербург). Данные трансторакальной ЭХОКГ представлены в таблице 4. Чреспищеводная ЭХОКГ проводилась всем пациентам, находящимся 50 на момент операции в состоянии ФП для исключения тромбоза ЛП. Размер левого желудочка (КДР ЛЖ) превышал верхнюю границу возрастной нормы у 8 пациентов (3,3 %). У 45 (70,3 %) пациентов констатировано увеличение левого предсердия и 17 (26,5 %) пациентов правого предсердия. Таблица 4 Результаты ЭХОКГ у обследованных пациентов Данные ЭХОКГ, n=64 КДР ЛЖ, мм 48,1 ± 0,6 КДР ЛЖ, % от нормы* 89,4 ± 0,9 ФВ ЛЖ, % 56,5 ± 5 ПЖ, мм 21,3 ± 1,3 ПЖ, % от нормы* 79,4 ± 1,1 ЛП, мм 46 ± 5 ЛП, % от нормы* 124 ± 2,2 ПП, мм 46,1 ± 0,9 ПП, % от нормы* 114,3 ± 3,1 Примечание: * – процентное отношение от верхней границы нормальных возрастных значений по H. Feigenbaum. [156] С пароксизмальной формой фибрилляции предсердий было 38 пациентов (59,3 %), 26 пациентов с персистирующей ФП (40,7 %). Полный аритмологический анамнез составил 5.2 ± 2.1 лет. У пациентов с пароксизмальной ФП длительность пароксизмов была 7,1 ± 1,7 часов (от 4 минут до 5 суток), с персистирующей ФП – 17,9 ± 2,1 (от 7 до 30) суток. Насыщенность ФП (% существования ФП в течение месяца) составила от 3,47 % у пациентов с пароксизмальной до 66,7 % у пациентов с непрерывно − рецидивирующей ФП. Периоды синусового ритма между пароксизмами составили 6,1 ± 0,7 часов (от 2 до 22 часов) при непрерывно − рецидивирующей ФП, 4,2 ± 1,5 (от 2 до 9) суток при пароксизмальной ФП, 7,9 ± 3,7 (от 2 до 55 суток) при персистирующей ФП. 51 По классификации S. Levy, 4,1 % пациентов с пароксизмальной ФП относились к классу 2С, 2 % – к классу 3А, 10,4 % – к классу 3В и 80 % – к классу 3С (то есть имели более одного симптомного пароксизма ФП за 3 месяца на фоне мощной антиаритмической терапии). Антикоагулянтная терапия проводилась варфарином не менее 4 недель до операции под контролем международного нормализованного отношения (МНО) 2 – 3 ед., и продолжалась у пациентов до 6 месяцев после операции, а в случае сохранения устойчивых пароксизмов ФП более 6 месяцев. Пациентам выполнялись следующие методики радиочастотной аблации: 1. при хирургической и катетерной аблации использовалась антральная (циркулярная) изоляция устьев легочных вен (n = 64). 2. при хирургической и катетерной аблации использовалась аблация ганглионарных сплетений левого предсердия анатомическим подходом (n = 64). Все пациенты получали антиаритмические препараты на протяжении 3 месяцев. 3. при торакоскопической аблации дополнительно выполнялись линии по крыше левого предсердия и нижней стенке левого предсердия (n = 32). Все пациенты получали антиаритмические препараты на протяжении 3 месяцев после операции (“слепой период”). Эффективность проведенного оперативного лечения оценивалась с помощью традиционных методов оценки, а именно, записи ЭКГ во время приступа и записи 24 – часового ХМ ЭКГ, а также данных полученных при опросе аппарата длительного подкожного мониторирования ЭКГ. Профилактическая антиаритмическая терапия проводилась у 59 (92,1 %) пациентов. За весь период лечения до операции обследованные пациенты принимали 2,7 ± 0,4 антиаритмических препарата. Рецидив фибрилляции предсердий оценивался через 3 месяца после операции, как пароксизм любой предсердной тахиаритмии (фибрилляция предсердий, трепетание предсердий, 52 предсердная тахикардия) продолжающийся более 30 секунд, согласно международным рекомендациям. 2.3. Технология хирургической (торакоскопической) аблации Оперативные вмешательства проводились с помощью эндоскопической стойки Karl Storz (Германия). Пациент находился в положении лежа на спине. Операция проводилась под общим наркозом с интубацией двупросветной трубкой. Доступ осуществлялся с помощью трех портов с обеих сторон грудной клетки. Два порта (10 мм) устанавливались в четвертое и шестое межреберье по средней подмышечной линии. Третий порт (5 мм) находился на 5 см кпереди от средней подмышечной линии в третьем межреберном пространстве. Эндоскоп вводился через порт, расположенный в четвертом межреберье. Оставшиеся два порта использовались для двух торакоскопических инструметов. С правой стороны грудной клетки перикард открывался на 2 – 3 см выше диафрагмального нерва, затем его края фиксировались на держалки для оптимального позиционирования аблационного устройства. Следующим этапом операции производилось «тупое» рассечение пространства вокруг ЛВ с последовательным прохождением в поперечный, а затем косой синус полости перикарда. Далее с помощью диссектора (AtriCure Lumitip, Inc., West Chester, Ohio, USA) производился обход ЛВ с последующей их изоляцией с помощью биполярного зажима (AtriCure, Inc, West Chester, Ohio, USA). Изоляция выполнялась не менее трех раз в области правых и левых ЛВ. Блок входа подтверждался с помощью биполярного картирующего электрода при отсутствии потенциалов в месте воздействия. Блок выхода подтверждался стимуляционно во время синусового ритма. При необходимости производилась дополнительная изоляция ЛВ. Далее трансполярным электродом (AtriCure, Inc., West Chester, Ohio, USA) выполнялась радиочастотное воздействие в области устьев легочных вен 53 (ганглионарных сплетений) в течении 20 секунд. Конечной точкой данного этапа операции явилось отсутствие высоковольтажной амплитуды после воздействия. Заключительным этапом выполнялось создание двух аблационных линии от правых верхней и нижней ЛВ, по куполу и нижней стенке ЛП достигая левых легочных вен. Аналогичная процедура выполнялась с левой стороны, за исключением перикарда, который открывался максимально низко под диафрагмальным нервом. Кроме того связка Маршала рассекалась электро − коагулятором (Рисунок 14 А – Е). Рисунок 14. Техника торакоскопической изоляция ЛВ с радиочастотной аблацией ГС. Панель А: вся процедура выполняется через торакоскопические порты биторакальным доступом: 1-Порт 5мм в 3 – ом межреберье по передней под мышечной линии; 2 – Порт 10 мм в 4 – ом межреберье по средней под мышечной линии; 3 – Порт 10 мм в 6 − ом межреберье по передней под мышечной линии. 54 Панель Б: с помощью атравматичного отсоса и граспера разделяется перикардиальная связка в проекции между нижней полой веной и нижнедолевой правой легочной веной, попадая в пространство косого перикардиального синуса. Панель В: с помощью атравматичного отсоса и граспера разделяется перикардиальная связка на куполом левого предсердия, попадая в пространство поперечного перикардиального синуса. Панель Г: Радиочастотная изоляция правых легочных вен аблационным биполярным зажимом. Панель Д: Радиочастотная аблация ганглионарных сплетений со стороны правых легочных вен, с последующим созданием линий по крыше и задней стенке левого предсердия линейным электродом. Панель Е: Радиочастотная изоляция левых легочных вен аблационным биполярным зажимом. По окончании процедуры пациенты переводились в палату интенсивной терапии под наблюдение. 2.4 Технология катетерной аблации Оперативные вмешательства проводились на электрофизиологических комплексе CardioLab диагностической Version стимуляции 6.0 (Pruka использовали Engeneering, Для Inc). электростимулятор Bloom Electrophysiology (США). Электроанатомическое картирование осуществляли в условиях навигационной системы CARTO 3 (Biosense Webster, США). Принцип подготовки к операции и методика выполнения транссептальной пункции была стандартной при катетерной аблации фибрилляции предсердий. Под местной анестезией раствором новокаина (0,5 %) или лидокаина (1 %) пунктировали левую подключичную вену (для диагностического/ референтного электрода) картирующего/аблационного и правую электрода). 55 В бедренную качестве вену (для диагностического референтного электрода использовали 10 – полюсный электрод Webster (6F), который проводился во всех случаях в коронарный синус и служил для регистрации левопредсердной электрограммы, диагностической стимуляции и в виде анатомического ориентира (фиброзное кольцо митрального клапана). Для манипуляций в полости левого предсердия проводилась пункция межпредсердной перегородки (транссептальная пункция, ТСП) при помощи транссептальной иглы BRK – 1 (Daig, с набором интродьюсеров по стандартной методике (рисунок 15 и рисунок 16) под контролем ЧПЭхоКГ [171]. На рисунках 15 и 16 представлены этапы пункции МПП под контролем ЧПЭхоКГ. Во всех случаях после выполнения транссептальной пункции внутривенно вводился раствор гепарина в дозе 100 Ед/кг для поддержания значений АСТ 300 – 400 сек на протяжении всего хода операции. Рисунок 15. Рентгеноскопические этапы пункции межпредсердной перегородки. Проекция RAO – 30. CS – электрод в коронарном синусе, 1 – игла для ТСП, intr – интродьюсер для ТСП, ЛПу – ушко ЛП. А – трпанссептальная игла упирается в межпредсердную 56 перегородку на уровне овальной ямки. Б – пункция МПП с выходом иглы в ЛП. В – контрастирование ЛП. Г – введение проводника в ЛП. Д – введение интродьюсера. А Б Рисунок 16. Пункция межпредсердной перегородки с помощью ЧПЭхоКГ. А – игла для ТСП упирается в область овальной ямки. Б – эффект спонтанного контрастирования в левых отделах сердца в момент промывания интродьюсера. Антральная изоляция легочных вен в сочетании с анатомической аблацией ганглионарных сплетений левого предсердия В данной группе пациентов (n = 32) проводилась антральная (циркулярная) изоляция УЛВ (в дальнейшем данная методика обозначается как антральная изоляция УЛВ) в сочетании с анатомической аблацией ганглионарных сплетений. Транссептальная пункция выполнялась по описанной ранее технике. После выполнения транссептальной пункции в условиях навигационной системы CARTO 3 (Biosense Webster) выполнялось построение анатомической реконструкции левого предсердия (ЛП). Количество точек для построения 3D изображения зависело от объема ЛП и составляло в среднем от 50 до 70 точек. Референтное отведение выбиралось в зависимости от ритма пациента во время операции. Во время синусового ритма за референт выбирали одно из отведений коронарного синуса, на котором амплитуда сигнала была максимальной. Во время ФП референтом служил один из каналов поверхностной ЭКГ. 57 ИЛВ оценивалась с помощью катетера Lasso (Biosense – Webster Inc, Diamond Bar, CA). Реизоляция ЛВ проводилась с помощью катетера NaviStar ThermoCool (Biosense – Webster Inc., Diamond Bar, CA). Радиочастотное воздействие выполнялось в области передней стенки ЛП при параметрах 43 С, 35 Вт и в области задней стенки ЛП при параметрах 43С, 30 Вт со скоростью орошения 17 мл/минуту. Радиочастотное воздействие выполнялось непрерывно до снижения предсердной амплитуды более чем на 80 % от исходных значений с продолжительностью каждой аппликации 40 секунд. Конечной точкой циркулярной ИЛВ вен являлось отсутствие электрической активности внутри изолированных вен, подтвержденное с помощью катетера Lasso (блох входа) и стимуляционно (блок выхода) (рисунок 17). Рисунок 17. (антральная изоляция УЛВ) 3D – анатомические изображения изоляции устьев легочных вен отдельными коллекторами. А – задняя проекция; Б – передняя проекция. После изоляции УЛВ дополнительно выполнялась аблация ГС. Воздействию подвергались скопления вегетативных ганглионарных сплетений, сконцентрированных в четырех областях ЛП по описанной нами ранее методике [136] (рисунок 18). 58 А Б Рисунок 18. 3D – изображение левого предсердия во время аблации ГС в сочетании изоляции легочных вен в передней (А) и задней (Б) проекции. Данный подход основывался на экспериментальных и анатомических работах по локализации ганглионарных сплетений (рисунок 19, 20) [11,33]. По данным анатомических работ были идентифицированы по 5 основных скоплений ГС, локализующихся, как в предсердиях, так и в желудочках. Рисунок 19. Локализация заднепредсердных и желудочковых ГС (вид сзади) Примечание: Superior left atrial GP – верхнее левопредсердное ГС, Posterolateral left atrial GP-заднелатеральное левопредсердное ГС, Posteromedial left atrial GP – заднемедиальное левопредсердное ГС, Obtuse marginal GP – ГС в области тупого края, Superior right atrial GP – верхнее правопредсердное ГС, Posterior right atrial GP-заднее правопредсердное ГС, 59 Posterior descending GP – заднее нисходящее ГС, PA-легочная артерия, Aorta-аорта, SVC – верхняя полая вена, IVC – нижняя полая вена, RV – правый желудочек, LV – левый желудочек В предсердиях они были названы согласно их месту расположения, а именно: верхнее правопредсердное ГС, верхнее левопредсердное ГС, заднее правопредсердное ГС, заднемедиальное левопредсердное ГС, заднелатеральное левопредсердное ГС. Наибольшее число ганглиев было связано с двумя ГС, находящимися на задней поверхности двух предсердий. Рисунок 20. Локализация ГС на поверхности предсердий и желудочков (вид сверху) Примечание: Superior left atrial GP – верхнее левопредсердное ГС, Posterolateral left atrial GP – заднелатеральное левопредсердное ГС, Posteromedial left atrial GP – заднемедиальное левопредсердное ГС, Obtuse marginal GP – ГС в области тупого края, Superior right atrial GP – верхнее правопредсердное ГС, Posterior right atrial GP – заднее правопредсердное ГС, Posterior descending GP-заднее нисходящее ГС, Right acute marginal GP – ГС острого края справа, PA – легочная артерия, Aorta – аорта, Aortic root GP – ГС корня аорты SVC – верхняя полая вена, IVC – нижняя полая вена, RV – правый желудочек, LV – левый желудочек. 60 В ходе аблации проводилось воздействие, в пределах скопления вегетативных ганглиев – четырёх зон округлой или овальной формы размером 1,5 – 2,5 см, каждая из которых соприкасается с устьем лёгочной вены. Аблация проводилась в ЛП по предложенной схеме: —зона № 1 (left superior, рисунок 21; 1) примыкает к устью левой верхней лёгочной вены на 8ч – 1ч по окружности устья вены в проекции изнутри левого предсердия; —зона № 2 (left inferior, рисунок 21; 2) примыкает к устью левой нижней лёгочной вены на 5ч – 10ч по окружности устья вены в проекции изнутри левого предсердия; —зона № 3 (right superior, рисунок 21; 3) примыкает к устью правой верхней лёгочной вены на 7ч – 1ч по окружности устья вены в проекции изнутри левого предсердия; —зона № 4 (right inferior, рисунок 21; 4) примыкает к устью правой нижней лёгочной вены на 2ч – 8ч по окружности устья вены в проекции изнутри левого предсердия. Рисунок 21. Схема аблации ГС. Эндокардиальная поверхность левого предсердия (вид изнутри после удаления его передней стенки). 1 – 4 четыре области для радиочастотного воздействия. Объяснения в тексте. 61 Последовательность воздействия определялась произвольно. В большинстве случаев (n = 50; 83,3%) указанные области обрабатывались в очерёдности «1–2–3–4». Последовательность «2–1–3–4» использована у 3 пациентов (5 %), «2–1–4–3» - у 2 пациентов (3,3 %), «3–4–1–2» – у 2 пациентов (3,3 %), «4–3–1–2» – у 3 пациента (5 %). Локализация воздействия объясняется постоянством расположения ГС у homo sapiens, то есть процедура носила исключительно анатомический характер, не сопровождалась активационным картированием. В протокол процедуры включалась попытка электрической индукции ФП после завершения схемы аблации в объёме учащающей стимуляции с пар CSprox и CSdist с частотой от 200 до 400 импульсов в минуту с повторением этой последовательности на фоне фармакологической провокации - внутривенной инфузии атропина в дозе 0,1 мг/10 кг веса (для пациентов с пароксизмальной ФП). 2.5 Имплантация аппарата для непрерывного подкожного мониторирования ЭКГ Всем пациентам в конце первого оперативного вмешательства была выполнена имплантация аппаратов Reveal XT (Medtronic Inc.) по ранее описанной стандартной методике. [2] Данные устройства диагностируют и классифицируют аритмические события по степени вариабельности сердечных циклов на основе 2-минутной записи ЭКГ с определением количества эпизодов ФП и характеристики аритмии, времени возникновения ФП, количества часов ФП за один день и процента ФП в течение всего периода наблюдения (AF burden). Кроме того, данные ЭКГ сохраняются для визуального подтверждения эпизодов. Пациентам предоставлялось активирующее устройство, позволяющее сохранять данные ЭКГ во время симптомов (самостоятельная активация). Данные автоматической и самостоятельной активации были проанализированы доктором, осуществлявшим контрольное обследование. 62 2.6 Методика статистического анализа Статистическая обработка результатов исследования проводилась на компьютере Pentium – IV с помощью системного пакета прикладных программ «STATISTICA for Windows. Версия 6.0». Все результаты выражены как арифметическое среднее ± SD. В ходе статистического анализа выборочных данных применялись методы и средства, относящиеся к следующим основным разделам математической статистики: предварительная обработка данных, описательная статистика (графический анализ данных, исследование законов распределения данных, расчет основных статистических характеристик); статистическая проверка гипотез (t – критерий Стьюдента и F-критерий Фишера для проверки гипотез о равенстве числовых характеристик выборочных распределений данных); анализ таблиц сопряженности (критерий – хи – квадрат); для оценки существенности различий в группах применяли многопараметрическую методику ANOVA; свобода от ФП выражалась графически по методу Kaplan – Maier; значение p < 0,05 считалось статистически достоверным Таким образом, для решения поставленных задач проведено тщательное кардиологическое и электрофизиологическое обследование 64 пациентов с фибрилляцией предсердий. Симптомность аритмии, отсутствие эффекта от ранее проведенной катетерной аблации и медикаментозной терапии и риск развития осложнений (ХСН, ТЭ) явились показаниями к интервенционному и хирургическому лечению ФП. Согласно дизайну данного исследования, пациенты были рандомизированы на две группы: группа I – хирургическая радиочастотная аблация (n = 32), группа II – радиочастотная катетерная реизоляция легочных ганглионарных вен в сплетением сочетании (n = 32) и недостатков каждой методики. 63 для с анатомической выявления аблацией преимуществ ГЛАВА 3. ИНТРАОПЕРАЦИОННЫЙ ЭФФЕКТ КАТЕТЕРНОЙ И ХИРУРГИЧЕСКОЙ АБЛАЦИИ 3.1 Конечные точки хирургической и катетерной аблаций Достижение конечных точек при различных методах катетерной или хирургической аблации является важным фактором в достижении положительного результата и профилактике последующих рецидивов [71]. Известны следующие конечные точки при изоляции УЛВ: отсутствие электрической активности (наличие изолинии) в местах воздействия, блокада входа, выхода вокруг изолированных правых и левых легочных вен, невозможность индукции устойчивых предсердных тахиаритмий после воздействия. При аблации ГС конечными точками явились: отсутствие электрической активности (наличие изолинии) в области воздействия, а так же отсутствие вагусных реакций на воздействие и невозможность индукции устойчивых предсердных тахиаритмий после воздействия. Хирургическая (торакоскопическая аблация) ФП (I группа) Критерии электрической изоляции устьев ЛВ были достигнуты у всех пациентов. Изоляция ЛВ была подтверждена отсутствием предсердных потенциалов в месте воздействий (блок входа) и стимуляционно (блок выхода). Как минимум по 3 линейных радиочастотных воздействий было сделано вокруг правых и левых ЛВ одним коллектором. Изоляция задней стенки левого предсердия также подтверждалась стимуляционно (блок выхода). В дополнении к ИЛВ выполнялась анатомическая аблация ганглионарных сплетений в области правых и левых легочных вен. На момент аблации у 15 пациенотв (46,9 %) из 32 регистрировалась ФП. Из них синусовый ритм был восстановлен у десяти (66,7 %) пациентов во время аблации. У одного пациента (6,6 %) отмечена трансформация ФП в типичное трепетание. По поводу чего выполнена катетерная аблация 64 вторым этапом в раннем послеоперационном периоде. Для восстановления синусового ритма после завершения аблации 4 (26,6 %) пациентам потребовалась электрическая кардиоверсия. Остальные пациенты изначально были с синусовым ритмом. Средняя продолжительность процедуры составляла181 ± 21 минут. Катетерная реизоляция легочных вен с аблацией ГС (II группа) Потенциалы были зарегистрированы по меньшей мере в одной из ЛВ у всех пациентов (2,2 ± 0,9 на пациента). Все ЛВ были успешно повторно изолированы. ИЛВ с подтверждением блока входа и выхода также была достигнута у всех пациентов. В общей сложности, количество радиочастотных воздействий, необходимых для реизоляции легочных вен и аблации 4 – х областей ГС составило 102,7 ± 12,4 аппликаций. Вагусные реакции отмечались у 27 пациентов (84,3 %) во время аблации ГС. На момент аблации у 15 пациентов (46,9 %) из 32 регистрировалась ФП. Из них синусовый ритм во время операции был восстановлен у 8 (53,2 %) пациентов. У двух пациента (13,4 %) отмечена трансформация ФП в типичное трепетание. По поводу чего была выполнена аблация каватрикуспидального перешейка. Для восстановления синусового ритма после завершения аблации электрическая кардиоверсия потребовалась 5 (33,4 %) пациентам. Остальные пациенты изначально были с синусовым ритмом. Среднее время процедуры было короче чем в группе ХА и составило 142 ± 28 минут (P < 0, 001). Время рентгеноскопии составило 19 ± 13 минут. Таким образом конечные точки у пациентов двух групп были достигнуты при первоначальном воздействии. Время процедуры было значительно выше в группе торакоскопической аблации, но без необходимости рентгена. 3.2 Феномен купирования Феномен прекращения тахиаритмии в процессе радиочастотного воздействия (феномен «аблационного купирования») является одним из 65 важнейших критериев точности вмешательства в функционировании соответствующего субстрата аритмии и фактором эффекта самой процедуры. Примером может служить исчезновение дельта – волны и купирование ортодромной тахикардии за счёт ретроградной блокады у больных с синдромом WPW, купирование фокусной тахиаритмии в момент аблации, аблационное купирование трепетания предсердий. Однако, применительно к больным с ФП этому феномену уделяется недостаточное внимание в современной электрофизиологической литературе, а отношение к нему как к критерию эффекта операции не столь прямолинейно и однозначно, как у пациентов с другими тахиаритмиями [22]. В то же время, именно сравнение аблационных методик лечения ФП по данному критерию позволило бы дифференцировать, какие из них напрямую, а какие − косвенно влияют на аритмогенный субстрат. Характер «аблационного купирования» В процессе аблации пациентам первой и второй группы производилась непрерывная регистрация ЭКГ. Пациентам второй группы дополнительно производилась непрерывная регистрация электрограммы коронарного синуса. В случае эффекта «аблационного купирования» фибрилляции предсердий оценивалось время купирования (от начала воздействия), анализировался характер изменения электрической активности накануне восстановления синусового ритма. В случае спонтанной трансформации фибрилляции предсердий в типичное трепетание после завершения аблации в левом предсердии производилась аблация каватрикуспидального перешейка. Наконец, в случае сохранения ФП после завершения аблации, осуществлялась электрическая трансторакальная кардиоверсия. В исследуемых группах пациентов отмечено несколько типов нормализации ритма, которые были выявлены у 21 пациента двух групп: I тип (n = 18; 60 %) – переход ФП непосредственно в синусовый ритм (рисунок 22); 66 II тип (n = 3; 10 %) – трансформация ФП в типичное трепетание предсердий (ТП) с его последующим каватрикуспидального купированием перешейка и в процессе восстановлением аблации синусового ритма (рисунок 23). Рисунок 22. Эффект пароксизмальная «аблационного ФП). электрокардиограмма, Скорость купирования» ФП = CS – коронарный 25 синус, электрода. 67 mm/s. I, (пациент II, Н., 58 лет, III – поверхностная Abl – электрограмма аблационного Рисунок 23. Эффект «аблационного купирования» ФП Г., 56 лет (параксизмальная ФП, 37.). А – трансформация ФП в типичное ТП (стрелка), 25 мм/сек. B – трансформация типичного ТП в синусовый ритм (стрелка) во время аблации каватрикуспидального перешейка, 50 мм/сек. Таблица 5 Типы аблационного купирования при выполнении различных аблационных методик I, n 10 Торакоскопическая аблация Катетерная аблация Всего 8 18 II, n 1 2 3 Анализ распределения типов «аблационного купирования» ФП при выполнении торакоскопической и катетерной аблации после одной неэффективной катетерной аблации позволяет отметить две закономерности: Во – первых, не было зарегистрировано трансформации ФП в левопредсердное трепетание ни в одной из групп. Во – вторых, аблационная трансформация ФП в типичное трепетание предсердий наблюдалась как при хирургической (торакоскопической) аблации, так и при катетерной аблации 6,6 %, 13,4 % случаев соответственно (p > 0,3). При анализе динамики перехода ФП в новый ритм было отмечено два возможных механизма. Первый механизм - путём внезапного прекращения ФП без видимого преобразования левопредсердной электрограммы (n = 18; 60 %). Второй механизм – путём последовательной электрофизиологической трансформации аритмии (n = 3; 10 %). Это выражалось в снижении вариабельности формы и величины предсердных потенциалов, снижении вариабельности и увеличении средней длины циклов фибрилляции, начиная с 145,9 ± 7,6 мс накануне аблации до 225,4 ± 23,5 мс – в процессе аблации и, наконец, до 288,2 ± 19,2 (на 97,5 %) перед восстановлением синусового ритма или переходом в трепетание предсердий (рисунок 24). Данный 68 феномен, по-видимому, свидетельствует об уменьшении количества циркулирующих волн re – entry и более упорядоченной активации левого предсердия. A B C Рисунок 24. Купирование ФП путём электрофизиологической трансформации (пациент H., 49 лет, персистирующая ФП 9 месяцев). А – до аблации. B – перед купированием. C – момент купирования. Скорость = 50 mm/s. Обращает внимание снижение вариабельности цикла и увеличение его длины с 140 – 190 мс до 260 – 300 мс перед купированием. 69 У 4 пациентов (22,2 %) перед стабилизацией синусового ритма наблюдалось от одного до четырёх эпизодов кратковременного его восстановления на несколько секунд с повторным возникновением ФП эффект «stop and restart». Подобный эффект отмечался при выполнении аблации ГС в сочетании с реизоляцией УЛВ в обеих группах и возможно был связан с аритмогенным (ацетилхолина), действием высвобождающегося парасимпатического при повреждении медиатора вегетативных сплетений. Таким образом статистических различий в момент трансформации фибрилляции предсердий в синусовый ритм или трепетание предсердий у пациентов двух групп после повторного воздействия не выявлено. На момент аблации трансформация в синусовый ритм в группе торакоскопической аблации была незначительно выше по сравнению с группой катетерной аблации. Клинический Артериальная пример. Больной гипертензия II Л., ст., 55 лет. Клинический диагноз: риск 4. Персистирующая форма фибрилляции предсердий, тахиформа. ХСН. ФК II (NYHA). Приступы ФП беспокоят пациента на протяжении 6 лет. Лечение получал нерегулярно. 04.2011 выполнена радиочастотная аблация ганглионарных сплетений левого предсердия, радиочастотная изоляция устьев легочных вен отдельными коллекторами, мониторирования. имплантация Через четыре аппарата длительного суточного месяца возобновились ежедневные приступы аритмичного сердцебиения. При опросе Reveal XT регистрируются многократные ежедневные пароксизмы фибрилляции предсердий разной продолжительности. В течение этого времени принимал ритмонорм, кордарон, соталекс, верапамил – без существенного эффекта. На момент поступления: пароксизмальная ФП с ЧСС для желудочков 92 – 104 в минуту, расширение ЛП (55 * 54 мм). Больному выполнена торакоскопическая аблация ФП. На вторые сутки после операции у пациента возникло трепетание предсердий. По ЭКГ и ИКМ зарегистрировано типичное трепетание предсердий (рисунок 25, 26). В условиях рентген – операционной 70 пациенту выполнена радиочастотная аблация каватрикуспидального перешейка (рисунок 27). Во время воздействия отмечено купирование трепетания предсердий и восстановление синусового ритма. Во время асинхронной ЭКС из КС 1 – 2 подтверждена блокада каватрикуспидального перешейка. Всеми видами ЭКС пароксизмы фибрилляции и трепетания предсердий не индуцировались. Больной выписан на 10 сутки после операции на фоне синусового ритма. В качестве медикаментозной терапии назначен кордарон. При последующем наблюдении пароксизмы ФП не наблюдаются, аритмические жалобы отсутствуют, размер ЛП через 3 месяца после операции составил 49 х 48 мм. Через 3 месяца снижена дозировка кордарона и с 6 – го месяца после операции антиаритмическая терапия не проводится. Рисунок 25. Пароксизм типичного трепетания предсердий по данным ИКМ. Рисунок 26. ЭКГ с пароксизмом типичного трепетания предсердий. 71 А B C Рисунок 27. А- 3D изображение правого предсердий, циркуляция трепетания вокруг трикуспидального клапана; B-3D изображение правого предсердий, темными точками показано РЧА каватрикуспидального перешейка; и восстановление синусового ритма во время РЧА. 72 С – купирование трепетания ГЛАВА 4. ОТДАЛЕННЫЙ ЭФФЕКТ ТОРАКОСКОПИЧЕСКОЙ И КАТЕТЕРНОЙ АБЛАЦИЙ 4.1 Антиаритмический эффект Средний период наблюдения пациентов двух групп составил 12,5 ± 2,2 месяцев. Первые 3 месяца после операции явились “слепым” периодом и качество ритма в этот период не оценивалось. Для профилактики тромбоэмболических осложнений все пациенты получали до операции варфарин с целевым значением МНО от 2 до 3 и продолжали принимать его на протяжении трёх месяцев после процедуры. Антиаритмические препараты, а именно кордарон (n = 5; 70,3 %), соталол (n = 17; 26,5 %) и пропанорм (n = 2; 3,2 %) назначались всем пациентам в течение трёх месяцев после процедуры с целью профилактики ятрогенных аритмий и обеспечения наилучших условий для обратного электрического ремоделирования. Схема последующего наблюдения включала осмотр через каждые три месяца после процедуры с оценкой клинического статуса пациента, оценки данных с подкожного монитора и проведением суточного мониторирования ЭКГ и эхокардиографии. В случае положительной динамики (отсутствие предсердных тахиаритмий) через три месяца после аблации производилась отмена антикоагулянтов и антиаритмических препаратов. Оценка свободы от ФП проводилась по методу Kaplan – Meier, согласно международным рекомендациям, по которым рецидив фибрилляции предсердий расценивался как любой приступ предсердной тахиаритмии, продолжающийся более 30 секунд и возникший через 3 месяца после оперативного лечения [20]. Через 12 месяцев наблюдения, у 26 (81 %) из 32 пациентов в группе торакоскопической отсутствовали пароксизмы ФП/ТП/ПТ по сравнению с 15 (47 %) из 32 пациентов в группе КА (p=0,004, Log − rank test; риссунок 28). 73 Рисунок 28. Общая свобода от фибрилляции предсердий; Примечание: КА – группа пациентов с катетерной аблацией ФП. ХА – группа пациентов с хирургической аблацией ФП. Верхняя кривая – эффективность лечения в группе ХА (черный цвет). Нижняя кривая – эффективность лечения в группе КА (серый цвет; лог – ранговый тест; р = 0.004). При пароксизмальной форме ФП синусовый ритм сохранялся без приступов аритмии у 17 (85 %) из 20 пациентов I группы, у 10 (56 %) из 18 пациентов II группы (p = 0,04 рисунок 29). Рисунок 29. Свобода от фибрилляции предсердий у пациентов с пароксизмальной формой 74 Примечание: КА – группа пациентов с катетерной аблацией ФП. ХА – группа пациентов с хирургической аблацией ФП. Верхняя кривая – эффективность лечения в группе ХА (черный цвет). Нижняя кривая – эффективность лечения в группе КА (серый цвет; лог – ранговый тест; р = 0.04). В I группе пациентов с персистирующей ФП синусовый ритм сохранялся в отдаленный период у 9 (75 %) из 12 пациентов, во II группе – у 5 (36 %) из 14 пациентов (p=0,04; рисунок 30). Рисунок 30. Свобода от фибрилляции предсердий у пациентов с персистирующими формами; Примечание: КА – группа пациентов с катетерной аблацией ФП. ХА – группа пациентов с хирургической аблацией ФП. Верхняя кривая – эффективность лечения в группе ХА (черный цвет). Нижняя кривая – эффективность лечения в группе КА (серый цвет; лог – ранговый тест; р = 0.04). В конце наблюдения 8 пациентам потребовалась третья процедура аблции: 1 (3 %) пациенту из группы ХА (катетерная аблация) и 7 (22 %) пациентам из группы КА (двум пациентам – катетерная аблация и пяти хирургическая аблация, (p = 0,001, Log – rank test). 75 Таким образом общая эффективность торакоскопической аблации превышает эндокардиальную процедуру на 34 %. Эффективность торакоскопической аблации при пароксизмальной форме ФП превышает эндокардиальную на 29 %, при персистирующей ФП на 39% к 12 – ти месяцам наблюдения. Клинический пример. Больной С., 64 года. Клинический диагноз: Артериальная гипертензия III ст., риск 4. Пароксизмальная форма фибрилляции-трепетания предсердий, тахиформа. 17.04.2012 Радиочастотная изоляция устьев легочных вен отдельными коллекторами. Радиочастотная аблация каватрикуспидального перешейка. Имплантация аппарата длительного суточного мониторирования Reveal XT. ХСН. ФК II (NYHA). Приступы ФП беспокоили пациента на протяжении 5 лет, в течение которых он регулярно проходил стационарное обследование и лечение. В течение этого времени больной принимал ритмонорм, кордарон, соталекс, верапамил – без существенного эффекта. В апреле 2011 в ННИИПК выполнена радиочастотная изоляция легочных вен, радиочастотная аблация каватрикуспидального перешейка. И имплантация аппарата длительного суточного мониторирования Reveal XT. После операции пациент отмечал улучшение, однако через три месяца вновь возобновились практически ежедневные пароксизмы мерцательной аритмии. На момент поступления: ФП на протяжении трёх дней, расширение ЛП (49 * 55 мм). Больному выполнена торакоскопическая радиочастотная изоляция устьев правых и левых легочных вен отдельными коллекторами, радиочастотная аблация ганглионарных сплетений левого предсердия; cоздание межколлекторной линии по крыше и нижней стенки левого предсердия торакоскопическим доступом (рисунок 31). Больной выписан c синусовым ритмом на фоне приёма кордарона. Первый месяц после выписки по данным ИКМ зарегистрированы ежедневные пароксизмы ФП. Следующие 10 месяцев пароксизмы ФП не регистрировались, аритмические жалобы отсутствовали; размер ЛП достиг границы нормы через 6 месяцев. Через 3 месяца кордарон заменён на эгилок, с 7 – го месяца после операции антиаритмическая терапия не проводится. 76 А B С D Рисунок 31. Видео изображение с эндоскопа у пациента, которому выполнялась торакоскопическая изоляция ИЛВ (A-обход правых легочных вен с помощью диссектора (AtriCure Lumitip, Inc., West Chester, Ohio, USA), B-радиочастотная изоляция правых легочных с помощью биполярного зажима (AtriCure, Inc, West Chester, Ohio, USA) передняя проекция) C,D – создание двух аблационных линии от правых верхней и нижней ЛВ, по куполу и нижней стенке ЛП, достигая левых легочных вен. На эндограме показано: в первый месяц после операции зарегистрированы ежедневные пароксизмы ФП, что соответствует «слепому периоду». Последующие десять месяцев ФП не регистрировалась. Клинический пример. Больной Артериальная гипертензия II И., ст., 48 риск лет. 4. Клинический Пароксизмальная диагноз: форма фибрилляции предсердий, тахиформа. ХСН. ФК II (NYHA). Приступы ФП пациента беспокоят на протяжении 7 лет. Лечение он получал нерегулярно. 04.2011 выполнена радиочастотная аблация ганглионарных сплетений левого 77 предсердия, радиочастотная изоляция устьев легочных вен отдельными коллекторами. Радиочастотная аблация каватрикуспидального перешейка. Имплантация аппарата длительного суточного мониторирования. Через четыре месяца возобновились ежедневные приступы аритмичного сердцебиения. При опросе Reveal XT регистрировались многократные ежедневные пароксизмы фибрилляции предсердий разной продолжительности. В течение этого времени больной принимал ритмонорм, кордарон, соталекс, верапамил – без существенного эффекта. На момент поступления: пароксизмальная ФП с ЧСС для желудочков 92 – 104 в минуту, расширение ЛП (55 * 54 мм). Больному выполнена катетерная реизоляция легочных вен (рисунок 32). Больной выписан на 4 сутки после операции на фоне синусового ритма. В качестве медикаментозной терапии назначен кордарон. При последующем наблюдении пароксизмы ФП не наблюдались, аритмические жалобы отсутствовали, размер ЛП через 3 месяца после операции составил 49 * 48 мм. Через 3 месяца снижена дозировка кордарона и с 6 – го месяца после операции антиаритмическая терапия не проводится. А B C 78 Рисунок 32. 3D – изображение левого предсердия. Реизоляция устьев легочных вен. Представлено электроанатомическое 3D-изображение ЛП в задней (А), передней (B) проекциях. На обеих картах красным цветом отмечены низковольтажные зоны после первой процедуры. У данного пациента имеются прорывы в области всех четырех устьев легочных вен. Аппликации радиочастотной энергии окружают левые и правые легочные вены. C – момент восстановления синусового ритма. 4.2 Процент ФП через 12 месяцев после оперативного лечения (AF Burden) Пациенты в группе ХА и КА на момент рандомизации имели схожий процент ФП (AF burden) по данным ИКМ (35,1 ± 33,7 % и 39,1 ± 32,1 %, соответственно (p = 0,62; Рисунок 33). Через 3 месяца после операции, процент ФП резко снизился в обеих группах, тем не менее процент ФП был несколько выше в группе КА, чем в группе с ХА и составил 6,8 ± 24,5 % и 0 % соответственно (p = 0,06). В конце периода наблюдения процент ФП в группе ХА и КА составил 8,4 ± 24,6 % и 19,1 ± 35,7 соответственно (p = 0,08). Группа КА Группа ХА Месяцы Рисунок 33. Процент ФП через 12 месяцев после оперативного лечения (AF Burden) 79 Примечание: КА – группа пациентов с катетерной аблацией ФП. ХА – группа пациентов с хирургической аблацией ФП. Таким образом количество эпизодов фибрилляции предсердий к 12 – ти месяцам наблюдения в группе торакоскопической аблации было ниже на 11 % чем в группе катетерной аблации. 4.3 Аритмогенные эффекты Послеоперационное левопредсердное трепетание является наиболее плохо переносимой аритмией и его возникновение значительно ухудшает самочувствие пациентов. Поэтому, отсутствие данной аритмии является очень важным фактором оценки клинического состояния пациента после операции. Левопредсердное трепетание было зафиксировано по данным длительного суточного мониторинга у 1(3 %) пациента в группе ХА и 3 (9 %) пациентов в группе КА (p = 0,3). Всем пациентам с левопредсердными тахикардиями было выполнено успешное эндокардиальное вмешательство. Во всех случаях механизмом тахикардий явилось макро ре – ентри в области прорывов линий аблации. У пациента I группы левопредсердная циркуляция проходила по крыше левого предсердия в месте прорыва зоны аблации. У трех пациентов второй группы циркуляция трепетания была во круг митральнорго клапана. Послеоперационные ТП были устранены дополнительными аппликациями в области левопредсердного перешейка (n = 3), по крыше ЛП (n = 1). Эффективность аблаций ТП составила – 100 %. Таким образом торакоскопическая аблация имела меньший проаритмогенный эффект в сравнении с катетерной аблацией. Количество левопредсердных трепетаний было в 3 раза меньше в группе торакоскопической аблации по сравнению с группой катетерной аблации. 80 4.4 Неблагоприятные события (осложнения) Средняя продолжительность госпитализации составила 2,4 ± 0,7 дня в группе КА, по сравнению с 5,2 ± 1,3 дня в группе ХА (P < 0,001). Общее количество неблагоприятных событий не отличалось между группами (таблица 6, p = 0,5). Периоперационная и отдаленная смертность составила 0 %. В группе ХА, одному пациенту потребовалось выполнение срединной торакотомии из – за выраженных плевральных спаек и в связи с кровотечением из правой нижней ЛВ. Другие осложнения в группе ХА включали в себя: пневмоторакс (n = 3), трепетание предсердий (n = 1), позднее развитие гидроторакса (n = 3), требующее установки дренажа. В группе КА, 1 пациент имел транзиторную ишемическую атаку и 3 пациента - трепетание предсердий. У 2 пациентов были выявлены незначительные осложнения в виде гематомы в области пункции бедренной вены, не требующие оперативного вмешательства. Общее количество серьезных неблагоприятных событий (за исключением трепетания предсердий и гематом в месте пункций) было значимо выше в группе ХА (1 осложнение в группе КА по сравнению с 7 осложнениями в группе ХА; p = 0,02). Таблица 6 Неблагоприятные события в группе КА и ХА КА ХА (n=32) (n=32) Эксудативный перикардит/тампонада ТИА/инсульт Пневматоракс Гематоракс/гидроторакс 0 1 0 0 1 0 3 3 0.32 0.32 0.08 0.08 Бедренная гематома 2 0 0.08 P Левопредсердные тахикардии 3 1 0.30 Всего 6 8 0.5 Примечание: ФП = фибрилляция предсердий; ХА – группа пациентов с хирургической аблацией ФП, КА – группа пациентов с катетерной аблацией ФП 81 Таким образом, общее количество неблагоприятных событий не отличалось между группами, хотя количество серьезных осложнений (тампонада сердца, пневмоторакс, гидроторакс) было в 7 раз выше в группе торакоскопической аблации по сравнению с группой катетерной аблации. Предложенная процедура хирургической (торакоскопической) аблации является высокоэффективной и безопасной процедурой, показывая более высокий антиаритмический эффект по сравнению с катетерной аблацией у пациентов после первой неэффективной катетерной аблации. Также доказано снижение аритмогенного эффекта в 3 раз и уменьшение риска повторных вмешательств на 19 % при использовании хирургического метода аблации по сравнению с катетерной методикой аблации у пациентов после первой неэффективной катетерной аблации. 82 ГЛАВА 5. ОБСУЖДЕНИЕ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ ФП является важной проблемой общественного здравоохранения. Пациенты с ФП имеют повышенный риск инсульта, сердечной недостаточности и смертности от всех причин. Катетерная аблация доказала свою эффективность в лечении симптоматичных пациентов с ФП [73]. Широкий клинический интерес к проблеме интервенционного лечения фибрилляции предсердий возник после того как, Haissaguerre с соавторами [59] впервые опубликовали данные о том, что фибрилляция предсердий может возникать спонтанно в результате триггерной активности из устьев легочных вен [5]. В последующем, появление экспериментальных и клинических данных убедительно доказало важную роль вегетативной нервной системы в генезе ФП. Хорошо известно, что вагусная стимуляция и введение ацетилхолина в значительной степени изменяет электрофизиологию сердца. Стимуляция вагуса вызывает укорочение предсердного рефрактерного периода и облегчает индукцию ФП [67]. В своем исследовании Schauerte с соавторами [116] продемонстрировали, что высокочастотная электрическая стимуляция ганглионарных сплетений может вызывать появление триггерной активности в ЛВ и являться причиной ФП. В дальнейшем Scherlag с соавторами [160] показали, что стимуляция эпикардиальных жировых подушек (fat pads), которые содержат скопления вегетативных ганглиев, может вызывать возникновение ФП при нанесении предсердного эктрастимула. Nakagawa с соавторами [111] продемонстрировали, что радиочастотная аблация ГС инвертирует изменение рефрактерного периода и прекращает индукцию ФП при стимуляции правых и левых легочных вен. Относительно недавно электрофизиологическая основа этих открытий была темой изучения Patterson [130], который записал внутриклеточные потенциалы действия миокардиальных муфт на иссеченном и охлажденном 83 препарате «легочная вена − левое предсердие». Кроме этого было обнаружено, что совместное действие симпатических и парасимпатических нейротрансмиттеров требуется для инициирования быстрого выброса из легочных вен. Chevalier с соавторами описали градиент плотности нервных волокон у людей при анатомическом исследовании сердец [30]. Его исследование показало, что наибольшая концентрация выхода нервных волокон (окончаний) встречается в области контакта ЛВ с предсердным миокардом, разделяясь по направлению к дистальной части ЛВ и передней стенке левого предсердия. Не так давно, эти исследования сформировали основу для новой стратегии катетерной аблации ФП. Pappone с соавторами [129] обнаружили, что пациенты, у которых была документирована вегетативная денервация, имели меньшее количество рецидивов ФП после процедуры катетерной аблации. Кроме того, дополнительные радиочастотные аппликации в местах с вагальной реакцией значимо повышали эффективность процедуры у пациентов с пароксизмальной формой ФП. В последующем, Scherlag с соавторами [162] подтвердили эти данные. Интересно, что аблация ганглионарных сплетений, еще до выполнения изоляции легочных вен, привела к исчезновению триггерной активности в ЛВ в 95 % случаев. Недавние исследования продемонстрировали, что сочетанная процедура ИУЛВ и аблации ГС значительно эффективнее по сравнению с изоляцией ЛВ в течение 12 – ти месячного периода наблюдения [19]. Модификация автономной нервной системы уже была предложена в качестве одного из механизмов циркулярной изоляции ЛВ [110, 129, 161]. До конца не ясно, что приводит к денервации ЛП: дополнительные воздействия на области ГС или просто воздействие на зоны фракционированных электрограмм, находящихся в этих областях. Впервые было опубликовано несколько статей о результате изолированной катетерной аблации СФПЭ у пациентов с ФП, эффективность 84 которой оказалась значительно ниже, чем у пациентов с изоляцией устьев ЛВ [82]. Некоторые исследователи пробовали сочетать катетерную изоляцию устьев легочных вен с дополнительной аблацией СФПЭ в сравнении с только ИУЛВ у пациентов с ФП. Эффективность процедуры ИУЛВ в комбинации с аблацией СФПЭ оказалась выше по сравнению с ИУЛВ (89 % против 84 %) у пациентов с ПФП и (62 % против 42 %) у пациентов с ПерсФП [65]. Katritsis с соавт. в своем недавнем исследовании показали, что фракционированные электрограммы обычно находятся в областях ГС [84]. Таким образом, аблация фракционированные ГС также неизменно электрограммы. устраняет Сочетание многие аблации фракционированных электрограмм с ИУЛВ показало свое преимущество над ИУЛВ [175]. Однако, последующие результаты варьировали у пациентов с пароксизмальной и персистирующей формами ФП [120, 39]. Наш опыт аблации ГС показывает, что анатомическая аблация ГС в дополнении к изоляции ЛВ, скорее всего, будет также эффективна не только у пациентов с пароксизмальной, и длительноперсистирующей формами но ФП и [137, с персистирующей 138]. В недавнем исследовании, Choi и соавторы [34] определили активность нервных окончаний как источник фракционированых электрограмм и пусковой механизм предсердных тахиаритмий, включая ФП, что соответствует нашей гипотезе о том, что аблация ГС может быть ориентирована как и на вегетативные нервные окончания, так и на фракционированные электрограммы. Конечно, не исключается вероятность того, что аблация в областях ГС может обеспечить более надежную изоляцию ЛВ, поскольку некоторые из этих участков, прилегающих к устьям ЛВ являются потенциальными областями для восстановления проведения. Недавние исследования показали, что гиперактивное состояние внутренней автономной системы (АНС) сердца является одним из главных механизмов, лежащих в основе формирования сложных фракционированных 85 предсердных электрограмм. Nademanee с соавт. показали, что распределение СФПЭ совпадает предсердий с [109]. изолированную предполагаемым Проведенное аблацию СФПЭ расположением исследование, основных ГС направленное на продемонстрировало свою низкую эффективность (42 %) у пациентов с пароксизмальной ФП. Полученные нами данные сопоставимы с данными ряда зарубежных авторов [95, 155]. В исследовании Scanavacca М. с соавторами проводился поиск скоплений ГС с помощью высокочастотной стимуляции как со стороны эндокарда, так и со стороны эпикарда, в результате чего РЧА была выполнена с обеих сторон [155]. Интересно, что вагусная реакция была получена только у 7 из 10 пациентов (70 %), и только 1 (10 %) пациент продемонстрировал брадиаритмию во время РЧА. Важно, что далеко не у всех пациентов удалось зарегистрировать вагусную реакцию с помощью высокочастотной стимуляции на участках, интенсивно иннервируемых автономной нервной системой. Необходимо отметить, что у пациентов, у которых не было такой реакции, стандартная изоляция устьев легочных вен впоследствии привела к вегетативной денервации. С другой стороны, у ряда пациентов имеется риск рецидива аритмии после аблации ФП. Эффективность одной процедуры катетерной аблации составляет приблизительно 60 % для пароксизмальной ФП и 40 % для персистирующей ФП [140, 24]. Электрическая реконнекция одной или более легочных вен является частой находкой среди пациентов, которые возвращаются на повторную процедуру аблации после первичной катетерной или хирургической процедуры аблации ФП [73]. На сегодняшний день отсутствуют клинические маркеры, которые могут указывать на наиболее целесообразный подход для пациентов с рецидивом ФП. Ряд исследований продемонстрировал, что эффективность антиаритмических (ААП) с повторной по сравнению 86 аблацией у препаратов пациентов после неэффективной первичной аблации в течении первого года наблюдения по данным ИКМ составляет 27 % и 58 % соответственно [139, 141]. В попытке сократить время сочетанной операции и сделать хирургическую технику доступной для большинства кардиохирургов, были предложены различные модификации оригинальной процедуры maze. Доминирующее клиническое значение на настоящий момент получило использование РЧ-энергии вместо разрезов с целью реплицирование классических разрезов при процедуре maze. Новая модификация впоследствии была названа процедура maze IV, занимающая небольшое количество дополнительного времени, но требовало использование аппарата искусственного кровообращения. Классическая процедура лабиринт (Maze IV) являлась золотым стандартом в хирургическом лечении симптоматической медикаментознорефрактерной ФП у пациентов без структурной патологии сердца. Несмотря на высокую эффективность, данная процедура не получила широкого применения вследствие технической сложности, большой инвазивности процедуры использовании искусственного кровообращения [12] Менее травматичные оперативные вмешательства были внедрены в результате расширения знаний о патофизиологии ФП, а так же развития аблационных методик и устройств, которые заменяют оригинальную технику “разрез – шов”. Wolf и соавторы разработали методику, при которой изоляция ЛВ и РЧА ганглионарных сплетений ГС левого предсердия выполняется через двусторонний торакотомный доступ [177]. Торакоскопическая процедура менее инвазивна, снижает количество периоперационных осложнений и дискомфорт пациента. До настоящего времени значение торакоскопической аблации у пациентов после первой неэффективной катетерной аблации не было оценено. Кроме того, существует 87 только одно рандомизированное исследование сравнивающее КА и ХА (торакоскопическую аблацию) в качестве первичной процедуры аблации ФП с эффективностью 36,5 % и 65,6 % соответственно [51]. Результаты данного исследования продемонстрировали, что «видео – ассистент» торакоскопическая хирургическая аблация превосходит эндокардиальноую катетерную абалцию в качестве повторной аблации у пациентов с ПФП и ПерсФП, после первичной неэффективной эндокардиальной КА. Данное исследование является единственным в своем роде, использующим ИКМ для регистрации сердечного ритма в течение 12 месяцев наблюдения у данной категории пациентов. В подавляющем большинстве исследований стратегия мониторинга была основана на периодической записи ЭКГ, что приводит к недооценке рецидивов ФП [162]. Данное исследование также впервые продемонстрировало объективную оценку эффекта операции на основании ИКМ, включая «слепоий период» наблюдения. Во время этого периода у пациентов могли возникать частые эпизоды ФП, даже если они в конце наблюдения становились респондерами. При исследовании кривой Kaplan – Meier, пиковая частота респондеров отмечалась приблизительно к 4 – 5 месяцам после аблации, а после 6 месяцев кривая стабилизировалась. Таким образом, классифицировать пациентов как респондеров и нереспондеров необходимо только спустя 6 месяцев после РЧА и только после этого срока принимать решение относительно дальнейшей антитромботической, антиаритмической терапии или выполнения повторных вмешательств. Результаты данного исследования также показали, что наличие симптомов не является показателем в оценке эффективности процедуры при развитии рецидивов ФП. При наличии пароксизмальных 88 эпизодов аритмии и несоответствии клинических симптомов пациента и ЭКГ, именно непрерывный мониторинг ритма является единственно надежным и точным методом выявления респондеров и нереспондеров. По нашим данным при активации аппарата ИКМ самим пациентом, 68 % эпизодов не были подтверждены как эпизоды ФП и лишь 32 % эпизодов были расценены как истинная фибрилляция предсердий. Следовательно, непрерывный мониторинг ритма можно считать самым надежным методом, на основании которого можно принимать решение об эффективности процедуры. Результаты данного исследования показали, ХА (торакоскопическая) является безопасной и легко выполнимой процедурой, которая является более эффективной по сравнению с катетерной аблацией. В данном исследовании мы классифицировали пациентов, ответивших на терапию (респондеров) как пациентов с процентом ФП < 0,5% по данным ИКМ. Это определение достаточно условное, но основано на данных некоторых предыдущих исследований в области ФП и имплантируемых устройств. Предыдущие исследования использовали «пороговый интервал» в 5 минут в отношении ежедневного процента возникновения ФП (AFBurden; общее время ФП в течении одного дня) для оценки наличия или отсутствия клинически значимой ФП [64, 18, 78, 142, 55]. Данное значение является и «техническим порогом», позволяющим устройству детектировать любой эпизод ФП, длящийся более чем 5 минут, исключая детектирование каких- либо артефактов, которые могут повлиять на распознавание коротких эпизодов [149]. Подобный подход использовался в исследовании G.L.Botto [18], в котором различались длительные эпизоды (> 24 часов) и любые другие эпизоды ФП длящиеся более 5 минут в течение дня. Техника ИКМ, которую мы использовали в этом исследовании, анализирует ЭКГ каждые две минуты и оценивает нерегулярность сердечного цикла в данном временном 89 интервале. Следовательно, продолжительность каждого эпизода ФП является кратным 2 минутам. Ежедневная продолжительность ФП в течение 5 минут соответствует проценту ФП равному 0,347 % и процент ФП = 0,5 % соответствует 7,2 минутам ФП в день. Эти два значения являются сопоставимыми. Недавнее исследование TRENDS [56] показало, что ежемесячное время ФП более чем 5,5 часов в день, может значительно увеличить риск инсульта. Это значение соответствует проценту ФП = 0,764 % в течение 1-месяца. Кроме того, при анализе результатов исследований CARE-HF [70] и IMPACT [75] данные о частоте ФП были получены от имплантированных устройств и «пороговый интервал» равный 10 минутам был введен для оценки продолжительности эпизодов. Этот «пороговый интервал» соответствует 0,694 % ФП в день. В нашем исследовании процент ФП = 0,5% сопоставим с «пороговым интервалом» предыдущих исследований и данные нашего исследования находятся в среднем диапазоне для определения респондеров на терапию. Так же G.L.Botto с соавт. показали, что продолжительность эпизодов является существенным клиническим параметром и должна быть объединена со стандартными факторами риска инсульта (шкала CHADS2) у больных с ФП. Наше исследование не было направлено для сопоставления количества ФП с риском инсульта, а основной целью его явилась оценки эффективности хирургической аблации. Все данные, полученные с помощью аппарата ИКМ, были проанализированы двумя независимыми исследователями при строгих требованиях к имплантации, а именно при амплитуде R-волны ≥ 0,4 милливольт. В случае высокой чувствительности и наличия артефактов, их влияние на AF-burden было ниже, чем наш «пороговый интервал» равный 0,5 % [70]. Кроме того, исследование XPECT показало, что именно ИКМ является наиболее точным в измерении AF-burden. По данным проведенного исследования, было показано что отсутствие ФП/ТП/ПТ в конце периода наблюдения было значительно выше у пациентов 90 после ХА (81 %) по сравнению с пациентами, которым выполнялась КА (47 %). В ряде проведенных исследований по аблации ФП, процент эффективности колеблется между 75 % и 92 % после одной процедуры [177, 44, 180, 42]. Тем не менее, является ли эта процедура столь же эффективной при повторном вмешательстве не было показано до этого исследования. Разница в эффективности может возникать в результате лучшей «трансмуральности» при эпикардиальной биполярной ХА. Мы полагаем, что основным фактором в достижении высокой эффективности у данной категории пациентов является более широкое воздействие на заднюю стенку и аблация ганглионарных сплетений. Добавление аблации ганглионарных сплетений к ИЛВ увеличивает эффективность оперативного вмешательства у пациентов с ФП [86, 183]. В недавно проведенном мета-анализе, ближайшая и отдаленная эффективность аблации ГС в сочетании с ИЛВ, превосходила по эффективности ИЛВ или ИЛВ в сочетании с линейными воздействиями [183]. Также, в данном исследовании ХА имела небольшой проаритмогенный эффект. В течение 12 месяцев послеоперационного наблюдения, только один пациент (3 %) в группе ХА имел рецидив ТП по сравнению с 3 (9 %) пациентами в группе КА. В недавнем опубликованном рандомизированном исследовании использование дополнительных аблационных линий с ИЛВ привело к высокой частоте (24 %) левопредсердных тахиаритмий [140]. Хирургическая аблация также может быть осложнена левопредсердным трепетанием, но с гораздой меньшей частотой 0 %-4 % [108,134]. Проаритмический эффект линейной КА, не смотря на интраоперационное подтверждение двунаправленного блока, является одним из основных ограничений этой тактики лечения. Кроме того, тактика линейной аблации при КА очень ограничена. Достижение блока при линейных воздействиях (особенно на митральном 91 перешейке) достаточно сложно и восстановление проводимости нередко происходит вдоль линейных аблаций в ЛП [151]. На сегодняшний день не существует крупных регистров для малоинвазивной ХА ФП, которые оценивают безопасность и эффективность. Несколько исследований по ХА ФП продемонстрировали высокий процент нежелательных событий (от 7 % до 23 %), по сравнению с КА ФП [17, 180, 92]. В проведенном исследовании частота нежелательных явлений была одинаковой в обеих группах в основном из - за высокой частоты левопредсердного трепетания в группе КА. Однако, при сравнении серьезных нежелательных событий, при исключении левопредсердного трепетания предсердий и гематом в области пункции, число серьезных нежелательных событий было значимо выше в группе ХА ФП по сравнению с КА ФП. Основным недостатком данного исследования является относительно небольшое количество пациентов (32 пациента в каждой группе). С другой стороны, данное исследование было рандомизированным, проспективным и расчет объема выборки позволил достичь достоверных результатов. Использование ИКМ позволяет получить полные данные о ФП, обнаружить больше эпизодов, чем многие другие устройства использующиеся для внешней записи ЭКГ, однако пока до конца не подтвержденные в рекомендациях по ведению пациентов с ФП [73]. Однако, данные с ИКМ в этом исследовании собирались ежемесячно, «пороговый интервал» равный 0,5 % исключает наличие эпизодов ФП длительностью более чем 3,6 часов и также возможность детекции многочисленных коротких эпизодов с общей продолжительностью более 3,6 часа в течение периода наблюдения. Аблация в группе ХА была более обширной с вовлечением задней стенки ЛП, в отличии от группы КА. Данное исследование сравнивало результаты различных стратегий аблации, так что было неизбежно, что степень аблации Наибольшая будет отличаться эффективность при между ХА ФП исследуемыми может быть группами. связана с дополнительной модификацией субстрата, однако данное предположение 92 не может быть определена с помощью данного исследования. Кроме того, несмотря на отсутствие достоверных статистических различий, в группу КА ФП было включено больше пациентов с ПерсФП, эффективность оперативного лечения которых ниже по сравнению с пароксизмальной формой ФП. 93 ВЫВОДЫ 1. Определен методологический подход для безопасной торакоскопической изоляции правых и левых легочных вен одним коллектором, анатомической радиочастотной аблации ганглионарных сплетений c созданием линий по крыше и нижней стенке левого предсердия (Box lesion) у пациентов после неэффективной катетерной аблации. 2. Общее количество неблагоприятных событий не отличалось между группами, хотя количество серьезных осложнений (тампонада сердца, пневмоторакс, гидроторакс) было в семь раз выше в группе торакоскопической аблации. 3. Общая эффективность торакоскопической аблации превышает эндокардиальную процедуру на 34 %. Эффективность торакоскопической аблации при пароксизмальной форме ФП превышает эндокардиальную на 29 %, при персистирующей ФП на 39 % к 12-ти месяцам наблюдения. 4. Количество эпизодов фибрилляции предсердий к 12-ти месяцам наблюдения в группе торакоскопической аблаци было ниже на 11 %, чем в группе катетерной аблации. 5. Торакоскопическая аблация имела меньший проаритмогенный эффект в сравнении с катетерной аблацией. Количество левопредсердных трепетаний было в 3 раза меньше в группе торакоскопической аблации по сравнению с группой катетерной аблации. 94 ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ Для эффективного и безопасного выполнения торакоскопической методики аблации рекомендуется: 1. Торакоскопическую аблацию необходимо выполнять в условиях раздельной вентиляции легких (интубация двупросветной трубкой). 2. Необходимо выполнять биторакальную пункционную торакотомию. Сначала осуществляется правосторонняя пункционная торакотомия, затем левосторонняя. Доступ осуществляется с помощью трех портов. Два порта устанавливаются в четвертое и шестое межреберье по средней подмышечной линии. Третий порт находится на 5 см кпереди от средней подмышечной линии в третьем межреберном пространстве. Эндоскоп вводится через порт, расположенный в четвертом межреберье. Оставшиеся два порта используются для двух торакоскопических инструметов. 3. Необходимо обеспечить постоянную инсуфляцию СО2 в плевральную полость для адекватного коллабирования легкого. Скорость подачи и давления СO2 нужно регулировать в зависимости от состояния гемодинамических показателей пациента. 4. Для предотвращения пареза диафрагмального нерва, нужно визуализировать нерв и открывать перикард с правой стороны на 2,5 - 3 см выше него, с левой стороны - максимально низко к корню легкого. 5. Для беспрепятственного обхода правых легочных вен диссектором необходимо провести «тупое» рассечение пространства вокруг ЛВ с последовательным прохождением в поперечный, а затем косой синус полости перикарда. 95 6. Изоляцию следует выполнять биполярным зажимом не менее трех раз в области правых и левых ЛВ; блок входа подтверждать с помощью биполярного картирующего электрода; блок входа подтверждается, если отсутствуют потенциалы в месте воздействия. Блок выхода следует подтверждать стимуляционно во время синусового ритма. При необходимости нужно производить дополнительную изоляцию ЛВ. 7. Заключительным этапом нужно создать две аблационные линии от правых верхней и нижней ЛВ по куполу и нижней стенке ЛП достигая левых легочных вен биполярным линейным электродом. Аналогичную процедуру следует выполнить с левой стороны. Кроме того, связку Маршала необходимо рассечь электрокоагулятором. 8. Для предотвращения пневмо – и гемоторакса в раннем послеоперационном периоде необходимо установить по одному дренажу в правую и левую плевральную полость через один из торакоскопических доступов. 96 СПИСОК ЛИТЕРАТУРЫ 1. Бокерия Л.А., Ревишвили А.Ш. Фибрилляция предсердий: новые подходы к интервенционному лечению // Вестник Российской АМН. – 2009. – No1 – С.4 – 9. 2. Елесин, Д.А. Радиочастотная аблация пароксизмальной и длительно- персистирующей форм наблюдения с фибрилляции помощью предсердий: 1-летний непрерывного период подкожного мониторирования. / Елесин Д.А., Романов А.Б., Туров А.Н. и др. // Вестник аритмологии – 2011. – №.63. – C.5 – 11. 3. Клинические рекомендации по проведению электрофизиологических исследований, катетерной аблации и применению импланитируемых антиаритмических устройств. – Москва. – 2009. – 304 с. 4. Клинические рекомендации по проведению электрофизиологических исследований, катетерной абляции и применению имплантируемых антиаритмических устройств // Москва – 2011. – 518 с. 5. Кушаковский М.С. Аритмии сердца. // Руководство для врачей. Издание 2 – е. – СПб, Фолиант, 1998. – 640 с. 6. Ревишвили А.Ш., Рзаев Ф.Г., Ханкишиева Ф.Р. и др. Отдаленные результаты интервенционного лечения персистирующей и хронической форм фибрилляции // Вестник Аритмологии. – 2006. – No45 – С. 27 – 34. 7. Ревишвили А.Ш., Рзаев Ф.Г., Ханкишиева Ф.Р. и др. Отдаленные результаты интервенционного лечения персистирующей и хронической форм фибрилляции // Вестник Аритмологии. – 2006. – No45 – С. 27 – 34. 8. Ревишвили А.Ш., Серов Р.А., Имнадзе Г.Г. и др. Новые представления об анатомическом субстрате, электрофизиологических механизмах фибрилляции предсердий и результаты интервенционного лечения // Вестник Российской АМН. – 2005. – No4 – С. 38 – 47. 9. Ревишвили А.Ш., Серов Р.А., Имнадзе Г.Г. и др. Новые представления об анатомическом субстрате, электрофизиологических 97 механизмах фибрилляции предсердий и результаты интервенционного лечения // Вестник Российской АМН. – 2005. – No4 – С. 38 – 47. 10. Рекомендации Всероссийского научного общества специалистов по клинической электрофизиологии, аритмологии и кардиостимуляции по проведению катетерной клинических, абляции и электрофизиологических имплантации антиаритмических исследований, устройств. – Москва. – 2009. 239 С. 11. Armour JA, Murphy DA, Yuan BX, et al. Gross and microscopic anatomy of the human intrinsic cardiac nervous system. Anat Rec 1997;247:289 – 298. 12. Ballaux PK, Geuzebroek GS, van Hemel NM, Kelder JC, Dossche KM, Ernst JM,BoersmaLV,WeverEF,BruteldelaRivie`reA,DefauwJJ.Freedom from atrial arrhythmias after classic maze III surgery: a 10 – year experi – ence. J Thorac Cardiovasc Surg 2006;132(6):1433 — 40. 13. Benussi S., Nascimbene S., Galanti A., et al. Complete left atrial ablation with bipolar radiofrequency. // Eur. J. Cardiothorac Surg. – 2008; 33: 590-595. 14. Ben-Haim S.A., Osadchy D., Schuster I. et al. Nonfluoroscopic, in vivo navigation and mapping technology // Nat. Med. 1996; 2:1393 – 1395. 15. Bettoni M., Zimmermann M. Autonomic tone variations before the onset of paroxysmal atrial fibrillation // Circulation. – 2002. – V.105. – P.2753. 16. Beyer E, Lee R, Lam BK. Point: Minimally invasive bipolar radiofrequency ablation of lone atrial fibrillation: Early multicenter results. J Thorac Cardiovasc Surg. 2009;137:521 526. 17. Boersma LV, Castella M, van Boven W, Berruezo A, Yilmaz A, Nadal M, Sandoval E, Calvo N, Brugada J, Kelder J, Wijffels M, Mont L. Atrial fibrillation catheter ablation versus surgical ablation treatment (FAST): a 2 – center randomized clinical trial. Circulation. 2012; 3;125(1):23 – 30. 18. Botto GL, Padeletti L, Santini M et al. Presence and duration of atrial fibrillation detected by continuous monitoring: Crucial implications for the risk of thromboembolic events // J Cardiovasc Electrophysiol. Res. – 2009. – V.20. – P.241-248. 98 19. Bunch TJ, Asirvatham SJ, Friedman PA, et al. Outcomes after cardiac perforation during radiofrequency ablation of the atrium // J Cardiovasc Electrophysiol. 2005;16:1172 – 1179. 20. Calkins H, Brugada J, Packer DL, Cappato R, Chen SA, Crijns HJ, Damiano RJ Jr., Davies DW, Haines DE, Haissaguerre M, Iesaka Y, Jackman W, Jais P, Kottkamp H, Kuck KH, Lindsay BD, Marchlinski FE, McCarthy PM, Mont JL, Morady F, Nademanee K, Natale A, Pappone C, Prystowsky E, Raviele A, Ruskin JN, Shemin RJ: HRS/ EHRA/ECAS expert Consensus Statement on catheter and surgical ablation of atrial fibrillation: Recommendations for personnel, policy, procedures and follow-up. A report of the Heart Rhythm Society (HRS) Task Force on catheter and surgical ablation of atrial fibrillation // Heart Rhythm. Res. – 2007. – V.4. – P.816-861. 21. Canavan ТЕ, Schuessler RB, Cain ME, et al. Computerized global electrophysiological mapping of the atrium in a patient with multiple supraventricular tachyarrhythmias. Ann Thorac Surg 1988;46:232 – 5. 22. Cappato R, Negroni S, Pecora D et al. Prospective assessment of late conduction recurrence across radiofrequency lesions producing electrical disconnection at the pulmonary vein ostium in patients with atrial fi brillation // Circulation 2003; 108: 1599 – 1604. 23. Cappato R, Calkins H, Chen SA, et al. Worldwide survey on the methods, efficacy, and safety of catheter ablation for human atrial fibrillation // Circulation. 2005;111:1100 – 1105. 24. Cappato R, Calkins H, Chen SA, Davies W, Iesaka Y, Kalman J, Kim YH, Klein G, Natale A, Packer D, Skanes A, Ambrogi F, Biganzoli E. Updated Worldwide Survey on the Methods, Efficacy, and Safety of Catheter Ablation for Human Atrial Fibrillation. Circ Arrhythm Electrophysiol. 2010;3:32 – 38. 25. Chae S, Oral H, Good E, et al. Atrial tachycardia after circumferential pulmonary vein ablation of atrial fibrillation: mechanistic insights, results of catheter ablation, and risk factors for recurrence // J. Am. Coll. Cardiol. – 2007. – Vol. 18. – P. 1781 – 1787. 99 26. Chang C.M., Wu T.J., Zhou S. et al. Nerve sprouting and sympathetic hyperinnervation in a canine model of atrial fibrillation produced by prolonged right atrial pacing // Circulation 2001; 103:22 – 5. 27. Charitos EI, Stierle U, Ziegler PD, Baldewig M, Robinson DR, Sievers HH, Hanke T. A comprehensive evaluation of rhythm monitoring strategies for the detection of atrial fibrillation recurrence: insights from 647 continuously monitored patients and implications for monitoring after therapeutic interventions. Circulation. 2012;126:806 – 814. 28. Cheema А, Dong J, Dalal D et al. Incidence and Time Course of Early Recovery of Pulmonary Vein Conduction After Catheter Ablation of Atrial Fibrillation // J Cardiovasc Electrophysiol. 2007; 18 (4): 387 – 391. 29. Chen SA, Tai CT. Catheter ablation of atrial fibrillation originating from the non-pulmonary vein foci // J Cardiovasc Electrophysiol. 2005;16:229 – 232. 30. Chevalier P, Tabib A, Meyronnet D, et al. Quantitative study of nerves of the human left atrium. Heart Rhythm 2005;2:518 – 522. 31. Chugh A., Oral H., Good. E. et al. Catheter ablation of atypical atrial flutter and atrial tachycardia within coronary sinus after left atrial ablation for atrial fibrillation // J.Am. Coll. Cardiol.2005;46:83 – 91. 32. Chevalier P, Tabib A, Meyronnet D, et al. Quantitative study of nerves of the human left atrium. Heart Rhythm 2005;2:518 – 522. 33. Chiou C-W, Eble JN, Zipes DP. Efferent vagal innervation of the canine atria and sinus and atrioventricular nodes – the third fat pad. Circulation 1997;95:2573 – 2584. 34. Choi E.K., Shen M.J., Han S. et al. Intrinsic cardiac nerve activity and paroxysmal atrial tachyarrhythmia in ambulatory dogs // Circulation. – 2010. – Vol. 121. – P. 2615 – 2623. 35. Cox J.L., Schuessler R.B., D’Agostino H.J. Jr., et al. The surgical treatment of atrial fibrillation. III. Development of a definitive surgical procedure. // J. Thorac. Cardiovasc. Surg. – 1991; 101: 569. 36. Cox J.L., Boineau J.P., Scheussler R.B., et al. Modification of the maze 100 procedure for atrial flutter and atrial fibrillation. I. Rationale and surgical results. // J. Thorac. Cardiovasc. Surg – 1995; 110: 473 – 84. 37. Damiano RJ.Jr., Gaynor S. Atrial fibrillation ablation during mitral valve surgery using the Atricure device. Operative Techniques in Thoracic and Cardiovascular Surgery. // Op. Tech. Thorac. Cardiovasc. Surg. – 2004; 9: 24-33. 38. Deisenhofer I., Estner H., Zrenner B. et al. Left atrial tachycardia after circumferential pulmonary vein ablation for atrial fibrillation: incidence, electrophysiological characteristics, and results of radiofrequency ablation // Europace 2006;8(8):573 – 582. 39. Deisenhofer I., Estner H., Reents T. et al. Does electrogram guided substrate ablation add to the success of pulmonary vein isolation in patients with paroxysmal atrial fibrillation? A prospective, randomized study // J. Cardiovasc. Electrophysiol. – 2009. – Vol. 20. – P. 514 – 521. 40. Deneke T., Khargi K., Muller K.M., et al. Histopathology of intraoperatively induced linear radiofrequency ablation lesions in patients with chronic atrial fibrillation. Eur Heart J 2005; 26: 1797–1803. 41. Dimmer C., Tavernier R., Gjorgov N. et al. Variations of autonomic tone preceding onset of atrial fibrillation after coronary artery bypass grafting // Am. J. Cardiol. – 1998. – V.82. – P.22 – 25. 42. Di Biase L, Burkhardt JD, Mohanty P. Left atrial appendage: an underrecognized trigger site of atrial fibrillation. Circulation. 2010;122:109 – 118. 43. Dong J, Vasamreddy CR, Jayam V, et al. Incidence and predictors of pulmonary vein stenosis following catheter ablation of atrial fibrillation using the anatomic pulmonary vein ablation approach: Results from paired magnetic resonance imaging // J. Cardiovasc. Electrophysiol. 2005;16:845 – 852. 44. Edgerton JR, Jackman WM, Mack MJ. A new epicardial lesion set for minimal access left atrial maze: the Dallas lesion set. Ann Thorac Surg. 2009;88:1655 – 1657. 45. Edgerton JR, Brinkman WT, Weaver T. Pulmonary vein isolation and autonomic denervation for the management of paroxysmal atrial fibrillation by a 101 minimally invasive surgical approach. J Thorac Cardiovasc Surg. 2010;140:823 – 828. 46. Elvan A., Pride H.P., Eble J.N., et al. Radiofrequency catheter ablation of the atria reduces inducibility and duration of atrial fibrillation in dogs. // Circulation. – 1995; 91: 2235 – 44. 47. Elvan A., Pride H.P., Zipes D.P., et al. Replication of the maze procedure by radiofrequency catheter ablation reduces the ability to induce atrial fibrillation. // PACE. – 1994; 17: 774. 48. Ernst S, Schluter M, Ouyang F et al. Modification of the substrate for maintenance of idiopathic human atrial fibrillation // Circulation. Res. – 1999. – V.100. – P.2085-2092. 49. Fuster V., Ryden L.E., Cannom D.S. et al. 2011 ACCF/AHA/HRS focused updates incorporated into the ACC/AHA/ESC 2006 guidelines for the management of patients with atrial fibrillation: a report of the American College of Cardiology Foundation/American Heart Association Task Force on practice guidelines. // Circulation. 2011 Mar 15;123(10):e269 – 367. 50. Gage BF, Waterman AD, Shannon W., et al. Validation of clinical classification schemes for predicting stroke: results from the National Registry of Atrial Fibrillation // JAMA. 2001 Jun 13;285(22):2864 – 70. 51. Gaynor S., Diodato M., Prasad S. et al. A prospective, single – center clinical trial of a modified Cox maze procedure with bipolar radiofrequency ablation. // J. Thoracic. Cardiovasc. Surg. – 2004; 128: 535 – 542. 52. Gerstenfeld E.P., Callans D.J., Dixit S. et al. Mechanisms of organized left atrial tachycardias occurring after pulmonary vein isolation // Circulation. 2004; 110:1351 – 1357. 53. Gerstenfeld EP, Marchlinski FE. Mapping and ablation of left atrial tachycardias occurring after atrial fibrillation ablation // Heart Rhythm. – 2007. – Vol. 4. – P. 65 – 72. 54. Gillinov M., Pettersson G., Rice T.W. Esophageal injury during radiofrequency ablation of atrial fibrillation. // J. Thoracic. Cardiovasc. Surg. – 102 2001; 122: 1239 – 1240. 55. Glotzer TV, Hellkamp AS, Zimmerman J et al. Atrial high rate episodes detected by pacemaker diagnostics predict death and stroke // Circulation. Res. – 2003. – V.107. – P.1614-1619. 56. Glotzer TV, Daoud EG, Wyse DG et al. The relationship between daily atrial tachyarrhythmia burden from implantable device diagnostics and stroke risk. The TRENDS Study // Circ Arrhythmia Electrophysiol. Res. – 2009. – V.2. – P.474-480. 57. Gould PA, Yii M, McLean C et al. Evidence for increased atrial sympathetic innervation in persistent human atrial fibrillation // Pacing Clin Electrophysiol 2006;29:821 – 829. 58. Haissaguerre M, Marcus FI, Fischer B. et al. Radiofrequency catheter ablation in unusual mechanisms of atrial fibrillation: Report of three cases // J Cardiovasc Electrophysiol. 1994;5:743 – 751. 59. Haissaguerre M, Jais P, Shah DC, et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins // N Engl J Med. 1998;339:659 – 666. 60. Haissaguerre M., Jais P., Shah D.C. et al. Electrophysiological end point for catheter ablation of atrial fibrillation initiated from multiple pulmonary venous foci // Circulation. – 2000. – V.101. – P.1409 – 1417. 61. Haissaguerre M., Shah D.C., Jais P. et al. Electrophysiologic breakthroughs from the left atrium to the pulmonary veins // Circulation. – 2000. – V.102. – P.2463 – 2465. 62. Haissaguerre M, Sanders P, Hocini M, et al. Catheter ablation of long- lasting persistent atrial fibrillation: Critical structures for termination // J Cardiovasc Electrophysiol. 2005;16:1125 – 1137. 63. Hand D.E., Lappas D.G., Hogue C.W.Jr., et al. Perioperative transesophageal Doppler echocardiographic verification of atrial transport function following the maze procedure for atrial fibrillation. // Surg. Forum. 1992; 43: 267 – 9. 103 64. Hanke T, Charitos EI, Stierle U et al. Twenty-four-hour holter monitor follow-up does not provide accurate heart rhythm status after surgical atrial fibrillation ablation therapy up to 12 months experience with a novel perma- nently implantable heart rhythm monitor device // Circulation. Res. – 2009. – V.120. – P.177-S184. 65. Hayward RM, Upadhyay GA, Mela T., et al. Pulmonary vein isolation with complex fractionated atrial electrogram ablation for paroxysmal and nonparoxysmal atrial fibrillation: A meta-analysis // Heart Rhythm. 2011 Jul; 8(7):994 – 1000. 66. Herrera Siklódy C, Deneke T, Hocini M, Lehrmann H, Shin DI, Miyazaki S, Henschke S, Fluegel P, Schiebeling-Römer J, Bansmann PM, Bourdias T, Dousset V, Haïssaguerre M, Arentz T. Incidence of asymptomatic intracranial embolic events after pulmonary vein isolation: comparison of different atrial fibrillation ablation technologies in a multicenter study. J Am Coll Cardiol. 2011;58:681 – 8. 67. Hirose M., Leatmanoratn Z., Laurita K.R. et al. Partial vagal denervation increases vulnerability to vagally induced atrial fibrillation// J Cardiovasc Electrophysiol 2002 ;13:1272 – 1279. 68. Hou Y, Scherlag BJ, Lin J, et al. Ganglionated plexi modulate extrinsic cardiac autonomic nerve input: Effects on sinus rate, atrioventricular conduction, refractoriness, and inducibility of atrial fibrillation // J Am Coll Cardiol. 2007;50:61 – 68. 69. Hou Y, Scherlag BJ, Lin J, et al. Interactive atrial neural network: Determining the connections between ganglionated plexi // Heart Rhythm. 2007;4:56 – 63. 70. Hoppe UC, Casares JM, Eiskjær H, et al. Effect of cardiac resynchronization on the incidence of atrial fibrillation in patients with severe heart failure // Circulation. Res. – 2006. – V.114. – P.18 – 25. 71. Hsieh M.H., Tai C.T., Chiang C.E. et al. Recurrent atrial flutter and atrial fibrillation after catheter ablation of the cavotricuspid isthmus: a very long-term follow-up of 333 patients//J Interv Card Electrophysiol. 2002; 7(3):225 – 31. 104 72. Hsu LF, Jais P, Hocini M, et al. Incidence and prevention of cardiac tamponade complicating ablation for atrial fibrillation // Pacing Clin Electrophysiol. 2005;28(Suppl 1):S106 – 109. 73. Hugh Calkins, Karl Heinz Kuck, Riccardo Cappato, Josep Brugada, A. John Camm, Shih-Ann Chen, Harry J.G. Crijns, Ralph J. Damiano, Jr., D. Wyn Davies, John DiMarco, James Edgerton, Kenneth Ellenbogen, Michael D. Ezekowitz, David E. Haines, Michel Haissaguerre, Gerhard Hindricks, Yoshito Iesaka, Warren Jackman, Jose Jalife, Pierre Jais, Jonathan Kalman, David Keane, Young-Hoon Kim, Paulus Kirchhof, George Klein, Hans Kottkamp, Koichiro Kumagai, Bruce D. Lindsay, Moussa Mansour, Francis E. Marchlinski, Patrick M. McCarthy, J. Lluis Mont, Fred Morady, Koonlawee Nademanee, Hiroshi Nakagawa, Andrea Natale, Stanley Nattel, Douglas L. Packer, Carlo Pappone, Eric Prystowsky, Antonio Raviele, Vivek Reddy, Jeremy N. Ruskin, Richard J. Shemin, Hsuan-Ming Tsao, David Wilber. 2012 HRS/EHRA/ECAS Expert Consensus Statement on Catheter and Surgical Ablation of Atrial Fibrillation: Recommendationsfor Patient Selection, Procedural Techniques, Patient Management and Follow-up, Definitions, Endpoints, and Research Trial Design A report of the Heart Rhythm Society (HRS) Task Force on Catheter and Surgical Ablation of Atrial Fibrillation. Developed in partnership with the European Heart Rhythm Association (EHRA), a registered branch of the European Society of Cardiology (ESC) and the European Cardiac Arrhythmia Society (ECAS); and in collaboration with the American College of Cardiology (ACC), American Heart Association (AHA), the Asia Pacific Heart Rhythm Society (APHRS), and the Society of Thoracic Surgeons (STS). Endorsed by the governing bodies of the American College of Cardiology Foundation, the American Heart Association, the European Cardiac Arrhythmia Society, the European Heart Rhythm Association, the Society of Thoracic Surgeons, the Asia Pacific Heart Rhythm Society, and the Heart Rhythm Society. 105 74. Hwang C., Wu T.L., Doshi R.N. et al. Vein of Marshall cannulation for the analysis of electrical activity in patients with focal atrial fibrillation // Circulation.2000;101:1503 – 1508. 75. Ip J, Waldo AL, Lip GYH et al. Multicenter randomized study of anticoagulation guided by remote rhythm monitoring in patients with implantable cardioverter-defibrillator and CRT-D devices: Rationale, design, and clinical characteristics of the initially enrolled cohort: The IMPACT study // Am Heart J. Res. – 2009. – V.158. – P.364 – 370. 76. Jais P, Haissaguerre M, Shah DC, et al. A focal source of atrial fibrillation treated by discrete radiofrequency ablation // Circulation. 1997;95:572 – 576. 77. Jais P., Hocini M., Weerasooriya R. et al. Left atrial isthmus ablation: technique and results in patients with atrial fibrillation//Circulation. 2002; 106 (II): 501. 78. Jaıs P, Nault I, Wright M et al. Early recurrences after atrial fibrillation ablation: Prognostic value and effect of early reablation // J Cardiovasc Electrophysiol. Res. – 2008. – V.19. – P.599 – 605. 79. Jalife J., Berenfeld O., Mansour M. Mother rotors and fibrillatory conduction: a mechanism of atrial fibrillation//Cardiovascular Research. 2002; 54:204 – 216. 80. Jongbloed MR, Schalij MJ, Poelmann RE, et al. Embryonic conduction tissue: A spatial correlation with adult arrhythmogenic areas. // J Cardiovasc Electrophysiol. 2004;15:349 – 355. 81. Kanagaratnam L, Tomassoni G, Schweikert R, et al. Empirical pulmonary vein isolation in patients with chronic atrial fibrillation using a three – dimensional nonfluoroscopic mapping system: Long-term follow-up // Pacing Clin Electrophysiol. 2001;24:1774 – 1779. 82. Katritsis D, Giazitzoglou E, Sougiannis D, et al.: Anatomic approach for ganglionic plexiablation in patients with paroxysmal atrial fibrillation // Am J. Cardiol. – 2008. – V.102. – P.330 – 401. 106 83. Katritsis D, Giazitzoglou E, Sougiannis D, Goumas N, Paxinos G, Camm AJ. Anatomic approach for ganglionic plexi ablation in patients with paroxysmal atrial fibrillation. Am J Cardiol. 2008;102:330 – 334. 84. Katritsis D., Giazitzoglou E., Sougiannis D. et al. Complex fractionated atrial electrograms at anatomic sites of ganglionated plexi in atrial fibrillation // Europace. – 2009. – Vol. 11. – P. 308 – 315. 85. Katritsis DG, Giazitzoglou E, Zografos T, Pokushalov E, Po SS, Camm AJ. Rapid pulmonary vein isolation combined with autonomic ganglia modification: A randomized study. Heart Rhythm. 2011;8:672 – 678. 86. Katritsis DG, Giazitzoglou E, Zografos T. Rapid pulmonary vein isolation combined with autonomic ganglia modification: a randomized study. Heart Rhythm. 2011;8:672 – 8. 87. Khargi K., Laczkovics A., Muller K., et al. A possible surgical technique to avoid esophageal and circumflex artery injuries using radiofrequency ablation to treat atrial fibrillation. // Interact. CardioVasc. Thorac. Surg. – 2004; 3(2): 352 – 355. 88. Klingenheben T., Grönefeld G., Li Y.G. et al. Heart rate variability to assess changes in cardiac vagal modulation before the onset of paroxysmal atrial fibrillation in patients with and without structural heart disease // Ann Noninvas Electrocardiol. 1999; 4: 19 – 26. 89. Kobza R, Hindricks G, Tanner H et al. Late recurrent arrhythmias after ablation of atrial fi brillation: incidence, mechanisms, and treatment // Heart Rhythm 2004; 1: 676 – 683. 90. Kosakai Y., Kawaguchi A.T., Isobe F., et al. Modified Maze procedure for patients with atrial fibrillation undergoing simultaneous open heart surgery. // Circulation. 1995; 92 (9 Suppl):II 359. 91. Kumagai K. Patterns of activation in human atrial fibrillation // Heart Rhythm. 2007;4:S7 – S12. 92. Krul SP, Driessen AH, van Boven WJ. Thoracoscopic video-assisted pulmonary vein antrum isolation, ganglionated plexus ablation, and periprocedural 107 confirmation of ablation lesions: first results of a hybrid surgical – electrophysiological approach for atrial fibrillation. Circ Arrhythm Electrophysiol. 2011;4:262 – 270. 93. Langberg Jj., Lee Ma., Chin Mc., Rosenqvist M., et al. Radiofrequency catheter ablation: the effect of electrode size on lesion volume in vivo. // PACE. – 1990; 13: 1242-1248. 94. Lellouche N, Jais P, Nault I et al. Early Recurrences After Atrial Fibrillation Ablation: Prognostic Value and Effect of Early Reablation // J Cardiovasc Electrophysiol 2008; V. 19. – p. 599 – 605. 95. Lemery R, Birnie D, Tang A, et al.: Feasibility study of endocardial mapping of ganglionated plexuses during catheter ablation of atrial fibrillation // Heart Rhythm. – 2006. – V.3. – P.387 – 396. 96. Lemola K., Hall B., Cheung P. et al. Mechanisms of recurrent atrial fibrillation after pulmonary vein isolation by segmental ostial ablation // Heart Rhythm. 2004; 1:197 – 202. 97. Levy S., Ricard P., Yapo F. et al. Les medicaments antiarythmiques dans la fibrillation auriculaire paroxystique. Quand et comment? // Arch. Mal. Coeur. Vaiss. 1996; 89:1 – 24. 98. Lin J, Scherlag BJ, Zhou J, et al. Autonomic mechanism to explain complex fractionated atrial electrograms (CFAE) // J Cardiovasc Electrophysiol. 2007;18:1197 – 1205. 99. Lu Z, Scherlag BJ, Lin J, et al. Autonomic mechanism for complex fractionated atrial electrograms: Evidence by fast fourier transform analysis. // J Cardiovasc Electrophysiol. 2008;19:835 – 842. 100. Mainigi SK, Sauer WH, Cooper JM, et al. Incidence and predictors of very late recurrence of atrial fibrillation after ablation. // J Cardiovasc Electrophysiol. 2007;18:69 – 74. 101. Marrouche N.F., Martin D.O., Wazni O. et al. Phased-array intracardiac echocardiography monitoring during pulmonary vein isolation in patients with 108 atrial fibrillation: impact on outcome and complications // Circulation. 2003; 107: 2710 – 2716. 102. Mehall JR, Kohut RM, Jr., Schneeberger EW, Taketani T, Merrill WH, Wolf RK. Intraoperative epicardial electrophysiologic mapping and isolation of autonomic ganglionic plexi. Ann Thorac Surg. 2007;83:538 – 541. 103. Mikhaylov E, Kanidieva A, Sviridova N, Abramov M, Gureev S, Szili – Torok T, Lebedev D. Outcome of anatomic ganglionated plexi ablation to treat paroxysmal atrial fibrillation: A 3 – year follow-up study. Europace. 2011;13:362 – 370. 104. Moe GK, Rheinboldt WC, Abildskov JA. A computer model of atrial fibrillation. // Am Heart J. 1964;67:200 – 220. 105. Mohr W.F., Fabricius A.M., Falk V., et al. Curative treatment of atrial fibrillation with intraoperative radiofrequency ablation: short-term and midterm results. // J. Thorac. Cardiovasc. Surg. – 2002; 123: 919 – 927. 106. Moreira W., Timmermans C., Wellens Hein J.J., Mizusawa Y., Philippens S., Perez D., Rodriguez L – M. Can Common – Type Atrial Flutter Be a Sign of an Arrhythmogenic Substrate in ParoxysmalAtrial Fibrillation? // Circulation. – 2007. – V.116. – P.2786 – 2792. 107. Moubarak J.B., Rozwadowski J.V., Strzalka C.T. et al. Pulmonary veins – left atrial junction: anatomic and histological study // Pacing Clin. Electrophysiol. 2000; 23:1836–1838. 108. Muneretto C, Bisleri G, Bontempi L. Durable staged hybrid ablation with thoracoscopic and percutaneous approach for treatment of long – standing atrial fibrillation: a 30-month assessment with continuous monitoring. J Thorac Cardiovasc Surg. 2012; 144(6):1460 – 5. 109. Nademanee K, Schwab M, Porath J, et al. How to perform electrogram – guided atrial fibrillation ablation // Heart Rhythm. 2006 Aug;3(8):981 – 4. 110. Nakagawa, H., Jackman W.M., Scherlag B.J. et al. Pulmonary vein isolation during atrial fibrillation: insight into the mechanism of pulmonary vein firing // Cardiovasc. Electrophysiol. – 2003. – Vol. 14. – P. 261-272. 109 111. Nakagawa H, Scherlag BJ, Aoyama H, et al. Catheter ablation of cardiac autonomic nerves for prevention of atrial fibrillation in a canine model [abstract]. Heart Rhythm 2004; 1:S10. 112. Nath S. , Lynch C., Whayne J.G., et al. Cellular electrophysiological effects of hyperthermia on isolated guinea pig papillary muscle. Implications for catheter ablation. // Circulation. – 1993; 88: 1826 – 31. 113. Nathan H, Eliakim M. The junction between the left atrium and the pulmonary veins. An anatomic study of human hearts. // Circulation. 1966;34:412 – 422. 114. Nilsson B, Chen Xu, Pehrson S, et al. Recurrence of pulmonary vein conduction and atrial fi brillation after pulmonary vein isolation for atrial fi brillation: A randomized trial of the ostial versus the extraostial ablation strategy // Am Heart J, 2006; 152: 537. 115. O’Neill MD, Jais P, Hocini M, et al. Catheter ablation for atrial fibrillation. // Circulation. 2007;116:1515 – 1523. 116. Oral H., Knight B.P., Tada H. et al. Pulmonary vein isolation for paroxysmal and persistent atrial fibrillation // Circulation. 2002; 105:1077 – 1081. 117. Oral H., Scharf C., Chugh A. et al. Catheter ablation for paroxysmal atrial fibrillation: segmental pulmonary vein ostial ablation versus left atrial ablation // Circulation. 2003; 108: 2355 – 2360. 118. Oral H., Chugh A., Good E. et al. A Tailored Approach to Catheter Ablation of Paroxysmal Atrial Fibrillation // Circulation. 2006; 113: 1824-1831. 119. Oral H, Chugh A, Ozaydin M, et al. Risk of thromboembolic events after percutaneous left atrial radiofrequency ablation of atrial fibrillation. // Circulation. 2006;114:759 – 765. 120. Oral H., Chugh A., Yoshida K. et al. A randomized assessment of the incremental role of ablation of complex fractionated atrial electrograms after antral pulmonary vein isolation for long-lasting persistent atrial fibrillation // J. Am. Coll. Cardiol. – 2009. – Vol. 53. – P. 782 – 789. 110 121. Ouyang F, Antz M, Ernst S, et al. Recovered pulmonary vein conduction as a dominant factor for recurrent atrial tachyarrhythmias after complete circular isolation of the pulmonary veins: Lessons from double Lasso technique // Circulation. 2005;111:127 – 135. 122. Ouyang F., Ernst S., Chun J. et al. Electrophysiological findings during ablation of persistent atrial fibrillation with electroanatomic mapping and double Lasso catheter technique // Circulation. 2005; 112(20):3038 – 3048. 123. Ouyang F, Bänsch D, Ernst S, et al. Complete isolation of left atrium surrounding the pulmonary veins: new insights from the double-Lasso technique in paroxysmal atrial fibrillation // Circulation. 2004 Oct 12;110(15):2090 – 6. 124. Pachon M J.C., Pachon M. E.I., Pachon M.J.C. et al. A new treatment for atrial fibrillation based on spectral analysis to guide the catheter RF – ablation // Europace. 2004; 6(6): 590-601. 125. Pappone C, Rosanio S, Oreto G, et al. Circumferential radiofrequency ablation of pulmonary vein ostia: A new anatomic approach for curing atrial fibrillation // Circulation. 2000;102:2619 – 2628. 126. Pappone C., Oreto G., Rosanio S. et al. Atrial electroanatomic remodeling after circumferential radiofrequency pulmonary vein ablation: Efficacy of an anatomic approach in a large cohort of patients with atrial fibrillation // Circulation. – 2001. – V.104. – P.2539 – 2544. 127. Pappone C., Rosanio S., Augello G. et al. Mortality, morbidity, and quality of life after circumferential pulmonary vein ablation for atrial fibrillation: outcomes from a controlled nonrandomized longterm study // J. Am. Coll. Cardiol. – 2003. – V.42. – P.185 – 197. 128. Pappone C., Oral H., Santinelli V. et al. Atrio-esophageal fistula as a complication of percutaneous transcatheter ablation of atrial fibrillation // Circulation.2004; 109:2724-2726. 129. Pappone C., Santinelli V., Manguso F. et al. Pulmonary vein denervation enhances long-term benefit after circumferential ablation for paroxysmal atrial fibrillation // Circulation. – 2004. – V.109. – P.327 – 334. 111 130. Pappone C., Manguso F., Vicedomini G., et al. Prevention of iatrogenic atrial tachycardia after ablation of atrial fibrillation: A prospective randomized study comparing circumferential pulmonary vein ablation with a modified approach // Circulation. 2004;110:3036 – 3042. 131. Pappone С., Augello G., Santinelli V. Atrial fibrillation ablation//Ital. Heart J. 2005; 6 (3):190 199. 132. Pappone C, Vicedomini G, Manguso F, et al. Robotic magnetic navigation for atrial fibrillation ablation // J Am Coll Cardiol. 2006;47:1390 – 1400. 133. Patterson E., Po S.S., Scherlag B. et al. Triggered firing in pulmonary veins initiated by in vitro autonomic nerve stimulation // Heart Rhythm 2005;2:624 – 31. 134. Pison L, La Meir M, van Opstal J. Hybrid thoracoscopic surgical and transvenous catheter ablation of atrial fibrillation. J Am Coll Cardiol. 2012; 3;60(1):54 – 61. 135. Platt M., Mandapati R., Scherlag B.J. et al. Limiting the number and extent of radiofrequency applications to terminate atrial fibrillation and subsequently prevent its inducibility [abstract] // Heart Rhythm 2004; 1:S11. 136. Pokushalov E, Turov A, Shugaev P, et al. A new anatomic approach in the treatment of atrial fibrillation: catheter ablation of left atrial ganglionated plexi // Heart Rhythm 2007; 4: 311. 137. Pokushalov E., Romanov A., Artyomenko S. et al. Ganglionated plexi ablation for longstanding persistent atrial fibrillation // Europace. – 2010. – Vol. 12. – P. 342 – 346. 138. Pokushalov E., Romanov A., Artyomenko S. et al. Left Atrial Ablation at the Anatomic Areas of Ganglionated Plexi for Paroxysmal Atrial Fibrillation // Pacing Clin. Electrophysiol. – 2010. – Vol. 33. – P. 1231-2138. 139. Pokushalov E, Romanov A, Corbucci G, Artyomenko S, Turov A, Shirokova N, Karaskov A. Use of an implantable monitor to detect arrhythmia recurrences and select patients for early repeat catheter ablation for atrial fibrillation: a pilot study. Circ Arrhythm Electrophysiol. 2011;4(6):823 – 31. 112 140. Pokushalov E, Romanov A, Corbucci G, Artyomenko S, Turov A, Shirokova N, Karaskov A. Ablation of paroxysmal and persistent atrial fibrillation: 1-year follow-up through continuous subcutaneous monitoring. J Cardiovasc Electrophysiol 2011;22:369 – 75. 141. Pokushalov E, Romanov A, Artyomenko S, Baranova V, Losik D, Bairamova S, Karaskov A, Mittal S, Steinberg JS. Cryoballoon Versus Radiofrequency for Pulmonary Vein Re-Isolation After a Failed Initial Ablation Procedure in Patients with Paroxysmal Atrial Fibrillation. J Cardiovasc Electrophysiol. 2013;24(3):274 – 9. 142. Pollak WM, Simmons JD, Interian A et al. Clinical utility of intraatrial pacemaker stored electrograms to diagnose atrial fibrillation and flutter // Pacing Clin Electrophysiol. Res. – 2001. – V.24. – P.424 – 429. 143. Po SS, Scherlag BJ, Yamanashi WS, et al. Experimental model for paroxysmal atrial fibrillation arising at the pulmonary vein-atrial junctions // Heart Rhythm. 2006;3:201 – 208. 144. Po SS, Nakagawa H, Jackman WM. Localization of left atrial ganglionated plexi in patients with atrial fibrillation. J Cardiovasc Electrophysiol. 2009;20:11861189. 145. Prasad S.M., Maniar H.S., Schuessler R.B., et al. Chronic transmural atrial ablation by using bipolar radiofrequency energy on the beating heart. // J. Thorac. Cardiovasc. Surg. – 2002; 124: 708 – 713. 146. Prasad S.M., Maniar H.S., Camillo C.J., et al. The Cox Qqhyphenmaze III procedure for atrial fibrillation: Long-term efficacy in patients undergoing lone versus concomitant procedure. // J. Thorac. Cardiovasc. Surg. – 2003; 126: 18221828. 147. Ratjawat Y.S., Gerstenfeld E.P., Patel V.V. et al. ECG criteria for localizing the pulmonary vein origin of spontaneous atrial premature complexes: validation using intracardiac recordings//Pacing Clin. Electrophysiol. 2004; 27:182 – 188. 113 148. Ren JF, Marchlinski FE, Callans DJ. Left atrial thrombus associated with ablation for atrial fibrillation: Identification with intracardiac echocardiography // J Am Coll Cardiol. 2004;43:1861 – 1867. 149. Ricci RP, Quesada A, Almendral J, Arribas F, Wolp- ert C, Adragao P, Zoni Berisso M, Navarro X, De Santo T, Grammatico G, SantiniM, on behalf of DATAS study Investigators: Dual-chamber implantable cardioverter defibrillators reduce clinical adverse events related to atrial fibrillation when compared with single-chamber defibrillators: A subanalysis of the DATAS trial // Europace. Res. – 2009 – V.11. – P.587-593. 150. Rostock Th, Rotter M, Sanders P et al. High-density activation mapping of fractionated electrograms in the atria of patients with paroxysmal atrial fi brillation // Heart Rhythm 2006; 3: 27 – 34. 151. Rostock T, O'Neill MD, Sanders P. Characterization of conduction recovery across left atrial linear lesions in patients with paroxysmal and persistent atrial fibrillation. J Cardiovasc Electrophysiol. 2006;17:1106 – 11. 152. Saad EB, Rossillo A, Saad CP, et al. Pulmonary vein stenosis after radiofrequency ablation of atrial fibrillation: Functional characterization, evolution, and influence of the ablation strategy // Circulation. 2003;108:3102 – 3107. 153. Savelieva I, Camm J. Update on atrial fibrillation: Part I. // Clin Cardiol. 2008;31:55 – 62. 154. Sealy W.C., Gallagher J.J., Kasell J., et al. His Bundle Interruption for Control of Inappropriate Ventricular Responses to Atrial Arrhythmias. // Ann. Thorac. Surg. 1981; 32: 429 – 438. 155. Scanavacca M, Pisani CF, Hachul D, Lara S, Hardy C, Darrieux F, Trombetta I, Negrão CE, Sosa E. Selective atrial vagal denervation guided by evoked vagal reflex to treat patients with paroxysmal atrial fibrillation // Heart Rhythm – 2006. – Vol. 9. – P. 876 – 885. 156. Singh JP, Larson MG, Levy D, Evans JC, Tsuji H, Benjamin EJ. Is baseline autonomic tone associated with new onset atrial fibrillation?: Insights from the framingham heart study// Ann. Noninvasive Electrocardiol 2004;9:215 – 20. 114 157. Scharf C., Oral H., Chugh A. et al. Acute effects of left atrial radiofrequency ablation on atrial fibrillation//J. Cardiovasc. Electrophysiol. 2004; – 15:1 – 7. 158. Sharifov O.F., Fedorov V.V., Beloshapko G.G., Glukhov A.V., Yushmanova A.V., Rosenshtraukh L.V. Roles of adrenergic and cholinergic stimulation in spontaneous atrial fibrillation in dogs // J. Am. Coll. Cardiol. – 2004. – V.43. – P.483–490. 159. Schauerte P, Scherlag BJ, Pitha J, et al. Catheter ablation of cardiac autonomic nerves for prevention of vagal atrial fibrillation // Circulation. 2000;102:2774 – 2780. 160. Schauerte P, Scherlag BJ, Patterson E, et al. Focal atrial fibrillation: Experimental evidence for a pathophysiologic role of the autonomic nervous system // J Cardiovasc Electrophysiol. 2001;12:592 – 599. 161. Scherlag B.J., Nakagawa H., Jackman W.M. et al. Electrical Stimulation to Identify Neural Elements on the Heart: Their Role in Atrial Fibrillation // Journal of Interventional Cardiac Electrophysiology. – 2005. – V.13. – P.37 – 42. 162. Scherlag BJ, Yamanashi WS, Patel U, et al. Autonomically induced conversion of pulmonary vein focal firing into atrial fibrillation // J Am Coll Cardiol 2005; 45: 1878 – 1886. 163. Sonmez B., Demirsoya E., Yagan N. A fatal complication due to radiofrequency ablation for atrial fibrillation: atrio-esophageal fistula. // Ann. Thorac. Surg. – 2003; 76: 281-283. 164. Spector P.S., Noori A.M., Hardin N.J. et al. Pulmonary vein encircling ablation alters the atrial electrophysiologic response to autonomic stimulation// J Interv Card Electrophysiol 2007; 5:22 – 9. 165. Stone C., Chang В., Tweddell J., et al. Ablation of atrial fibrillation by the maze procedure. // Surg. Forum. – 1989; 40: 213 – 5. 166. Stulak J., Sundt T., Dearani J., et al. Ten-year Experience With the CoxMaze Procedure for Atrial Fibrillation: How Do We Define Success? // Ann. Thorac. Surg. – 2007; 83: 1319 – 1324. 115 167. Szalay Z.A., Skwara, W., Pitschner H.F., et al. Midterm results after the mini – maze procedure. // Eur. J. Cardiothorac Surg. - 1999; 16: 306-311. 168. Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology. Heart rate variability: standards of measurement, physiological interpretation, and clinical use // Circulation.1996; 93: 1043 – 1065. 169. Themistoclakis S., Schweikert R.A., Saliba W.I. et al. Clinical predictors and relationship between early and late atrial tachyarrhythmias after pulmonary vein antrum isolation// Heart Rhythm. 2008; 5(5):679 – 85. 170. Thomas S.P., Guy D.J., Boyd A.C., et al. Comparison of epicardial and endocardial linear ablation using handheld probes. // Ann. Thorac. Surg. – 2003; 75(2): 543-548. 171. Twracy C. M., Akhtar M., DiMarco J. P. et al. American College of Cardiology/American Heart Association Clinical Competence Statement on invasive electrophysiology studies, catheter ablation, and cardioversion: A report of the american college of cardiology/american heart association/american college of physicians-american society of internal medicine task force on clinical competence//J. Am. Coll. Cardiol. 2000; 36(5):1725 - 1736. 172. Van den berg M.P., Haaksma J., Tieleman R. et al. Heart rate variability in patients with atrial fibrillation is related to vagal tone// Circulation 1997; 96:120916. 173. Verma A., Natale A., Padanilam B.J. et al. Why Atrial Fibrillation Ablation Should Be Considered First-Line Therapy for Some Patients//Circulation. 2005; 112(8): 1214 - 1222. 174. Verma A, Saliba WI, Lakkireddy D, Burkhardt JD, Cummings JE, Wazni OM, Belden WA, Thal S, Schweikert RA, Martin DO, Tchou PJ, Natale A. Vagal responses induced by endocardial left atrial autonomic ganglion stimulation before and after pulmonary vein antrum isolation for atrial fibrillation. Heart Rhythm. 2007;4:1177 – 1182. 116 175. Verma A., Mantovan R., Macle L. et al. Substrate and Trigger Ablation for Reduction of Atrial Fibrillation (STAR AF): a randomized, multicentre, international trial // Eur. Heart. J. – 2010. – Vol. 31. – P. 1344-1356. 176. Wijffels MC, Kirchhof CJ, Dorland R, Allessie MA. Atrial fibrillation begets atrial fibrillation. A study in awake chronically instrumented goats // Circulation. 1995;92:1954 – 1968. 177. Wolf RK, Schneeberger EW, Osterday R, Miller D, Merrill W, Flege Jr JB, Gillinov AM. Video-assisted bilateral pulmonary vein isolation and left atrial appendage exclusion for atrial fibrillation. J Thorac Cardiovasc Surg 2005;130:797 – 802. 178. Wright M, Haissaguerre M, Knecht S, et al. State of the art: Catheter ablation of atrial fibrillation // J Cardiovasc Electrophysiol. 2008;19:583 – 592. 179. Wyse DG, Waldo AL, DiMarco JP, et al. A comparison of rate control and rhythm control in patients with atrial fibrillation // N Engl J Med. 2002;347:1825 – 1833. 180. Yilmaz A, Geuzebroek GS, Van Putte BP. Completely thoracoscopic pulmonary vein isolation with ganglionic plexus ablation and left atrial appendage amputation for treatment of atrial fibrillation. Eur J Cardiothorac Surg. 2010; 38:356 – 360. 181. Zhang Y, Scherlag BJ, Lu Z, et al. Comparison of atrial fibrillation inducibility by electrical stimulation of either the extrinsic or the intrinsic autonomic nervous systems // J Interv Card Electrophysiol. 2009;24:5 – 10. 182. Zhou J, Scherlag BJ, Edwards J, et al. Gradients of atrial refractoriness and inducibility of atrial fibrillation due to stimulation of ganglionated plexi // J Cardiovasc Electrophysiol. 2007;18:83 – 90. 183. Zhou Q, Hou Y, Yang S. A meta-analysis of the comparative efficacy of ablation for atrial fibrillation with and without ablation of the ganglionated plexi. Pacing Clin Electrophysiol. 2011;34:1687 – 1694. 117