Водородная химическая связь
реклама

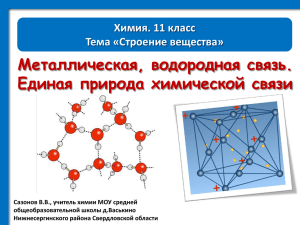
Водородная химическая связь Рассмотрением водородной связи завершаем знакомство с типами химической связи. И это не случайно. Во-первых, водородная связь -- предмет нескончаемых дискуссий между физиками и химиками, с различных точек зрения рассматривающих этот тип связи. Физики утверждают, что это разновидность межмолекулярного взаимодействия, имеющего физическую природу, и аргументируют тем, что энергия такой связи составляет всего лишь 4 —40 кДж/моль. Большинство химиков придерживаются иной точки зрения, которая будет изложена ниже. Во-вторых, рассмотрение водородной связи позволит сравнить эту связь с другими типами и тем самым обобщить наши представления о природе химической связи вообще. В-третьих, это самая значимая па нашей планете химическая связь, ибо она определяет структуру тех соединений, которые являются носителями жизни на Земле, отвечают за хранение и воспроизведение наследственной информации живых организмов. Все изученные ранее типы химической связи имеют названия, в основу которых положены обобщенные химические понятия: ионы, атомы, металлы. А «водородная связь» — специфический термин, ассоциирующийся с конкретным химическим элементом — водородом. Очевидно, это связано со спецификой строения атома водорода, имеющего один валентный электрон. Участвуя в образовании химической связи, этот электрон обнажает крошечное ядро атома водорода, представляющее собой ни что иное как протон. Химическую связь между атомами водорода одной молекулы и атомами электроотрицательных элементов (фтором, кислородом, азотом) другой молекулы называют водородной. Межмолекулярная водородная связь объясняет тот факт, что вещества с небольшими относительными молекулярными массами при обычных условиях представляют собой жидкости (вода, спирты — метиловый, этиловый, карбоновые кислоты — муравьиная, уксусная) или легко сжижаемые газы (аммиак, фтороводород). Механизм образования водородной связи имеет двойную природу. С одной стороны, он состоит в электростатическом притяжении между атомом водорода с частичным положительным зарядом и атомом кислорода (фтора или азота) с частичным отрицательным зарядом. С другой стороны, в образование водородной связи вносит свой вклад и донорно-акцепторное взаимодействие между почти свободной орбиталью атома водорода и неподеленной электронной парой атома кислорода (фтора или азота). Например, вода ассоциирована в жидкость за счет водородных связей, возникающих между молекулами-диполями: В жидкой воде образуется множество водородных связей между молекулами. Способность некоторых газов за счет образования водородных связей легко сжижаться и вновь переходить в газообразное состояние с поглощением теплоты позволяет использовать их в качестве хладагентов в промышленных холодильных установках. Наиболее широко применяется в этой роли аммиак: Именно водородными связями объясняются аномально высокие температуры кипения (100 °С) и плавления (0 °С) воды. При этом в отличие от большинства других жидкостей плотность воды при переходе в твердое состояние (лед, снег) не увеличивается, а уменьшается. Это объясняет тот факт, что лед легче воды и не тонет в ней, а потому водоемы не промерзают зимой до дна, тем самым сохраняя жизнь водным обитателям. Водородные связи в немалой степени способствуют образованию кристаллов I! виде бесконечного разнообразия снежинок. Все рассмотренные выше примеры касались такой разновидности водородной связи, которая называется межмолекулярной водородной связью. Однако еще более важна в организации структур жизненно важных молекул внутримолекулярная водородная связь. Эта связь определяет вторичную структуру белковых молекул. Белковая молекула представляет длинную полимерную цепочку, закрученную в спираль. Витки этой спирали удерживаются от раскручивания за счет водородных связей между атомами водорода и кислорода участков первичной структуры белковой молекулы. Будучи очень нежной и уязвимой водородная связь в белках может легко разрушаться — белки денатурируют. Такая денатурация может быть обратимой и необратимой. Обратимая денатурация белковых молекул имеет социальное значение. Так, денатурирующими факторами белков человеческого организма могут служить механические воздействия (работники дорожных служб, шахтеры, горняки и другие специалисты, использующие вибрирующие инструменты), действие высоких температур (рабочие горячих цехов — металлурги (рис. 3.5), стекловары и т.д.), электромагнитное излучение (врачи-рентгенологи, работники АЭС), химическое воздействие (работники химических производств). А потому все перечисленные категории работников для компенсации вредного воздействия условий [руда на организм пользуются предусмотренными законодательством Российской Федерации льготами: имеют сокращенный рабочий лень, большую продолжительность оплачиваемого отпуска, специальное питание, более ранний выход на пенсию, более высокую заработную плату. Рис. 3.5. Сталевар — работник горячего цеха Необратимая денатурация хорошо вам известна по процедуре варки яиц или приготовления мяса, рыбы и других белковых продуктов. О том, как денатурирующие факторы приводят к разрушению природной структуры белковых молекул, можно судить по несложным опытам. Если к раствору белка куриного яйца прилить немного этилового спирта или соли тяжелого металла (медного купороса, нитрата свинца(П)), можно будет заметить выпадение осадка вследствие денатурации белка. Аналогичным действием обладает никотин, очень крепкий чай и кофе. Может быть, эти опыты помогут вам понять, как губительны такие вредные привычки, как курение, употребление спиртного и др. 1. Дайте определение водородной связи. Какую точку зрения — физиков или химиков — вы разделяете по вопросу ее природы? 2. Каков механизм возникновения водородной связи? Какие виды водородной связи вы знаете? 3. Какими особыми свойствами обладают вещества с межмолекулярной водородной связью? 4. Какую роль играет межмолекулярная водородная связь в практической жизни человека и в природе? 5. Какую роль играет внутримолекулярная водородная связь в организации структуры белков? 6. В чем, по-вашему, состоит социальная роль водородных связей? Ответ проиллюстрируйте примерами из практической жизни человека. 7. Приготовьте сообщение о химической природе негативных последствий курения и употребления алкоголя для организма человека.