ВЛИЯНИЕ ИОННОЙ СИЛЫ НА ЗНАЧЕНИЯ КОНСТАНТЫ
реклама

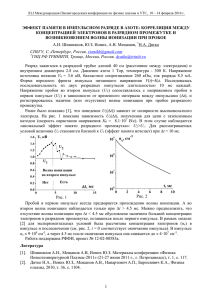
ДОКЛАДЫ АКАДЕМИИ НАУК РЕСПУБЛИКИ ТАДЖИКИСТАН 2008, том 51, №8 ФИЗИЧЕСКАЯ ХИМИЯ УДК 547: 541.1. З.Н.Юсупов, Г.Б.Эшова, С.С.Саидов ВЛИЯНИЕ ИОННОЙ СИЛЫ НА ЗНАЧЕНИЯ КОНСТАНТЫ ИОНИЗАЦИИ АМИНОЭТАНОВОЙ КИСЛОТЫ (Представлено академиком АН Республики Таджикистан Д.Х.Халиковым 08.06.2008 г.) Исследование образования координационных соединений переходных элементов, которые также называются «металлами жизни», с аминокислотами и пептидами является актуальной задачей современной биокоординационной химии [1,2]. Ионы железа участвуют во многих биохимических процессах, поэтому так важны изучение и расчет ионного равновесия в системе «ионы железа – аминокислота» [3,4]. Сведения о константах ионизации аминоэтановой кислоты в литературе имеются, однако для подробного исследования процесса образования комплексов железа в двух степенях окисления необходимо определить значения констант ионизации кислоты при тех же условиях, что при реакциях комплексообразования в исследуемых растворах [1-5]. Экспериментальная часть Настоящая работа выполнена с целью определения константы ионизации аминоэтановой кислоты при 298.16 K, концентрациях 0.001, 0.002, 0.003 М, в интервале ионных сил (J): 0.10 1.00. Постоянство ионной силы достигалось добавлением рассчитанного количества перхлората натрия (NaClO4, моль/л). Константы ионизации были определены методом pHметрического титрования, способ расчета и статистической обработки результатов эксперимента описан в работах [6,7], а расчеты ионного равновесия выполнены с использованием программы Excel. Обсуждение результатов Аминоэтановая кислота (глицин, аминоуксусная кислота, гликокол) относится к классу органических соединений, объединяющих в себе свойства кислот и аминов, то есть содержащих наряду с карбоксильной группой и аминогруппу, поэтому называются аминокислотами. В зависимости от положения аминогруппы в углеводородной цепи относительно карбоксильной группы различают -, -, - и другие аминокислоты. Глицин относится к группе моноаминокарбоновых кислот, его химическая формула NH СH СOOH. Это бесцветное кристаллическое вещество, растворимое в воде, с температурой плавления 262°С. Высокое значение температуры плавления глицина и вообще аминокислот связано с амфотерностью их структуры. Так, формулу глицина более правильно следует представить, как в уравнении (1). Глицин в отличие от других аминокислот не содержит ассиметричного атома углерода [8]. 620 Физическая химия З.Н.Юсупов, Г.Б.Эшова, С.С.Саидов Ионное равновесие глицина в водных растворах в зависимости от pH среды имеет три формы: катионную, цвиттерионную и анионную, то есть имеются равновесия протонирования при кислотном титровании – ионизации при титровании щелочами. Таким образом, катионная форма может доминировать только в кислой области, в слабокислых и нейтральных средах в растворах доминирует цвиттерионная, а ближе к щелочной среде увеличивается молярная доля анионной формы. Согласно этим физико-химическим свойствам аминокислот обычно для них определяют два значения констант: pKa1 и pKa . В связи с этим можно предполагать, что в водных растворах глицина в зависимости от изменения кислотности среды могут быть следующие равновесия: N H 3CH 2COOH Катионная форма K a1 H N H 3CH 3CO O Цвиттерионная форма Ka2 NH 2CH 2COO H . (1) Анионная форма Необходимо отметить, что при вычислении различных констант с участием кислот величины рКai ионизации играют существенную роль. В тех условиях, когда реакции не подчиняются закону действующих масс, в расчетах необходимо внести поправку на активность, что является довольно сложной задачей. Однако константа ионизации, полученная применением стеклянного электрода, является смешанной, поэтому она обозначается как Ka m, причем эта величина постоянна лишь для ионизированных частиц, для которых были измерены величины pH при титровании. Выражение для констант ионизации равновесий катионной и цвитерионной форм глицина можно выразить следующим образом: Ka1 = [ N H 3 CH 2 COOH ]/[ N H 3CH 2CO O ][H+], (2) Ka = [ N H 3CH 2CO O ]/[ NH 2CH 2COO ][H+]. (3) Уравнения (2) и (3) являются основными уравнениями для вычисления констант ионизации кислот. Если учесть, что при бесконечном разбавлении концентрационные константы приближаются к термодинамическим величинам, так как при этом, согласно теории Дебая-Хюккеля, усредненный коэффициент активности иона 1, а a C , тогда становит- ся возможным применять концентрации компонентов раствора. Чтобы сохранить постоянство коэффициентов активностей все измерения проводят при постоянной ионной силе, Ј. Из уравнений (2) и (3) при условии, что кислота является слабой и равновесная концентрация аниона равна общей концентрации кислоты, для расчѐта pKa1 и pKa имеем следующие выражения: pKa1 = pH + lgCкислота/Cсоль, 621 (4) Доклады Академии наук Республики Таджикистан pKa = pH + lgCкислота/Cсоль. 2008, том 51, №8 (5) Экспериментально величина pKa1 была определена титрованием хлорной кислотой, а pKa -тированным раствором NaOH, которые были проведены для трех концентраций глицина. Фактически, согласно уравнениям (4) и (5), мы находим величины смешанных констант, которые в таблицах обозначены как pKam1 и pKam2. Это связано с измерениями значения pH стеклянным электродом, а остальные – концентрационными выражениями. Чтобы получить термодинамические значения констант ионизации кислоты для расчета коэффициентов активностей ионов применяются различные эмпирические и полуэмпирические уравнения, согласно электростатической теории Дебая-Хюккеля для сильных электролитов, которые для процесса ионизации кислот принимают следующие выражения: pKaT = pH + lg[НА]/[А-] + (0.505J1/2)/(1+1.6J1/2), (6) pKaT = pH + lg[НА]/[А-] + (0.505.J1/2)/(1+1.6J1/2) + B`J. (7) Уравнения (6) и (7) получены на основе второго и третьего приближений теории Дебая-Хюккеля, где постоянные 0.505 и 1.6 рассчитаны для одно-одновалентного электролита, а величины констант ионизации зависят от диэлектрической постоянной и температуры среды. Однако физическое представление возникновения ионной атмосферы в растворах электролитов намного сложнее, так как нельзя рассматривать растворитель как некую макроскопическую среду, в которой распределено ионное облако как молекулярная система [5,8]. Очевидно, эти факты являются одной из причин ограниченности применения теории ДебаяХюккеля к менее разбавленным растворам. В случае с глицином этот факт подтверждается результатами титрования 0.001М раствором хлорной кислоты и едкого натрия при 298.16 K. Аналогичные титрования глицина были проведены также для других концентраций при различных ионных силах. При этом были введены следующие обозначения pKam1 и pKam2 - значения константы ионизации глицина, определенные экспериментально, а - pKa1(1), pKa1(2), pKa2(1) и pKa2(2) – рассчитанные теоретически с помощью второго (уравнения 8 и 11) и третьего (уравнения 9 и 12) приближений теории Дебая-Хюккеля. Величины pKa1(3) и pKa2(3) рассчитаны с помощью предложенного нами эмпирического выражения (уравнения 10 и 13). Эти уравнения выражаются следующим образом: pKa1(1) = pKam1 + (0.505J1/2)/(1+1.6J1/2), (8) pKa1(2) = pKam1 + (0.505J1/2)/(1+1.6J1/2) – 0.24J, (9) pKa1(3) = pKam1 + (0.505J1/2)/(1+1.6J1/2) – 0.24J1/2, (10) pKa2(1) = pKam2 + (0.505J1/2)/(1+1.6J1/2), (11) pKa2(2) = pKam2 + (0.505J1/2)/(1+1.6J1/2) – 0.22J, (12) 622 Физическая химия З.Н.Юсупов, Г.Б.Эшова, С.С.Саидов pKa2(3) = pKam2 + (0.505J1/2)/(1+1.6J1/2) – 0.22J1/2. (13) Таблица 1 Значения pKa1 глицина с доверительной вероятностью P = 0.75 при 298.16 K [Gly] 0.001 J 0.10 0.25 0.50 0.75 1.00 0.002 0.10 0.25 0.50 0.75 1.00 0.003 0.10 0.25 0.50 0.75 1.00 pKa1 = pKam1 2.62 0.02 2.76 0.04 2.70 0.03 2.41 0.04 1.92 0.03 2.42 0.02 2.52 0.03 2.49 0.02 2.36 0.04 1.72 0.03 2.43 0.02 2.48 0.04 2.40 0.04 2.56 0.02 2.20 0.04 pKa1(1) 2.73 2.90 2.87 2.60 2.12 pKa1(2) 2.70 2.84 2.75 2.42 1.88 pKa1(3) 2.65 2.78 2.70 2.39 1.88 2.53 2.66 2.66 2.54 1.92 2.50 2.60 2.54 2.36 1.68 2.45 2.54 2.49 2.33 1.68 2.54 2.62 2.56 2.74 2.40 2.51 2.56 2.44 2.56 2.16 2.46 2.50 2.39 2.53 2.16 Таблица 2 Значения pKa2 глицина с доверительной вероятностью P = 0.75 при 298.16 K [Gly] 0.001 J 0.10 0.25 0.50 0.75 1.00 0.002 0.10 0.25 0.50 0.75 1.00 0.003 0.10 0.25 0.50 0.75 1.00 pKa2 = pKam2 9.33 0.07 9.01 0.01 9.07 0.02 9.01 0.04 9.36 0.03 9.51 0.06 9.53 0.03 9.54 0.02 9.44 0.02 9.43 0.1 9.65 0.04 9.60 0.04 9.49 0.02 9.49 0.01 9.60 0.04 pKa2(1) 9.44 9.15 9.23 9.20 9.55 pKa2(2) 9.42 9.10 9.12 9.03 9.33 pKa2(3) 9.37 9.04 9.08 9.01 9.33 9.62 9.67 9.71 9.63 9.63 9.59 9.61 9.60 9.46 9.41 9.55 9.56 9.55 9.44 9.41 9.76 9.74 9.66 9.68 9.80 9.73 9.69 9.55 9.51 9.58 9.69 9.63 9.50 9.48 9.58 Обработка и сравнение результатов эксперимента и расчетов показали, что наиболее близкие значения расчетных величин к экспериментальным значениям pKa1 и pKa2 имеют величины констант ионизации глицина, полученные расчетными уравнениями (10) и (13), отличающимися от уравнения Дебая-Хюккеля (уравнения 11 и 12) тем, что в этих выражениях коэффициенты 0.24 и 0.22 умножаются не на величину ионной силы, а на величину ее корня квадратного. Анализ результатов показал, что такая закономерность практически со623 Доклады Академии наук Республики Таджикистан 2008, том 51, №8 храняется для всех трех концентраций глицина, то есть 0.001, 0.002 и 0.003 М при выбранных ионных силах. pKa 1 2.9 1 2.7 4 2.5 2 2.3 3 6 2.1 1.9 1.7 5 1.5 0.10 0.25 0.50 0.75 1.00 Рис.1. Зависимость рКа1 глицина от ионной силы. Обозначение кривых: экспериментальные – 1-0.001 М; 2-0.002 М; 3-0.003 М, расчѐтные – 4-0.001 М; 5-0.002 М; 6-0.003 М. pKa2 10.0 9.9 9.8 3 9.7 9.6 9.5 9.4 9.3 9.2 9.1 9.0 6 2 1 0.10 5 4 0.25 0.50 J 0.75 1.00 Рис. 2. Зависимость рКа2 глицина от ионной силы. Зависимость pKa2 от J. Обозначение кривых: экспериментальные – 1-0.001М; 2-0.002 М; 3-0.003 М, расчѐтные – 4-0,001 М; 5-0,002 М; 6-0,003 М. Таким образом, полученные результаты показывают, что влияние ионной силы на процессы ионизации имеет сложную зависимость от коэффициента активностей взаимодействующих ионов. На величину константы ионизации оказывают влияние физико-химические свойства кислоты как электролита, а также природа растворителя. Растворители отличаются диэлектрической постоянной, структурой, наличием или отсутствием водородных связей и дипольным моментом. Поэтому не имеется единой закономерности вида графика зависимости величины pKai от ионной силы для всех карбоновых кислот. Таджикский национальный университет Поступило 8.06.2009 г. 624 Физическая химия З.Н.Юсупов, Г.Б.Эшова, С.С.Саидов Л И Т Е РАТ У РА 1. Яцимирский К.Б. Введение в бионеорганическую химию. – Киев: Наукова думка, 1976, 213 с. 2. Никольский Б.П., Пальчевский В.В., Пендин А.А., Якубов Х.М. Оксредметрия – Л.: Химия, 1975, 304 с. 3. Юсупов З.Н., Винниченко Г.М.. – Вопросы физико-химических свойств веществ. – Душанбе: Шамъ,1995, вып. 2, с.75-90. 4. Юсупов З.Н., Винниченко Г.М. – Вопросы физико-химических свойств веществ. – Душанбе: ТГНУ, 1998, вып.3, с.39-46. 5. Измайлов Н.А. Электрохимия растворов. – М.: Химия, 1966, с.93-165. 6. Альберт А., Сержент Е. Константы ионизации кислот и оснований / Пер.с англ. – М.-Л.: Химия, 1964, 177 с. 7. Зайдель А.Н. Элементарные оценки ошибок измерений. Изд-е 3-е, исп. и доп. – Л.: Наука, 1968, 96 с. 8. Кретович В. Л., Основы биохимии растений. 4 изд. – М., 1964. З.Н.Юсупов, Г.Б.Эшова, С.С.Саидов АСАРИ ЌУВВАИ ИОНЇ БА ЌИММАТИ СОБИТИ ТАФЌИЌИ ТЕЗОБИ АМИНОЭТАНАТ Дар асоси натиљањои таљрибавї собити тафќиќи тезоби аминоэтанат таъин гардида, ба василаи муодилањои эмпирикї собитњои термодинамикии он њисоб карда шуд. Муайян гардид, ки бузургии собити тафќиќ ба хосиятњои физикї-кимиёї ва табиати тезоб вобаста аст. Z.N.Yusupov, G.B.Eshova, S.S.Saidov THE INFLUENCE OF IONIC STRENGCE ON THE VALUE OF CONSTANT IONIZATION AMINOETANIC ASID On the results of determination the value of constant ionization the aminoetanic acid was installed that on the value of constant ionization influence the physical-chemical propriety acid and nature of the solvent. 625