На правах рукописи АБАЛЕНИХИНА Юлия Владимировна
реклама

ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО
ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«РЯЗАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
ИМЕНИ АКАДЕМИКА И.П. ПАВЛОВА»
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
На правах рукописи
АБАЛЕНИХИНА Юлия Владимировна
ОКИСЛИТЕЛЬНАЯ МОДИФИКАЦИЯ БЕЛКОВ И ЛИЗОСОМАЛЬНЫЙ
ЦИСТЕИНОВЫЙ ПРОТЕОЛИЗ ИММУНОКОМПЕТЕНТНЫХ ОРГАНОВ КРЫС
В УСЛОВИЯХ МОДУЛИРОВАНИЯ СИНТЕЗА ОКСИДА АЗОТА
03.01.04 – биохимия
Диссертация на соискание ученой степени
кандидата биологических наук
Научный руководитель:
кандидат медицинских наук,
доцент
Фомина Мария Алексеевна
Рязань – 2014
2
ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ…………………………………………………………………………….4
ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ………………………………………………...10
1.1 Оксид азота в биологических системах: синтез, регуляция и функции…...10
1.1.1 Синтез NO и его регуляция……………………...……………………...10
1.1.2 Биологическая роль оксида азота………………………………………15
1.2 Современные представления об окислительной модификации белков…..20
1.2.1 Окислительная модификация белков: механизмы и последствия……20
1.2.2 Эволюция методологических подходов к оценке окислительной
модификации белков…………………………………………………………...28
1.2.3 Взаимосвязь окислительной модификации белка и протеолиза……..34
1.3 Лизосомальный цистеиновый протеолиз: механизмы, регуляция, роль в
иммуногенезе………………………………………………………………………37
1.3.1 Структурно-фукнкциональные
особенности
лизосомальных
цистеиновых протеиназ………………………………………………37
1.3.2 Место лизосомального цистеинового протеолиза в системе
иммунитета…………………………………………….………………43
ГЛАВА 2. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ……..…………….47
2.1 Экспериментальные модели in vivo и схемы введения препаратов………...47
2.2 Экспериментальные модели in vitro…………………………………..………48
2.3 Методы получения биологического материала in vivo………………...…….49
2.4 Методы получения биологического материала для экспериментов
in vitro……………………………………………………………………..…….50
2.5 Биохимические методы исследования………………………………..………51
2.6 Статистическая обработка данных…………………………..………………..59
ГЛАВА 3. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ……....60
3.1
Биохимико-физиологические
характеристики
экспериментальных
моделей………………………………………………………………………………..60
3.2 Оценка состояния окислительной модификации белков…………..….…….63
3
3.2.1 Характеристика окислительного карбонилирования белков под
действием ингибитора синтеза оксида азота…………………………………63
3.2.2 Характеристика окислительного карбонилирования белков под
влиянием субстрата синтеза оксида азота – L-аргинина…………………….77
3.2.3 Состояние окислительной модификации остатков тирозина
и
триптофана в условиях in vivo- и in vitro-модулирования дефицита синтеза
оксида азота…………………………………………………………………….88
3.3 Оценка состояния лизосомального цистеинового протеолиза…………...…91
ЗАКЛЮЧЕНИЕ.…………………...……………………………………………….109
ВЫВОДЫ…...……………………………………………………………………….117
СПИСОК УСЛОВНЫХ СОКРАЩЕНИЙ………………...…………………….118
СПИСОК ЛИТЕРАТУРЫ………………………………………………………...119
4
ВВЕДЕНИЕ
Актуальность темы
Белки в силу особенностей своего строения являются одной из основных
ловушек активных форм кислорода и азота, образующихся под действием
ионизирующей радиации, фотохимических воздействий, а также в процессе
металл-зависимого окисления или ряда окислительно-восстановительных реакций
ферментативной и неферментативной природы [12]. Продуктом токсического
действия свободных радикалов и активных форм кислорода/азота являются
модифицированные белки, которые представляют собой один из мощных
элементов клеточной сигнализации [100] и, одновременно, активно используются
для характеристики окислительного стресса. В силу широкой природной
распространенности белков и стабильности продуктов их окисления, оценка
окислительной
модификации
протеинов
считается
надежным
маркером
оксидативного повреждения [12, 31]. В результате того, что окисленные белки
возможно регистрировать не только в клетках крови и плазме, но и в тканях,
накопился большой фактический материал [6, 7, 11, 15, 17, 26, 53, 188], который
демонстрирует
изменение
уровня
карбонильных
производных
при
ряде
патологических состояний. Однако, в настоящее время отсутствует единый
методологический подход к трактовке результатов, что затрудняет анализ
полученных данных.
В последние годы в качестве одного из агентов оксидативного стресса
рассматривается эндогенно продуцируемый оксид азота [9, 172]. Наблюдающееся
в настоящее время экспоненциальное нарастание исследований в области
биологии оксида азота привело к обнаружению множественности его эффектов [9,
176], демонстрирующих как токсическое [140, 224], так и защитное [170, 189]
действие
этой
«универсальной»
молекулы.
При
этом
систематические
исследования взаимоотношений стимуляции и ингибирования синтеза NO с
формированием карбонильных производных не проводились.
5
Известно, что модифицированные формы протеинов более подвержены
действию протеиназ, чем их нативные аналоги [11, 21, 35]. С другой стороны,
клеточные протеиназы могут стать возможными мишенями для повреждающего
действия свободных радикалов, что свойственно другим ферментам [21, 31, 188].
Важным
объектом
исследований
механизмов
ответа
тканей
на
окислительное повреждение является иммунная система, для которой характерно
наличие способности к гибкому реагированию на внешние воздействия с
одновременным жестким поддержанием собственного гомеостаза [14]. На данный
момент доказано, участие в формировании иммунного ответа лизосомальных
цистеиновых протеиназ [101, 220, 236, 242, 247] и оксида азота [80, 135, 168, 190,
в
211]
качестве
регуляторов.
Однако,
карбонильный
статус
иммуннокомпетентных тканей в условиях изменения продукции оксида азота не
описан.
Таким образом, исследование влияния изменений уровня синтеза оксида
азота на процессы окислительного повреждения и распада белков представляется
актуальным.
Цель и задачи исследования
Целью настоящей работы является изучения влияния конкурентного
ингибитора и субстрата синтеза оксида азота на состояние окислительной
модификации белков и лизосомального цистеинового протеолиза тимуса и
селезенки крыс in vivo и in vitro.
Задачи исследования:
1. Провести комплексную оценку содержания продуктов окислительной
модификации белков в тимусе и селезенке крыс в условиях изменения синтеза
оксида азота (II).
2. Описать изменения активности лизосомальных цистеиновых катепсинов
В, L и Н в изучаемых моделях с оценкой ингибиторного влияния и
аутокаталитического процессинга.
3. Проанализировать зависимость состояния лизосомального цистеинового
протеолиза от степени окислительной модификации белков.
6
Научная новизна
Впервые представлен способ комплексной оценки содержания продуктов
окислительной модификации белков в тканях и биологических жидкостях,
позволивший обнаружить увеличение общего содержания карбонилированных
белков в условиях in
vivo- и in vitro-ингибирования синтеза оксида азота.
Установлено нарастание доли вторичных маркеров окислительного стресса и
истощение резервно-адаптационного потенциала под действием конкурентного
ингибитора синтеза оксида азота. Впервые доказано, что воздействие N-нитро-Lаргининметилового эфира приводит к повышению активности лизосомальных
цистеиновых протеиназ, преимущественно за счет внелизосомальной фракции.
Показано, что субстрат NO-синтазы - L-аргинин при изолированном
применении не оказывает влияния на окислительную модификацию белков и
состояние лизосомального протеолиза. Применение L-аргинина
в условиях
дефицита синтеза оксида азота способствует корригирующему действию на
состояние карбонилового статуса и сохранению эффекта L-NAME для активности
лизосомальных цистеиновых протеиназ.
Впервые
доказано
влияние
изменения
уровня
оксида
азота
на
аутопроцессинг катепсинов В, L и Н: при дефиците синтеза NO – преобладает
доля активных молекул, при моделировании избытка синтеза NO – преобладает
доля проэнзимов. Цистатин С не вносит существенного вклада в регуляцию
активности катепсинов В, L и Н в условиях изменения уровня синтеза оксида
азота.
Впервые была выявлена положительная корреляционная взаимосвязь между
увеличением количества карбонильных производных белков и активностью
катепсинов L и Н селезенки.
Теоретическая значимость
Работа
носит
преимущественно
фундаментальный
характер:
представленные в диссертации экспериментальные данные позволяют понять
роль субстрата (L-аргинин) и ингибитора (L-NAME) синтеза оксида азота в
процессах модификации белковых молекул в совокупности с изменением
7
активности лизосомальных протеиназ, что может быть использовано для
выяснения возможных путей утилизации карбонильных производных белков.
Практическая значимость работы
Запатентованный «Способ комплексной оценки содержания продуктов
окислительной модификации белков в тканях и биологических жидкостях»
(Фомина М.А., Абаленихина Ю.В., Фомина Н.В., Терентьев А.А., приоритет от
21.01.2013) может быть использован в области клинической и фундаментальной
биохимии с целью определения степени выраженности и стадии окислительного
стресса, источников, образовавшихся карбонилов и направленности возможных
патологических последствий при накоплении окисленных белков.
Достоверность полученных результатов
Достоверность
результатов
работы
подтверждается
корректным
использованием теоретических и экспериментальных методов обоснования
полученных результатов и выводов.
Достоверность экспериментальных данных обеспечивается использованием
современных средств и методик проведения исследований. Положения теории
основываются на известных достижениях фундаментальных и прикладных
научных дисциплин, сопряженных с предметом исследования диссертации.
Положения, выносимые на защиту
Внутрибрюшинное введение L-NAME в дозе 25 мг/кг и 200 мг/кг
способствует
окислительному
карбонилированию
белков
иммунокомпетентных органов крыс in vivo и in vitro. Пероральное введение
L-аргинина в дозе 500 мг/кг способствует снижению уровня карбонильных
производных.
Моделирование дефицита синтеза оксида азота способствует повышению
активности лизосомальных цистеиновых протеиназ, в том числе за счет
увеличения доли зрелых форм.
8
Моделирование дополнительного синтеза оксида азота не влияет на
активность лизосомальных цистеиновых протеиназ, однако влияет на
аутопроцессинг катепсинов.
Применение L-аргинина в условиях дефицита синтеза оксида азота
корригирует состояние карбонилового статуса, при этом для изменений
активности лизосомальных цистеиновых протеиназ сохраняется эффект LNAME.
Между процессом окислительной модификации белков и активностью
лизосомальных цистеиновых протеиназ L и Н выявлена положительная
корреляционная связь в условиях моделирования дефицита синтеза оксида
азота.
Апробация работы
Результаты исследования доложены на: научно-практической конференции
молодых ученых «Аспирантские чтения 2013» (Рязань, 2013); ХII региональной
научно-практической конференции с международным участием «Обмен веществ
при адаптации и повреждении» (Ростов-на-Дону, 2013); ХIХ межгородской
конференции молодых ученых «Актуальные проблемы патофизиологии» (СанктПетербург, 2013); международном симпозиуме, посвященном 150-летию кафедры
биохимии Казанского университета «Биохимия – основа наук о жизни» (Казань,
2013); международной научно-практической конференции «Актуальные вопросы
развития науки» (УФА, 2014); Х юбилейной международной конференции
«Окислительный стресс и свободнорадикальные патологии» (Пицунда, Абхазия,
2014); межрегиональной научной конференции университета с международным
участием (Рязань, 2014); второй региональной конференции молодых ученых
«Пути инновационного развития экономики Рязанской области» (Рязань, 2014).
Публикации
По теме диссертации опубликовано 16 печатных работ, из них 4 – в
журналах, рекомендованных ВАК РФ, 1 патент на изобретение, и 1методические
рекомендации.
9
Личный вклад соискателя
Все
изложенные
в
диссертации
результаты
получены
автором
самостоятельно или при его непосредственном участии. Постановка задач,
интерпретация полученных результатов осуществлялись совместно с научным
руководителем и другими соавторами публикаций.
Объём и структура диссертации
Диссертационная
работа
состоит
из
введения,
обзора
литературы,
материалов и методов исследования, результатов исследования, заключения и
выводов. Список литературы содержит 247 источников, из них 59 российских и
188 зарубежных. Объем работы составляет 142 страницы машинописного текста,
содержит 75 рисунков и 19 таблиц.
10
Глава 1. ОБЗОР ЛИТЕРАТУРЫ
1.1 Оксид азота в биологических системах: синтез, регуляция и
функции
1.1.1 Синтез NO и его регуляция
Оксид азота является важнейшим внутри- и межклеточным вторичным
мессенджером, синтез которого в организме человека и животных происходит
путем ферментативной трансформации гуанидинового фрагмента полузаменимой
аминокислоты L-аргинина при участии ферментов семейства цитохром-Р-450подобных гемпротеинов – NO-синтаз (NOS) [9]. В настоящее время описано три
изоформы NOS [9, 44, 125], общим для которых является наличие оксигеназного
домена на N-терминальном участке и редуктазного домена на С-терминальном
участке.
Оксигеназный
тетрагидробиоптерин,
домен
а
в
качестве
редуктазный
кофактора
домен
содержит
-
5,6,7,8-
никотинамид-
адениндинуклеотидфосфат, флавин-адениндинуклеотид, флавинмононуклеотид
[175]. Между доменами расположены аминокислотные остатки, служащие для
связывания белка кальмодулина [9, 44, 122, 218]. Все изоформы NOS
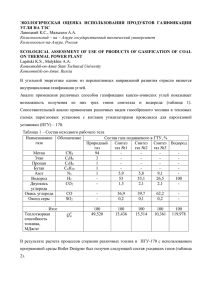
катализируют превращение L-аргинина в эквивалентное количество NO и Lцитрулина (рис. 1).
НАДФН2
НАДФ+
НАДФН2
НАДФ+
Рис.1.Ферментативный синтез оксида азота из L-аргинина (цит. по: Граник
В.Г., Григорьев Н.Б.,2004)
11
Несмотря на общие черты в структуре NO-синтаз, каждая из них имеет свои
особенности локализации и механизмов активации. По содержанию в тканях
выделяют две основные формы NO-синтаз – конститутивная NOS (кNOS),
присутствующая в клетках в постоянном количестве, не зависящем от
метаболических процессов, и индуцибельная NOS (iNOS), которая обычно
присутствует в клетках в следовых количествах, однако при добавлении субстрата
концентрация iNOS возрастает. Конститутивные NOS в зависимости от первично
выявленной локализации разделяют на эндотелиальную (еNOS) и нейрональную
(nNOS) изоформы. nNOS и eNOS катализируют образование оксида азота в
нейронах центральной, периферической нервной системы и эндотелии сосудов
соответственно [125].
Активность конститутивных NO-синтаз регулируется ионами Ca2+ через
образование комплекса с белком кальмодулином (положительная регуляция).
Индуцибельная NO-синтаза (iNOS) является кальций/кальмодулин-независимой,
её
активность
индуцируется
глюкокортикоидами
в
липополисахаридами,
макрофагах,
гепатоцитах,
цитокинами
и
эндотелиоцитах
и
кардиомиоцитах [9, 43, 44]. Основная функция iNOS – иммунная защита
организма, то есть синтез оксида азота как противовоспалительного агента [9, 46,
99, 229]. В современной литературе имеются сведения о том, что синтез оксида
азота в тимусе и селезенке происходит под действием нейрональной и
индуцибельной NO-синтаз в ответ на инфекцию или неоплазию [51, 219].
Следует отметить, что метаболизм субстрата NOS L-аргинина может также
осуществляться посредством аргиназы I (печеночная форма) и аргиназы II
(внепеченочная форма) [43, 74]. Аргиназы играют важную роль в синтезе
орнитина, являющегося предшественником пролина и полиаминов, которые
необходимы для клеточной пролиферации и заживления ран. То есть, метаболизм
L-аргинина может осуществляться по двум путям, при этом аргиназа и NOсинтаза конкурируют за общий субстрат L-аргинин [162,117].
Таким
образом,
метаболизм
L-аргинина
определяется
экспрессией
индуцибельной NO-синтазы, синтез которой стимулируется цитокинами Th1
12
(интерлейкин-1 (IL-1), фактор некроза опухоли (TNFα), и γ-интерферон), и
аргиназами, индукция синтеза которых обеспечивается цитокинами Th2 (IL -4, IL
-10, IL -13, а также трансформирующим фактором роста β) [43,162].
Th2Цитокины
(IL-4,IL-10,
IL-13)
Th1-Цитокины
(IL-1,TFNα)
Рис. 2. Регуляция синтеза оксида азота в клетке (цит. по: Markus Munder,
2009)
Помимо описанного выше NOS-катализируемого синтеза NO, генерация
оксида азота может происходить неферментативно в результате взаимодействия
аргинина и перекиси водорода [43, 69]. Кроме того, обнаружено, что нитританионы – продукты превращения оксида азота – способны неферментативно
трансформироваться в NO [37, 44]. На этом факте основана концепция цикла
оксида азота В.П. Реутова [40]. В основе концепции лежат представления о
циклическом превращении продуктов метаболизма оксида азота в исходное
вещество NO (рис. 3).
Цикл оксида азота включает два этапа:
1 этап: NO-синтазные реакции. В ходе реакции 1 происходит превращение
L-аргинина в L-цитруллин и оксид азота, который затем (реакция 2) окисляется до
нитритов и нитратов.
13
2 этап: нитритредуктазная реакция. В ходе реакции 3 наблюдается
восстановление нитритов и нитратов до оксида азота (II) с участием
электронодонорных систем [9].
Рис. 3. Цикл оксида азота (модификация Граник В.Г., Григорьев Н.Б. 2004;
Реутов В.П. и др. 2005)
Авторы считают, что существование цикла оксида азота необходимо для
предотвращения токсического действия избыточного количества метаболитов
NO.
В настоящее время, в связи с выявлением негативных последствий
образования избыточных количеств NO, особый интерес исследователей
привлечен к вопросу о механизмах регуляции синтеза оксида азота [125, 139].
Оказалось, что данный процесс подвержен сложной многоуровневой регуляции.
Оксид азота образуется при участии целого семейства NO-синтаз, ингибирование
которых основано на взаимодействии соединения – антагониста – с активным
центром фермента и его близлежащей частью [9, 122]. В настоящее время описано
несколько путей ингибирования:
1. Подавление
экспрессии
гена
транскрипции NFkB [9, 118].
NOS
путем
инактивации
фактора
Генерация эндогенного оксида азота
регулируется по механизму отрицательной обратной связи: по мере
накопления оксида азота подавляется экспрессия мРНК iNOS, что
14
препятствует дальнейшему образованию NO [9, 143]. Принцип обратной
связи объясняет механизм поддержания постоянного уровня оксида азота и
его метаболитов в организме млекопитающих.
2. Нарушение функционирования небелковой части NO-синтазы, то есть
инактивация NOS может происходить за счет связывания оксида азота с
гем-содержащей группой фермента [110].
3. Действие
конкурентных
ингибиторов,
препятствующих
связыванию
субстрата (L-аргинина) с ферментом [9].
В настоящее время наиболее изучены ингибиторы NOS, являющиеся
производными субстрата синтеза оксида азота – L-аргинина. Механизм
ингибирования основан на конкурентных взаимоотношениях субстрата и
ингибитора за активный центр фермента. Важным шагом в патофизиологии NO
было открытие эндогенного природного конкурентного ингибитора NOS –
асимметричного диметиларгинина (ADMA) присутствие которого приводит к
нарушению метаболизма и мембранного транспорта L-аргинина, следствием чего
является снижение биосинтеза NO [9, 70, 72, 124]. Метиларгинины образуются в
результате посттрансляционной модификации аргинин-содержащих белков и
высвобождаются в результате протеолиза [81].
С
момента
своего
открытия,
асимметричный
диметиларгинин
рассматривают не только в качестве ингибитора синтеза оксида азота, но и
основного участника патогенеза различных заболеваний. Так, повышенная
концентрация ADMA приводит к дисфункции эндотелия и дисбалансу между
вазоконстрикцией
и
вазодилатацией
[155].
Накопление
асимметричного
диметиларгинина в дыхательных путях приводит к изменениям в метаболизме Lаргинина, что способствует обструкции дыхательных путей при астме и
муковисцидозе [71]. Кроме этого, у пациентов с хронической болезнью почек
зарегистрирован повышенный уровень ADMA [213].
ADMA-имитирующим экзогенным ингибитором является Nω-нитро-Lаргинин-метиловый
эфир
(L-NAME).
L-NAME
является
неселективным
ингибитором индуцибельной NO-синтазы в тканях, имеющих специфические
15
эстеразы. L-NAME нуждается в предварительной биоактивации посредством
гидролиза данного эфира до L-NNA под действием эстераз. При этом
продолжительность развития эффекта L-NAME пропорциональна времени его
превращения в нитроаргинин [9].
Обнаружение
патологических
состояний
при
действии
эндогенных
ингибиторов синтеза оксида азота привлекает особое внимание к проблеме
дефицита синтеза оксида азота и требует дальнейшего исследования.
1.1.2 Биологическая роль оксида азота
С момента открытия оксида азота накоплено значительное количество
сведений о его биологической роли. Большинство исследований 1990-х годов
были направлены на изучение механизмов действия NO на активность гладких
мышц сосудов посредством активации гуанилатциклазы [9]. Было установлено,
что важнейшей физиологической мишенью для оксида азота в организме является
растворимая гуанилатциклаза (рГЦ) [39], которая при активации увеличивает
внутриклеточную
концентрацию
циклического
гуанозинмонофосфата,
в
результате этого активируется протеинкиназа G. Действуя по этому пути, оксид
азота вызывает расслабление гладкой мускулатуры сосудов и ингибирует
агрегацию тромбоцитов [177].
Кроме этого, оксид азота широко представлен как в центральной, так и в
периферической нервной системе. Полагают, что NO действует опосредованно на
динамическую
активность
нейронов,
модулируя
высвобождение
нейротрансмиттеров (ацетилхолин, катехоламины, серотонин, гистамин) [194].
Эндогенный оксид азота участвует во многих жизненно важных процессах,
являясь универсальным и необходимым регулятором функций клеточного
метаболизма. Оксид азота ингибирует агрегацию тромбоцитов и их адгезию на
стенках кровеносных сосудов [233], участвует в регуляции тонуса кровеносных
сосудов [136], деятельности органов дыхания [173], желудочно-кишечного тракта
[150, 228] и мочеполовой системы посредством центральной и вегетативной
нервной системы [166, 195]. Кроме этого NO играет важную роль в
нейротрансмиссии [142] и в формировании иммунного ответа [211].
16
Известно, что NO отличается высокой реакционной способностью,
благодаря наличию неспаренного электрона на внешней π-орбитали [130].
Основным продуктом окисления оксида азота являются химически инертные
нитратные ионы, способные вновь превращаться в NO [37]. При взаимодействии
с
NO
супероксид-анион
пероксонитрит:
радикалом
(
)
образуется
.
Пероксонитрит
представляет
собой
короткоживущую
молекулу,
обладающую повреждающим эффектом. Это объясняется способностью ONOO ̄
инактивировать
и
Mn-супероксиддисмутазу
воздействовать
на
митохондриальную дыхательную цепь, способствуя увеличению уровня О 2˙̄ , что
приводит к повреждению не только митохондриальной мембраны, но и ДНК,
липидов и белков [44, 224]. Помимо этого, накопление пероксонитрита
способствует развитию апоптоза по пути активации проапоптозных белков Bax
[171]. Таким образом, пероксонитрит – сильнейший окислитель [205], однако
было установлено, что ONOO ̄ реагирует с глутатионом с образованием Sнитрозотиола,
способного
стать
источником
оксида
азота
[9,
205].
Предполагается, что этот механизм может представлять путь детоксикации
пероксонитрита. Биологическими мишенями NO˙ при участии кислорода
являются тиолы и остатки тирозина, реакция нитрозилирования происходит через
производное оксида азота – пероксонитрит, который также способен повреждать
мембрану митохондрий [44].
С
другой
стороны,
в
литературе
отмечается
способность
взаимодействовать с металлами переменной валентности, замедляя
NO
Fe2+-
индуцируемое перекисное окисления липидов. Доказанным фактом является и то,
что в клетках и тканях, продуцирующих оксид азота из L-аргинина, образуются
динитрозильные комплексы негемового железа (ДНКЖ) [58]. При этом белковые
ДНКЖ являются стабильными депо оксида азота, низкомолекулярные ДНКЖ –
переносчиками NO через клеточные мембраны, однако этот вопрос требует
дополнительного исследования [9].
17
Для оксида азота характерен ряд защитных эффектов: увеличение
активности антиоксидантных ферментов [230] и экспрессии кодирующих их
генов. Важно отметить, что оксид азота ингибирует перекисное окисление
липидов, взаимодействуя с радикалом липидной перекиси
.
Окислительно-восстановительные реакции, использующие NO и O 2– в
качестве исходных видов молекул, делятся на два класса. Первый класс включает
в себя NO и активные формы азота (АФА), полученные при взаимодействии NO и
активных форм кислорода (АФК). Второй класс содержит АФК в качестве
исходного вида молекул. NO / АФА и АФК могут использоваться отдельно или в
комплексе в иммунных реакциях, а также участвовать в "уничтожении" бактерий
и иммунной регуляции. Как уже было сказано, NO вырабатывается в качестве
первичного продукта ферментативного действия индуцибельной NO-синтазы и
является относительно нереактивным, так как вступает в прямую реакцию только
с переходным металлом в геме или кобаламином, с негемовым железом или
реактивными радикалами, например, радикалом гидропероксида, образованным
при липидной пероксидации [168]. Последняя реакция является примером
мощного антиоксидантного свойства NO.
В настоящее время известно, что NO выступает в качестве мощного
антиоксиданта в клетках млекопитающих, предотвращая повреждение АФК,
которое может быть вызвано реакциями с металлами, супероксидом и липидными
радикалами. С другой стороны, NO не вступает в прямую реакцию с тиолами, так
как необходима активация с супероксидом или O 2– для выработки активных форм
азота, например, ONOO–, NO2, и N2O3. ONOO- и NO2 могут окислять субстрат, а
N2O3 является основным источником нитрозилирования субстрата. Таким
образом, эти АФА создают условия, приводящие к нитрозативному или
окислительному стрессу. Так как NO и NO2 – липофильны, они могут
мигрировать через клетки, увеличивая количество потенциальных мишеней [168].
Баланс между NO и супероксидом определяет не только биодоступность NO, но и
образование АФА в непосредственной близости от источника супероксида.
18
Другим важным результатом взаимодействия АФК и NO является то, что
активность пероксидазы приводит к потреблению NO и образованию NO 2 и N2O3,
а также нитритов/нитратов.
Известно, что биологическая окислительно-восстановительная система,
связанная с иммунитетом, представлена O 2–, H2O2 и другими активными формами
кислорода (АФК) [168]. Первичный клеточный источник АФК – оксидазы,
которые изменяют O2–, путем переноса отдельного электрона с НАДФН•H
(восстановленная форма) на кислород [237]. Дальнейшее восстановление
кислорода до активной формы катализируется рядом ферментов посредством
взаимодействия с переходными металлами или реакции с NO.
Открытие молекулярных механизмов действия NO позволило обнаружить
участие оксида азота в формировании иммунных реакций [211]. Оксид азота
прямо и косвенно модулирует иммунную реакцию в макрофагах и фагоцитах.
Первые предположения о роли оксида азота в формированиии иммунного ответа
возникли после обнаружения феномена синтеза NO макрофагами [174]. В
дальнейшем были получены подтверждения вовлеченности оксида азота в
механизмы неспецифического иммунитета [80, 135, 168, 190, 211] и частично в
комплексный
механизм
тканевого
повреждения
через
модуляцию
воспалительного процесса [46, 99] и апоптоза [169]. Оксиды азота (NOX) в
качестве участников врожденного иммунного ответа были найдены в фагоцитах
[149, 226]. Активация выработки NOX запускается при взаимодействии
иммуногенов со специфическими рецепторами мембраны, такими как комплемент
или рецепторы [168, 217]. Образование NOX также стимулируется при лечении
веществами, которые активируют поступление кальция [237]. Хотя процесс
активации хорошо исследован, о процессах, помогающих контролировать или
ограничивать активность
НАДФН•H-оксидазы
и выработку супероксидов
недостаточно известно [237]. Потенциальные механизмы дезактивации варьируют
от дефосфорилирования сложных компонентов фосфатазами до мембранной
деполяризации или отсутствия механизма упорядочивания зарядов [168]. Многие
из этих процессов модулируются NO, который может оказаться ключевым в
19
управлении уровня АФК и в ограничении реактивности О2 и Н2О2 по отношению
к
специфическим
клеточным
участкам
[168].
Ограниченные
поставки
супероксида в конкретных условиях и локализациях помогают минимизировать
сопутствующий ущерб, который могут нанести АФК.
Важно отметить, что оксид азота в высоких концентрациях способен
проявлять токсическое действие, что приводит к формированию аутоиммунного
ответа.
Противоположные эффекты действия NO во многом зависят от
источников синтеза оксида азота, природы иммунных клеток, концентрации NO и
биологической окислительно-восстановительой среды. Стоит отметить, что
результат действия оксида азота в эффективных концентрациях зависит от
расстояния между клетками-мишенями и источником синтеза NO [135].
В настоящее время нет однозначного мнения по поводу участия NO в
формировании иммунного ответа. Защитные и токсические эффекты оксида азота
часто
проявляются
параллельно
и
сигнальная
способность
NO
делает
непредсказуемым эффект ингибиторов и доноров синтеза оксида азота.
Генерация оксида азота является особенностью клеток иммунной системы.
Данный процесс происходит под действием нейрональной и индуцибельной NOсинтаз в тимусе [51] и селезенке [156]. Вырабатывая высокие уровни NO,
индуцибельная
NO-синтаза
может
создавать
разные
NO-модулированные
микросреды в тканях, каждая из которых будет иметь разные функции.
Индуцибельная NO-синтаза обладает уникальной гибкостью эффектов, что имеет
немаловажное значение в формировании иммунитета. Стоит отметить, что малое
количество
оксида
азота,
вырабатываемое
эндотелиальной
NO-синтазой,
ограничивает его действие. Чтобы быть эффективной, эндотелиальная NO-синтаза
или нейрональная NO-синтаза должна быть направлена и закреплена в
непосредственной близости от своей цели.
Таким образом, в настоящее время накоплено достаточно фактов,
свидетельствующих о защитной роли оксида азота в организме. Изучение роли
NO позволяет говорить о широком спектре его действия не только в регуляции
физиологических состояний, но и патологических.
20
1.2 Современные представления об окислительной модификации белков
1.2.1 Окислительная модификация белков: механизмы и последствия
Белки являются главными мишенями для активных форм кислорода (АФК)
и азота (АФА) из-за своей высокой чувствительности к свободным радикалам
[100] и распространенности в биологических материалах, кроме того они
ответственны за большинство функциональных процессов клетки, вследствие
чего изучение их окислительной модификации вызывает значительный интерес
[78, 131]. Окисление белков представляет собой процесс их ковалентной
модификации, вызванный непосредственным воздействием АФК и/или АФА, а
также косвенным взаимодействием с вторичными побочными продуктами
окислительного стресса [197]. В качестве индукторов образования окислительномодифицированных белков (ОМБ) могут выступать активные формы кислорода
(ОН˙, О2˙ ̄, Н2О2, О2), активные формы азота (NO˙, ONOO ̄), металлы переменной
валентности (Сu2+, Fe2+), продукты перекисного окисления липидов (малоновый
диальдегид, 4-гидрокси-2-ноненаль) [75, 199]. Малоновый диальдегид (МДА) и 4гидрокси-2-ноненаль (ГНЕ) являются наиболее распространёнными продуктами
взаимодействия липидов с активными формами кислорода. МДА имеет в своей
структуре две альдегидные группы, что обуславливает его взаимодействие с
аминогруппами белков. ГНЕ может взаимодействовать с гистидином, лизином и
цистеином, образуя циклические продукты, способные далее превращаться в
карбонильные группы [12, 21].
Формирование ОМБ происходит не только при нарастании концентрации
индуцирующих агентов, но и при смещении баланса антиоксидантов и
прооксидантов в пользу вторых в условиях истощения антиоксидантной системы
[7, 207].
Следует отметить, что при взаимодействии активных форм кислорода и
азота с простыми белками происходит модификация полипептидной цепи, а при
атаке сложных белков выделяют модификацию полипептидного компонента и
небелковой части [12, 21]. Модификация простетической группы, представленной
21
негемовым железом, заключается в диссоциации ионов железа от белка [21].
Изменение
структуры полипептидной цепи сопровождается
модификациями
пептидной связи и боковых радикалов аминокислот [75, 164]. Окислительная атака
полипептидной цепи приводит к образованию углеродного радикального центра
за счет реакции с ОН· α-водородного атома аминокислотного остатка, что в
конечном итоге может повлечь за собой разрыв пептидных связей [12, 21].
В настоящее время наиболее изученным вариантом окислительной
модификации белков является формирование карбонильных производных в
результате окисления боковых аминокислотных остатков полипептидной цепи
[197]. При этом окисление остатков лизина, аргинина, гистидина, пролина
приводит к формированию альдегидных или кетонных производных, а окисление
остатков
глутаминовой
и
аспарагиновой
кислот
приводит
к
разрыву
полипептидной цепи с образованием пирувильной группы из N-концевой
аминокислоты [12, 100, 197].
Формирование СО-группы является характерным признаком карбонильных
производных окисленных белков. Карбонильные группы (альдегид- и кетогруппы)
формируются
на
боковых
цепях
белков
при
повреждении
аминокислотных остатков [100, 200]. По данным литературы, альдегидные
производные принято считать ранними маркерами окислительной деструкции
белка, а кетонные производные – поздними маркерами [52], характеризующими
степень окислительной деструкции белковой молекулы. Накопление в клетке
активных карбонильных соединений приводит к развитию карбонилового стресса
[31, 58].
Следует отметить, что формирование карбонильных групп происходит не
только при атаке белковых молекул активными формами кислорода и азота, но и
в присутствии металлов переменной валентности (медь, железо), кислорода и
перекиси водорода. Данный процесс получил название металл-катализируемое
окисление белков [12, 100, 221]. Металл-катализируемое окисление – это сайтспецифический
процесс,
реализующийся
в
области
металл-связывающей
поверхности белка, где и происходит модификация аминокислотных остатков
22
[12]. Таким образом, окисление белков по металл-зависимому механизму
возможно в случае простых белков - при наличии металл-связывающей
поверхности
[12],
а
в
случае
сложных белков,
имеющих
в
качестве
простетической группы металл переменной валентности, - при условии
доступности данного участка для пероксида водорода. Генерация ОН· за счет
металл-катализируемой реакции происходит на ограниченном участке, вызывая
окислительную модификацию близлежащих аминокислотных остатков [30].
Одним из возможных механизмов металл-катализируемого окисления
является взаимодействие остатка лизина с ионом Fe2+, при котором образуется
Fe2+-белковый координационный комплекс. Ион металла, ассоциированный с
металл-связывающей поверхностью белка, реагирует с пероксидом водорода, что
приводит к генерации реакционноспособных соединений, способных разрушать
металл-связывающую поверхность белка и диссоциировать
Fe2+-белковый
комплекс [12, 221]. Результатом этих превращений является окисление
аминокислотных остатков и образование карбонильного производного, в данном
случае альдегидного (рис. 4).
Рис. 4. Возможный механизм сайт специфического металл-катализируемого
окисления белков (цит. по: Stadtman, E.R. 1990)
23
Среди аминокислотных остатков наиболее чувствительными к металлкатализируемому окислению являются гистидиновые, аргининовые, лизиновые,
метиониновые
аминокислот
и цистеиновые
[100].
Из
остатки,
всего
а
также
вышеизложенного
остатки
ароматических
следует,
что
металл-
катализируемое окисление белков представляет собой локальный процесс, в
результате которого образуются карбонильные производные.
Помимо
этого,
формирование
модифицированных
белков
может
происходить как за счет окисления нескольких аминокислотных остатков, так и
определенной аминокислоты бокового радикала. Наиболее изученным является
модификация цистеина. Атом серы тиольной группы (-SH) имеет несколько
состояний окисления, поэтому модификация боковой цепи, содержащей цистеин,
происходит до различных продуктов [84].
Для индукции модификации цистеина необходимо окисление SH-группы до
тиолят-аниона, который представляет собой реактивную форму. Окисление
цистеина начинается с образования сульфеновой кислоты (RS-OH), из которой
формируются следующие продукты окисления:
- дисульфиды (S-S-сшивки);
- глутатионтиолы (белок-SSG);
- сульфиновая кислота (R-SO2H);
- сульфоновая кислота (R-SO3H) [84, 209].
Высокой
чувствительностью
к
воздействию
ОН˙
и
совместному
воздействию ОН˙ и О2˙ ̄ (О2) обладает также индольное кольцо триптофана:
гидроксилирование по 2,4,5,6,7 положению приводит к последующему разрыву
пятичленной структуры (рис. 5). Конечные продукты окисления триптофановых
остатков – 3-гидроксикинуренин, кинуренин, 5-гидроксикинуренин, N-формил-Lкинуренин, 3-гидрокси-N-формил-L-кинуренин [12].
Структурные
модификации
изменения,
тирозина
и
являющиеся
триптофана,
флуоресцирующей способности.
результатом
проявляются
в
окислительной
изменении
их
24
Рис. 5. Образование продуктов окисления ароматических аминокислотных
остатков (цит. по: Stadtman E.R. 1995)
Конечным продуктом окисления тирозина является битирозин, образование
которого возможно по двум механизмам: через электрофильную реакцию или за
счет одноэлектронного окисления аминокислоты [12]. Окисление L-тирозина
сопровождается образованием тирозил-радикала, который взаимодействуя с
таким же радикалом, синтезирует битирозиновые сшивки (рис. 6), образование
которых за счет взаимодействия полипептидных цепей приводит к агрегации
белков [9].
Продукты окисления триптофана (N-формилкинуренин) характеризуется
снижением флуоресцирующей способности относительно исходного вещества
[100], а окисление тирозина приводит к образованию битирозина, что
сопровождается повышением флуоресцирующей активности [66, 100, 127].
Особым
вариантом
окислительной
модификации
белков
является
нитрозилирование, индуцируемое оксидом азота [153]. Кроме того, известно, что
остатки тирозина чувствительны к окислению активными формами азота с
25
образованием конечного продукта 3-нитротирозина [84]. Нитрозилирование
тирозина представляет собой селективный процесс, поскольку возможно не у всех
белков и зависит от пространственной доступности аминокислотного остатка [4].
Формирование нитротирозина и нитротиолов часто происходит на фоне
повышенного содержания оксида азота [84].
Рис. 6. Два возможных пути окисления тирозиновых остатков белков (цит.
по: McCormick M.L. et al., 1998)
Окислительная
модификация
белков
сопровождается
изменением
структуры аминокислотных остатков и функций белков в целом. В процессе
окислительной модификации белки способны менять молекулярную массу, что
сопровождается процессами агрегации или фрагментации белковых молекул.
Преобладание тех или иных процессов зависит от наличия определенных
свободных радикалов: ОН˙ способствует агрегации белков, а совместное действие
ОН˙ и О2˙ ̄ (О2) – формированию фрагментов нерадикальной природы [12].
Окислительное повреждение белков может быть как обратимым процессом,
так и необратимым. Необратимое окисление белков приводит к утрате их
биологических свойств, а в дальнейшем агрегации или деградации. К этому типу
26
окисления относится образование карбонильных производных белков [246],
нитротирозина и битирозина [206]. Обратимое окисление белков имеет большое
значение для клеточной сигнализации, например, при ишемическом повреждении
[84, 186]. Этот тип окисления характерен для модификации остатков цистеина с
конечными
продуктами
дисульфиды,
глутатион-тиолы,
нитрозотиолы
и
сульфеновой и сульфоновой кислот [84].
Агрегация
взаимодействий
белковых
или
аминокислотный
молекул
образования
радикал
взаимодействовать своими
радикалами
другой
происходит
ковалентных
одной
за
счет
связей,
полипептидной
цепи,
то
есть
цепи
гидрофобными остатками с
полипептидной
белок-белковых
образуя
любой
способен
аминокислотными
сшивки
(белковые
конгломераты). Однако, образование битирозиновых сшивок между отдельными
молекулами белков считается одной из основных причин агрегации белка [12,
121]. Кроме этого, взаимодействие серосодержащих аминокислотных остатков
приводит к формированию S-S-сшивок (дисульфидные мостики), а также
агрегация наблюдается при коньюгации белков с продуктами окисления [12, 164].
Образование белок-белковых сшивок сопровождается изменением физикохимических свойств белков: снижением растворимости белка, его денатурацией,
увеличением гидрофобности, изменением значения изоэлектрической точки.
Накопление белковых агрегатов обнаруживается при старении [75] и ряде
заболеваний [79], а также в условиях пониженной активности протеаз [17].
Образующиеся белок-белковые сшивки устойчивы к протеолизу, а
белковые фрагменты, накапливаясь в клетке, обладают токсическим действием
[17].
Накопление
белковых
агрегатов
и
фрагментов
может
нарушать
метаболические процессы клетки, срывая витальные биохимические механизмы,
что приведет в конечном итоге к апоптозу или некрозу клетки [21, 100, 201].
Окислительная модификация белков сопровождается изменениями вторичной и
третичной
структуры,
что
может
воздействовать
непосредственно
на
функциональную деятельность белка [75, 113]. Однако, не каждая окислительная
модификация аминокислотных остатков является пагубной для функционирования
27
белка, что связано с включением новых производных в дальнейшие метаболические
пути [105]. Окислительные процессы регулярно происходят в клетке, так как живой
организм существует в аэробных условиях [100]. По этой причине, окисление
протеинов является неотъемлемой составляющей обмена белков в организме.
«Судьба» окисленных белков может развиваться по трем направлениям (рис. 7):
1.
Более глубокое повреждение частично окисленного белка, что может
способствовать его агрегации и, как следствие, накоплению модифицированных
протеинов в клетке [12]. Как правило, белковые агрегаты высокоустойчивы к
протеолизу и имеют токсические свойства, что может приводить к апоптозу или
некрозу клетки [31].
2.
Репарация с образованием исходной формы белка. Данный путь
характерен для окисленных форм цистеина и метионина [164].
3.
Разрушение модифицированных белков протеасомами или другими
протеазами с образованием пептидов, которые могут быть направлены на синтез
новых необходимых клетке протеинов [21, 129].
Рис 7. Пути образования и утилизации модифицированных белков
(модификация Davies, K.J.,2001)
28
1.2.2 Эволюция методологических подходов к оценке окислительной
модификации белков
Положение о том, что белки чрезвычайно чувствительны к действию
свободных радикалов и широко распространены в клетке, дает основание считать
оценку их окислительного повреждения ранним и надежным маркером
окислительного стресса [79]. Измерению подлежат продукты окисления белков,
образующиеся как спонтанно, так и индуцируемо в реакции Фентона [25]. В
настоящее время проводится много исследований по оценке окислительной
модификации белков в плазме, клетках крови и тканях при различных
патологических состояниях: ишемии-реперфузии [112], инфаркте миокарда [32],
атеросклерозе [3, 151], нейродегенеративных болезнях [28, 151, 185], хронических
дерматозах [27], сахарном диабете [7, 13], пневмонии [54], раке легкого [15].
Накопление
фактического
материала
заставляет
задуматься
о
новых
методических подходах и способах интерпретации полученных результатов.
Карбонильные производные белков формируются за счет окисления
нескольких аминокислотных остатков, а также взаимодействия с продуктами
перекисного окисления липидов и редуцирующими сахарами, вследствие чего
количественно больше и легче обнаруживаются, чем любые другие модификации
в результате повреждения свободными радикалами. Карбонильные производные
белков являются необратимыми продуктами окислительного стресса. Кроме того,
биологические образцы обладают высокой химической устойчивостью (3 месяца
при -800С) и клинической доступностью, что позволяет их считать удобным
объектом
для
лабораторных
исследований.
В
качестве
материала
исследования уровня карбонильных производных могут выступать:
- сыворотка крови;
- плазма крови;
- спиномозговая жидкость;
- белковые экстракты из тканей;
- гомогенаты тканей.
для
29
В целом, оценка содержания карбонильных производных белков имеет ряд
преимуществ:
- точно указывает степень окислительного повреждения;
- является ранним индикатором патологического повреждения;
- позволяет
оценить
фармакологический ответ
на
терапевтическое
вмешательство;
- оценивает эффективность антиоксидантных систем [203].
В силу указанных причин, регистрация карбонильных производных
является
наиболее
распространенным
методом
анализа
окислительной
модификации белков.
Существует
несколько
методологических
подходов
к
определению
карбонильных производных:
1. Флуорометрический метод, основанный на измерении флуоресценции
гидразоно-карбонильных группировок после их обработки флуоресцилгидразидом и флуоресцин-тиосемикарбозидом [65, 68]. Недостатком
анализа является нестабильность флуоресцентно меченных белков при
комнатной температуре.
2. Радиометрический метод, основанный на измерении радиоактивности
белков после восстановления карбонильных группировок в спиртовые в
результате обработки третичным боргидридом [109].
Отмечалось также участие в этой реакции шиффовых оснований [12]:
Этот
метод
имеет
два
недостатка:
низкую
селективность
из-за
неспецифического включение трития в Шиффовы основания и высокая опасность
при работе с радиоактивными атомами.
3. Высокоэффективная жидкостная хроматография (ВЭЖХ), метод основан на
восстановительном
аминировании
с
цианоборогидридом
натрия
и
30
взаимодействии с флуоресцентным реагентом (п-аминобензойная кислота) с
последующим анализом ВЭЖХ, используя 50 мМ натрий-ацетатный буфер
(рН 5,4) в качестве подвижной фазы. ВЭЖХ включает этап разделения
смеси карбонильных производных белков по их молекулярной массе, метод
удобен для обнаружения и оценки гамма-глутаминового полуальдегида и αаминоадипинового
полуальдегида
[82].
Метод
имеет
следующие
недостатки: эллюирование белков с более близкими по молекулярной массе
и невозможность структурной идентификации белков [203].
4. Метод газовой хроматографии основан на восстановлении боргидридом
натрия глутаминового и аминоадипинового альдегида до 5-гидрокси-2аминовалериановой
соответственно.
и
Затем
6-гидрокси-2-аминокапроновой
путем
их
дериватизации
кислоты
с
N,
O-
трифторацетилметиловым эфиром получают летучие продукты, которые
анализируют с помощью газовой хроматографии и оценивают посредством
масс-спектрометрии. Метод требует использования стандартов, процедура
является многоступенчатой и требует много времени [128].
5. Капиллярный электрофорез является универсальным методом, который
широко применяется для разделения и определения различных белков.
Данный метод удобен для оценки гидразида и 3-(2-фуроил)-хинолин-2карбоксальдегида, следовательно имеет узкое применение [123].
6. Иммуноферментный анализ (ИФА), метод основан на формировании 2,4динитрофенилгидразона с последующей неспецифической адсорбцией. Для
осуществления ИФА требуется небольшое количество белка (мкг), поэтому
метод применим в случаях, когда существует ограниченное количество
образца. В настоящее время существует коммерческие наборы, которые
широко
используются
для
количественной
оценки
карбонильных
производных белков в биологических жидкостях (сыворотка, плазма,
бронхо-альвеолярная жидкость, спинномозговая жидкость). Основным
недостатком является, что ИФА не дает информации о молекулярной
31
природе карбонильных производных белков и степени повреждения
конкретного белка в сложной смеси.
7. Спектрофотометрический
метод
основан
на
регистрации
2,4-
динитрофенилгидразонов, образующихся в реакции карбонилирования
производных белков с 2,4-динитрофенилгидразином (2,4-DNP) [107]. На
сегодняшний день спектрофотометрический метод является классическим
подходом к количественной оценке содержания карбонильных групп белка:
В реакции участвуют не только карбонильные производные, но и шиффовы
основания [12]:
Несмотря на то, что метод не позволяет идентифицировать поврежденные
белки, спектрофотометрический анализ является наиболее удобным способом
регистрации общего количества карбонильных производных в смеси белков
биологического материала [243]. Основоположником методологии считается R.L.
Levine, описавший в своих работах анализ данных, полученных на длине волны
370 нм, основываясь на том, что на данной длине волны происходит
максимальное
светопоглощение
оптимальным
диапазоном
[107].
Однако
светопоглощения
для
существует
определения
мнение,
что
содержания
карбонильных производных белков является λ=360-390 нм [198] и λ=355-390 нм
[108]. В связи с этим необходимо выделить работы, в которых ОМБ определяют
спектрофотометрическим методом, используя только одну длину волны 366 нм
[61] или 370 нм [2, 15, 108]. Кроме этого, для оценки окислительной модификации
белков
светопоглощение
образовавшихся
динитрофенилгидразонов,
регистрируют спектрофотометрически при длинах волн 270 и 363 нм [13] или 274
и 363 нм [28, 54].
В более поздних работах, в том числе и отечественных авторов, появляется
количественный анализ на четырех длинах волн, каждая из которых позволяет
32
косвенно оценить природу образовавшихся окислительно модифицированных
белков. Выделены следующие спектры поглощения для алифатических альдегид–
динитрофенилгидразонов:
нейтрального
характера
–
спектр
поглощения
зарегистрирован в диапазоне 260 – 558 нм; основного характера – в диапазоне 258
– 264
и 428 – 520 нм. Для кетон-динитрофенилгидразонов нейтрального
характера спектр поглощения отмечается в диапазоне 363-370 нм; основного
характера – 430-434 нм и 524-535 нм [145]. Так Е.Е. Дубинина и др. [29] на
основании работ L.A. Jones et al. [145] предлагает регистрировать альдегид- и
кетон-динитрофенилгидразоны нейтрального характера на длине волны 356 и 370
нм соответственно, а альдегид- и кетон-динитрофенилгидразоны основного
характера – на длине волны 430 и 530 нм. Предложенный способ анализа активно
используется [6, 53]. Кроме этого, существует мнение о возможности
использования
для
количественной
динитрофенилгидразонов
λ=230
нм
оценки
и
алифатических
λ=530
нм,
а
альдегид-
для
кетон-
динитрофенилгидразонов – λ=363 нм и λ=270 нм [27].
Карбонильные производные белков могут образовываться как спонтанно,
так и индуцируемо гидроксильным радикалом, образовавшимся в реакции
Фентона. Реактив Фентона, определенный как смесь пероксида водорода и ионов
железа, в настоящее время является одним из самых эффективных методов для
окисления органических веществ. Реакция Фентона известна больше столетия,
однако, в современных научных исследованиях она также актуальна и широко
применяется в качестве источника гидроксильных радикалов. Генерация
реакционноспособных соединений происходит в результате реакции иона металла
с пероксидом водорода: Fe++ + Н2О2 = ОН- + Fe+++ + ОН· [12, 25].
Образование ОН· in vivo возможно в результате металл-зависимого
разрушения перекиси водорода, при этом в качестве металла переменной
валентности выступает железо [30]. Эффективность реакции Фентона зависит,
главным образом, от концентрации H2O2 и соотношения Fe2+/H2O2. Кроме этого
ОН· является короткоживущим радикалом, поэтому в физиологических условиях
повреждение
локализовано
в
местах
его
образования
[12,
25].
При
33
экспериментальной металл-зависимой окислительной модификации белков в
среду, содержащую Fe2+, H2O2 добавляют этилендиаминтетрауксусную кислоту
(ЭДТА), что способствует наряду с образованием ОН· и других реакционных
соединений – феррил-, перферилл-ионов, СО3· [30]. Известно применение реакции
Фентона для определения антиоксидантной способности веществ [25].
Регистрация карбонильных производных белков, образовавшихся под
действием реактива Фентона, осуществляется спектрофотометрически при длинах
волн, аналогичных при регистрации спонтанно образовавшихся ОМБ, а анализ
результатов проводится параллельно [54, 28].
Считается, что показатели спонтанной ОМБ
характеризуют общее
физиологическое состояние организма, а показатели ОМБ, индуцируемой по
металл-катализируемому механизму, характеризуют резервно-адаптационные
возможности
организма
[52].
Резервно-адаптационный
потенциал,
представляющий собой сопоставление спонтанной ОМБ к металл-зависимой [26],
дает возможность косвенно оценить устойчивость белков к повреждению при
различных экспериментальных моделях.
Анализ окислительной модификации белков (спонтанной и металлзависимой), произведенный путем сравнения отдельных значений на длинах волн,
входящих в соответствующий диапазон, приводит к накоплению большого
фактического
материала,
который
демонстрирует
изменение
уровня
карбонильных производных. В результате отсутствия единого методологического
подхода, оценка и анализ результатов эксперимента затруднены. Для корректной
интерпретации полученных результатов необходим новый подход к анализу
данных, который позволит комплексно оценить и проанализировать значения
количества карбонильных производных, учитывая стадию окислительного стресса
и нарушения конформации белков.
В целом, уровень карбонильных производных позволяет одновременно
оценить
повреждение
аминокислотных
остатков
свободными
радикалами
кислорода и азота, а также продуктами перекисного окисления липидов, однако
идентифицировать тот или иной путь не представляется возможным.
34
1.2.3 Взаимосвязь окислительной модификации белка и протеолиза
В настоящее время протеолиз признается одним из возможных механизмов
защиты от накопления окислительно модифицированных белков.
Окисленные формы белков более чувствительны к действию протеаз, чем
их нативные аналоги [11, 31, 60]. В процесс расщепления окислительно
модифицированных белков вовлечены пепсин, трипсин, кальпаин и катепсин Д
[11]. Кроме этого, предполагается, что щелочные протеазы отвечают за
деградацию окисленных белков в клетках печени, селезенки и нейтрофилах, при
этом их активность с возрастом не снижается. Однако, чувствительность
модифицированных белков к протеолизу с возрастом становится меньше, что
приводит к нарушению иммунологической толерантности [35]. Стоит отметить,
что необратимое окисление белков делает невозможным их деградацию
протеолитическими системами, что приводит к формированию белковых
агрегатов.
Лизосомы, с одной стороны, могут оказаться внутриклеточными мишенями
оксислительного стресса, так как многие лизосомальные протеиназы в активном
центре имеют тиоловые группы, что может привести к образованию цистеиновых
сшивок и инактивации протеолитических ферментов.
С другой стороны, существуют данные, подтверждающие защитную
функцию лизосом в условиях окислительного стресса. В эукариотической клетке
одним из компартментов по утилизации белков служит лизосома, куда поступают
поврежденные
белки
и
деградируют.
Процесс
протеолиза
в
лизосомах
неспецифичный: разрушаются белки, связанные с мембранами, а также белки,
захваченные во время эндоцитоза [147]. Макромолекулы, которые окислительно
изменены за счет сшивок с другими белками, липопротеидами, углеводами или
металлами устойчивы к действию гидролаз и формируют прочный побочный
продукт. Накопление окисленных продуктов липидной и белковой природы
может
негативно
сказаться
на
целостности
лизосомальных
мембран.
Устойчивость окисленных белков к протеолитическому действию часто приводит
к их накоплению внутри клетки, а именно, либо в цитозоле, либо внутри лизосом.
35
Наличие продуктов окислительного стресса внутри лизосом изменяет их
нормальную функцию и преобразует их в новый источник свободных радикалов,
в результате чего происходит дестабилизация мембран лизосом, выход гидролаз в
цитозоль и, как следствие, клеточное повреждение [38].
Мембрана
лизосом
обладает
высокой
проницаемостью
для
металлопротеидов: деградация и удаление металла переменной валентности из
сложного белка повышает уровень свободного железа в клетке и может привести
к интрализосомальным повреждениям свободными радикалами, образовавшимися
по механизму реакции Фентона [38].
Важность лизосом в жизнедеятельности клетки проявляется не только в их
уникальной способности эффективно разлагать металлопротеиды и окислительно
поврежденные белки, но и отличительной способностью индуцировать каспаззависимый и лизосомно-зависимый апоптоз клетки [8, 42, 223]. Согласно
представлениям «классического» апоптоза, каспаза-8 вызывает выход из лизосом
активного катепсина В, который в результате ограниченного протеолиза
активирует проапоптозный белок Вах [8]. Кроме того, в настоящее время
накопилось достаточно данных, чтобы полагать, что существует механизм
развития лизосомального типа апоптоза, в котором каспазы не принимают
участия, а их сигнальную функцию выполняют катепсины [38, 42, 223].
На
сегодняшний
день
наиболее
изученной
является
деградация
окислительно поврежденных белков с участием протеасом. Важный вклад в
процесс утилизации внутриклеточных белков вносит 26S протеасома. Протеасома
представляет собой мультиспецифичный комплекс по утилизации поврежденных
белков клетки. 26S протеасома состоит из 20S протеасомы, имеющей в своем
составе пептидазные центры, и двух регуляторных комплексов, обладающих
ферментативной активностью. Однако, субстратами для протеолиза в 26S
протеасоме являются белки, которые подверглись убиквитилированию, именно
поэтому данный процесс получил название «убиквинтин-зависимая деградация
белка» [47, 148].
36
В результате окислительной модификации белки претерпевают структурные
изменения на уровне вторичной и третичной организации молекулы, которые
сопровождаются денатурацией, увеличением гидрофобных групп на поверхности
молекулы, что влечет за собой повышенную чувствительность к протеолизу.
Точный механизм данного процесса до конца не изучен, однако существует
мнение, что повышение гидрофобности – это основная причина, по которой белки
теряют способность противостоять действию протеасом и протеаз. Важно
отметить,
что
при
средней
степени
модификации
белки
подвергаются
дальнейшему окислению, приобретая всё больше гидрофобных групп и, тем
самым, повышая свою чувствительность к внутриклеточному протеолизу [17].
Белки обладают различными биологическими функциями, их окислительная
модификация может привести к метаболическим нарушениям. Модификации
могут подвергаться ферменты, а также структурные белки, что может привести к
потере функции. Одной из проблем изучения окисления является определение
окислительного стресса в естественных условиях. Так как белки чувствительны к
окислительной модификации, а продукты их распада стабильны и доступны для
определения, то ОМБ можно рассматривать в качестве маркеров окислительного
стресса.
Таким образом, развитие карбонилового стресса возникает не только в
условиях генерации активных форм кислорода и азота, снижения деятельности
антиоксидантных систем, но и при недостаточной деятельности протеасом и
протеаз. Если рассмотреть белки в качестве ловушек свободных радикалов, то,
несомненно, им принадлежит важная роль поддержания гомеостаза клетки.
Конечными продуктами гидролиза белков являются пептиды, из которых
способны
синтезироваться
новые
необходимые
белки
клетки.
Процесс
образования карбонильных производных – это один из способов контроля
качества структуры белков, при условии баланса между деградацией и синтезом
белковых молекул.
37
1.3 Лизосомальный цистеиновый протеолиз: механизмы, регуляция,
роль в иммуногенезе
1.3.1 Структурно-фукнкциональные
особенности
лизосомальных
цистеиновых протеиназ
В настоящее время лизосомальные цистеиновые протеиназы обнаружены
во многих тканях животных и растений, а также у микроорганизмов. Они
функционируют в первую очередь как эндопептидазы, но некоторые из них
обладают экзопептидазной активностью. Одним из самых крупных и интересных
считается
семейство
папаиноподобных
протеолитических
ферментов,
локализующихся, главным образом, в лизосомах, имеющих оптимальную кислую
среду
для
максимальной
активности
катепсинов.
Среди
лизосомальных
цистеиновых протеиназ выделено 11 представителей (B, C, F, H, K, L, O, S, V, W,
X), которые обладают различной протеолитической активностью, регулируя
физиологические или патологические процессы [208]. Катепсины синтезируются
в
виде
неактивных
препроэнзимов,
которые
далее
поступают
в
эндоплазматический ретикулум для дозревания путем ограниченного протеолиза.
Образующиеся проферменты затем превращаются в зрелые формы в кислой среде
поздних эндосом или лизосом. Ключевым моментом в дозревании катепсинов
является протеолитическое отделение пропептида [146]. Данный процесс
происходит под действием пепсина, нейтрофильной эластазы и катепсина D [16].
Для цистеиновых протеиназ известен механизм аутокаталитической
активации, который представляет собой сочетание мономолекулярного и
бимолекулярного процессов [104]. Эндопептидазы В, Н, L, S и К могут быть
активированы в результате аутокаталитического удаления концевого пептида, что
представляет собой мономолекулярный процесс. Далее зрелые молекулы
катепсинов активируют другие прокатепсины, таким образом, инициируя цепную
реакцию, приводящую к быстрой активации прокатепсинов. Например, для
активации экзопептидаз С и Х необходимы эндопептидазы L и S [16].
Известно, что все папаиноподобные катепсины состоят из лево- (L-) и
правовращающего (R-) доменов. Характерной особенностью L-домена является
38
центральная спираль с каталитическим Cys25 на вершине, где R-домен
локализуется на противоположной стороне активного центра и сложен в βструктуру с каталитическим His159 или His163 в катепсине L [234]. Эти два
каталитических остатка формируют тиолят/имидазольную ионную пару, которая
необходима для деятельности протеаз и располагается в середине V-образного
активного центра [104].
Как показано на рис. 8, механизм каталитического действия, типичный для
цистеиновых протеаз семейства папаиноподобных, происходит при участии
тиолят/имидазольной пары (Cys-S-/His-Im+) в результате переноса протона между
Cys25 и His159 (нумерация папаина). Тиолят воздействует на атом углерода,
разрывая пептидную связь в субстрате, что способствует преобразованию
карбонильной группы в отрицательно заряженный СО -, в результате этого
формируется тетраэдрическая структура. Далее протон переходит от катиона
имидазолия
амидной
связи
путем
гидролиза.
Амин
уходящей
группы
освобождается от фермента и, таким образом, происходит расщепление субстрата.
Вновь образованный субстрат водородом связан с остатком His159, а
карбонильная часть субстрата связана с остатком Cys25 через тиоэфирную связь.
Некоторое количество субстрата способно диссоциировать до воды, азот
имидазола способствует поляризации молекулы воды, что в свою очередь
приводит к переносу электронов с карбонильной группы и последующему
образованию второй промежуточной тетраэдрической структуры. Продуктом
реакции является карбонильное производное субстрата, а в ферменте образуется
тиоэфирная связь, что свидетельствует об образовании активной тиоловой
протеиназы [158, 212, 277].
Большинство
зрелых
катепсинов
неустойчиво
и
слабоактивно
в
нейтральной рН, их каталитическая активность максимальна в кислой среде. Вне
лизосом, при нейтральном рН, цистеиновые протеиназы нестабильны и могут
инактивироваться, исключение составляет лишь катепсин S, который при
нейтральном или слабо-щелочном рН сохраняет свою активность. Известно, что
катепсин
В,
связанный
с
гепарином,
защищен
от
рН-индуцированной
39
инактивации [86, 133]. В свою очередь, инактивация катепсина L при
нейтральном рН является неустойчивым процессом и снижается при нарастании
концентрации
субстрата,
что
представляет
собой
некоторую
защиту.
Внелизосомальная локализация цистеиновых протеиназ часто сопровождается их
повышенной экспрессией, таким образом, рН не единственный фактор,
регулирующий деятельность катепсинов [16].
Рис 8. Каталитический механизм действия лизосомальных цистеиновых
протеиназ на примере папаина (цит. по: Chang Wun-Shaing W. et al. , 2007)
Деятельность лизосомальных цистеиновых протеиназ строго регулирована,
в значительной степени через их взаимодействие с эндогенными ингибиторами –
цистатинами. Цистатины – это большое суперсемейство белков с разнообразными
биологическими функциями. Первоначально цистатины характеризовались, как
ингибиторы лизосомальных цистеиновых протеиназ, однако, в последние годы
были предложены и другие функции. В настоящее время цистатинам
приписывают роль в катаболизме белка и резорбции кости [231], регуляции
образования гормонов и формировании иммунного ответа [160, 244].
Суперсемейство цистатинов включает три семейства [234]:
40
I – стефины – кислые белки, имеющие в составе неразветвленной
полипептидной цепи около 100 аминокислотных остатков. Стефин А в больших
количествах содержится в клетках кожи, где, по-видимому, регулирует
активность цистеиновых протеиназ этой ткани. Еще один представитель – стефин
В локализуется, главным образом, в цитоплазме, где защищает клетку от
деятельности протеаз, вышедших из лизосом.
II – цистатины – белки, имеющие в своем составе полипептидную цепь из
115 аминокислотных остатков. Цистатины, главным образом, локализуются в
цитоплазме. Классическим представителем является цистатин С.
III – кининогены –
многофункциональные гликопротеины плазмы
млекопитающих.
В конце 1980 годов была открыта структура ингибитора цистеиновых
протеиназ. Это событие явилось первым шагом к объяснению молекулярного
механизма подавления активности катепсинов цистатином. Молекула цистатина
состоит из пяти спиралей и пяти скрученных антипараллельных β-цепей, которые
обвивают
α-спирали.
На
основе
этой
структуры
были
выделены
три
последовательности аминокислот, формирующие клинообразный край, который
подходит к активному центру фермента, в результате чего происходит
инактивация протеаз [102, 234].
Из-за лизосомальной локализации катепсинам долгое время присваивали
функцию
«клеточных уборщиков».
Однако,
современный этап изучения
состояния лизосомального аппарата характеризуется большим количеством
публикаций, посвященных изменению активности тканевых протеиназ при
различных патологических процессах. Исследования последних лет выявили у
протеаз специфические функции, в том числе формирование иммунного ответа
[101],
участие
в
дозревании
белковых
молекул
[157],
поддержании
воспалительных процессов и регуляции апоптоза [8, 85, 63]. Несмотря на то, что
лизосомальные цистеиновые протеиназы имеют общую локализацию, структуру и
механизм действия и активации, каждый член этой группы ферментов имеет свои
функциональные особенности (таблица 1).
41
Таблица 1
Общая характеристика лизосомальных цистеиновых протеиназ
Катепсин
Катепсин В
Деятельность
протеиназы
Эндопептидаза/
Участвует в патологических и физиологических процессах.
Избыточно экспрессируется раковыми клетками простаты [62, 119], прямой
карбоксипептидаза кишки [56], легкого [106, 116]. Накапливается в синовиальной жидкости
пациентов с ревматоидным артритом [103, 193]. Участвует в апоптозе [8] и
процессах формирования кровеносных сосудов [19, 138].
Катепсин C
Аминопептидаза
Наблюдается при аутосомальной неупорядочности рецессива [88].
Катепсин F
Эндопептидаза
Сверхвыражен в цервикальной жидкости при течении опухолевых процессов
[181].
Катепсин H
Аминопептидаза/
Впервые в чистом виде был выделен из свиной селезенки. Секретируется
Эндопептидаза
раковыми клетками простаты [67], прямой кишки и легких [216].
42
Катепсин K
Эндопептидаза
Секретируется костными клетками при остеопорозе [241], а также способен
генерировать эндостатинподобные фрагменты с различными свойствами [19].
Катепсин L
Эндопептидаза
Повышенная экспрессия в различных опухолевых клетках [157, 182], вовлечен в
рост опухоли и избыточно экспрессируется клетками брюшной аорты при
атеросклеротическом повреждении [90, 92]. Экспрессируется тимоцитами [120] и
принимает участие в созревании молекул II класса в кортикальных клетках
тимуса, генерирует из коллагена XVIII эндостатин в умеренно кислой
внеклеточной среде [114, 214].
Катепсин O
Эндопептидаза
Участвует в деградации белковых молекул и экспрессируется при раке груди
[134].
Катепсин S
Эндопептидаза
Активно секретируется при раке легкого [98, 160] и участвует в процессе
ангиогенеза [19, 158, 179].
Катепсин V
Эндопептидаза
Способен экспрессироваться клетками тимуса [120], в котором участвует в
процессе деградации белковой цепи [94].
Катепсин W
Не определено
Секретируется при хроническом воспалении слизистой желудка [96, 236].
Катепсин X
Карбоксипептидаза Секретируется при воспалении слизистой желудка [96].
43
1.3.2 Место лизосомального цистеинового протеолиза в системе
иммунитета
Иммунная система представлена большим разнообразием клеток и молекул,
которые формируют ответ на чужеродные антигены, названный иммунной
реакцией. В настоящее время есть все основания утверждать, что этап
лизосомального
протеолиза
является
неотъемлемой
частью
общего
универсального механизма врожденного и приобретённого иммунитета [36, 85].
На начальном этапе иммунного ответа происходит частичная деградация
антигенного материала в лизосомах макрофагов и дальнейшей презентации
антигена Т-хелперами [85, 245].
Катепсин В и L участвуют во внутрилизосомальном расщеплении белка, а в
межклеточном веществе обладают коллагенолитической активностью [104]. Для
катепсина L, помимо участия в презентации антигена, обнаружена специфическая
функция – пролиферация и дифференцировка Т-клеток [91, 93]. На определенном
этапе иммунного ответа активация Т-клеток антигеном уже не вызывает их
пролиферацию,
а
затухание
Т-клеточного
ответа
служит
стимулом
запрограммированной гибели клеток (апоптоза). Важно отметить, что апоптоз
клеток иммунной системы является механизмом контроля иммунных реакций
[85]. В результате апоптоза число Т-лимфоцитов снижается до уровня, имевшего
место перед иммунизацией. Известно, что катепсин В вовлечен в апоптоз клеток
[154, 210]. Каспаза-8
вызывает высвобождение катепсина В, который путем
ограниченного протеолиза активирует проапоптические белки семейства Bcl-2 и
Bid [8]. Смещение равновесия про- и антиапоптозных белков в сторону первых
способствует апоптозу клетки (рис. 9).
Помимо
участия
в
апоптозе
клеток,
катепсину
В
присваивают
имунореактивность в области синаптических контактов [33]. Известно, что
лизосомальные катепсины принимают важное участие во врожденной иммунной
реакции. Толл-подобные рецепторы (TLRs) 3, 7, 8 и 9, располагающиеся на
эндолизосомальных
мембранах,
распознают
нуклеиновые
кислоты
микроорганизмов, которые были фагоцитированы клетками, в результате этого
44
происходит мобилизация иммунной системы организма [85, 161]. TLRs
принадлежат к семейству лейцинобогатых протеинов, они взаимодействуют как с
гидрофобной, так и гидрофильной поверхностями рецептирующих молекул через
амфипатические
петли,
формируемые
многократно
повторяющимися
структурами [45]. В запуск сигналов через TLRs вовлечены адапторные белки,
универсальным является MyD88, который взаимодействует со всеми TLRs за
исключением TLR3 [41] (рис. 9).
Катепсин К изначально был выявлен как специфическая лизосомальная
протеаза остеокластов, но исследования показали, что он снижает воспалительные
аутоиммунные
заболевания
[68].
Фармакологическое
или
генетическое
ингибирование катепсина К приводит к дефектной передаче сигнала Толлподобного рецептора 9 (TLR9) в дендритных клетках [89], но катепсины В, L, S и
F необходимы для реакции TLR9 [95].
Аутоиммунные,
хронические,
воспалительные
и
инфекционные
заболевания являются следствием регуляторного дисбаланса в результате
избыточной активации TLRs [41]. Эктодомены TLR7 и TLR9 расщепляются в
лизосоме [202], расщепление эктодомена приводит к ограничению активации
рецептора и предотвращению реакции TLRs на собственные нуклеиновые
кислоты. Эти исследования определяют важную роль катепсин-зависимого
лизосомального протеолиза во врожденном иммунитете [85]. Кроме этого,
катепсины способны регулировать активность определенных цитокинов, что
имеет важное значение в формировании врожденного иммунитета. IL-8
приобретает активность в результате ограниченного протеолиза N-концевой цепи
под действием катепсина L [137], в пострансляционной модификации фактора
некроза опухоли-альфа (TNF-α) участвует катепсин В [87].
Катепсины играют важную роль в обработке и представлении антигенов,
предполагается их участие в реакциях приобретенного иммунитета [67]. Реакция
приобретенного иммунитета зависит от образования соответствующих пептидов
из чужеродных белков и их последующего представления на главных комплексах
гистосовместимости классов I и II (МНС I и II) [85, 242, 247]. В этом отношении
45
эндолизосомальные протеазы внутри антигенпредставляющих клеток, таких как
дендритные клетки и макрофаги, оказались незаменимыми для эффективной
работы приобретенного иммунитета. Протеазы преобразуют белки в более мелкие
пептиды подходящего размера перед образованием пептидного комплекса
гистосовместимости и представления CD4 +Т-лимфоцитам [91]. Существует
тонкий баланс между процессом образования пептидов и процессом их полного
уничтожения [238], а катепсины S, L, F, V, B, D, W и их эндогенный ингибитор
цистатин С предположительно участвуют в регулировании этого баланса [85].
Катепсин S считается основной протеазой, участвующей в МНС II обработке и
представлении антигена. Мыши с недостатком катепсина L имеют дефект
презентации МНС II-связанного антигена из-за неполного процессинга в
эпителиальных клетках коркового слоя вилочковой железы, которые выступают в
качестве антигенпредставляющих клеток для положительной селекции Тлимфоцитов в тимусе. Кроме того, у мышей с недостатком катепсина L число
CD4
+
Т-лимфоцитов сокращено. Это подтверждает тем, что катепсин L может
оказаться основной протеазой в представлении антигена МНС II в вилочковой
железе [93]. У людей эта функция выполняется гомологом катепсина L –
катепсином V [94]. Последние исследования показывают, что катепсины В и D
принимают участие в представлении антигена опосредованного МНС II [85, 245].
Способ расщепления белков эндопротеазами является потенциально важной
детерминантой в отображении пептидов комплекса гистосовместимости класса II
[245].
Таким образом, участие лизосом специализированных клеток в защитной
реакции организма при внедрении чужеродных агентов характеризуется двойной
направленностью: с одной стороны, они ответственны за освобождение
бактерицидных веществ, с другой – за процесс внутриклеточного переваривания
фагоцитированного материала. Лизосомальные цистеиновые протеазы являются
ключевыми факторами для индукции физиологических иммунных реакций. Эта
индукция может быть прямой, через деградацию патогенов в пределах
фаголизосом, или косвенной, посредством активации ключевых рецепторов [161].
46
УЧАСТИЕ КАТЕПСИНОВ В ФОРМИРОВАНИИ ИММУНИТЕТА
Приобретенный иммунитет
Врожденный иммунитет
TNF
TNF
А. Высвобождение катепсинов в цитозоль,
где происходит апоптоз по каспазному
механизму.
В. Активация Толл-подобных рецепторов
(TLRs) на мембране лизосом, в следствие
чего
происходит
передача
сигнала
(распознавание структуры микроорганизма и
активация клеточного иммунного ответа).
С. Сигнал воспаления от фактора некроза
опухоли (TNF) индуцирует синтез и
секрецию
цитокинов,
например,
интерлейкина-8 (IL-8). Предшественник IL-8
превращается в зрелую форму в результате
ограниченного протеолиза.
А. Эндолизосомальный протеолиз управляет
эффективностью и качеством отображения
антигенов зависимых от главного комплекса
гистосовместимости МНС II. Цитокины
(IL1β,
TNF-α)
изменяют
активность
катепсинов и влияют на регуляторный путь
MHC.
В. Fc-рецепторы (FcR) связываются с
антителами, в результате этого происходят
конформационные измения поверхностных
рецепторов, например, интегринов. Для
катепсинов в цитозоле мишенью являются
интегрины
на
цитоплазматической
мембране, в результате чего происходит
синтез цитокинов
С.
Апоптоз
по
каспазо-зависимому
механизму.
Рис 9. Функциональное значение катепсинов в формировании иммунного
ответа (модификация Conus Sébastien,2010)
47
Глава 2. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена на 88 конвенциональных половозрелых крысах-самцах
линии Wistar массой 280-320 граммов. Животные содержались по 3-4 особи
одного пола в металлических клетках площадью 24 дм 2 при естественном
освещении, получали воду и полноценный сухой комбикорм для лабораторных
животных «Чара» (производство ЗАО «Ассортимент – Агро», Московская
область, Сергиев-Посадский район, д. Тураково). Приготовление кормов для
животных, расчет рациона осуществлялся сотрудниками вивария в соответствии с
установленными нормами. Содержание животных в виварии соответствовало
«Санитарным
правилам
по
экспериментально-биологических
устройству,
клиник»
оборудованию
от
и
06.04.1993.
содержанию
Содержание
и
выведение животных из эксперимента выполняли в соответствии с правилами,
изложенными Международным Советом Медицинских Научных Обществ
(CIOMS)
в
«Международных
рекомендациях
по
проведению
медико-
биологических исследований с использованием животных» (1985 г.) и приказе
МЗРФ №267 от 19.06.2003 г. «Об утверждении правил лабораторной практики».
2.1 Экспериментальные модели in vivo и схемы введения препаратов
Моделирование дефицита синтеза оксида азота (II) разной степени
выраженности
Для
моделирования
дефицита
синтеза
оксида
азота
осуществляли
внутрибрюшинное введение неселективного ингибитора NO-синтазы N-нитро-Lаргининметилового эфира (L-NAME, «Sigma», США) в дозе 25мг/кг [59] и 200
мг/кг [240] в виде физиологического раствора через переднюю брюшную стенку
одноразовым пластиковым шприцем с тонкой короткой иглой.
Объем вводимого препарата зависел от массы животного: 0,5 мл на 200
граммов животной массы. Препарат вводился 1 раз в сутки в утренние часы
ежедневно в течение 7 дней. Выведение из эксперимента осуществлялся на 8-е
сутки.
48
Моделирование изменения уровня синтеза оксида азота (II) субстратом
NO-синтазы – L-аргинином
Моделирование изменения уровня синтеза оксида азота (II) субстратом NOсинтазы, осуществляли путем внутрижелудочного введения раствора L-аргинина
(«Sigma», США) на 0,9 % растворе NaCl в дозе 500 мг/кг [10] через стеклянный
градуированный шприц с внутрижелудочным зондом. Объем вводимого раствора
зависел от массы и не превышал 1 мл. Препарат вводили 1 раз в сутки до
утреннего кормления ежедневно в течение 10 дней. Выведение из эксперимента
осуществляли на 11-е сутки.
Моделирование
корригирующего
действия
L-аргинина
при
экспериментальном подавлении синтеза оксида азота (II)
Для
изучения
корригирующего
действия
L-аргинина
осуществляли
внутрибрюшинное введение L-NAME в указанных дозах с 3-х по 9-е сутки на
фоне перорального введения L-аргинина. Животных выводили из эксперимента
на 10-е сутки.
Контрольные группы формировались для каждой серии эксперимента из
животных, сопоставимых по возрасту, массе и условиям содержания с
экспериментальными особями. Животным контрольной группы осуществляли
введение физиологического раствора, при этом вариант введения, объемы
раствора и продолжительность воздействия совпадают с
экспериментальной
группы:
контроль
1
–
таковыми для
внутрибрюшинное
введение
физиологического раствора 1 раз в сутки в течение 7 дней; контроль 2 –
внутрижелудочное введение физиологического раствора в течение 10 дней;
контроль 3 – внутрибрюшинное введение физиологического раствора с 3-х по 9-е
сутки на фоне перорального введения физиологического раствора.
2.2 Экспериментальные модели in vitro
Моделирование дефицита синтеза оксида азота (II) in vitro
Для моделирования дефицита синтеза оксида азота (II) in vitro производили
инкубацию свежевыделенных тимоцитов и спленоцитов в полной питательной
среде, содержащей 5 мМ L-NAME [49] в течение 24 часов при температуре 370С.
49
Моделирование изменения уровня синтеза оксида азота субстратом NOсинтазы – L-аргинином
Для моделирования изменения уровня синтеза оксида азота (II) in vitro
производили инкубацию тимоцитов и спленоцитов в полной питательной среде,
содержащей 5 мМ L-аргинин [49] в течение 24 часов при температуре 370С.
Контрольные группы формировались для каждой серии эксперимента из
тимоцитов и спленоцитов, инкубированных параллельно опытным пробам в
полной питательной среде в течение 24 часов при температуре 370С.
2.3 Методы получения биологического материала
За 12 часов до забоя животных лишали пищи для стандартизации условий
опытов. Эвтаназия животных осуществлялась методом обескровливания под
эфирным рауш-наркозом при сохраненном дыхании и сердцебиении. Немедленно
после обескровливания извлекали тимус и селезенку, которые помещали в 0,25 М
раствор сахарозы. Затем очищенные органы взвешивали на электронных весах
(AJH-220 CE, Япония) и помещали в стеклянный стакан гомогенизатора «Potter S»
(Sartorius, Германия), предварительно измельчив их ножницами. Далее, добавляя
холодный раствор 0,25 М сахарозы в соотношении 1/10, гомогенизировали в
течение 40 секунд тимус и 35 секунд селезенку при скорости вращения
тефлонового пестика 900 об/мин и зазоре в пределах 0,16-0,24 мм. Описанные
процедуры проводили при температуре не выше 40С.
Оценку
приготовленного
гомогената
осуществляли
посредствам
морфологического контроля путем окраски мазков гомогенатов по РомановскомуГимзе с последующим подсчетом на предметном стекле числа не разрушенных
клеток на 1000 освобожденных ядер [36]. Число не разрушенных клеток в
гомогенате не превышало 1-2%.
Полученные гомогенаты центрифугировали 10 мин при 800 g (центрифуга
CM-6M ELMI, Латвия) для осаждения не полностью разрушенных клеток и ядер.
Надосадочную
жидкость
отбирали
пипеткой
в
отдельные
гильзы
и
центрифугировали 15 мин при 14000 g для удаления митохондрий, а затем
полученный супернатант – дополнительно при 20000 g в течение 30 мин
50
(центрифуга
рефрижераторная
К
24
Д,
ГДР)
для
получения
чистой
цитоплазматической (неседиментируемой) фракции. Осадок, представляющий
собой грубую фракцию лизосом (седиментируемая фракция), ресуспендировали в
0,25 М сахарозе с добавлением Тритона Х-100 в конечной концентрации 0,1%.
Активность кислых гидролаз в седиментируемой и неседиментируемой
фракциях определяли раздельно и обозначали, как седиментируемую и
неседиментируемую активность (СА и НСА) соответственно. Общую активность
(ОА) рассчитывали, как сумму СА и НСА.
Окислительную
модификацию
белков
оценивали
только
в
неседиментируемой (внелизосомальной) фракции.
2.4 Методы получения тимоцитов и спленоцитов для экспериментов in
vitro
После введения животных в глубокий эфирный наркоз производили
обескровливание и стерильно извлекали тимус и селезенку. Сразу, после
извлечения, тимус и селезенку погружали в охлажденную среду RPMI 1640,
освобождали от крови, жира и соединительной ткани. Далее, предварительно
взвесив каждую из долей, левую долю тимуса использовали для получения
тимоцитов контрольной серии, а правую – экспериментальной группы. Селезенку
делили на две части, примерно по 500 мг, и каждую использовали отдельно для
получения спленоцитов контрольной и экспериментальной групп. Очищенную
ткань переносили в стеклянный гомогенизатор (150x25 мм), содержащий среду
RPMI 1640 в соотношении 1/10, и измельчали, вращая стеклянный пестик
вручную. Полученную взвесь клеток отбирали шприцем через длинную иглу,
переносили в центрифужную пробирку и оставляли для оседания клеточных
агрегатов на ледяной бане в течение 1 часа. После этого отбирали шприцем взвесь
одиночных клеток и осаждали тимоциты и спленоциты центрифугированием в
течение 10 мин при 100 g (центрифуга CM-6M ELMI, Латвия) [20]. Клеточный
осадок ресуспендировали при комнатной температуре в 5 мл полной питательной
среды. Полученную клеточную взвесь инкубировали в течение 24 часов при 37 0С.
51
Состав полной питательной среды: среда RPMI 1640, содержащая 2 мМ LGln, по 2 мг/мл стрептомицина и пенициллина, а также 5 мМ L-аргинин или 5 мМ
L-NAME в зависимости от экспериментальной модели.
После инкубации полученные клетки осаждали при 100 g в течение 10 мин
и ресуспендировали в 0,25М сахарозе, добавляли Тритон Х-100 в конечной
концентрации 0,1%, что представляло собой материал для определения общей
активности (ОА).
Подсчет количества клеток и оценку их жизнеспособности осуществляли до
и после инкубации пробирочным методом в камере Горяева, используя в качестве
красителя 0,2 % раствор трипанового синего в физиологическом растворе [20].
2.5 Методы исследования
Определение концентрации метаболитов оксида азота
Содержание метаболитов оксида азота определяли в неседиментируемой
фракции гомогената спектрофотометрией в видимой области спектра по реакции
с реактивом Грисса [23].
Ход определения. Гомогенат депротеинизировали 96% этиловым спиртом в
соотношении 1:2 и центрифугировали при 800 g в течение 20 мин. Для
колориметрического определения нитрит-иона использовали реактив Грисса
(Нева Реактив, Санкт-Петербург), растворенный в 12 % уксусной кислоте. Для
колориметрического определения нитрат-иона готовили раствор ванадия хлорида,
для этого использовали растворенный VCl3 в 1 N НCl. Реактивы готовили ex
tempore [23].
Уровень метаболитов оксида азота (суммарную концентрацию нитратов и
нитритов NOх) определяли спектрофотометрическим методом по окраске в
реакции диазотирования нитритом сульфаниламида, входящего в состав реактива
Грисса. Интенсивность окраски определяли в видимой области спектра с
регистрацией на микропланшетном анализаторе StatFax 3200 (Awareness
Technology, США) при длине волны 540 нм и выражали в нМоль/мг белка.
52
Для построения калибровочной кривой использовали 1 М раствор NaNO2 в
воде, перед употреблением его разводили в 1000 раз и готовили серию разведений
для построения кривой.
Метод определения содержания белка
Содержание белка определяли в седиментируемой и неседиментируемой
фракциях гомогената по методу Лоури коммерческим набором НПЦ «Экосервис» (Санкт-Петербург).
Метод основан на образовании окрашенных продуктов ароматических
аминокислот с реактивом Фолина-Чокальтеу в сочетании с биуретовой реакцией
на пептидные связи. Интенсивность окраски пропорциональна концентрации
белка в исследуемой пробе, определяемой при 750 нм.
Содержание белка в опытной пробе определяли по калибровочному
графику, для построения которого использовали входящий в состав набора
калибровочный бычий сывороточный альбумин 0,25 мг/мл.
Метод определения кислой фосфатазы
Активность
неседиментируемой
кислой
фосфатазы
фракциях
определяли
гомогената
в
седиментируемой
унифицированным
методом
и
по
«конечной точке», используя коммерческий набор «Витал Диагностикс СПб»
(Санкт-Петербург).
Количество
образовавшегося
в
единицу
времени
n-нитрофенола,
пропорциональное активности фермента, определяется по оптической плотности
образца при 405 нм.
Расчет активности фермента производили по калибровочной кривой,
используя входящий в состав набора калибровочный раствор п-нитрофенола.
53
Далее подсчитывали коэффициент лабильности кислой фосфатазы (ClabAP) как
отношение активности кислой фосфатазы внелизосомальной фракции к общей
активности кислой фосфатазы.
Метод определения активности лизосомальных цистеиновых протеиназ
Активность катепсинов В, L и Н изучалась спектрофлуориметрическим
методом (System 3 Scanning Spectrofluorometr, Optical technology devices, inc.
Elmstord, New York, 10523) по Barrett & Kirschke [77].
Принцип метода: количественное определение 7-амидо-4-метилкумарина,
высвобождающегося в результате энзиматического гидролиза пептидной связи
Nα-CBZ-Arg-Arg-7-amido-4-methylcoumarin («Sigma», США) для катепсина В, NαCBZ-Phe-Arg-7-amido-4-methylcoumarin («Sigma», США) для катепсина L, Arg-7amido-4-methylcoumarin («Sigma», США) для катепсина Н («Sigma», США).
Преимущества данного метода связаны с высокой чувствительностью и
специфичностью используемых субстратов.
Ход определения. К 0,4 мл субстратно-буферного раствора, содержащего 20
мкМ Nα-CBZ-Arg-Arg-7-amido-4-methylcoumarin («Sigma», США) для катепсина
В, N-CBZ-Phe-Arg-7-амидо-4-метилкумарина («Sigma», США) для катепсина L и
Arg-7-amido-4-methylcoumarin («Sigma», США) для катепсина Н, 8 мМ ДТТ и 2
мМ ЭДТА в 0,1 М ацетатном буфере рН 6,0 и pH 5,5 для катепсинов В и L
соответственно,
Na/K-фосфатном
буфере
6,8
pH
для
катепсина
Н,
преинкубированного 2 минуты при 370С, добавляли 0,1 мл исследуемого
материала. Реакционную смесь инкубировали при 37 0С 60 минут. Реакцию
останавливали добавлением 2 мл холодного 0,1 М ацетатного буфера рН 4,0.
Контролем служила проба, содержащая те же компоненты, за исключением
исследуемого материала, который вносился в конце инкубации непосредственно
после добавления ацетатного буфера рН 4,0.
Количество свободного 7-амидо-4-метилкумарина измеряли на при λex и λem ,
соответственно 360 нм и 440 нм против контроля.
В
качестве
стандартного
раствора использовали 7-амидо-4-метилкумарин (Sigma, США), растворенный в
54
диметилсульфоксиде (Вектон, Санкт-Петербург).
Активность ферментов в 1
мл гомогената рассчитывалась по формуле:
F0 – интенсивность флуоресценции анализируемого образца;
Fst – интенсивность флуоресценции стандартного раствора амидометилкумарина;
С – концентрация 7-амидо-4-метилкумарина в стандартном растворе;
В – разведение гомогената;
t – время инкубации (сек);
0,1 – объем гомогената в пробе (мл).
Удельную активность катепсинов в тимусе и селезенке выражали в нмоль
амидо-метилкумарина/сек
г белка и нмоль/сек
г ткани; в тимоцитах и
спленоцитах - нмоль/сек 106 клеток.
Метод определение степени аутокаталитического действия катепсинов
Для выявления аутокаталитического действия катепсинов в реакционную
смесь, включающую 8 мМ ДТТ, 2 мМ ЭДТА и 0,1 мл исследуемого материала,
преинкубировали в течение 15 минут при 370 С. После этого к ней добавляли 20
мкМ Nα-CBZ-Arg-Arg-7-amido-4-methylcoumarin для катепсина В, N-CBZ-PheArg-7-амидо-4-метилкумарина для катепсина L и Arg-7-amido-4-methylcoumarin
для катепсина Н и инкубировали 60 минут при 370 C [5]. Аутокаталитическое
действие катепсинов оценивалось по коэффициенту отношения значения
активности фермента после прекаталитической инкубации к параллельно
определяемому значению активности без преинкубации (K
aca
– коэффициент
аутокаталитического действия).
Метод количественного определение цистатина С
Содержание ингибитора лизосомальных цистеиновых протеиназ цистатина
С проводили с использованием наборов иммуноферментного анализа
для
определения цистатина С Bio Vendor (Чехия). Оптическую плотность образцов
оценивали с помощью планшетного ридера «OPSIS MR» (Швеция) при длине
55
волны 450 нм. Результаты представляли в виде общей концентрации цистатина С
в нг/мг белка.
Метод оценки окислительной модификации белков в тканях
Для оценки окислительной модификации белков использовали определение
уровня карбонильных производных по R.L. Levine в модификации Е.Е.
Дубининой [29].
Метод оценки окислительной модификации белков основан на реакции
взаимодействия
карбонильных
производных
окисленных
аминокислотных
остатков белков с 2,4-динитрофенилгидразином (2,4-ДНФГ) с образованием 2,4динитрофенилгидразонов, которые регистрировались спектрофотометрически.
Ход
определения.
(цитоплазматическую)
Для
анализа
фракцию,
использовали
полученную
неседиментируемую
в
результате
ультрацентрифугирования гомогената тимуса и селезенки.
Предварительно в материале осаждали нуклеиновые кислоты во избежание
ошибочно завышенных показателей уровня карбонильных производных белков.
Осаждение нуклеиновых кислот осуществляли с помощью 10% стрептомицина
сульфата, в соотношении к гомогенату 1:9, экспозиция 15 минут при комнатной
температуре. Далее центрифугировали в течение 10 мин при 800g и для работы
использовали надосадочную жидкость.
При определении уровня карбонильных белков, образовавшихся при
спонтанной окислительной модификации (спонтанная ОМБ), использовали 0,1 мл
надосадочной жидкости, в которой осаждали белки 1 мл 20% трихлоруксусной
кислоты, как в опыте, так и в контроле. Далее в опытную пробу вносили 1 мл 0,01
М 2,4-ДНФГ, растворенного в 2 М НCl, а в контрольную пробу - 1 мл 2 М НСl.
56
Пробы инкубировали при комнатной температуре 1 час, затем центрифугировали
в течение 15 мин при 1000 g. Полученные осадки промывали 3 раза смесью
этанол (96%) – этилацетат (1:1) для экстракции липидов и 2,4-ДНФГ, не
прореагировавшего с карбонильными группами окисленных белков. Полученные
осадки высушивали для удаления оставшегося раствора этанол-этилацетат, а
затем растворяли в 8 М растворе мочевины в объеме 3 мл, для лучшего
растворения к осадкам добавляли 1 каплю 2 М НСl.
Определение
карбонильных
белков,
образующихся
по
металл-
катализируемому механизму (индуцируемая ОМБ), проводится аналогичным
образом с предварительным добавлением к опытной и контрольной пробам по 0,1
мл 4 10-3 М FeSO4, 1 10-3 М ЭДТА, 3 10-4 М Н2О2 приготовленные ex tempore,
при этом взаимодействие двухвалентного железа с перекисью водорода,
способствует последующему образованию радикала ОН˙ по реакции Фентона:
Fe2+ + Н2О2 = Fe3+ + ОН ̄ + ОН˙ [12]
Внесение в инкубационную среду ЭДТА обеспечивает сохранение в
растворе окисленной формы железа. Для тимоцитов и спленоцитов анализ
осуществляли аналогичным способом.
Карбонильные
производные
окисленных
белков
регистрировали
на
спектрофотометре (СФ-2000, Санкт-Петербург) в ультрафиолетовой части
спектра
на
длинах
волн
230,
254,
270,
280,
356
нм
(альдегид-
динитрофенилгидразоны нейтрального характера
), 363 нм и 370 нм (кетон-
динитрофенилгидразоны нейтрального характера
), а в области видимого
света - 428 и 430 нм (альдегид-динитрофенилгидразоны основного характера
) и 434, 524, 530, 535 нм (кетон-динитрофенилгидразоны основного
характера
). Перечисленные длины волн выбраны в соответствии с
диапазонами, которые регистрируются динитрофенилгидразоны [145].
57
-АДНФГ
-КДНФГ
Рис. 10. Характеристика регистрации динитрофенилгидразонов в световом
спектре
По полученным значениям экстинкций строили спектр поглощения
продуктов окислительной модификации белков и подсчитывали площадь под
кривой. Учитывая, что «шаг» между длинами волн является величиной
непостоянной, то вычислить площадь плоской фигуры с помощью определенного
интеграла
не
представлялся
возможным.
В
результате
этого
возникла
необходимость разбить площадь под кривой на отдельные фигуры, которые
представляли собой прямоугольные трапеции, высота которых была равна
разнице между длинами волн (h = λ2 – λ1), а основания равны значениям
экстинкции на определенной длине волны, например Extλ1 и Extλ2 , выраженные в
единицах оптической плотности (е.о.п.). Таким образом, площадь под кривой
спектра поглощения окислительной модификации белков складывалась из 4
площадей под кривой АДНФГ и КДНФГ и определялась формулой (Пат.2524667
РФ, МПК G01N33/52. Способ комплексной оценки содержания продуктов
окислительной модификации белков в тканях и биологических жидкостях /
Фомина М.А. [и др.]; Ряз. гос. мед. ун-т им. И.П. Павлова. – 2013102618/15; заявл.
21.01.2013; опубл. 27.07.2014, Бюл. № 21. – 8 с. ) :
,
где
58
Далее полученное значение выражали в условных единицах/грамм белка.
Способ оценки доли первичных и вторичных маркеров окислительного
стресса
Для оценки доли первичных маркеров подсчитывалась сумма АДНФГ
), для оценки вторичных - сумма КДНФГ (
(
), и
соотносили к общему содержанию карбонильных производных белков (S общ).
Способ оценки резервно-адаптационного потенциала
Оценка
резервно-адаптационного
потенциала
производилась
путем
подсчета отношения площади под кривой карбонильных производных белков при
спонтанном окислении протеинов к индуцированному по реакции Фентона,
принимая КДНФГинд. и АДНФГинд. за 100 % [26].
Рис. 11. Пример выражения результатов оценки резервно-адаптационного
потенциала
59
Метод определения битирозина и окисленного триптофана
Окислительная
образованием
модификация
битирозина,
тирозиновых
который
обладает
остатков
сопряжена
характерной
с
голубой
флуоресценцией. Окисление триптофановых остатков сопровождается снижением
флуоресценции, характерной для триптофана.
Ход определения. Контрольная проба содержала 1,9 мл фосфатного буфера
(рН 7,4) и 0,05 мл дистилированной воды. Опытная проба содержала 1,9 мл
фосфатного буфера
и 0,05 мл пробы. Обе пробы инкубировали при 37 0С в
течение 1 часа. По истечении инкубации интенсивность окислительной
модификации белков оценивали по степени флуоресценции битирозина и
триптофана. Флуоресценцию триптофана регистрировали при длине волны
возбуждения λ 295 нм и длина волны испускания λ 340 нм [30], образование
битирозина регистрировали при длине возбуждения λ 325 нм и длина волны
испускания λ 415 нм) [66]. Полученные результаты выражали в единицах
флуоресценции, отнесенных на грамм белка.
2.6 Статистическая обработка данных
Статистический анализ результатов исследования проведен согласно
руководству по медицинской статистике с применением современных методов
виртуального математического анализа, а именно, с использованием программы
«Microsoft Office Excel 2010» и «Statistica 10.0». Проверку нормальности
распределения данных осуществляли с помощью критерия Шапиро-Уилка (Wкритерий). Для вариационных рядов с отсутствием согласия данных с
нормальным
распределением
вычисляли
характеристики:
медиану
(Ме),
минимальное (min) и максимальное (max) значение, результаты представляли в
формате Ме [min; max]; при нормальном распределении данных вычисляли
среднее значение (М) и стандартное отклонение (s), результаты представляли в
формате М±s. Поскольку отмечалось отсутствие согласия большинства данных с
нормальным распределением, для оценки статистической значимости различий
независимых выборок использовали ранговый критерий Манна-Уитни (U-тест).
Для оценки ранговой корреляции использовали коэффициент Спирмена.
60
Глава 3. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
3.1 Характеристика экспериментальных моделей
Для подтверждения эффекта конкурентного ингибитора и субстрата NOсинтазы осуществляли измерение уровня метаболитов оксида азота. Обнаружено,
что
в
гомогенатах
тимуса
и
селезенки
под
действием
L-аргинина
конценцентрация оксида азота статистически значимо увеличивается, под
действием L-NAME в гомогенате селезенки – дозозависимо уменьшается, в
тимусе – не изменяется относительно значений контрольной группы (табл. 2).
В условиях применения L-NAME на фоне L-аргинина уровень метаболитов
оксида азота приближается к контрольным значениям и статистически значимо
снижался относительно группы L-аргинин.
Таблица 2
Концентрация метаболитов оксида азота в тимусе и селезенке крыс в моделях
in vivo, Ме [min; max]
экспериментальная модель
тимус
селезенка
контроль 1
16,9 [10,9; 23,6]
10,6 [9,0; 18,9]
L-NAME (25 мг/кг)
15,2 [11,7; 19,9]
8,3 [6,6; 9,1]* (p=0,019)
L-NAME (200 мг/кг)
18,1 [10,9; 21,2]
5,1 [3,8; 5,2]*#
(*p=0,02; # р=0,03)
контроль 2
17,9 [9,1; 31,5]
12,9 [10,5; 20,7]
23,8 [10,7; 49,2]*
21,1 [15,1; 27,2]*
(р=0,012)
(р=0,012)
контроль 3
15,8 [11,7; 24,9]
9,8 [8,5; 19,1]
L-NAME (25 мг/кг) +
13,2 [9,8; 34,6]^
12,1 [9,4; 14,2]^
L-аргинин (500 мг/кг)
(р=0,008)
(p=0,008)
L-NAME (200 мг/кг) +
16,0 [12,7; 19,0]^
11,5 [6,7; 13,1]^
L-аргинин (500 мг/кг)
(p=0,007)
(p=0,007)
L-аргинин (500 мг/кг)
Примечание: * - статистически значимые отличия относительно группы контроля;
# -статистически значимые отличия относительно группы L-NAME (25 мг/кг);
^ - статистически значимые отличия относительно группы L-аргинин
Известно, что тимоциты и спленоциты крыс могут генерировать оксид азота,
поэтому экспериментальную модель на организменном уровне можно перенести и
61
на эксперимент с изолированными клетками, то есть in vitro. В условиях in vitrо моделирования дефицита синтеза оксида азота концентрация NO2̄ и NO3̄ в
тимоцитах и спленоцитах снижается, а при дополнительном внесении субстрата в
питательную среду – повышается.
Таблица 3
Концентрация метаболитов оксида азота (нмоль/мг белка) в спленоцитах и
тимоцитах крыс в условиях in vitro-модулирования синтеза оксида азота,
Ме [min; max]
экспериментальная модель
тимоциты
спленоциты
Контроль
24,9 [20,4; 32,7]
6,11 [5,7; 8,81]
L-аргинин (5 мМ)
40,0 [35,1; 42,1]* (p=0,01)
32,7[24,9;38,9]* (p=0,01)
L-NAME (5 мМ)
15,4 [12,7; 17,3]* (p=0,03)
4,9 [4,3; 5,7]* (p=0,04)
Примечание: * - статистически значимые различия относительно контроля (р < 0,05)
Применение ингибитора и субстрата синтеза NO не сопровождается
статистически значимыми изменениями концентрации белка в гомогенатах
тимуса и селезенки крыс, поэтому в дальнейшем все значения исследуемых
показателей выражали в пересчете на грамм белка (рис. 12).
Рис. 12. Влияние модуляторов синтеза оксида азота на содержание белка
(мг/мл) в гомогенате тимуса и селезенки
62
Одним из показателей морфометрических параметров является относительная
масса тимуса. В исследуемых моделях изменения данного показателя не
отмечены (табл. 4).
Таблица 4
Относительная масса тимуса контрольной и экспериментальной групп
Масса крысы (г)
Масса тимуса (мг)
Контроль 1
406 [352; 425]
345 [285; 380]
Относительная
масса тимуса (%)
0,08 [0,07; 0,09]
L-NAME (25 мг/кг)
315 [278; 407]
306 [286; 400]
0,09 [0,07; 0,14]
L-NAME (200 мг/кг)
350 [340; 364]
334 [315; 370]
0,09 [0,01; 0,11]
Контроль 2
405 [246; 470]
325 [225; 415]
0,08 [0,05; 0,15]
L-аргинин
307 [290; 354]
245 [110; 385]
0,07 [0,04; 0,12]
Контроль 3
350 [256; 410]
290 [236; 406]
0,08 [0,05; 0,09]
L-NAME (25 мг/кг) + L- 326 [269; 407]
299 [120; 320]
0,08 [0,04; 0,1]
299 [120; 320]
0,07 [0,03; 0,1]
аргинин
L-NAME (200 мг/кг) + 340 [269; 407]
L-аргинин
Жизнеспособность свежевыделеных тимоцитов составила 70,2 ± 2,8 %.,
после
инкубации
жизнеспособность
контрольной
группы
тимоцитов
незначительно снизилась и стала равна 66 ± 5,5 % (p=0,88). При in vitroмоделировании дополнительного синтеза оксида азота субстратом L-аргинин
данный показатель статистически значимо не изменился и составил 66,8 ± 2,1 %
(p=0,79), однако добавление 5 мМ L-NAME в инкубационную среду способствует
уменьшению жизнеспособности клеток по сравнению со свежевыделенными
клетками и инкубированным контролем - 52 ± 2,1 % (р=0,03).
Для свежевыделенных спленоцитов жизнеспособность клеток составила
69,7 ± 1,03%, после инкубации в полной питательной среде незначительно
снизился до 67,7 ± 2,4% (p=1,00). Добавление аргинина в питательную среду не
способствует изменению жизнеспособности клеток – 67,8 ± 2,3% (p=0,94), а
внесение L-NAME 5 мМ приводит к статистически значимому уменьшению
жизнеспособности – 48,5 ± 1,1% (p=0,02).
63
3.2 Оценка состояния окислительной модификации белков
3.2.1 Характеристика окислительного карбонилирования белков под
действием конкурентного ингибитора синтеза оксида азота – L-NAME
Внутрибрюшинное введение L-NAME приводит к статистически значимому
увеличению общей площади под кривой спектра поглощения продуктов
окислительной модификации белков селезенки крыс за счет статистически
значимого повышения количества альдегид- и кетон-динитрофенилгидразонов
основного характера при дозе 25 мг/кг (рис. 13) и дополнительно кетондинитрофенилгидразонов нейтрального характера при дозе 200 мг/кг (рис. 14),
однако дозозависимых различий отмечено не было (рис. 15).
e.o.п./г белка
0,06
0,05
0,04
0,03
0,02
0,01
λ(нм)
0
230
254 270
280
356 363 370
SАДНФГ н.
контроль 1
L-NAME (25 мг/кг)
5,1 [2,2; 9,6]
3,6 [2,7; 10,5]
p = 0,68
428 430 434
SКДНФГ н.
SАДНФГ о.
1,6 [0,24; 4,8]
2,7 [1,1; 5,5]
p = 0,11
0,4 [0,3; 0,9]
2,8 [2,2; 5,9]*
p = 0,002
520 535
SКДНФГ о.
0,06 [0,03; 0,12]
0,6 [0,4; 1,4]*
p = 0,001
S общ.
6,69 [3,8; 14,9]
10,9 [7,2; 23,5]*
p = 0,072
e.o.n./г белка
Примечание: *- статистически значимые отличия относительной контроля (р < 0,05)
Рис. 13. Сравнительный анализ спектра поглощения продуктов
окислительной модификации белков селезенки под действием L-NAME в дозе 25
мг/кг
e.o.п./г белка
0,06
0,05
0,04
0,03
0,02
0,01
λ(нм)
0
230
254 270
280
356 363 370
SАДНФГ н.
контроль 1
L-Name (200 мг/кг)
5,1 [2,2; 9,6]
5,9 [3,9; 8,09]
p = 0,68
SКДНФГ н.
1,6 [0,24; 4,8]
3,2 [2,5; 3,7]*
p = 0,04
428 430 434
SАДНФГ о.
0,4 [0,3; 0,9]
3,01 [2,07; 5,3]*
p = 0,002
520 535
SКДНФГ о.
0,06 [0,03; 0,12]
0,5 [0,2; 0,7]*
p = 0,001
S общ.
6,69 [3,8; 14,9]
13,8 [9,4; 14,7]*
p = 0,01
e.o.п./г белка
Примечание: *- статистически значимые отличия относительной контроля (р < 0,05)
Рис. 14. Сравнительный анализ спектра поглощения продуктов окислительной
модификации белков селезенки под действием L-NAME в дозе 200 мг/кг
64
e.o.п./г белка
0,06
0,05
0,04
0,03
0,02
0,01
0
λ(нм)
230
254 270
280
356 363 370
SАДНФГ н.
L-Name (25 мг/кг)
L-Name (200 мг/кг)
3,6 [2,7; 10,5]
5,9 [3,9; 8,09]
p = 0,08
428 430 434
SКДНФГ н.
SАДНФГ о.
2,7 [1,1; 5,5]
3,2 [2,5; 3,7]
p = 0,23
2,8 [2,2; 5,9]
3,01 [2,07; 5,3]
p = 0,95
520 535
SКДНФГ о.
0,6 [0,4; 1,4]
0,5 [0,2; 0,7]
p = 0,19
S общ.
10,9 [7,2; 23,5]
13,8 [9,4; 14,7]
p = 0,13
белка
Рис. e.o.n./г
15.
Сравнительный анализ спектра поглощения продуктов
окислительной модификации белков селезенки под действием L-NAME в дозе 25
мг/кг относительно экспериментальной группы L-NAME в дозе 200 мг/кг
В условиях in vivo-моделирования дефицита синтеза оксида азота доля
вторичных маркеров увеличивается относительно контроля, эти изменения не
зависят от вводимой дозы L-NAME (рис. 16).
контроль1
L-NAME (25 мг/кг)
L-NAME (200 мг/кг)
- Первичные маркеры
- Вторичные маркеры
Примечание: *- статистически значимые отличия относительно контроля (р < 0,05)
Рис. 16. Доля первичных и вторичных маркеров окислительного стресса в
селезенке крыс в условиях in vivo-моделирования дефицита синтеза оксида азота,
Ме [min; max]
Обнаруженные in vivo изменения подтверждаются в эксперименте in vitro.
Так, при сопоставлении результатов площади под кривой окислительной
модификации белков спленоцитов, инкубированных в полной питательной среде
с внесением 5мМ L-NAME, со значениями контрольной группы были получены
следующие результаты: общая площадь под кривой поглощения продуктов
модификации белков статистически значимо увеличивается, при этом за счет
65
статистически значимого увеличения АДНФГ и КДНФГ основного характера
(рис. 17).
e.o.п./г белка
0,35
0,3
0,25
0,2
0,15
0,1
0,05
0
230
254 270
280
356 363 370
SАДНФГ н.
контроль
L-NAME
L-Name (5
(5мМ)
мМ)
428 430 434
λ(нм)
520 535
SКДНФГ н.
SАДНФГ о.
15,8 [15,6; 20,5]
7,4 [4,5; 9,8]
6,5 [4,7; 9,7]
1,1 [0,8; 1,7]
33,4 [25,7; 39,4]
25,7 [11,7; 44,9]
10,6 [7,1; 31,8]
23,5 [9,8; 44,9]*
4,7 [2,1; 8,0]*
72,1 [31,3; 129,8]*
p = 0,76
p = 0,23
p = 0,037
SКДНФГ о.
p = 0,037
S общ.
0,037
Примечание: *- статистически значимые отличия относительной контроля (р < 0,05)
Рис. 17. Сравнительный анализ спектра поглощения продуктов
окислительной модификации белков спленоцитов крыс под действием 5 мМ LNAME in vitro
В условиях in vitro-моделирования дефицита синтеза оксида азота доля
вторичных
маркеров
статистически
значимо
увеличивается
относительно
показателей контрольной группы.
контроль
- Первичные маркеры
L-NAME (5мМ)
- Вторичные маркеры
Примечание: *-статистически значимые отличия относительно контроля (р<0,05)
Рис. 18. Доля первичных и вторичных маркеров окислительного стресса
спленоцитов крыс в условиях in vitro-моделирования дефицита синтеза оксида
азота, Ме [min; max]
В тимусе под действием L-NAME in vivo в дозе 25 мг/кг и 200 мг/кг
наблюдается тенденция к увеличению содержания карбонильных производных
белков, однако, статистически значимых различий не отмечается ни для общей
площади под кривой спектра поглощения продуктов окислительной модификации
66
белков, ни для составляющих компонентов: АДНФГ и КДНФГ нейтрального и
основного характера (рис.19, 20).
e.o.п./г белка
0,35
0,3
0,25
0,2
0,15
0,1
0,05
λ нм.
0
230
254 270
280
356 363 370
SАДНФГ н.
контроль 1
L-NAME
(25 мг/кг)
428 430 434
SКДНФГ н.
520 535
SАДНФГ о.
SКДНФГ о.
12,65 [8,9; 26,3]
7,2 [4,8; 15,5]
7,8 [5,9; 15,9]
1,7 [1,3; 3,2]
29,2[20,6;53,7]
14,08 [10,5; 40,8]
6,8 [4,4; 14,9]
10,7 [6,4; 20,5]
1,9 [1,1; 3,8]
33,6 [22,5;80,1]
P = 0,31
p = 0,31
p = 0,15
p = 0,15
p = 0,19
S общ.
Рис. 19. Сравнительный анализ спектра поглощения продуктов
окислительной модификации белков тимуса экспериментальной группы под
действием L-NAME в дозе 25 мг/кг
e.o.п./г белка
0,18
0,16
0,14
0,12
0,1
0,08
0,06
0,04
0,02
λ нм.
0
230
254 270
280
356 363 370
SАДНФГ н.
контроль 1
L-Name
(200 мг/кг)
428 430 434
SКДНФГ н.
520 535
SАДНФГ о.
SКДНФГ о.
12,65 [8,9; 26,3]
7,2 [4,8; 15,5]
7,8 [5,9; 15,9]
1,7 [1,3; 3,2]
29,2[20,6;53,7]
S общ.
16,8 [11,8; 21,2]
6,2 [3,6; 8,5]
5,4 [3,5; 9,2]
1,05 [0,96; 2,4]
30,2[19,8;37,6]
p=0,16
p=0,94
p=0,09
p=0,60
p=0,94
Рис. 20. Сравнительный анализ спектра поглощения продуктов
окислительной модификации белков тимуса под действием L-NAME в дозе 200
мг/кг
Как показывают результаты выполненных исследований, внутрибрюшинное
введение N-нитро-L-аргининметилового эфира не способствует изменению
концентрации оксида азота в тимусе крыс. По данным литературы известно, что
тимус половозрелых животных покрыт тонкой соединительнотканной капсулой
[14]. При анализе результатов следует учесть, что структурная организация
кровяного русла тимуса органоспецифична и находится в прямой зависимости от
строения соединительнотканного каркаса. Источниками артериального притока к
67
тимусу являются ветви внутренней грудной артерии и ветви от общей сонной
артерии [34].
В свою очередь N-нитро-L-аргининметиловый эфир способствует сужению
сосудов, что может затруднить биодоступность данного вещества для вилочковой
железы. Вероятно, именно поэтому в тимусе не изменяется концентрация
метаболитов оксида азота и окислительная модификация белков в условиях in
vivo-моделирования дефицита синтеза оксида азота.
Интересно, что с повышением дозы L-NAME наблюдается статистически
значимое снижение количества альдегид- и кетон-динитрофенилгидразонов
основного характера (рис. 21).
e.o.п./г белка
0,35
0,3
0,25
0,2
0,15
0,1
0,05
λ нм.
0
230
254 270
280
356 363 370
SАДНФГ н.
L-NAME
(25 мг/кг)
L-Name
(200 мг/кг)
428 430 434
SКДНФГ н.
520 535
SАДНФГ о.
SКДНФГ о.
S общ.
14,08 [10,5; 40,8]
6,8 [4,4; 14,9]
10,7 [6,4; 20,5]
1,9 [1,1; 3,8]
33,6 [22,5;80,1]
16,8 [11,8; 21,2]
6,2 [3,6; 8,5]
5,4 [3,5; 9,2]#
0,9 [0,7; 1,4]#
30,2[19,8;37,6]
p = 0,94
p = 0,34
p = 0,02
p=0,007
p=0,21
Примечание: # - статистически значимые отличия от группы L-NAME (25 мг/кг), р<0,05.
Рис. 21. Сравнительный анализ спектра поглощения продуктов
окислительной модификации белков тимуса под действием L-NAME в дозе 25
мг/кг относительно экспериментальной группы L-NAME в дозе 200 мг/кг
контроль 1
L-NAME (25 мг/кг)
- Первичные маркеры
L-NAME (200 мг/кг)
- Вторичные маркеры
Рис. 22. Доля первичных и вторичных маркеров окислительного стресса
тимуса крыс в условиях in vivo-моделирования дефицита синтеза оксида азота, Ме
[min; max]
68
Доля альдегидных (первичные маркеры) и кетонных (вторичные маркеры)
форм группы L-NAME 25 мг/кг и 200 мг/кг также статистически значимо не
отличается от значений данных показателей контрольной группы, дозозависимых
отличий отмечено не было (рис. 22).
Предположение об отсутствии изменений in vivo по причине слабой
биодоступности L-NAME в ткань тимуса, подтверждаются в эксперименте in
vitro. Так, в тимоцитах, инкубированных в полной питательной среде с внесением
5 мМ L-NAME, было отмечено статистически значимое повышение общей
площади под кривой относительно контрольного значения, за счет повышения
площади под кривой спектра поглощения всех компонентов (рис. 23).
e.o.п./г белка
λ(нм)
L-NAME
(5мМ)
Примечание: *- статистически значимые отличия относительной контроля (р < 0,05).
Рис. 23. Сравнительный анализ спектра поглощения продуктов
окислительной модификации белков тимоцитов крыс под действием 5 мМ
L-NAME in vitro
Контроль
- Первичные маркеры
L-NAME (5 мМ)
- Вторичные маркеры
Рис. 24. Доля первичных и вторичных маркеров окислительного стресса
тимоцитов крыс в условиях in vitro-моделирования дефицита синтеза оксида
азота, Ме [min; max]
69
Однако, соотношение первичных и вторичных маркеров в условиях in vitroмоделирования дефицита синтеза оксида азота доля первичных и вторичных
маркеров
статистически
значимо
не
отличалась
относительно
значений
контрольной группы (рис. 24).
Таким образом, можно предположить, что для селезенки в условиях
моделирования дефицита синтеза оксида азота, мишенями для повреждающих
агентов
являются
остатки
аминокислот
основного
характера,
о
чем
свидетельствует повышение уровня карбонильных производных, поглощающих в
области видимого света спектра. Для тимуса такой специфичности отмечено не
было, так как в модели in vitro статистически значимо повышался уровень
карбонильных производных белков на всех участках спектра. Важно отметить,
что накопление вторичных маркеров окислительного стресса свидетельствует об
усугублении свободно-радикальных процессов. Таким образом, в результате in
vivo- и in vitro-моделирования дефицита синтеза NO происходит развитие
окислительного стресса иммуннокомпетентных органов крыс, что согласуется с
данными
литературы
обусловлены
тем,
[48,
что
Вышеперечисленные
55].
неселективный
ингибитор
факты
могут
NO-синтазы
быть
L-NAME
способствует угнетению цитопротекторных свойств оксида азота.
Для
оценки
используется
устойчивости
реакция
белков
Фентона,
к
широко
повреждающему
применяемая,
воздействию
как
источник
гидроксильных радикалов. Данную реакцию используют для определения
антиоксидантной
способности
информативным
подходом
к
веществ
анализу
[25].
Именно
данных
поэтому
является
наиболее
параллельное
осуществление спонтанной и металл-зависимой окислительной модификации
белков с последующим подсчетом отношения результатов измерения продуктов
спонтанного окисления к индуцированному по реакции Фентона, принимая
результаты измерения индуцированного за 100%, что характеризует резервноадаптационный
потенциал
[26].
Трактовка
полученных
результатов
осуществляется следующим образом: чем меньше доля спонтанного окисления в
индуцированном, тем выше резервно-адаптационный потенциал, и наоборот.
70
В условиях in vivo-моделирования дефицита синтеза оксида азота
наблюдалось
истощение
резервно-адаптационного
потенциала
селезенки
преимущественно за счет динитрофенилгидразонов основного характера (рис.
25а, 25б), при увеличении дозы L-NAME - дополнительно и за счет
динитрофенилгидразонов нейтрального характера (рис. 25а, 25б).
- Доля ДНФГ спонт.
- Резервно-адаптационный потенциал
Примечание: * – статистически значимые отличия от контрольной группы (р < 0,05);
# - статистически значимые отличия от экспериментальной группы L-NAME 25 мг/кг (р < 0,05)
Рис.
25.
Состояние
резервно-адаптационного
потенциала
динитрофенилгидразонов селезенки в условиях in vitro-моделирования дефицита
синтеза оксида азота
В условиях инкубации спленоцитов крыс в полной питательной среде с
добавлением 5 мМ L-NAME наблюдалось истощение резервно-адаптационного
потенциала альдегид- и кетон-динитрофенилгидразонов основного характера
(р=0,036
и
р=0,0036
соответственно),
кетон-динитрофенилгидразонов
нейтрального характера (р=0,042) относительно контроля. Однако, значение
общего
резервно-адаптационного
потенциала
экспериментальной
группы
статистически значимо не отличается от контрольного значения, возможно за счет
увеличения
уровня
резервно-адаптационного
потенциала
динитрофенилгидразонов нейтрального характера, р=0,03 (рис. 26).
альдегид-
71
- Доля ДНФГ спонт.
- Резервно-адаптационный потенциал
Примечание: * – статистически значимые отличия от контрольной группы (р < 0,05)
Рис. 26. Состояние резервно-адаптационного потенциала спленоцитов в
условиях in vitro-моделирования дефицита синтеза оксида азота
- Доля ДНФГ спонт.
- Резервно-адаптационный потенциал
Примечание: * – статистически значимые отличия от контрольной группы (р < 0,05);
# - статистически значимые отличия от экспериментальной группы L-NAME 25 мг/кг (р < 0,05)
Рис.
27.
Состояние
резервно-адаптационного
потенциала
динитрофенилгидразонов тимуса в условиях in vivo-моделирования дефицита
синтеза оксида азота
Под действием ингибитора синтеза оксида азота in vivo и in vitro отмечается
истощение резервно-адаптационного потенциала тимуса преимущественно за счет
АДНФГ и КДНФГ нейтрального характера (рис. 27, 28).
72
- Доля ДНФГ спонт.
- Резервно-адаптационный потенциал
Примечание: * – статистически значимые отличия от контрольной группы (р < 0,05)
Рис.
28.
Состояние
резервно-адаптационного
потенциала
динитрофенилгидразонов тимоцитов в условиях in vitro-моделирования дефицита
синтеза окисда азота
Из полученных результатов следует, что в условиях дефицита синтеза
оксида
азота
относительно
значение
показателей
резервно-адаптационного
контрольной
группы.
потенциала
снижается
Полученная
тенденция
истощения резервно-адаптационного потенциала иммунокомпетентных органов
может свидетельствовать о недостаточной активности антиоксидантных систем и
накоплении поврежденных, имеющих слабую функциональную активность
белков.
3.2.2 Характеристика окислительного карбонилирования белков под
влиянием субстрата синтеза оксида азота – L-аргинина
Влияние
изолированного
введения
L-аргинина
на
формирование
карбонильных производных белков
L-аргинин представляет собой эндогенное соединение, из которого
энзиматически образуется in vivo оксид азота. Тем не менее, путь метаболизма
аргинина зависит от активности следующих ферментов: аргининдекарбоксилазы,
73
аргиназы и NO-синтаз [9]. Как показывают результаты исследования, пероральное
введение L-аргинина способствует дополнительному образованию метаболитов
оксида азота, что может быть связано с доступностью субстрата для NO-синтаз в
тимусе и селезенке крыс. Установленным фактом является вазодилататорное
действие L-аргинина [59], с этим может быть связано и увеличение доставки
аминокислоты, оксида азота и/или его метаболитов с током крови к
иммунокомпетентным органам.
Под действием L-аргинина in vivo (рис. 29) и in vitro (рис. 31) общая
площадь под кривой окислительной модификации белков селезенки
не
изменяется относительно контроля, однако спектр поглощения продуктов
претерпевает изменения. Так, статистически значимо снижается содержание
альдегид-динитрофенилгидразонов нейтрального характера и статистически
значимо повышается содержание кетон-динитрофенилгидразонов основного
характера.
Полученная
тенденция
указывает
на
дифференцированный
антиоксидантный и прооксидантный эффект L-аргинина.
e.o.п./г белка
0,06
0,05
0,04
0,03
0,02
0,01
λ(нм)
0
230
254 270
280
356 363 370
SАДНФГ н.
контроль 2
L-аргинин
(500 мг/кг)
428 430 434
SКДНФГ н.
520
535
SАДНФГ о.
SКДНФГ о.
5,2 [2,5; 9,4]
1,2 [0,3; 5,4]
0,5 [0,3; 1,0]
0,06 [0,04; 0,1]
6,3 [3,2; 13,6]
4,0 [0,07; 6,1]*
1,2 [0,2; 1,8]
0,7 [0,2;1,8]*
0,2 [0,1; 0,5]*
6,9 [1,0; 10,0]
p = 0,025
p = 0,64
p = 0,057
p = 0,0035
S общ.
p = 0,7
Примечание: *- статистически значимые отличия относительной контроля (р < 0,05)
Рис. 29. Сравнительный анализ спектра поглощения продуктов
окислительной модификации белков селезенки под влиянием L-аргинина
В условиях in vivo- и in vitro-моделирования дополнительного синтеза
оксида азота субстратом L-аргинином доля первичных и вторичных маркеров
селезенки статистически значимо не изменяется относительно контроля (рис. 30,
32).
74
L-аргинин (500 мг/кг)
- Вторичные маркеры
контроль2
- Первичные маркеры
Рис. 30. Доля первичных и вторичных маркеров окислительного стресса в
селезенке крыс в условиях in vivo-моделирования дополнительного синтеза
оксида азота, Ме [min; max]
e.o.п./г белка
0,3
0,25
0,2
0,15
0,1
0,05
λ(нм)
0
230
254 270
280
356 363 370
SАДНФГ н.
контроль
L-аргинин
(5 мМ)
428 430 434
SКДНФГ н.
520
535
SАДНФГ о.
SКДНФГ о.
15,8 [15,6; 20,5]
7,4 [4,5; 9,8]
6,5 [4,7; 9,7]
1,1 [0,8; 1,7]
33,4 [25,7; 39,4]
7,7 [6,6; 17,5]*
4,7 [1,8; 17,2]
5,8 [2,9;22,4]
2,6 [0,5; 5,4]*
18,4 [12,9; 81,1]
p = 0,36
p = 0,045
p = 0,76
P = 0,045
p = 1,0
S общ.
Примечание: *- статистически значимые отличия относительной контроля (р < 0,05)
Рис. 31. Сравнительный анализ спектра поглощения продуктов
окислительной модификации белков спленоцитов под влиянием 5 мМ L-аргинина
in vitro
контроль
- Первичные маркеры
L-аргинин (5 мМ)
- Вторичные маркеры
Рис. 32. Доля первичных и вторичных маркеров окислительного стресса
спленоцитов крыс в условиях in vitro-моделирования дополнительного синтеза
оксида азота, Ме [min; max]
В тимусе крыс, в свою очередь, проявляется четкий антиоксидантный
эффект действия L-аргинина in vivo (рис. 33) и in vitro (рис. 35) – снижение
количества альдегидных и кетонных форм.
75
e.o.п./г белка
0,12
0,1
0,08
0,06
0,04
0,02
λ(нм)
0
230
254 270
280
356 363 370
SАДНФГ н.
контроль
L-аргинин
(5 мМ)
428 430 434
SКДНФГ н.
520
SАДНФГ о.
535
SКДНФГ о.
S общ.
13,05 [9,1; 24,3]
6,2 [4,4; 12,5]
7,3 [5,1; 14,08]
1,4 [0,9; 2,7]
28,4[20,6;53,7]
8,4 [3,7; 17,9]
5,2 [1,5; 6,5]*
6,1 [1,2; 8,4]*
1,2 [0,3; 1,9]
20,9[6,8;32,8]
p = 0,09
p = 0,02
p = 0,023
p = 0,12
p = 0,13
Примечание: *-статистически значимые отличия от контроля (р < 0,05)
Рис. 33. Сравнительный анализ спектра поглощения продуктов
окислительной модификации белков тимуса под влиянием L-аргинин in vitro
Доля альдегидных и кетонных форм в контрольной группе статистически
значимо не отличается по сравнению с группой L-аргинин in vivo (рис. 34) и in
vitro (рис. 36).
контроль
L-аргинин (500 мг/кг)
- Первичные маркеры
- Вторичные маркеры
Рис. 34. Доля первичных и вторичных маркеров окислительного стресса
тимуса крыс в условиях in vivo-моделирования синтеза оксида азота, Ме [min;
max]
e.o.п./г белка
0,18
0,16
0,14
0,12
0,1
0,08
0,06
0,04
0,02
λ(нм)
0
230
254 270
280
356 363 370
SАДНФГ н.
контроль
L-аргинин
(5 мМ)
428 430 434
SКДНФГ н.
520
535
SАДНФГ о.
SКДНФГ о.
15,5 [12,1; 25,1]
5,5 [3,3; 8,1]
5,2 [3,1; 11,6]
1,03 [0,8; 1,9]
27,5 [20,9; 44,8]
4,2 [2,08; 8,7]*
2,4 [0,7; 4,9]*
2,7 [0,5; 5,5]
0,6 [0,08; 1,3]
10,9 [3,4; 18,8]*
p=0,03
p=0,05
p=0,31
p=0,66
S общ.
p=0,03
Примечание: *- статистически значимые отличия относительной контроля (р < 0,05)
Рис. 35. Сравнительный анализ спектра поглощения продуктов
окислительной модификации белков тимoцитов под влиянием L-аргинина
76
контроль
- Первичные маркеры
L-аргинин (5мМ)
- Вторичные маркеры
Рис. 36. Доля первичных и вторичных маркеров окислительного стресса
тимоцитов крыс в условиях экспериментального моделирования синтеза оксида
азота, Ме [min; max]
В условиях in vivo и in vitro-моделирования дополнительного синтеза
оксида
азота
происходит
уменьшение
значений
резервно-адаптационного
потенциала КДНФГ основного характера селезенки (рис. 37, 38).
- Доля ДНФГ спонт.
- Резервно-адаптационный потенциал
Примечание: * – статистически значимые отличия от контрольной группы (р < 0,05)
Рис.
37.
Состояние
резервно-адаптационного
динитрофенилгидразонов селезенки под влиянием L-аргинина
потенциала
Пероральное введение L-аргинина приводит к истощению резервноадаптационного потенциала АДНФГ нейтрального характера и увеличению
данного показателя АДНФГ основного характера тимуса относительно значений
контрольной группы (рис. 39).
77
А
Б
- Доля ДНФГ спонт.
В
- Резервно-адаптационный потенциал
Примечание: * – статистически значимые отличия от контрольной группы (р < 0,05)
Рис.
38.
Состояние
резервно-адаптационного
потенциала
динитрофенилгидразонов спленоцитов в условиях in vitro-моделирования
дополнительного синтеза оксида азота
- Доля ДНФГ спонт.
- Резервно-адаптационный потенциал
Примечание: * – статистически значимые отличия от контрольной группы (р < 0,05)
Рис.
39.
Состояние
резервно-адаптационного
динитрофенилгидразонов тимуса под влиянием L-аргинина
потенциала
При этом, в условиях in vitro действия L-аргинина резервно-адаптационный
потенциал тимоцитов относительно контрольной группы не изменяется (рис. 40).
78
- Доля ДНФГ спонт.
- Резервно-адаптационный потенциал
Рис.
40.
Состояние
резервно-адаптационного
потенциала
динитрофенилгидразонов тимоцитов в условиях in vitro-моделирования
дополнительного синтеза оксида азота
В условиях стимулирования синтеза оксида азота общее количество
карбонильных производных белков не изменяется относительно значений
контрольной группы.
Однако,
структура
спектра
поглощения
продуктов
окислительной модификации белков селезенки изменяется: снижается количество
АДНФГ нейтрального характера, повышается содержание КДНФГ основного
характера, сопровождаемое истощением резервно-адаптационного потенциала.
Для тимуса прослеживается тенденция снижения содержания карбонильных
производных белков. Разнонаправленная тенденция изменения окислительного
статуса иммунокомпетентных органов может объясняться разным белковым
составом тимуса и селезенки, то есть цитопротекторный и цитотоксический
эффект оксида азота, возможно, определяется его взаимодействием с доступными
мишенями.
Использование L-аргинина в условиях экспериментального дефицита
синтеза оксида азота
При сочетанном применении L-NAME (25 мг/кг или 200 мг/кг) и Lаргинина общая площадь под кривой поглощения продуктов окислительной
79
модификации белков селезенки статистически значимо не отличается от значений
контрольной группы (табл. 5).
Таблица 5
Значения площади под кривой спектра поглощения продуктов окислительной
модификации белков селезенки в условиях корригирующего действия L-аргинина
Контроль 3
S АДНФГ н.
4,0 [2,7; 10,01]
L-аргинин (500 мг/кг)
+L-NAME (25 мг/кг)
3,2 [1,9; 6,8]
L-аргинин (500 мг/кг)
+L-NAME (200 мг/кг)
4,4 [2,8; 11,3]
S КДНФГ н.
1,1 [0,32; 5,9]
1,4 [0,8; 2,1]
1,3 [0,8; 3,6]
S АДНФГ о.
0,32 [0,28; 1,51]
1,1 [0,7; 1,6]
0,7 [0,4; 1,2]
S КДНФГ о.
0,05 [0,03; 0,32]
0,2 [0,1; 0,3]
0,09 [0,07; 0,18]
S ОБЩ
6,57 [3,9; 14,4]
6,09 [4,8; 10,05]
7,09 [5,02; 16,3]
Для селезенки общая площадь под кривой окислительной модификации
белков в экспериментальной группе сочетанного применения L-NAME на фоне Lаргинина ниже относительно группы L-NAME и не отличается от значений
группы L-аргинин, что свидетельствует о корригирующем действии аргинина при
использовании L-NAME в дозе 25 мг/кг (рис. 41) и в дозе 200 мг/кг (рис. 42).
е.о.п./г белка
0,06
0,05
0,04
0,03
0,02
0,01
0
λ нм.
230
254 270
280
356 363 370
SАДНФГ н.
L-аргинин
(500 мг/кг)
L-Name (25 мг/кг)
L-NAME(25 мг/кг)
+L-аргинин (500 мг/кг)
428 430 434
SКДНФГ н.
4,0 [0,07; 6,1]
1,2 [0,2; 1,8]
3,6 [2,7; 10,5]
2,7 [1,1; 5,5]
3,2 [1,9; 6,8]
1,4 [0,8; 2,1]
#
p = 0,014
520 535
SАДНФГ о.
#
SКДНФГ о.
S общ.
0,7 [0,2;1,8]
0,2 [0,1; 0,5]
6,9 [1,0; 10,0]
2,8 [2,2; 5,9]
0,6 [0,4; 1,4]
10,9 [7,2; 23,5]
1,1 [0,7; 1,6]
#
#
p = 0,001
0,2 [0,1; 0,3]
#
p = 0,001
#
6,09[4,8;10,05]
#
#
p = 0,007
Примечание: ^ - статистически значимые отличия от группы L-аргинина (p<0,05);
# - статистически значимые отличия от группы L-NAME (p<0,05)
Рис. 41. Сравнительный анализ спектра поглощения продуктов
окислительной модификации белков селезенки экспериментальной группы LNAME (25 мг/кг) на фоне L-аргинина относительно группы L-NAME (25 мг/кг) и
L-аргинин
80
е.о.п./г белка
0,06
0,05
0,04
0,03
0,02
0,01
λ нм.
0
230
254 270
280
356 363 370
SАДНФГ н.
428 430 434
SКДНФГ н.
L-аргинин
(500 мг/кг)
4,0 [0,07; 6,1]
1,2 [0,2; 1,8]
L-Name (200 мг/кг)
5,9 [3,9; 8,09]
3,2 [2,5; 3,7]
L-NAME(200 мг/кг)
+L-аргинин (500 мг/кг)
4,4 [2,8; 11,3]
▲
▲
1,3 [0,8; 3,6]
▲
p = 0,05
520 535
SАДНФГ о.
0,7 [0,2;1,8]
p = 0,001
0,7 [0,4; 1,2]
▲
p = 0,007
S общ.
0,2 [0,1; 0,5]
3,01 [2,07; 5,3]
▲
SКДНФГ о.
▲
6,9 [1,0; 10,0]
0,5 [0,2; 0,7]
0,09 [0,07; 0,18]
▲
p = 0,001
13,8 [9,4; 14,7]
▲
7,09[5,02;16,3] ▲
▲
p = 0,02
Примечание: ^ - статистически значимые отличия от группы L-аргинина (p<0,05);
▲
– статистически значимые отличия от группы L-NAME (200 мг/кг), p<0,05
Рис. 42. Сравнительный анализ спектра поглощения продуктов
окислительной модификации белков селезенки экспериментальной группы LNAME (200 мг/кг) на фоне L-аргинина относительно группы L-NAME (200 мг/кг)
и L-аргинин
Доля первичных и вторичных маркеров селезенки в экспериментальной
группе, получавшей L-NAME (25 мг/кг или 200 мг/кг) на фоне L-аргинина
статистически значимых различий не имеет относительно значений групп
контроля и группы L-аргинин (табл. 6).
Однако, при сопоставлении полученных результатов экспериментальной
группы крыс, получавших совместно L-NAME в дозе 25 мг/кг и L-аргинин, с
результатами группы животных, получавших только L-NAME в дозе 25 мг/кг,
отмечено статистически значимое снижение доли вторичных маркеров и
увеличение первичных (табл. 6). Аналогичная тенденция отмечается при
использовании L-NAME в дозе 200 мг/кг (табл. 6).
Для тимуса отмечалась несколько иная тенденция, чем для селезенки: при
совместном применении L-NAME (25 мг/кг или 200 мг/кг) на фоне аргинина
отмечено статистически значимое снижение значения общей площади под кривой
спектра
поглощения
продуктов
окислительной
модификации
белков
относительно значений контрольной группы (табл. 7). При использовании LNAME в дозе 25 мг/кг статистически значимо снижается содержание альдегид- и
81
кетон-динитрофенилгидразонов нейтрального характера относительно значений
контрольной группы (табл. 7), а при дозе L-NAME 200 мг/кг - статистически
значимо
снижается
содержание
динитрофенилгидразонов
нейтрального
и
основного характера (табл. 7).
Таблица 6
Доля первичных и вторичных маркеров окислительного стресса селезенки крыс в
условиях корригирующего действия L-аргинина, Ме [min; max]
Доля первичных маркеров
Доля вторичных маркеров
L-аргинин (500 мг/кг)
73,9 [64,8; 80,3] #
26,1 [19,7; 35,2]#
+L-NAME (25 мг/кг)
p=0,02
p=0,002
L-аргинин (500 мг/кг)
76,2 [70,5; 83,7] ▲
23,8 [16,3; 29,5] ▲
+L-NAME (200 мг/кг)
p=0,01
p=0,001
Контроль 3
78,5 [63,8; 82,1]
21,5 [18,9; 36,5]
L-аргинин (500 мг/кг)
76,2 [72,7; 85,3]
23,8 [18,6; 34,8]
L-NAME (25 мг/кг)
69,1 [66,9; 75,1]
30,9 [24,9; 33,1]
L-NAME (200 мг/кг)
70,7 [68,0; 75,1]
29,3 [26,0; 32,0]
Примечание: * - статистически значимые различия от группы контроля (р < 0,05);
#
- статистически значимые различия от группы L-NAME 25 мг/кг (р < 0,05);
▲
- статистически значимые различия от группы L-NAME 200 мг/кг (р < 0,05)
Таблица 7
Значения площади под кривой спектра поглощения продуктов окислительной
модификации белков тимуса в условиях корригирующего действия L-аргинина
Контроль 3
S АДНФГ н.
13,9 [10,6; 26,1]
S КДНФГ н.
6,9 [5,6; 14,5]
S АДНФГ о.
7,8 [4,9; 13,1]
L-аргинин (500 мг/кг)
+L-NAME (25 мг/кг)
3,2 [2,2; 7,1]*
p=0,001
3,8 [0,8; 6,3]*
p=0,005
L-аргинин (500 мг/кг)
+L-NAME (200 мг/кг)
6,5 [2,1; 7,8]*
p=0,001
2,3 [0,9; 3,4]*
p=0,001
6,1 [1,1; 13,6]
1,3 [0,6; 1,8]*
*p=0,001
S КДНФГ о.
1,7 [0,8; 3,1]
1,3 [0,3; 2,8]
0,2 [0,1; 0,4]*
p=0,001
S ОБЩ
29,8 [20,6; 53,7]
13,7 [5,4; 29,9]*
10,8 [3,9; 12,1]*
p=0,009
p=0,001
Примечание: * - статистически значимые различия от группы контроля (р < 0,05)
При использовании L-NAME (25 мг/кг) на фоне L-аргинина отмечается
статистически значимое снижение общей площади под кривой относительно
82
группы L-NAME: за счет статистически значимого снижения содержания АДНФГ
и КДНФГ нейтрального характера и АДНФГ основного характера (рис. 43).
Относительно группы L-аргинин статистически значимо снижается площадь под
кривой АДНФГ нейтрального характера (рис. 43).
е.о.п./г.белка
0,35
0,3
0,25
0,2
0,15
0,1
0,05
λ нм.
0
230
254 270
280
356 363 370
SАДНФГ н.
L-аргинин
(500 мг/кг)
L-Name (25 мг/кг)
L-NAME(25 мг/кг)
+L-аргинин (500 мг/кг)
#
428 430 434
SКДНФГ н.
520 535
SАДНФГ о.
SКДНФГ о.
S общ.
8,4 [3,7; 17,9]
5,2 [1,5; 6,5]
6,1 [1,2; 8,4]
1,2 [0,3; 1,9]
20,9[6,8;32,8]
14,08 [10,5; 40,8]
6,8 [4,4; 14,9]
10,7 [6,4; 20,5]
1,9 [1,1; 3,8]
33,6 [22,5;80,1]
3,2 [2,2; 7,1]^#
3,8 [0,8; 6,3]#
6,1 [1,1; 13,6] #
1,3 [0,3; 2,8]
13,7[5,4;29,96] #
#
p=0,001; ^ p = 0,02
#
p = 0,003
#
p = 0,04
p = 0,002
Примечание: ^ - статистически значимые отличия от группы L-аргинина (p<0,05);
# - статистически значимые отличия от группы L-NAME 25 мг/кг (p<0,05)
Рис. 43. Сравнительный анализ спектра поглощения продуктов
окислительной модификации белков тимуса экспериментальной группы L-NAME
(25 мг/кг) на фоне L-аргинина относительно группы L-NAME (25 мг/кг) и Lаргинин
е.о.п./г.белка
0,18
0,16
0,14
0,12
0,1
0,08
0,06
0,04
0,02
λ нм.
0
230
254 270
280
356 363 370
SАДНФГ н.
L-аргинин
(500 мг/кг)
8,4 [3,7; 17,9]
L-Name (200 мг/кг)
16,8 [11,8; 21,2]
L-NAME(200 мг/кг)
+L-аргинин (500 мг/кг)
▲
6,5 [2,1; 7,8]^
^ p=0,045; ▲ p=0,004
428 430 434
SКДНФГ н.
520 535
SАДНФГ о.
SКДНФГ о.
S общ.
5,2 [1,5; 6,5]
6,1 [1,2; 8,4]
1,2 [0,3; 1,9]
20,9[6,8;32,8]
6,2 [3,6; 8,5]
5,4 [3,5; 9,2]
0,9 [0,7; 1,4]
30,2[19,8;37,6]
▲
2,3 [0,9; 3,4]^
^ p=0,04;▲ p=0,004
▲
1,3 [0,6; 1,8]^
▲
0,2 [0,1; 0,4]^
10,8[3,9;12,1]^▲
^ p=0,02;▲ p=0,004 ^ p=0,001;▲ p=0,001 ^ p=0,001;▲ p=0,001
Примечание: ^ - статистически значимые отличия от группы L-аргинина (p<0,05);
▲
- статистически значимые отличия от группы L-NAME (200 мг/кг), p<0,05
Рис. 44. Сравнительный анализ спектра поглощения продуктов
окислительной модификации белков тимуса экспериментальной группы L-NAME
(200 мг/кг) на фоне L-аргинина относительно группы L-NAME (200 мг/кг) и Lаргинин
83
При сопоставлении результатов группы сочетанного применения L-NAME
200 мг/кг на фоне L-аргинина статистически значимо снизился уровень
модифицированных
белков,
как
общее
количество,
так
и
динитрофенилгидразонов нейтрального и основного характера относительно
значений групп L-NAME 200 мг/кг и L-аргинина (рис. 44).
Доля первичных и вторичных маркеров в экспериментальной группе,
получавшей L-NAME в дозе 25 мг/кг, на фоне L-аргинина статистически
значимых различий не имеет относительно значений групп контроля и Lаргинина. При этом относительно значений группы L-NAME (25 мг/кг)
отмечается статистически значимое увеличение доли вторичных маркеров и
снижение первичных (табл. 8).
Доля первичных и вторичных маркеров в группе с применением L-NAME в
дозе 200 мг/кг на фоне L-аргинина статистически значимо не отличалась от
значений групп контроля, L-аргинин, L-NAME (200 мг/кг).
Таблица 8
Доля первичных и вторичных маркеров окислительного стресса тимуса крыс в
условиях корригирующего действия L-аргинина, Ме [min; max]
Доля первичных маркеров
Доля вторичных маркеров
69,7 [66,6; 78,1] #
#
p=0,024
30,3 [21,9; 33,4] #
#
p=0,024
73,5 [66,5; 79,5]
26,5 [20,5; 33,5]
Контроль 3
72,5 [69,8; 76,1]
27,5 [23,7; 32,3]
L-аргинин (500 мг/кг)
73,5 [66,9; 77,6]
26,5 [22,4; 33,1]
L-NAME (25 мг/кг)
74,6 [73,7; 78,6]
25,4 [21,4; 26,3]
L-NAME (200 мг/кг)
74,6 [73,7; 78,6]
25,4 [21,4; 26,3]
L-NAME (25 мг/кг)
+L-аргинин (500 мг/кг)
L-NAME (200 мг/кг)
+L-аргинин (500 мг/кг)
После применения L-NAME (25 мг/кг или 200 мг/кг) на фоне L-аргинина
наблюдается
следующая
адаптационного
тенденция
потенциала
АДНФГ
для
и
селезенки:
КДНФГ
значение
резервно-
основного
характера
статистически значимо ниже относительно значений контрольной группы (рис.
84
44). Важно отметить, что значение общего резервно-адаптационного потенциала
не отличается от значений контрольной группы (рис. 45).
- Доля ДНФГ спонт.
- Резервно-адаптационный потенциал
Примечание: * – статистически значимые отличия от контрольной группы (р < 0,05)
Рис.
45.
Состояние
резервно-адаптационного
потенциала
динитрофенилгидразонов селезенки при действии L-NAME (25 мг/кг или 200
мг/кг) на фоне L-аргинина (500 мг/кг)
При сопоставлении результатов группы, получавшей L-NAME в дозе 25
мг/кг на фоне L-аргинина, с экспериментальной группой L-аргинин и L-NAME 25
мг/кг статистически значимых различий для всех показателей отмечено не было
(рис. 46).
- Доля ДНФГ спонт.
- Резервно-адаптационный потенциал
Рис. 46. Состояние резервно-адаптационного динитрофенилгидразонов
селезенки групп L-NAME (25 мг/кг) на фоне L-аргинина (500 мг/кг) относительно
L-аргинина (500 мг/кг), L-NAME (25 мг/кг)
85
При сопоставлении результатов группы, получавшей L-NAME в дозе 200
мг/кг на фоне L-аргинина, с экспериментальной группой L-аргинин отмечается
статистически
значимое
уменьшение
резервно-адаптационного
потенциала
альдегид-динитрофенилгидразонов основного характера (р=0,01), и увеличение
данного показателя для кетон-динитрофенилгидразонов основного характера
(р=0,001) (рис. 47).
При сопоставлении результатов группы, получавшей L-NAME в дозе 200
мг/кг на фоне L-аргинина, с экспериментальной группой L-NAME 200 мг/кг
наблюдается
статистически значимое
увеличение
резервно-адаптационного
потенциала АДНФГ основного (р=0,004), а также КДНФГ основного характера
(р=0,001) и КДНФГ нейтрального характера (р=0,03) (рис. 47).
- Доля ДНФГ спонт.
- Резервно-адаптационный потенциал
Примечание: ▲ – статистически значимые отличия относительно группы L-NAME (200 мг/кг);
^ -статистически значимые отличия относительно группы L-аргинин, р<0,05
Рис.
47.
Состояние
резервно-адаптационного
потенциала
динитрофенилгидразонов селезенки под влиянием L-NAME (200 мг/кг) на фоне
L-аргинина (500 мг/кг) относительно L-аргинина (500 мг/кг), L-NAME (200 мг/кг)
После применения L-NAME в дозе 25 мг/кг на фоне L-аргинина
наблюдается следующая тенденция для тимуса: значение общего резервноадаптационного потенциала увеличивается (р=0,002), за счет увеличения данного
86
показателя АДНФГ нейтрального характера (р=0,003) относительно значений
контрольной группы (рис. 48).
При сопоставлении результатов группы, получавшей L-NAME в дозе 200
мг/кг
на
фоне
L-аргинина,
с
контрольной
группой
была
отмечена
однонаправленная тенденция: статистически значимое увеличение общего
резервно-адаптационного потенциала за счет увеличения данного показателя для
АДНФГ и КДНФГ основного (р=0,01 и р=0,03 соответственно) и нейтрального
характера (р=0,01 и р=0,005 соответственно) (рис. 48).
- Доля ДНФГ спонт.
- Резервно-адаптационный потенциал
Примечание: * – статистически значимые отличия от контрольной группы (р < 0,05)
Рис.
48.
Состояние
резервно-адаптационного
потенциала
динитрофенилгидразонов тимуса под влиянием L-NAME (25 мг/кг или 200 мг/кг)
на фоне L-аргинина (500 мг/кг)
При сопоставлении результатов группы, получавшей L-NAME в дозе 25
мг/кг на фоне L-аргинина, с экспериментальной группой L-аргинин и L-NAME 25
мг/кг наблюдалась одинаковая тенденция для тимуса: статистически значимое
увеличение резервно-адаптационного потенциала для АДНФГ нейтрального
характера (р=0,001) (рис. 49).
Значение общего резервно-адаптационного потенциала увеличивается при
сочетанном применении L-NAME и L-аргинин относительно группы L-аргинин
(р=0,02) (рис. 49).
87
- Доля ДНФГ спонт.
- Резервно-адаптационный потенциал
Примечание: # - статистически значимые отличия относительно группы L-NAME (25 мг/кг); ^ статистически значимые отличия относительно группы L-аргинин, р<0,05
Рис.
49.
Состояние
резервно-адаптационного
потенциала
динитрофенилгидразонов тимуса под влиянием L-NAME (25 мг/кг) на фоне Lаргинина (500 мг/кг) относительно L-аргинина (500 мг/кг), L-NAME (25 мг/кг)
При сопоставлении результатов группы, получавшей L-NAME в дозе 200
мг/кг на фоне L-аргинина, с экспериментальной группой L-аргинин отмечается
статистически значимое увеличение значения общего резервно-адаптационного
потенциала тимуса, за счет увеличения данного показателя для АДНФГ
нейтрального характера (р=0,001).
- Доля ДНФГ спонт.
- Резервно-адаптационный потенциал
Примечание: ▲ – статистически значимые отличия относительно группы L-NAME (200 мг/кг);
^ -статистически значимые отличия относительно группы L-аргинин, р<0,05
Рис.
50.
Состояние
резервно-адаптационного
потенциала
динитрофенилгидразонов тимуса под влиянием L-NAME (200 мг/кг) на фоне Lаргинина (500 мг/кг) относительно L-аргинина (500 мг/кг), L-NAME (200 мг/кг)
88
При сопоставлении результатов группы, получавшей L-NAME в дозе 200
мг/кг на фоне L-аргинина, с экспериментальной группой L-NAME 200 мг/кг
наблюдается статистически значимое увеличение значения общего резервноадаптационного потенциала, за счет АДНФГ и КДНФГ нейтрального характера
(р=0,01 и р=0,004 соответственно) (рис. 50).
При сочетанном применении L-аргинина и L-NAME значение общей
площади под кривой и её составляющих статистически значимо не отличается от
значений группы контроля и L-аргинин, однако ниже значений группы L-NAME,
что указывает на корригирующее действие субстрата NO-синтазы в условиях
дефицита синтеза оксида азота. Уровень резервно-адаптационного потенциала
увеличивается относительно значений контрольной группы, что также указывает
на положительное влияние L-аргинина.
3.2.3 Состояние окислительной модификации остатков тирозина и
триптофана в условиях in vivo- и in vitro-модулирования дефицита синтеза
оксида азота
Остатки
аминокислот
тирозина
и
триптофана
чувствительны
к
повреждению в условиях окислительного стресса благодаря системе развитых
двойных связей в своей структуре.
Сайт-специфическое нитрозилирование тирозина и триптофана сочетается с
изменением функций протеинов и развитием NO-зависимого окислительного
стресса (нитрозативного стресса). В условиях in vivo и in vitro-моделирования
дополнительного синтеза оксида азота ожидаемого накопления битирозина и
окисленного триптофана не отмечалось (табл. 9). Полученный факт может
объясняться пространственной недоступностью тирозиновых и триптофановых
остатков.
Поскольку реакция образования нитротриптофана обратима, то он способен
разлагаться. Таким образом, низкие концентрации оксида азота in vivo и in vitro
способствуют
смещению
равновесия
в
сторону
немодифицированного
триптофана, о чем свидетельствует увеличение флуоресценции (табл. 9-12). В
условиях моделирования дефицита синтеза оксида азота, содержание битирозина
89
в спленоцитах не изменяется (табл. 10), а в тимоцитах - снижается (табл. 12), что,
вероятно,
связано
с
уменьшение
количества
активных
форм
азота.
Незначительный уровень битирозина свидетельствует об отсутствии процессов
агрегации, а низкий уровень окисленного триптофана - об отсутствии процессов
фрагментации белковых молекул.
Таблица 9
Изменения флуоресценции битирозина и триптофана селезенки крыс в условиях
модулирования синтеза оксида азота, ед. фл./г белка (Ме [min; max])
экспериментальная модель
Флуоресценция
Флуоресценция
битирозина
триптофана
контроль 1
0,15 [0,14; 0,17]
0,29 [0,26; 0,31]
L-NAME (25 мг/кг)
контроль 2
0,09 [0,08; 0,12]*
р=0,045
0,13 [0,12; 0,15]*
р=0,02
0,16 [0,13; 0,22]
0,72 [0,69; 0,73]*
р=0,018
0,71 [0,62; 0,77]*
р=0,008
0,31 [0,29; 0,34]
L-аргинин (500 мг/кг)
0,18 [0,15; 0,20]
контроль 3
0,13 [0,11; 0,19]
0,61 [0,39; 0,74]*
р=0,02
0,33 [0,28; 0,36]
L-NAME (25 мг/кг) +
0,14 [0,09; 0,13]
L-NAME (200 мг/кг)
L-аргинин (500 мг/кг)
L-NAME (200 мг/кг) +
0,15 [0,10; 0,18]
L-аргинин (500 мг/кг)
0,73 [0,69; 0,96]*
р=0,01
0,86 [0,79; 1,25]*
р=0,008
Примечание: * - статистически значимые отличия относительно группы контроля
Таблица 10
Изменения флуоресценции битирозина и триптофана спленоцитов крыс в
условиях модулирования синтеза оксида азота, ед. фл./г белка (Ме [min; max])
экспериментальная модель
Флуоресценция
Флуоресценция
битирозина
триптофана
контроль
4,4 [1,8; 5,7]
3,8 [1,3; 11,1]
L-аргинин (5 мМ)
3,5 [3,3; 3,9]
2,1 [1,5; 2,9]
L-NAME (5 мМ)
4,4 [2,9; 5,6]
3,3 [2,9; 4,4]
90
Таблица 11
Изменения флуоресценции битирозина и триптофана тимуса крыс в условиях
модулирования синтеза оксида азота, ед. фл./г белка (Ме [min; max])
экспериментальная модель
Флуоресценция
Флуоресценция
битирозина
триптофана
контроль 1
0,32 [0,31; 0,38]
0,65 [0,63; 0,75]
L-NAME (25 мг/кг)
контроль 2
0,20 [0,15; 0,25]
р=0,045
0,26 [0,19; 0,32]
р=0,04
0,31 [0,30; 0,35]
1,47 [1,42; 1,53]*
р=0,008
1,68 [0,94; 2,17]*
р=0,008
0,62 [0,61; 0,69]
L-аргинин (500 мг/кг)
0,34 [0,19; 0,66]
контроль 3
0,34 [0,25; 0,40]
1,43 [0,59; 2,65]*
р=0,002
0,61 [0,59; 0,73]
L-NAME (25 мг/кг) +
0,39 [0,11; 0,49]#
р=0,021
1,59 [0,95; 3,53]*
р=0,01
0,38 [0,17; 0,49]▲
р=0,03
1,44 [1,38; 1,67]*
р=0,008
L-NAME (200 мг/кг)
L-аргинин (500 мг/кг)
L-NAME (200 мг/кг) +
L-аргинин (500 мг/кг)
Примечание: * - статистически значимые отличия относительно группы контроля;
#
- статистически значимые отличия относительно группы L-NAME (25 мг/кг);
▲
– статистически значимые отличия относительно группы L-NAME (200 мг/кг)
Таблица 12
Изменения флуоресценции битирозина и триптофана тимоцитов крыс в условиях
модулирования синтеза оксида азота, ед. фл./г белка (Ме [min; max])
экспериментальная модель
Флуоресценция
Флуоресценция
битирозина
триптофана
контроль
88,0 [37,8; 111,1]
22,2 [15,1; 27,6]
L-аргинин (5 мМ)
19,6 [18,5; 23,1]*
р=0,008
13,9 [13,9; 27,8]*
р=0,007
L-NAME (5 мМ)
18,5 [15,7; 22,2]
8,4 [5,6; 13,9]*
р=0,033
Примечание: * - статистически значимые отличия относительно группы контроля;
^ - статистически значимые отличия относительно группы L-аргинин, р<0,05
В условиях in vivo и in vitro-моделирования синтеза оксида азота
флуоресценция битирозина не изменяется, однако повышается для триптофана.
Устойчивость
триптофана
при
действии
L-аргинина
может
объясняться
91
труднодоступностью индольного кольца для повреждающего агента. Процессу
нитрозилирования могут помешать функциональные группы аминокислот,
которые окружают остатки триптофана в первичной структуре белка.
Сайт-специфическое нитрозилирование тирозина сочетается с изменением
функций протеинов и развитием NO-зависимого окислительного стресса
(нитрозативного стресса). Выделяют несколько механизмов нитрозилирования
тирозиновых остатков белков, а именно: пероксонитритный (классический),
пероксидазный (энзиматический) и гем-пероксидазный (неэнзиматический) [184].
Важно отметить,
что для нитрозилирование
тирозина
необходимы
следующие условия:
- недостаток остатков цистеина,
- отсутствие пространственных преград.
Кроме этого нитрозилирование протеинов в организме животных связано с
оксидативным стрессом [4], который, по данным полученных результатов, под
действием субстрата синтеза NO не развивается.
3.3 Оценка состояния лизосомального цистеинового протеолиза
Протеолитические системы способны удалять поврежденные белки, именно
поэтому их рассматривают как вторичные антиоксидантные системы [35].
Изучение активности протеаз в условиях окислительного стресса важно для
понимания процесса обновления белков.
Лизосомы долгое время считались устойчивыми компартментами клетки,
выход гидролитических ферментов за их пределы происходит во время апотоза
или некроза [159]. На сегодняшний день является доказанным тот факт, что
лизосомы очень чувствительны к дестабилизирующим факторам. Подробно
описан процесс пермеабилизации лизосомальной мембраны, сопровождающийся
высвобождением в цитозоль катепсинов [38]. Поэтому, наиболее показательной
является
раздельная
лизосомальной
оценка
изменений
(седиментируемой),
(неседиментируемой) фракции.
а
активности
так
и
во
катепсинов
как
в
внелизосомальной
92
Внутрибрюшинное введение L-NAME в дозе 25 мг/кг и 200 мг/кг
лабораторным животным в течение 7 дней приводит к увеличению общей
активности катепсина В селезенки относительно контроля за счет увеличения
неседиментируемой активности (рис.51).
Примечание: * -статистически значимые отличия от группы контроля (р<0,05)
Рис. 51. Активность катепсина В селезенки в условиях in vivoмоделирования дефицита синтеза оксида азота
В условиях in vivo-моделирования дефицита синтеза оксида азота общая
активность катепсинов L и Н селезенки статистически значимо повышается
относительно контроля при дозе ингибитора в дозе 25 мг/кг за счет
неседиментируемой активности, а при дозе 200 мг/кг еще и седиментируемой
активности.
Общая активность лизосомальных протеиназ L и Н возрастает с
увеличением дозы ингибитора (рис. 52).
Примечание: * - статистически значимые отличия относительно группы контроля;
# -статистически значимые отличия относительно группы L-NAME (25 мг/кг)
Рис. 52. Активность катепсинов L и Н (нмоль/схг белка) селезенки в
условиях in vivo-моделирования дефицита синтеза оксида азота
93
Активность катепсинов В, L, Н тимуса не изменилась относительно
значений контрольной группы под действием L-NAME в дозе 25 мг/кг (рис. 53,
54). Внутрибрюшинное введение L-NAME в дозе 200 мг/кг приводит к
увеличению общей активности катепсинов В, L, Н, за счет увеличения
неседиментируемой и седиментируемой активностей относительно значений
контрольной
группы.
Кроме
этого,
отмечается
увеличение
общей,
неседиментируемой и седиментируемой активности катепсинов В, L, Н в группе
L-NAME в дозе 200 мг/кг относительно значений группы L-NAME в дозе 25
мг/кг, значит данные изменения носят дозозависимый характер (рис. 53, 54).
Примечание: * - статистически значимые отличия относительно группы контроля;
#-статистически значимые отличия относительно группы L-NAME (25 мг/кг)
Рис. 53. Активность катепсина В тимуса в условиях in vivoингибирования синтеза оксида азота
Примечание: * - статистически значимые отличия относительно группы контроля;
# -статистически значимые отличия относительно группы L-NAME (25 мг/кг)
Рис. 54. Активность катепсинов L и Н
ингибирования синтеза оксида азота
тимуса в условиях in vivo-
94
Внутрижелудочное введение L-аргинина в дозе 500 мг/кг в течение 10 дней
не вызывало статистически значимых изменений активности катепсинов В, L, Н
селезенки и тимуса: значения неседиментируемой, седиментируемой и общей
активностей близки к значениям данных показателей контрольной группы (рис.
55, 56).
Совместное введение L-аргинина и L-NAME (25 мг/кг) способствует
статистически значимому увеличению общей и неседиментируемой, активности
катепсинов L и Н селезенки относительно контроля (рис. 57), то есть в условиях
данной экспериментальной модели эффект L-NAME сохраняется.
Рис. 55. Активность катепсинов В, L и Н селезенки в условиях in vivoстимуляции синтеза оксида азота
Рис. 56. Активность катепсинов В, L и Н тимуса в условиях in vivoстимуляции синтеза оксида азота
95
Примечание: * - статистически значимые отличия относительно группы контроля
Рис. 57. Активность катепсинов L и Н селезенки в условиях
корригирующего действия L-аргинина при действии L-NAME (25 мг/кг)
При этом, при использовании L-NAME (25 мг/кг) на фоне L-аргинина неседиментируемая и общей активность катепсинов L и Н снижается относительно
группы L-NAME (25 мг/кг), оставаясь выше относительно значений группы Lаргинин (рис. 58).
Примечание: # - статистически значимые отличия от группы L-NAME 25 мг/кг (р < 0,05);
^ - статистически значимые отличия от группы L-аргинин (р < 0,05)
Рис. 58. Активность катепсинов L и Н селезенки экспериментальных
групп L-аргинин, L-NAME (25 мг/кг), L-NAME (25 мг/кг) на фоне Lаргинина
Стоит отметить, что общая активность катепсина В селезенки группы,
получавшей L-NAME (25 мг/кг) на фоне L-аргинина, статистически значимо не
отличается от контрольной группы (рис. 59) и группы L-аргинин (рис. 60), но
статистически достоверно ниже значений группы
снижения неседиментируемой активности (рис. 60).
L-NAME 25 мг/кг за счет
96
Рис. 59. Активность катепсина В Примечание: # - статистически значимые
селезенки в условиях корригирующего отличия от группы L-NAME 25 мг/кг (р < 0,05)
Рис. 60. Активность катепсина В
действия L-аргинина при действии Lселезенки экспериментальных групп
NAME (25 мг/кг)
L-аргинин, L-NAME (25 мг/кг), L-NAME
(25 мг/кг) на фоне L-аргинина.
Что касается влияния L-NAME в дозе 200 мг/кг на фоне L-аргинина, то
отмечается следующая тенденция для катепсинов В и Н селезенки: значение
общей активности не изменяется относительно группы контроля (рис. 60).
Рис. 61. Активность катепсинов В и Н селезенки в условиях
корригирующего действия L-аргинина при действии L-NAME (200 мг/кг)
Под влиянием L-NAME (200 мг/кг) на фоне L-аргинина общая и
неседиментируемая
активность катепсина В селезенки выше относительно
значений
L-аргинина,
группы
а
неседиментируемая
активность
ниже
относительно значений группы L-NAME (200 мг/кг). Неседиментируемая,
седиментируемая и общая активность катепсина Н селезенки при введении L-
97
NAME (200 мг/кг) на фоне L-аргинина статистически значимо снижается
относительно значений группы L-NAME (200 мг/кг) (рис. 62).
Примечание:▲–статистически значимые отличия от группы L-NAME 200 мг/кг (р < 0,05);
^ - статистически значимые отличия от группы L-аргинин (р < 0,05)
Рис. 62. Активность катепсинов В и Н селезенки экспериментальных
групп L-аргинин, L-NAME (200 мг/кг), L-NAME (200 мг/кг) на фоне Lаргинина
Значения общей, неседиментируемой и седиментируемой активности
катепсина L селезенки в условиях воздействия L-NAME (200 мг/кг) на фоне Lаргинина статистически достоверно выше относительно значений группы
контроля (рис. 63) и группы L-аргинина (рис. 64), но ниже – L-NAME (200 мг/кг)
(рис. 64).
Примечание: * - статистически значимые Примечание:▲–статистически
значимые
отличия относительно группы контроля
отличия от группы L-NAME 200 мг/кг;
Рис. 63. Активность катепсина L ^- статистически значимые отличия от группы
селезенки в условиях корригирующего L-аргинин (р < 0,05)
действия L-аргинина при действии LРис. 64. Активность катепсина L
NAME (200 мг/кг)
селезенки экспериментальных групп
L-аргинин, L-NAME (200 мг/кг), LNAME (200 мг/кг) на фоне L-аргинина
98
Значения
общей,
неседиментируемой
и
седиментируемой
активностей
катепсинов В, L, Н тимуса после применения L-NAME в дозе 25 мг/кг или 200
мг/кг на фоне L-аргинина не имеют статистически значимых отличий от значений
группы контроля (рис. 65, 66).
Рис. 65. Активность катепсина В тимуса в условиях корригирующего
действия L-аргинина при действии L-NAME
Рис. 66. Активность катепсинов L и Н тимуса в условиях
корригирующего действия L-аргинина при действии L-NAME
Рис. 67. Активность катепсина В тимуса экспериментальных групп
L-аргинин, L-NAME (25 мг/кг), L-NAME (25 мг/кг) на фоне L-аргинина
99
Неседиментируемая, седиментируемая и общая активность катепсинов
В, L и Н тимуса группы сочетанного применения L-NAME (25 мг/кг) и Lаргинина не изменяется относительно значений группы L-NAME (25 мг/кг) и
L-аргинин (рис. 67, 68).
Рис. 68. Активность катепсина L и Н тимуса экспериментальных групп
L-аргинин, L-NAME (25 мг/кг), L-NAME (25 мг/кг) на фоне L-аргинина
В условиях сочетанного применения L-NAME (200 мг/кг) и L-аргинина
неседиментируемая и общая активность катепсинов В, L, Н тимуса статистически
значимо снижается относительно значений группы L-NAME (200 мг/кг) (рис. 69,
70).
Примечание:▲–статистически значимые отличия от группы L-NAME 200 мг/кг
Рис. 69. Активность катепсина В тимуса экспериментальных групп
L-аргинин, L-NAME (200 мг/кг), L-NAME (200 мг/кг) на фоне L-аргинина
100
Примечание:▲–статистически значимые отличия от группы L-NAME 200 мг/кг
Рис. 70. Активность катепсинов L и Н тимуса экспериментальных
групп L-аргинин, L-NAME (200 мг/кг), L-NAME (200 мг/кг) на фоне Lаргинина
В условиях in vitro-моделирования дополнительного синтеза оксида азота
статистически значимых различий активности катепсинов В, L и Н спленоцитов и
тимоцитов относительно значений контрольной группы отмечено не было (рис.
71, 72).
Рис. 72. Активность катепсинов
Рис. 71. Активность катепсинов
В, L и Н спленоцитов в условиях in В, L и Н тимоцитов в условиях in
vitro-моделирования синтеза оксида vitro-моделирования синтеза оксида
азота
азота
В условиях in vitro-моделирования дефицита синтеза оксида азота
отмечается
однонаправленная
тенденция
для
спленоцитов
и
тимоцитов:
увеличение общей активности катепсинов L и Н относительно значений
контрольной группы (рис. 73, 74).
101
Примечание: * - статистически значимые Примечание: * - статистически значимые
отличия от контрольной группы (р < 0,05)
отличия от контрольной группы (р < 0,05)
Рис. 74. Активность катепсинов В, L
Рис. 73. Активность катепсинов
В, L и Н спленоцитов в условиях in и Н тимоцитов в условиях in vitrovitro-моделирования
дефицита моделирования дефицита синтеза оксида
азота
синтеза оксида азота
Проведенные нами исследования показали, что активность различных
тиоловых протеиназ в условиях моделирования дефицита синтеза оксида азота
изменяется в одинаковой степени: общая активность катепсинов В, L и Н
иммуннокомпетентных
органов
увеличивается
преимущественно
за
счет
внелизосомальной активности.
Для обеспечения физиологических процессов цистеиновые протеиназы
способны секретироваться в цитозоль и выполнять функции за пределами
лизосом, а значит, изменение активности катепсинов может происходить в
результате их секреции. Следует отметить, что в связи с нарушением целостности
мембран лизосом катепсины также оказываются в цитоплазме. Доказано, что
мембрана
лизосом
играет
чрезвычайно
важную
роль
в
регуляции
компартментализации лизосомальных цистеиновых протеиназ [22, 36, 57].
Таким
образом,
выход
катепсинов
за
пределы
лизосом
может
осуществляться по двум причинам: изменение степени секреции и изменение
общей проницаемости мембраны. Относительное распределение фермента между
лизосомальной
и
внелизосомальной
фракциями,
а
также
проницаемость
мембраны для отдельных гидролаз косвенно характеризует коэффициент
лабильности.
102
Почти все ферменты лизосомального матрикса и большинство ферментов,
встроенных в мембрану лизосом, относятся к группе кислых гидролаз. К наиболее
изученным ферментам относится кислая фосфатаза, которая считается маркерным
ферментом лизосом [36].
В условиях моделирования дефицита синтеза оксида азота, выход
катепсинов в цитозоль, возможно, происходит за счет повреждения мембраны, о
чем свидетельствует увеличение коэффициента лабильности кислой фосфатазы
(рис. 75). В условиях моделирования дополнительного синтеза оксида азота
повреждение мембраны не отмечается (рис. 75).
Примечание: * - статистически значимые отличия от контрольной группы (р < 0,05);
#
- статистически значимые отличия от группы L-NAME 25 мг/кг (р < 0,05)
Рис.75. Коэффициент лабильности лизосомальной мембраны селезенки и
тимуса в условиях in vivo-модулирования синтеза оксида азота
Известно, что катепсины синтезируются на рибосомах в виде препроэнзима,
который после прохождения через эндоплазматическую сеть отделяется и
проходит процесс созревания активных катепсинов [16, 104, 234]. Для всех
лизосомальных протеиназ в процессе активации ключевым моментом является
лимитированный протеолиз пропептида, который происходит под действием
других протеиназ [16]. Наряду с ограниченным протеолизом, рассматривают и
103
аутокаталитическую активацию лизосомальных протеиназ.
К
настоящему
времени аутокаталитический механизм активации был описан для многих
цистеиновых протеиназ, в том числе и для катепсинов В [86], L [73], Н [16].
С целью оценки степени аутокаталитической активации в условиях in vivoи in vitro-модулирования синтеза оксида азота проведен сравнительный анализ
коэффициента аутокаталитического действия (Касa) катепсинов В, L, Н селезенки
и тимуса крыс. Результаты изучения активации лизосомальных цистеиновых
протеиназ показывают, что неселективный ингибитор индуцибельной NOсинтазы – L-NAME влияет in vivo на аутопроцессинг данной группы ферментов
(табл. 13, 14). Это свидетельствует, что в условиях моделирования дефицита
синтеза оксида азота, организм испытывает функциональную потребность в
протеиназах.
Однако, в условиях стимулирования дополнительного синтеза оксида азота
in vivo, значения Касa селезенки и тимуса статистически значимо не изменяется
относительно значений контрольной группы. В условиях сочетанного применения
L-NAME на фоне L-аргинина проявляется корригирующее действие субстрата
синтеза NO: значение коэффициента аутокаталитического действия ниже
относительно значений групп контроля и группы L-аргинин, но выше
относительно группы L-NAME (табл. 13, 14).
104
Таблица 13
Значение коэффициента аутокаталитического действия катепсинов B, L, H селезенки в условиях
in vivo- модулировании синтеза NO (Ме [min; max])
экспериментальная
модель
Касa
катепсина В
Касa
катепсина L
Касa
катепсина H
НСА
СА
НСА
СА
НСА
СА
контроль 1
1,32 [1,24; 1,62]
1,15 [1,02; 1,25]
1,15 [1,02; 1,36]
1,10 [0,85; 1,20]
1,05 [0,75; 1,35]
0,92 [0,75; 1,10]
L-NAME (25 мг/кг)
0,48 [0,31; 0,76]*
*р=0,001
0,97 [0,31; 1,24]#
#
p=0,010
0,46 [0,36; 1,12]*
*р=0,007
1,11 [0,97; 2,04]#
#
p=0,015
0,55[0,33;0,64]*
*р=0,001
1,06 [0,65; 1,69]#
#
p=0,001
0,45 [0,27; 0,91]*
*р=0,001
0,97 [0,79; 1,83]#
#
p=0,001
контроль 2
1,28[1,07; 1,59]
1,12[0,94;1,45]
1,12[0,96; 1,33]
1,02[0,73; 1,19]
0,41[0,25; 0,57]*
*р=0,004
0,85 [0,53; 0,90]*#
*р=0,031
#
p=0,001
1,08[0,69; 1,39]
0,35 [0,29; 0,82]*
*р=0,015
0,73 [0,59; 1,66]*#
*р=0,018
#
p=0,001
0,98[0,71;1,09]
L-аргинин (500 мг/кг)
1,18[1,05; 1,36]
1,16[1,11;1,43]
1,14 [1,11;1,73]
1,22[1,06; 1,9]
0,72[0,19;1,48]
1,06[1,15;1,41]
контроль 3
1,32 [1,02; 1,64]
1,12 [0,94; 1,25]
1,21 [1,02; 1,42]
1,71 [1,51; 1,75]
1,05 [0,75; 1,24]
0,22 [0,19; 1,04]
0,91 [0,67; 1,02]*^#
*р=0,013
^ p=0,008
#
p=0,014
1,06 [0,91; 1,31]
0,88 [0,78;0,96]*^#
*р=0,05
^ p=0,008
#
p=0,045
0,95 [0,75; 1,23]
0,86[0,74;1,46]*^#
*р=0,004
^ p=0,006
#
p=0,004
1,12 [0,88; 1,40]
1,46 [1,32;1,67]*^#
*р=0,004
^ p=0,006
#
p=0,004
1,06 [0,77; 1,11]
0,21 [0,17; 0,82]
0,22 [0,19; 1,04]
0,51 [0,21; 0,96]
0,51 [0,25; 084]
L-NAME (200 мг/кг)
L-NAME (25 мг/кг) +
L-аргинин (500 мг/кг)
L-NAME (200 мг/кг) +
L-аргинин (500 мг/кг)
Примечание: * - статистически значимые отличия относительно группы контроля (р < 0,05);
# -статистически значимые отличия относительно группы L-NAME (25 мг/кг) (р < 0,05);
^ - статистически значимые отличия относительно группы L-аргинин (р < 0,05)
105
Таблица 14
Значение коэффициента аутокаталитического действия катепсинов B, L, H тимуса в условиях
in vivo- модулировании синтеза NO (Ме [min; max])
экспериментальная
модель
Касa
катепсина В
контроль 1
НСА
1,11 [1,01; 1,21]
СА
1,03 [0,79; 1]
L-NAME (25 мг/кг)
1,23 [0,97; 1,29]
1,4 [0,97; 2,58]
L-NAME (200 мг/кг)
1,07 [0,23;1,14]#
#
p=0,03
Касa
катепсина L
Касa
катепсина H
СА
1,08 [0,95; 1,14]
НСА
0,82 [0,79; 0,86]
СА
0,66 [0,62; 0,70]
0,94 [0,71; 1,14]
0,73 [0,65; 0,84]
0,64 [0,61; 0,67]
1,22 [0,73; 1,48]
НСА
1,02 [0,96;
1,15]
1,05 [0,75;
1,43]
0,85 [0,45;1,22]
1,1 [0,63; 1,15]
1,0 [1; 1,24]
1,0 [0,74; 1]
1,01 [0,93; 1,1]
1,01 [0,93; 1,1]
0,41[0,26;0,77]*#
*р=0,011
#
p=0,011
0,85 [0,80; 0,89]
0,42 [0,39; 0,46]*#
*р=0,003
#
p=0,045
0,65 [0,61; 0,72]
L-аргинин (500 мг/кг)
1,02 [0,27; 2,67]
1,28 [0,2; 1,2]
1,21 [0,34; 1,83]
0,94 [0,11; 1,05]
0,92 [0,30; 1,5]
контроль 3
1,02 [1,0; 1,16]
1,08 [0,74; 1,1]
0,87 [0,18;
1,17]
1,05 [0,98; 1,2]
1,03 [0,96; 1,17]
0,89 [0,79; 0,88]
0,62 [0,59; 0,69]
L-NAME (25 мг/кг) +
L-аргинин (500 мг/кг)
L-NAME (200 мг/кг) +
L-аргинин (500 мг/кг)
1,27 [1,06; 4,9]
1,28 [0,32; 4,67]
0,75 [0,38;1,42]
0,99 [0,36; 2,36]
0,68 [0,33; 0,76]
0,56 [0,24; 0,83]
1,37 [0,5; 2,0]*
*p=0,045
2,95 [1,97; 4,43]*
*p=0,015
0,85 [0,45;1,22]
1,1 [0,63; 1,15]
0,41 [0,26; 0,77]*
*p=0,03
0,42 [0,39; 0,46]*
*p=0,035
контроль 2
Примечание: * - статистически значимые отличия относительно группы контроля (р < 0,05);
# -статистически значимые отличия относительно группы L-NAME (25 мг/кг) (р < 0,05);
^ - статистически значимые отличия относительно группы L-аргинин (р < 0,05)
106
В условиях in vitro-модулирования синтеза оксида азота наблюдается
одинаковая тенденция изменения коэффициента аутокаталитического действия
катепсинов В, L, Н спленоцитов (табл. 15) и тимоцитов (табл. 16): в условиях
инкубации
в
полной
питательной
среде
с
L-аргинином
–
повышение
коэффициента, а в условиях инкубирования в полной питательной среде с LNAME – снижение коэффициента аутокаталитического действия относительно
значений контроля и группы L-аргинина.
Таблица 15
Значение коэффициента аутокаталитического действия катепсинов B, L, H
спленоцитов в условиях in vitro-модулировании синтеза NO (Ме [min; max])
Касa
катепсина В
Касa
катепсина L
Касa
катепсина H
Контроль
1,85 [1,82; 2,05]
1,56 [1,39; 1,65]
1,74 [1,64; 2,08]
L-аргинин
5 мМ
2,03 [1,73; 2,14]*
*р=0,002
1,70 [1,39; 1,97]*
*р=0,045
4,01 [3,78; 4,11]*
*р=0,001
L-NAME
5 мМ
0,27 [0,19; 0,33]*^
0,77 [0,51; 1,06]*^
0,47 [0,22; 0,62]*^
*р=0,02
*р=0,015
*р=0,03
^p=0,001
^p=0,01
^p=0,001
Примечание: * -статистически значимые отличия от группы контроля (р<0,05)
^ - статистически значимые отличия от группы L-аргинин (р<0,05)
Таблица 16
Значение коэффициента аутокаталитического действия катепсинов B, L, H
тимоцитов в условиях in vitro-модулировании синтеза NO (Ме [min; max])
Касa
катепсина В
Касa
катепсина L
Касa
катепсина H
Контроль
1,15 [1,11; 1,25]
1,06 [1,06; 1,20]
1,09 [1,00; 1,20]
L-аргинин
5 мМ
1,57 [1,14; 1,80]*
*р=0,03
1,21 [1,13; 1,33]*
*р=0,05
1,13 [1,06; 1,53]*
*р=0,02
L-NAME
5 мМ
0,52 [0,37; 0,70]*^
0,50 [0,08; 0,59]*^
0,68 [0,38; 1,12]*^
*р=0,035
*р=0,002
*р=0,03
^p=0,003
^p=0,003
^p=0,02
Примечание: * -статистически значимые отличия от группы контроля (р<0,05)
^ - статистически значимые отличия от группы L-аргинин (р<0,05)
В регуляции активности лизосомальных цистеиновых протеаз принимает
участие ингибитор цистатин. В условиях модулирования синтеза оксида азота
количество
цистатина С тимуса и селезенки статистически значимо не
107
изменилось в экспериментальных группах относительно значений контрольной
группы (табл. 17).
Таблица 17
Количество цистатина С (нг/мг белка) тимуса и селезенки крыс в условиях in
vivo- модулировании синтеза NO (Ме [min; max])
экспериментальная модель
тимус
селезенка
контроль 1
18,03 [16,1; 26,5]
12,6 [8,8; 16,3]
L-NAME (25 мг/кг)
20,4 [17,7; 30,9]
12,35 [7,7; 22,7]
L-NAME (200 мг/кг)
23,9 [13,0; 58,5]
17,6 [15,9; 19,81]
контроль 2
17,9 [16,9; 25,1]
13,9 [8,1; 18,7]
L-аргинин (500 мг/кг)
21,5 [7,8; 47,9]
14,9 [7,4; 19,3]
контроль 3
19,52 [14,9; 36,8]
13,2 [7,4; 16,8]
L-NAME (25 мг/кг) +
20,55 [13,8; 52,1]
12,9 [4,8; 17,2]
21,31 [15,2; 48,4]
13,1 [5,2; 18,4]
L-аргинин (500 мг/кг)
L-NAME (200 мг/кг) +
L-аргинин (500 мг/кг)
Увеличение активности тиоловых протеиназ, очевидно, не связано с
изменением количества цистатина С, но может объясняться нарушением
структурно-функциональных особенностей молекулы
цистатина в условиях
модулирования синтеза оксида азота.
При анализе полученных данных были выявлены прямые корреляционные
связи между общей площадью под кривой окислительной модификации белков и
общей активностью катепсина L и Н селезенки под влиянием L-NAME в условиях
in vivo (табл. 18) и in vitro (табл. 19). Данная тенденция свидетельствует о
существовании взаимосвязи процессов окислительного повреждения белков и
лизосомального цистеинового протеолиза в условиях дефицита синтеза оксида
азота.
108
Таблица 18
Коэффициенты корреляции (R) селезенки и тимуса между общим
содержанием карбонильных производных белков и общей активностью
катепсинов В, L и Н в условиях in vivo- изменения синтеза NO
Контроль
L-NAME
25 мг/кг
L-NAME
200 мг/кг
L-аргинин
L-NAME
(25 мг/кг)
+ L-аргинин
L-NAME
(200 мг/кг)
+ L-аргинин
катепсин В
селезенка
тимус
0,36
0,24
0,21
0,64
0,38
-0,20
0,19
-0,05
0,31
катепсин L
селезенка
тимус
0,55
-0,33
0,095
0,16
-0,20
-0,57
-0,61
0,62*
р=0,01
-0,14
-0,11
-0,26
0,33
катепсин Н
селезенка
тимус
0,55
-0,024
0,41
0,02
-0,10
0,27
0,39
0,67*
р=0,037
0,071
0,36
0,63
-0,095
0,51
0,21
0,23
Таблица 19
Коэффициенты корреляции (R) селезенки и тимуса между общим содержанием
карбонильных производных белков и общей активностью катепсинов В, L и Н в
условиях in vitro- изменения синтеза NO
Контроль
L-NAME
5 мМ
L-аргинин
5 мМ
катепсин В
спленоциты тимоциты
0,56
0,40
-0,50
0,80
-0,87
катепсин L
спленоциты тимоциты
0,50
-0,62
0,60
0,95*
р=0,02
-0,60
0,20
-0,60
катепсин Н
спленоциты тимоциты
0,50
0,20
0,87
0,90*
р=0,02
-0,50
-0,60
Таким образом, активность лизосомальных цистеиновых протеиназ в
условиях
моделирования
дефицита
синтеза
оксида
азота
нарастает
и
сопровождается выходом катепсинов в цитоплазму за счет повреждения
лизосомальной мембраны. Важно отметить, что изменение уровня оксида азота
влияет на аутопрцессинг катепсинов В, L, Н, что имеет важное функциональное
значение. Кроме этого, процесс карбонилирования белков и активация
лизосомальных цистеиновых протеиназ L и Н селезенки взаимосвязаны.
109
ЗАКЛЮЧЕНИЕ
В
силу
физико-химических
свойств
оксид
азота
выполняет
роль
универсального биологического месседжера. Универсальность действия NO
проявляется
в
способности
регулировать
многие
физиологические
и
патофизиологические процессы. Однако, при рассмотрении конкретного действия
отмечается двойственность проявления эффектов, например, оксид азота
способен как индуцировать [9, 172], так и ингибировать
окислительные
процессы [170, 196]. Этот факт и ряд других причин позволяют называть
молекулу NO «двуликим Янусом» [172, 176]. В связи с этим, существует две
стороны проблемы изучения биологии оксида азота в организме: исследование
эффектов избыточной и недостаточной продукции данного вещества [9].
Обнаружение эндогенных ингибиторов синтеза оксида азота привлекает
повышенное внимание к проблеме дефицита его образования. По этой причине, в
нашем исследовании было изучено влияние N-нитро-L-аргининметилового эфира
(L-NAME), представляющего экзогенный аналог эндогенного ингибитора NOсинтаз
ассиметричного
карбонильного
статуса
N,N-диметиларгинина
(ADMA),
и
цистеинового
лизосомального
на
состояние
протеолиза
иммуннокомпетентных органов.
При оценке состояния карбонилированных белков в исследуемых моделях
применяли разработанный нами способ комплексной оценки окислительной
модификации белков в тканях и биологических жидкостях, предоставляющий
возможность более полного анализа полученных результатов. В условиях LNAME-индуцированного дефицита синтеза оксида азота in vivo и in vitro общее
содержание карбонилированных протеинов в селезенке нарастает. При этом для
ткани тимуса in vivo применение L-NAME не оказало влияния ни на
концентрацию метаболитов оксида азота, ни на количество карбонильных
производных белков. Однако, оказалось, что изолированные тимоциты реагируют
на воздействие L-NAME in vitro: изменения концентрации метаболитов оксида
азота и общего содержания карбонильных производных белков аналогичны
обнаруженным
для
селезенки.
Таким
образом,
отсутствие
изменений
110
обсуждаемых показателей в тимусе in vivo может быть обусловлено малой
биодоступностью препарата для данного органа, например, вызванной его
капсулярным строением. Известно, что одним из основных путей образования
модифицированных белков является прямое воздействие окислителей на
аминокислотные остатки боковых радикалов [78]. Вероятно, в условиях дефицита
синтеза оксида азота в спленоцитах и тимоцитах ведущей мишенью для
повреждения
становятся остатки аминокислот, обладающие основными
свойствами, о чем свидетельствует обнаруженное нами нарастание содержания
альдегид- и кетон-динитрофенилгидразонов основного характера.
Оксид азота относят к числу систем неферментативного контроля уровня
активных форм кислорода [48], возможно, именно поэтому, в условиях
моделирования
дефицита
синтеза
NO
главным
повреждающим
агентом
становятся активные формы кислорода. Кроме того, обнаруженные изменения
могут быть следствием
описанного для аналогичной модели [207] снижения
активности антиоксидантной системы с нарушением баланса между процессами
генерации и дезактивации активных форм кислорода.
Косвенная оценка возможностей антиоксидантной защиты белков может
быть осуществлена с использованием показателя резервно-адаптационного
потенциала [26, 52]. Нами обнаружено, что под влиянием L-NAME значение
резервно-адаптационного потенциала в тимусе и селезенке снижается, что может
не только свидетельствовать об истощеннии антиоксидантных систем, но и
демонстрировать доступность белковых молекул к повреждающему действию,
обусловленную денатурацией молекул [17].
Исследование соотношения первичных (АДНФГ) и вторичных (КДНФГ)
маркеров
окислительного
стресса
дает
возможность
оценить
стадию
и
потенциальную обратимость развития окислительного стресса [52, 53]. Так, под
влиянием L-NAME в спленоцитах и ткани селезенки наблюдается увеличение
доли вторичных маркеров окислительного стресса относительно значений
контрольной группы, что свидетельствует об усугублении окислительного стресса
и переходе его в позднюю стадию. Однако, в тимоцитах, несмотря на нарастание
111
общего количества карбонильных производных белков, соотношение первичных
и вторичных маркеров не изменяется относительно контроля, что может
подтверждать тезис о высоких адаптационных способностях тимуса [14].
Внутриклеточный уровень окисленных белков отражает баланс между
процессами формирования карбонильных белков и степенью их деградации
протеолитическими системами [12]. Существует предположение, что появление
на поверхности белковых молекул гидрофобных групп является пусковым
фактором повышения протеолитической чувствительности [17]. Известно, что
протеиназы, разрушающие окисленные белки, более селективны к поврежденным
основным аминокислотным остаткам [105], нарастание которых было нами
обнаружено в условиях дефицита синтеза оксида азота.
Для
оценки
вклада
лизосомального
протеолиза
в
метаболизм
модифицированных белков нами было предпринято изучение активности
катепсинов в условиях изменения уровня метаболитов синтеза оксида азота.
В условиях in vivo- и in vitro-ингибирования синтеза NO общая активность
лизосомальных цистеиновых протеиназ (катепсинов В, L, Н) возрастает.
Исследование
in
vivo
показывают,
что
данное
нарастание
происходит
преимущественно за счет внелизосомальной фракции. Представленный факт
указывает на то, что одним из эффектов L-NAME является увеличение выхода
лизосомальных протеиназ в цитоплазму. Данный феномен может происходить по
двум причинам: благодаря секреции сквозь лизосомальную мембрану или её
повреждению [22, 36, 57].
Внутриклеточное высвобождение лизосомальных
ферментов вследствие лабилизации мембраны отражает повреждения лизосом
[38]. Почти все ферменты лизосомального матрикса и большинство ферментов,
встроенных в мембрану лизосом, относятся к группе кислых гидролаз. К наиболее
изученным ферментам относится типичный маркерный фермент лизосом - кислая
фосфатаза, большая часть активности которой связана с лизосомами [36]. Для
оценки причины нарастания активности катепсинов в цитоплазме был произведен
анализ коэффициента доли внелизосомальной фракции в общей активности
кислой фосфатазы как показатель повреждения лизосомальной мембраны [36].
112
Под влиянием L-NAME доля внелизосомальной фракции в общей
активности кислой фосфатазы увеличивалась. Полученные результаты дают
основание утверждать, что в условиях дефицита синтеза оксида азота происходит
повреждение лизосомальной мембраны, возможно, вследствие атаки активными
формами
и
окисления
структурных
белков
мембраны.
Дестабилизация
(лабилизация) лизосомальной мембраны проявляется в виде ее разрывов и
сопровождается выходом ферментов в цитозоль [38], что может являться одной из
причин нарастания активности катепсинов в цитоплазматической фракции.
Кроме того, при экспериментальном моделировании дефицита синтеза
оксида азота, увеличение общей активности катепсинов может объясняться
повышенной функциональной потребностью в протеолизе в ответ на нарастание
количества поврежденных белков. Эти данные были подтверждены и дополнены
результами
полученной
корреляционной
взаимосвязи
между нарастанием
карбонильных производных белков и активностью катепсинов L и Н селезенки
под
влиянием
L-NAME.
Таким
образом,
при
снижении
концентрации
метаболитов оксида азота активность катепсинов B, L и уровнь карбонильных
производных белков тесно взаимосвязаны.
Регуляция активности лизосомальных протеиназ осуществляется на уровне
транскрипции и трансляции, а также посттрансляционного процессинга по пути
активации зимогена и ингибирования эндогенными белковыми ингибиторами
[104].
Катепсины синтезируются на рибосомах в виде препроэнзима [234],
поэтому можно предположить, что в условиях моделирования дефицита синтеза
оксида азота нарастание общей активности изучаемых ферментов объясняется
стимуляцией их биогенеза. Затем препептиды удаляются во время прохождения
молекул
через
эндоплазматический
ретикулум,
где
происходит
посттрансляционная модификация, например, образование дисульфидных связей.
В лизосомах при кислом рН прокатепсины подвергаются протеолитическому [16,
146, 157] или аутокаталитическому процессингу [16, 73, 86] с образованием
зрелой активной формы фермента. Аутокаталитическая активация представляет
113
собой бимолекулярный процесс, при котором одна из молекул катепсина
активирует другую по типу цепной реакции [104].
В условиях моделирования дефицита синтеза оксида азота, значение
коэффициента аутокаталитического действия статистически значимо снижается
относительно значений контрольной группы, что может указывать на меньшую
долю зимогенов и, как следствие, существование большей части протеиназ в
активном состоянии.
Основным фактором регуляции зрелых активных лизосомальных протеиназ
являются их эндогенные белковые ингибиторы, к которым относятся цистатины
[234]. Образование комплекса цистатина с протеиназами способствует искажению
структуры
активного
центра
фермента,
в
результате
чего
снижается
протеолитическая активность. Однако, полученные нами данные об отсутствии
изменения концентрации цистатина C в условиях моделирования дефицита
синтеза оксида азота подтверждают, что нарастание активности цистеиновых
протеиназ не связано с изменением ингибиторного влияния.
Совокупность
полученных
результатов
позволяет
рассматривать
вовлеченность лизосомальных протеиназ в процесс удаления карбонильных
производных белков, как один из возможных механизмов белкового оборота в
тканях. Однако, частично окисленные протеины могут подвергаться дальнейшему
окислению
с
последующим
формированием
агрегатов,
которые
могут
накапливаться в клетке [21, 31]. В этой ситуации процесс апоптоза может
выступать в качестве защитного механизма, в результате которого происходит
удаление нежелательных клеток. В регуляции апоптоза участвуют лизосомальные
цистеиновые протеиназы [8, 55, 223] и оксид азота [169]. Вышеуказанное
предположение согласуется с данными литературы [49] и подтверждается
полученными результатами: в условиях in vitro снижения концентрации
метаболитов оксида азота, повышения активности катепсинов и нарастания
количества карбонильных производных белков, а жизнеспособность спленоцитов
и тимоцитов снижается.
114
Исходя
из
вышеизложенного,
следует отметить,
что
конкурентное
подавление синтеза оксида азота влечет за собой формирование карбонилового
стресса и активацию цистеиновых протеиназ, а применение субстрата NOсинтазы с целью преодоления эффектов конкурентного ингибирования может
оказаться патогенетически оправданным.
В первую очередь, необходимо отметить проявление цитопротекторного и
цитотоксического эффекта оксида азота при изолированном применении Lаргинина. В условиях дополнительного синтеза оксида азота общее количество
модифицированных белков селезенки не изменяется, однако, повышается
содержание КДНФГ основного характера и снижается АДНФГ нейтрального
характера. Для тимуса в условиях данной экспериментальной модели отмечается
четкий
цитопротекторный
эффект
L-аргинина
–
снижение
содержания
карбонильных производных белков за счет АДНФГ и КДНФГ нейтрального
характера.
Полученные данные укладываются в представления о двойственности
действия молекулы NO, а также роли оксида азота и его метаболитов как
антиоксидантных агентов [172]. Избыток NO способен связываться с ионами Fe 2+,
низкомолекулярные динитрозильные комплексы негемового железа (ДНКЖ)
являются переносчиками NO, а белковые ДНКЖ – его стабильными депо [9, 58].
В
результате
образования
формирования
карбонильных
ДНКЖ,
вероятно,
производных
белков
снижается
по
возможность
металл-зависимому
механизму. Кроме этого, антиоксидантное действие NO может быть связано с его
способностью взаимодействовать с пероксильными и алкоксильными радикалами
липидов с образованием нитропроизводных [1].
Повреждающее действие оксида азота реализуется при взаимодействии с
супероксид-анион
радикалом,
с
образованием
сильного
окислителя
-
пероксонитрита (ONOO-), который подвергается детоксикации через эндогенные
антиоксидантные механизмы [206].
Из полученных результатов следует, что дополнительное введение Lаргинина не влияет на соотношение доли первичных и вторичных маркеров. Что
115
касается резервно-адаптационного потенциала, то наблюдается его снижение для
КДНФГ основного характера в селезенке. По-видимому, данный факт связан с
нарастанием количества динитрофенилгидразонов, но, которые, возможно, не
были удалены протеолитическими системами. Эти данные были подтверждены и
дополнены результатами по изучению активности лизосомальных протеиназ.
В условиях дополнительного синтеза оксида азота общая, седиментируемая
и
неседиментируемая
активности
катепсинов,
не
изменяются,
однако
коэффициент аутокаталитического действия возрастает, что еще раз указывает на
влияние разных уровней оксида азота на аутопроцессинг данной группы
ферментов тимоцитов и спленоцитов. Таким образом, полученные результаты
указывают на замедление созревания зимогенов, так как большая часть протеиназ
находится в неактивном состоянии. Представленный факт свидетельствует о том,
что в лизосомах происходит накопление прокатепсинов, поскольку протеолиз в
данных условиях менее востребован.
Корригирующее воздействие L-аргинина четко прослеживается в условиях
подавления синтеза оксида азота. Наиболее ярко данную тенденцию можно
рассмотреть на примере селезенки, так как влияние L-NAME на ткань тимуса in
vivo отмечено не было.
При сочетанном применении L-аргинина и L-NAME общая площадь под
кривой спектра поглощения карбонильных производных белков приближается к
контрольным значениям, что указывает на корригирующее действие L-аргинина.
При этом в условиях представленной экспериментальной модели сохраняется
повышение
общей
неседиментируемой
активности
активности,
катепсинов
L
описанное
и
Н
как
селезенки
эффект
за
счет
L-NAME.
Представленный факт характеризует лизосомальный протеолиз в качестве
первостепенного защитного механизма на подавление синтеза оксида азота, что,
вероятно, препятствует развитию окислительного стресса.
Таким образом, экспериментальные результаты проведенного исследования
свидетельствуют, что изменение уровня оксида азота влияет на формирование
карбонильных производных белков, соотношение доли первичных и вторичных
116
маркеров,
резервно-адаптационный
потенциал,
изменение
активности
лизосомальных цистеиновых протеиназ, а также на их аутокаталитический
процессинг.
Совокупность полученных результатов позволила обнаружить не
только взаимосвязь процессов повреждения белковых молекул с активацией
катепсинов, но и возможные уровни регуляции в условиях изменения уровня
метаболитов оксида азота.
Вышесказанное
позволяет
сделать
заключение
о
возможности
использования разработанного нами методологического подхода с целью оценки
общего состояния карбонильного статуса и поиска путей регуляции посредствам
воздействия на лизосомальный протеолиз.
117
ВЫВОДЫ
1. Подавление синтеза оксида азота конкурентным ингибитором N-нитро-Lаргининметиловым
карбонильных
эфиром
приводит
производных
к
нарастанию
белков
с
содержания
преобладанием
динитрофенилгидразонов основного характера селезенки и тимуса, при
этом наблюдается истощение резервно-адаптационного потенциала и
увеличение доли вторичных маркеров окислительного стресса.
2. В условиях дефицита синтеза оксида азота происходит активация
лизосомальных цистеиновых протеиназ В, L, Н селезенки и тимуса крыс,
сопровождаемая
их
выходом
в
цитоплазму
за
счет
повреждения
лизосомальной мембраны.
3. Воздействие субстрата синтеза оксида азота L-аргинина приводит к
снижению уровня карбонильных производных белков без изменения
активности катепсинов В, L, Н тимуса и селезенки крыс. Применение Lаргинина в условиях моделирования дефицита синтеза оксида азота
оказывает корригирующее воздействие на показатели окислительной
модификации белков, однако, для активности катепсинов сохраняется
эффект N-нитро-L-аргининметилового эфира.
4. Между
окислительным
карбонилированием
белков
и
активностью
лизосомальных цистеиновых протеиназ L и Н селезенки выявлена
положительная корреляционная связь в условиях моделирования дефицита
синтеза оксида азота.
118
СПИСОК УСЛОВНЫХ СОКРАЩЕНИЙ
АДНФГ – альдегид-динитрофенилгидразоны
АФА – активные формы азота
АФК – активные формы кислорода
АФК – активные формы кислорода
ВЭЖХ – высокоэффективная жидкостная хромотография
ГНЕ – 4-гидрокси-2-ноненаль
ДНКЖ – динитрозильные комплексы железа
еNOS – эндотелиальная NO-синтаза
ИФА – иммуноферментный анализ
кNOS – конститутивная NO-синтаза
КДНФГ – кетон-динитрофенилгидразоны
МДА – малоновый диальдегид
МНС (major histocompatibility complex) – комплекс гистосовместимости
ОМБ – окислительная модификация белков
рГЦ – растворимая гуанилатциклаза
ADMA – ассиметричный N,N-диметиларгинин
FcR (fragment crystallizable receptor) – Fc-рецептор
IL - интерлейкин
iNOS – индуцибельная NO-синтаза
L-NAME - Nω-нитро-L-аргининметиловый эфир
L-NNA - Nω-нитро-L-аргинин
NOS – NO-синтаза
NOх – оксиды азота
TLRs (Toll-like receptor) – толл-подобные рецепторы
TNFα (tumor necrosis factor) - фактор некроза опухоли
119
СПИСОК ЛИТЕРАТУРЫ
1. Антиоксидантное и прооксидантное действие доноров и метаболитов окиси
азота [Teкст] / Л.Л. Гудков [и др.] // Биофизика.- 2007.- Т.52, вып. 3.- С. 503-509.
2. Астаева,
М.Д.
Влияние
гипотермии
на
интенсивность
окислительной
модификации белков плазмы крови сусликов [Teкст] / М.Д. Астаева, В.Р.
Абдуллаев, Н.К. Кличханов // Проблемы криобиологии.- 2009.- Т.19, №3.- С. 254260.
3. Атеросклероз
и
окислительные
процессы.
Новые
способы
оценки
окислительных белков [Teкст] / Ю.И. Рагино [и др.] // Бюл. СО РАМН.- 2006.- №4
(122).- С. 67-74.
4. Блюм, Я.Б. Нітрування тирозину як регуляторна посттрансляційна модифікація
протеїнів [Teкст] / Я.Б. Блюм, Ю.А. Красиленко, А.I. Ємецъ // Укр. біохім. журн.2009.- Т.81, № 5. - С. 5-15.
5. Борискина, М.А.
Изменение активности лизосомальных цистеиновых
протеиназ у больных хроническими лейкозами в динамике заболевания [Teкст]:
дис.
канд. мед. наук / М.А. Борискина.- Рязань, 1996. - 150 с.
6. Ведунова, М.В. Влияние низких терапевтических доз озона на уровень
окислительной модификации белков при метаболическом синдроме [Teкст] / М.В.
Ведунова, А.И. Сазанов, К.Н. Конторщикова // Вестник Нижегородского
университета им. Н.И. Лобачевского.- 2010.- №2 (2).- С. 504-507.
7. Влияние аллоксана на систему глутатиона и окислительную модификацию
белков в адипоцитах при экспериментальном диабете [Teкст] / В.В. Иванов [и др.]
// Бюл. Сиб. медицины.- 2011.- № 3.- С. 44-47.
8. Гордеева, А.В. Апоптоз одноклеточных организмов: механизмы и эволюция
[Teкст] / А.В. Гордеева, Ю.А. Лабас, Р.А. Звягильская // Биохимия.- 2004.Т.69,вып. 10.- С. 1301-1313.
9. Граник, В.Г. Оксид азота (NO). Новый путь к поиску лекарств: монография
[Teкст] / В.Г. Граник, Н.Б. Григорьев.- М.: Вузовская книга, 2004.- 360 с.
120
10. Дорохина, Л.В. Прооксидантно-антиоксидантное равновесие у крыс при
гипотермии в условиях коррекции L-аргинин-NO системы [Teкст] / Л.В.
Дорохина, В.В. Зинчук // Весцi НАН РБ. Сер.бiял. нав. – 2000. - №4. – С. 87-90.
11. Дубинина, Е.Е. Окислительная модификация протеинов, ее роль при
патологических состояниях [Teкст] / Е.Е. Дубинина, А.В. Пустыгина // Укр.
бiохiм. журн.- 2008.- Т. 80, №6.- С. 5-18.
12. Дубинина,
Е.Е.
Продукты
метаболизма
кислорода
в функциональной
активности клеток (жизнь и смерть, созидание и разрушение). Физиологические и
клинико-биохимические аспекты [Teкст] / Е.Е. Дубинина.- СПб.: Издательство
«Медицинская пресса», 2006. - 400 с.
13. Занозина, О.В. Возможности коррекции окислительного стресса у больных
сахарным диабетом с помощью дибикора [Teкст] / О.В. Занозина // Фарматека.2010.- № 16.- С. 51-54.
14. Захаров, А.А. Морфологические изменения тимуса после иммуносупрессии в
эксперименте [Teкст] / А.А. Захаров // Клiнiчна анатомiя та оперативна хiрургiя. –
2008.- Т.7, №4.- С. 15- 19.
15. Изменение содержания продуктов окислительной модификации белков и
липидов в опухолевой ткани на разных стадиях рака легкого [Teкст] / Р.Н.
Белоногов [и др.] // Бюл. эксперим. биологии и медицины.- 2009.- Т.147, № 5.- С.
562-563.
16. Изучение механизма аутокаталитической активации прокатепсина H invitro
[Teкст] / О.С. Васильева [и др.] // Электронный журнал «Исследовано в России». –
2002.
–
С.
1092-1102.-
Электрон.
дан.-
Режим
доступа:
http://zhurnal.ape.relarn.ru/articles/2002/100.pdf
17. Исмаилова, Ж.Г. Окислительная модификация белков плазмы крови при
гипотермии на фоне введения даларгина [Teкст]: дис. канд. биол. наук / Ж.Г.
Исмаилова.- Махачкала, 2004.
18. Козина, О.В.Образование и биологическая роль NO при аллергическом
воспалении [Teкст] / О.В.Козина, Л.М. Огородова // Бюл. Сиб. медицины.- 2009.№ 3.- С. 95-105.
121
19. Коровин, М.С. Роль лизосомальныхцистеиновыхпротеиназ в опухолевой
прогрессии [Teкст] / М.С. Коровин, В.В. Новицкий, О.С. Васильева // Бюл. Сиб.
медицины.- 2009. - № 2.- С. 85-91.
20. Лепихова, Т.Н. Свойства и механизм действия декапептида, соответствующего
кортикотропин-подобной последовательности иммуноглобулина G1 человека
[Teкст]: автореф… канд. биол. наук / Т.Н. Лепихова - Пущино, 2001. – 21 с.
21. Лущак, В.И. Свободнорадикальное окисление белков и его связь с
функциональным состоянием организма [Teкст] / В.И. Лущак // Биохимия.- 2007.Т. 72, вып. 8.- С. 995-1017.
22. Лысенко, Л.А. Протеолитическая регуляция биологических процессов [Teкст] /
Л.А. Лысенко, Н.Н. Немова, Н.П. Канцерова.- Петрозаводск: Карельский научный
центр РАН, 2011. – 482с.
23. Метельская, В.А. Скрининг-метод определения уровня метаболитов оксида
азота в сыворотке крови [Teкст] / В.А. Метельская, Н.Г. Гуманова // Клинич. лаб.
диагностика.- 2005.- №6.- С. 15- 18.
24. Методические положения по изучению процессов свободнорадикального
окисления и системы антиоксидантной защиты организма [Teкст].- Воронеж,
2010. - 70 с.
25. Механизмы хемилюминесценции в реакции Фентона [Teкст] / Н.А. Аристова
[и др.]. – М., 2011. - 23 с.
26. Никитина, Ю.В. Изменения окислительных процессов в ткани головного мозга
и крови крыс в раннем онтогенезе [Teкст] / Ю.В. Никитина, И.В. Мухина // Вестн.
Нижегородского университета им. Н.И. Лобачевского.- 2009.- № 6 (1).- C. 124–
131.
27. Окислительная
модификация
белков
и
олигопептидов
у
больных
хроническими дерматозами с синдромом эндогенной интоксикации [Teкст] /
Т.В.Копытова [и др.] // Фундаментальные исследования. – 2009. – № 6. – С. 25-29.
28. Окислительная модификация белков плазмы крови больных психическими
расстройствами (депрессия, деперсонализация) [Teкст] / Е.Е. Дубинина [и др.] //
Вопр. мед. химии.- 2000.- Т.46, вып. 4.- С. 398-409.
122
29. Окислительная модификация белков сыворотки крови человека, метод её
определения [Teкст] / Е.Е.Дубинина [и др.] // Вопр. мед. химии. – 1995.- Т.41,№ 1.
- С. 24-26.
30. Окислительная модификация белков: окисление триптофана и образование
битирозина в очищенных белках с использованием системы Фентона [Teкст] /
Е.Е. Дубинина [и др.] // Биохимия.- 2002.- Т. 67, вып. 3.- С. 413-421.
31. Окислительная модификация белков: проблемы и перспективы исследования
[Teкст] / Л.Е. Муравлева [и др.] // Фундаментальные исследования.- 2010.- №1.С.74-78.
32. Окислительная модификация липидов и протеинов при остром инфаркте
миокарда [Teкст] / Ю.И. Рагино [и др.] // Атеросклероз и дислипидемии.- 2012.№ 2.- С. 27-31.
33. Особенности регуляции катепсина В и каспазы-3 при долговременной
пластичности [Teкст] / И.В.Кудряшова [и др.] // Нейрохимия.- 2009. - Т. 26, № 4.С. 290-296.
34. Петренко, В.М. Анатомия тимуса белой крысы [Teкст] / В.М. Петренко //
Междунар. журн. прикладных и фундаментальных исследований.- 2012.- №8.- С.
10-13.
35. Плешакова, О.В. Окислительная модификация белков и активность протеаз, их
расщепляющих, в тканях грызунов разного возраста [Teкст]: автореф. дис. канд.
биол. наук / О.В. Плешакова.- Пущино, 1999.
36. Покровский, А.А. Лизосомы [Teкст] / А.А. Покровский, В.А. Тутельян. – М.:
Наука, 1976. – 378с.
37. Проблема оксида азота в биологии и медицине и принцип цикличности
(ретроспективный анализ идей, принципов и концепций) [Teкст] / В.П. Реутов [и
др.].- Эдиториал УРСС, 2003. - 96 с.
38. Пупышев, А.Б. Пермеабилизация лизосомальных мембран как апоптогенный
фактор [Teкст] / А.Б. Пупышев // Цитология.- 2011. – Т. 53, №4. –С. 313-324.
39. Пятакова, Н.В. Регуляция активности растворимой гуанилатциклазы [Teкст]:
автореф. дис….канд. биол. наук / Н.В. Пятакова.- М., 2012.
123
40. Реутов, В.П. Проблемы оксида азота и цикличности в биологии и медицине
[Teкст] / В.П. Реутов, Е.Г. Сорокина, Н.С. Косицын // Успехи совр. биологии. –
2005.- Т.125, №1.- С. 41-65.
41. Роль TOLL-подобных рецепторов в регуляции иммунного ответа в норме и
при патологии [Teкст] / Н.Я. Спивак [и др.] // Фiзiол. Журн.- 2008.- Т.54, №6.- C.
87-99.
42. Роль протеолитических ферментов в контроле различных стадий апоптоза
[Teкст] / Г.А. Яровая [и др.] // Лабораторная медицина. – 2011.- №11. – С. 39-52.
43. Северьянова, Л.А. Механизмы действия аминокислоты L-аргинина на нервную
и иммунную регуляторные системы [Teкст] / Л.А. Северьянова, И.И. Бобынцев //
Курский науч. – практ. вестн. «Человек и его здоровье».- 2006.- № 3.- С. 60-75.
44. Серая, И.П. Современные представления о биологической роли оксида азота
[Teкст] / И.П. Серая, Я.Р. Нарциссов // Успехи совр. биологии.- 2002.- Т. 122, №
3.- С. 249-258.
45. Симбирцев, А.С. Толл-белки: специфические рецепторы неспецифического
иммунитета [Teкст] / А.С. Симбирцев // Иммунология.- 2005.- №6.- С. 368–377.
46. Сомова, Л.М. Оксид азота как медиатор воспаления [Teкст] / Л.М. Сомова,
Н.Г. Плехова // Вестн. ДВО РАН.- 2006.- № 2.- С. 77-80.
47. Сорокин, А.В. Протеасомная система деградации и процессинга белка [Teкст] /
А.В. Сорокин, Е.Р. Ким, Л.П. Овчинников // Успехи биол. химии.- 2009.- Т.49.- С.
3-76.
48. Спиридонов, В.К. Капсаицин-чувствительные нервы и окислительный стресс
[Teкст] / В.К. Спиридонов, З.С. Толочко // Бюл. СО РАМН.- 2010.- Т.30, № 4.- C.
76–81.
49. Стариков, Ю.В. Роль молекул оксида азота в программированной гибели
нейтрофилов при окислительном стрессе [Teкст]: автореф. дис.… канд. мед. наук
/ Ю.В. Стариков.– Новосибирск, 2008. – 22 с.
50. Старосельцева,
прекондиционирования
О.А.
Использование
никорандилом
для
фармакологического
коррекции
эндотелиальной
124
дисфункции на модели L-NAME-индуцированного дефицита оксида азота
[Teкст]: автореф. дис.… канд. мед.наук / О.А. Старосельцева.– Курск, 2012. – 21 с.
51. Титова, И.В. Молекулярно-цитологическая характеристика тимуса крыс при
введении бактериального липополисахарида [Teкст]: дис.
канд. биол. наук /
И.В.Титова. – Ижевск, 2005. – 120 с.
52. Токсикологические последствия окислительной модификации белков при
различных патологических состояниях [Teкст] / Ю.И. Губский [и др.] // Совр.
пробл. токсикологии. – 2005. – Т. 8, №3. – С. 20–27.
53. Толочко, З.С. Окислительная модификация белков в крови крыс при
повреждении капсаицин-чувствительных нервов и изменении уровня оксида азота
[Teкст] / З.С. Толочко, В.К. Спиридонов // Рос. физиол. журн. им. И.М. Сеченова.2010.- Т. 96, № 1.- С. 77- 84.
54. Функциональные свойства и окислительная модификация белков нейтрофилов
и плазмы крови при внебольничной пневмонии [Teкст] / Е.А. Степовая [и др.] //
Клинич. лаб. диагностика.-2010.- № 3. - С. 18-21.
55. Черноморцева, Е.С. Влияние макролипидов на функциональные возможности
эндотелия и миокарда при экспериментальном моделировании L-NAMEиндуцированной эндотелиальной дисфункции [Teкст] / Е.С. Черноморцева //
Курский науч. – практ. вестн. «Человек и его здоровье».- 2010.- №1.- С. 30-33.
56. Шапкин, Ю.Г. Значение селезенки в иммунном статусе организма [Teкст] /
Ю.Г. Шапкин, В.В. Масляков // Анналы хирургии.- 2009.- № 1.- С. 9-12.
57. Шаронов, А.С. Зависимость иммуногенеза на начальных этапах от состояния
стабильности лизосомальных мембран фагоцитирующих клеток [Teкст] / А.С.
Шаронов, И.А. Храмова // Тихоокеанский мед. журн.- 2009. – №4. – С. 37-38.
58. Шумаев, К.Б. Роль динитрозильных комплексов железа в защите биомолекул и
клеточных структур от окислительного, нитрозативного и карбонилового стресса
[Teкст]: автореф. дис.… д-ра биол. наук / К.Б. Шумаев.– М., 2010. – 50 с.
59. Эндотелиопротекторные эффекты L-аргинина при моделированиии дефицита
окиси азота [Teкст] / М.В. Покровский [и др.] // Эксперим. и клинич.
фармакология. – 2008.- Т.71, №2.- С. 29-31.
125
60. A dityrosine-based substrate for a protease assay: application for the selective
assessment of papain and chymopapain activity [Text] / C.J. Kim [et al.] // Anal Chim
Acta.- 2012.-Vol. 723.- P. 101-107.
61. A Study of the Oxidation-Induced Conformational and Functional Changes in
Neuroserpin [Text] / Afshin Mohsenifar [et al.] // Iranian Biomedical Journal.- 2007.Vol. 11,№1.- P. 41-46.
62. Acid ceramidase-mediated production of sphingosine 1-phosphate promotes prostate
cancer invasion through upregulation of cathepsin B [Text] / T.H. Beckham [et al.] //
Int J Cancer.- 2012.-Vol. 131,№ 9.- P. 2034-2043.
63. Activation of cathepsins B and L in mouse lymphosarcoma tissue under the effect of
cyclophosphamide is associated with apoptosis induction and infiltration by
mononuclear phagocytes [Text] / S.Y. Zhanaeva [et al.] // Bull Exp Biol Med.- 2013.Vol. 156,№ 1.- P. 86-90.
64. Adaramoye O.A. Sub-acute effect of N(G)-nitro-l-arginine methyl-ester (L-NAME)
on biochemical indices in rats: Protective effects of Kolaviron and extract of Curcuma
longa L. [Text] / O.A. Adaramoye, I.O. Nwosu, E.O. Farombi // Pharmacognosy Res.2012.- Vol.4,№3.- P.127-133.
65. Ahn, B. Use of fluorescein hydrazide and fluorescein thiosemicarbazide reagents for
the fluorometric determination of protein carbonyl groups and for the detection of
oxidized protein on polyacrylamide gels [Text] / B. Ahn, S.G. Rhee, E.R. Stadtman //
Anal. Biochem. - 1987.- Vol.161,№2.- P. 245-257.
66. Amado, R. Dytirosine: in vitro production and characterization [Text] / R. Amado,
R. Aeschbach, H. Neukom // Methods Enzymol. – 1984. – Vol. 107. – P. 377–388.
67. Analysis of a truncated form of cathepsin H in human prostate tumor cells [Text] /
A. Waghray [et al.] // J Biol Chem.- 2002.-Vol.277.- P. 11533-11538.
68. Analysis of oxidative stress-induced protein carbonylation using fluorescent
hydrazides [Text] / J. Tamarit [et al.] // J. Proteomics.- 2012.-Vol.75.- P. 3778-3788.
69. Antineutrophil cytoplasm antibody-induced neutrophil nitric oxide production is
nitric oxide synthase independent [Text] / W.Y. Tse [et al.] // Kidney Int. – 2001. – Vol.
59, № 2. – P. 593-600.
126
70. Asymmetric dimethylarginine and critical illness [Text] / S.J. Brinkmann [et al.] //
Curr Opin Clin Nutr Metab Care.- 2014.-Vol. 17,№ 1.- P. 90-97.
71. Asymmetric dimethylarginine in chronic obstructive pulmonary disease (ADMA in
COPD) [Text] / J.A. Scott [et al.] // Int J Mol Sci.- 2014.-Vol. 15,№ 4.- P. 6062-6071.
72. Asymmetric dimethylarginine, an endogenous inhibitor of nitric oxide synthase,
interacts with gastric oxidative metabolism and enhances stress-induced gastric lesions
[Text] / S. Kwiecien [et al.] // J Physiol Pharmacol.- 2012.-Vol. 63,№ 5.- P. 515-524.
73. Autocatalytic processing of recombinant human procathepsin L. Contribution of
both intermolecular and unimolecular events in the processing of procathepsin L in vitro
[Text] / R. Menard [et al.] // J Biol Chem.-. 1998.- Vol. 273,№8.- P. 4478-4484.
74. Bansal, V. Arginine availabity, arginase, and the immune response [Text] / V.
Bansal, J.B. Ochoa // Curr. Opin. Clin. Nutr. Metab. Care. – 2003. – Vol. 6, №2. – P.
223-228.
75. Baraibar, M.A. Proteomic quantification and identification of carbonylated proteins
upon oxidative stress and during cellular aging [Text] / M.A. Baraibar, R. Ladouce, B.
Friguet // Journal of Proteomics.- 2013.-Vol.92.- P. 67-70.
76. Barbato, J.E. Nitric oxide and arterial disease [Text] / J.E. Barbato, E. Tzeng // J.
Vase. Surg. - 2004. - Vol. 40. - P. 187-193.
77. Barrett, A.J. Cathepsin B, cathepsin H, cathepsin L [Text] / A.J. Barrett, H. Kirschke
// Methods in Enzymol. – 1981. – Vol. 80. – P.535-561.
78. Biomarkers of Oxidative Damage in Human Disease [Text] / Isabella Dalle-Donne
[et al.] // Clinical Chemistry.- 2006.- Vol.52, №4.- P.601–623.
79. Biomarkers of protein oxidation in human disease [Text] / A. Garcia-Garcia [et al.] //
Curr Mol Med.- 2012.-Vol. 12,№ 6.- P. 681-697.
80. Bogdan, Christian. Nitric oxide and the immune response [Text] / Christian Bogdan
// Nature Immunology.- 2001.-Vol.2,№10.-P. 907-916.
81. Böger, R.H. The pharmacodynamics of L-arginine [Text] / R.H. Böger // Altern Ther
Health Med.- 2014.-Vol.20,№ 3.- P.48-54.
82. Bollineni, R.Ch. Identification of protein carbonylation sites by two-dimensional
liquid chromatography in combination with MALDI- and ESI-MS [Text] / R.Ch.
127
Bollineni, R. Hoffmann, M. Fedorova // J Proteomics.- 2011.-Vol.74,№ 11.- P. 23382350.
83. Bosiljka, Plećaš-Solarović. Age-dependent morphometrical changes in the thymus of
male propranolol-treated rats [Text] / Bosiljka Plećaš-Solarović, Ljubica Lalić, Gordana
Leposavić // Ann Anat.- 2004.- Vol.186.- P.141-147.
84. Cai, Z. Protein Oxidative Modifications: Beneficial Roles in Disease and Health
[Text] / Z. Cai, L.-J. Yan // Journal of Biochemical and Pharmacological Research.2013.-Vol.1,№1.- P. 15-26.
85. Caspase-8 is activated by cathepsin D initiatingneutrophil apoptosis during the
resolution of inflammation [Text] / S. Conus [et al.] // J Exp Med.- 2008.- Vol.
205,№3.- P.685–698.
86. Cathepsin B activity regulation. Heparin-like glycosaminogylcans protect human
cathepsin B from alkaline pH-induced inactivation [Text] / P.C. Almeida [et al.] // J.
Biol. Chem. - 2001.-Vol. 276.- P. 944–951.
87. Cathepsin B is involved in the trafficking of TNF-{alpha}-containing vesicles to the
plasma membrane in macrophages [Text] / S.-D. Ha [et al.] // J Immunol.- 2008.Vol.181,№ 1.- P. 690–607.
88. Cathepsin C gene 5'-untranslated region mutation in papillon-lefèvre syndrome
[Text] / R. Kosem [et al.] // Dermatology.- 2012.-Vol.225,№ 3.- P. 193-203.
89. Cathepsin K-dependent Toll-like receptor 9 signallingrevealed in experimental
arthritis [Text] / M. Asagiri [et al.] // Science.- 2008.- Vol.319,№5863.- P.624–627.
90. Cathepsin L expression and regulation in human abdominal aortic aneurysm,
atherosclerosis, and vascular cells [Text] / J. Liu [et al.] // Atherosclerosis.- 2006.- Vol.
184.- P. 302-311.
91. Cathepsin L Regulates CD4 T Cell Selection Independentlyof Its Effect on Invariant
Chain: A Role in the Generation of Positively
Selecting Peptide Ligands [Text] /
Karen Honey [et al.] // J. Exp. Med.- 2002.- Vol.195,№10.- P.1349–1358.
92. Cathepsin L stimulates autophagy and inhibits apoptosis of ox-LDL-induced
endothelial cells: potential role in atherosclerosis [Text] / D.H. Wei [et al.] // Int J Mol
Med.- 2013.-Vol. 31,№ 2.- P. 400-406.
128
93. Cathepsin L: critical role in li degradation and CD4 T cell selection in the thymus
[Text] / T. Nakagawa [et al.] // Science.- 1998.- Vol.280,№5362.- P.450–453.
94. Cathepsin V is involved in the degradation of invariant chain in human thymus and
is overexpressed in myasthenia gravis [Text] / E. Tolosa [et al.] // J Clin Invest. – 2003.Vol.112,№4.- P.517–526.
95. Cathepsins are required for Toll-like receptor 9 responses [Text] / F. Matsumoto [et
al.] // Biochem Biophys Res Commun.- 2008.- Vol.367,№3.- P.693–699.
96.
Cathepsins K, L, B, X and W are differentially expressed in normal and
chronically inflamed gastric mucosa [Text] / F. Buhling [et al.] // Biol Chem.-2004.Vol.385.- P. 439-445.
97. Chapman, H.A. Endosomal proteases in antigen presentation [Text] / H.A. Chapman
// Curr Opin Immunol.- 2006.- Vol.18,№1.- P.78–84.
98. Chen, B. Multiplex zymography captures stage-specific activity profiles of
cathepsins K, L, and S in human breast, lung, and cervical cancer [Text] / B. Chen,
M.O. Platt // J Transl Med.- 2011.-Vol. 9.- P.109.
99. Cirino, Giuseppe. Wallace Nitric Oxide and Inflammation [Text] / Giuseppe Cirino,
Eleonora Distrutti, L. John // Inflammation& Allergy - Drug Targets.- 2006.- №5.P.115-119.
100. Čolak, E. New markers of oxidative damage to macromolecules [Text] / E. Čolak
// JMB.- 2008.- P. 1-16.
101. Conus, Sébastien. Cathepsins and their involvement in immune responses [Text] /
Sébastien Conus, Hans-Uwe Simon // Swiss Medical Weekly.- 2010. - P. 1-12.
102. Crystal structure and functional characterization of an immunomodulatory
salivary cystatin from the soft tick Ornithodoros moubata [Text] / J. Salát [et al.] //
Biochem J.- 2010.-Vol. 429,№ 1.- P. 103-112.
103. Cysteine and serine proteases of synovial tissue in rheumatoid arthritis and
osteoarthritis [Text] / Solau- E. Gervais [et al.] // Scand J Rheumatol.- 2007.-Vol. 36,№
5.- P. 373-377.
129
104. Cysteine cathepsins: From structure, function and regulation to new frontiers
[Text] / Vito Turk [et al.] // Biochimica et Biophysica Acta.- 2012.- Vol. 1824.- P. 68–
88.
105. Davies, K.J. Degradation of oxidized proteins by the 20S proteasome [Text] / K.J.
Davies // Biochimie.- 2001.-Vol.83,№3/4. - P. 301-310.
106. Detection of cathepsin B, cathepsin L, cystatin C, urokinase plasminogen
activator and urokinase plasminogen activator receptor in the sera of lung cancer
patients [Text] / Q. Chen [et al.] // Oncol Lett. - 2011.-Vol. 2,№ 4.- P. 693-699.
107. Determination of carbonyl content in oxidatively modified proteins [Text] / R.L.
Levine [et al.] // Methods Enzymol.- 1990.- Vol.186.- P. 464–478.
108. Determination of Carbonyl Group Content in Plasma Proteins as a Useful Marker
to Assess Impairment in Antioxidant Defense in Patients with Eales' Disease [Text] / M.
Rajesh [et al.] // Indian Journal of Ophthalmology.- 2004.-Vol.52, Is. 2.- P. 139-144.
109. Determination of carbonyl groups in oxidativily modified proteins by reduction
with tritiated sodium borohydride [Text] / A.G. Len [et al.] // Anal. Biohem. - 1989.Vol. 177,№2.- P. 419-425.
110. Dissecting regulation mechanism of the FMN to heme interdomain electron
transfer in nitric oxide synthases [Text] / C. Feng [et al.] // J Inorg Biochem.- 2014.Vol.130.- P.130-140.
111. Donnelly, S. How pathogen-derived cystein et proteases modulate host immune
responses [Text] / S. Donnelly, J.P. Dalton, M.W. Robinson // Adv Exp Med Biol.–
2011.-Vol.712.- P.192-207.
112. Dynamics of changes of blood inflammatory-oxidative biomarkers in acute
coronary syndrome [Text] / Iu.I. Ragino [et al.] // Kardiologiia. - 2012.-Vol.52,№ 2.P. 18-22.
113. Effect of posttranslational modifications on enzyme function and assembly [Text]
/ H. Ryšlavá [et al.] // Journal of Proteomics.- 2013.-Vol. 92.- P.80-109.
114. Effects of cysteine proteases on the structural and mechanical properties of
collagen fibers [Text] / P. Panwar [et al.] // J Biol Chem.- 2013.-Vol. 288,№ 8.- P.
5940-5950.
130
115. Electron paramagnetic resonance detection of free tyrosyl radical generated by
myeloperoxidase, lactoperoxidase, and horseradish peroxidase [Text] / M.L.
McCormick [et al.] // J. Biol. Chem.- 1998.- Vol.273.- P.32030-32037.
116. Emerging roles of cysteine cathepsins in disease and their potential as drug
targets [Text] / O. Vasiljeva [et al.] // Curr. Pharm. Des.- 2007.- Vol.13, № 4.- P.387403.
117. Endothelial nitric oxide synthase activation through obacunone-dependent
arginase inhibition restored impaired endothelial function in ApoE-null mice [Text] / J.
Yoon [et al.] // Vascul Pharmacol.- 2014.- Feb 6.- pii: S1537-1891(14)00021-4. doi:
10.1016/j.vph.2014.01.006
118. Eo, S.H. Resveratrol Inhibits Nitric Oxide-Induced Apoptosis via the NF-Kappa
B Pathway in Rabbit Articular Chondrocytes [Text] / S.H. Eo, H. Cho, S.J. Kim //
Biomol Ther (Seoul).- 2013.-Vol. 21,№ 5.- P. 364-370.
119. Expression of cathepsins B and S in the progression of prostate carcinoma [Text]
/ P.L. Fernandez [et al.] // Int. J. Cancer.- 2001.- Vol.95.- P. 51-55.
120. Expression of human cathepsin L or human cathepsin V in mouse thymus
mediates positive selection of T helper cells in cathepsin L knock-out mice [Text] / L.
Sevenich [et al.] // Biochimie.- 2010.- Vol.92,№11.- P.1674-1680.
121. Feeney, M.B. Tyrosine modifications in aging [Text] / M.B. Feeney, C.
Schöneich // Antioxid Redox Signal.- 2012.-Vol. 17,№ 11.- P. 1571-1579.
122. Feng, C. Mechanism of Nitric Oxide Synthase Regulation: Electron Transfer and
Interdomain Interactions [Text] / C. Feng // Coord Chem Rev.- 2012.- Vol. 256,№ 3-4.P. 393-411.
123. Feng, J. Quantification of carbonylated proteins in rat skeletal muscle
mitochondria using capillary sieving electrophoresis with laser-induced fluorescence
detection [Text] / J. Feng, E.A. Arriaga // Electrophoresis.- 2008.-Vol.29,№ 2.- P. 475482.
124. Fliser, D. Asymmetric dimethylarginine (ADMA): the silent transition from an
«uraemic tox- in» to a global cardiovascular risk molecule [Text] / D. Fliser // Eur J
Clin Invest.- 2005.-Vol. 35,№ 2.- P. 71-79.
131
125. Förstermann, U. Nitric oxide synthases: Regulation and function [Text] / U.
Förstermann, W.C. Sessa // European Heart Journal.- 2012.- P.829-837.
126. Garaliene, V. Endothelium and nitric oxide [Text] / V. Garaliene // Medicina
(Kaunas).- 2008.-Vol.44,№ 7 .- P.564-569.
127. Giulini, C. Tyrosine oxidation products: analysis and biological relevance [Text] /
C. Giulini,N.J. Traaseth, K.J. Davies // Amino Acids.- 2003.-№3–4.- P.227–232.
128. Glutamic and aminoadipic semialdehydes are the main carbonyl products of
metal-catalyzed oxidation of proteins [Text] / J.R. Requena [et al.] // Proc Natl Acad Sci
USA.- 2001.-Vol.98,№ 1.- P. 69–74.
129. Grimm, S. Oxidative protein damage and the proteasome [Text] / S. Grimm, A.
Höhn, T. Grune // Amino Acids. - 2012.-Vol. 42,№1.- P. 23-38.
130. Habib, S. Biochemistry of nitric oxide [Text] / S. Habib, A. Ali // Indian Journal
of Clinical Biochemistry.- 2011.- P. 3-17.
131. Hawkins, Clare L. Quantification of protein modification by oxidants [Text] /
Clare L. Hawkins, Philip E. Morgan, Michael J. Davies // Free Radical Biology &
Medicine.- 2009.- Vol.46.- P.965–988.
132. Honey, K. Lysosomal cysteine proteases regulate antigen presentation [Text] / K.
Honey, A.Y. Rudensky // Nat Rev Immunol.- 2003.- Vol.3,№6.- P.472–482.
133. How does heparin prevent the pH inactivation of cathepsin B? Allosteric
mechanism elucidated by docking and molecular dynamics [Text] / M.G. Costa [et al.]
// BMC Genomics.- 2010.-Vol. 11 (Suppl. 5) .- P. S5.
134. Human cathepsin O: molecular cloning from a breast carcinoma, production of
the active enzyme in Escherichia coli, and expression analysis in human tissues [Text] /
G. Velasco [et al.] // J Biol Chem.- 1994.- Vol. 269.- P. 27136-27142.
135. Ibiza, S. The role of nitric oxide in the regulation of adaptive immune responses
[Text] / S. Ibiza, J.M. Serrador // Inmunología.- 2008.- Vol. 27, № 3.- Р. 103-117.
136. Ide, N. Vascular endothelial dysfunction [Text] / N. Ide, K. Node // Nihon
Rinsho.- 2009.- Vol.67,№ 4.- P. 701-706.
137. Identification of interleukin-8 converting enzyme as cathepsin L [Text] / K.
Ohashi [et al.] // Biochem Biophys Acta.- 2003.-Vol.1649,№ 1.- P. 30–39.
132
138. Im, E. Cathepsin Bregulates the intrinsic angiogenic threshold of endothelial cells
[Text] / E. Im, A. Venkatakrishnan, A. Kazlauskas // Mol. Biol. Cell.- 2005.- Vol. 16,№
8.- P. 3488-3500.
139. In search of potent and selective inhibitors of neuronal nitric oxide synthase with
more simple structures [Text] / Q. Jing [et al.] // Bioorg Med Chem.- 2013.-Vol. 21,№
17.- P. 5323-5331.
140. In vitro effects of nitric oxide donors on apoptosis and oxidative/nitrative protein
modifications in ADP-activated platelets [Text] / A. Sener [et al.] // Hum Exp Toxicol.2013.-Vol. 32,№ 3.- P. 225-235.
141. In vivo and in vitro apoptosis of human thymocytes are associated with
nitrotyrosine formation [Text] / N. Moullan [et al.] // Blood. - 2001.-Vol. 97.- P. 35213530.
142. Increased nitric oxide-mediated neurotransmission in the medial prefrontal cortex
is associated with the long lasting anxiogenic-like effect of predator exposure [Text] /
A.C. Campos [et al.] // Behav Brain Res.- 2013.-Vol. 256.- P. 391-397.
143. Inhibition of Acute Phase Inflammation by Laminaria japonica through
Regulation of iNOS-NF- κ B Pathway Evid Based Complement [Text] / S.K. Park [et
al.] // Alternat Med. - 2013;2013:439498. - doi: 10.1155/2013/439498 [Epub 2013 Oct
31]
144. Ischiropoulos, H. Biological selectivity and functional aspects of protein tyrosine
nitration [Text] / H. Ischiropoulos // Biochem Biophys Res Commun.- 2003.-Vol.305.P.776–783.
145. Jones, L.A. Spectrophotometric Studies of Some 2,4-Dinitrophenylhydrazones
[Text] / L.A. Jones, J.C. Holmes, R.B. Seligman // Analytical chemistry.- 1956.- Vol.
28, №2.- Р. 191-198.
146. Katunuma, N. Posttranslational processing and modification of cathepsins and
cystatins
[Text]
/
N.
Katunuma
//
J
Signal
http://www.readcube.com/articles/10.1155/2010/375345
Transduct.-
2010.-
URL:
133
147. Kiffin, Roberta. Oxidative Stress and Autophagy [Text] / Roberta, Kiffin, Urmi
Bandyopadhyay, Ana Maria Cuervo // ANTIOXIDANTS & REDOX SIGNALING.2005.- Vol. 8,№1 & 2.- Р. 152-162.
148. Kish-Trier, E. Structural biology of the proteasome [Text] / E. Kish-Trier, C.P.
Hill // Annu Rev Biophys.- 2013.-Vol.42.- P. 29-49.
149. Lambeth, J.D. Nox enzymes, ROS, and chronic disease: an example of
antagonistic pleiotropy [Text] / J.D. Lambeth // Free Radic. Biol. Med. – 2007.Vol.43.- P. 332–347.
150. Lanas, Angel. Role of nitric oxide in the gastrointestinal tract [Text] / Angel
Lanas // Arthritis Res Ther.- 2008; 10.- Published online 2008: doi: 10.1186/ar2465
151. LDL oxidative modification and carotid atherosclerosis: results of a multicenter
study [Text] / K. Nyyssönen [et al.] // Atherosclerosis.- 2012.-Vol. 225,№ 1.- P. 231236.
152. Lee, D.H. Mechanisms of Oxidative Damage in Multiple Sclerosis and
Neurodegenerative Diseases: Therapeutic Modulation via Fumaric Acid Esters [Text] /
D.H. Lee, R. Gold, R.A. Linker // Int J Mol Sci.- 2012.-Vol.13,№ 9.- P. 11783-11803.
153. Liang-Jun, Yan. Protein Redox Modification as a Cellular Defense Mechanism
against Tissue Ischemic Injury [Text] / Yan Liang-Jun // Oxidative Medicine and
Cellular
Longevity.-
2014.-
Vol.2014.-
Article
ID
343154.-
URL:
http://dx.doi.org/10.1155/2014/343154
154. Loss of lysosomal ion channel transient receptor potential channel mucolipin-1
(TRPML1) leads to cathepsin B-dependent apoptosis [Text] / G.A. Colletti [et al.] // J
Biol Chem.- 2012.-Vol. 287,№11.- P. 8082-8091.
155. Lüneburg, N. The Endothelial ADMA/NO Pathway in Hypoxia-Related Chronic
Respiratory Diseases [Text] / N. Lüneburg, L. Harbaum, J.K. Hennigs // Biomed Res
Int.- 2014;2014:501612.
156. Lung, spleen, and kidney the major places for inducible nitric oxide synthase
expression in endotoxicshok: role of p38 mitogen-activated protein kinase in signal
transduction of inducible nitric oxide synthase expression [Text] / Wenhong Kan [et al.]
// Shock.- 2004.- Vol. 21,№3.- P.281–287.
134
157. Lysosomal cathepsins: structure, role in antigen processing and presentation, and
cancer [Text] / V. Turk [et al.] // Adv Enzyme Regul.- 2002.- Vol. 42.- P. 285-303.
158. Lysosomal Cysteine Proteinase Cathepsin S as a Potential Target for Anti-Cancer
Therapy [Text] / Wun-Shaing W. Chang [et al.] // J. Cancer Mol. - 2007.- Vol. 3,№ 1.P. 5-14.
159. Lysosomal Labilization [Text] / А. Terman [et al.] // IUBMB Life.- 2006. – Vol.
58,№9. –Р. 531-539.
160. Magister, Špela. Cystatins in Immune System [Text] / Špela Magister, Janko Kos
// Journal of Cancer.- 2013.- Vol. 4.- Р. 45- 56.
161. Manoury, Be´ne´dicte. Serine and Cysteine Proteases and Their Inhibitors as
Antimicrobial Agents and Immune Modulators [Text] / Be´ne´dicte Manoury, Ali
Roghanian,
Jean-Michel
Sallenave.-
2011.
-
P.
27-50.-
URL:
http://www.springer.com/978-3-0348-0156-0
162. Markus, Munder. Arginase: an emerging key player in the mammalian immune
system [Text] / Munder Markus // Br J Pharmacol.- 2009.-Vol. 158,№ 3.- P. 638–651.
163. Mebius, Reina E. Structure and function of the spleen [Text] / Reina E. Mebius,
Georg Kraal // NATURE REVIEWS IMMUNOLOGY.- 2005.- Vol 5.- P. 606-616.
164. Modification of peptide and protein cysteine thiol groups by conjugation with a
degradation product of ascorbate [Text] / P. Kay [et al.] // Chemical Research in
Toxicology.- 2013.-Vol. 26,№ 9.- P. 1333-1339.
165. Mohammadi, Mohammad Taghi. Contribution of Nitric Oxide Synthase (NOS)
Activity
in
Blood-Brain
Barrier
Disruption
and
Edema
after
Acute
Ischemia/Reperfusion in Aortic Coarctation-Induced Hypertensive Rats [Text] /
Mohammad Taghi Mohammadi, Seyed Mostafa Shid Moosavi,Gholam Abbas
Dehghani // Iranian Biomedical Journal.- 2011.- Vol.15, № 1- 2.- P.22-30.
166. Mount, P.F. Nitric oxide in the kidney: functions and regulation of synthesis
[Text] / P.F. Mount, D.A. Power // Acta Physiologica.- 2006.- Vol.187,№ 4.- P. 433446.
135
167. Müller, S. Specific functions of lysosomal proteases in endocytic and autophagic
pathways [Text] / S. Müller, J. Dennemärker, T. Reinheckel // Biochim Biophys Acta.2012.- Vol.1824, № 1.- P.34-43.
168. Nitric oxide and redox mechanisms in the immune response [Text] / David A.
Wink [et al.] // Journal of Leukocyte Biology.- 2011. - Vol 89.- P. 873-891.
169. Nitric Oxide as a Bioregulator of Apoptosis [Text] / Hun-Taeg Chung [et al.] //
Biochemical and Biophysical Research Communications.- 2001.- Vol.282.-P.1075–
1079.
170. Nitric oxide as a cellular antioxidant: A little goes a long way [Text] / Stephen G.
Hummel [et al.] // Free Radical Biology & Medicine.- 2006.- Vol.40.- P.501 – 506.
171. Nitric Oxide as a Pro-apoptotic as well as Anti-apoptotic Modulator [Text] /
Byung-Min Choi [et al.] // Journal of Biochemistry and Molecular Biology.- 2002.Vol.35, № 1.- P.116-126.
172. Nitric Oxide in Cell Survival: A Janus Molecule [Text] / Vittorio Calabrese [et
al.] // ANTIOXIDANTS & REDOX SIGNALING.- 2009.- Vol.11, №11.- P.2717-2739.
173. Nitric oxide in health and disease of the respiratory system [Text] / F.L.
Ricciardolo [et al.] // Physiol Rev.- 2004.-Vol.84,№ 3.- P. 731-765.
174. Nitric oxide and macrophage function [Text] / J. MacMicking [et al.] // Annu Rev
Immunol.- 1997.-Vol. 15.- P. 323-350.
175. Nitric oxide synthase domain interfaces regulate electron transfer and calmodulin
activation [Text] / B.C. Smith [et al.] // Proc Natl Acad Sci U S A.- 2013.-Vol.110,№
38.- P. E3577-586.
176. Nitric oxide, a biological double-faced janus- Is this good or bad? [Text] / T.
Thippeswamy [et al.] // Histol Histopathol.- 2006.-Vol.21.- P.445-458.
177. Nitric oxide, a protective molecule in the cardiovascular system [Text] / J. Lei [et
al.] // Nitric Oxide.- 2013.-Vol. 35.- P.175-185.
178. Nyström, Thomas. Role of oxidative carbonylation in protein quality control and
senescence [Text] / Thomas Nyström // The EMBO Journal.- 2005.-Vol.24.- P.1311–
1317.
136
179. Ogino, Keiki. Biomarkers of Oxidative/NitrosativeStress:An Approach to Disease
Prevention [Text] / Keiki Ogino, Da-Hong Wang // Acta Med. Okayama.- 2007.- Vol.
61, №4.- P.181-189.
180. Osamu, Handa. Role of endothelial nitric oxide synthase-derived nitric oxide in
activation and dysfunction of cerebrovascular endothelial cells during early onsets of
sepsis [Text] / Handa Osamu, Stephen Jancy, Gediminas Cepinskas // Am J Physiol
Heart Circ Physiol.- 2008.-Vol.295,№4.- P.H1712–H1719.
181. Over expression of cathepsin F, matrix metalloproteinases 11 and 12 in cervical
cancer [Text] / G. Vazquez-Ortiz [et al.] // BMC Cancer.- 2005.- Vol.5.- P. 68.
182. Overexpression of cysteine cathepsin L is a marker of invasion and metastasis in
ovarian cancer [Text] / W. Zhang [et al.] // Oncol Rep.- 2014.-Vol. 31,№ 3.- P. 13341342.
183. Overlapping functions of lysosomal acid phosphatase (LAP) and tartrateresistant
acid phosphatase (Acp5) revealed by doubly deficient mice [Text] / Anke Suter [et al.]
// Development.- 2001. – Vol. 128. –P. 4899-4910.
184. Oxidative and nitrosative stress markers in bus drivers [Text] / Pavel Rossner
Jr.[et al.] // Mutation Research.- 2007.-Vol.617.- P.23–32.
185. Oxidative modification of blood serum proteins in multiple sclerosis after
interferon or mitoxantrone treatment [Text] / I. Sadowska-Bartosz [et al.] // Journal of
Neuroimmunology.- 2014.-Vol.266, Is.1-2.- P. 67-74.
186. Oxidative modification of proteins: an emerging mechanism of cell signaling
[Text] / S.B. Wall [et al.] // Frontiers in Physiology.- 2012.-Vol.3.- Article 369.
187. Oxidative Stress and Autophagy in the Regulation of Lysosome-Dependent
Neuron Death [Text] / Violetta N. Pivtoraiko [et al.] // Antioxid Redox Signal.- 2009.Vol.11,№ 3.- P.481–496.
188. Oxidative stress and covalent modification of protein with bioactive aldehydes
[Text] / P. A. Grimsrud [et al.] // The journal of biological chemistry. – 2008. – Vol.
283, № 32. – P. 21837-21841.
137
189. Ozçubukçu, S. Waterlogging and nitric oxide induce gene expression and
increase antioxidant enzyme activity in wheat (Triticum aestivum L.) [Text] / S.
Ozçubukçu, N. Ergün, E. Ilhan // Acta Biol Hung.- 2014.-Vol. 65,№ 1.- P. 47-60.
190. Pavanelli, Wander Rogério. The Role of Nitric Oxide in Immune Response
Against Trypanosoma Cruzi Infection [Text] / Wander Rogério Pavanelli, Jean Jerley
Nogueira Silva // The Open Nitric Oxide Journal.- 2010.- Vol.2.- P. 1-6.
191. Pearse, Gail. Normal Structure, Function and Histology of the Thymus [Text] /
Gail Pearse // Toxicologic Pathology.- 2006.- Vol.34.-P.504–514.
192. Pickering, A.M. A simple fluorescence labeling method for studies of protein
oxidation, protein modification, and proteolysis [Text] / A.M. Pickering, K.J. Davies //
Free Radic Biol Med.- 2012.-Vol. 52,№ 2.- P. 239-246.
193. Podgorski, I. Cathepsin B and its role(s) in cancer progression [Text] / I.
Podgorski, B.F. Sloane // Biochem Soc Symp.- 2003.-Vol. 70.- P. 263-276.
194. Prast, H. Nitric oxide as modulator of neuronal function [Text] / H. Prast, A.
Philippu // Prog Neurobiol.- 2001.-Vol. 64,№1.- Р. 51-58.
195. Protective role of the endothelial isoform of nitric oxide synthase in ANG IIinduced inflammatory responses in the kidney [Text] / C. Whiting [et al.] // Am J
Physiol Renal Physiol.- 2013.-Vol. 305,№ 7.- P. P1031-1041.
196. Protective roles of nitric oxide on antioxidant systems in tall fescue leaves under
high-light stress [Text] / Yue-FeiXu [et al.] // African Journal of Biotechnology.2010.- Vol. 9, № 3.- P.300-306.
197. Protein carbonyl groups as biomarkers of oxidative stress [Text] / Isabella DalleDonnea [et al.] // Clinica Chimica Acta.- 2003.- Vol.329.- P.23–38.
198. Protein Carbonyl Levels - An Assessment of Protein Oxidation Apoptosis
Methods in Pharmacology and Toxicology [Text] / Castegna [et al.] // Methods in
Biological Oxidative Stress.- 2003.- Р. 161-168.
199. Protein modifications by electrophilic lipoxidation products: Adduct formation,
chemical strategies and tandem mass spectrometry for their detection and identification
[Text] / Y.V. Vasil'ev [et al.] // Mass Spectrometry Reviews.- 2013.- Vol. 33,№ 3.- P.
157-182.
138
200. Protein oxidation: Identification and utilisation of molecular markers to
differentiate singlet oxygen and hydroxyl radical-mediated oxidative pathways [Text] /
J.E. Plowman [et al.] // Photochemical and Photobiological Sciences.- 2013.-Vol. 12,№
11.- P. 1960-1967.
201. Proteins as biomarkers of oxidative stress in diseases: the contribution of redox
proteomics [Text] / I. Dalle-Donne [et al.] // Mass Spectrom Rev.- 2005.-Vol.24.- P.55–
99.
202. Proteolytic cleavage in an endolysosomal compartment is required for activation
of Toll-like receptor 9 [Text] / B. Park [et al.] // Nat Immunol.- 2008.- Vol.9,№12.P.1407–1414.
203. Purdel, N.C. Current Methods Used in the Protein Carbonyl Assay [Text] / N.C.
Purdel, D. Margina, M. Ilie // Annual Research & Review in Biology.- 2014.-Vol. 4,№
12.- P. 2015-2026.
204. Radi, R. Nitric oxide, oxidants, and protein tyrosine nitration [Text] / R. Radi //
Proc Natl Acad Sci U S A. – 2004.- Vol.101, № 12.- P. 4003-4008.
205. Radi, R. Peroxynitrite, a stealthy biological oxidant [Text] / R. Radi // J Biol
Chem.- 2013.-Vol. 288,№ 37.- P. 26464-26472.
206. Radi, R. Protein tyrosine nitration: biochemical mechanisms and structural basis
of functional effects [Text] / R. Radi // Accounts of Chemical Research.- 2013.-Vol.46.P.550–559.
207. Raja, B. Efficacy of piperine, an alkaloidal constituent of pepper on nitric oxide,
antioxidants and lipid peroxidation markers in L-NAME induced hypertensive rats
[Text] / B. Raja, S. Kumar, Kumar M. Saravana // Int. J. Res. Pharm. Sci. – 2010.Vol.1, №3. – P. 300-307.
208. Rawlings, N.D. MEROPS: the peptidase database [Text] / N.D. Rawlings, F.R.
Morton, A.J. Barrett // Nucleic Acids Res.- 2006.- Vol.34.- P. D270-D272.
209. Reddie, K.G. Expanding the functional diversity of proteins through cysteine
oxidation [Text] / K.G. Reddie, K.S. Carroll // Current Opinion in Chemical Biology.2008.- Vol.12,№6.- P. 746–754.
139
210. Role of cathepsin B in dengue virus-mediated apoptosis [Text] / A. Morchang [et
al.] // Biochem Biophys Res Commun.- 2013.-Vol. 438,№ 1.- P. 20-25.
211. Role of nitric oxide in immunity-A. REVIEW [Text] / A.K. Singh [et al.] //
Journal of Animal Science. - 2011.-Vol.24.- P 97-102.
212. Rzychon, M. Modes of inhibition of cysteine proteases [Text] / M. Rzychon, D.
Chmiel, J. Stec-Niemczyk // Acta Biochim Pol.- 2004.-Vol.51.- P. 861-873.
213. Schwedhelm, E. The role of asymmetric and symmetric dimethylarginines in
renal disease [Text] / E. Schwedhelm, R.H. Böger // Nat Rev Nephrol.- 2011.-Vol.7,№
5.- P. 275-285.
214. Secreted cathepsin L generates endostatin from collagen XVIII [Text] / U. Felbor
[et al.] // EMBO J.- 2000.- Vol.19, №6.- P. 1187-1194.
215. Semchyshyn, Halyna M. Interplay Between Oxidative and Carbonyl Stresses
[Text] / Halyna M. Semchyshyn,Volodymyr I. Lushchak // Molecular Mechanisms,
Biological Effects and Therapeutic
Strategies
of Protection.- 2012.- URL:
http://www.intechopen.com/books/oxidative-stress-molecular-mechanisms
216. Serum cathepsin H as a potential prognostic marker in patients with colorectal
cancer [Text] / A. Schweiger [et al.] // Int J Biol Markers.- 2004.-Vol.19.- P. 289-294.
217. Shin, H.J. Isobavachalcone suppresses expression of inducible nitric oxide
synthase induced by Toll-like receptor agonists [Text] / H.J. Shin, D.H. Shon, H.S.
Youn // Int Immunopharmacol.- 2013.-Vol. 15,№ 1.- P. 38-41.
218. Solution Structure of Calmodulin bound to the target peptide of Endothelial Nitric
Oxide Synthase phosphorylated at Thr495 [Text] / M. Piazza [et al.] // Biochemistry.2014.- Feb 4. [Epub ahead of print]
219. Spleen damage in endotoxamic mice: the involvement of nitric oxide [Text] / G.
Yilmaz [et al.] // Journal of physiology and pharmacology.- 2001.-Vol.52,№ 4.- P.729744.
220. Splenic cathepsin L is maturated from the proform by interferon-gamma after
immunization with exogenous antigens [Text] / T. Zhang [et al.] // Biochem Biophys
Res Commun.- 2001.-Vol.283, № 2.- P.499-506.
140
221. Stadtman, E.R. Metal ion-catalyzed oxidation of proteins: Biochemical
mechanismand biological consequences [Text] / E.R. Stadtman // Free Radical Biol.
Med.- 1990.- Vol.9.- P.315–325.
222. Stadtman, E.R. Role of oxidized amino acids in protein breakdown and stability
[Text] / E.R. Stadtman // Methods Enzymol.- 1995.- Vol. 258.- P. 379-393.
223. Stoka, Veronika. Lysosomal Cysteine Proteases: Structural Features and their
Role in Apoptosis [Text] / Veronika Stoka, Boris Turk, Vito Turk // IUBMB Life.2005.- Vol. 57,№ 4/5.-P.347 – 353.
224. Szabõ, Csaba. Peroxynitrite: biochemistry, pathophysiology and development of
therapeutics [Text] / Csaba Szabõ, Harry Ischiropoulos, Rafael Radi // NATURE
REVIEWS DRUG DISCOVERY.- 2006.- Vol. 6.- P. 662-680.
225. Takahama, Yousuke. Modest cortex and promiscuous medulla for thymic
repertoire formation [Text] / Yousuke Takahama, Keiji Tanakaand, Shigeo Murata //
Trends in Immunology.- 2008.- Vol.29, №6.- P. 251-255.
226. Targeting and regulation of reactive oxygen species generation by Nox family
NADPH oxidases [Text] / T.L. Leto [et al.] // Antioxid. Redox Signal.- 2009.- Vol.11.P. 2607–2619.
227. The crystal structure of the cysteine protease Xylellain from Xylella fastidiosa
reveals an intriguing activation mechanism [Text] / N.R. Leite [et al.] // FEBS Lett.2013.-Vol. 587,№ 4.- P. 339-344.
228. The expression of type-1 and type-2 nitric oxide synthase in selected tissues of
the gastrointestinal tract during mixed mycotoxicosis [Text] / M. Gajęcka [et al.] //
Toxins (Basel).- 2013.-Vol. 5,№ 11.- P. 2281-2292.
229. The immunomodulation of inducible nitric oxide in scallop Chlamys farreri
[Text] / Q. Jiang [et al.] // Fish Shellfish Immunol.- 2013.-Vol. 34,№1.- P. 100-108.
230. The nitric oxide synthase inhibitor NW-nitro-L-arginine methylester attenuates
brain catalase activity in vitro [Text] / S. Rotzinger [et al.] // LifeSci.- 1995.-Vol.56, №
16.- P.1321-1324.
141
231. Thickened skull, scoliosis and other skeletal findings in Unverricht-Lundborg
disease link cystatin B function to bone metabolism [Text] / S. Suoranta [et al.] //
Bone.- 2012.-Vol. 51,№ 6.- P. 1016-1024.
232. Thymic dendritic cells express inducible nitric oxide synthase and generate nitric
oxide in response to self - and alloantigens [Text] / S. Aiello [et al.] // The Journal of
Immunology. – 2000. – Vol. 164,№9. – P. 4649-4658.
233. Transport limitations of nitric oxide inhibition of platelet aggregation under flow
[Text] / J.L. Sylman [et al.] // Ann Biomed Eng.- 2013.-Vol. 41,№ 10.- P. 2193-2205.
234. Turk, Vito. Lysosomal Cysteine Proteases and Their Protein Inhibitors: Recent
Developments [Text] / Vito Turk, Boris Turk // Acta Chim. Slov. – 2008.-Vol.55.P.727–738.
235. Tyrosine iminoxyl radical formation from tyrosyl radical/nitric oxide and
nitrosotyrosine [Text] / B.E. Sturgeon [et al.] // J Biol Chem.- 2001.- Vol.276, № 49.P.45516-45521.
236. Upregulation of cathepsin W expressing T cell is specific for autoimmune
atrophic gastritis compared to other types of chronic gastritis [Text] / D. Kuester [et al.]
// World J Gastroenterol.- 2005.- Vol. 11.- P. 5951-5957.
237. Ushio-Fukai, M. Localizing NADPH oxidase-derived [Text] / M. Ushio-Fukai //
ROS. Sci. STKE.- 2006.- re8.
238. Villadangos, J.A. Control of MHC class II antigen presentation in dendritic cells:
a balance between creative and destructive forces [Text] / J.A. Villadangos, P.
Schnorrer, N.S. Wilson // Immunol Rev.- 2005.- Vol.207,№1.- P.191–205.
239. Von Knethen, A. Activation of peroxisome proliferator-activated receptor by
nitric oxide in monocytes/macrophages down-regulates p47phox and attenuates the
respiratory burst [Text] / A. Von Knethen, B. Brune // J. Immunol.- 2002.-Vol.169.- P.
2619–2626.
240. Wang, Zun-Yi. Role of nitric oxide (NO) in ocular inflammation [Text] / Zun-Yi
Wang, 'Rolf Ha'kanson // British Journal of Pharmacology.- 1995.- Vol.116.-P.24472450.
142
241. Watanabe, R. Reducing bone resorption by cathepsin K inhibitor and treatment of
osteoporosis [Text] / R. Watanabe, R. Okazaki // Clin Calcium.- 2014.-Vol. 24,№ 1.P. 59-67.
242. Watts, C. The endosome-lysosome pathway and information generation in the
immune system [Text] / C. Watts // Biochim Biophys Acta.- 2012.-Vol. 1824,№ 1.- P.
14-21.
243. Wehr, N.B. Quanti fication of protein carbonylation [Text] / N.B. Wehr, R.L.
Levine // Methods in Molecular Biology.- 2013.-Vol.965.- P. 265-281.
244. Wittek, N. Cystatin C - modulator of immune processes [Text] / N. Wittek, E.
Majewska // Przegl Lek.- 2010.-Vol.67,№ 7.- P. 484-487.
245. Wolters, Paul J. Chapman Importance of lysosomal cysteine proteases in lung
disease [Text] / Paul J. Wolters, A. Harold // Respir Res.- 2000.- Vol.1.- P.170–177.
246. Yan, L.J. Analysis of oxidative modification of proteins [Text] / L.J. Yan //
CurrProtoc Protein Sci.- 2009.- Unit14.4.- Chapter 14.
247. Zavasnik-Bergant,
T.
Cysteine
proteases:
destruction
ability
versus
immunomodulation capacity in immune cells [Text] / T. Zavasnik-Bergant, B. Turk //
Biol Chem.- 2007.-Vol. 388,№11.- P.1141–1149.