ДНК, подобн
реклама
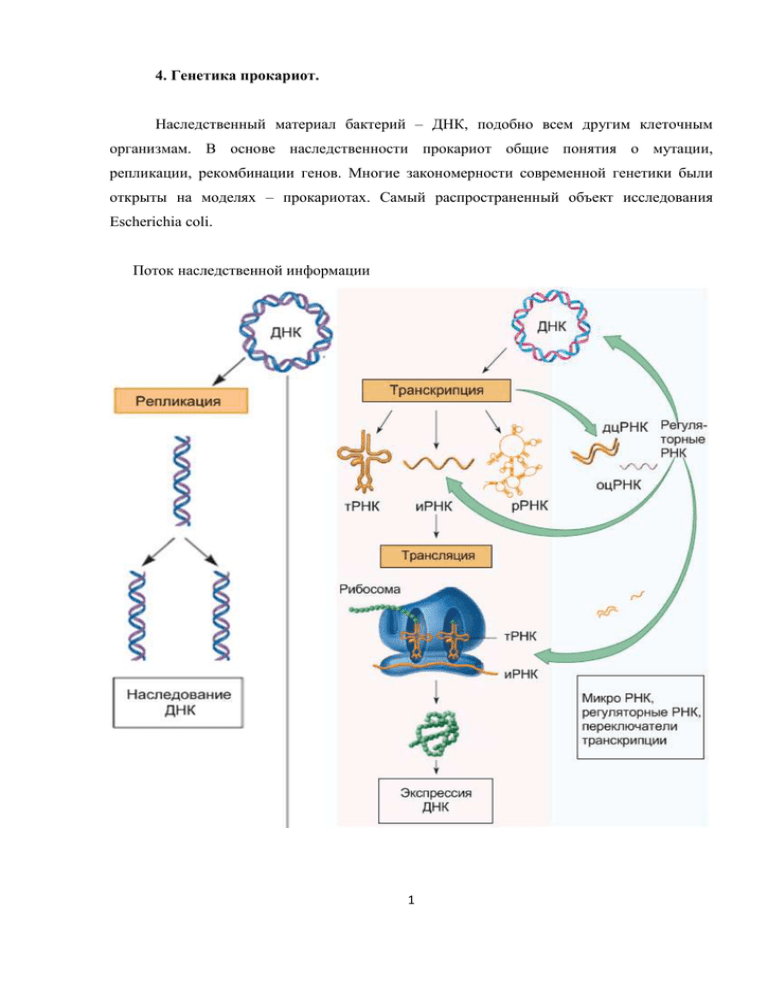
4. Генетика прокариот. Наследственный материал бактерий – ДНК, подобно всем другим клеточным организмам. В основе наследственности прокариот общие понятия о мутации, репликации, рекомбинации генов. Многие закономерности современной генетики были открыты на моделях – прокариотах. Самый распространенный объект исследования Escherichia coli. Поток наследственной информации 1 Основная догма молекулярной биологии: «Один ген – один фермент» существенно дополнена в наши дни. РНК-продукты экспресии генов также могут регулировать процессы клетки. Генетическая информация передается от родительских клеток дочерним (вертикально). Реализация информации происходит с помощью механизмов транскрипции и трансляции. Роль ДНК была доказана в опытах О. Эвери, К. Маклеода и М. Маккарти в 1944 (трансформация стрептококка). И в эксперименте А. Херши и М. Чейза в 1952 (трансдукция E.сoli фагом). 4.1. Организация генетического аппарата прокариот. ДНК прокариот – компактное образование в цитоплазме клетки. Генетический аппарат получил название нуклеоид. Занимает, как правило, центральную часть клетки и заполнен нитями ДНК. Нуклеоид по морфологии напоминает соцветие цветной капусты и занимает примерно 30% объема цитоплазмы. Его составляет одна кольцевая молекула ДНК – бактериальная хромосома. Бактериальная хромосома представляет собой кольцевую двуспиральную правозакрученную молекулу ДНК, которая свернута во вторичную спираль. Длина бактериальной хромосомы составляет примерно 4,7 млн. нуклеотидных пар (п.н.), или ~ 1,6 мм. В растущей культуре число бактериальных хромосом может достигать 4-8 на клетку. Вторичная структура хромосомы поддерживается с помощью гистоноподобных (основных) белков и РНК. Точка прикрепления бактериальной хромосомы к мезосоме (складке плазмалеммы) является точкой начала репликации ДНК (эта точка носит название OriC). ДНК – полинуклеотидная цепь, состоящая из дезоксинуклеотидов для которой выполняется правило Чаргаффа, соотношение AT/GC является специфичным для данного организма. ДНК состоит из 2 атипараллельных цепей и представляет собой двойную спираль. ДНК может иметь различные конформации (B, A, Z) – топоизомеры, переход катализируется топоизомеразами. Механизмы синтеза ДНК универсальны для всего живого (полуконсервативность). Организация генома прокариот (на примере E. coli) Бактериальная хромосома удваивается перед делением клетки, и сестринские копии распределяются по дочерним клеткам с помощью мезосомы. Репликация ДНК идет в две стороны от точки OriC и завершается в точке TerC. Молекулы ДНК, способные себя воспроизводить путем репликации, называются репликоны. Бактериальные хромосомы 2 содержат 2000 – 4000 генов. Обычно это гены «домашнего хозяйства», то есть необходимые для поддержания жизнедеятельности клетки. Хромосома бактерий. • Хромосома бактерий = крупный репликон. • Точка начала и терминации репликации. • Бактериальная ДНК не организована в нуклеосомы, но покрыта гистоноподобными белками, структурирующими нуклеоид. • Область нуклеоида почти не содержит рибосом. Организация генетического материала. • Цистрон = структурный ген (функциональная единица наследственного материала). Ген= Цистрон+регуляторные последовательности. Некоторые гены кодируют РНК-продукты (рРНК, тРНК, регуляторные РНК). • У бактерий несколько цистронов транскрибируются в общую полицистронную иРНК. Полицистронная иРНК – оперон. Как правило, в бактериальных и вирусных геномах гены не прерываются (нет структур подобных интронам в генах Эукариот), соответственно, иРНК у прокариот не подвергается сплайсингу. У некоторых фагов (на рисунке) и некоторых бактерий обнаружено перекрывание генетической информации. Гены бактерий на примере E. Coli. 1. Транспорт различных соединений и ионов в клетку (92). 2. Реакции, поставляющие энергию, включая катаболизм различных природных соединений (138). 3. Реакции синтеза аминокислот, нуклеотидов, витаминов, компонентов цепей переноса электронов, жирных кислот, фосфолипидов и некоторых других соединений (221). 3 4. Генерация АТФ при переносе электронов (15). 5. Катаболизм макромолекул (22). 6. Аппарат белкового синтеза (164). 7. Синтез нуклеиновых кислот, включая гены, контролирующие рекомбинацию и репарацию (49). 8. Синтез клеточной оболочки (42). 9. Хемотаксис и подвижность (39). 10. Прочие гены, в том числе с неизвестной функцией (110). Репликация ДНК прокариот. Бактериальные хромосомы в отличие от эукариотических имеют только одну точку начала репликации. Репликация ДНК происходит одновременно и сразу в двух направлениях кольца хромосомы, создавая две репликационные вилки. Раскручивание спирали ДНК в обоих направлениях должно вызвать скручивание хромосомы в направлении спирали и сделать хромосому такой плотной, что репликация должна бы закончиться, если бы не действие фермента ДНК-гиразы. Это представитель группы ферментов, называемых топоизомеразами, которые могут изменять форму молекул ДНК. ДНК-гираза предотвращает положительное суперскручивание, скручивая ДНК в противоположном направлении. В репликационных вилках ДНК расплетаются ферментом, называемым геликазой. Как только отдельные нити расплетутся, белки, связывающиеся с однонитевыми ДНК (ССБ-белки), не дают расплетенным нитям соединяться друг с другом вновь. Фермент праймаза использует участок на каждой нити расплетенной ДНК как матрицу для синтеза коротких нитей РНК, называемых праймерами, которые, в свою очередь, требуются для 4 начала дупликации ДНК ферментом ДНК-полимеразой. Примерно в середине процесса репликации хромосома похожа на греческую букву тета θ, поэтому процесс называется тета-репликацией. Сигма-репликация служит для полной или частичной репликации ДНК. Бактерии передают фрагмент ДНК в процессе конъюгации или при заражении бактерии вирусом. При сигма-репликации разрезается одна из нитей двойной спирали ДНК, а геликаза и ССБ-белки стабилизируют репликационную вилку в этом месте. Во время репликации ведущей нити матрица отстающей нити смещается и реплицируется в виде коротких фрагментов Оказаки. Репликация происходит так же, как репликация линейной ДНК у эукариот. В результате образуется кольцо с линейным хвостом. 5 Синтез каждого сегмента Оказаки происходит через следующие стадии: 1. Раскручивание нитей ДНК. 2. Расплетение (разделение нитей). 3. Стабилизация однонитевых участков. 4. Формирование праймосомы. Праймосома — мультиферментный комплекс, в который входят фермент ДНК-праймаза и ряд других белков. 5. Синтез с участием ДНК-праймазы (англ. prime — подготавливать) затравочной РНК. Затравочная РНК необходима для синтеза каждого сегмента Оказаки потому, что сама ДНК-полимераза не способна инициировать синтез ДНК, для этого ей нужна специальная затравка, роль которой и выполняют короткие, длиной не более 10 нуклеотидов, фрагменты РНК, комплементарные ДНК-матрице. 6. Синтез сегмента Оказаки. 7. Вырезание затравочной РНК и замещение ее дезоксирибонуклеотидами, комплементарными основаниям ДНК-матрицы. 8. Сшивание сегмента Оказаки с предсуществующей нитью ДНК с помощью лигазы. 9. Суперспирализация вновь синтезированных участков нитей ДНК. 10. Ревизия ДНК-полимеразой вновь синтезированного фрагмента ДНК — нет ли ошибочного включения нуклеотидов. Если произошла ошибка, то ошибочно включенный нуклеотид с частью этой нити вырезается и образовавшаяся брешь заполняется правильными нуклеотидами. Особенности репликации ДНК прокариот. • В осуществлении процессов репликации ДНК участвует целый комплекс ферментов, образующих единую структуру — реплисому. Скорость репликации ДНК у Е. coli при температуре 37ºС соответствует включению 2000 пар нуклеотидов в 1 с. • При благоприятных для роста бактерий условиях, когда еще не закончился один цикл репликации, могут возникать вторичные и третичные репликативные вилки, благодаря чему в клетке и происходит увеличение массы ДНК и числа копий хромосом. • Генетический контроль репликации ДНК осуществляется большим количеством генов (у Е. coli не менее 25), локализованных в самой ДНК. Комплекс генов обеспечивает строгую временную и пространственную координацию функционирования ферментов, участвующих в репликации. • Репликон – автономная репликационная единица, содержащая точку начала репликации. 6 Механизм распределения бактериальных хромосом: А - бактериальная клетка содержит частично реплицированную хромосому, прикрепленную к мембране в точке (или точках) репликации; Б - репликация хромосомы завершена. В бактериальной клетке две дочерние хромосомы, каждая из которых прикреплена к ЦПМ. Показан синтез клеточной стенки и ЦПМ; В - продолжающийся синтез мембраны и клеточной стенки приводит к разделению дочерних хромосом. Показано начало деления клетки путем образования поперечной перегородки; 1 - ДНК; 2 - прикрепление хромосомы к ЦПМ; 3 - ЦПМ; 4 - клеточная стенка; 5 синтезированный участок ЦПМ; 6 - новый материал клеточной стенки. Транскрипция у прокариот. • Транскрипция – процесс синтеза иРНК на матрице ДНК. • Транскрипционная единица может включать несколько цистронов. • Иницииация происходит на участке промотора. Сигма-субъединица РНКполимеразы распознает промотор. • После синтеза 12 нуклеотидов, сигма-фактор покидает РНК-полимеразу, начинается элонгация. • Существует множество стоп-сигналов: петли и шпильки РНК, белки терминирующие транскрипцию. • Кодирующая цепь ДНК– аналогична иРНК. Матричная – служит для синтеза иРНК (комплиментарна). • Начало синтеза на 3’ конце матричной цепи, синтез иРНК происходит от 5’ к 3’, при этом промотор распознает РНК полимеразу. 7 • Лидерная последовательность транскрибируется, но не транслируется. Содержит регион Шайн-Дельгарно, необходимый для инициации трансляции, иногда участвует в регуляции транскрипции и трансляции. • Обычно началом служит кодон AUG (формилметионин у бактерий). • Терминатор – отсоединение РНК-полимеразы. Трансляция полицистронной иРНК. 8 Трансляция у прокариот. • У E.coli скорость синтеза 900 аминокислот в минуту, у эукариот около 100 АК в минуту. • 30 S и 50 S субъединицы рибосом находятся в цитоплазме, их сборка часто инициируется иРНК, которая может формировать полисому. Максимальная загрузка иРНК – рибосома каждые 80 нуклеотидов (до 20 рибосом в полисоме). • Транскрипция и трансляция у Эубактерий и Архебактерий происходят совместно, когда синтезируется иРНК, рибосомы уже готовы к прикреплению и началу транскрипции. • Связывание рибосомы происходит на RBS участке (Шайна-Дельгарно). Инициирующий кодон кодирует формилметионин. • Многие антибиотики подавляют синтез белков. Тетрациклины блокируют А-сайт рибосомы, Хлорамфеникол, подавляет пептидилтрансферазную активность, стрептомицин нарушает узнавание кодонов. • Инициирование трансляции требует наличия 3 белковых регуляторов. • IF-3 обеспечивает связывание иРНК с 30 S субъединицей. IF-2 связывает ГТФ, формилметионин-тРНК, и обеспечивает прикрепление формилметионин-тРНК к Рсайту 50S. IF-1 отвечает за связывание 30 и 50 субъединиц. • Терминация трансляции чаще осуществляется UAA кодоном. 4.2. Изменчивость и мобильные элементы генома у прокариот. Изменчивость свойство организмов приобретать новые признаки, отличающие их от родительских форм. Изменчивость приводит к росту разнообразия в природных популяциях. Основные пути роста разнообразия в бактериальных популяциях – рекомбинация и обмен генетическим материалом (горизонтальный перенос генов). Источником новых генетических вариантов являются мутации, которые возникают постоянно и позволяют приобретать новые признаки, необходимы для выживания популяций и эволюции вида. Адаптивные мутации будут наследоваться, «вредные» мутации будут элиминироваться давлением отбора. Мобильные элементы осуществляют перенос генов и групп генов, способствуя изменчивости. В то же время большое количество повреждений ДНК может привести к гибели клетки, и, очевидно, стабильность генетического материала также необходима для выживания организма. Восстановления нарушенной структуры генетического материала 9 происходит при помощи ряда механизмов репарации ДНК. Баланс изменчивости и эффективной работы репарации обеспечивает стабильное развитие популяций, при котором частота мутаций поддерживается на определенном уровне (спонтанный мутационный процесс), достаточном для адаптации организмов к меняющимся условиям среды. Мутации – стабильные, наследуемые изменения нуклеотидной последовательности генетического материала. Спонтанные мутации возникают в результате ошибок репликации, разрывов ДНК и инсерций. Индуцированные мутации вызываются действием мутагенов. Нормальная частота спонтанных мутаций одна на 106 – 108 клеток. В зависимости от изменения биосинтетических возможностей клеток выделяют: • Клетки ауксотрофы – потеря способности синтезировать один из компонентов компонентов клетки в результате мутации. • Прототрофы – сохраняют способность к синтезу. • Ревертанты – восстановление исходного фенотипа и супрессоры восстановление благодаря мутации в другом сайте. Клетки бактериальных культур «чистых линий» происходят от одной клетки – общего предка, несмотря на это, в популяции появляются клетки с генотипом отличным от родительской особи. Причина – постоянно возникающие мутации. Генные (точковые) мутации. В случае генной мутации происходит замена основания, А-Т – G-C (пурины A и G заменяют пурины, пиримидины C и T - пиримидины). Различают вставки, делеции, инверсии и замены (транзиции и трансверсии). Предполагается, что один из главных источников ошибок репликации – таутомеризация азотистых оснований. Таутомерия – явление обратимой изомерии, когда два или более изомеров легко переходят друг в друга. Для азотистых оснований помимо основной, привычной формы, существуют редкие таутомеры, которые отличаются меньшей стабильностью. Большую часть времени основания пребывают в обычной форме, но в течение небольших промежутков времени (микросекунд) могут переходить в неустойчивые таутомерные формы, что может приводить к образованию неправильных пар оснований. Так редкая имино-форма цитозина образует пару с аденином, енольная форма тимина – с гуанином. 10 Временная енолизация гуанина приводит к формированию GC – AT транзиции (мутант). Мутация проявляется во втором поколении, если GT не будет репарирована в первом поколении 5-Бром урацил – аналог оснований, который может формировать пары с аденином и гуанином, что впоследствии может приводить к замене основания. Репарация ДНК. Эксцизионная репарация – исправляет повреждения одной из цепей (пиримидиновые димеры, АР-сайты и т.д.), использует вторую цепь в качестве матрицы для заполнения пробелов. При воздействии ультрафиолетового излучения отмечено явление фотореактивации в ответ на возникновение повреждений (пиримидиновых димеров). Репарация неспаренных нуклеотидов (mismatch repair). Рекомбинационная репарация (используется неповрежденная цепь). SOS-репарация. При множественных повреждениях останавливается синтез ДНК. 11 Механизмы роста генетического разнообразия прокариот. Рост генетического разнообразия происходит в процессах рекомбинации, когда генетический материал разных молекул ДНК комбинируется в гибридной молекуле ДНК. У эукариот – рекомбинация в мейозе. У прокариот – рекомбинация 3 типов, по молекулярным механизмам схожая с рекомбинацией эукариот. • Гомологичная рекомбинация. Реципрокный обмен участками хромосом с аналогичными нуклеотидными последовательностями. Возможен нереципрокный обмен с короткими участками ДНК. • Сайт-специфическая рекомбинация. Интеграция многих вирусных геномов. Донор имеет небольшой участок, гомологичный ДНК хозяина. • Транспозиция. С участием мобильных элементов генома. Гомологичная рекомбинация. 12 Транспозиция. • Рекомбинация, не зависящая от гомологии участков ДНК, которая происходит во многих сайтах генома с участием мобильных элементов генома – транспозонов. Мобильные элементы могут перемещаться между хромосомной и нехромосомной ДНК, они внедряются в геном хозяина, меняя генную структуру или подчиняя экспрессию генов новым регуляторным элементам. Данный тип рекомбинации не зависит от гомологии участков ДНК и происходит во многих сайтах генома. Мобильные элементы внедряются в геном хозяина, меняя генную структуру или подчиняя экспрессию генов новым регуляторным элементам, они могут перемещаться между хромосомной и нехромосомной ДНК. Плазмиды. Небольшие молекулы ДНК (от 1 000 п.н. до неск. сот тыс. п.н.), способные к самостоятельной репликации (репликон). Существуют в свободном состоянии или в составе хромосом. Эписомы – плазмиды способные к обратимой интеграции в хромосому. Крупные плазмиды, содержащие гены «домашнего хозяйства» – называют хромосомами. Плазмиды состоят из модулей: обязателен репликативный, другие опциональны. Плазмиды реплицируются независимо от хромосомы, могут существовать в большом количестве в клетке. Могут содержать мобильные элементы (транспозоны), способные переходить от плазмиды к хромосоме и между плазмидами. 1 – бактериальная хромосома, 2 – плазмиды, 3 – деление, 4 – ДНК с включенным материалом плазмид 13 Понятие мобилом – объединяет мобильные генетические элементы клетки. Плазмиды способны переносить генетический материал при конъюгации бактериальных клеток (F-плазмиды). В их состав входят гены белков пилей и другие, всего до 14 генов. В плазмидах переносятся гены деградации ксенобиотиков и азотфиксирующих ферментов. Горизонтальный перенос генов. Перенос генов между 2 прокариотическими организмами. Важный механизм увеличения генетического разнообразия у прокариот. Часть геном – экзогенот переноситься от донора к реципиенту и интегрируется в эндогенот. Мерозигот временное диплоидное состояние части наследственного материала прокариот. Бактерии способны обмениваться участками наследственного материала, в том числе генами устойчивости к антибиотикам. Обмен может происходить между непатогенными и патогенными формами. Конъюгация. • Прямой перенос ДНК во время временного физического контакта клеток. Трансформация. • Перенос свободных молекул ДНК. Трансдукция. Перенос молекул ДНК с участием бактериальных вирусов. Конъюгация бактерий • Конъюгация – перенос генетического материала между бактериальными клетками при помощи прямого клеточного контакта. Включает F-фактор (F-плазмиду), половые пили и систему секреции IV типа. • При F+ X F- конъюгации, F-плазмида существует независимо от бактериальной хромосомы и переноситься в клетку реципиента целиком, гены донора обычно не переносятся. • При Hfr-конъюгации, происходит частичная репликация донорской ДНК, переноситься только цепь ДНК (Hfr), содержащая гены плазмиды и хозяина, F-плазмида интегрирована в хромосому хозяина и не переноситься целиком. 14 F+ X F- конъюгация. 15 Hfr-конъюгация. Инсерция F-плазмиды в бактериальную хромосому с образованием Hfr-клетки. Затем происходит конъюгация Hfr-клетки с новым реципиентом. Трансформация. Впервые явление трансформации описано Ф. Гриффитом в 1928. Включает перенос ДНК без участия дополнительных структур. Внесенная ДНК включается в геном и может наследоваться. 16 Часто фрагменты ДНК выходят во внешнюю среду при лизисе клетки, при попадании в «компетентную» клетку вызывают трансформацию. Средняя частота трансформации «компетентных клеток» 10-3. Компетентность зависит от размеров популяции, при достижении больших размеров кл./мл., на 107-108 поверхности экспрессируется отвечающий белок за трансформацию. Происходит почвенных и в водных экосистемах. Трансформация может осуществляться фрагментами ДНК и плазмидами. Трансформация бактерий Streptococcus pneumonia.Генетический материал от клеток s-формы, убитых нагреванием попадает в живые клетки R-формы, вызывая их трансформацию в патогенную S-форму. 17 Для переноса ДНК через клеточные оболочки имеются сложные системы, включающие ферменты нуклеазы, транслоказы и другие, а также некоторые структурные белки образующие канал для перемещения ДНК. Один из таких механизмов – система секреции IV типа. Трансдукция. Трансдукцию осуществляют бактериофаги, переносящие невирусную информацию. Профаг – внедренный в хромосому геном вируса. Ошибки в жизненном цикле фага могут приводить к попаданию в капсид вируса фрагментов ДНК бактерии. Вирулентные фаги вызывают лизис клетки после увеличения количества фаговых частиц в клетке – литический цикл. Умеренные фаги внедряются в геном хозяина, совместно реплицируются длительное время – лизогенный цикл. 18 Общая трансдукция Описана в 1951г. Дж.Ледербергом и Н.Циндером. Процесс включает неспецифический перенос разнообразных генов хозяина. Во время лизиса клетки-хозяина обломки ДНК хозяина (0,5 – 2,5 %) укладываются под капсидную оболочку вместе с ДНК фага. Подобная трансдукция характерна для литических циклов. Наследование внесенной ДНК происходит только при условии успешной гомологичной рекомбинации с ДНК клетки-хозяина. Если ген не может быть интегрирован в геном хозяина – абортивная трансдукция. Специфическая трансдукция. Перенос ограниченного числа генов, расположенных в участке включения ДНК фага в хромосому бактерии. Происходит в результате ошибки лизогенного цикла, когда профаг покидает хромосому хозяина, вырезание может быть неточным, захватывая участок ДНК хозяина (5-10%). Наиболее известный пример – фаг лямбда, который размножается 2 способами: при литическом цикле присутствует в виде автономной молекулы ДНК, которая обеспечивает синтез фаговых частиц. При лизогенном цикле ДНК фага интегрирована в хромосому и реплицируется пассивно. Дефектный фаг может содержать гены, следующие на хромосоме за точкой внедрения и профагом. 19 4.3. Регуляция экспрессии генов у прокариот. Регуляция метаболизма, поведения, морфологии бактерий осуществляется с помощью контроля экспрессии генов. Прокариоты способны быстро меняться в ответ на условия среды, переключая работу многих гены и оперонов. Для адаптации и экономии ресурсов экспрессия должна строго регулироваться. Регуляция экспрессия эукариот сложнее в сравнении с прокариотами и включает больше точек контроля. Контроль осуществляется на уровне инициации и элонгации транскрипции, трансляции и посттрансляции. Архебактерии схожи с эубактериями по организации генома, однако их регуляторные механизмы имеют большое сходство с эукариотическими организмами. Примеры: Почвенный микроорганизм Bacillus subtilis при понижении концентрации питательных веществ запускает процессы споруляции. Патогенные организмы при попадании в организм хозяина приспосабливаются к температуре и высокой концентрации питательных веществ. Например, хромосома Escherichia coli кодирует 4500 белков, многие из которых не экспрессируются. Некоторые участки экспрессируются постоянно, некоторые – раз за генерацию. Исследования Е. coli показали, что у бактерий существуют ферменты 3 типов: конститутивные, присутствующие в клетках в постоянных количествах независимо от метаболического состояния организма (например, ферменты гликолиза); индуцируемые, их концентрация в обычных условиях мала, но может возрастать в 100 раз и более; репрессируемые, т.е. ферменты метаболических путей, синтез которых прекращается при добавлении в среду выращивания конечного продукта этих путей. 20 Уровни регуляции активности генов в трех доменах жизни. Механизмы транскрипции и трансляции схожи у всех живых организмов. Бактерии не содержат гистонов (за исключением некоторых архебактерий), их ДНК более доступна для РНК-полимеразы, в то же время Эукариоты имеют дополнительные этапы регуляции, связанные с изменением моноцистронны, требуется структуры хроматина. обработка иРНК Молекулы (кэпирование, РНК у эукариот полиаденилирование, вырезание интронов). У прокариот транскрипция и трансляция происходят совместно. Лактозный оперон. При выращивании E.coli на среде с лактозой, содержание лактозы достигает 3000 молекул на клетку, без лактозы – 3 молекулы. Фермент галактозидаза расщепляет лактозу на галактозу и глюкозу. Галактозидаза – индуцибельный фермент, кодируется индуцибельными генами. Лактоза – индуктор. Промотор – связывает РНК-полимеразу. Регуляторный элемент – участок ДНК, примыкающий к промотору и связывающий белок-регулятор (активатор или репрессор). 21 Схема связывания репрессора с промоторным участком. Лактозный оперон представляет пример отрицательного (белок регулятор, связывая ДНК, тормозит транскрипцию), индуцибельного (при появлении субстрата – лактозы, запускается синтез галактозидазы) контроля генов. Положительными обозначают пути регуляции, в которых белок выполняет функции активатора, связывая ДНК, он активирует транскрипцию сайта. Также регуляцию можно разделить на индуцибельную (запуск транскрипции в присутствии субстрата) и репрессибельную (торможение транскрипции в присутствии субстрата). В таблице приведены различные возможные типы регуляции активности генов. Особенности механизмов контроля инициации транскрипции. Экспрессия генов осуществляется с разной интенсивностью на протяжении жизни бактерии. Ингибирование транскрипции не приводит к полному «выключению» гена. Синтез иРНК замедляется и остается на очень низком уровне («базальный уровень транскрипции»). Решение о синтезе фермента, метаболизирующего субстрат клетка «принимает» в случае если в среде есть субстрат, но нет предпочтительного источника углерода. Группы оперонов. Опероны (сходные функции), которые регулируются общим регуляторным протеином – регулон. Опероны (общее направление), которые регулируются одним общим регуляторным белком, но каждый из оперонов также подвержен отдельным частным механизмам регуляции – модулон. 22 Опероны (общий стимул), которые функционируют совместно в ответ на воздействие окружающей среды -- стимулон. Может содержать несколько регулонов или модулонов. Катаболическая репрессия. Наличие предпочтительного источника углерода (углерода) требует скоординированной репресии генов, кодирующий альтернативные пути получения энергии (катаболизм арабинозы, мальтозы, галактозы, лактозы). Переход на другой источник энергии определяет характерную форму кривой роста – диауксический рост. Роль цАМФ в регуляции оперонов. Координация катаболических оперонов осуществляется при помощи цАМФрегуляторного белка (CAP). Активация происходит при связывании цАМФ. Уровень цАМФ регулируется аденилатциклазой, активность, которой возрастает при недостатке глюкозы в клетке. Катаболические опероны контролируются 2 типами белков: 1) Специфическим для оперона. 2) Общий механизм – цАМФ регуляторный белок (САР). 23 Катаболическая репрессия на примере лактозного оперона 24
