ГБОУ ВПО Ставропольский государственный медицинский университет Министерства здравоохранения Российской Федерации
реклама
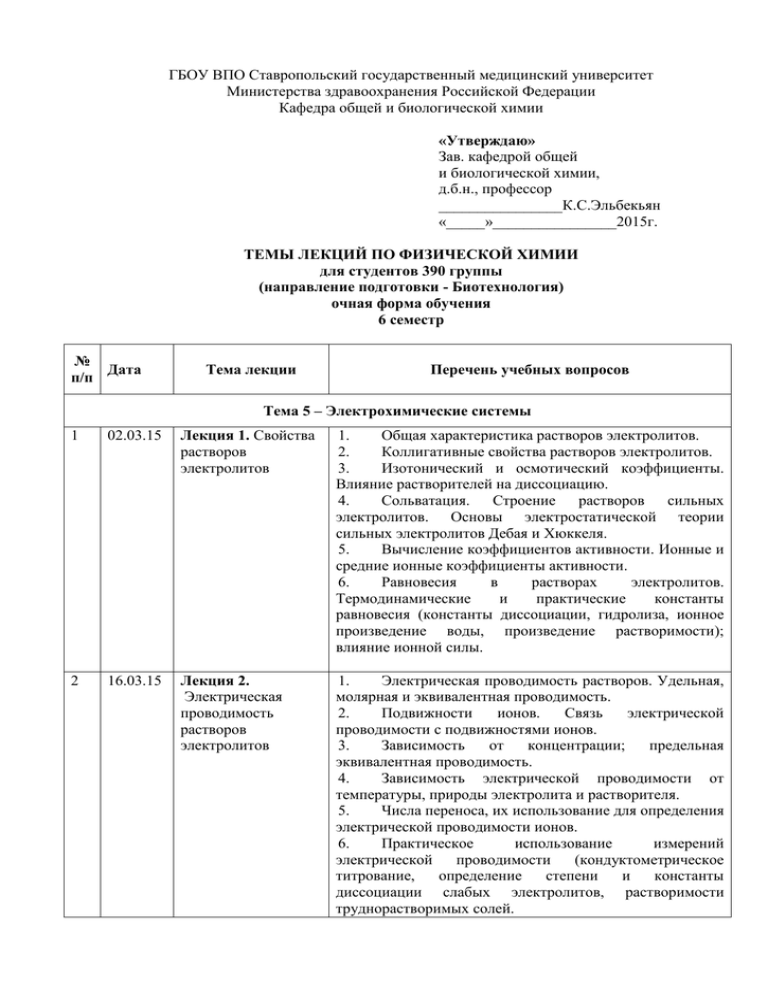
ГБОУ ВПО Ставропольский государственный медицинский университет Министерства здравоохранения Российской Федерации Кафедра общей и биологической химии «Утверждаю» Зав. кафедрой общей и биологической химии, д.б.н., профессор ________________К.С.Эльбекьян «_____»________________2015г. ТЕМЫ ЛЕКЦИЙ ПО ФИЗИЧЕСКОЙ ХИМИИ для студентов 390 группы (направление подготовки - Биотехнология) очная форма обучения 6 семестр № Дата п/п Тема лекции Перечень учебных вопросов Тема 5 – Электрохимические системы 1 02.03.15 Лекция 1. Свойства растворов электролитов 1. Общая характеристика растворов электролитов. 2. Коллигативные свойства растворов электролитов. 3. Изотонический и осмотический коэффициенты. Влияние растворителей на диссоциацию. 4. Сольватация. Строение растворов сильных электролитов. Основы электростатической теории сильных электролитов Дебая и Хюккеля. 5. Вычисление коэффициентов активности. Ионные и средние ионные коэффициенты активности. 6. Равновесия в растворах электролитов. Термодинамические и практические константы равновесия (константы диссоциации, гидролиза, ионное произведение воды, произведение растворимости); влияние ионной силы. 2 16.03.15 Лекция 2. Электрическая проводимость растворов электролитов 1. Электрическая проводимость растворов. Удельная, молярная и эквивалентная проводимость. 2. Подвижности ионов. Связь электрической проводимости с подвижностями ионов. 3. Зависимость от концентрации; предельная эквивалентная проводимость. 4. Зависимость электрической проводимости от температуры, природы электролита и растворителя. 5. Числа переноса, их использование для определения электрической проводимости ионов. 6. Практическое использование измерений электрической проводимости (кондуктометрическое титрование, определение степени и константы диссоциации слабых электролитов, растворимости труднорастворимых солей. 3 4 5 6 1. Механизм возникновения скачка потенциала и двойного электрического слоя на границе раздела металл – раствор электролита. 2. Электрохимический потенциал. Электродвижущие силы электрохимических систем. 3. Гальванические элементы. Водородная шкала электродных потенциалов. 4. Равновесный потенциал. Стандартные потенциалы. Выражение равновесного потенциала для электродов различных типов (электроды первого и второго рода, окислительно-восстановительные, ионообменные). 5. Классификация гальванических элементов (химические и концентрационные элементы, элементы с переносом и без переноса). Диффузионный потенциал. 6. Использование стандартных потенциалов для определения направления химических и электрохимических реакций. Определение ΔG, ΔS, ΔH и константы равновесия реакции, протекающей в гальваническом элементе. 13.04.15 Лекция 4 1. Практическое использование (продолжение) потенциометрических измерений (определение рН, степени и константы диссоциации слабых электролитов, степени и константы гидролиза, коэффициентов активности сильных электролитов, потенциометрическое титрование, определение произведения растворимости, константы нестойкости и состава комплексного соединения, чисел переноса). 27.04.15 Лекция 5. 1. Электролиз. Катодные и анодные процессы. Кинетика 2. Характеристика скорости электрохимических электрохимических процессов с помощью поляризационных кривых. процессов и 3. Виды поляризации электродов. Концентрационная электрохимическая поляризация; предельный ток. коррозия. 4. Практическое значение перенапряжения при выделении водорода. Анодное перенапряжение, пассивирование металлов. 5. Электрохимическая коррозия. 6. Термодинамические и кинетические факторы в коррозии. 7. Способы защиты от коррозии. Тема 6. Физическая химия поверхностных явлений и дисперсных систем 30.03.15 Лекция 3. Термодинамика гальванических элементов. Потенциометрия. Химические источники тока 11.05.15 Лекция 1. Введение. Термодинамика поверхностных явлений 1. Классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды. Классификация свободнодисперсных систем по размерам частиц. Лиофильные и лиофобные дисперсные системы. 2. Общая характеристика поверхностной энергии. Поверхностное натяжение как мера энергии Гиббса межфазной поверхности. Внутренняя (полная) удельная поверхностная энергия. Зависимость энергетических параметров поверхности от температуры. 3. Адсорбция и поверхностное натяжение. Связь адсорбции с параметрами системы: изотерма, изопикна и 7 25.05.15 Лекция 2. Адсорбционные равновесия. Электрические явления на поверхности 8 08.06.15 Лекция 3. Кинетические и оптические свойства дисперсных систем изостера адсорбции. 4. Фундаментальное адсорбционное уравнение Гиббса. Гиббсовская адсорбция. Частное выражение уравнения Гиббса. Поверхностно-активные и поверхностно-инактивные вещества. 5. Адгезия, смачивание и растекание жидкостей. Адгезия и когезия. Природа сил межфазного взаимодействия. Уравнение Дюпре для работы адгезии. Смачивание и краевой угол. Значение адгезии, смачивания и растекания в химической технологии. 6. Получение дисперсных систем. Методы диспергирования. Гомогенная и гетерогенная конденсация. Примеры получения дисперсных систем методами физической и химической конденсации. 1. Адсорбция газов и паров на однородной поверхности. Закон Генри. 2. Уравнение мономолекулярной адсорбции Ленгмюра и его анализ. Определение констант этого уравнения (линейная форма уравнения Ленгмюра). Уравнение Фрейндлиха. 3. Теория полимолекулярной адсорбции БЭТ, уравнение изотермы адсорбции, его анализ. Линейная форма уравнения БЭТ и расчет его констант. Определение удельной поверхности методом БЭТ. 4. Адсорбция поверхностно-активных веществ. Влияние строения молекул ПАВ на поверхностную активность, правило Траубе. Определение строения адсорбционного слоя и размеров молекул ПАВ. 5. Механизм образования двойного электрического слоя (ДЭС). 6. Толщина диффузного слоя и влияние на нее различных факторов. Емкость ДЭС. Двойной электрический слой по теории Штерна, перезарядка поверхности. Примеры образования ДЭС. Строение мицеллы. 7. Четыре вида электрокинетических явлений. Электрокинетический потенциал и влияние на него различных факторов. Уравнение ГельмгольцаСмолуховского для электроосмоса и электрофореза. 8. Практическое использование электрокинетических явлений. 1. Основы седиментационного анализа. Связь размеров частиц со скоростью их осаждения. Условия соблюдения закона Стокса. 2. Седиментационный анализ полидисперсных систем. Кривая седиментации. Кривые распределения частиц по радиусам. 3. Броуновское движение и его молекулярнокинетическая природа. Связь между средним сдвигом частиц и коэффициентом диффузии (закон ЭйнштейнаСмолуховского. 4. Особенности оптических свойств дисперсных 9 22.06.15 Лекция 4. Агрегативная устойчивость и коагуляция дисперсных систем ИТОГО за 6 семестр: систем. Уравнение Рэлея для светорассеяния, его анализ. 5. Фиктивное поглощение света дисперсными системами и уравнение Бугера-Ламберта-Бера. Оптические методы исследования дисперсных систем (нефелометрия, турбидиметрия). 6. Определение размеров частиц, не подчиняющихся уравнению Рэлея (уравнение Геллера). Ультрамикроскоп, определение размеров частиц в золях, поточный ультрамикроскоп. 1. Лиофильные дисперсные системы. Классификация и общая характеристика поверхностно-активных веществ. Термодинамика и механизм мицеллообразования. Строение мицелл ПАВ. Солюбилизация. Основные факторы, влияющие на ККМ. Методы определения ККМ. Применение ПАВ. 2. Лиофобные дисперсные системы. Факторы устойчивости лиофобных систем. Быстрая и медленная коагуляция. Кинетика коагуляции по Смолуховскому. Определение скорости и времени половинной коагуляции. Зависимость числа частиц разного порядка от времени. 3. Основные положения теории ДЛФО. Расклинивающее давление и его составляющие. Энергия электростатического отталкивания при взаимодействии слабозаряженных поверхностей. Потенциальный барьер и его зависимость от толщины диффузного слоя. 4. Нейтрализационная и концентрационная коагуляция. Порог коагуляции. Правило Шульце-Гарди. Коагуляция в системах, стабилизированных ВМС и ПАВ. Методы очистки промышленных растворов, основанные на изменении агрегативной и седиментационной устойчивости дисперсных систем. 18 ч. Обсуждение на заседании кафедры «__»_________20____ протокол №___