Лекция 5 «Термодинамика фазовых равновесий»
реклама

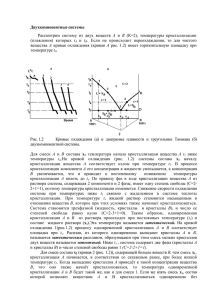
Лекция 5 «Термодинамика фазовых равновесий в двухкомпонентных конденсированных гетерогенных системах» • В двухкомпонентных системах возможны четыре вида двухфазных равновесий: Ж – П; К – П; К – Ж; К – К. • Системы, в которых отсутствует газовая фаза или же ею можно пренебречь, называются конденсированными. • Если система содержит 2 компонента (А и В), то её состояние зависит не только от температуры и давления (внешних факторов), но ещё и от состава. • В изобарных или изотермических условиях фазовое равновесие будет зависеть только от одного внешнего фактора и степень свободы системы, в соответствии с правилом фаз Гиббса, определяется уравнением: C = К – Ф + 1 • Диаграмма состояния бинарных систем, графически изображающая зависимость температур плавления и кристаллизации смесей от их состава, называется диаграммами плавкости. • Если при охлаждении расплавов смесей веществ А и В различного состава выпадают чистые индивидуальные кристаллы (либо вещества А , либо вещества В), то такие вещества называются неограниченно растворимыми в жидком состоянии, но полностью нерастворимыми в кристаллическом состоянии. • Если же при охлаждении расплавов смесей веществ А и В различного состава одновременно кристаллизуются оба компонента, входящие в одну кристаллическую фазу – твёрдый раствор, – то такие вещества называются полностью растворимыми друг в друге в жидком и кристаллическом состоянии. Термический анализ. Кривые охлаждения • При исследовании систем методом термического анализа обычно используют образцы, полученные сплавлением компонентов А и В с последующим медленным охлаждением этого расплава. • По результатам измерений строят график зависимости температуры от времени и получают так называемые кривые охлаждения. • Кривые охлаждения показывают, как меняется температура системы при постоянной скорости отвода теплоты в окружающую среду. • При изменении фазового состояния системы на кривых охлаждения появляются изломы или горизонтальные участки. T, °C I Т пл II III О ТМ К М Тэ t, сек При охлаждении расплава индивидуального вещества А (кривая I) его температура будет равномерно понижаться с постоянной скоростью до тех пор, пока при определенной температуре не начнѐтся кристаллизация, так как растворимость веществ уменьшается с понижением температуры Рис. 1. Кривые охлаждения чистого вещества (I) и смесей неэвтектического (II) и эвтектического (III) состава Кристаллизация расплавленного чистого вещества вызывает температурную остановку, так как состав жидкой фазы остаѐтся неизменным, а выделяющаяся теплота кристаллизации полностью компенсирует отвод теплоты в окружающую среду. Температура остаѐтся постоянной пока не закончится процесс кристаллизации. После окончания кристаллизации происходит дальнейшее равномерное охлаждение кристаллической фазы. T, °C I Т пл II III Т нач. кр. О М К Тэ t, сек Рис. 1. Кривые охлаждения чистого вещества (I) и смесей неэвтектического (II) и эвтектического (III) состава Если к веществу А , которое выполняет роль растворителя, добавить некоторое количество вещества В (кривая II), то температура начала кристаллизации смеси понизится, согласно закону Рауля. Охлаждение расплава смеси также происходит равномерно, пока при температуре, отвечающей точке О, не начнѐтся кристаллизация исходного вещества А. Отвердевание смеси всегда начинается с того вещества, относительно которого жидкий раствор становится насыщенным. Выделяющаяся при этом теплота кристаллизации замедляет охлаждение и на кривой охлаждения появляется излом (точка О). При дальнейшем охлаждении температура равномерно понижается (участок ОК). На этом участке охлаждения состав жидкой фазы непрерывно изменяется (идѐт обеднение компонентом А и обогащение компонентом В). T, °C I Т пл II III О Т нач. кр. К М Тэ N t, сек Рис. 1. Кривые охлаждения чистого вещества (I) и смесей неэвтектического (II) и эвтектического (III) состава При достижении температуры, при которой жидкий раствор становится насыщенным, не только по отношению к компоненту А, но и к компоненту В, происходит одновременная кристаллизация обоих веществ. Раствор, насыщенный обоими компонентами и имеющий наименьшую температуру кристаллизации, называется эвтектическим. Состав жидкой фазы (эвтектический состав) при этом остаѐтся постоянным, поэтому на кривой охлаждения наблюдается температурная остановка (участок КМ), которая отвечает выпадению мелких кристаллов обоих компонентов (выпадению эвтектики). Самая низкая температура, при которой заканчивается кристаллизация расплава любого состава, называется эвтектической температурой Тэ. При более низкой температуре система существует только в твѐрдом состоянии; охлаждению твѐрдой смеси отвечает участок MN. Для двухкомпонентных систем ход кривой охлаждения, T, °C аналогичный наблюдаемому для чистых веществ, имеет место только при кристаллизации Т нач. кр. Т пл О систем эвтектического состава М Тэ (кривая III). Из двухкомпонентных К систем неэвтетического состава (кривая II) выпадение кристаллов N происходит в некотором температурном интервале и t, сек протекает в два этапа: сначала в твердую фазу переходит Рис. 1. Кривые охлаждения чистого находящийся в вещества (I) и смесей неэвтектического (II) компонент, расплаве в избытке по и эвтектического (III) состава сравнению с эвтектическим составом (участок ОК), а затем, когда состав жидкой фазы станет эвтектическим, при постоянной температуре Тэ кристаллизуется эвтектика (участок КМ). I II III Диаграмма плавкости двухкомпонентной системы с неограниченной взаимной растворимостью в жидком состоянии и полной нерастворимостью – в кристаллическом состоянии • На основании анализа кривых охлаждения чистых компонентов А и В и их смесей различного состава строят диаграмму «температура – состав» (диаграмму плавкости). А В Рис. 2. Кривые охлаждения (а) и диаграмма плавкости системы (b) с полной нерастворимостью компонентов друг в друге в кристаллическом состоянии и неограниченной нерастворимостью в жидком состоянии На рисунке представлены кривые для чистых веществ А и В (кривые 1 и 5) и для смесей веществ А и В различного состава (кривые 2, 3 и 4). А В • Пока в системе не происходит фазовых превращений (например, охлаждается расплав), график зависимости температуры системы от времени (Рис. 2, а) представляет собой прямую линию, угол наклона которой к оси абсцисс зависит только от скорости теплообмена с окружающей средой, чему соответствуют участки кривых охлаждения до верхней точки перегиба – точки начала кристаллизации (точка соответствует температуре выпадения первого кристалла). А В • При кристаллизации чистых веществ на кривых охлаждения 1 и 5 наблюдается температурная остановка (горизонтальные участки кривых охлаждения), которая соответствует температуре плавления (кристаллизации) индивидуальных компонентов А и В, соответственно. • Итак, для чистых веществ температуры начала и конца кристаллизации одинаковы. Чистые вещества кристаллизуются (и плавятся) при постоянной температуре (горизонтальные участки на кривых охлаждения 1 и 5). А В • При кристаллизации из расплавов смесей, которым соответствуют кривые охлаждения 2 и 4, процесс охлаждения замедляется (более пологие участки кривых охлаждения 2 и 4). Когда в системе закристаллизуется последняя капля жидкости – точка конца кристаллизации (точка соответствует температуре кристаллизации последней капли жидкости) – теплота кристаллизации прекращает выделяться и скорость охлаждения системы возрастает. А В • Для двухкомпонентной системы, которой соответствует кривая охлаждения 3, ход кривой охлаждения аналогичен наблюдаемому для чистых веществ (горизонтальный участок на кривой охлаждения 3). А В • Если взяты расплавы, отличающиеся по составу, то кристаллизация начнётся при разных температурах. Однако закончится она, независимо от состава исходной смеси, при одной и той же температуре: последняя капля жидкости перейдёт в твёрдую фазу при наинизшей температуре (Тэ) – эвтектической температуре. Состав бинарной смеси, при котором достигается эвтектическая температура, называется эвтектическим составом (в данном случае: 60% А и 40% В). А В • Из двухкомпонентых систем неэвтектического состава (кривые охлаждения 2 и 4) выпадение кристаллов происходит в некотором температурном интервале и протекает в два этапа: сначала в твёрдую фазу переходит компонент, находящийся в расплаве в избытке по сравнению с эвтектическим составом (наклонный участок на кривой охлаждения), а затем, когда состав жидкой фазы станет эвтектическим (горизонтальный участок кривой охлаждения), происходит выпадение кристаллов компонентов А и В. Построение и анализ диаграмм плавкости А В Построение диаграмм плавкости по кривым охлаждения производится переносом на ось ординат точек начала и конца кристаллизации с кривых охлаждения на график «состав – температура», где по оси абсцисс откладывается исходные состав смеси (Рис. 2). Точки на диаграмме состояния, соответствующие равновесному состоянию системы, при конкретно заданных внешних параметрах, называются фигуративными. Построение и анализ диаграмм плавкости А В На диаграмме плавкости (Рисунок 2, b) ордината А отвечает 100% вещества А (0% вещества В), а ордината В – 100% вещества В (0% вещества А). Точки а0 и b0 соответствуют температурам кристаллизации (плавления) чистых веществ А и В. Фигуративные точки, расположенные на одной из этих ординат, показывают, что система однокомпонентая (К = 1), а расположенные в любом другом месте диаграммы – указывают на то, что система двухкомпонентная (К = 2). Построение и анализ диаграмм плавкости А В Если соединить сплошными линиями точки начала кристаллизации систем с различным исходным составом, а также точки конца их кристаллизации, то диаграмма состояния окажется разделенной этими линиями на несколько зон, внутри каждой из которых число и характер фаз не меняются. Построение и анализ диаграмм плавкости А В Линия, соединяющая температуры начала кристаллизации, называется линией ликвидуса (liquidus – жидкий). Линия, соединяющая температуры конца кристаллизации, называется линией солидуса (solidus – твёрдый). Ликвидус состоит из ветвей а0Э и Эb0. Солидус представляет собой ломаную линию a0aЭЭbЭЭ0, горизонтальный участок которой проходит через эвтектическую точку Э, общую для линий ликвидуса и солидуса. Температура ТЭ, отвечающая минимуму на кривой ликвидуса (точка Э), является самой низкой температурой плавления для двухкомпонентной системы, составленной из данной пары веществ. Построение и анализ диаграмм плавкости А В Ликвидус и солидус делят диаграмму плавкости на четыре зоны. Число фаз в каждой из этих двухкомпонентных зон и их агрегатное состояние, как и число степеней свободы, рассчитанное по правилу фаз Гиббса, приведены в таблице. Как видно из таблицы, только в одной из четырёх зон (I) система является гомогенной, в то время как в зонах II – IV она гетерогенная. Лишь в зоне I система обладает двумя степенями свободы, а следовательно, только в пределах этой зоны можно произвольно менять оба внешних- параметра – температуру и состав – не вызывая этим изменение числа и характера фаз, находящихся в равновесии. В зонах II и III – зонах равновесного сосуществования жидкого расплава обоих компонентов и, соответственно, крупных кристаллов веществ А и В, степень свободы равна единице. Следовательно, произвольно можно изменять лишь один внешний параметр – или температуру, или состав жидкой фазы. Система моновариантна и в зоне IV, в которой образуется микрогетерогенная смесь кристаллов веществ А и В. В пределах этой зоны при сохранении постоянства состава равновесных твёрдых фаз произвольно можно менять только температуру. Двухкомпонентная система нонвариантна только при температуре кристаллизации эвтектики (ТЭ), при которой жидкая фаза эвтектического состава находится в равновесии с кристаллами веществ А и В. это означает, что для данной пары веществ при постоянном давлении кристаллизация эвтектики происходит при строго определенной постоянной температуре и состав эвтектической смеси имеет строго определенное значение. В точке Э состав эвтектики и состав расплава совпадают. Определение количественных соотношений между сопряжёнными фазами 1). Определение состава сопряженных фаз. Рис. 3. Построение нод. Рассмотрим, как происходит перераспределение компонентов между фазами в процессе изменения температуры (Рис. 3). Если фигуративная точка, описывающая состояние системы в целом, находится в зоне I (например, точка k1), то она действительно характеризует состав гомогенной жидкой фазы при данной температуре. Если же точка находится в зоне равновесного сосуществования двух фаз (например, точка k2) то она указывает лишь, каково соотношение компонентов А и В в системе в целом, а не состав сопряжённых (равновесных между собой) фаз. Для определения состава каждой из равновесных фаз при заданной температуре (T = const) через фигуративную точку следует провести в пределах данной гетерогенной зоны соединительную прямую, называемую нодой (коннодой), параллельную оси абсцисс. Рис. 3. Построение нод. Точка, принадлежащая одновременно и ноде, и линии ликвидуса, характеризует состав жидкой фазы, а точка, принадлежащая и ноде, и линии солидуса, - состав твердой фазы. Если охлаждать гомогенную жидкую систему, состояние которой характеризуется точкой k1, то сначала при охлаждении происходит понижение температуры расплава без изменения числа фаз. При температуре, соответствующей точке перечечения перпендикуляра с линией ликвидуса (точка l1) начнётся кристаллизация из расплава, состав которого определяется точкой l1. Рис. 3. Построение нод. Другой конец ноды l1s1 – точка s1 – показывает состав первого выпадающего кристалла (в данном случае – это кристалл чистого компонента А). При дальнейшем понижении температуры относительное содержание вещества В в жидкой фазе будет увеличиваться вследствие перехода вещества А в твёрдую фазу и состав будет изменяться по линии ликвидуса от l1 до Э (сдвиг вправо по линии ликвидуса). При достижении температуры ТЭ состав жидкой фазы будет отвечать эвтектическому составу (точка Э) и, как показывает нода, аЭbЭ, наряду с кристаллами компонента А из расплава начнут выпадать кристаллы компонента В. Когда исчезнет последняя капля жидкости, в системе останутся только две фазы – кристаллы вещества А и кристаллы вещества В (нода, проведенная, например, через точку k3 общих точек с линией ликвидуса не имеет). Рис. 3. Построение нод. Если же рассматривать процесс охлаждения расплава, в котором содержание компонента В выше, чем в эвтектической смеси, то он будет отличаться от уже рассмотренного только тем, что в период от момента выпадения первого кристалла до достижения температуры ТЭ в этом случае из расплава кристаллизуется вещество В, а не вещество А. Таким образом, в системах, способных образовывать эвтектику из расплава при охлаждении первоначально выпадают кристаллы компонента, находящегося в расплаве в избытке по сравнению с эвтектическим составом. Кристаллизация всегда заканчивается при вполне определенной эвтектической температуре ТЭ и при эвтектическом составе последней капли жидкой фазы (точка Э). При температуре ТЭ из расплава одновременно выпадают кристаллы обоих веществе в виде мелкокристаллической смеси (эвтектики). 2). Определение относительных количеств сопряженных фаз Рассмотрим диаграмму плавкости, представленную на Рис.4. если при температуре Ti составу жидкой фазы, выраженному в массовых процентах, отвечает точка li, составу твердой фазы – точка si, а состояние системы в целом характеризуется фигуративной точкой ki, то соотношение масс твёрдой и жидкой фаз (mтв / mж) будет по правилу рычага определяться в Рис.4. Определение соотношения масс общем виде уравнением сопряженных фаз по правилу рычага m тв / m ж = ki·li / ki·si, Согласно правилу рычага, количества сопряженных фаз обратно пропорциональны отрезкам, на которые делит ноду фигуративная точка.). Диаграмма плавкости двухкомпонентной системы с неограниченной взаимной растворимостью компонентов в твердом и жидком состоянии Рис. 5. Система с полной растворимостью компонентов друг в друге в кристаллическом состоянии Для систем с неограниченной растворимостью компонентов друг в друге в кристаллическом состоянии при построении диаграмм плавкости и их анализе используют те же общие правила, которые были рассмотрены для систем с полной нерастворимостью компонентов друг в друге в кристаллическом состоянии. Однако по виду диаграммы плавкости таких систем (рис.5) заметно отличаются от диаграмм, представленных ранее; здесь кривые ликвидуса и солидуса представляют собой плавные кривые, сходящиеся в точках плавления чистых компонентов А и В. Рис. 5. Система с полной растворимостью компонентов друг в друге в кристаллическом состоянии Кривые ликвидуса и солидуса делят диаграмму плавкости (рис.5) на три зоны. В зоне I система находится в жидком состоянии. В зоне II, лежащей между ликвидусом и солидусом, равновесно сосуществуют две фазы: жидкий расплав и твердый раствор. В зоне III система находится в твердом состоянии. Зоны I и III гомогенны (Ф=1), и система обладает двумя степенями свободы (С=2). В гетерогенной зоне II (Ф=2) система обладает одной степенью свободы (С=1), и соответственно на кривой охлаждения 2 наблюдается более пологий участок. Рис. 5. Система с полной растворимостью компонентов друг в друге в кристаллическом состоянии Определить составы и относительные количества твердой и жидкой фаз при любой температуре можно, проводя в гетерогенной зоне ноды. Для систем с полной взаимной растворимостью компонентов друг в друге в твердом состоянии ноды не доходят до ординат, отвечающих чистым компонентам А и В: из расплава кристаллизуется не чистый компонент А или В, а твердый раствор, состав которого характеризуется точкой на линии солидуса, принадлежащей одновременно и соответствующей ноде. Эти системы не образуют эвтектических смесей, и горизонтальные участки на кривых охлаждения отсутствуют. Если охлаждать гомогенную жидкую фазу состава k, кристаллизация начнется при температуре Т1 (точка k1) и закончится при температуре Т3 (точка k3) .При охлаждении точка, характеризующая равновесный состав твердой фазы, смещается по линии солидуса от s1 (cостав первого кристалла) до k3 , а точка, характеризующая равновесный состав жидкой фазы, смещается по линии ликвидуса от k1 до l3 Следовательно, твердая фаза обогащена, по сравнению с исходным составом, компонентом В, который имеет в чистом виде более высокую температуру плавления, чем компонент А. Жидкая фаза обогащена легкоплавким компонентом А. • Такие системы образуют вещества, которые имеют одинаковый тип и близкие параметры кристаллической решетки: медь и никель (Cu - Ni), золото и серебро (Au - Ag), хлорид натрия и хлорид серебра (NaCl – AgCl) и др. Типичная диаграмма состояния для такой системы приведена на рис. 5. Верхняя линия на диаграмме называется линией ликвидуса, она выражает зависимость температуры начала кристаллизации от состава расплава. Нижняя линия – линия солидуса, она выражает зависимость температуры окончания кристаллизации от состава расплава. Выше ликвидуса система находится в жидком, а ниже солидуса – в твердом состоянии. В области между линиями ликвидуса Рис. 5. Диаграмма плавкости и солидуса система гетерогенна и двухкомпонентной системы с состоит из двух фаз – твердого тела неограниченной взаимной растворимостью компонентов в и жидкости (Т + Ж). твердом и жидком состоянии • Твердое тело в данном случае представляет собой твердый раствор веществ А и В. Температура начала (и окончания) кристаллизации зависит от состава расплава, причем состав выпадающих кристаллов не совпадает с составом жидкости. Для определения составов фаз, находящихся в равновесии в гетерогенной области диаграммы, проводят коноды (конода nmp), а для расчета количеств (масс) фаз, находящихся в равновесии, применяют правило рычага. В целом описание системы такого рода проводится по схеме, использованной ранее при Рис. 5. Диаграмма плавкости расмотрении системы, двухкомпонентной системы с неограниченной взаимной диаграмма состояния которой растворимостью компонентов в приведена выше. твердом и жидком состоянии