Двухкомпонентные системы Рассмотрим систему из двух
реклама
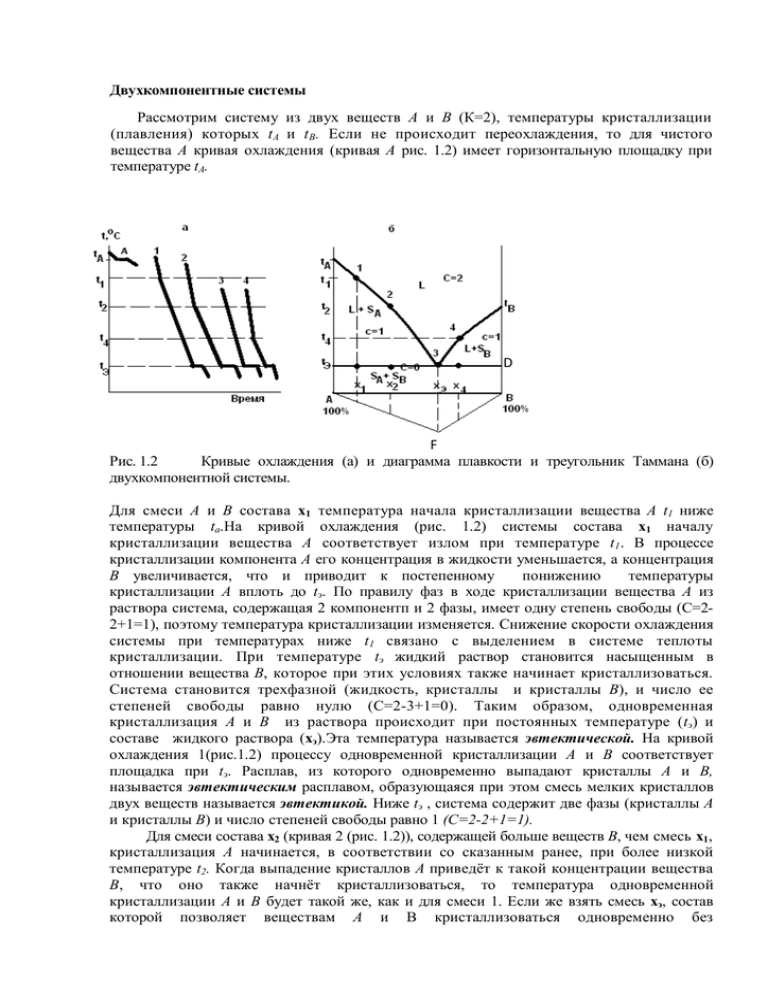
Двухкомпонентные системы Рассмотрим систему из двух веществ А и В (К=2), температуры кристаллизации (плавления) которых tА и t В. Если не происходит переохлаждения, то для чистого вещества А кривая охлаждения (кривая А рис. 1.2) имеет горизонтальную площадку при температуре tА. D F Рис. 1.2 Кривые охлаждения (а) и диаграмма плавкости и треугольник Таммана (б) двухкомпонентной системы. Для смеси А и В состава x1 температура начала кристаллизации вещества А t1 ниже температуры ta.На кривой охлаждения (рис. 1.2) системы состава x1 началу кристаллизации вещества А соответствует излом при температуре t1 . В процессе кристаллизации компонента А его концентрация в жидкости уменьшается, а концентрация В увеличивается, что и приводит к постепенному понижению температуры кристаллизации А вплоть до tэ. По правилу фаз в ходе кристаллизации вещества А из раствора система, содержащая 2 компонентп и 2 фазы, имеет одну степень свободы (С=22+1=1), поэтому температура кристаллизации изменяется. Снижение скорости охлаждения системы при температурах ниже t1 связано с выделением в системе теплоты кристаллизации. При температуре tэ жидкий раствор становится насыщенным в отношении вещества В, которое при этих условиях также начинает кристаллизоваться. Система становится трехфазной (жидкость, кристаллы и кристаллы В), и число ее степеней свободы равно нулю (С=2-3+1=0). Таким образом, одновременная кристаллизация А и В из раствора происходит при постоянных температуре (tэ) и составе жидкого раствора (xэ).Эта температура называется эвтектической. На кривой охлаждения 1(рис.1.2) процессу одновременной кристаллизации А и В соответствует площадка при tэ. Расплав, из которого одновременно выпадают кристаллы А и В, называется эвтектическим расплавом, образующаяся при этом смесь мелких кристаллов двух веществ называется эвтектикой. Ниже tэ , система содержит две фазы (кристаллы А и кристаллы B) и число степеней свободы равно 1 (C=2-2+1=1). Для смеси состава x2 (кривая 2 (рис. 1.2)), содержащей больше веществ В, чем смесь x1, кристаллизация А начинается, в соответствии со сказанным ранее, при более низкой температуре t2. Когда выпадение кристаллов А приведёт к такой концентрации вещества В, что оно также начнёт кристаллизоваться, то температура одновременной кристаллизации A и В будет такой же, как и для смеси 1. Если же взять смесь xэ, состав которой позволяет веществам А и В кристаллизоваться одновременно без предварительного выпадения кристаллов А или кристаллов В, то кривая охлаждения будет изображаться как кривая 3(охлаждение расплава эвтектического состава). Для смеси x4, содержащей избыток вещества В по сравнению с концентрацией xэ , кривая охлаждения подобна кривой 2, но сначала выпадают кристаллы В, и только при достижении состава раствора, допускающего одновременную кристаллизацию А и В, наблюдается горизонтальная площадка при температуре tэ . Чем ближе по составу расплав к эвтектике, тем длиннее горизонтальные участки на кривых охлаждения, так как масса эвтектики увеличивается. Диаграмма состояния двухкомпонентной системы в координатах температура-состав (рис. 1.2,б) строится на основании кривых охлаждения и называется диаграммой плавкости. Например, для чистого вещества А (левая ось ординат диаграммы плавкости) температура кристаллизации tА, для смеси x1 , содержащей 20% вещества В, кристаллизация начинается при температуре t1 , что на диаграмме соответствует точке 1. Для смесей x2 , xЭ и x4 начало кристаллизации показано точками 2, 3 и 4. Следовательно, область диаграммы над линией tА3 и tB3 соответствует жидкому состоянию системы. Такие линии называют линиями ликвидуса от латинского слова liquidus (жидкость), и область диаграммы над ней обозначают буквой L. Твёрдое тело по латыни называется solidus, поэтому существование твердой фазы в области диаграммы обозначают буквой S. Области диаграммы между кривой ta 3,tb 3 и прямой tЭD отвечают двухфазным (гетерогенным) состояниям системы, так как в ней при этих условиях присутствуют жидкость и кристаллы веществ А или В. Как видно из диаграммы( рис. 1.2.б) есть две области L + S: в левой - жидкая фаза находится в равновесии с кристаллами вещества A (L + SА), а в правой - с кристаллами вещества В (L + SВ). Область диаграммы под прямой tЭD соответствует двум твёрдым фазам и обозначается как (SА + SВ), потому что система в данном случае состоит из смеси кристаллов А и В. Система из трех фаз может существовать только при температуре tЭ (линия tЭD). Если на диаграмме отложить по вертикали вниз отрезки, пропорциональные или равные длинам горизонтальных участков(площадок) от оси состава для всех исследованных смесей, и соединить их концы, то можно получить треугольник Таммана (∆ABF). Причем максимальную эвтектическую площадку имеет смесь эвтектического состава. Этот треугольник позволяет экстраполяцией определить эвтектический состав, если он не попал в составы исследуемых смесей. Таким образом, получив из опыта кривые охлаждения ряда смесей с известным соотношением двух данных компонентов, можно построить диаграмму плавкости. Работа 1. Физико-химический анализ двухкомпонентной смеси. Цель работы: По кривым охлаждения для бинарных смесей нескольких составов построить диаграмму плавкости, и с ее помощью определить состав контрольной смеси, состоящей из тех же компонентов. Порядок выполнения работы: 1. Получить у лаборанта пробирки со смесями известных составов и с контрольной смесью, термометр и мешалку. 2. Взять одну из пробирок, записать в лабораторный журнал состав смеси, указанный на пробирке. Нагреть пробирку и, когда смесь расплавится, осторожно погрузить в нее шарик термометра и мешалку. На стенках термометра могут образоваться кристаллы, в этом случае пробирку нагреть до расплавления этих кристаллов. 3. Закрепить пробирку вместе с погруженным в расплав термометром в лапке штатива. Верхний конец столбика ртути должен быть освещён, и находиться на уровне глаз работающего. 4. Сразу после закрепления пробирки начать запись в журнал (табл. 1.1) температуры расплава, медленно помешивая его мешалкой. Отсчеты температуры делать через 30 сек. Важно визуально отметить температуру, при которой появляются первые кристаллы, после этого помешивание расплава можно прекратить. Наблюдение и запись температуры продолжать до тех пор, пока температура не будет близкой к комнатной. 5. Окончив опыт, расплавить смесь, вынуть термометр и вытереть его фильтровальной бумагой. Такие же опыты провести со всеми полученными смесями. 6. Построить на миллиметровой бумаге кривые охлаждения для каждой смеси, так чтобы 1мм на оси ординат соответствовал 0,5 °С, а на оси абсцисс-0,5 мин. 7. Найти по изломам на кривых охлаждения температуры начала кристаллизации (tнач) и окончания кристаллизации расплава (tЭ) и записать их в таблицу 1.2 для всех смесей. 8. Построить диаграмму плавкости, исследуемой смеси в координатах "температура плавления(ось ординат) – состав(ось абсцисс)". Для этого нанести точки tнач и tЭ на график, построенный в масштабе: по оси ординат 1мм равен 0,5 °С, по оси абсцисс 1 мм равен 1 % В. Соединить нанесенные точки линиями. 9. По кривым охлаждения определить длины эвтектических площадок для всех смесей ( L) и записать в таблицу 1.2. 10.Построить в нижней части диаграммы треугольник Таммана зависимость L от состава смеси. То есть на диаграмме отложить по вертикали вниз отрезки, пропорциональные или равные длинам горизонтальных участков (площадок) от оси состава для всех исследованных смесей, и соединить их концы 11.По кривой охлаждения для контрольной смеси определить температуры начала и конца кристаллизации и длину эвтектической площадки. С помощью диаграммы плавкости и треугольника Таммана определить состав контрольной смеси(если он не попал в составы исследуемых смесей, то находим экстраполяцией на ось ординат и ось абсцисс(состав)). Таблица 1.1 Зависимость температуры смеси от времени охлаждения. N смеси………..Состав смеси………….. Время, мин. t 0C 0,5 1,0 1,5 2,0 ….. ….. Таблица 1.2 Температуры кристаллизации смесей двух веществ различного состава. № проб. масс.% В tнач.кристал. °C tЭ°C Варианты систем: камфора - бензойная кислота L, мм бензойная кислота – дифениламин бензойная кислота – мочевина Контрольные вопросы 1. 2. 3. 4. 5. Перед выполнением работы: Нарисовать диаграмму плавкости системы из двух веществ, растворимых в жидкой и нерастворимых в твердой фазах . Какую зависимость называют кривой охлаждения? Как из набора кривых охлаждения построить диаграмму плавкости? Каковы причины отклонения реальной кривой охлаждения от идеальной? Объясните появление минимумов на кривых охлаждения. Какие данные необходимы для построения треугольника Таммана? К защите работы: 1. На чем основан термический анализ? 2. Назовите компоненты и фазы изученной вами системы. 3. Какой набор фаз в каждом поле полученной диаграммы? 4. Как примеси влияют на температуру плавления вещества? 5. Сформулируйте правило фаз Гиббса. 6. Определите число степеней свободы в каждом поле диаграммы и налинии эвтектики. 7. От чего зависит длина эвтектической площадки на кривой охлаждения? 8. Как отличить эвтектическую смесь от смеси любого другого состава? 9. В каких случаях необходим треугольник Таммана при определении состава смеси? 10. Два образца имеют одинаковые температуры плавления. Как доказать, что эти образцы имеют одинаковый состав?
