MYP Agar Basex
реклама
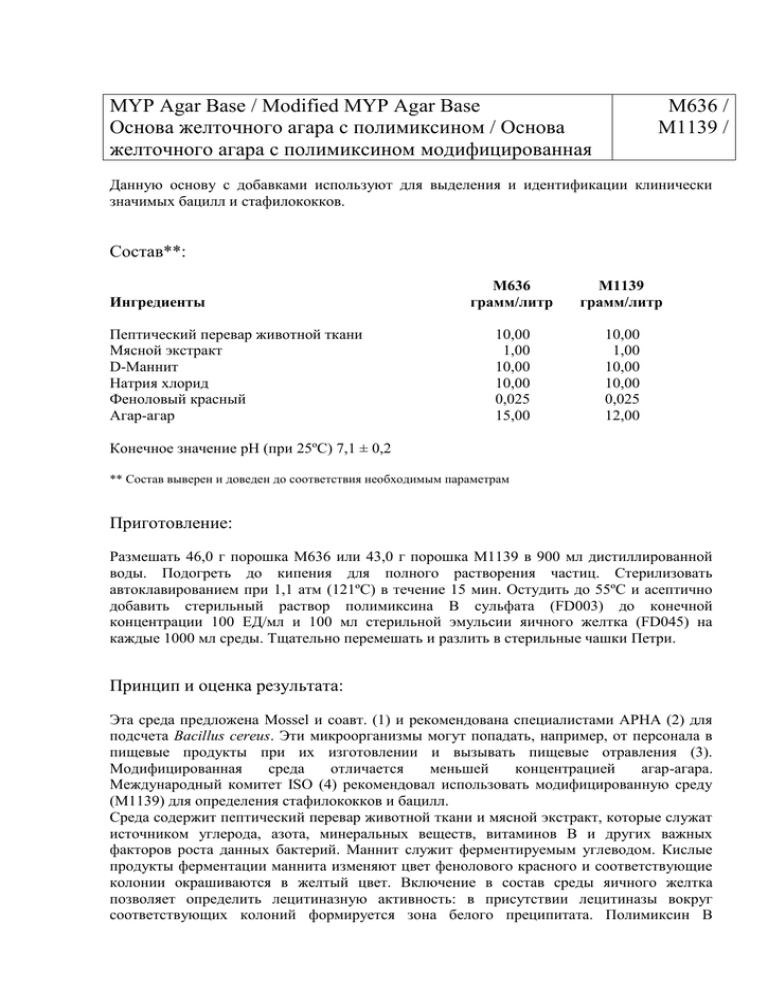
MYP Agar Base / Modified MYP Agar Base Основа желточного агара с полимиксином / Основа желточного агара с полимиксином модифицированная M636 / M1139 / Данную основу с добавками используют для выделения и идентификации клинически значимых бацилл и стафилококков. Состав**: Ингредиенты Пептический перевар животной ткани Мясной экстракт D-Маннит Натрия хлорид Феноловый красный Агар-агар М636 грамм/литр М1139 грамм/литр 10,00 1,00 10,00 10,00 0,025 15,00 10,00 1,00 10,00 10,00 0,025 12,00 Конечное значение рН (при 25ºС) 7,1 ± 0,2 ** Состав выверен и доведен до соответствия необходимым параметрам Приготовление: Размешать 46,0 г порошка М636 или 43,0 г порошка М1139 в 900 мл дистиллированной воды. Подогреть до кипения для полного растворения частиц. Стерилизовать автоклавированием при 1,1 атм (121ºС) в течение 15 мин. Остудить до 55ºС и асептично добавить стерильный раствор полимиксина В сульфата (FD003) до конечной концентрации 100 ЕД/мл и 100 мл стерильной эмульсии яичного желтка (FD045) на каждые 1000 мл среды. Тщательно перемешать и разлить в стерильные чашки Петри. Принцип и оценка результата: Эта среда предложена Mossel и соавт. (1) и рекомендована специалистами АРНА (2) для подсчета Bacillus cereus. Эти микроорганизмы могут попадать, например, от персонала в пищевые продукты при их изготовлении и вызывать пищевые отравления (3). Модифицированная среда отличается меньшей концентрацией агар-агара. Международный комитет ISO (4) рекомендовал использовать модифицированную среду (М1139) для определения стафилококков и бацилл. Среда содержит пептический перевар животной ткани и мясной экстракт, которые служат источником углерода, азота, минеральных веществ, витаминов В и других важных факторов роста данных бактерий. Маннит служит ферментируемым углеводом. Кислые продукты ферментации маннита изменяют цвет фенолового красного и соответствующие колонии окрашиваются в желтый цвет. Включение в состав среды яичного желтка позволяет определить лецитиназную активность: в присутствии лецитиназы вокруг соответствующих колоний формируется зона белого преципитата. Полимиксин В подавляет рост таких грамотрицательных бактерий, как кишечная и синегнойная палочки. Такая среда позволяет дифференцировать Bacillus cereus от других бацилл по ферментации маннита и характеру спорообразования. Микроорганизмы, не относимые к Bacillus cereus, часто вызывают диффузное пожелтение среды при ферментации маннита, что мешает дифференцировать колонии по этому признаку. В этом случае рекомендуется проверить ферментацию маннита у чистой культуры на свежей среде. Выросшие на данном агаре колонии отсевают на Питательный агар и инкубируют при 30ºС в течение 24 ч с последующим определением морфологии вегетативных клеток, спор, липидных включений в вегетативных клетках. Контроль качества: Внешний вид порошка: Гомогенный сыпучий светло-розовый порошок. Плотность готовой среды: Образуется среда, соответствующая по плотности 1,5%-ному (М636) или 1,2%-ному (М1139) агаровому гелю . Цвет и прозрачность готовой среды: Основа среды имеет красную окраску, прозрачна или слегка опалесцирует. После добавления эмульсии желтка среда становится оранжевого цвета, непрозрачна, если в чашках Петри формируется гель. Кислотность среды: При 25ºС водные растворы М636 (4,6% вес/об) или М1139 (4,3% вес/об) имеют рН 7,1 ± 0,2. Культуральные свойства: Ростовые характеристики референс-штаммов через 18-40 ч при 32ºС. Штаммы микроорганизмов (АТСС) Рост Bacillus subtilis (6633) Обильный Bacillus cereus (10876) Обильный Proteus mirabilis (25933) Обильный Staphylococcus aureus (25923) Обильный Escherichia coli (25922) Слабый или отсутствует Pseudomonas aeruginosa (27853) Слабый или отсутствует Примечание: + = ореол вокруг колоний Цвет колоний Лецитиназа Желтые Красные Красные Желтые – – – + – + – – Ссылки: Условия и сроки хранения: Порошок хранить при температуре ниже +25ºС. Использовать до даты, указанной на этикетке. Готовую среду хранить при температуре +2…8ºС.











