Что делал(а).
реклама
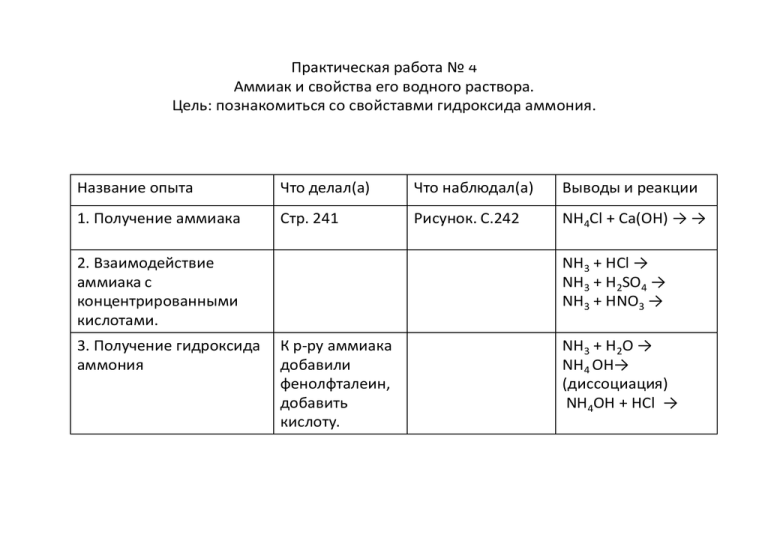
Практическая работа № 4 Аммиак и свойства его водного раствора. Цель: познакомиться со свойставми гидроксида аммония. Название опыта Что делал(а) Что наблюдал(а) Выводы и реакции 1. Получение аммиака Стр. 241 Рисунок. С.242 NH4Cl + Ca(OH) → → 2. Взаимодействие аммиака с концентрированными кислотами. 3. Получение гидроксида аммония NH3 + HCl → NH3 + H2SO4 → NH3 + HNO3 → К р-ру аммиака добавили фенолфталеин, добавить кислоту. NH3 + H2O → NH4 ОН→ (диссоциация) NH4OH + HCl → Практическая работа № Решение экспериментальных задач по теме «ЭЛЕКТРОЛИТЫ». Название опыта. Что делал(а). 1. Реакция между растворами карбоната натрия и соляной кислоты. Прилил(а) к раствору соляной кислоты раствор карбоната натрия. 2.Получение гидроксида железа (III) К раствору хлорида железа (III) прилил(а) раствор гидроксида натрия 3.В пробирках под номерами 1,2,3 определить хлорид бария, гидроксид калия и карбонат натрия 4. Проведение реакции, которое выражается сокращенным ионным уравнением: Ва 2 2 SO 4 BaSO4 Что наблюдал(а). Выводы и реакции. (реакция в молекулярном и ионном сокращенном виде) (реакция в молекулярном и ионном сокращенном виде) (реакции в ионном сокращенном виде) В прбирке под № 1 - ……. В прбирке под № 2 - ……. В прбирке под № 3 - ……. (реакция в молекулярном и ионном сокращенном виде) Практическая работа ( 9 кл. ) Решение экспериментальных задач по теме «Неметаллы». Название опыта 1. Получение углекислого газа. 2. Растворение углекислого газа в воде. Что делал(а). Поместил(а) кусочек мела в пробирку, прилил(а) к нему соляную кислоту. Закрыл(а) пробкой с газоотводной трубкой. В чистую пробирку налил(а) чистой воды и опустил(а) в нее газоотводную трубку. Через несколько минут (2-3) вынул(а) газоотводную трубку и капнул(а) в пробирку, в которой была вода каплю лакмуса. 3. Осуществить превращения: Na2SiO3→H2SiO3 4.В пробирках под номерами 1,2,3 определить: сульфат натрия, карбонат натрия и хлорид натрия а) В три чистые пробирки отлил(а) растворы из пробирок под номерами и в каждую из них прилил(а) раствор соляной кислоты б) В следующие 2 чистые пробирки налил(а) растворы с неопределенными веществами и добавила к ним хлорид бария. Что наблюдал(а). (что наблюдали) Выводы и реакции. … +… = СО2 +… +… СО2 + Н2О = … (что увидели) (что увидели) (записать уравнения реакций ) (что увидели) Следовательно, в пробирке под № …. карбонат натрия (записать уравнения реакций ) Следовательно, в пробирке под № …. сульфат натрия (записать уравнения реакций ) Вещество №1 – Вещество №2 – Вещество №3 – Практическая работа № Решение экспериментальных задач. Название опыта. Что делал(а). 1.Определение условий Прилил(а) к раствору протекания реакций до хлорида железа (III) раствор конца. гидроксида натрия. 2.Получение гидроксида меди (II) 3.В пробирках под номерами 1,2,3 определить хлорид бария, гидроксид калия и карбонат натрия Что наблюдал(а). Увидел(а)……………… Прилил(а) к раствору серной кислоты раствор карбоната натрия. Увидел(а)……………… К твердому CuO прилил раствор H2SO4 и подогрел. Раствор стал……..цвета. Раствор без осадка слил и добавил к нему NaOH. Появился……………….. К в-вам прилил(а) H2SO4 Выпадение белого осадка увидел в пробирке под № Выделение газа увидел в пробирке под № К в-вам прилил(а) CuSO4 Выпадение синего осадка увидел в пробирке под № Выводы и реакции. (реакция в молекулярном и ионном сокращенном виде) (реакция в молекулярном и ионном сокращенном виде) (реакция в молекулярном и ионном сокращенном виде) Сокращенные ионные уравнения В прбирке под № 1 - ……. В прбирке под № 2 - ……. В прбирке под № 3 - ……. Практическая работа № Изучение свойств соляной кислоты. Цель: Исследовать химические свойства соляной кислоты Название опыта. 1. Изучение свойств соляной кислоты. Что делал(а). К раствору соляной кислоты: 1. Прилил(а) лакмус. Что наблюдал(а). Цвет раствора…….. Реакция диссоциации кислты. 2. В пробирку с кислотой Увидел(а) ………… опустил(а) кусочек цинка. HCl + Zn → 3. В пробирку с кислотой опустил(а) кусочек мела Увидел(а) ………… HCl + … 4. К сульфату меди добавил(а) Увидел(а) ………… гидроксид натрия и прилил(а) соляной кислоты. 5. К раствору соляной кислоты Увидел(а) ………… добавил(а) 1/5 ложечки оксида меди и нагрел(а) её 2. Проведение качественной реакции на хлорид-ион Выводы и реакции. К раствору хлорида бария прилил(а) раствор нитрата серебра. Увидел(а) ………… (определить окислитель и восстановитель) (записать реакцию в ионном виде) HCl + Сu(OH)2 → (записать реакцию в ионном виде) HCl + СuО → (записать реакцию в ионном виде) (записать реакцию в молекулярном и ионном виде) Вывод : соляная кислота проявляет свойства, характерные для……. и может взаимодействовать с…… Практическая работа № Решение экспериментальных задач по теме «Подгруппа кислорода» Название опыта. 1. Определить в пробирках под номерами 1, 2, 3 растворы сульфат натрия, серной кислоты и хлорид натрия. Что делал(а). Что наблюдал(а). Выводы и реакции. Изменился цвет вещества под номером…. Следовательно, в пробирке под номером… находится кислота (уравнение диссоциации) 2.В оставшиеся 2 пробирки Выпал белый осадок добавил(а) хлорид бария пробирке с веществом под номером…. Следовательно, в пробирке под номером… находится сульфат натрия. 1.Во все определяемые вещества добавил(а) лакмус. (Уравнение реакции ) Вывод: №1№2№32.Осуществление превращений: CuSO4 Cu(OH)2 CuCl2 В пробирку с CuSO4 добавил(а)… К образовавшемуся осадку добавил(а) Выпал осадок синего цвета. Осадок растворился. (уравнения реакций ). Практическая работа №. (9кл) Решение экспериментальных задач по теме «Подгруппа азота» Название опыта. 1. Распознавание азотных и фосфорных удобрений. Под №№ 1 и 2 определить аммонийную селитру и двойной суперфосфат. 2. Осуществление превращений.(теоретически). Что делал(а). ? Что наблюдал(а). ? Выводы и реакции. - В пробирке под №….. …….. - В пробирке под №….. …….. I вариант: Р Р2О5 Н3РО4 СаНРО4 Са 3(РО4) . II вариант: N2 NO NO2 HNO3 NH4NO3 . ______________________ (реакции) 1. 2. 3. 4. Практическая работа №. (9кл) Решение экспериментальных задач по теме «Металлы и их соединения» Название опыта. 1.Окрашивание пламени солями металлов 2. Определение хлорида калия и хлорида кальция под номерами 1 и 2 Что делал(а). Опыт стр 245 Что наблюдал(а). Выводы и реакции. Ион К+ окрашивает пламя в Ион Na+ окрашивает пламя в Ион Са+2 окрашивает пламя в КСl + … В пробирке №1 – СаCl2 + … В пробирке №2 – 3. Определение хлорида железа (II) и хлорида железа (III) под номерами 3 и4 FeСl2 + … В пробирке №3 – FeCl3 + … В пробирке №4 – Практическая работа (9кл) Изучение свойств железа и его соединений Название опыта. 1. Взаимодействие железа с кислотами. Что делал(а). Что наблюдал(а). Внесите в пробирку с соляной кислотой железные опилки. Выводы и реакции. (Запишите уравнение окислительновосстановительного процесса) Внесите железные опилки в пробирку с серной кислотой. 2. Получение гидроксида железа (II) В пробирку с сульфатом железа (II) добавьте гидроксид натрия. (Запишите уравнение реакции в ионном виде) 3. Изучение свойств гидроксида железа (II) Разделите гидроксид железа (II) на 3 части В одну прилейте соляную кислоту Во вторую- гидроксид натрия Третью оставьте на 15 минут. (Запишите уравнения прошедших реакций в ионном виде) Что происходит с веществом с течением времени? (Запишите уравнение реакции) 4. Получение гидроксида железа (III) В пробирку с хлоридом железа (III) добавьте немного гидроксида натрия. (Запишите уравнение реакции в ионном виде) 5. Изучение свойств гидроксида железа (III) Разделите гидроксид железа (III) на 2 части В одну прилейте соляную кислоту Во вторую- гидроксид натрия (Запишите уравнения прошедших реакций в ионном виде) 6.Определение под номерами 1 и 2 раствор солей Fe2+ и Fe3+ Вывод: Ответьте на вопросы: 1. Сравните свойства Fe(OH)2 и Fe(OH)3 по отношению к кислотам и основаниям. 2. С помощью какого реагента можно отлечить соли двух и трехвалентного железа? В пробирке №1В пробирке №2- Практическая работа Изучение влияния различных факторов на скорость химических реакций. Цель: выяснить как влияют на скорость химической реакции некоторые факторы . Название опыта. 1.Зависимость скорости реакции от природы реагирующих веществ. Что делал(а). 2. Зависимость скорости реакции от концентрации кислоты. Что наблюдал(а). Выводы и реакции. Чем активнее металл, тем скорость реакции ………. Zn + HCl = Zn + CH3COOH= Чем больше концентрация, тем скорость реакции ………. 3.Зависимость скорости реакции от температуры. Температура ………….. скорость реакции. 4.Зависимость скорости реакции от поверхности соприкосновения реагирующих веществ. Чем сильнее измельчено вещество, тем реакция протекает…….. СаСО3 + HCl = 5.Зависимость скорости реакции от присутствия катализатора. Катализаторы – это вещества, которые…………(стр 85). Вывод: скорость химической реакции зависит А) от природы реагирующих веществ: чем………… Б) В) Г) Д) 1.Зависимость скорости реакции от природы реагирующих веществ. А) В две пробирки налейте соляной кислоты. В первую положите кусочек цинка, во вторую – кусочек меди. Что наблюдаете? Какая из реакций идет быстрее? Почему? Б) В одну пробирку налейте соляную кислоту, во вторую – уксусную. В каждую опустите гранулу цинка. Какая из реакций идет быстрее? Почему? 2.Влияние концентрации реагирующих веществ. В две пробирки поместите по грануле цинка. В обе добавьте одинаковое количество соляной кислоты. В 1 капните 3 капли воды, во вторую 30 капель воды. В каком случае реакция идет быстрее? Почему? 3. Зависимость скорости реакции от температуры. В две пробирки поместите по грануле цинка. В обе добавьте одинаковое количество соляной кислоты. Одну пробирку опустите в стакан с горячей водой. По интенсивности выделения газа сделайте вывод о влиянии температуры на скорость реакции. 4.Зависимость скорости реакции от поверхности соприкосновения реагирующих веществ. В одну пробирку опустите кусочек мела, в другую - порошок мела. Налейте в обе пробирки одинаковое количество соляной кислоты. В какой пробирке скорость реакции выше? Практическая работа ( 9 кл. ) «Получение оксида углерода (IV) и изучение его свойств. Свойства карбонатов». Название опыта 1. Получение углекислого газа. 2. Растворение углекислого газа в воде. 3.В пробирках под номерами 1,2,3 определить карбонат натрия Что делал(а). Поместил(а) кусочек мела в пробирку, прилил(а) к нему соляную кислоту. Закрыл(а) пробкой с газоотводной трубкой. В чистую пробирку налил(а) чистой воды и опустил(а) в нее газоотводную трубку. Через несколько минут (2-3) вынул(а) газоотводную трубку и капнул(а) в пробирку, в которой была вода каплю лакмуса. В три чистые пробирки отлил(а) растворы из пробирок под номерами и в каждую из них прилил(а) раствор ??? Что наблюдал(а). (что наблюдали) Выводы и реакции. … +… = СО2 +… +… СО2 + Н2О = … (что увидели) (что увидели) Следовательно, в пробирке под № …. карбонат натрия (записать уравнения реакций )




