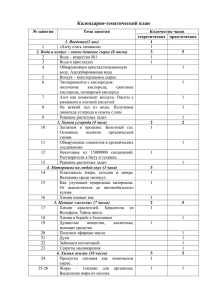
М2.В.ДВ.1.1 Неорганические вещества в природе (новое окно)
реклама

Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на Лист 1 из 166 УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное автономное образовательное учреждение высшего профессионального образования «Дальневосточный федеральный университет» (ДВФУ) Филиал ДВФУ в г. Уссурийске УЧЕБНО-МЕТОДИЧЕСКИЙ КОМПЛЕКС ДИСЦИПЛИНЫ Неорганические вещества в природе Направление — 050100.68. Педагогическое образование Магистерская программа – Химическое образование Форма подготовки (очная) Школа педагогики ДВФУ кафедра естественнонаучного образования курс 2 семестр 3, 4 лекции 10 (час.) практические занятия 72 (час.) лабораторные работы не предусмотрены всего часов аудиторной нагрузки 82 (час.) самостоятельная работа 62 (час.) реферативные работы не предусмотрены контрольные работы не предусмотрены зачёт 3, 4 семестр экзамен не предусмотрен Учебно-методический комплекс составлен в соответствии с требованиями федерального государственного образовательного стандарта высшего профессионального образования (Приказ Министерства образования и науки РФ №35 от 14 января 2010 г.). Учебно-методический комплекс дисциплины обсужден на заседании кафедры естественнонаучного образования протокол № 10 « 27 » июня 2012 г. Заведующая кафедрой: Литвинова Е.А. 2012 г. Составитель: к.б.н., доцент Шишлова М.А. Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на Лист 2 из 166 УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования СОДЕРЖАНИЕ Аннотация..…………………………………………………………….….…..3 Рабочая программа учебной дисциплины (РПУД)..…………………….….9 Конспекты лекций……………….…………………………………………..24 Материалы практических занятий.………………….…………………..….56 Материалы для организации самостоятельной работы студентов...……..120 Контрольно-измерительные материалы……………………………………132 Список литературы …………………………………………………………145 Глоссарий…………………………………………………………………….149 Дополнительные материалы…………………………………………….….166 2 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на Лист 3 из 166 УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Аннотация учебно-методического комплекса дисциплины «Неорганические вещества в природе» Учебно-методический комплекс дисциплины «Неорганические вещества в природе » разработан для магистрантов 2 курса по направлению 050100.68 «Педагогическое образование» (магистерская программа Химическое образование) в соответствии с требованиями ФГОС ВПО по данному направлению и положением об учебно-методических комплексах дисциплин образовательных программ высшего профессионального образования (утверждено приказом и.о. ректора ДВФУ от 17.04.2012 №12-13-87). Дисциплина «Неорганические вещества в природе» входит в дисциплины по выбору профессионального цикла. Общая трудоемкость освоения дисциплины составляет 4 зачетные единицы, 144 часа. Учебным планом предусмотрены лекционные занятия (10 часов), практические занятия (72 часа), самостоятельная работа студента (62 часа). Дисциплина реализуется на 2 курсе в 3, 4 семестрах. Содержание дисциплины охватывает следующий круг вопросов: Химические элементы в биосфере. Состояние воды в биосфере и состав природных растворов. Газы в биосфере и состав природных газовых смесей. Магматические расплавы. Биогенная форма. Техногенные соединения. Металлы Распространенность и формы нахождения металлов в природе. Окислительно-восстановительные реакции, окислители, восстановители. Неметаллы. Распространенность и формы нахождения неметаллов в природе. Физические и общие химические свойства неметаллов. Оксиды. Гидроксиды. Общая и сравнительная характеристика гидроксидов. Соли. Тип связи и тип решетки. Средние соли, гидро- и гидроксосоли. Двойные, смешанные соли и кристаллогидраты. Важнейшие природные соли. Их применение в качестве природного сырья. Особенности химии элементов металлов. Щелочные элементы. Бериллий, магний, щелочноземельные элементы 3 (кальций, Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на Лист 4 из 166 УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования стронций, барий), радий. Редкоземельные элементы (РЗЭ: скандий, натрий, лантан, лантаниды), актиний и актиниды. Титан, цирконий, гафний. Ванадий, ниобий, тантал. Хром, молибден, вольфрам. Марганец, технеций, рений. Триада железа (железо, кобальт, никель). Платиновые элементы (триады рутения и осмия). Медь, серебро, золото. Цинк, кадмий, ртуть. Бор, алюминий и элементы подгруппы галлия галлий, индий, таллий. Углерод, кремний, элементы подгруппы германия германий, олово, свинец. Азот, фосфор, элементы подгруппы мышьяка мышьяк, сурьма, висмут. Кислород и элементы подгруппы серы. Галогены фтор, хлор, бром, йод, астат. Инертные (благородные) газы. Особенности химии элементов - неметаллов. Дисциплина «Неорганические вещества в природе» логически и содержательно связана с такими курсами, как «Химия окружающей среды», «Современные проблемы неорганической химии», «Физико-химические методы анализа» и специальными химическими дисциплины на ступени бакалавриата. Дисциплина направлена на формирование следующих общекультурных и профессиональных компетенций выпускника: ОПК – 1, ПК-5, ПК-17. Учебно-методический комплекс включает в себя: - рабочую программу дисциплины; - конспекты лекций (развернутые по темам полные конспекты лекций); - материалы для практических занятий (темы семинаров, задания для практических занятий); - материалы для организации самостоятельной работы (методические указания по их выполнению); - контрольно-измерительные материалы; - список литературы (в том числе интернет-ресурсов); - глоссарий; 4 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на Лист 5 из 166 УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования - дополнительные материалы (учебники, образовательные интернетресурсы). Достоинством данного УМКД является разработанная теоретическая и практическая часть, а также глоссарий дисциплины. Автор-составитель учебно-методического комплекса: к.б.н., доцент кафедры естественнонаучного образования школы педагогики ДВФУ Шишлова М.А. Зав. кафедрой естественнонаучного образования 5 Литвинова Е.А. Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на Лист 6 из 166 УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Abstract The teaching materials on the course «Inorganic substances in nature» are designed to train students of the 2 year in the «Chemical Education» educational program. Field of study – 050100.68. «Pedagogical Education», qualification (degree) to be earned – Master of Science in Chemical Education. Full-time program. Language of the program – Russian. The teaching materials are written in Russian. This teaching materials on the course are developed in accordance with the curriculum of the educational program under the Federal State Educational Standard of Higher Professional Education (FSES HPE) 050100.68 « Chemical Education» (Master's degree), approved by the Ministry of Education and Science of the Russian Federation (January 14, 2010. № 35). The contents of the course covers the following issues: Chemical elements in the biosphere. The state of water in the biosphere and the composition of natural solutions . The gases in the biosphere and the composition of natural gas mixtures. Magmatic melts . Nutrient form . Man-made compounds . Metals Prevalence and forms of occurrence of metal in nature. Redox reactions , oxidizing agents , reducing agents . Non-metals . Prevalence and forms of occurrence of nonmetals in nature. Physical and chemical properties of common non-metals . Oxides . Hydroxides . General and comparative analysis of hydroxides. Salt. Type of communication and the type of lattice. Average salt , hydro and gidroksosoli . Doubles, mixed salts and crystalline hydrates . The most important natural salt . Their use as a natural material. Features chemistry of metal elements . Alkaline . Beryllium , magnesium, alkaline earth elements (calcium , strontium , barium ) , radium . Rare earth elements (REE : scandium , sodium , lanthanum , lanthanide ) , anemones and actinides . Titanium , zirconium and hafnium. Vanadium , niobium, tantalum. Chromium , molybdenum and tungsten. Manganese , technetium , rhenium . Triad iron (iron , cobalt , nickel) . Platinum members ( triad of 6 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на Лист 7 из 166 УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования ruthenium and osmium ) . Copper, silver and gold. Zinc , cadmium and mercury. Boron, aluminum and gallium subgroup elements gallium , indium and thallium . Carbon , silicon, germanium subgroup elements germanium, tin and lead. Nitrogen, phosphorus, arsenic subgroup elements arsenic, antimony, bismuth. Oxygen and sulfur elements subgroups . Halogens fluorine, chlorine , bromine , iodine and astatine . Inert ( noble ) gases . Features of chemical elements - nonmetals. The course is built on the basis of academic networking community for pupils, students, school teachers and teachers of pedagogical institutes and allows you to master not only new technologies, but also new ways of activities. Discipline «Inorganic substances in nature» is logically and meaningfully related to the courses "Environmental Chemistry", "Modern Problems of Inorganic Chemistry", "Physico-chemical methods of analysis". Discipline aimed at the formation of common cultural and professional competencies of graduates. The teaching materials on the course provide extensive use of active, creative and interactive lessons, combined with private study in order to create and develop the professional skills of the students. The total number of the course’s credits – 4 credits (144 hours). These teaching materials on the course include the following materials: 1. Course syllabus; 2. Lectures notes; 3. Materials for practice work lessons; 4. Materials for students’ private study; 5. Test and examination materials; 6. Reading list; 7. Glossary; 8. Additional materials. 7 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на Лист 8 из 166 УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования The advantage of this is UMKD developed a theoretical and practical part, as well as a glossary of discipline. The author-composer of the educational and methodical complex: PhD, assistant professor of science education school pedagogy FEFU Shishlova M.A. - Head of department of science education Litvinova E.A. 8 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на Лист 9 из 166 УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное автономное образовательное учреждение высшего профессионального образования «Дальневосточный федеральный университет» (ДВФУ) Филиал ДВФУ в г. Уссурийске РАБОЧАЯ ПРОГРАММА УЧЕБНОЙ ДИСЦИПЛИНЫ (РПУД) Неорганические вещества в природе Направление — 050100.68. Педагогическое образование Магистерская программа – Химическое образование Форма подготовки (очная) Школа педагогики ДВФУ кафедра естественнонаучного образования курс 2 семестр 3, 4 лекции 10(час.) практические занятия 72 (час.) лабораторные работы не предусмотрены всего часов аудиторной нагрузки 82 (час.) самостоятельная работа 62 (час.) реферативные работы не предусмотрены контрольные работы не предусмотрены зачёт 3, 4 семестр экзамен не предусмотрен Рабочая программа составлена на основании требований федерального государственного образовательного стандарта высшего профессионального образования (Приказ Министерства образования и науки РФ №35 от 14 января 2010 г.). Рабочая программа обсуждена на заседании кафедры естественнонаучного образования протокол № 10 «27 » июня 2012 г. Заведующая кафедрой: Литвинова Е.А. Составитель: к.б.н., доцент Шишлова М.А. 2012 г. 9 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Оборотная сторона титульного листа РПУД I. Рабочая программа пересмотрена на заседании кафедры: Протокол от «_____» _________________ 20 г. № ______ Заведующий кафедрой _______________________ __________________ (подпись) (и.о. фамилия) II. Рабочая программа пересмотрена на заседании кафедры: Протокол от «_____» _________________ 20 г. № ______ Заведующий кафедрой _______________________ __________________ (подпись) (и.о. фамилия) 10 Лист 10 из 166 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 11 из 166 АННОТАЦИЯ Цель дисциплины «Неорганические вещества в природе» состоит в подготовке магистранта в том, чтобы дать теоретические, методологические и практические знания, формирующие современную химическую основу для освоения профилирующих учебных дисциплин и для выполнения в будущем основных профессиональных задач в соответствии с квалификацией: проведение научных исследований; обработка результатов экспериментальных исследований, научно-производственная, педагогическая деятельность, осуществление мероприятий по контролю состояния и охране окружающей среды. К задачам дисциплины относятся: - показать связь химических наук с другими дисциплинами учебного плана подготовки магистранта; - показать роль неорганических веществ в развитии современной неорганической химии; - привить магистрантам навыки грамотного и рационального оформления выполненных экспериментальных работ, обработки результатов эксперимента; навыки работы с учебной, монографической, справочной химической литературой. Дисциплина направлена на формирование следующих общекультурных и профессиональных компетенций выпускника: ОПК – 1, ПК-5, ПК-17: - готовностью осуществлять профессиональную коммуникацию на государственном (русском) и иностранном языках (ОПК-1); - способностью анализировать результаты научных исследований и применять их при решении конкретных исследовательских задач (ПК-5); 11 образовательных и Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 12 из 166 - способностью изучать и формировать культурные потребности и повышать культурно-образовательный уровень различных групп населения (ПК-17). Место дисциплины в структуре ООП. Дисциплина «Неорганические вещества в природе» относится к математическому и естественнонаучному циклу. Дисциплина является интегрирующей для изучения таких курсов как аналитическая, органическая, биологическая с основами физической и коллоидной химии. Для ее изучения необходимы знания, умения и компетенции по физике, биологии и математике в объеме, предусмотренном государственным образовательным стандартом среднего (полного) общего образования (базовый уровень). Требования к результатам освоения дисциплины: В результате изучения дисциплины магистрант должен: Знать: - особенности химической связи в различных химических соединениях; - основные формы нахождения неорганических веществ в природе; -свойства важнейших классов неорганических, органических соединений во взаимосвязи с их строением и функциями; - основные понятия и законы химии, закономерности протекания химических процессов; - методы аналитического анализа выделения, очистки, идентификации соединений; - свойства различных дисперсных систем и растворов биополимеров; Уметь: - подготовить и провести химический эксперимент по изучению свойств и идентификации различных классов неорганических химических веществ; ряда природных объектов; - определять физико-химические константы веществ; 12 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 13 из 166 - использовать необходимые приборы и лабораторное оборудование при проведении исследований; - осуществлять подбор химических методов и проводить исследования в соответствии с профессиональными компетенциями, проводить обработку результатов эксперимента и оценивать их в сравнении с литературными данными; - использовать теоретические знания и практические навыки, полученные при изучении дисциплины «Неорганические вещества в природе» для решения соответствующих профессиональных задач. Владеть: - современной химической терминологией, основными навыками работы с научной и учебной литературой. Краткое содержание дисциплины: Химические элементы в биосфере. Состояние воды в биосфере и состав природных растворов. Газы в биосфере и состав природных газовых смесей. Магматические расплавы. Биогенная форма. Техногенные соединения. Металлы Распространенность и формы нахождения металлов в природе. Окислительно-восстановительные реакции, окислители, восстановители. Неметаллы. Распространенность и формы нахождения неметаллов в природе. Физические и общие химические свойства неметаллов. Оксиды. Гидроксиды. Общая и сравнительная характеристика гидроксидов. Соли. Тип связи и тип решетки. Средние соли, гидро- и гидроксосоли. Двойные, смешанные соли и кристаллогидраты. Важнейшие природные соли. Их применение в качестве природного сырья. Особенности химии элементов металлов. Щелочные элементы. Бериллий, магний, щелочноземельные элементы (кальций, стронций, барий), радий. Редкоземельные элементы (РЗЭ: скандий, иттрий, лантан, лантаниды), актиний и актиниды. Титан, цирконий, гафний. Ванадий, ниобий, тантал. Хром, молибден, вольфрам. Марганец, технеций, рений. Триада железа 13 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 14 из 166 (железо, кобальт, никель). Платиновые элементы (триады рутения и осмия). Медь, серебро, золото. Цинк, кадмий, ртуть. Бор, алюминий и элементы подгруппы галлия галлий, индий, таллий. Углерод, кремний, элементы подгруппы германия германий, олово, свинец. Азот, фосфор, элементы подгруппы мышьяка мышьяк, сурьма, висмут. Кислород и элементы подгруппы серы. Галогены фтор, хлор, бром, йод, астат. Инертные (благородные) газы. Особенности химии элементов - неметаллов. 14 Разработчик: Шишлова М.А. I. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 15 из 166 СТРУКТУРА И СОДЕРЖАНИЕ ТЕОРЕТИЧЕСКОЙ ЧАСТИ КУРСА Тема 1. Химические элементы в биосфере (4 часа). Самостоятельные минеральные виды. Минералы в биосфере. Изоморфная форма нахождения химических элементов. Изоморфные смеси в биосфере. Водные растворы. Разложение и образование воды в биосфере. Состояние воды в биосфере и состав природных растворов. Газовые смеси. Газы в биосфере и состав природных газовых смесей. Коллоидная и сорбированная формы нахождения элементов. Адсорбия молекул и ионов. Ионный обмен в водных растворах. Миграция и старение коллоидов. Магматические расплавы. Состав расплавов. Биогенная форма. Техногенные соединения. Характеристика ряда распространенных техногенных соединений, не имеющих природных аналогов. Тема 2. Металлы (2 часа). Распространенность и формы нахождения металлов в природе. Способы получения металлов. Металлотермия. Физические и общие химические свойства металлов. Восстановительная способность металлов. Окислительновосстановительные реакции, окислители, восстановители. Тема 3. Неметаллы (2 часа). Распространенность и формы нахождения неметаллов в природе. Способы получения неметаллов. Физические и общие химические свойства неметаллов. Тема 4. Оксиды. Гидроксиды (1 час). Общая и сравнительная характеристика гидроксидов: тип связи и тип решетки, длина и энергия связи, валентный угол, термическая устойчивость, 15 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 16 из 166 возможность получения гидратацией оксидов, полярность связи, полярность молекул, Периодичность изменения кислотно-основных свойств гидроксидов и концепции её объяснения. Тема 5. Соли (1 час). Тип связи и тип решетки. Средние соли, гидро- и гидроксосоли. Двойные, смешанные соли и кристаллогидраты. Объяснение свойств солей с позиций термодинамики растворения, концепции поляризации. Способы получения солей. Важнейшие природные соли. Их применение в качестве природного сырья. II. СТРУКТУРА И СОДЕРЖАНИЕ ПРАКТИЧЕСКОЙ ЧАСТИ КУРСА 3 семестр Занятие 1. Особенности химии элементов металлов (2 часа). Занятие 2-3. Щелочные элементы (4 часа). Занятие 4-5. Бериллий, магний, щелочноземельные элементы(кальций, стронций, барий), радий (4 часа). Занятие 6-7. Редкоземельные элементы (РЗЭ: скандий, иттрий, лантан, лантаниды), актиний и актиниды (4 часа). Занятие 8-9. Титан, цирконий, гафний (4 часа). Занятие 10-11. Ванадий, ниобий, тантал (4 часа). Занятие 12-13. Хром, молибден, вольфрам (4 часа). Занятие 14-15. Марганец, технеций, рений (4 часа). Занятие 16-17. Триада железа (железо, кобальт, никель) (4 часа). Занятие 18-19. Платиновые элементы (триады рутения и осмия) (4 часа). Занятие 20-21. Медь, серебро, золото (4 часа). Занятие 22-23. Цинк, кадмий, ртуть (4 часа). 16 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 17 из 166 Занятие 24-25. Бор, алюминий и элементы подгруппы галлия галлий, индий, таллий (4 часа). Занятие 26-27. Углерод, кремний, элементы подгруппы германия германий, олово, свинец (4 часа). 4 семестр Занятие 28-29. Азот, фосфор, элементы подгруппы мышьяка мышьяк, сурьма, висмут (4 часа). Занятие 30-31. Кислород и элементы подгруппы серы (4 часа). Занятие 32-33. Галогены фтор, хлор, бром, йод, астат (4 часа). Занятие 34-35. Инертные (благородные) газы (4 часа). Занятие 36. Особенности химии элементов - неметаллов (2 часа). 17 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 18 из 166 III. КОНТРОЛЬ ДОСТИЖЕНИЯ ЦЕЛЕЙ КУРСА Текущий контроль знаний магистрантов осуществляется путём устного собеседования, защиты отчётов по темам с применением слайд-презентаций. Промежуточный контроль знаний магистрантов осуществляется путем проведения контрольных работ, включающих вопросы и задания по отработанным разделам. Итоговый контроль Вопросы к зачету (3 семестр) 1. Оксиды, гидроксиды s -металлов группы: тип химические связи, тип решетки. Физические свойства (термическая устойчивость, растворимость), применение. Сравнительная характеристика кислотно-основных свойств гидроксидов 2. Соли щелочных металлов: тип химические связи, тип решетки, физические свойства (термическая устойчивость, гидролиз, растворимость, применение) 3. Соли s-металлов 2 группы: тип химические связи, тип решетки, физические свойства (термическая устойчивость, растворимость, гидролиз), применение. 4 Типы кристаллический решеток простых веществ /молекулярные, атомные, металлические/. Физические свойства веществ и тип К.Р Влияние энергии атомизации, ионизации и гидратации на место металла в ряду напряжени 5. Германий и его соединения: физические и химические свойства, применение. Сравнение свойств германия: с углеродом и кремнием, оловом и свинцом. Значение открытия германия. 6. Мышьяк, сурьма и висмут: общая характеристика атомов элементов и простых веществ, водородных и кислородных соединений. Галогениды и сульфиды. Практическое использование и токсичность соединений. 18 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 19 из 166 7. Селен, теллур, полоний и их соединения с водородом и кислородом. Использование селена и теллура в полупроводниковой технике 8. Соединения водорода с металлами и неметаллами. Сравнительная характеристика водородных соединений элементов 5, 6 ,7 групп 9.Оксиды: строение, тип связи между атомами. Классификация оксидов. Основные свойства и способы получения оксидов. Сравнительная характеристика оксидов в III периоде и главной подгруппе II группы. 10. Гидроксиды: строение, тип связи между атомами. Классификация гидрооксидов. Основные свойства и способы получения гидрооксидов. Сравнительная характеристика . 11. Соли: тип связи, строение, классификация, термическая устойчивость. Получение солей. Растворимость солей. 12. Гидролиз солей: причины и случаи, константа и степень гидролиза. 13. Комплексные соединения: теории строения. Практическое применение. Получение, устойчивость. 14. Элементы главной подгруппы 7 группы: общая характеристика атомов элементов и простых веществ. Фтор и его соединения. 15. Сравнение силы, термической устойчивости и окислительновосстановительных свойств кислот хлора. Практическое применение кислородных соединений хлора. 16. Бром, йод и их соединения. Вопросы к зачету (4 семестр) 1. Элементы главной подгруппы 6 группы: общая характеристика атомов элементов и простых веществ. Кислород и озон: строение простого вещества, физические и химические свойства, получение и применение. Озон: образование в природе, разрушение озонового слоя в стратосфере. 2. Халькогены в природе. Аллотропия. Свойства и практическое применение. Свойства серы, селена и теллура, их применение. 19 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 20 из 166 3. Кислородные кислоты серы: сернистая, серная, полисерные, тиосерная и др. Свойства и применение их солей. Сульфиды и полисульфиды.. 4. Элементы главной подгруппы 5 группы: общая характеристика атомов элементов простых веществ Оксиды азота. Соединения азота с металлами и галогенами. 5. Аммиак, гидразин и гидроксиламин.: электронное строение и геометрия молекул, физические и химические свойства, способы получения. Практическое применение . 6. Фосфор: аллотропные видоизменения фосфора, их свойства. Важнейшие природные соединения фосфора, его получение и применение. Оксиды фосфора: строение, физические и химические свойства, применение. 7. Фосфорные кислоты (ортофосфорная, полифосфорные, метафосфорные) строение, физические и химические свойства, применение. 8. Свойства и применение средних и кислых фосфатов, фосфорные удобрения. 9. Элементы главной подгруппы 4 группы: общая характеристика атомов элементов и простых веществ. Углерод в природе. Аллотропия углерода: алмаз, графит, карбин и фуллерены: их структура, физические и химические свойства, практическое значение. 10. Химические свойства углерода. Углерод как восстановитель. Сравнение углерода с азотом и галогенами. Карбиды. Синильная кислота и цианиды: строение, физические и химические свойства, использование в промышленности. 11. Оксиды углерода: строение молекул, физические и химические свойства, физиологическое действие, способы получения. Карбонилы. 12. Угольная кислота. Карбонаты и гидрокарбонаты: природе, растворимость, гидролиз, термическая устойчивость. 20 нахождение в Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 21 из 166 13. Кремний в природе. Физические и химические свойства кремния, его получение и применение. Понятие о зонной теории полупроводников. 14. Диоксид кремния, кремниевая кислота, силикаты: строение, физические и химические свойства, применение. 15. Бор и его соединения: физические и химические свойства, применение. Свойства и применение ортоборной кислоты и буры. 16. Благородные газы: особенности положения в периодической системе, способы получения, физические и химические свойства, применение. IV. ТЕМАТИКА И ПЕРЕЧЕНЬ КУРСОВЫХ РАБОТ И РЕФЕРАТОВ Учебным планом курсовые работы и рефераты не предусмотрены. 21 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 22 из 166 V. УЧЕБНО-МЕТОДИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ДИСЦИПЛИНЫ Основная литература 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010.- 256 с. 2. Ардашников, Е.И. Сборник задач по неорганической химии / Е.И. Ардашников. – М.: Академия, 2008. – 208 с. 3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006.- 743 с. 4. Батраков, В.В. Практикум по общей и неорганической химии / В.В. Батраков. – М.: Колос С, 2007. – 464 с. 5. Вольхин, В.В. Общая химия / В.В. Вольхин. - СПб.: Лань, 2009. - 464 с. 6. Глинка, Н.Л. Задачи и упражнения по общей химии / Н.Л. Глинка. М.: Интеграл-пресс, 2009.- 240 с. 7. Глинка, Н.Л. Общая химия / Н.Л. Глинка.- М.: Юрайт, 2010. – 886 с. 8. Гринвуд, Н.Н. Химия элементов В 2-х томах / Н.Н. Гринвуд. – М.: Бином, 2008. – 1 том – 600 с., 2 том – 666 с. 9. Неорганическая химия / Под ред. Ю.Д.Третьякова. - М.: Академкнига, 2007. - 1209 с. 10. Павлов, Н.Н. Сборник задач и упражнений по общей и неорганической химии / Н.Н. Павлов, В.И. Фролов. – М.: Дрофа, 2005. – 240 с. Дополнительная литература 1. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами / Р.А. Лидин. - М.: Бином ,2010. – 230 с. 2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. - М.: Высшая школа, 2009. – 560 с. 22 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 23 из 166 3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: Учеб. Пособие для студентов / З.Е. Гольбрайх, Е.И. Маслов. – М.: Астрель, 2004.383 с. 4. Князев, Д.А. Неорганическая химия. 3-е изд. испр. / Д.А. Князев, С.Н. Смарыгин. – М.: Дрофа, 2004. – 592 с. 5. Коровин, В.Н. Общая химия / В.Н. Коровин. - М.: Высшая школа, 2009. - 377 с. 6. Неорганическая химия (элементы биогенные и абиогенные): Учебное пособие / Под ред. проф. В.В. Егорова. – СПб.: Издательство «Лань», 2009. – 320 с. 7. Общая и неорганическая химия, Т.2 Химические свойства неорганических веществ / Под ред. А.Ф. Воробьева. - М.: ИКЦ «Академкнига», 2007. -544 с. Электронные информационные образовательные ресурсы: http://window.edu.ru Афиногенов Ю.П., Гончаров Е.Г., Ховив А.М., Селеменев В.Ф. Химическая связь в курсе неорганической химии (Межмолекулярное взаимодействие): Учебное пособие. – Часть 5. – М., 2012. – 213 с. http://window.edu.ru Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М: ИНФРА-М, 2009. - 336 с. http://znanium.com Татаринцева Т.Б. Технологии синтеза моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://window.edu.ru/ Афиногенов Ю.П., Гончаров Е.Г., Ховив А.М., Селеменев В.Ф. Химическая связь в курсе неорганической химии (Межмолекулярное взаимодействие): Учебное пособие. – Часть 5. – М., 2011. 65 с. 23 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 24 из 166 МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное автономное образовательное учреждение высшего профессионального образования «Дальневосточный федеральный университет» (ДВФУ) Филиал ДВФУ в г. Уссурийске КОНСПЕКТЫ ЛЕКЦИЙ по дисциплине «Неорганические вещества в природе» 050100.68 «Педагогическое образование» Магистерская программа – «Химическое образование» г. Уссурийск 2012 24 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 25 из 166 Тема 1. Химические элементы в биосфере (4 часа), с использованием метода активного обучения – ведомая (управляемая) беседа, с элементами лекции-дискуссии. Цель: Изучить химические элементы в биосфере. Задачи: 1. Рассмотреть понятие «химический элемент в биосфере». 2. Рассмотреть биогенные элементы. 3. Ознакомиться с минералами, которые входят в биосферу. План: 1. Химические элементы: понятие, общая характеристика. а) Определение «химический элемент» б) Общая характеристика химических элементов. в) Элементы-металлы и элементы-неметаллы. 2. Биогенные элементы: понятие, общая характеристика. а) Общая характеристика биогенных элементов. б) Основные круговороты биогенных элементов (кислород, водород, азот, углерод). 3. Минералы: общая характеристика. а) Нахождение минералов в природе. б) Виды классификаций минералов. в) Химический состав, химические формулы минералов. 4. Минералы, входящие в состав биосферы. Содержание лекции: 1. В естественных условиях на нашей планете в более или менее ощутимых количествах обнаружено 92 элемента. Л. П. Виноградов считал, что концентрация элементов в живом веществе прямо пропорциональна его содержанию в среде обитания с учетом растворимости их соединений. По мнению А. П. Виноградова химический 25 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 26 из 166 состав организма определяется составом окружающей среды. Биосфера содержит 100 млрд тонн живого вещества. Около 50% массы земной коры приходится на кислород, более 25% на кремний. Восемнадцать элементов (О, Si, Al, Fe, Ca. Na, К, Mg, H, Ti, С, Р, N, S, Cl, F, Мn, Ва) составляют 99,8% массы земной коры. Живые организмы принимают активное участие в перераспределении химических элементов в земной коре. Минералы, природные химические вещества, образуются в биосфере в различных количествах, благодаря деятельности живых веществ (образование железных руд, горных пород, в основе которых соединения кальция). Кроме этого, оказывают влияние техногенные загрязнения окружающей среды. Изменения, происходящие в верхних слоях земной коры, влияют на химический состав живых организмов. В организме можно обнаружить почти все элементы, которые есть в земной коре и морской воде. Пути поступления элементов в организм разнообразны. Согласно биогеохимической теории Вернадского существует «биогенная миграция атомов». 2. Элементы-металлы и элементы-неметаллы. Нахождение в природе. Характеристика простых веществ. Биогенные элементы, содержание которых превышает 0,01% от массы тела, относят к макроэлементам. К ним отнесены 12 элементов: органогены, ионы электролитного фона и железо. Они составляют 99,99% живого субстрата. Еще более поразительно, что 99% живых тканей содержат только шесть элементов: С, Н, О, N, Р, Ca. Элементы К, Na, Mg, Fe, Сl, S относят к олигобиогенным элементам. Содержание их колеблется от 0,1 до 1%. Биогенные элементы, суммарное содержание которых составляет величину порядка 0,01%, относят к микроэлементам. Содержание каждого из них £ 0,001% (10-3 – 10-5%).Большинство микроэлементов содержится в основном в тканях печени. Это депо микроэлементов. Некоторые микроэлементы 26 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 27 из 166 проявляют сродство к определенным тканям (йод - к щитовидной железе, фтор - к эмали зубов, цинк - к поджелудочной железе, молибден - к почкам и т.д.). Элементы, содержание которых меньше чем 10-5%, относят к ультрамикроэлементам. Данные о количестве и биологической роли многих элементов невыяснены до конца. Некоторые из них постоянно содержатся в организме животных и человека: Ga, Ti, F, Al, As, Cr, Ni, Se, Ge, Sn и другие. Биологическая роль их мало выяснена. Их относят к условно биогенным элементам. Другие примесные элементы (Те, Sc, In, W, Re и другие) обнаружены в организме человека и животных, и данные об их количестве и биологической роли не выяснены. Примесные элементы также делят на аккумулирующиеся (Hg, Pb, Cd) и не аккумулирующиеся (Al, Ag, Go, Ti, F). Известны крылатые слова, сказанные в 40-х годах немецкими учеными Вальтером и Идой Ноддак: «В каждом булыжнике на мостовой присутствуют все элементы периодической системы». Если согласиться, что в каждом булыжнике содержатся все элементы, то тем более это должно быть справедливо для живого организма. 3. Самостоятельные минеральные виды. Минералы в биосфере. Изоморфная форма нахождения химических элементов. Изоморфные смеси в биосфере. Водные растворы. Разложение и образование воды в биосфере. Состояние воды в биосфере и состав природных растворов. Газовые смеси. Газы в биосфере и состав природных газовых смесей. Коллоидная и сорбированная формы нахождения элементов. Адсорбия молекул и ионов. Ионный обмен в водных растворах. Миграция и старение коллоидов. Работа с коллекциями минералов. Активная форма проведения занятия: информационная лекция, которая сопровождается проблемными вопросами и слайд-презентациями, позволяющими проиллюстрировать теоретический материал. 27 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 28 из 166 Активные методы обучения: - ведомая (управляемая) беседа - элементы лекции-дискуссии Проблемные вопросы для обсуждения: 1. Магматические расплавы. 2. Состав расплавов. 3. Биогенная форма. 4. Техногенные соединения. 5. Характеристика ряда распространенных техногенных соединений, не имеющих природных аналогов. Основная литература 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010.- 256 с. 2. Ардашников, Е.И. Сборник задач по неорганической химии / Е.И. Ардашников. – М.: Академия, 2008. – 208 с. 3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006.- 743 с. Дополнительная литература 1. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами / Р.А. Лидин. - М.: Бином ,2010. – 230 с. 2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. - М.: Высшая школа, 2009. – 560 с. 3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: Учеб. Пособие для студентов / З.Е. Гольбрайх, Е.И. Маслов. – М.: Астрель, 2004.383 с. Электронные информационные и образовательные ресурсы: 28 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 29 из 166 http://znanium.com Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М ИНФРА-М, 2009. – 336 с. http://window.edu.ru Абакумова Н.А., Быкова Н.Н. Неорганическая химия. Учебное пособие. - Тамбов: Изд-во ТГТУ, 2009. - 124 с. http://znanium.com Татаринцева Т.Б. Технологии синтеза моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://znanium.com Горбылева А. И. Почвоведение: Учебное пособие. М.: НИЦ ИНФРА-М; Мн.: Нов. знание, 2014 – 400 с. Жебентяев http://znanium.com А.И. Аналитическая химия. Хроматографические методы анализа: Учебное пособие. - М.: НИЦ ИнфраМ; Мн.: Нов. знание, 2013. http://www. college.ru/chemistry/index/php. Базы данных, информационносправочные и поисковые системы Ресурсы Интернета по химии. Вопросы для самопроверки 1. Минералы: общая характеристика. 2. Минералы, входящие в состав биосферы. 3. Химические элементы: понятие, общая характеристика. 4. Биогенные элементы: понятие, общая характеристика. Тема 2. Металлы в природе (2 часа), с использованием метода активного обучения – создание проблемной ситуации и демонстрация слайдов Цель: Изучить металлы, которые можно встретить в природе. Задачи: 1. Рассмотреть периодическую таблицу Менделеева 2. Рассмотреть щелочные и щелочноземельные металлы 3. Рассмотреть процесс восстановления металлов 29 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 30 из 166 План: 1. Нахождение металлов в Периодической таблице Д.И. Менделеева. 2. Щелочные металлы таблицы Д.И. Менделеева. 3. Щелочноземельные металлы таблицы Д.И. Менделеева. Содержание лекции: 1. Вследствие высокой химической активности, металлы в природе находятся в виде различных соединений, и только малоактивные (благородные) металлы – платина, золото и т.п. – встречаются в самородном (свободном) состоянии. Наиболее распространенными природными соединениями металлов являются оксиды (гематит Fe2O3, магнетит Fe3O4, куприт Cu2O, корунд Al2O3, пиролюзит MnO2 и др.), сульфиды (галенит PbS, сфалерит ZnS, халькопирит CuFeS, киноварь HgS и т.д.), а также соли кислородосодержащих кислот (карбонаты, силикаты, фосфаты и сульфаты). Щелочные и щелочноземельные металлы встречаются преимущественно в виде галогенидов (фторидов или хлоридов). Основная масса металлов получается путем переработки полезного ископаемого – руды. Поскольку металлы, входящие в состав руд, находятся в окисленном состоянии, то их получение осуществляется путем реакции восстановления. Предварительно руду очищают от пустой породы. Образовавшийся концентрат оксида металла очищают от воды, а сульфиды для удобства последующей переработки переводят в оксиды путем обжига, например: 2ZnS + 2O2 = 2ZnO + 2SO2. Для разделения элементов полиметаллических руд пользуются методом хлорирования. При обработке руд хлором в присутствии восстановителя образуются хлориды различных металлов, которые вследствие значительной и различной летучести могут быть легко отделены друг от друга. Восстановление металлов в промышленности осуществляется посредством различных процессов. Процесс восстановления безводных соединений 30 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 31 из 166 металлов при высоких температурах называют пирометаллургией. В качестве восстановителей используют металлы более активные, чем получаемый, либо углерод. В первом случае говорят о металлотермии, во втором – карботермии, например: Ga2O3 + 3C = 2Ga + 3CO; Cr2O3 + 2Al = 2Cr + Al2O3; TiCl4 + 2Mg = Ti + 2MgCl2 . Особое значение углерод приобрел как восстановитель железа. Углерод для восстановления металлов применяется обычно в виде кокса. Процесс восстановления металлов из водных растворов их солей относится к области гидрометаллургии. Получение металлов осуществляется при обычных температурах, причем в качестве восстановителей могут быть использованы сравнительно активные металлы или электроны катода при электролизе. Электролизом водных растворов солей могут быть получены только сравнительно малоактивные металлы, расположенные в ряду напряжений (стандартных электродных потенциалов) непосредственно перед водородом или после него. Активные металлы – щелочные, щелочноземельные, алюминий и некоторые другие, получают электролизом расплава солей. С химической точки зрения металл – это элемент, который во всех соединениях проявляет положительную степень окисления. Из известных в настоящее время отличительной элементов, особенностью 86 являются металлов металлами. является Основной наличие в конденсированном состоянии свободных, не связных с определенным атомом электронов. Эти электроны способны перемещаться по всему объему тела. Наличие свободных электронов определяет всю совокупность свойств металлов. В твердом состоянии большинство кристаллическую высокосимметричную структуру. 31 металлов имеет Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 32 из 166 2. Существует техническая классификация металлов. Обычно выделяют следующие группы: черные металлы (Fe); тяжелые цветные металлы (Cu, Pb, Zn, Ni, Sn, Co, Sb, Bi, Hg, Cd), легкие металлы с плотностью менее 5 г/см3 (Al, Mg, Ca и т.д.), драгоценные металлы (Au, Ag и платиновые металлы) и редкие металлы (Be, Sc, In, Ge и некоторые другие). В химии металлы классифицируются по их месту в периодической системе элементов. Различают металлы главных и побочных подгрупп. Металлы главных подгрупп называют непереходными. Эти металлы характеризуются тем, что в их атомах происходит последовательное заполнение s- и p-электрон-ных оболочек. Типичными металлами являются s-элементы (щелочные Li, Na, K, Rb, Cs, Fr и щелочноземельные Be, Mg, Ca, Sr, Ba, Ra металлы). Данные металлы расположены в Iа и IIа подгруппах (т. е., в главных подгруппах I и II групп). Этим металлам отвечает конфигурация валентных электронных оболочек ns1 или ns2 (n – главное квантовое число). Для данных металлов характерно: а) металлы имеют на внешнем уровне 1–2 электрона, поэтому проявляют постоянные степени окисления +1, +2; б) оксиды этих элементов носят основной характер (исключение – бериллий, т.к. малый радиус иона придает ему амфотерные свойства); в) гидриды имеют солеобразный характер и образуют ионные кристаллы; г) возбуждение электронных подуровней возможно только у металлов IIА группы с последующей sp-гибридизацией орбиталей. К p-металлам относятся элементы IIIа (Al, Ga, In, Tl), IVа (Ge, Sn, Pb), Vа (Sb, Bi) и VIа (Ро) групп с главными квантовыми числами 3, 4, 5, 6. Данным металлам отвечает конфигурация валентных электронных оболочек ns2pz (z может принимать значение от 1 до 4 и равно номеру группы минус 2). Для данных металлов характерно: 32 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 33 из 166 а) образование химических связей осуществляется s- и p-электронами в процессе их возбуждения и гибридизации (sp- и spd-), однако сверху вниз по группам способность к гибридизации падает; б) оксиды p-металлов амфотерные или кислотные (основные оксиды только у In и Tl); в) гидриды p-металлов имеют полимерный характер (AlH3)n или газообразный (SnH4 ,PbH4 и т.д.), что подтверждает сходство с неметаллами, открывающими эти группы. В атомах металлов побочных подгрупп, называемых переходными металлами, происходит застраивание d- и f-оболочек, в соответствии с чем их делят на d-группу и две f-группы лантаноиды и актиноиды. 3. К переходным металлам относят 37 элементов d-группы и 28 металлов f-группы. К металлам d-группы относят элементы Ib (Cu, Ag, Au), IIb (Zn, Cd, Hg), IIIb (Sc, Y, La, Ac), IVb (Ti, Zr, Hf, Db), Vb (V, Nb, Ta, Jl), VIb (Cr, Mo, W, Rf), VIIb (Mn, Tc, Re, Bh) и VIII групп (Fe, Co, Ni, Ru, Rh, Pd, Os, Ir, Rt, Hn, Mt, Db, Jl, Rf, Bh, Hn, Mt). Этим элементам отвечает конфигурация 3dz4s2. Исключения составляют некоторые атомы, в том числе атомы хрома с полузаполненной 3d5-оболочкой (3d54s1) и меди – с полностью заполненной 3d10-оболочкой (3d104s1). Эти элементы обладают некоторыми общими свойствами: 1. Все они образуют сплавы между собой и другими металлами; 2. Наличие частично заполненных электронных оболочек обусловливает способность d-металлов образовывать парамагнитные соединения; 3. В химических реакциях они проявляют переменную валентность (за немногими исключениями), а их ионы и соединения, как правило, окрашены; 4. В химических соединениях d-элементы электроположительны. «Благородные» металлы, обладая высоким положительным значением 33 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 34 из 166 стандартного электродного потенциала (Е > 0), взаимодействуют с кислотами необычным образом; 5. Ионы d-металлов имеют вакантные атомные орбитали валентного уровня (ns, np, (n – 1) d), поэтому они проявляют акцепторные свойства, выступая в качестве центрального иона в координационных (комплексных) соединениях. Химические свойства элементов определяются их положением в Периодической системе элементов Менделеева. Так, металлические свойства сверху вниз в группе возрастают, что обусловлено уменьшением силы взаимодействия между валентными электронами и ядром вследствие увеличения радиуса атома и за счет возрастания экранирования электронами, расположенными на внутренних атомных орбиталях. Это приводит к облегчению ионизации атома. В периоде металлические свойства уменьшаются слева направо, т.к. это связано с увеличением заряда ядра и тем самым с увеличением прочности связи валентных электронов с ядром. В химическом отношении атомы всех металлов характеризуются сравнительной легкостью отдачи валентных электронов (т.е. малой величиной энергии ионизации) и низким значением сродства к электрону (т.е. малой способностью удерживать избыточные электроны). Как следствие этого – низкое значение электроотрицательности, т.е. способность образовывать только положительно заряженные ионы и проявлять в своих соединениях только положительную степень окисления. В связи с этим металлы в свободном состоянии являются восстановителями. Восстановительная способность разных металлов неодинакова. Для реакций в водных растворах она определяется значением стандартного электродного потенциала металла (т.е. положением металла в ряду напряжений) и концентрацией (активностью) его ионов в растворе. 34 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 35 из 166 Активная форма проведения занятия: информационная лекция, которая сопровождается проблемными вопросами и слайд-презентациями, позволяющими проиллюстрировать теоретический материал. Активные методы обучения: - демонстрация слайдов - использование метода создания проблемной ситуации Проблемные вопросы для обсуждения: 1. Распространенность и формы нахождения металлов в природе. 2. Способы получения металлов. 3. Металлотермия. 4. Физические и общие химические свойства металлов. 5. Восстановительная способность металлов. 6. Окислительно-восстановительные реакции, окислители, восстановители. Литература Основная литература 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010.- 256 с. 2. Ардашников, Е.И. Сборник задач по неорганической химии / Е.И. Ардашников. – М.: Академия, 2008. – 208 с. 3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006.- 743 с. 4. Батраков, В.В. Практикум по общей и неорганической химии / В.В. Батраков. – М.: Колос С, 2007. – 464 с. 5. Вольхин, В.В. Общая химия / В.В. Вольхин. - СПб.: Лань, 2009. - 464 с. Дополнительная литература 35 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 36 из 166 1. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами / Р.А. Лидин. - М.: Бином ,2010. – 230 с. 2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. - М.: Высшая школа, 2009. – 560 с. Электронные информационные и образовательные ресурсы: http://znanium.com Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М ИНФРА-М, 2009. – 336 с. http://window.edu.ru Абакумова Н.А., Быкова Н.Н. Неорганическая химия. Учебное пособие. - Тамбов: Изд-во ТГТУ, 2009. - 124 с. http://znanium.com Татаринцева Т.Б. Технологии синтеза моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://znanium.com Горбылева А. И. Почвоведение: Учебное пособие. М.: НИЦ ИНФРА-М; Мн.: Нов. знание, 2014 – 400 с. http://lib.uspi.ru Кислинский К.В., Шишлова Т.М. Методические указания к выполнению лабораторных работ по оптическим методам анализа. — Уссурийск : УОП ПГСХА, 2010. — 37 c. http://www. college.ru/chemistry/index/php. Базы данных, информационносправочные и поисковые системы Ресурсы Интернета по химии. Вопросы для самопроверки 1. Периодическая таблица Д.И. Менделеева. 2. Щелочные металлы таблицы Д.И. Менделеева. 3. Щелочноземельные металлы таблицы Д.И. Менделеева. Тема 3. Неметаллы в природе (2 часа), с использованием метода активного обучения – демонстрация слайдов с презентациями Цель: Изучить неметаллы в природе. 36 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 37 из 166 Задачи: 1. Рассмотреть распространенность и формы нахождения неметаллов в природе. 2. Рассмотреть способы получения неметаллов. 3. Рассмотреть физические и общие химические свойства неметаллов. План: 1. Распространенность и формы нахождения неметаллов в природе. а) Распространенность и формы нахождения серы в природе. б) Распространенность и формы нахождения азота в природе. в) Распространенность и формы нахождения углерода в природе. г) Распространенность и формы нахождения кислорода в природе. 2. Способы получения неметаллов. 3. Физические и общие химические свойства неметаллов. Содержание лекции: 1. В число десяти элементов, знакомых людям с глубокой древности, входят два неметалла — углерод и сера. Оба элемента встречаются в природе в свободном состоянии. Молекула серы состоит из восьми атомов, соединяющихся друг с другом в кольцо. При нагревании такие кольца разрываются, а при более высокой температуре образовавшиеся цепочки укорачиваются, так что сера становится смесью молекул, содержащих 8, 6 и 2 атома. При очень высокой температуре пары серы состоят из молекул S2, т. е. построены так же, как молекулы кислорода, азота, хлора в обычных условиях. Самое устойчивое состояние серы — кольцеобразная молекула S8. При быстром охлаждении расплавленной серы разорванные кольца не успевают замкнуться и сера становится пластичной, а затем, превращаясь в самую устойчивую форму, возвращает себе привычный внешний вид и свойства. 37 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 38 из 166 Так проявляется один из самых универсальных законов: все процессы в природе идут так, чтобы достигалось самое устойчивое состояние, энергия которого самая маленькая (камень падает с горы, потому что у ее подножия он будет обладать самой маленькой потенциальной энергией; сжатая пружина разжимается, потому что это ведет к снижению ее потенциальной энергии; атом любого элемента стремится к образованию устойчивой наружной оболочки, так как это тоже отвечает минимуму энергии). Углерод встречается в природе в двух различных формах (аллотропических видоизменениях), отличающихся друг от друга строением кристаллической решетки: это — алмаз и графит. Люди не сразу пришли к пониманию того, что благороднейший алмаз и невзрачный уголь — близнецы. А между тем установить это было совсем просто: в один прекрасный день с помощью линзы сконцентрировали солнечные лучи на кристаллике алмаза, помещенного под стеклянный колпак. Алмаз... сгорел, а под колпаком образовался углекислый газ — тот же самый, что образуется при горении угля. Если алмаз — одно из редчайших произведений природы, то графит и уголь образуют мощные залежи. Правда, уголь почти никогда не состоит из чистого углерода, а всегда содержит различные примеси. Недавно было установлено, что обычная сажа имеет строение, похожее на строение графита. В течение долгого времени она причиняла людям одни неприятности, засоряя дымоходы, загрязняя воздух. Сажу использовали лишь для приготовления красок, туши и т. п. Но в последние десятилетия ее стали специально готовить, причем для этого пришлось строить большие заводы, придумывать способ сжигать топливо так, чтобы сажи получалось как можно больше. Сажа — необходимый компонент при изготовлении резины из каучука. Специальным образом приготовленный аморфный углерод широко 38 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 39 из 166 используется для поглощения (адсорбции) многих веществ и как основа для нанесения катализаторов. Графит очень нужен людям не только для карандашей. Порошок графита — хорошая смазка для трущихся частей машин. Из графита делают электроды для различных электрических устройств, потому что графит хорошо проводит электрический ток, и это, пожалуй, единственный пример хорошей электропроводности среди неметаллов. Азот и кислород составляют 99% атмосферы нашей планеты (78%— азот и 21%— кислород). Галогены встречаются в природе в виде различных соединений, и это понятно — ведь они очень активны. Но кислород тоже очень активный неметалл. Как же это совместить с большим количеством свободного кислорода в природе? Нет ли здесь какого-то противоречия? Все дело в огромной роли, которую играют в химии Земли растения. Это они — действующие «фабрики» — производят кислород. Если бы вдруг в один совсем не прекрасный день весь растительный мир перестал существовать, количество кислорода немедленно начало бы уменьшаться, а через 3000 лет в атмосфере совсем не осталось бы кислорода... И все же высокая химическая активность кислорода сказывается на его судьбе. Количество свободного кислорода 1015 т, т. е. 1 миллион миллиардов тонн. В соединениях с другими элементами его содержится в 10 000 раз больше. Без кислорода нет дыхания, а без дыхания нет жизни. Но значение кислорода для жизни не ограничивается только этим. Из двух аллотропных видоизменений кислорода — «обычного» кислорода O2 и озона O3 — устойчивой является именно первая форма. Озон довольно быстро превращается в «обычный» кислород, если не успевает вступать в реакцию с другими веществами. Солнце могло бы стать причиной гибели всего живого, потому что, кроме благодатного тепла и света, оно посылает на Землю разящий поток губительных ультрафиолетовых лучей. И защищает нас от 39 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 40 из 166 этого врага невидимое кислородное «одеяло»: на большой высоте ультрафиолетовые лучи встречаются с молекулами кислорода, «разбивают» их и превращают в молекулы озона. Образовавшийся озон и задерживает смертоносное излучение Солнца. О кислороде обычно говорят: «газ без цвета, без запаха, без вкуса». Это верно, но лишь для привычных нам условий. Если обычный воздух охладить ниже -150° под давлением в 40 атм, он превращается в бесцветную жидкость. Если такую жидкость поместить в специальные сосуды с двойными стенками из зеркального стекла, между которыми выкачан воздух, то жидкий воздух медленно испаряется, причем легче улетучивается азот. Поэтому в конце концов в сосуде останется чистый жидкий кислород. Оказывается, жидкий кислород совсем не бесцветный, а голубой. Его помещают под давлением в стальные баллоны и используют там, где это необходимо. А необходимость в кислороде большая. Для выплавки чугуна, например, в домну вдувают воздух, необходимый для сгорания топлива. Но необходим-то только кислород, а азот активно мешает процессу, уносит тепло, ухудшает качество металла. Поэтому в доменном процессе очень перспективно применение чистого кислорода. Жидкий кислород используют в качестве окислителя топлива в некоторых системах космических ракет. Азот — «безжизненный» газ, как его назвали когда-то (он не поддерживает горения и дыхания),— интересный неметалл. Молекула N2 очень прочна, поэтому азот с трудом вступает в реакции. Свободный азот — самая устойчивая форма существования этого элемента в природе. В пределах каждого периода происходит переход от элементов-металлов к элементам-неметаллам и затем к инертному газу. Но в первом периоде перед инертным газом гелием находится лишь один элемент — водород. Это исключительный случай. Потому и элемент очень необычен, своеобразен. По физическим свойствам он очень похож на неметаллы — галогены. Реагируя с 40 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 41 из 166 некоторыми металлами, например с литием, водород проявляет, как и галогены, валентность -1. Значит, водород — неметалл? Но, соединяясь со всеми остальными неметаллами, водород проявляет валентность + 1, отдавая электрон. В таком состоянии он способен образовать ионы Н+. В этом водород похож на металлы. Вот почему водород часто помещают и в I и в VII группу периодической системы. «Окись водорода» — вода при диссоциации дает не только ионы водорода Н+ (как положено кислоте), но и ионы ОН- (как положено основанию). Это ли не амфотерность? Итак, в известном смысле водород — и металл, и неметалл, и «пограничный элемент» одновременно. Мы уже знаем, что растения освобождают кислород и выделяют его в атмосферу. С азотом дело обстоит как раз наоборот: живые организмы связывают азот атмосферы. Подсчитано, что так называемые азотобактерии, живущие в почве, способны за год связать 50 кг азота на каждом гектаре Земли. Бактерии же, обитающие на корнях бобовых растений, перерабатывают втрое больше атмосферного азота в расчете на 1 га! Есть бактерии, «работающие» в обратном направлении,— они возвращают связанный в соли азотной кислоты элемент опять в атмосферу. При электрических разрядах в атмосфере во время грозы азот вступает в соединение с кислородом и в конце концов превращается в азотную кислоту. Потоки азотной кислоты, льющиеся на землю с грозовым дождем! Не слишком ли это преувеличено? Судите сами: в среднем на всех материках происходит более 40 000 гроз в день, и эти грозы приносят ежегодно около 15 кг связанного азота на 1 га земной поверхности. В наше время в судьбу азота активно вмешался человек. Еще 140 лет назад первую партию чилийской селитры — одного из важнейших азотных удобрений — выбросили в море за ненадобностью. Сегодня на сотнях заводов превращают атмосферный азот в химические соединения, без 41 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 42 из 166 которых невозможна ни современная промышленность, ни сельскохозяйственное производство. Один из методов связывания атмосферного азота подражает природе: смесь азота и кислорода пропускают через электрическую дугу и получают окисел N0, который далее легко реагирует с кислородом воздуха, превращаясь в бурый NO2. При растворении в воде он дает азотную кислоту. Как же может случиться, что кислород находится не в устойчивой форме своих соединений, а в свободном состоянии; наоборот, почему же азот, максимально устойчивый в своем элементарном состоянии, все же превращается в различные соединения? Активная форма проведения занятия: информационная лекция, которая сопровождается проблемными вопросами и слайд-презентациями, позволяющими проиллюстрировать теоретический материал. Активные методы обучения: - ведомая (управляемая) беседа - демонстрация слайдов Проблемные вопросы для обсуждения: 1. Распространенность и формы нахождения неметаллов в природе 2. Способы получения неметаллов. 3. Физические и общие химические свойства неметаллов. Литература Основная литература 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010.- 256 с. 2. Ардашников, Е.И. Сборник задач по неорганической химии / Е.И. Ардашников. – М.: Академия, 2008. – 208 с. 3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006.- 743 с. 42 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 43 из 166 4. Батраков, В.В. Практикум по общей и неорганической химии / В.В. Батраков. – М.: Колос С, 2007. – 464 с. 5. Вольхин, В.В. Общая химия / В.В. Вольхин. - СПб.: Лань, 2009. - 464 с. 6. Глинка, Н.Л. Задачи и упражнения по общей химии / Н.Л. Глинка. М.: Интеграл-пресс, 2009.- 240 с. 7. Глинка, Н.Л. Общая химия / Н.Л. Глинка.- М.: Юрайт, 2010. – 886 с. 8. Гринвуд, Н.Н. Химия элементов В 2-х томах / Н.Н. Гринвуд. – М.: Бином, 2008. – 1 том – 600 с., 2 том – 666 с. 9. Неорганическая химия / Под ред. Ю.Д.Третьякова. - М.: Академкнига, 2007. - 1209 с. 10.Павлов, Н.Н. Сборник задач и упражнений по общей и неорганической химии / Н.Н. Павлов, В.И. Фролов. – М.: Дрофа, 2005. – 240 с. Дополнительная литература 1. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами / Р.А. Лидин. - М.: Бином ,2010. – 230 с. 2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. - М.: Высшая школа, 2009. – 560 с. 3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: Учеб. Пособие для студентов / З.Е. Гольбрайх, Е.И. Маслов. – М.: Астрель, 2004.383 с. 4. Князев, Д.А. Неорганическая химия. 3-е изд. испр. / Д.А. Князев, С.Н. Смарыгин. – М.: Дрофа, 2004. – 592 с. 5. Коровин, В.Н. Общая химия / В.Н. Коровин. - М.: Высшая школа, 2009. - 377 с. 43 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 44 из 166 6. Неорганическая химия (элементы биогенные и абиогенные): Учебное пособие / Под ред. проф. В.В. Егорова. – СПб.: Издательство «Лань», 2009. – 320 с. 7. Общая и неорганическая химия, Т.2 Химические свойства неорганических веществ / Под ред. А.Ф. Воробьева. - М.: ИКЦ «Академкнига», 2007. -544 с. Электронные информационные и образовательные ресурсы: http://znanium.com Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М ИНФРА-М, 2009. – 336 с. http://window.edu.ru Абакумова Н.А., Быкова Н.Н. Неорганическая химия. Учебное пособие. - Тамбов: Изд-во ТГТУ, 2009. - 124 с. http://znanium.com Татаринцева Т.Б. Технологии синтеза моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://znanium.com Горбылева А. И. Почвоведение: Учебное пособие. М.: НИЦ ИНФРА-М; Мн.: Нов. знание, 2014. – 400 с. http://lib.uspi.ru Кислинский К.В., Шишлова Т.М. Методические указания к выполнению лабораторных работ по оптическим методам анализа. — Уссурийск : УОП ПГСХА, 2010. — 37 c. http://www. college.ru/chemistry/index/php. Базы данных, информационносправочные и поисковые системы Ресурсы Интернета по химии. Вопросы для самопроверки 1. Распространенность и формы нахождения неметаллов в природе. 2. Способы получения неметаллов. 3. Физические и общие химические свойства неметаллов. 44 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 45 из 166 Тема 4. Оксиды в природе. Гидроксиды в природе (1 час), с использованием метода активного обучения – доклады с презентациями Цель: Изучить оксиды в природе. Задачи: 1. Рассмотреть общую и сравнительную характеристику гидроксидов: тип связи и тип решетки. 2. Рассмотреть две группы оксидов солеобразующие и несолеобразующие. 3. Рассмотреть свойство основных оксидов План: 1. Общая и сравнительная характеристика гидроксидов: а) Тип химической связи и тип решетки. б) Сравнительная характеристика гидроксидов. 2. Группы оксидов солеобразующие и несолеобразующие. 3. Основные оксиды, их свойства. Содержание лекции: 1. Общая и сравнительная характеристика гидроксидов: тип связи и тип решетки, длина и энергия связи, валентный угол, термическая устойчивость, возможность получения гидратацией оксидов, полярность связи, полярность молекул, Периодичность изменения кислотно-основных свойств гидроксидов и концепции её объяснения. Оксидами называют соединения, состоящие из двух элементов, одним из которых является кислород. Многие элементы проявляют переменную валентность и дают оксиды различного состава, что учитывается по международной номенклатуре указанием степени окисления элемента римскими цифрами, например: CrO – оксид хрома (II), Сг2О3 – оксид хрома (III), СгО3 — оксид хрома (VI). 45 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 46 из 166 2. Оксиды делят на две группы: солеобразующие и несолеобразующие. Солеобразующие оксиды принято делить на три группы: основные, амфотерные, кислотные. К основным относятся оксиды типичных металлов, им соответствуют гидроксиды, обладающие свойствами оснований. Получение основных оксидов. Окисление металлов, например: 2Cu + O2 = 2CuO Этот метод неприменим для щелочных металлов, которые при окислении дают пероксиды. Обжиг сульфидов, например: 2CuS + 3О2 = 2CuO + 2SО2 Разложение гидроксидов тяжелых металлов: Cu(OH)2 = CuO + Н2О Разложение солей кислородсодержащих кислот. Этот способ особенно легко осуществляется для нитратов и карбонатов: СаСО3 = СаО + СO2 2Рb(NО3)2 = 2РbО + 4NO2 + O2 Свойства основных оксидов. Основные оксиды при нагревании могут вступать в реакции с кислотными и амфотерными оксидами, с кислотами. Оксиды щелочных и щелочноземельных металлов непосредственно реагируют с водой: ВаО + SiO2 = ВаSiO3 ZnO + H2S04 = ZnS04 + Н2O СаО + H2O = Са(ОН)2 Основные оксиды могут вступать в окислительно-восстановительные реакции (ОВР), например: Fe2О3 + 2AI = Аl2О3 + 2Fe 46 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 47 из 166 Кислотные оксиды — оксиды неметаллов или переходных металлов в высоких степенях окисления, которые могут быть получены методами, аналогичными методам получения основных оксидов, например: 4Р + 5O2 = 2Р2O5 2ZnS + 3O2 = 2ZnO + 2SО2 Свойства кислотных оксидов. Большинство кислотных оксидов взаимодействует с водой с образованием кислот, например: SO3 + Н2O = Н2SO4 Наиболее типичными для кислотных оксидов являются их реакции с основными и амфотерными оксидами, со щелочами: P2O5 + Al2O3 = 2AlPO3 CO2 + Ca(OH)2 = CaCO3↓ + H2O Амфотерные оксиды способны к реакциям, в которые вступают как основные, так и кислотные оксиды, например: Аl2О3 + 6НС1 = 2А1С13 + ЗН2O Аl2О3 + 2NaOH + ЗН2O = 2Na[AI(OH)4] К числу амфотерных оксидов относятся оксид алюминия Аl2О3, оксид хрома (III) Сr2O3, оксид бериллия ВеО, оксид цинка ZnO, оксид железа (III) Fe2O3. Идеально амфотерным оксидом является вода Н2O, что ярко проявляется при гидролизе солей. Основаниями называются вещества (частицы), связывающие протоны (Бренстед). К основаниям относятся аммиак, амины (анилин), гидроксиды металлов. H3N: + H+ → H4N+ Частным случаем оснований являются гидроксиды. Химические соединения, содержащие атом металла, связанный с гидроксильными группами (ОН), называются гидроксидами металлов [Me(OH)n ]. С точки зрения теории электролитической диссоциации гидроксиды представляют 47 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 48 из 166 собой электролиты, образующие в водных растворах в качестве анионов только гидроксид-ионы (ОН-). Кислотность гидроксидов определяется числом гидроксильных групп, способных замещаться на кислотные остатки с образованием солей. По современной номенклатуре их принято называть гидроксидами элементов с указанием степени окисления: КОН — гидроксид калия, Sr(OH)2 –гидроксид стронция, Сг(ОН)2 – гидроксид хрома (II). Гидроксиды металлов делят на две группы: растворимые в воде – щёлочи (образованные щелочными и щелочноземельными металлами) и нерастворимые в воде. Получение оснований. Нерастворимые основания обычно получают реакцией обмена: CuSO4 + 2КОН = Сu(ОН)2 + К2SO4 Щелочи в технике получают электролизом водных растворов хлоридов: 2NaCI + 2Н2O = 2NaOH + Н2 + Сl2 В лаборатории щелочи получают взаимодействием соответствующих металлов или их оксидов с водой. Химические свойства гидроксидов металлов. Все нерастворимые в воде гидроксиды при нагревании разлагаются с образовавшем оксидов. Самой типичной реакцией гидроксидов является реакция нейтрализации с кислотами. В нее вступают как щелочи, так и нерастворимые основания: CsOH + НВг = CsBr + Н2O Zn(OH)2 + H2SO4 = ZnSO4 + 2Н2O Активная форма проведения занятия: информационная лекция, которая сопровождается проблемными вопросами и слайд-презентациями, позволяющими проиллюстрировать теоретический материал. Активные методы обучения: - демонстрация слайдов - использование метода создания проблемной ситуации 48 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 49 из 166 Проблемные вопросы для обсуждения: 1. Общую и сравнительную характеристику гидроксидов: тип связи и тип решетки. 2. Группы оксидов солеобразующие и несолеобразующие. 3. Рассмотреть свойства основных оксидов Литература Основная литература 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010.- 256 с. 2. Ардашников, Е.И. Сборник задач по неорганической химии / Е.И. Ардашников. – М.: Академия, 2008. – 208 с. 3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006.- 743 с. 4. Батраков, В.В. Практикум по общей и неорганической химии / В.В. Батраков. – М.: Колос С, 2007. – 464 с. 5. Вольхин, В.В. Общая химия / В.В. Вольхин. - СПб.: Лань, 2009. - 464 с. 6. Глинка, Н.Л. Задачи и упражнения по общей химии / Н.Л. Глинка. М.: Интеграл-пресс, 2009.- 240 с. 7. Глинка, Н.Л. Общая химия / Н.Л. Глинка.- М.: Юрайт, 2010. – 886 с. 8. Гринвуд, Н.Н. Химия элементов В 2-х томах / Н.Н. Гринвуд. – М.: Бином, 2008. – 1 том – 600 с., 2 том – 666 с. 9. Неорганическая химия / Под ред. Ю.Д.Третьякова. - М.: Академкнига, 2007. - 1209 с. 10.Павлов, Н.Н. Сборник задач и упражнений по общей и неорганической химии / Н.Н. Павлов, В.И. Фролов. – М.: Дрофа, 2005. – 240 с. Дополнительная литература 49 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 50 из 166 1. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами / Р.А. Лидин. - М.: Бином ,2010. – 230 с. 2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. - М.: Высшая школа, 2009. – 560 с. 3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: Учеб. Пособие для студентов / З.Е. Гольбрайх, Е.И. Маслов. – М.: Астрель, 2004.383 с. 4. Князев, Д.А. Неорганическая химия. 3-е изд. испр. / Д.А. Князев, С.Н. Смарыгин. – М.: Дрофа, 2004. – 592 с. 5. Коровин, В.Н. Общая химия / В.Н. Коровин. - М.: Высшая школа, 2009. - 377 с. 6. Неорганическая химия (элементы биогенные и абиогенные): Учебное пособие / Под ред. проф. В.В. Егорова. – СПб.: Издательство «Лань», 2009. – 320 с. 7. Общая и неорганическая химия, Т.2 Химические свойства неорганических веществ / Под ред. А.Ф. Воробьева. - М.: ИКЦ «Академкнига», 2007. -544 с. Электронные информационные и образовательные ресурсы: http://znanium.com Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М ИНФРА-М, 2009. – 336 с. http://window.edu.ru Абакумова Н.А., Быкова Н.Н. Неорганическая химия. Учебное пособие. - Тамбов: Изд-во ТГТУ, 2009. - 124 с. http://znanium.com Татаринцева Т.Б. Технологии синтеза моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://znanium.com Горбылева А. И. Почвоведение: Учебное пособие. М.: НИЦ ИНФРА-М; Мн.: Нов. знание, 2014 – 400 с. 50 Разработчик: Шишлова М.А. http://lib.uspi.ru ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Кислинский К.В., Шишлова Т.М. Лист 51 из 166 Методические указания к выполнению лабораторных работ по оптическим методам анализа. — Уссурийск : УОП ПГСХА, 2010. — 37 c. http://www. college.ru/chemistry/index/php. Базы данных, информационносправочные и поисковые системы Ресурсы Интернета по химии. Вопросы для самопроверки 1. Общая и сравнительная характеристика гидроксидов: тип связи и тип решетки. 2. Группы оксидов солеобразующие и несолеобразующие. 3. Основные оксиды, их свойства. Тема 5. Соли в природе (1 час), с использованием метода активного обучения – лекция - беседа Цели: Изучить соли в природе. Задачи: 1. Рассмотреть тип связи и тип решетки 2. Рассмотреть средние соли, гидро- и гидроксосоли. 3. Рассмотреть двойные, смешанные соли и кристаллогидраты. План: 1. Тип химической связи и тип решетки в солях. 2. Средние соли, гидро- и гидроксосоли. 3. Двойные, смешанные соли и кристаллогидраты. Содержание лекции: 1. Соли являются продуктом замещения водорода в кислоте на металл или гидроксогрупп в основании на кислотный остаток. Примеры формул и названия солей. 2. Нормальные (средние) соли получаются при полном замещении; кислые – при неполном замещении водорода кислоты на металл; основные – 51 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 52 из 166 при неполном замещении гидроксогрупп основания на кислотный остаток. Кислая соль может быть образована только кислотой, основность которой 2 и более, а основная – металлом, заряд которого 2 и более. Примеры: NaHS, KHCO3 – кислые соли (гидросульфид натрия и гидрокарбонат натрия); MgOHCl, CaOHCl – основные соли (хлориды гидроксо магния и кальция); NaCl, CuS – нормальные соли (хлорид натрия и сульфид меди). 3. Некоторые соли образуют с водой кристаллогидраты. Привести примеры и формулы кристаллогидратов. При растворении веществ с ионной структурой молекулы растворителя удерживаются около иона силами электростатического притяжения, т.е. за счет ион-дипольного взаимодействия. Например: кристаллогидрат сульфата натрия Na2SO410H2O (глауберова соль), Na2CO310H2O - кристаллическая сода. Гидраты, образующиеся в результате донорно-акцепторного взаимодействия (где ионы растворенного вещества выступают обычно в качестве акцепторов, а молекулы растворителя в качестве доноров электронных пар) представляют собой частный случай комплексных соединений. Аквакомплексы – лигaндами является вода, [Co(H2O)6]Cl2, [Al(H2O)6]Cl3, [Cr(H2O)6]Cl3 и др. Некоторые аквакомлексы в кристаллическом состоянии удерживают кристаллизационную воду [Cu(H2O)4]SO4H2O – медный купорос. Na2CO3 • 10H2O – (кристаллическая сода), потребляется мыловаренной, стекольной, текстильной, бумажной, нефтяной промышленностью. Na2SO4 • 10H2O – глауберова соль (мирабилит) или слабительное. Эта соль медленно всасывается из кишечника, что приводит к повышению осмотического давления и накоплению воды в кишечнике, содержимое его 52 Разработчик: Шишлова М.А. разжижается, и ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования каловые массы быстрее выводятся из Лист 53 из 166 организма. Na2B4O7 · 10H2O - (бура) применяется наружно, как антисептическое средство для полосканий, спринцеваний, смазываний. Антисептическое действие аналогично NaHCO3 и связано с гидролизом и с образованием противомикробного лекарственного средства борной кислоты. Na2B4O7 + 7H2O ↔ 4H3BO3 + 2NaOH NaNO3 – натриевая (чилийская) селитра, азотное удобрение с нитратной формой азота. Na3[AlF6] – криолит Наибольшее практическое значение среди соединений натрия имеют: NaOH – каустическая сода, NaHCO3 – питьевая сода, Na2CO3 кальцинированная сода, Na2CO310H2O – кристаллическая сода. NaCl – основной источник соляной кислоты для желудочного сока. Активная форма проведения занятия: информационная лекция, которая сопровождается проблемными вопросами и слайд-презентациями, позволяющими проиллюстрировать теоретический материал. Активные методы обучения: ведомая (управляемая) лекция - беседа Проблемные вопросы для обсуждения: 1. Объяснение свойств солей с позиций термодинамики растворения, концепции поляризации. 2. Способы получения солей. 3. Важнейшие природные соли. Их применение в качестве природного сырья. Литература Основная литература 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010.- 256 с. 53 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 54 из 166 2. Ардашников, Е.И. Сборник задач по неорганической химии / Е.И. Ардашников. – М.: Академия, 2008. – 208 с. 3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006.- 743 с. 4. Батраков, В.В. Практикум по общей и неорганической химии / В.В. Батраков. – М.: Колос С, 2007. – 464 с. Дополнительная литература 1. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами / Р.А. Лидин. - М.: Бином ,2010. – 230 с. 2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. - М.: Высшая школа, 2009. – 560 с. 3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: Учеб. Пособие для студентов / З.Е. Гольбрайх, Е.И. Маслов. – М.: Астрель, 2004.383 с. 4. Князев, Д.А. Неорганическая химия. 3-е изд. испр. / Д.А. Князев, С.Н. Смарыгин. – М.: Дрофа, 2004. – 592 с. 5. Коровин, В.Н. Общая химия / В.Н. Коровин. - М.: Высшая школа, 2009. - 377 с. 6. Неорганическая химия (элементы биогенные и абиогенные): Учебное пособие / Под ред. проф. В.В. Егорова. – СПб.: Издательство «Лань», 2009. – 320 с. 7. Общая и неорганическая химия, Т.2 Химические свойства неорганических веществ / Под ред. А.Ф. Воробьева. - М.: ИКЦ «Академкнига», 2007. -544 с. Электронные информационные и образовательные ресурсы: http://znanium.com Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М ИНФРА-М, 2009. – 336 с. 54 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 55 из 166 http://window.edu.ru Абакумова Н.А., Быкова Н.Н. Неорганическая химия. Учебное пособие. - Тамбов: Изд-во ТГТУ, 2009. - 124 с. http://znanium.com Татаринцева Т.Б. Технологии синтеза моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://znanium.com Горбылева А. И. Почвоведение: Учебное пособие. М.: НИЦ ИНФРА-М; Мн.: Нов. знание, 2014 – 400 с. http://lib.uspi.ru Кислинский К.В., Шишлова Т.М. Методические указания к выполнению лабораторных работ по оптическим методам анализа. — Уссурийск : УОП ПГСХА, 2010. — 37 c. http://www. college.ru/chemistry/index/php. Базы данных, информационносправочные и поисковые системы Ресурсы Интернета по химии. Вопросы для самопроверки 1. Тип связи и тип решетки. 2. Средние соли, гидро- и гидроксосоли. 3. Двойные, смешанные соли и кристаллогидраты. 55 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 56 из 166 МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное автономное образовательное учреждение высшего профессионального образования «Дальневосточный федеральный университет» (ДВФУ) Филиал ДВФУ в г. Уссурийске МАТЕРИАЛЫ ПРАКТИЧЕСКИХ ЗАНЯТИЙ по дисциплине «Неорганические вещества в природе» 050100.68 «Педагогическое образование» Магистерская программа – «Химическое образование» г. Уссурийск 2012 56 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 57 из 166 Занятие 1. Особенности химии элементов металлов (2часа), с использованием метода активного обучения – слайд-презентация. План: 1. Влияние (энтальпия энергии атомизации, кристаллической структуры температура плавления на и физические кипения, электропроводность) и химические (взаимодействие с водой, кислотами, щелочами, неметаллами) свойства металлов. 2. Сплавы металлов. Использование простейших диаграмм состояний для описания свойств сплавов металлов (температура плавления, растворимость). 3. Интерметаллиды. Основные принципы переработки руд и способы выделения элементов в металлическом состоянии. 4. Редкие и рассеянные элементы металлы. 5. Применение металлов в промышленности. Работа магистрантов строится по следующему алгоритму: 1. Получив карточку, прочитайте теоретический вопрос и найдите на него ответ. Магистрант подробно изучает теорию вопроса, при этом использует материал лекции, учебника, дополнительной литературы и т. д. 2. Расскажите партнеру теоретический материал своей карточки. После подготовки партнерами теории, один из них становится «учителем» и объясняет другому теоретический вопрос своей карточки. «Ученик» выслушав рассказ «учителя» задает ему вопросы по этому материалу. 3. Выслушайте теоретический материал карточки партнера. Ответив на вопросы «ученика», партнеры меняются ролями и выполняется совместная работа по изучению карточки партнера. 4. Оцените работу партнера. 57 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 58 из 166 5. Обменяйтесь карточками, найдите нового партнера и образуйте новую пару. Работа новой пары строится по этому же алгоритму. Активные методы обучения: - слайд-презентации, позволяющие эффективно и наглядно представить содержание информационной части занятия, выделить и проиллюстрировать сообщение, его ключевые содержательные пункты. -работа в парах сменного состава при рассмотрении вопроса «Свойства металлов». Проблемные вопросы для обсуждения: 1. Минимальная энергия ионизации атомов элементов металлов. 2. Классификация простых веществ металлов по их физическим и химическим свойствам. 3. Металлическая и ковалентная связь в металлах. 4. Основные структурные типы металлов: кубическая (примитивная, объемно и гранецентрированная), гексагональная структура. Литература Основная литература 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010.- 256 с. 2. Ардашников, Е.И. Сборник задач по неорганической химии / Е.И. Ардашников. – М.: Академия, 2008. – 208 с. 3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006.- 743 с. 4. Батраков, В.В. Практикум по общей и неорганической химии / В.В. Батраков. – М.: Колос С, 2007. – 464 с. Дополнительная литература 1. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами / Р.А. Лидин. - М.: Бином ,2010. – 230 с. 58 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 59 из 166 2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. - М.: Высшая школа, 2009. – 560 с. 3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: Учеб. Пособие для студентов / З.Е. Гольбрайх, Е.И. Маслов. – М.: Астрель, 2004.383 с. 4. Князев, Д.А. Неорганическая химия. 3-е изд. испр. / Д.А. Князев, С.Н. Смарыгин. – М.: Дрофа, 2004. – 592 с. 5. Коровин, В.Н. Общая химия / В.Н. Коровин. - М.: Высшая школа, 2009. - 377 с. 6. Неорганическая химия (элементы биогенные и абиогенные): Учебное пособие / Под ред. проф. В.В. Егорова. – СПб.: Издательство «Лань», 2009. – 320 с. 7. Общая и неорганическая химия, Т.2 Химические свойства неорганических веществ / Под ред. А.Ф. Воробьева. - М.: ИКЦ «Академкнига», 2007. -544 с. Электронные информационные и образовательные ресурсы: http://znanium.com Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М ИНФРА-М, 2009. – 336 с. http://window.edu.ru Абакумова Н.А., Быкова Н.Н. Неорганическая химия. Учебное пособие. - Тамбов: Изд-во ТГТУ, 2009. - 124 с. http://znanium.com Татаринцева Т.Б. Технологии синтеза моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://znanium.com Горбылева А. И. Почвоведение: Учебное пособие. М.: НИЦ ИНФРА-М; Мн.: Нов. знание, 2014 – 400 с. 59 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. http://lib.uspi.ru Кислинский К.В., Шишлова Т.М. Лист 60 из 166 Методические указания к выполнению лабораторных работ по оптическим методам анализа. — Уссурийск : УОП ПГСХА, 2010. — 37 c. http://www. college.ru/chemistry/index/php. Базы данных, информационносправочные и поисковые системы Ресурсы Интернета по химии. Занятие 2-3. Щелочные элементы (4 часа), с использованием метода активного обучения – рефераты с использованием презентации План занятия: 1.Получение ЩЭ в металлическом состоянии из природного сырья. Изменение химической активности ЩЭ в металлическом состоянии по ряду литий цезий (отношение к воде, кислороду, азоту). 2.Соединения ЩЭ с неметаллами получение, строение, свойства гидридов, галогенидов, сульфидов, нитридов. Изменение термической устойчивости и состава кислородных соединений в группе ЩЭ. Озониды, их применение. 3.Гидроксиды ЩЭ. Получение, строение, свойства, применение едкого натра, едкого кали. 4.Строение, свойства, получение, применение солей ЩЭ нитратов, сульфатов, галогенидов. Кристаллогидраты наиболее практически важных солей ЩЭ. Изменение степени гидратации катионов ЩЭ в водных растворах их солей по ряду литий цезий. Калийные удобрения. Малорастворимые соли лития, натрия и калия. 5.Изменение термической устойчивости карбонатов, нитратов, сульфатов в ряду литий цезий. Изменение в том же ряду температуры плавления и электропроводности галогенидов ЩЭ. Комплексообразующие свойства катионов ЩЭ. Особые свойства соединений лития. 60 Разработчик: Шишлова М.А. 6.Применение ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования ЩЭ в промышленности. Использование Лист 61 из 166 ЩЭ в металлическом состоянии в качестве теплоносителей в ядерной энергетике. Биологическая роль соединений ЩЭ (калий-натриевый "насос", препараты лития, калия и цезия в медицине). Активные методы обучения: занятие проводится в форме подготовки рефератов студентами с презентациями - реферат на тему: «Общая характеристика ЩЭ» - доклады магистрантов с электронными презентациями по применению солей. Проблемные вопросы для обсуждения: 1. Общая характеристика ЩЭ. 2. Нахождение элементов первой группы в природе. 3. Важнейшие минералы: сподумен (литий), каменная соль, альбит, криолит, глауберова соль (натрий), сильвинит, карналлит (калий), лепидолит, карналлит (рубидий), поллуцит (цезий). Франций радиоактивный ЩЭ. Требования к содержанию: - материал, использованный в реферате, должен относиться строго к выбранной теме; - необходимо изложить основные аспекты проблемы не только грамотно, но и в соответствии с той или иной логикой (хронологической, тематической, событийной и др.) - при изложении следует сгруппировать идеи разных авторов по общности точек зрения или по научным школам; - реферат должен заканчиваться подведением итогов проведенной исследовательской работы: содержать краткий анализ-обоснование преимуществ той точки зрения по рассматриваемому вопросу, с которой Вы солидарны. 61 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 62 из 166 Структура реферата. 1. Начинается реферат с титульного листа. Образец оформления титульного листа для реферата: 2. За титульным листом следует Оглавление. Оглавление - это план реферата, в котором каждому разделу должен соответствовать номер страницы, на которой он находится. 3. Текст реферата. Он делится на три части: введение, основная часть и заключение. 4. а) Введение - раздел реферата, посвященный постановке проблемы, которая будет рассматриваться и обоснованию выбора темы. б) Основная часть - это звено работы, в котором последовательно раскрывается выбранная тема. Основная часть может быть представлена как цельным текстом, так и разделена на главы. При необходимости текст реферата может дополняться иллюстрациями, таблицами, графиками, но ими не следует "перегружать" текст. в) Заключение - данный раздел реферата должен быть представлен в виде выводов, которые готовятся на основе подготовленного текста. Выводы должны быть краткими и четкими. Также в заключении можно обозначить проблемы, которые "высветились" в ходе работы над рефератом, но не были раскрыты в работе. 4. Список источников и литературы. В данном списке называются как те источники, на которые ссылается студент при подготовке реферата, так и все иные, изученные им в связи с его подготовкой. В работе должно быть использовано не менее 5 разных источников, из них хотя бы один – на иностранном языке (английском или французском). Работа, выполненная с использованием материала, содержащегося в одном научном источнике, является явным плагиатом и не принимается. Оформление Списка 62 Разработчик: Шишлова М.А. источников и ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования литературы должно соответствовать Лист 63 из 166 требованиям библиографических стандартов. Литература Основная литература 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010.- 256 с. 2. Ардашников, Е.И. Сборник задач по неорганической химии / Е.И. Ардашников. – М.: Академия, 2008. – 208 с. 3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006.- 743 с. 4. Батраков, В.В. Практикум по общей и неорганической химии / В.В. Батраков. – М.: Колос С, 2007. – 464 с. Дополнительная литература 1. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами / Р.А. Лидин. - М.: Бином ,2010. – 230 с. 2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. - М.: Высшая школа, 2009. – 560 с. 3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: Учеб. Пособие для студентов / З.Е. Гольбрайх, Е.И. Маслов. – М.: Астрель, 2004.383 с. 4. Князев, Д.А. Неорганическая химия. 3-е изд. испр. / Д.А. Князев, С.Н. Смарыгин. – М.: Дрофа, 2004. – 592 с. 5. Коровин, В.Н. Общая химия / В.Н. Коровин. - М.: Высшая школа, 2009. - 377 с. 6. Неорганическая химия (элементы биогенные и абиогенные): Учебное пособие / Под ред. проф. В.В. Егорова. – СПб.: Издательство «Лань», 2009. – 320 с. 63 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. 7. Общая и неорганическая химия, Т.2 Химические Лист 64 из 166 свойства неорганических веществ / Под ред. А.Ф. Воробьева. - М.: ИКЦ «Академкнига», 2007. -544 с. Электронные информационные и образовательные ресурсы: http://znanium.com Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М ИНФРА-М, 2009. – 336 с. http://window.edu.ru Абакумова Н.А., Быкова Н.Н. Неорганическая химия. Учебное пособие. - Тамбов: Изд-во ТГТУ, 2009. - 124 с. http://znanium.com Татаринцева Т.Б. Технологии синтеза моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://znanium.com Горбылева А. И. Почвоведение: Учебное пособие. М.: НИЦ ИНФРА-М; Мн.: Нов. знание, 2014 – 400 с. http://lib.uspi.ru Кислинский К.В., Шишлова Т.М. Методические указания к выполнению лабораторных работ по оптическим методам анализа. — Уссурийск : УОП ПГСХА, 2010. — 37 c. http://www. college.ru/chemistry/index/php. Базы данных, информационносправочные и поисковые системы Ресурсы Интернета по химии. Занятие 4-5. Бериллий, магний, щелочноземельные элементы (кальций, стронций, барий), радий (4 часа), с использованием метода активного обучения – дискуссия План: 1.Гидроксид бериллия, его амфотерность. Соли бериллия и бериллаты, их гидролиз. Основные и комплексные карбонаты бериллия, их свойства. Летучесть оксоацетата бериллия. Галогениды бериллия (фториды и хлориды), особенности их строения. 64 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 65 из 166 2.Магний. Минералы магния (доломит, магнезит, карналлит). Получение магния из минерального сырья. Физические и химические свойства металлического магния. Сплавы магния, их значение для современной техники. Оксид и гидроксид магния. Карбонаты магния. Гидролиз растворимых солей магния. Магнезиальный цемент. Получение безводных галогенидов магния. Применение магния в форме металла и в виде сложных соединений. Диагональное сходство свойств соединений магния и лития. 3.Щелочноземельные элементы (ЩЗЭ). Минералы кальция (известняк, мел, мрамор, гипс), стронция (целестин, стронцианит), бария (тяжелый шпат, витерит). Получение металлического кальция, стронция, бария, их физические и химические свойства. Оксиды и гидроксиды, гидриды ЩЗЭ. Гашеная и негашеная известь. Галогениды, нитриды. Растворимые (галогениды, нитраты, ацетаты) и нерастворимые (сульфаты, карбонаты, оксалаты) соли. Изменение сульфатов, нитратов в способность ионов ЩЗЭ. соединений кальция ряду термической кальций барий. Переработка (известь, устойчивости мрамор, и Комплексообразующая использование мел). карбонатов, Гипс, его природных свойства. Производство цемента, процессы "схватывания" и твердения цемента. 4.Геохимическая и биологическая роль ЩЗЭ. Токсичность соединений бария. Опасность радиоактивного заражения стронцием-90. 5.Радий. Закономерное изменение химических свойств простых и сложных соединений в ряду Be-Ra. Активные методы обучения: занятие проводится в форме подготовки рефератов студентами с презентациями - слайдовые презентации «Бериллий», «Магний» - дискуссия на тему полезности щелочных элементов Проблемные вопросы для обсуждения: 65 Разработчик: Шишлова М.А. 1. Бериллий. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 66 из 166 Влияние особенностей строения атома бериллия на свойства его соединений. 2. Распространенность бериллия, изотопный состав. 3. Переработка берилла (щелочной, фторидный и сернокислотный способы). 4. Токсичность бериллия и его соединений. 5. Получение и свойства металлического бериллия, применение в технике бериллия и его сплавов. Литература Основная литература 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010.- 256 с. 2. Ардашников, Е.И. Сборник задач по неорганической химии / Е.И. Ардашников. – М.: Академия, 2008. – 208 с. 3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006.- 743 с. 4. Батраков, В.В. Практикум по общей и неорганической химии / В.В. Батраков. – М.: Колос С, 2007. – 464 с. Дополнительная литература 1. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами / Р.А. Лидин. - М.: Бином ,2010. – 230 с. 2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. - М.: Высшая школа, 2009. – 560 с. 3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: Учеб. Пособие для студентов / З.Е. Гольбрайх, Е.И. Маслов. – М.: Астрель, 2004.383 с. 66 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 67 из 166 4. Князев, Д.А. Неорганическая химия. 3-е изд. испр. / Д.А. Князев, С.Н. Смарыгин. – М.: Дрофа, 2004. – 592 с. 5. Коровин, В.Н. Общая химия / В.Н. Коровин. - М.: Высшая школа, 2009. - 377 с. 6. Неорганическая химия (элементы биогенные и абиогенные): Учебное пособие / Под ред. проф. В.В. Егорова. – СПб.: Издательство «Лань», 2009. – 320 с. 7. Общая и неорганическая химия, Т.2 Химические свойства неорганических веществ / Под ред. А.Ф. Воробьева. - М.: ИКЦ «Академкнига», 2007. -544 с. Электронные информационные и образовательные ресурсы: http://znanium.com Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М ИНФРА-М, 2009. – 336 с. http://window.edu.ru Абакумова Н.А., Быкова Н.Н. Неорганическая химия. Учебное пособие. - Тамбов: Изд-во ТГТУ, 2009. - 124 с. http://znanium.com Татаринцева Т.Б. Технологии синтеза моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://znanium.com Горбылева А. И. Почвоведение: Учебное пособие. М.: НИЦ ИНФРА-М; Мн.: Нов. знание, 2014 – 400 с. http://lib.uspi.ru Кислинский К.В., Шишлова Т.М. Методические указания к выполнению лабораторных работ по оптическим методам анализа. — Уссурийск : УОП ПГСХА, 2010. — 37 c. http://www. college.ru/chemistry/index/php. Базы данных, информационносправочные и поисковые системы Ресурсы Интернета по химии. Занятие 6-7. Редкоземельные элементы (РЗЭ: скандий, иттрий, лантан, лантаниды), актиний и актиниды (4 часа) 67 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 68 из 166 План занятия: Различный подход к определению элементов подгрупп скандия или галлия как электронных аналогов бора и алюминия. Альтернативные варианты порядка рассмотрения химии бора и алюминия типических (по Менделееву) элементов в третьей или в тринадцатой группах Периодической системы. РЗЭ, актиний и актиниды как элементы начала 3d, 4d, 5d, 6d-рядов переходных элементов. Правомерность отнесения РЗЭ и актиния к fэлементам. Редкоземельные элементы. Общая характеристика РЗЭ. Открытие РЗЭ. Строение электронных оболочек атомов, характерные валентные состояния, устойчивые степени окисления. Цериевая и иттриевая подгруппы. "Гадолиниевый излом". Лантанидное сжатие. Распространенность РЗЭ, изотопный состав, нахождение в природе (монацит, лопарит, ксенотим, гадолинит). Синтез прометия. Получение, физические и химические свойства РЗЭ в металлическом состоянии, применение РЗЭ в металлургии в качестве "раскислителей", а также для легирования. Оксиды, гидроксиды, соли РЗЭ. Двойные соли. Комплексные соединения, изменение их устойчивости в ряду скандий иттрий лантан лютеций. Комплексные соединения с полидентатными лигандами как основа современных методов разделения и очистки РЗЭ ионообменной хроматографии и экстракции. Разделение смесей РЗЭ дробной кристаллизацией их солей и фракционным осаждением плохорастворимых соединений (гидроксидов, оксалатов, двойных сульфатов). Летучие соединения РЗЭ, перспективы их использования для разделения РЗЭ. Применение соединений РЗЭ (материалы лазерной оптики, магнитные материалы: гранаты, катализаторы, люминофоры, составная часть ВТСП материалов). 68 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 69 из 166 Актиний и актиниды. Общая характеристика актиния и актинидов. Проблематичность химической аналогии актинидов и лантанидов. Минералы тория (монацит), урана (урановая смоляная руда). Валентные состояния тория, урана. Металлические торий, уран. Принципы получения тория и урана из природного сырья. Оксиды и гидроксиды тория. Безводные и гидратированные соли тория. Кислородные соединения урана оксиды урана, уранаты. Соли уранила и четырехвалентного урана. Галогениды урана. Комплексные соединения урана (VI) и (IV). Получение U-233 из тория. Синтез трансурановых элементов. Принципы разделения смесей урана и плутония. Применение тория, урана и плутония. Литература Основная литература 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010.- 256 с. 2. Ардашников, Е.И. Сборник задач по неорганической химии / Е.И. Ардашников. – М.: Академия, 2008. – 208 с. 3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006.- 743 с. 4. Батраков, В.В. Практикум по общей и неорганической химии / В.В. Батраков. – М.: Колос С, 2007. – 464 с. Дополнительная литература 1. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами / Р.А. Лидин. - М.: Бином ,2010. – 230 с. 2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. - М.: Высшая школа, 2009. – 560 с. 69 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 70 из 166 3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: Учеб. Пособие для студентов / З.Е. Гольбрайх, Е.И. Маслов. – М.: Астрель, 2004.383 с. 4. Князев, Д.А. Неорганическая химия. 3-е изд. испр. / Д.А. Князев, С.Н. Смарыгин. – М.: Дрофа, 2004. – 592 с. 5. Коровин, В.Н. Общая химия / В.Н. Коровин. - М.: Высшая школа, 2009. - 377 с. 6. Неорганическая химия (элементы биогенные и абиогенные): Учебное пособие / Под ред. проф. В.В. Егорова. – СПб.: Издательство «Лань», 2009. – 320 с. 7. Общая и неорганическая химия, Т.2 Химические свойства неорганических веществ / Под ред. А.Ф. Воробьева. - М.: ИКЦ «Академкнига», 2007. -544 с. Электронные информационные и образовательные ресурсы: http://znanium.com Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М ИНФРА-М, 2009. – 336 с. http://window.edu.ru Абакумова Н.А., Быкова Н.Н. Неорганическая химия. Учебное пособие. - Тамбов: Изд-во ТГТУ, 2009. - 124 с. http://znanium.com Татаринцева Т.Б. Технологии синтеза моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://znanium.com Горбылева А. И. Почвоведение: Учебное пособие. М.: НИЦ ИНФРА-М; Мн.: Нов. знание, 2014 – 400 с. http://lib.uspi.ru Кислинский К.В., Шишлова Т.М. Методические указания к выполнению лабораторных работ по оптическим методам анализа. — Уссурийск : УОП ПГСХА, 2010. — 37 c. http://www. college.ru/chemistry/index/php. Базы справочные и поисковые системы Ресурсы Интернета по химии. 70 данных, информационно- ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 71 из 166 Занятие 8-9. Титан, цирконий, гафний (4 часа) План занятия: Общая характеристика элементов четвертой группы. Минералы титана (ильменит, рутил, перовскит), циркония гафния (циркон). Титан рассеянный элемент. Валентные состояния элементов четвертой группы. Металлические титан, цирконий, гафний. Физические и химические свойства, способы получения, очистка методом иодидного рафинирования. Применение металлических титана, циркония, гафния и сплавов на их основе. Соединения элементов четвертой группы со степенью окисления (IV): оксиды и гидроксиды. Материалы на основе оксидов (IV). Титановые белила. Твердые растворы на основе оксида циркония (IV). Изменение кислотноосновных свойств оксидов и гидроксидов в ряду титан гафний. Состояние четырехвалентных титана, циркония, гафния в водных растворах, влияние рН среды на равновесие гидролиза. Полимеризация соединений титана, циркония, гафния за счет гидроксо(оловых) и оксо(оксоловых) мостиков. Строение титанилиона и соответствующих производных циркония и гафния. Титанаты, цирконаты, гафнаты, полученные Пьезоэлектрики на гидратированные соли "сухим" основе способом титанатов четырехвалентных и в водных цирконатов. титана, растворах. Безводные циркония, и гафния. Галогениды титана и его аналогов, их получение, строение, свойства, применение. Другие бинарные соединения карбиды, нитриды, сульфиды и материалы на их основе. Пероксосоединения титана (IV). Комплексные соединения четырехвалентных титана, циркония, гафния. Использование фтороцирконатов и фторогафнатов для разделения смесей циркония и гафния. 71 Разработчик: Шишлова М.А. Сопоставление ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования окислительно-восстановительной Лист 72 из 166 устойчивости соединений со степенями окисления (IV), (III), (II) в ряду титан гафний. Получение и свойства солей титана (III), состояние ионов титана (III) в водных растворах, гидроксид титана (III). Оксид титана (II) как пример кислородных соединений элементов четвертой группы со степенью окисления (II). Нестехиометрия оксида титана (II). Применение соединений титана, циркония, гафния. Целесообразность совместного рассмотрения химии тория и титана, циркония, гафния. Литература Основная литература 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010.- 256 с. 2. Ардашников, Е.И. Сборник задач по неорганической химии / Е.И. Ардашников. – М.: Академия, 2008. – 208 с. 3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006.- 743 с. 4. Батраков, В.В. Практикум по общей и неорганической химии / В.В. Батраков. – М.: Колос С, 2007. – 464 с. Дополнительная литература 1. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами / Р.А. Лидин. - М.: Бином ,2010. – 230 с. 2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. - М.: Высшая школа, 2009. – 560 с. 3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: Учеб. Пособие для студентов / З.Е. Гольбрайх, Е.И. Маслов. – М.: Астрель, 2004.383 с. 72 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 73 из 166 4. Князев, Д.А. Неорганическая химия. 3-е изд. испр. / Д.А. Князев, С.Н. Смарыгин. – М.: Дрофа, 2004. – 592 с. 5. Коровин, В.Н. Общая химия / В.Н. Коровин. - М.: Высшая школа, 2009. - 377 с. 6. Неорганическая химия (элементы биогенные и абиогенные): Учебное пособие / Под ред. проф. В.В. Егорова. – СПб.: Издательство «Лань», 2009. – 320 с. 7. Общая и неорганическая химия, Т.2 Химические свойства неорганических веществ / Под ред. А.Ф. Воробьева. - М.: ИКЦ «Академкнига», 2007. -544 с. Электронные информационные и образовательные ресурсы: http://znanium.com Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М ИНФРА-М, 2009. – 336 с. http://window.edu.ru Абакумова Н.А., Быкова Н.Н. Неорганическая химия. Учебное пособие. - Тамбов: Изд-во ТГТУ, 2009. - 124 с. http://znanium.com Татаринцева Т.Б. Технологии синтеза моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://znanium.com Горбылева А. И. Почвоведение: Учебное пособие. М.: НИЦ ИНФРА-М; Мн.: Нов. знание, 2014 – 400 с. http://lib.uspi.ru Кислинский К.В., Шишлова Т.М. Методические указания к выполнению лабораторных работ по оптическим методам анализа. — Уссурийск : УОП ПГСХА, 2010. — 37 c. http://www. college.ru/chemistry/index/php. Базы данных, информационносправочные и поисковые системы Ресурсы Интернета по химии. Занятие 10-11. Ванадий, ниобий, тантал (4 часа) План занятия: 73 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 74 из 166 Нахождение в природе. Ванадий рассеянный элемент. Минералы ниобия и тантала (лопарит, колумбит, танталит). Валентные состояния элементов пятой группы. Металлические ванадий, ниобий, тантал, их физические и химические свойства, получение, применение. Ванадиевые стали. Соединения элементов пятой группы со степенью окисления (V). Оксиды ванадия, ниобия, тантала (V), получение, свойства. Ванадий (V), ниобий (V) и тантал (V) в водных растворах. Влияние рН среды на состояние ионов элементов пятой группы в водных растворах. Изополи и гетерополисоединения ванадия. Ванадаты, ниобаты, танталаты получение, свойства. Безводные галогениды. Пероксидные соединения ванадия (V). Комплексные соединения ванадия, ниобия, тантала. Использование фторониобатов и фторотанталатов для разделения смесей ниобия и тантала методом дробной кристаллизации. Принципы экстракционного и хроматографического разделения смесей ниобия и тантала. Изменение устойчивости соединений с высшими и низшими степенями окисления в ряду ванадий тантал. Получение соединений ванадия (IV), (III), (II) в водных растворах, состояние ионов; гидролиз соединений ванадия с различными степенями окисления. Сопоставление окислительно- восстановительных и кислотно-основных свойств соединений ванадия со степенями окисления (V), (IV), (III), (II). Литература Основная литература 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010.- 256 с. 2. Ардашников, Е.И. Сборник задач по неорганической химии / Е.И. Ардашников. – М.: Академия, 2008. – 208 с. 74 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 75 из 166 3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006.- 743 с. 4. Батраков, В.В. Практикум по общей и неорганической химии / В.В. Батраков. – М.: Колос С, 2007. – 464 с. Дополнительная литература 1. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами / Р.А. Лидин. - М.: Бином ,2010. – 230 с. 2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. - М.: Высшая школа, 2009. – 560 с. 3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: Учеб. Пособие для студентов / З.Е. Гольбрайх, Е.И. Маслов. – М.: Астрель, 2004.383 с. 4. Князев, Д.А. Неорганическая химия. 3-е изд. испр. / Д.А. Князев, С.Н. Смарыгин. – М.: Дрофа, 2004. – 592 с. 5. Коровин, В.Н. Общая химия / В.Н. Коровин. - М.: Высшая школа, 2009. - 377 с. 6. Неорганическая химия (элементы биогенные и абиогенные): Учебное пособие / Под ред. проф. В.В. Егорова. – СПб.: Издательство «Лань», 2009. – 320 с. 7. Общая и неорганическая химия, Т.2 Химические свойства неорганических веществ / Под ред. А.Ф. Воробьева. - М.: ИКЦ «Академкнига», 2007. -544 с. Электронные информационные и образовательные ресурсы: http://znanium.com Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М ИНФРА-М, 2009. – 336 с. http://window.edu.ru Абакумова Н.А., Быкова Н.Н. Неорганическая химия. Учебное пособие. - Тамбов: Изд-во ТГТУ, 2009. - 124 с. 75 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. http://znanium.com Татаринцева Т.Б. Технологии синтеза Лист 76 из 166 моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://znanium.com Горбылева А. И. Почвоведение: Учебное пособие. М.: НИЦ ИНФРА-М; Мн.: Нов. знание, 2014 – 400 с. http://lib.uspi.ru Кислинский К.В., Шишлова Т.М. Методические указания к выполнению лабораторных работ по оптическим методам анализа. — Уссурийск : УОП ПГСХА, 2010. — 37 c. http://www. college.ru/chemistry/index/php. Базы данных, информационносправочные и поисковые системы Ресурсы Интернета по химии. Занятие 12-13. Хром, молибден, вольфрам (4 часа) План занятия: Минералы хрома (хромистый железняк), молибдена (молибденит), вольфрама (шеелит, вольфрамит). Валентные состояния элементов шестой группы. Металлические хром, молибден, вольфрам. Физические и химические свойства, способы получения. Переработка хромистого железняка в дихромат и феррохром. Особенности получения металлических молибдена и вольфрама (порошковая металлургия). Кислородные соединения хрома, молибдена, вольфрама со степенью окисления (VI). Оксид хрома (VI), получение, свойства. Кислотно-основное равновесие в водных растворах хроматов. Ди, три и тетрахроматы. Оксиды молибдена и вольфрама (VI), получение, свойства. Молибденовая и вольфрамовая кислоты. Полимеризация молибденовой и вольфрамовой кислот в подкисленных растворах их солей. Изополимолибдаты, изополивольфраматы, их получение "сухим" путем и в водных растворах. Гетерополисоединения на основе молибденовой и 76 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 77 из 166 вольфрамовой кислот, получение, строение, свойства и применение (катализаторы в органическом синтезе, ингибиторы коррозии металлов, реагенты в аналитической химии). Соединения, содержащие хром, молибден, вольфрам в низших степенях окисления. Производные хрома (II) оксид, гидроксид. Получение солей хрома (II) хлорида, сульфата, ацетата. Восстановительные свойства соединений двухвалентного хрома. Соединения хрома (III) оксид, гидроксид. Соли трехвалентного хрома и хромиты. Гидратная изомерия солей хрома (III). Комплексные соединения и двойные соли хрома (III). Сопоставление кислотно-основных и окислительно-восстановительных свойств соединений хрома со степенями окисления (II), (III), (VI). Кислородные соединения молибдена и вольфрама в низших степенях окисления оксиды, молибденовые и вольфрамовые "сини", вольфрамовые бронзы. Серосодержащие соединения хрома, молибдена, вольфрама: сульфиды, оксосульфиды, тиосоли (тиомолибдаты и тиовольфраматы). Материалы на основе оксидов и халькогенидов хрома. Галогениды хрома, молибдена, вольфрама. Изменения состава высшего галогенида в ряду хром вольфрам. Оксогалогениды (хлористый хромил). Пероксидные соединения хрома надхромовая кислота, надхроматы. Целесообразность совместного рассмотрения химии урана и хрома, молибдена, вольфрама. Литература Основная литература 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010.- 256 с. 77 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 78 из 166 2. Ардашников, Е.И. Сборник задач по неорганической химии / Е.И. Ардашников. – М.: Академия, 2008. – 208 с. 3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006.- 743 с. 4. Батраков, В.В. Практикум по общей и неорганической химии / В.В. Батраков. – М.: Колос С, 2007. – 464 с. Дополнительная литература 1. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами / Р.А. Лидин. - М.: Бином ,2010. – 230 с. 2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. - М.: Высшая школа, 2009. – 560 с. 3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: Учеб. Пособие для студентов / З.Е. Гольбрайх, Е.И. Маслов. – М.: Астрель, 2004.383 с. 4. Князев, Д.А. Неорганическая химия. 3-е изд. испр. / Д.А. Князев, С.Н. Смарыгин. – М.: Дрофа, 2004. – 592 с. 5. Коровин, В.Н. Общая химия / В.Н. Коровин. - М.: Высшая школа, 2009. - 377 с. 6. Неорганическая химия (элементы биогенные и абиогенные): Учебное пособие / Под ред. проф. В.В. Егорова. – СПб.: Издательство «Лань», 2009. – 320 с. 7. Общая и неорганическая химия, Т.2 Химические свойства неорганических веществ / Под ред. А.Ф. Воробьева. - М.: ИКЦ «Академкнига», 2007. -544 с. Электронные информационные и образовательные ресурсы: http://znanium.com Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М ИНФРА-М, 2009. – 336 с. 78 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 79 из 166 http://window.edu.ru Абакумова Н.А., Быкова Н.Н. Неорганическая химия. Учебное пособие. - Тамбов: Изд-во ТГТУ, 2009. - 124 с. http://znanium.com Татаринцева Т.Б. Технологии синтеза моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://znanium.com Горбылева А. И. Почвоведение: Учебное пособие. М.: НИЦ ИНФРА-М; Мн.: Нов. знание, 2014 – 400 с. http://lib.uspi.ru Кислинский К.В., Шишлова Т.М. Методические указания к выполнению лабораторных работ по оптическим методам анализа. — Уссурийск : УОП ПГСХА, 2010. — 37 c. http://www. college.ru/chemistry/index/php. Базы данных, информационносправочные и поисковые системы Ресурсы Интернета по химии. Занятие 14-15. Марганец, технеций, рений (4 часа) План занятия: Минералы марганца (пиролюзит, гаусманит). Открытие рения. Синтез технеция ("экамарганца"). Валентные состояния марганца, технеция, рения. Получение металлических марганца, технеция, рения. Свойства и применение металлического марганца и его сплавов. Соединения, содержащие элементы седьмой группы в высших степенях окисления. Марганцовая и марганцовистая кислоты, перманганаты и манганаты получение, свойства, применение. Окислительно- восстановительные реакции соединений марганца (VII) и (VI). Влияние на окислительно-восстановительный процесс концентрации ионов водорода в водных растворах. Пертехнетаты и Соединения марганца (V). 79 перренаты, состав и свойства. Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 80 из 166 Соединения марганца (IV). Оксид марганца (IV), строение, свойства. Соли марганца (IV) и манганиты получение, свойства. Окислительновосстановительные реакции с участием марганца (IV). Соединения, содержащие элементы седьмой группы в низших степенях окисления. Марганец (II) и (III). Оксиды, гидроксиды, их получение, свойства. Комплексные соединения марганца (II) и (III). Сопоставление их устойчивости. Сопоставление кислотно-основных и окислительно-восстановительных свойств соединений марганца (и его аналогов) в различных степенях окисления. Литература Основная литература 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010.- 256 с. 2. Ардашников, Е.И. Сборник задач по неорганической химии / Е.И. Ардашников. – М.: Академия, 2008. – 208 с. 3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006.- 743 с. 4. Батраков, В.В. Практикум по общей и неорганической химии / В.В. Батраков. – М.: Колос С, 2007. – 464 с. Дополнительная литература 1. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами / Р.А. Лидин. - М.: Бином ,2010. – 230 с. 2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. - М.: Высшая школа, 2009. – 560 с. 80 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 81 из 166 3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: Учеб. Пособие для студентов / З.Е. Гольбрайх, Е.И. Маслов. – М.: Астрель, 2004.383 с. 4. Князев, Д.А. Неорганическая химия. 3-е изд. испр. / Д.А. Князев, С.Н. Смарыгин. – М.: Дрофа, 2004. – 592 с. 5. Коровин, В.Н. Общая химия / В.Н. Коровин. - М.: Высшая школа, 2009. - 377 с. 6. Неорганическая химия (элементы биогенные и абиогенные): Учебное пособие / Под ред. проф. В.В. Егорова. – СПб.: Издательство «Лань», 2009. – 320 с. 7. Общая и неорганическая химия, Т.2 Химические свойства неорганических веществ / Под ред. А.Ф. Воробьева. - М.: ИКЦ «Академкнига», 2007. -544 с. Электронные информационные и образовательные ресурсы: http://znanium.com Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М ИНФРА-М, 2009. – 336 с. http://window.edu.ru Абакумова Н.А., Быкова Н.Н. Неорганическая химия. Учебное пособие. - Тамбов: Изд-во ТГТУ, 2009. - 124 с. http://znanium.com Татаринцева Т.Б. Технологии синтеза моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://znanium.com Горбылева А. И. Почвоведение: Учебное пособие. М.: НИЦ ИНФРА-М; Мн.: Нов. знание, 2014 – 400 с. http://lib.uspi.ru Кислинский К.В., Шишлова Т.М. Методические указания к выполнению лабораторных работ по оптическим методам анализа. — Уссурийск : УОП ПГСХА, 2010. — 37 c. http://www. college.ru/chemistry/index/php. Базы данных, информационносправочные и поисковые системы Ресурсы Интернета по химии. 81 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 82 из 166 Занятие 16-17. Триада железа (железо, кобальт, никель) (4 часа) План занятия: Общая характеристика железа, кобальта, никеля. Минералы железа (магнетит, гематит, сидерит, пирит), кобальта (кобальтин), никеля (пентландит). Получение железа восстановлением железных руд водородом или природным газом. Доменный процесс получения чугуна. "Передел" чугуна на сталь и ковкое железо. Физические и химические свойства металлического железа. Специальные и нержавеющие стали. Совместное присутствие кобальта и никеля в рудах. Получение кобальта и никеля из сульфидных руд. Свойства и применение металлических кобальта, никеля. Валентные состояния элементов триады железа. Изменение устойчивости соединений с низшими (II) и высшими (VI, III) степенями окисления в ряду железо никель. Соединения железа в различных степенях окисления. Проблема получения железа (VIII). Ферраты как производные железа (VI). Получение и свойства ферратов. Соединения железа (III). Оксиды, содержащие ионы Fe3+: оксид железа (III), смешанные оксиды. и Fe2O3. Соли железа (III), их гидролиз. Гидроксид железа (III). Получение и свойства ферритов, их применение. Соединения железа (II). Оксид, получение и свойства. Нестехиометрия низшего оксида железа. Гидроксид железа (II). Соли железа (II). Соль Мора. Карбонаты железа (II) (средний, кислый, основный). Сопоставление кислотно-основных и окислительно-восстановительных свойств соединений железа со степенями окисления (II), (III), (VI). Комплексные соединения железа (II) и (III) с неорганическими и органическими лигандами. Влияние комплексообразования на окислительновосстановительные процессы в растворах, содержащих железо 82 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 83 из 166 (II) и железо (III). Комплексные соединения железа с оксидом углерода (II) (карбонилы) и циклопентадиеном (ферроцен). Роль железа в биологических процессах (гемоглобин, питание растений). Соединения кобальта (II) и (III). Оксиды , гидроксиды. Средние и основные соли кобальта (II). Фторид кобальта (III). Сравнение устойчивости комплексных соединений кобальта (II) и (III). Условия стабилизации кобальта (III) в комплексных соединениях, оксидах, фторидах. Карбонилы кобальта. Применение соединений кобальта. Соединения никеля (II). Оксид, гидроксид. Соли никеля (II). Комплексные соединения никеля (II), их строение, проявление эффекта Яна Теллера. Карбонил никеля. Соединения никеля (III). Применение соединений никеля. Принципы разделения смесей кобальта и никеля методами фракционного окисления, осаждения, сублимации. Литература Основная литература 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010.- 256 с. 2. Ардашников, Е.И. Сборник задач по неорганической химии / Е.И. Ардашников. – М.: Академия, 2008. – 208 с. 3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006.- 743 с. 4. Батраков, В.В. Практикум по общей и неорганической химии / В.В. Батраков. – М.: Колос С, 2007. – 464 с. Дополнительная литература 1. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами / Р.А. Лидин. - М.: Бином ,2010. – 230 с. 83 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 84 из 166 2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. - М.: Высшая школа, 2009. – 560 с. 3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: Учеб. Пособие для студентов / З.Е. Гольбрайх, Е.И. Маслов. – М.: Астрель, 2004.383 с. 4. Князев, Д.А. Неорганическая химия. 3-е изд. испр. / Д.А. Князев, С.Н. Смарыгин. – М.: Дрофа, 2004. – 592 с. 5. Коровин, В.Н. Общая химия / В.Н. Коровин. - М.: Высшая школа, 2009. - 377 с. 6. Неорганическая химия (элементы биогенные и абиогенные): Учебное пособие / Под ред. проф. В.В. Егорова. – СПб.: Издательство «Лань», 2009. – 320 с. 7. Общая и неорганическая химия, Т.2 Химические свойства неорганических веществ / Под ред. А.Ф. Воробьева. - М.: ИКЦ «Академкнига», 2007. -544 с. Электронные информационные и образовательные ресурсы: http://znanium.com Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М ИНФРА-М, 2009. – 336 с. http://window.edu.ru Абакумова Н.А., Быкова Н.Н. Неорганическая химия. Учебное пособие. - Тамбов: Изд-во ТГТУ, 2009. - 124 с. http://znanium.com Татаринцева Т.Б. Технологии синтеза моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://znanium.com Горбылева А. И. Почвоведение: Учебное пособие. М.: НИЦ ИНФРА-М; Мн.: Нов. знание, 2014 – 400 с. 84 Разработчик: Шишлова М.А. http://lib.uspi.ru ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Кислинский К.В., Шишлова Т.М. Лист 85 из 166 Методические указания к выполнению лабораторных работ по оптическим методам анализа. — Уссурийск : УОП ПГСХА, 2010. — 37 c. http://www. college.ru/chemistry/index/php. Базы данных, информационносправочные и поисковые системы Ресурсы Интернета по химии. Занятие 18-19. Платиновые элементы (триады рутения и осмия) (4 часа). План занятия: Роль отечественных ученых в изучении химии платиновых элементов (К.К. Клаус, Л.А. Чугаев, И.И. Черняев). Общая характеристика платиновых элементов. Самородная платина. Извлечение элементов группы платиновых металлов из руд. Физические и химические свойства металлов, их применение. Закономерности в изменении устойчивости характерных степеней окисления в соединениях платиновых элементов. Соединения рутения и осмия в степени окисления (VIII). Соли родия (III) и иридия (III). Соединения палладия (II), платины (II) и (IV). Гексахлороплатиновая кислота и ее соли. Фториды платины. Значение комплексных соединений в химии платиновых элементов. Строение и свойства комплексов платины (IV) и (II). Инертность комплексов платины, явление изомерии, эффект трансвлияния Черняева. Применение соединений платиновых элементов в химической технологии и медицине. Литература Основная литература 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010.- 256 с. 85 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 86 из 166 2. Ардашников, Е.И. Сборник задач по неорганической химии / Е.И. Ардашников. – М.: Академия, 2008. – 208 с. 3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006.- 743 с. 4. Батраков, В.В. Практикум по общей и неорганической химии / В.В. Батраков. – М.: Колос С, 2007. – 464 с. Дополнительная литература 1. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами / Р.А. Лидин. - М.: Бином ,2010. – 230 с. 2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. - М.: Высшая школа, 2009. – 560 с. 3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: Учеб. Пособие для студентов / З.Е. Гольбрайх, Е.И. Маслов. – М.: Астрель, 2004.383 с. 4. Князев, Д.А. Неорганическая химия. 3-е изд. испр. / Д.А. Князев, С.Н. Смарыгин. – М.: Дрофа, 2004. – 592 с. 5. Коровин, В.Н. Общая химия / В.Н. Коровин. - М.: Высшая школа, 2009. - 377 с. 6. Неорганическая химия (элементы биогенные и абиогенные): Учебное пособие / Под ред. проф. В.В. Егорова. – СПб.: Издательство «Лань», 2009. – 320 с. 7. Общая и неорганическая химия, Т.2 Химические свойства неорганических веществ / Под ред. А.Ф. Воробьева. - М.: ИКЦ «Академкнига», 2007. -544 с. Электронные информационные и образовательные ресурсы: http://znanium.com Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М ИНФРА-М, 2009. – 336 с. 86 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 87 из 166 http://window.edu.ru Абакумова Н.А., Быкова Н.Н. Неорганическая химия. Учебное пособие. - Тамбов: Изд-во ТГТУ, 2009. - 124 с. http://znanium.com Татаринцева Т.Б. Технологии синтеза моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://znanium.com Горбылева А. И. Почвоведение: Учебное пособие. М.: НИЦ ИНФРА-М; Мн.: Нов. знание, 2014 – 400 с. http://lib.uspi.ru Кислинский К.В., Шишлова Т.М. Методические указания к выполнению лабораторных работ по оптическим методам анализа. — Уссурийск : УОП ПГСХА, 2010. — 37 c. http://www. college.ru/chemistry/index/php. Базы данных, информационносправочные и поисковые системы Ресурсы Интернета по химии. Занятие 20-21. Медь, серебро, золото (4 часа) План занятия: Причины нахождения в природе золота, серебра и меди в самородном состоянии. Медные руды (куприт, халькопирит, малахит), принципы переработки сульфидных медных руд и рафинирования меди. Переработка природных соединений серебра. Извлечение серебра из отходов переработки полиметаллических руд. Принципы металлургии золота. Аффинаж золота. Физические и химические свойства металлических меди, серебра, золота. Понятие о пробе. Применение меди, серебра и золота, а также их сплавов. Соединения меди (II) и (I). Оксиды, гидроксиды. Диспропорционирование меди (1). Соли меди (II) и (I) получение, свойства, гидролиз. Важнейшие комплексные соединения меди (II) и (I), их состав и строение. Соединения меди (III) купраты; периодаты и теллураты меди (III). Применение соединений меди. Медь (II, III) составная часть материалов со 87 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 88 из 166 свойствами ВТСП. Медь (II) важнейший биометалл. Токсичность соединений меди. Соединения серебра (I) оксид, гидроксид, растворимые и нерастворимые соли. Галогенидные, аммиачные и тиосульфатные комплексные соединения серебра (I), получение, строение, устойчивость, свойства. Принципы процессов фотографирования и серебрения. Условия стабилизации серебра в степени окисления (II). Серебро (III) и (V). Диспропорционирование серебра в четных степенях окисления. Оксиды золота (I) и (III), их гидраты. Аураты. Соли и комплексные соединения золота, их состав, строение, свойства. Тетрахлорозолотая кислота. Причина нестабильности золота (II). Диметилзолото пример металлоорганических соединений этого элемента. Изменение характерных степеней окисления в ряду медь золото. Литература Основная литература 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010.- 256 с. 2. Ардашников, Е.И. Сборник задач по неорганической химии / Е.И. Ардашников. – М.: Академия, 2008. – 208 с. 3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006.- 743 с. 4. Батраков, В.В. Практикум по общей и неорганической химии / В.В. Батраков. – М.: Колос С, 2007. – 464 с. Дополнительная литература 1. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами / Р.А. Лидин. - М.: Бином ,2010. – 230 с. 88 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 89 из 166 2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. - М.: Высшая школа, 2009. – 560 с. 3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: Учеб. Пособие для студентов / З.Е. Гольбрайх, Е.И. Маслов. – М.: Астрель, 2004.383 с. 4. Князев, Д.А. Неорганическая химия. 3-е изд. испр. / Д.А. Князев, С.Н. Смарыгин. – М.: Дрофа, 2004. – 592 с. 5. Коровин, В.Н. Общая химия / В.Н. Коровин. - М.: Высшая школа, 2009. - 377 с. 6. Неорганическая химия (элементы биогенные и абиогенные): Учебное пособие / Под ред. проф. В.В. Егорова. – СПб.: Издательство «Лань», 2009. – 320 с. 7. Общая и неорганическая химия, Т.2 Химические свойства неорганических веществ / Под ред. А.Ф. Воробьева. - М.: ИКЦ «Академкнига», 2007. -544 с. Электронные информационные и образовательные ресурсы: http://znanium.com Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М ИНФРА-М, 2009. – 336 с. http://window.edu.ru Абакумова Н.А., Быкова Н.Н. Неорганическая химия. Учебное пособие. - Тамбов: Изд-во ТГТУ, 2009. - 124 с. http://znanium.com Татаринцева Т.Б. Технологии синтеза моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://znanium.com Горбылева А. И. Почвоведение: Учебное пособие. М.: НИЦ ИНФРА-М; Мн.: Нов. знание, 2014 – 400 с. 89 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. http://lib.uspi.ru Кислинский К.В., Шишлова Т.М. Лист 90 из 166 Методические указания к выполнению лабораторных работ по оптическим методам анализа. — Уссурийск : УОП ПГСХА, 2010. — 37 c. http://www. college.ru/chemistry/index/php. Базы данных, информационносправочные и поисковые системы Ресурсы Интернета по химии. Занятие 22-23. Цинк, кадмий, ртуть (4 часа) План занятия: Минералы цинка (цинковая обманка), сульфидные полиметаллические руды кадмия (гринокит), ртути (киноварь) в природе. Физические и химические свойства цинка, кадмия, ртути. Получение и применение металлических цинка, кадмия, ртути и их сплавов. Амальгамы. Изменение типа связи в соединениях двухвалентных цинка, кадмия, ртути. Причины аномального (немонотонного) характера изменения кислотноосновных свойств оксидов, гидроксидов и солей (гидролиз) в ряду цинк (II) ртуть (II). Амфотерность цинка (II). Комплексные соединения цинка (II), кадмия (II), ртути (II) получение, состав, устойчивость. Амидные соединения ртути. Соединения ртути (I) оксид, гидроксид, получение, строение, свойства. Диспропорционирование ртути (I). Соли ртути (I). Каломель. Применение соединений цинка, кадмия, ртути. Цинксодержащие ферменты (на примере карбоангидразы, карбоксипептидазы), их биологическая роль. Токсичность соединений кадмия и ртути. Способы устранения заражения помещений металлической ртутью. Литература Основная литература 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010.- 256 с. 90 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 91 из 166 2. Ардашников, Е.И. Сборник задач по неорганической химии / Е.И. Ардашников. – М.: Академия, 2008. – 208 с. 3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006.- 743 с. 4. Батраков, В.В. Практикум по общей и неорганической химии / В.В. Батраков. – М.: Колос С, 2007. – 464 с. Дополнительная литература 1. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами / Р.А. Лидин. - М.: Бином ,2010. – 230 с. 2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. - М.: Высшая школа, 2009. – 560 с. 3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: Учеб. Пособие для студентов / З.Е. Гольбрайх, Е.И. Маслов. – М.: Астрель, 2004.383 с. 4. Князев, Д.А. Неорганическая химия. 3-е изд. испр. / Д.А. Князев, С.Н. Смарыгин. – М.: Дрофа, 2004. – 592 с. 5. Коровин, В.Н. Общая химия / В.Н. Коровин. - М.: Высшая школа, 2009. - 377 с. 6. Неорганическая химия (элементы биогенные и абиогенные): Учебное пособие / Под ред. проф. В.В. Егорова. – СПб.: Издательство «Лань», 2009. – 320 с. 7. Общая и неорганическая химия, Т.2 Химические свойства неорганических веществ / Под ред. А.Ф. Воробьева. - М.: ИКЦ «Академкнига», 2007. -544 с. Электронные информационные и образовательные ресурсы: http://znanium.com Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М ИНФРА-М, 2009. – 336 с. 91 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 92 из 166 http://window.edu.ru Абакумова Н.А., Быкова Н.Н. Неорганическая химия. Учебное пособие. - Тамбов: Изд-во ТГТУ, 2009. - 124 с. http://znanium.com Татаринцева Т.Б. Технологии синтеза моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://znanium.com Горбылева А. И. Почвоведение: Учебное пособие. М.: НИЦ ИНФРА-М; Мн.: Нов. знание, 2014 – 400 с. Кислинский http://lib.uspi.ru К.В., Шишлова Т.М. Методические указания к выполнению лабораторных работ по оптическим методам анализа. — Уссурийск : УОП ПГСХА, 2010. — 37 c. http://www. college.ru/chemistry/index/php. Базы данных, информационносправочные и поисковые системы Ресурсы Интернета по химии. Занятие 24-25. Бор, алюминий и элементы подгруппы галлия галлий, индий, таллий (4 часа) План занятия: Бор и алюминий как типические элементы подгрупп галлия и скандия. Выбор альтернативного варианта. Преимущества и недостатки рассмотрения химии бора и алюминия как предшественников элементов подгрупп скандия и галлия. Бор. Общая характеристика бора. Причина преобладания у бора неметаллических свойств. Минералы бора (тинкал, гидроборацит, колеманит). Изотоп 10В. Использование бора в ядерной энергетике. Модификации бора простого вещества. Получение бора, его физические и химические свойства. Соединения бора с металлами и неметаллами. Карбид бора В4С - конкурент алмаза. Нитрид бора, гексагональный и кубический (боразон). Галогениды бора. Неорганические полимеры на 92 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 93 из 166 основе соединений бора. Тетрафтороборная кислота, ее соли. Боразол аналог бензола. Получение, строение, свойства диборана (трехцентровая двухэлектронная связь). Гомологические ряды гидридов бора: В nHn+4 и BnHn+6. Гидридобораты и бориды металлов. Кислородные соединения бора. Оксид бора (III). Борные кислоты, их соли. Получение, строение буры, ее гидролиз. Переработка буры в борную кислоту. Сложные эфиры борной кислоты. Применение соединений бора. Алюминий. Общая характеристика алюминия. Минералы алюминия (боксит, нефелин, каолин). Переработка боксита в оксид алюминия. Роль алюмосиликатов в неживой природе (цеолиты, глины). Оксид алюминия (III): и Al2O3. Искусственные рубины. Гидроксид алюминия, "старение" за счет процессов оляции и оксоляции. Строение и свойства алюминатов, полученных методом твердофазного синтеза и в водных растворах. Полиалюминат натрия, Al2O3 суперионный проводник. Гидролиз солей алюминия и алюминатов. Комплексные соединения и двойные соли алюминия. Получение и строение безводных галогенидов алюминия. Диагональное сходство свойств соединений бериллия и алюминия. Гидрид алюминия и гидридоалюминаты щелочных элементов. Применение соединений алюминия. Элементы подгруппы характеристика элементов галлия галлий, подгруппы индий, галлия. таллий. Специфика Общая свойств соединений галлия, индия, таллия как постпереходных элементов-металлов. Галлий, индий, таллий рассеянные элементы. Извлечение галлия, индия, таллия из отходов производства алюминия и цветных металлов. Физические и химические свойства металлических галлия, индия, таллия, их получение и применение, нахождение в природе. 93 Разработчик: Шишлова М.А. Валентные ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования состояния элементов подгруппы галлия. Лист 94 из 166 Изменение устойчивости соединений, содержащих галлий, индий, таллий в степени окисления (III) и (I). Способы получения одно и трехвалентных галлия, индия, таллия. Особенности окислительно-восстановительных свойств соединений таллия. Сходство соединений таллия (I) и соединений рубидия (I), с одной стороны, и серебра (I) с другой. Амфотерность оксидов и гидроксидов трехвалентных галлия, индия, таллия. Соли и комплексные соединения галлия, индия, таллия. Применение соединений галлия, индия, таллия в полупроводниковой технике. Арсенид галлия как основа нового поколения полупроводников. Токсичность таллия. Литература Основная литература 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010.- 256 с. 2. Ардашников, Е.И. Сборник задач по неорганической химии / Е.И. Ардашников. – М.: Академия, 2008. – 208 с. 3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006.- 743 с. 4. Батраков, В.В. Практикум по общей и неорганической химии / В.В. Батраков. – М.: Колос С, 2007. – 464 с. Дополнительная литература 1. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами / Р.А. Лидин. - М.: Бином ,2010. – 230 с. 2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. - М.: Высшая школа, 2009. – 560 с. 94 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 95 из 166 3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: Учеб. Пособие для студентов / З.Е. Гольбрайх, Е.И. Маслов. – М.: Астрель, 2004.383 с. 4. Князев, Д.А. Неорганическая химия. 3-е изд. испр. / Д.А. Князев, С.Н. Смарыгин. – М.: Дрофа, 2004. – 592 с. 5. Коровин, В.Н. Общая химия / В.Н. Коровин. - М.: Высшая школа, 2009. - 377 с. 6. Неорганическая химия (элементы биогенные и абиогенные): Учебное пособие / Под ред. проф. В.В. Егорова. – СПб.: Издательство «Лань», 2009. – 320 с. 7. Общая и неорганическая химия, Т.2 Химические свойства неорганических веществ / Под ред. А.Ф. Воробьева. - М.: ИКЦ «Академкнига», 2007. -544 с. Электронные информационные и образовательные ресурсы: http://znanium.com Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М ИНФРА-М, 2009. – 336 с. http://window.edu.ru Абакумова Н.А., Быкова Н.Н. Неорганическая химия. Учебное пособие. - Тамбов: Изд-во ТГТУ, 2009. - 124 с. http://znanium.com Татаринцева Т.Б. Технологии синтеза моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://znanium.com Горбылева А. И. Почвоведение: Учебное пособие. М.: НИЦ ИНФРА-М; Мн.: Нов. знание, 2014 – 400 с. http://lib.uspi.ru Кислинский К.В., Шишлова Т.М. Методические указания к выполнению лабораторных работ по оптическим методам анализа. — Уссурийск : УОП ПГСХА, 2010. — 37 c. http://www. college.ru/chemistry/index/php. Базы данных, информационносправочные и поисковые системы Ресурсы Интернета по химии. 95 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 96 из 166 Занятие 26-27. Углерод, кремний, элементы подгруппы германия германий, олово, свинец (4 часа) План занятия: Закономерный переход в группе от неметаллических (углерод, кремний) к металлическим свойствам (германий, олово, свинец). Углерод. Общая характеристика углерода. Особенности электронного строения атома углерода, обусловливающие уникальную способность этого элемента образовывать связи С-С различной кратности и связи с атомами других элементов-неметаллов. неорганических соединений Многообразие углерода, органических валентные формы и углерода. Распространенность и изотопный состав. Использование изотопа 14 С для определения возраста археологических объектов. Формы нахождения углерода в природе. Кристаллическая структура алмаза и графита. Искусственные алмазы и графит. Карбин. Фуллерены. Применение алмазов, графита, сажи. Химические свойства углерода. Соединения углерода с металлами и неметаллами. Важнейшие карбиды, их классификация по типу химической связи. Карбиды серы (сероуглерод), азота (дициан), кремния (карборунд), железа, вольфрама, гафния, тория и др. Применение карбидов в технике и химической промышленности в качестве тугоплавких, жаростойких, высокотвердых материалов, составляющих конструкционных материалов, сталей и сплавов, применение в синтезе (карбид кальция и др.) Синильная кислота, простые и комплексные цианиды. Цианамиды щелочных и щелочноземельных элементов. Роданистоводородная кислота и ее соли. Галогениды углерода четыреххлористый углерод, хлороформ, фторпроизводные углерода и их практическое применение (фреоны, фторопласты). 96 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 97 из 166 Углеводороды с одинарной, двойной и тройной связью. Изменение прочности связи углерод углерод в ряду углеводородов с одинарной, двойной и тройной связью. Катенация (образование гомоядерных цепей), ее ослабление в ряду С Si Ge. Примеры металлоорганических соединений веществ, содержащих связь металл углерод (метиллитий, тетраэтилсвинец, диметилртуть). Кислородные соединения углерода. Оксид углерода (II) (угарный газ). Строение молекулы (методы МО и ВС). Получение и свойства оксида углерода (II). Координационные соединения оксида углерода (II) карбонилы переходных элементов. Фосген как хлорангидрид угольной кислоты. Применение оксида углерода (II) в химической промышленности и в качестве топлива. Оксид углерода (IV) (углекислый газ), получение, строение молекулы, физические и химические свойства. Применение углекислого газа. Угольная кислота, ее строение и свойства. Карбонаты, гидрокарбонаты, их термическая устойчивость. Получение и применение карбамида (мочевины). Кремний. Общая характеристика кремния. Роль соединений кремния в построении земной коры. Основные кремнийсодержащие минералы: кварц, силикаты, алюмосиликаты (полевой шпат, слюда, асбест, каолин). Кристаллическая структура кремния. Получение, нахождение в природе кремния. Физические и химические свойства кремния простого вещества. Кремний полупроводник. Соединения кремния с металлами и неметаллами. Силициды, их классификация по типу химической связи, применение. Соединения кремния с галогенами. Гексафторокремниевая кислота, ее соли. Карбид кремния и материалы на его основе. Соединения кремния с водородом. Строение силанов. Получение, свойства, применение. Различия в термической устойчивости углеводородов и силанов. 97 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 98 из 166 Кислородные соединения кремния. Оксид кремния (IV) полиморфные модификации. Природные разновидности оксида кремния (IV). Кремниевые кислоты. Силикагель, получение, применение. Золь и гель кремниевой кислоты. Силикаты, их гидролиз. Современные представления о строении силикатов. Основные типы структур силикатов: островные, цепные, слоистые, трехмерные. Искусственные силикаты: стекла, ситаллы, цементы, принципы промышленного получения стекла и цемента. Оксид кремния (II), получение и свойства. Важнейшие кремнийорганические соединения: силоксан, силиконы, их применение в технике. Сравнение свойств кислородных соединений и галогенидов углерода и кремния. Элементы подгруппы германия германий, олово, свинец. Общая характеристика элементов подгруппы германия. Распространенность германия, олова, свинца в природе. Аномальный изотопный состав свинца. Германий - рассеянный элемент. Минералы олова (касситерит), свинца (свинцовый блеск). Получение германия, его физические и химические свойства. Германий как важнейший материал с полупроводниковыми свойствами. Получение металлического олова из касситерита, рафинирование олова; физические и химические свойства олова. Применение олова и его сплавов. Получение металлического свинца, его рафинирование. Физические и химические свойства, применение свинца и его сплавов. Изменение окислительно-восстановительной устойчивости соединений, содержащих элементы в степени окисления (IV) и (II), по ряду германий свинец. 98 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 99 из 166 Важнейшие соединения германия (IV): оксид германия, германаты, тетрахлорид германия, гидриды и металлоорганические соединения германия (IV). Соединения германия (II). Важнейшие соединения олова (IV) и (II): их получение, состав, строение, свойства. Оксид олова (IV), оловянные кислоты, станнаты. Оксид и гидроксид олова (II), станниты. Хлориды олова (IV) и (II). Сульфиды олова (IV) и (II), тиостаннаты. Окислительно-восстановительные свойства соединений олова (IV) и (II). Применение соединений олова. Сенсорные материалы. Важнейшие соединения свинца (II) и (IV): оксиды свинца (II) и (IV), сурик, плюмбиты, плюмбаты. Растворимые и нерастворимые соли свинца (II) и (IV). Свинцовые белила. Галогениды и сульфиды свинца. Комплексные соединения свинца (II) и (IV). Сравнение окислительно-восстановительных, кислотно-основных и комплексообразующих свойств свинца (II) и (IV). Применение соединений свинца. Токсичность свинца и его соединений. Литература Основная литература 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010.- 256 с. 2. Ардашников, Е.И. Сборник задач по неорганической химии / Е.И. Ардашников. – М.: Академия, 2008. – 208 с. 3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006.- 743 с. 4. Батраков, В.В. Практикум по общей и неорганической химии / В.В. Батраков. – М.: Колос С, 2007. – 464 с. Дополнительная литература 1. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами / Р.А. Лидин. - М.: Бином ,2010. – 230 с. 99 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 100 из 166 2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. - М.: Высшая школа, 2009. – 560 с. 3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: Учеб. Пособие для студентов / З.Е. Гольбрайх, Е.И. Маслов. – М.: Астрель, 2004.383 с. 4. Князев, Д.А. Неорганическая химия. 3-е изд. испр. / Д.А. Князев, С.Н. Смарыгин. – М.: Дрофа, 2004. – 592 с. 5. Коровин, В.Н. Общая химия / В.Н. Коровин. - М.: Высшая школа, 2009. - 377 с. 6. Неорганическая химия (элементы биогенные и абиогенные): Учебное пособие / Под ред. проф. В.В. Егорова. – СПб.: Издательство «Лань», 2009. – 320 с. 7. Общая и неорганическая химия, Т.2 Химические свойства неорганических веществ / Под ред. А.Ф. Воробьева. - М.: ИКЦ «Академкнига», 2007. -544 с. Электронные информационные и образовательные ресурсы: http://znanium.com Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М ИНФРА-М, 2009. – 336 с. http://window.edu.ru Абакумова Н.А., Быкова Н.Н. Неорганическая химия. Учебное пособие. - Тамбов: Изд-во ТГТУ, 2009. - 124 с. http://znanium.com Татаринцева Т.Б. Технологии синтеза моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://znanium.com Горбылева А. И. Почвоведение: Учебное пособие. М.: НИЦ ИНФРА-М; Мн.: Нов. знание, 2014 – 400 с. 100 Разработчик: Шишлова М.А. http://lib.uspi.ru ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Кислинский К.В., Шишлова Т.М. Лист 101 из 166 Методические указания к выполнению лабораторных работ по оптическим методам анализа. — Уссурийск : УОП ПГСХА, 2010. — 37 c. http://www. college.ru/chemistry/index/php. Базы данных, информационносправочные и поисковые системы Ресурсы Интернета по химии. 4 семестр Занятие 28-29. Азот, фосфор, элементы подгруппы мышьяка мышьяк, сурьма, висмут (4 часа) План занятия: Закономерное усиление металлических свойств от азота и фосфора к элементам подгруппы мышьяка. Азот. Общая характеристика азота. Распространенность и нахождение азота в природе (воздух, органические азотсодержащие соединения, селитры, нитриты). Строение молекулы азота (методы МО и ВС). Уникальные физические и химические свойства молекулярного азота. Энергия тройной, двойной и одинарной связи азот-азот. Сопоставление энергетических характеристик связей азот-азот, углерод-азот, углерод-углерод. Получение азота в лаборатории и промышленности. Применение молекулярного азота. Аммиак. Строение, физические и химические свойства, нахождение в природе. Получение аммиака в лаборатории. Сжижение аммиака. Физикохимические условия промышленного синтеза аммиака. Катализаторы синтеза аммиака. Равновесие взаимодействия аммиака с водой. Гидраты аммиака. Проблема существования гидроксида аммония. Соли аммония, их получение и свойства. Строение иона аммония. Термическая устойчивость солей аммония производных важнейших минеральных кислот. Гидролиз солей аммония. Применение аммиака и солей аммония. Аммиакаты как пример комплексных азотсодержащих соединений. 101 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 102 из 166 Нитриды с ионной, ковалентной связью, металлоподобные нитриды. Гидразин и гидроксиламин, состав и свойства. Сравнение основных и окислительно-восстановительных свойств аммиака, гидразина и гидроксиламина. Азотистоводородная кислота и ее соли (азиды). Галогениды азота, их свойства. Кислородные соединения азота. Природа связи азот-кислород. Состав, строение и закономерности в изменении свойств оксидов азота: N2O, NO, N2O3, NO2, N2O4, N2O5 (дипольный момент, межмолекулярное взаимодействие, взаимодействие с водой, термическая устойчивость, кислотные свойства). Получение оксидов азота. Схема МО для NO, сопоставление свойств NO и NO+. Радикальные реакции NO (взаимодействие с О2, Cl2), NO2 (реакции нитрования органических веществ). Анионные (NO2, NO3) и катионные (NO+, NO2+) формы оксидов азота (III), (V). Диспропорционирование оксидов азота (III), (IV) в кислой и щелочной средах, полярных и неполярных растворителях. Синтез безводных нитратов элементов металлов. Термическое разложение нитратов натрия, серебра, свинца. Получение, сопоставление строения и свойств азотистой HNO2 и азотной HNO3 кислот: восстановительные устойчивость, свойства водных кислотные растворов. и окислительно- Зависимость состава продуктов взаимодействия азотной кислоты с металлами от концентрации кислоты и природы металла. Нитриты и нитраты, получение, свойства, их роль в технике. Гипоазотистая кислота (HNO)2. Фосфор. Общая характеристика фосфора. Распространенность фосфора и формы его нахождения в природе (фосфаты элементов-металлов фосфориты, апатиты, монацит; фосфорсодержащие органические соединения нуклеиновые кислоты и др.). Валентные состояния фосфора. 102 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 103 из 166 Аллотропные модификации фосфора. Условия стабильности белого и красного фосфора. Строение белого и красного фосфора, физические и химические свойства. Свечение фосфора. Взаимодействие фосфора с металлами и неметаллами. Получение и применение красного и белого фосфора в промышленности. Водородные соединения фосфора. Способы получения фосфина. Соли фосфония, их термическая и гидролитическая устойчивость. Фосфиды металлов, получение, свойства. Типы химической связи в фосфидах металлов и неметаллов. Инсектофунгициды и полупроводниковые материалы на основе фосфидов. Галогениды фосфора, оксогалогениды. Особенности строения PCl5 и PCl3, PBr5 и PBr3. Неорганические полимеры на основе галогенидов фосфора (фосфонитрилхлорид). Кислородные соединения фосфора оксиды, кислородсодержащие кислоты. Оксид фосфора (III), получение, строение молекулы, свойства. Фосфористая кислота, получение, строение, свойства. Фосфиты. Фосфорноватистая кислота, получение, строение, свойства. Гипофосфиты. Фосфорноватая кислота, ее соли. Оксид фосфора (V), получение, строение молекулы, свойства. Получение и взаимные переходы орто, ди(пиро) и метафосфорной кислот. Строение и свойства фосфорных кислот и их солей. Аналитические методы их идентификации. Гидролиз фосфатов. Полиметафосфаты. Сравнение кислотных, окислительно-восстановительных свойств и термической устойчивости кислородсодержащих кислот фосфора (I), (III), (V). Фосфорные удобрения и моющие средства на основе фосфатов. Роль производных фосфорной кислоты в биологических процессах. Протонные проводники на основе кислых фосфатов. Элементы подгруппы мышьяка: мышьяк, сурьма, висмут. Общая характеристика элементов подгруппы мышьяка. Особенности химических 103 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 104 из 166 свойств мышьяка, сурьмы, висмута как постпереходных элементов. Склонность элементов подгруппы мышьяка к образованию химической связи с серой. Минералы мышьяка (реальгар, аурипигмент), сурьмы (сурьмяный блеск), висмута (висмутовый блеск). Получение мышьяка, сурьмы, висмута из природного сырья. Физические и химические свойства, применение мышьяка, сурьмы, висмута. Сплавы сурьмы и висмута, сплав Вуда. Важнейшие соединения мышьяка (V) и (III): оксиды (V) и (III), мышьяковая и мышьяковистая кислоты, арсенаты и арсениты. Сульфиды и тиосоли мышьяка (V) и (III). Проявление амфотерных свойств соединениями мышьяка. Сравнение окислительно-восстановительных и кислотно-основных свойств однотипных соединений мышьяка (V) и (III). Кислородные соединения сурьмы: оксиды (V) и (III), сурьмяная и сурьмянистая кислоты, антимонаты и антимониты. Сопоставление окислительно-восстановительных и кислотно-основных свойств соединений сурьмы (V) и (III). Состояние сурьмы (V) и (III) в водных растворах. Галогениды сурьмы (V) и (III), их гидролиз. Сульфиды и тиосоли сурьмы (V) и (III). Важнейшие соединения висмута (III) оксид и гидроксид, соли и оксосоли, сульфид висмута (III). Состояние висмута (III) в водных растворах. Соединения висмута (V) висмутаты, их получение и свойства сильнейших окислителей. Водородные соединения мышьяка, сурьмы и висмута, получение, строение, свойства. Арсениды, антимониды, висмутиды. Получение, свойства. Применение соединений элементов подгруппы мышьяка промышленности. Токсичность соединений мышьяка, сурьмы, висмута. Литература Основная литература 104 в ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 105 из 166 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010.- 256 с. 2. Ардашников, Е.И. Сборник задач по неорганической химии / Е.И. Ардашников. – М.: Академия, 2008. – 208 с. 3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006.- 743 с. 4. Батраков, В.В. Практикум по общей и неорганической химии / В.В. Батраков. – М.: Колос С, 2007. – 464 с. Дополнительная литература 1. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами / Р.А. Лидин. - М.: Бином ,2010. – 230 с. 2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. - М.: Высшая школа, 2009. – 560 с. 3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: Учеб. Пособие для студентов / З.Е. Гольбрайх, Е.И. Маслов. – М.: Астрель, 2004.383 с. 4. Князев, Д.А. Неорганическая химия. 3-е изд. испр. / Д.А. Князев, С.Н. Смарыгин. – М.: Дрофа, 2004. – 592 с. 5. Коровин, В.Н. Общая химия / В.Н. Коровин. - М.: Высшая школа, 2009. - 377 с. 6. Неорганическая химия (элементы биогенные и абиогенные): Учебное пособие / Под ред. проф. В.В. Егорова. – СПб.: Издательство «Лань», 2009. – 320 с. 7. Общая и неорганическая химия, Т.2 Химические свойства неорганических веществ / Под ред. А.Ф. Воробьева. - М.: ИКЦ «Академкнига», 2007. -544 с. Электронные информационные и образовательные ресурсы: 105 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 106 из 166 http://znanium.com Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М ИНФРА-М, 2009. – 336 с. http://window.edu.ru Абакумова Н.А., Быкова Н.Н. Неорганическая химия. Учебное пособие. - Тамбов: Изд-во ТГТУ, 2009. - 124 с. http://znanium.com Татаринцева Т.Б. Технологии синтеза моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://znanium.com Горбылева А. И. Почвоведение: Учебное пособие. М.: НИЦ ИНФРА-М; Мн.: Нов. знание, 2014 – 400 с. http://lib.uspi.ru Кислинский К.В., Шишлова Т.М. Методические указания к выполнению лабораторных работ по оптическим методам анализа. — Уссурийск : УОП ПГСХА, 2010. — 37 c. http://www. college.ru/chemistry/index/php. Базы данных, информационносправочные и поисковые системы Ресурсы Интернета по химии. Занятие 30-31. Кислород и элементы подгруппы серы (4 часа) План занятия: Кислород. Общая характеристика кислорода. Роль кислорода как самого распространенного элемента в биологических и минеральных процессах на Земле. Строение молекулы кислорода с позиций методов ВС и МО. Важнейшие кислородные соединения оксиды элементов-металлов и элементов-неметаллов, гидроксиды металлов, кислородсодержащие кислоты и их соли. Типы химической связи в оксидах, гидроксидах, кислородсодержащих кислотах различных элементов. Оксиды элементовметаллов с переменной степенью окисления. Нестехиометрические оксиды. Химические и физические свойства оксидов. Оксидные бронзы. 106 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 107 из 166 Пероксиды и надпероксиды, их получение, свойства и применение. Строение ионов О2 и О22 с точки зрения метода МО. Озон, его свойства, строение, получение. Применение для озонирования воды и воздуха, в качестве окислителя в синтезе. Озониды, их получение, свойства и применение. Элементы подгруппы серы: сера, селен, теллур, полоний. Общая характеристика элементов подгруппы серы. Распространенность, формы нахождения в природе элементов подгруппы серы (самородная сера, сульфаты, халькогениды металлов, органические соединения, содержащие серу). Биологическая роль селена. Полоний радиоактивный элемент металл. Изменение характерных валентных состояний в ряду кислород теллур. Аллотропные и полиморфные модификации серы, диаграмма состояний серы. Соединения серы с металлами и неметаллами. Применение серы. Водородные соединения серы, селена, теллура, химические и физические свойства, получение и применение. Многосернистый водород, получение и свойства (полисульфаны). Токсичность водородных соединений серы, селена, теллура. Халькогениды металлов (сульфиды, селениды, теллуриды), получение и свойства. Гидросульфиды и полисульфиды металлов. Сульфиды металлов как важнейшее минеральное сырье. Использование халькогенидов металлов в качестве полупроводников. Кислородные соединения серы, селена, теллура со степенью окисления (IV). Способы получения, строение и свойства оксидов (IV) элементов подгруппы серы. Сернистая кислота, строение, получение, свойства. Сульфиты и гидросульфиты, термическая устойчивость, окислительно- восстановительные свойства, гидролиз в водных растворах. Таутомерия 107 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 108 из 166 гидросульфитиона. Сравнение свойств сернистой, селенистой и теллуристой кислот и их солей. Тиосернистая, тиосерная, гидросернистая, политионовые кислоты состав, свойства. Получение, строение и свойства тиосульфата натрия. Кислородные соединения серы, селена, теллура со степенью окисления (VI). Изменение термической устойчивости и термодинамических характеристик оксидов (VI) элементов в ряду сера теллур. Оксид серы (VI) (серный ангидрид), его строение, физические и химические свойства. Физикохимические параметры процесса получения серного ангидрида окислением сернистого газа кислородом. Серная кислота важнейшая из минеральных кислот, ее применение. Строение и свойства серной кислоты. Основные принципы промышленных методов получения серной кислоты контактного и нитрозного. Нитрозилсерная кислота. Олеум. Сульфаты и гидросульфаты. Влияние природы катиона элемента-металла на термическую устойчивость сульфатов. Сравнение свойств серной, селеновой и теллуровой кислот и их солей. Особенности состава и строения теллуровой кислоты. Проявление вторичной периодичности в свойствах кислородных соединений элементов подгруппы серы. Сравнение кислотных, окислительно-восстановительных свойств и термической устойчивости серной и сернистой кислот. Замещение в H2SO4: концевого атома кислорода на серу (тиосульфаты), пероксогруппу (моно и динадсерная кислоты), гидроксильной группы на мостиковый кислород (пиросульфат и полисульфаты), на галоген (SO2Cl2, HSO3F). Литература Основная литература 108 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 109 из 166 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010.- 256 с. 2. Ардашников, Е.И. Сборник задач по неорганической химии / Е.И. Ардашников. – М.: Академия, 2008. – 208 с. 3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006.- 743 с. 4. Батраков, В.В. Практикум по общей и неорганической химии / В.В. Батраков. – М.: Колос С, 2007. – 464 с. Дополнительная литература 1. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами / Р.А. Лидин. - М.: Бином ,2010. – 230 с. 2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. - М.: Высшая школа, 2009. – 560 с. 3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: Учеб. Пособие для студентов / З.Е. Гольбрайх, Е.И. Маслов. – М.: Астрель, 2004.383 с. 4. Князев, Д.А. Неорганическая химия. 3-е изд. испр. / Д.А. Князев, С.Н. Смарыгин. – М.: Дрофа, 2004. – 592 с. 5. Коровин, В.Н. Общая химия / В.Н. Коровин. - М.: Высшая школа, 2009. - 377 с. 6. Неорганическая химия (элементы биогенные и абиогенные): Учебное пособие / Под ред. проф. В.В. Егорова. – СПб.: Издательство «Лань», 2009. – 320 с. 7. Общая и неорганическая химия, Т.2 Химические свойства неорганических веществ / Под ред. А.Ф. Воробьева. - М.: ИКЦ «Академкнига», 2007. -544 с. Электронные информационные и образовательные ресурсы: 109 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 110 из 166 http://znanium.com Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М ИНФРА-М, 2009. – 336 с. http://window.edu.ru Абакумова Н.А., Быкова Н.Н. Неорганическая химия. Учебное пособие. - Тамбов: Изд-во ТГТУ, 2009. - 124 с. http://znanium.com Татаринцева Т.Б. Технологии синтеза моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://znanium.com Горбылева А. И. Почвоведение: Учебное пособие. М.: НИЦ ИНФРА-М; Мн.: Нов. знание, 2014 – 400 с. http://lib.uspi.ru Кислинский К.В., Шишлова Т.М. Методические указания к выполнению лабораторных работ по оптическим методам анализа. — Уссурийск : УОП ПГСХА, 2010. — 37 c. http://www. college.ru/chemistry/index/php. Базы данных, информационносправочные и поисковые системы Ресурсы Интернета по химии. Занятие 32-33. Галогены фтор, хлор, бром, йод, астат (4 часа) План занятия: Общая характеристика галогенов. Нахождение в природе. Основные формы химической связи. Преобладание неметаллических свойств. Важнейшие минералы фтора (фторапатит, флюорит, криолит) и хлора (каменная соль, сильвинит). Добыча поваренной соли из морской воды. Получение соединений брома из буровых вод, солей йода из морских водорослей. Астат - радиоактивный член группы галогенов. Строение двухатомных молекул галогенов. Изменение энергии связи галоген-галоген и химической активности в ряду двухатомных молекул галогенов. Влияние изменения межмолекулярного взаимодействия по ряду фтор - йод на агрегатное состояние галогенов. 110 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Химические свойства галогенов в молекулярном Лист 111 из 166 состоянии, взаимодействие с металлами и неметаллами. Солеобразные галогениды, галогенангидриды. Межгалогенные соединения. Аналогия в химических свойствах галогенов и межгалогенных соединений. Полигалогениды. Порядок вытеснения галогенов из растворов их галогенидов, иллюстрация этих процессов величинами окислительно-восстановительных потенциалов. Получение галогенов в лаборатории и промышленности. Химические и электрохимические методы. Токсичность галогенов. Правила техники безопасности при промышленности работе и с технике: галогенами. в Применение металлургии галогенов (электролиз в безводных галогенидов, йодидное рафинирование), в неорганическом и органическом синтезе. Галогеноводороды, их физические и химические свойства. Нахождение в природе. Способы получения галогеноводородов. Цепная реакция синтеза хлороводорода. Получение галогеноводородов из солеобразных галогенидов и из галогенангидридов. Растворы галогеноводородов в воде, изменение силы галогеноводородных кислот в ряду HF - HJ. Соляная кислота как одна из важнейших минеральных кислот, ее свойства, получение в промышленности и применение. Плавиковая кислота, особенности ее строения, применение. Гидрофториды. Травление стекла плавиковой кислотой и газообразным фтороводородом. Кислородные соединения галогенов оксиды и кислородсодержащие кислоты. Изменение их устойчивости в ряду фтор - йод. Вторичная периодичность в изменении устойчивости кислородных соединений галогенов с точки зрения теории поляризации и с учетом образования кратных связей галоген - кислород. 111 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 112 из 166 Взаимодействие галогенов с водой: сольватация и клатратообразование, гетеролитическое разложение. Изменение состава продуктов этого взаимодействия в ряду фтор - йод. Термодинамические и кинетические характеристики процессов взаимодействия галогенов с водой. Влияние концентрации водородных ионов на равновесие реакции галогенов с водой. Процесс "беления" сухим и влажным хлором. Хлорноватистая кислота, ее соли гипохлориты. Жавелевая вода. Хлорная известь. Хлористая, хлорноватая, хлорная кислоты и их соли: хлориты, хлораты, перхлораты. Способы получения. Строение и свойства, применение важнейших кислородсодержащих кислот хлора и их солей. Сопоставление термической устойчивости, силы кислот и окислительно-восстановительных свойств в ряду кислородсодержащих кислот хлора. Оксиды хлора Cl2O, ClO2, ClO3, Cl2O7, их термическая неустойчивость. Оксиды брома и йода. Кислородсодержащие кислоты брома, йода и их соли, состав, свойства. Неустойчивость кислородных кислот и оксидов брома. Получение бромной кислоты с помощью фторидов ксенона и путем облучения нейтронами селенатов щелочных металлов. Амфотерность йодноватистой кислоты. Йодные кислоты, их гидратные формы. Получение йодных кислот и их солей. Порядок взаимного вытеснения галогенов из кислородсодержащих соединений, иллюстрация наблюдаемой закономерности величинами окислительно-восстановительных потенциалов. Водород. Нахождение в природе. Свойства водорода, характерные как для элементов неметаллов (легкий аналог галогенов), так и для элементов металлов (легкий рассмотрения аналог свойств щелочных водорода на Периодической системы. 112 элементов). завершающем Целесообразность этапе изучения ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 113 из 166 Особенности строения атома водорода. Изотопы водорода протий, дейтерий и тритий. Значение изотопов водорода для ядерной техники. Распространенность водорода, формы его нахождения в природе. Валентные состояния водорода. Размеры атома и ионов. Молекулярный водород, физические и химические свойства. Атомарный водород. Проблема металлоподобного водорода. Лабораторные и промышленные способы получения водорода. Хранение водорода. Техника безопасности при работе с водородом. Применение водорода. Гидриды соединения водорода с металлами и неметаллами. Гидриды с ковалентным, ионным и промежуточными типами связей. Водородная связь, ее влияние на строение и свойства водородсодержащих соединений. Гидриды с трехцентровой связью. Растворимость водорода в металлах. Физические и химические свойства гидридов. Получение и применение гидридов. Вода как важнейшее соединение водорода. Роль воды в биосфере и геосфере. Строение молекулы воды. Ассоциация молекул воды за счет водородных связей. Цепная реакция синтеза воды. Разложение воды под действием радиации (радиолиз) с образованием радикалов гидроксила, пероксида водорода, молекулярного кислорода, гидратированного электрона. Физические и химические свойства обычной и тяжелой воды. Термическая диссоциация воды. Проблемы очистки воды. Получение химически чистой воды. Пероксид водорода. Строение, термическая устойчивость и кислотная диссоциация. Окислительно-восстановительные свойства пероксида водорода. Способы получения и применение пероксида водорода в технике, технологии, медицине. Литература Основная литература 113 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 114 из 166 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010.- 256 с. 2. Ардашников, Е.И. Сборник задач по неорганической химии / Е.И. Ардашников. – М.: Академия, 2008. – 208 с. 3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006.- 743 с. 4. Батраков, В.В. Практикум по общей и неорганической химии / В.В. Батраков. – М.: Колос С, 2007. – 464 с. Дополнительная литература 1. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами / Р.А. Лидин. - М.: Бином ,2010. – 230 с. 2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. - М.: Высшая школа, 2009. – 560 с. 3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: Учеб. Пособие для студентов / З.Е. Гольбрайх, Е.И. Маслов. – М.: Астрель, 2004.383 с. 4. Князев, Д.А. Неорганическая химия. 3-е изд. испр. / Д.А. Князев, С.Н. Смарыгин. – М.: Дрофа, 2004. – 592 с. 5. Коровин, В.Н. Общая химия / В.Н. Коровин. - М.: Высшая школа, 2009. - 377 с. 6. Неорганическая химия (элементы биогенные и абиогенные): Учебное пособие / Под ред. проф. В.В. Егорова. – СПб.: Издательство «Лань», 2009. – 320 с. 7. Общая и неорганическая химия, Т.2 Химические свойства неорганических веществ / Под ред. А.Ф. Воробьева. - М.: ИКЦ «Академкнига», 2007. -544 с. Электронные информационные и образовательные ресурсы: 114 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 115 из 166 http://znanium.com Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М ИНФРА-М, 2009. – 336 с. http://window.edu.ru Абакумова Н.А., Быкова Н.Н. Неорганическая химия. Учебное пособие. - Тамбов: Изд-во ТГТУ, 2009. - 124 с. http://znanium.com Татаринцева Т.Б. Технологии синтеза моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://znanium.com Горбылева А. И. Почвоведение: Учебное пособие. М.: НИЦ ИНФРА-М; Мн.: Нов. знание, 2014 – 400 с. http://lib.uspi.ru Кислинский К.В., Шишлова Т.М. Методические указания к выполнению лабораторных работ по оптическим методам анализа. — Уссурийск : УОП ПГСХА, 2010. — 37 c. http://www. college.ru/chemistry/index/php. Базы данных, информационносправочные и поисковые системы Ресурсы Интернета по химии. Занятие 34-35. Инертные (благородные) газы (4 часа) План занятия: Особенности электронного строения атомов инертных газов. Неустойчивость двухатомных молекул инертных газов (на примере гелия, метод МО). Физические свойства инертных газов. Нахождение инертных газов в природе, способы разделения их смесей. Дифторид, тетрафторид, гексафторид ксенона. Триоксид ксенона. Перксенатион. Трехцентровая четырехэлектронная связь в соединениях инертных газов. Окислительные свойства фторидных и кислородных соединений ксенона. Положение фторидов ксенона в ряду известных фторокислителей. Фторидные соединения радона и криптона. Применение инертных газов и их соединений как фторокислителей и в радиохимии для улавливания летучих соединений осколочных элементов. 115 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 116 из 166 Литература Основная литература 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010.- 256 с. 2. Ардашников, Е.И. Сборник задач по неорганической химии / Е.И. Ардашников. – М.: Академия, 2008. – 208 с. 3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006.- 743 с. 4. Батраков, В.В. Практикум по общей и неорганической химии / В.В. Батраков. – М.: Колос С, 2007. – 464 с. Дополнительная литература 1. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами / Р.А. Лидин. - М.: Бином ,2010. – 230 с. 2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. - М.: Высшая школа, 2009. – 560 с. 3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: Учеб. Пособие для студентов / З.Е. Гольбрайх, Е.И. Маслов. – М.: Астрель, 2004.383 с. 4. Князев, Д.А. Неорганическая химия. 3-е изд. испр. / Д.А. Князев, С.Н. Смарыгин. – М.: Дрофа, 2004. – 592 с. 5. Коровин, В.Н. Общая химия / В.Н. Коровин. - М.: Высшая школа, 2009. - 377 с. 6. Неорганическая химия (элементы биогенные и абиогенные): Учебное пособие / Под ред. проф. В.В. Егорова. – СПб.: Издательство «Лань», 2009. – 320 с. 116 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. 7. Общая и неорганическая химия, Т.2 Химические Лист 117 из 166 свойства неорганических веществ / Под ред. А.Ф. Воробьева. - М.: ИКЦ «Академкнига», 2007. -544 с. Электронные информационные и образовательные ресурсы: http://znanium.com Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М ИНФРА-М, 2009. – 336 с. http://window.edu.ru Абакумова Н.А., Быкова Н.Н. Неорганическая химия. Учебное пособие. - Тамбов: Изд-во ТГТУ, 2009. - 124 с. http://znanium.com Татаринцева Т.Б. Технологии синтеза моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://znanium.com Горбылева А. И. Почвоведение: Учебное пособие. М.: НИЦ ИНФРА-М; Мн.: Нов. знание, 2014 – 400 с. http://lib.uspi.ru Кислинский К.В., Шишлова Т.М. Методические указания к выполнению лабораторных работ по оптическим методам анализа. — Уссурийск : УОП ПГСХА, 2010. — 37 c. http://www. college.ru/chemistry/index/php. Базы данных, информационносправочные и поисковые системы Ресурсы Интернета по химии. Занятие 36. Особенности химии элементов - неметаллов (2 часа) План занятия: Признаки простых и сложных веществ, характерные для элементов неметаллов.Особенности строения электронных оболочек атомов, придающие элементам неметаллические свойства. Изменение прочности и кратности связи элемент - элемент в ряду элементов-неметаллов бор – углерод – азот – кислород – фтор – неон. Влияние электронного строения и изменения размеров атомов в группах на прочность и тип химической связи в важнейших классах сложных соединений (гидриды, оксиды, галогениды). 117 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 118 из 166 Изменение в группах и рядах кислотно-основных свойств гидратов окислов (кислотный, амфотерный или основный характер диссоциации). Влияние специфических свойств элементов-неметаллов на формы их нахождения в природе. Важнейшие биологически активные элементынеметаллы. Основные биолиганды белки, углеводы, нуклеиновые кислоты. Ферменты их роль в процессах метаболизма (гидролиз, окисление). Принципы фотосинтеза. Литература Основная литература 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010.- 256 с. 2. Ардашников, Е.И. Сборник задач по неорганической химии / Е.И. Ардашников. – М.: Академия, 2008. – 208 с. 3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006.- 743 с. 4. Батраков, В.В. Практикум по общей и неорганической химии / В.В. Батраков. – М.: Колос С, 2007. – 464 с. Дополнительная литература 1. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами / Р.А. Лидин. - М.: Бином ,2010. – 230 с. 2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. - М.: Высшая школа, 2009. – 560 с. 3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: Учеб. Пособие для студентов / З.Е. Гольбрайх, Е.И. Маслов. – М.: Астрель, 2004.383 с. 4. Князев, Д.А. Неорганическая химия. 3-е изд. испр. / Д.А. Князев, С.Н. Смарыгин. – М.: Дрофа, 2004. – 592 с. 118 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 119 из 166 5. Коровин, В.Н. Общая химия / В.Н. Коровин. - М.: Высшая школа, 2009. - 377 с. 6. Неорганическая химия (элементы биогенные и абиогенные): Учебное пособие / Под ред. проф. В.В. Егорова. – СПб.: Издательство «Лань», 2009. – 320 с. 7. Общая и неорганическая химия, Т.2 Химические свойства неорганических веществ / Под ред. А.Ф. Воробьева. - М.: ИКЦ «Академкнига», 2007. -544 с. Электронные информационные и образовательные ресурсы: http://znanium.com Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М ИНФРА-М, 2009. – 336 с. http://window.edu.ru Абакумова Н.А., Быкова Н.Н. Неорганическая химия. Учебное пособие. - Тамбов: Изд-во ТГТУ, 2009. - 124 с. http://znanium.com Татаринцева Т.Б. Технологии синтеза моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://znanium.com Горбылева А. И. Почвоведение: Учебное пособие. М.: НИЦ ИНФРА-М; Мн.: Нов. знание, 2014 – 400 с. http://lib.uspi.ru Кислинский К.В., Шишлова Т.М. Методические указания к выполнению лабораторных работ по оптическим методам анализа. — Уссурийск : УОП ПГСХА, 2010. — 37 c. http://www. college.ru/chemistry/index/php. Базы данных, информационносправочные и поисковые системы Ресурсы Интернета по химии. 119 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 120 из 166 МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное автономное образовательное учреждение высшего профессионального образования «Дальневосточный федеральный университет» (ДВФУ) Филиал ДВФУ в г. Уссурийске МАТЕРИАЛЫ ДЛЯ ОРГАНИЗАЦИИ САМОСТОЯТЕЛЬНОЙ РАБОТЫ СТУДЕНТОВ по дисциплине «Неорганические вещества в природе» 050100.68 «Педагогическое образование» Магистерская программа – «Химическое образование» г. Уссурийск 2012 120 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 121 из 166 Студенту рекомендуется следующая схема подготовки к практическому занятию: 1. Проработать конспект лекций; 2. Прочитать основную и дополнительную литературу, рекомендованную по изучаемому разделу; 3. Ответить на вопросы плана семинарского занятия; 4. Выполнить домашнее задание; 5. Проработать тестовые задания и задачи; 6. При затруднениях сформулировать вопросы к преподавателю. Тема 1. Основные классы неорганических веществ (14 часов) Вопросы: 1.Принципы классификации неорганических веществ. 2.Классификация веществ на основе их строения. 3.Классификация простых веществ. 4.Классификация сложных веществ: оксидов, гидроксидов, кислот и солей. Рекомендуемая литература по теме: Основная литература 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010.- 256 с. 2. Ардашников, Е.И. Сборник задач по неорганической химии / Е.И. Ардашников. – М.: Академия, 2008. – 208 с. 3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006.- 743 с. 4. Батраков, В.В. Практикум по общей и неорганической химии / В.В. Батраков. – М.: Колос С, 2007. – 464 с. 121 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 122 из 166 5. Вольхин, В.В. Общая химия / В.В. Вольхин. - СПб.: Лань, 2009. - 464 с. Дополнительная литература 1. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами / Р.А. Лидин. - М.: Бином ,2010. – 230 с. 2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. - М.: Высшая школа, 2009. – 560 с. 3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: Учеб. Пособие для студентов / З.Е. Гольбрайх, Е.И. Маслов. – М.: Астрель, 2004.383 с. 4. Князев, Д.А. Неорганическая химия. 3-е изд. испр. / Д.А. Князев, С.Н. Смарыгин. – М.: Дрофа, 2004. – 592 с. 5. Коровин, В.Н. Общая химия / В.Н. Коровин. - М.: Высшая школа, 2009. - 377 с. Электронные информационные и образовательные ресурсы: http://znanium.com Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М ИНФРА-М, 2009. – 336 с. http://window.edu.ru Абакумова Н.А., Быкова Н.Н. Неорганическая химия. Учебное пособие. - Тамбов: Изд-во ТГТУ, 2009. - 124 с. http://znanium.com Татаринцева Т.Б. Технологии синтеза моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://znanium.com Горбылева А. И. Почвоведение: Учебное пособие. М.: НИЦ ИНФРА-М; Мн.: Нов. знание, 2014 – 400 с. Тема 2. Номенклатура неорганических веществ (16 часов) Вопросы: 122 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 123 из 166 1.Основные принципы международной номенклатуры неорганических веществ. 2.Названия оксидов, гидроксидов, кислот и солей. 3.Номенклатура комплексных соединений. 4.Тривиальные названия веществ. Рекомендуемая литература по теме: Основная литература 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010.- 256 с. 2. Ардашников, Е.И. Сборник задач по неорганической химии / Е.И. Ардашников. – М.: Академия, 2008. – 208 с. 3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006.- 743 с. 4. Батраков, В.В. Практикум по общей и неорганической химии / В.В. Батраков. – М.: Колос С, 2007. – 464 с. 5. Вольхин, В.В. Общая химия / В.В. Вольхин. - СПб.: Лань, 2009. - 464 с. Дополнительная литература 1. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами / Р.А. Лидин. - М.: Бином ,2010. – 230 с. 2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. - М.: Высшая школа, 2009. – 560 с. 3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: Учеб. Пособие для студентов / З.Е. Гольбрайх, Е.И. Маслов. – М.: Астрель, 2004.383 с. 4. Князев, Д.А. Неорганическая химия. 3-е изд. испр. / Д.А. Князев, С.Н. Смарыгин. – М.: Дрофа, 2004. – 592 с. 123 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 124 из 166 5. Коровин, В.Н. Общая химия / В.Н. Коровин. - М.: Высшая школа, 2009. - 377 с. Электронные информационные и образовательные ресурсы: http://znanium.com Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М ИНФРА-М, 2009. – 336 с. http://window.edu.ru Абакумова Н.А., Быкова Н.Н. Неорганическая химия. Учебное пособие. - Тамбов: Изд-во ТГТУ, 2009. - 124 с. http://znanium.com Татаринцева Т.Б. Технологии синтеза моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://znanium.com Горбылева А. И. Почвоведение: Учебное пособие. М.: НИЦ ИНФРА-М; Мн.: Нов. знание, 2014 – 400 с. Тема 3. Простые вещества (16 часов) Вопросы: 1.Простые вещества - неметаллы. 2.Физические и химические свойства неметаллов. 3.Применение неметаллов. 4.Простые вещества - металлы. 5.Физические и химические свойства металлов. 6.Основные способы получения металлов. Рекомендуемая литература по теме: Основная литература 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010.- 256 с. 2. Ардашников, Е.И. Сборник задач по неорганической химии / Е.И. Ардашников. – М.: Академия, 2008. – 208 с. 124 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 125 из 166 3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006.- 743 с. Дополнительная литература 1. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами / Р.А. Лидин. - М.: Бином ,2010. – 230 с. 2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. - М.: Высшая школа, 2009. – 560 с. 3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: Учеб. Пособие для студентов / З.Е. Гольбрайх, Е.И. Маслов. – М.: Астрель, 2004.383 с. Электронные информационные и образовательные ресурсы: http://znanium.com Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М ИНФРА-М, 2009. – 336 с. http://window.edu.ru Абакумова Н.А., Быкова Н.Н. Неорганическая химия. Учебное пособие. - Тамбов: Изд-во ТГТУ, 2009. - 124 с. http://znanium.com Татаринцева Т.Б. Технологии синтеза моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://znanium.com Горбылева А. И. Почвоведение: Учебное пособие. М.: НИЦ ИНФРА-М; Мн.: Нов. знание, 2014 – 400 с. Тема 4. Сложные вещества (16 часов) Вопросы: 1.Оксиды. Получение, физические и химические свойства оксидов. 2.Гидроксиды. Получение, физические и химические свойства гидроксидов. 3.Кислоты. Получение, физические и химические свойства кислот. 125 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 126 из 166 4.Соли. Кислые, средние, основные и комплексные. Получение, физические и химические свойства солей. Рекомендуемая литература по теме: Основная литература 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010.- 256 с. 2. Ардашников, Е.И. Сборник задач по неорганической химии / Е.И. Ардашников. – М.: Академия, 2008. – 208 с. 3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006.- 743 с. 4. Батраков, В.В. Практикум по общей и неорганической химии / В.В. Батраков. – М.: Колос С, 2007. – 464 с. 5. Вольхин, В.В. Общая химия / В.В. Вольхин. - СПб.: Лань, 2009. - 464 с. Дополнительная литература 1. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами / Р.А. Лидин. - М.: Бином ,2010. – 230 с. 2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. - М.: Высшая школа, 2009. – 560 с. 3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: Учеб. Пособие для студентов / З.Е. Гольбрайх, Е.И. Маслов. – М.: Астрель, 2004.383 с. 4. Князев, Д.А. Неорганическая химия. 3-е изд. испр. / Д.А. Князев, С.Н. Смарыгин. – М.: Дрофа, 2004. – 592 с. 5. Коровин, В.Н. Общая химия / В.Н. Коровин. - М.: Высшая школа, 2009. - 377 с. Электронные информационные и образовательные ресурсы: 126 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 127 из 166 http://znanium.com Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М ИНФРА-М, 2009. – 336 с. http://window.edu.ru Абакумова Н.А., Быкова Н.Н. Неорганическая химия. Учебное пособие. - Тамбов: Изд-во ТГТУ, 2009. - 124 с. http://znanium.com Татаринцева Т.Б. Технологии синтеза моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://znanium.com Горбылева А. И. Почвоведение: Учебное пособие. М.: НИЦ ИНФРА-М; Мн.: Нов. знание, 2014 – 400 с. Вопросы для самоконтроля 1. Химия s-элементов: своеобразие строения атома водорода, физических и химических свойств этого элемента; бинарные соединения водорода с электроотрицательными элементами, их поведение в водных растворах, гидратация протона. 2. Ггидриды щелочных и щелочно-земельных металлов, их солеобразный характер, гидрид-ион как восстановитель и лиганд. 3. Водородная связь, её значение в природе; вода, геометрия и свойства её молекулы, структура льда и жидкой воды, химические свойства воды, вода как растворитель и лиганд. 4. Начение водорода как наиболее распространённого элемента Вселенной. 5. Вода в природе, экологические аспекты водопользования. 6. Общие свойства элементов IА-подгруппы. 7. Щелочные металлы как восстановители, образование бинарных соединений и их свойства, катионы щелочных металлов как важнейшая химическая форма их существования в природе, свойства этих катионов, реакции бинарных соединений с водой. 127 Разработчик: Шишлова М.А. 8. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Гидратированные катионы щелочных металлов, Лист 128 из 166 высокая растворимость солей щелочных металлов в воде. 9. Кристаллогидраты; комплексы катионов натрия и калия с биомолекулами. 10. Катиониты и ионный обмен натрия и калия и других однозарядных ионов почвенного раствора; натрий и калий как компоненты почвы и почвенных растворов, калий как элемент питания растений, калийные удобрения. 11. Круговороты натрия и калия в природе. 12. Общие свойства элементов IIА-подгруппы. 13. Амфотерность бериллия, его оксида и гидроксида, токсичность бериллия и его соединений. 14. Физические и химические свойства магния и кальция, их восстановительные свойства, катионы магния и кальция как важнейшие формы существования этих элементов в природе, свойства этих катионов; различие в растворимости солей магния и кальция и солей натрия и калия, кристаллогидраты. 15. Комплексные соединения магния и кальция с хелатообразующими лигандами, Mg2+ и Са2+ в живой клетке, роль магния в хлорофилле, Mg2+ и Са2+ в ферментативных реакциях; магний и кальций как питательные компоненты почв, их ионообменное поведение в почвах, жесткость воды, известкование и известкование почв. 16. Химия p-элементов: общие свойства элементов IIIA-подгруппы. 17. Отличие электронного строения атомов бора и алюминия от строения других элементов подгруппы, преобладание ковалентного характера связей в соединениях бора и двойственный характер связей алюминия, физические и химические свойства элементного бора. 128 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 129 из 166 18. Кислородсодержащие соединения бора: оксид, борные кислоты и их соли. 19. Физические и химические свойства металлического алюминия, важнейшие химические свойства бинарных соединений алюминия. 20. Оксиды и гидроксиды алюминия, разнообразие их строения, амфотерность этих соединений, реакции их взаимного превращения; аквакатион А13+, особенности его строения и поведения в растворах; соли алюминия, их кристаллогидраты, растворимость в воде и гидролиз. 21. Комплексные соединения алюминия. 22. Бор и алюминий в биосистемах. 23. Общие свойства элементов IVA-подгруппы. 24. Химия неорганических соединений углерода: аллотропные модификации углерода, оксиды углерода, угольная кислота и ее соли. 25. Значение углерода в природе, круговорот углерода в природе, экологические аспекты химии углерода. 26. Особенности химических свойств кремния. 27. Оксид, кремния, кремниевые кислоты и их соли. 28. Кремнезем, силикаты, алюмосиликаты как почвообразующие материалы, их значение для плодородия почв, применение силикатов и других соединений кремния. 29. Особенности химии германия, олова и свинца, экологическая опасность свинца. 30. Общие свойства элементов VA-подгруппы. 31. Особенности химических связей азота с водородом, углеродом и кислородом; термодинамическая неустойчивость большинства химических соединений азота, её причины и проявления в химии и природе. 32. Химические свойства молекулярного азота. 129 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 130 из 166 33. Аммиак и его производные; оксиды азота, азотная, азотистая и азотноватистая кислоты и их соли. 34. Особенности азота как биогенного элемента, азотсодержащие биомолекулы, их значение в жизнедеятельности растительных и животных клеток; значение азота как элемента питания, круговорот азота в природе, азотные удобрения, экологические аспекты их применения. 35. Особенности термодинамической устойчивости различных соединений фосфора в земных условиях, оксиды фосфора. 36. Ортофосфорная кислоты и её соли, конденсированные фосфорные кислоты и их соли; особенности фосфора как биогенного элемента, специфика поведения и значение соединений фосфора в биосистемах, значение фосфора как элемента питания, круговорот фосфора в природе, фосфорные удобрения и экологические аспекты их использования. 37. Общие свойства элементов VIA-подгруппы; молекулярный кислород как окислитель; озон; термодинамическая устойчивость и распространенность соединений кислорода; оксиды, кислородсодержащие кислоты, основания, соли кислородсодержащих кислот как важнейшие классы неорганических соединений; пероксид водорода и другие пероксиды, молекулярный кислород в биоэнергетеке, роль функциональных кислородсодержащих групп в биомолекулах, экологическая роль кислорода и озона атмосферы. 38. Особенности химических связей серы, оксиды серы. 39. Серная кислота и ее соли. 40. Сернистая кислота и ее соли; сероводород и полисульфаны, сульфиды и полисульфиды. 41. Сера как биогенный элемент. 42. Применение сульфатов и других соединений серы в сельском хозяйстве, экологическая опасность сернистого газа. 130 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 131 из 166 43. Селеновая кислота и ее соли, селенистая кислота и ее соли. 44. Роль селена в природе. 45. общие свойства элементов IIVA-подгруппы. 46. Степени окисления галогенов в соединениях, особенности связей, термодинамики и строения соединений фтора, фтороводород, фтороводородная кислота и ее соли. 47. Хлороводород, хлороводородная кислота и ее соли, соединения с положительными степенями окисления хлора, их химические свойства. 48. Особенности хлора как биогенного элемента, роль хлора в живой клетке, применение соединений хлора в сельском хозяйстве. 49. Фтор как жизненно необходимый элемент и как элементзагрязнитель окружающей среды. 50. Химия d-элементов: общие свойства переходных металлов. 51. Общие свойства и особенности переходных металлов. 52. Соединения хрома в степенях окисления +3 и +6; соединения молибдена(VI); соединения марганца в степенях окисления +2, +4, +6 и +7; роль соединений хрома, молибдена, марганца, железа, никеля, меди и цинка в жизнедеятельности человека и животных; соединения железа в степенях окисления +2 и +3, соединения кобальта в степенях окисления +2 и +3; соединения никеля в степени окисления +2. 53. Соединения меди в степенях окисления +1 и +2; соединения цинка, кадмия и ртути; роль соединений хрома, молибдена, марганца, железа, никеля, меди и цинка в жизнедеятельности человека и животных, токсичность соединений кадмия и ртути. 131 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 132 из 166 МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное автономное образовательное учреждение высшего профессионального образования «Дальневосточный федеральный университет» (ДВФУ) Филиал ДВФУ в г. Уссурийске КОНТРОЛЬНО-ИЗМЕРИТЕЛЬНЫЕ МАТЕРИАЛЫ по дисциплине «Неорганические вещества в природе» 050100.68 «Педагогическое образование» Магистерская программа – «Химическое образование» г. Уссурийск 2012 132 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 133 из 166 Тесты для промежуточной аттестации В каком ряду простые вещества расположены в порядке усиления металлических свойств? Mg, Ca, Ва Na, Mg, A1 K,Ca,Fe Sc, Ca, Mg Наиболее сильное основание образует магний стронций барий кадмий Оксид углерода (IV) реагирует с оксидом кальция оксидом серы (VI) ортофосфорной кислотой Одновременно в растворе не могут находиться ионы Fe3+ и ClCa2+ и CO32Br- и FNa+ и PO43В ходе химических реакций энергия всегда выделяется всегда поглащается 133 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 134 из 166 может как выделяться, так и поглащаться не выделяется и не поглащается Степень окисления марганца в соединении KMnO4 равна -2 0 +2 +3 +5 +7 При взаимодействии соляной кислоты и карбоната кальция выделяется хлор оксид углерода (IV) хлорная кислота оксид кальция В реакции цинка с концентрированной азотной кислотой окислителем является Zn0 Zn2+ NO3H+ Оксид кремния (II) SiO относится к классу кислотных оксидов основных оксидов амфотерных оксидов 134 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 135 из 166 несолеобразующих оксидов двойных оксидов При добавлении лакмуса к водному раствору карбоната натрия, цвет индикатора не изменится изменится на красный изменится на синий Вопросы и упражнения по теме «Хром, молибден, вольфрам» 1. Обосновать размещение хрома, молибдена и вольфрама в VI группе ПСЭ, в чем проявляется сходство с элементами главной подгруппы VI группы? 2. Чем обусловлена близость атомных и ионных радиусов молибдена и вольфрама? Как она сказывается на характере изменения свойств в ряду хром – вольфрам? 3. Охарактеризовать свойства хрома, указав отношение металлического хрома к воздуху, воде, кислотам. 4. Как изменяются устойчивость, кислотно-основные и окислительновосстановительные свойства в рядах оксидов и гидроксидов хрома: CrO – Cr2O3 – CrO3; Cr(OH)2 – Cr(OH)3 – H2CrO4? 5. Как изменяется сила кислот и устойчивость в ряду хромовая – вольфрамовая кислота? Объяснить характер этого изменения. 6. В водном растворе устанавливается равновесие: 2H+ + 2Cr-42- = Cr2O72- + H2O В каком направлении сместиться равновесие при добавлении: a) Кислоты 135 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования b) Щелочи c) Соли бария? Почему? Лист 136 из 166 7. Как осуществить превращения: Cr2O3 – K2CrO4 – K2Cr2O7 – Cr2(SO4)3 – K3[Cr(OH)6] 8. Закончите уравнения реакций: a) CrSO4 + H2O = b) CrCL3 + HCL + ZN = c) CrCL3 + KOH(изб) = d) K2Cr2O7 + KY + H2SO4 = Задачи. 1. Какой объем 40 % - ного раствора NaOH (плотность 1,437г/см3) потребуется для полного растворения 20,6г Cr(OH)3? 2. При сплавлении Cr2O3 массой 3,04 с окислителем в присутствии едкого натра был получен Na2CrO4 массой 6,37г. Определите выход продукта (в %). 3. Какая масса алюминия необходима для восстановления хрома из 76 кг оксида хрома (III)? 4. Определите массовую долю дихромата натрия Na2Cr2O7 в техническом образце, если 1,0 г последнего в кислой среде окисляют 3,38г иодида калия. Варианты контрольных заданий №1. Вариант 1 1. Объяснение характерных степеней окисления и валентных состояний элементов триады железа. 2. Строение комплекса K3Fe(CN)6 (парамагнитный один неспаренный электрон). Реагентом на какой ион он является? Привести три названия этого комплекса. 3. Отношение железа к кислороду, воде, растворам кислот и щелочей. 136 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 137 из 166 4. Чугун и сталь: получение и свойства. Вариант 2 1. Как и почему изменяются физические и химические свойства в рядах железо-кобальт-никель и железо-рутений-осмий? 2. Строение комплекса Fe(H2O)6SO4 . Какую реакция раствора он имеет? Как называется этот комплекс? 3. КО и ОВ свойства соединений железа (III). 4. Сущность процессов закалки и отпуска стали. Вариант 3 1. Почему в VIII В группе выделяют семейство железа и семейство платины? 2. Строение комплекса K4Fe(CN)6 . Привести три названия этого комплекса. Реактивом на какой ион он является? 3. Кислотно-основные и окислительно-восстановительные свойства соеди-нений железа (II). 4. Для чего применяют хромирование и никелирование металлических изделий? Вариант 4 1. Объяснить положение железа и платины в ряду напряжений. 2. Строение комплекса Сo(H2O)6CI2 (3 не спаренных электрона). Назвать комплекс. 3. Сравнить и объяснить отличие в свойствах гидроксидов железа(II), железа (III) и железа (VI). 4. Применение платиновых металлов, кобальта и никеля. Вариант 5 1. Схемы коррозии оцинкованного и луженого железа: а) в кислом растворе б) в нейтральном с участием кислорода 137 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 138 из 166 2. Строение комплекса Ni(H2O)6(NO3)2 (2 не спаренных электрона). Назвать комплекс. 3. Сравнить и объяснить различие в свойствах солей железа (II) и железа (III). 4. Природные соединения железа. Варианты контрольных заданий №2 Вариант 1 1. Общая характеристика атомов элементов IВ группы. 2. Химические свойства цинка. 3. Амфотерные гидроксиды d-элементов (получение и свойства). 4. Закончить уравнения реакций и указать химические свойства веществ. KMnO4 + H2O + K2SO4 = FeSO4 + H2O = K2Cr2O7 + KOH + H2O = CuO + HCl = 5. Строение комплексного соединения: K3[Fe(CN)6]. Вариант 2 1. Общая характеристика атомов элементов YIIВ группы. 2. Химические свойства благородных металлов (серебро, золото, платина). 3. Полный гидролиз солей d-элементов. 4. Закончите уравнения реакций: K2Cr2O7 + K2SO4 + H2SO4 = K2CrO4 + HCl = MnO2 + KOH + KNO3 = AgNO3 + HCl = 5. Строение комплексного соединения: [Fe(H2O)6]Cl3 Вариант 3 1. Общая характеристика атомов элементов YIВ группы. 2. Химические свойства ртути. 3. Гидролиз солей d-элементов по катиону. 138 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 139 из 166 4. Закончите уравнения реакций: KMnO4 + H2SO4 + K2SO4 = MnO2 + HCl = CrCl3 + Br2 + NaOH = FeCl3 + KJ = 5. Строение комплексного соединения: [Ag(NH3)2]Cl Вариант 4 1. Общая характеристика атомов элементов VВ группы. 2. Химические свойства железа. 3. Получение и свойства оснований d-металлов. 4. Закончите уравнения реакций и укажите химические свойсива веществ: KMnO4 = ZnCl2 + H2O = MnCl2 + PlO2 + HNO3 = Cr2O3 + NaOH = 5. Строение комплексного соединения: CuSO4 5H2O. Вариант 5 1. Общая характеристика атомов элементов IIВ группы. 2. Химические свойства меди. 3. Кислотные оксиды и гидроксиды d-металлов (получение и свойства). 4. Закончите уравнения реакций и укажите химические свойства веществ: KMnO4 + KOH + K2SO4 = MnCl2 + H2O = Fe(OH)2 + O2 + H2O = Cu(OH)2 = 5. Строение комплексного соединения: K4[Fe(CN)6] Тесты для итоговой аттестации А 1. Число атомов всех химических элементов в молекуле серной кислоты равно: 1) 3 2) 4 3) 7 4) 6 А 2. Число протонов, нейтронов и электронов в атоме фтора 139 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования 1) p+ – 9; n0 – 10; е - 19 2) p+ – 9; n0 – 10; е - 9 3) p+ – 10; n0 – 9; е - 10 4) p+ – 9; n0 – 9; е - 19 Лист 140 из 166 А 3. Группа формул веществ с ковалентным типом связи: 1) H2S, P4, CO2 3) HCl, NaCl, H2O 2) H2, Na, CuO 4) CaO, SO2, CH4 А 4. Вещество, при растворении которого в воде электролитической диссоциации практически не происходит: 1) гидроксид натрия 3) хлорид серебра 2) сульфат калия 4) нитрат алюминия А 5. Одновременно могут находиться в растворе ионы: 1) Na+, H+, Ba2+, OH- 3) Mg2+, K+, NO3-, SO42 - 2) Fe2+, Na+, OH- , SO42- 4) Ca2+, H+, CO32-, Cl - А 6. Верны ли следующие высказывания? А. Оксид углерода (IV) – кислотный оксид Б. Оксид натрия – основный оксид. 1) верно только А 3) верно только Б 2) верны оба суждения 4) оба суждения не верны Часть 2. В задании В1 на установление соответствия запишите последовательность цифр без пробелов и других символов. В1. Установите соответствие между формулой вещества и классом соединения: Формула вещества: Класс соединения: А) MgO 1) соль Б) H2SO4 2) основный оксид В) KOH 3) нерастворимое основание Г) Ba(NO3)2 4) кислотный оксид 5) кислота 140 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 141 из 166 6) растворимое основание Ответом к заданию В 2 является последовательность цифр в порядке возрастания. В 2. В реакцию с раствором серной кислоты вступают: 1) медь 4) магний 2) оксид меди (II) 5) хлорид бария 3) гидроксид натрия 6) оксид серы (IV) Часть 3 Запишите номер задания и полное решение C1. Составьте уравнения химических реакций согласно схеме Fe → FeCl2 → Fe(OH)2 → FeO → Fe Назовите все вещества, укажите тип реакции Вопросы к зачету 1. Оксиды, гидроксиды s -металлов группы: тип химические связи, тип решетки. Физические свойства (термическая устойчивость, растворимость), применение. Сравнительная характеристика кислотно- основных свойств гидроксидов 2. Соли щелочных металлов: тип химические связи, тип решетки, физические свойства (термическая устойчивость, гидролиз, растворимость, применение) 3. Соли s-металлов 2 группы: тип химические связи, тип решетки, физические свойства (термическая устойчивость, растворимость, гидролиз), применение. 4 Типы кристаллический решеток простых веществ /молекулярные, атомные, металлические. Физические свойства веществ и тип К.Р Влияние энергии атомизации, ионизации и гидратации на место металла напряжении. 141 в ряду ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 142 из 166 5. Германий и его соединения: физические и химические свойства, применение. Сравнение свойств германия: с углеродом и кремнием, оловом и свинцом. Значение открытия германия. 6. Мышьяк, сурьма и висмут: общая характеристика атомов элементов и простых веществ, водородных и кислородных соединений. Галогениды и сульфиды. Практическое использование и токсичность соединений. 7. Селен, теллур, полоний и их соединения с водородом и кислородом. Использование селена и теллура в полупроводниковой технике 8. Соединения водорода с металлами и неметаллами. Сравнительная характеристика водородных соединений элементов 5, 6 ,7 групп 9.Оксиды: строение, тип связи между атомами. Классификация оксидов. Основные свойства и способы получения оксидов. Сравнительная характеристика оксидов в III периоде и главной подгруппе II группы. 10. Гидроксиды: строение, тип связи между атомами. Классификация гидрооксидов. Основные свойства и способы получения гидрооксидов. Сравнительная характеристика . 11. Соли: тип связи, строение, классификация, термическая устойчивость. Получение солей. Растворимость солей. 12. Гидролиз солей: причины и случаи, константа и степень гидролиза. 13. Комплексные соединения: теории строения. Практическое применение. Получение, устойчивость. 14. Элементы главной подгруппы 7 группы: общая характеристика атомов элементов и простых веществ. Фтор и его соединения. 15. Сравнение силы, термической устойчивости и окислительновосстановительных свойств кислот кислородных соединений хлора. 16. Бром, йод и их соединения. 142 хлора. Практическое применение Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 143 из 166 17. Элементы главной подгруппы 6 группы: общая характеристика атомов элементов и простых веществ. Кислород и озон: строение простого вещества, физические и химические свойства, получение и применение. Озон: образование в природе, разрушение озонового слоя в стратосфере. 18. Халькогены в природе. Аллотропия. Свойства и практическое применение. Свойства серы, селена и теллура, их применение. 19. Кислородные кислоты серы: сернистая, серная, полисерные, тиосерная и др. Свойства и применение их солей. Сульфиды и полисульфиды. 20. Элементы главной подгруппы 5 группы: общая характеристика атомов элементов простых веществ Оксиды азота. Соединения азота с металлами и галогенами. 21. Аммиак, гидразин и гидроксиламин: электронное строение и геометрия молекул, физические и химические свойства, способы получения. Практическое применение . 22. Фосфор: аллотропные видоизменения фосфора, их свойства. Важнейшие природные соединения фосфора, его получение и применение. Оксиды фосфора: строение, физические и химические свойства, применение. 23. Фосфорные кислоты (ортофосфорная, полифосфорные, метафосфорные) строение, физические и химические свойства, применение. 24. Свойства и применение средних и кислых фосфатов, фосфорные удобрения. 25. Элементы главной подгруппы 4 группы: общая характеристика атомов элементов и простых веществ. Углерод в природе. Аллотропия углерода: алмаз, графит, карбин и фуллерены: их структура, физические и химические свойства, практическое значение. 26. Химические свойства углерода. Углерод как восстановитель. Сравнение углерода с азотом и галогенами. Карбиды. Синильная кислота и 143 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 144 из 166 цианиды: строение, физические и химические свойства, использование в промышленности. 27. Оксиды углерода: строение молекул, физические и химические свойства, физиологическое действие, способы получения. Карбонилы. 28. Угольная кислота. Карбонаты и гидрокарбонаты: нахождение в природе, растворимость, гидролиз, термическая устойчивость. 29. Кремний в природе. Физические и химические свойства кремния, его получение и применение. Понятие о зонной теории полупроводников. 30. Диоксид кремния, кремниевая кислота, силикаты: строение, физические и химические свойства, применение. 31. Бор и его соединения: физические и химические свойства, применение. Свойства и применение ортоборной кислоты и буры. 32. Благородные газы: особенности положения в периодической системе, способы получения, физические применение 144 и химические свойства, Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 145 из 166 МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное автономное образовательное учреждение высшего профессионального образования «Дальневосточный федеральный университет» (ДВФУ) Филиал ДВФУ в г. Уссурийске СПИСОК ЛИТЕРАТУРЫ по дисциплине «Неорганические вещества в природе» 050100.68 «Педагогическое образование» Магистерская программа – «Химическое образование» г. Уссурийск 2012 145 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 146 из 166 Основная литература 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010.- 256 с. 2. Ардашников, Е.И. Сборник задач по неорганической химии / Е.И. Ардашников. – М.: Академия, 2008. – 208 с. 3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006.- 743 с. 4. Батраков, В.В. Практикум по общей и неорганической химии / В.В. Батраков. – М.: Колос С, 2007. – 464 с. 5. Вольхин, В.В. Общая химия / В.В. Вольхин. - СПб.: Лань, 2009. - 464 с. 6. Глинка, Н.Л. Задачи и упражнения по общей химии / Н.Л. Глинка. М.: Интеграл-пресс, 2009.- 240 с. 7. Глинка, Н.Л. Общая химия / Н.Л. Глинка.- М.: Юрайт, 2010. – 886 с. 8. Гринвуд, Н.Н. Химия элементов В 2-х томах / Н.Н. Гринвуд. – М.: Бином, 2008. – 1 том – 600 с., 2 том – 666 с. 9. Неорганическая химия / Под ред. Ю.Д.Третьякова. - М.: Академкнига, 2007. - 1209 с. 10.Павлов, Н.Н. Сборник задач и упражнений по общей и неорганической химии / Н.Н. Павлов, В.И. Фролов. – М.: Дрофа, 2005. – 240 с. Дополнительная литература 1. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами / Р.А. Лидин. - М.: Бином ,2010. – 230 с. 2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. Для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. - М.: Высшая школа, 2009. – 560 с. 146 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 147 из 166 3. Гольбрайх, З.Е. Сборник задач и упражнений по химии: Учеб. Пособие для студентов / З.Е. Гольбрайх, Е.И. Маслов. – М.: Астрель, 2004.383 с. 4. Князев, Д.А. Неорганическая химия. 3-е изд. испр. / Д.А. Князев, С.Н. Смарыгин. – М.: Дрофа, 2004. – 592 с. 5. Коровин, В.Н. Общая химия / В.Н. Коровин. - М.: Высшая школа, 2009. - 377 с. 6. Неорганическая химия (элементы биогенные и абиогенные): Учебное пособие / Под ред. проф. В.В. Егорова. – СПб.: Издательство «Лань», 2009. – 320 с. 7. Общая и неорганическая химия, Т.2 Химические свойства неорганических веществ / Под ред. А.Ф. Воробьева. - М.: ИКЦ «Академкнига», 2007. -544 с. Электронные информационные образовательные ресурсы: http://window.edu.ru Афиногенов Ю.П., Гончаров Е.Г., Ховив А.М., Селеменев В.Ф. Химическая связь в курсе неорганической химии (Межмолекулярное взаимодействие): Учебное пособие. – Часть 5. – М., 2012. – 213 с. http://window.edu.ru Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М: ИНФРА-М, 2009. - 336 с. http://znanium.com Татаринцева Т.Б. Технологии синтеза моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://window.edu.ru/ Афиногенов Ю.П., Гончаров Е.Г., Ховив А.М., Селеменев В.Ф. Химическая связь в курсе неорганической химии (Межмолекулярное взаимодействие): Учебное пособие. – Часть 5. – М., 2011. 65 с. 147 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 148 из 166 МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное автономное образовательное учреждение высшего профессионального образования «Дальневосточный федеральный университет» (ДВФУ) Филиал ДВФУ в г. Уссурийске ГЛОССАРИЙ по дисциплине «Неорганические вещества в природе» 050100.68 «Педагогическое образование» Магистерская программа – «Химическое образование» г. Уссурийск 2012 148 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Адгезия (прилипание, сцепление, притяжение) – связь Лист 149 из 166 между разнородными конденсированными телами при их молекулярном контакте. Адсорбат – адсорбируемое вещество на поверхности раздела фаз. Адсорбент – вещество, на которое адсорбируется другое вещество. Адсорбтив – адсорбируемое вещество, находящееся в объеме и способное адсорбироваться. Адсорбция – концентрирование (сгущение) вещества на поверхности раздела фаз. Аутогезия – частный случай адгезии, проявляющийся при соприкосновении однородных тел. Аэрозоли – дисперсные системы, в газовой (воздушной) дисперсионной среде которых находятся твердые во взвешенном состоянии и (или) жидкие частицы дисперсной фазы. Акцептор - атом, предоставляющий свободную орбиталь при образовании ковалентной связи по донорно-акцепторному механизму. Анионы - отрицательно заряженные ионы. Анод - электрод, на котором происходит процесс окисления, отдачи электронов в электрохимической реакции. Атом - сложная электронейтральная структура, состоящая из положительно заряженного ядра и отрицательно заряженных электронов, расположенных в пространстве вне ядра. Атомная электронная орбиталь - состояние электрона в атоме, характеризующееся определенными значениями квантовых чисел. Атмосферная коррозия - коррозия во влажном воздухе при комнатной температуре. Валентность атома - число химических связей, которое данный атом образует с другими атомами. 149 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 150 из 166 Вещество - одна из форм существования материи. Внутренняя энергия - это энергия, скрытая в веществах и освобождающаяся при химических реакциях или физических превращениях. Водородный показатель - отрицательный десятичный логарифм концентрации ионов водорода в растворе. Водородная связь - связь между атомом водорода одной молекулы и сильно электроотрицательным атомом (фтором, кислородом, хлором и др.) другой молекулы. Восстановление - процесс принятия электронов в окислительновосстановительных реакциях. Восстановитель. Вещество, атомы или ионы которого принимают электроны. Ван-дер-ваальсовы силы - силы притяжения между молекулами (или между группами одной молекулы), отличные от сил, возникающих за счет образования связи или электростатического взаимодействия ионов или ионных групп друг с другом или с нейтральными молекулами. Водородная связь - форма ассоциации между электротрицательным атомом и водородным атомом, связанным с другим электротрицательным атомом. Могут быть меж- и внутримолекулярными. Обычно энергия этих связей 20-25 кДж/моль-1. Восстановление - полный перенос одного или нескольких электронов к молекуле. Процесс, обратный окислению. Вырожденная перегруппировка - молекулярная перегруппировка, в которой основной продукт реакции неотличим от основного реагента. Наличие вырожденных перегруппировок можно определить с помощью изотопной метки или динамической ЯМР-спектроскопии. Внутренняя сфера комплексного соединения - центральный атом со связанными с ним лигандами, то есть, собственно, комплексная частица. Внешняя сфера комплексного соединения - остальные частицы, связанные 150 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 151 из 166 с комплексной частицей ионной или межмолекулярными связями, включая водородные. Гидратация - присоединение воды или элементов воды к молекуле. Гидрофобное липофильных взаимодействие групп межмолекулярные в - тенденция растворенных агрегаты в водной углеводородов (или веществах) образовывать среде аналогичные (и внутримолекулярные взаимодействия). Гиперконъюгация - это взаимодействие s-связей с p-системой. Это понятие распространяется на карбониевые ионы и радикалы, где имеется взаимодействие между s-связями и незаполненными или частично заполненными p- или p-орбиталями. Гомолиз - расщепление связи, происходящее таким образом, что у каждого из молекулярных фрагментов, связь между которыми разрывается, остается один связывающий электрон. Граничные орбитали - орбитали в молекуле – самая высокоэнергетическая заселенная орбиталь ВЗМО (заполнена целиком или частично) и самая низкоэнергетическая незаселенная орбиталь НСМО (полностью или частично вакантная). Анализ дает подход к интерпретации реакционной способности в рамках упрощенной теории возмущения МО. Газовая коррозия - Коррозия в газах и парах без конденсации влаги на поверхности металлов, обычно наблюдается при высоких температурах. Гальванический элемент - устройство, в котором за счет протекания окислительно-восстановительной реакции создается разность потенциалов и энергия химической реакции превращается в электрическую. Гидролиз соли - ионообменное взаимодействие ионов соли с ионами молекулы воды. 151 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 152 из 166 Главное квантовое число (n) - определяет возможные энергетические состояния электрона в атоме, его численные значения соответствуют номеру периода, в котором находится рассматриваемый атом. Гели – структурированные высокодисперсные системы с жидкой дисперсионной средой, состоящие из заполненного жидкостью каркаса, который образует структуру из частиц дисперсной фазы. Гидрофобные взаимодействия – взаимодействия, возникающие в водной среде между неполярными частицами, молекулами или неполярными радикалами сложных молекул . Диссоциация - разделение молекулы на две или несколько частиц. Примерами являются мономолекулярный гетеролиз, разделение ионной пары на составляющие свободные ионы. Донор электрона - соединение, которое может передавать электрон другому соединению. Дентатность лиганда - определяется числом координационных мест, занимаемых лигандом в координационной сфере комплексообразователя. Различают монодентатные (унидентатные) лиганды, связанные с центральным атомом через один из своих атомов, то есть одной ковалентной связью), бидентатные (связанные с центральным атомом через два своих атома, то есть, двумя связями), три- , тетрадентатные и т. д. Делокализация - квантовомеханическое понятие, непосредственно связанное с принципом неопределенности, наиболее употребляемое для описания p-связи в сопряженных системах. Дзета ()-потенциал – потенциал диффузной части ДЭС по границе скольжения, определяющий возможность перемещения дисперсной фазы относительно дисперсионной среды. Диализ – самопроизвольный процесс перехода примесей через мембрану, применяемый для очистки коллоидных растворов и растворов 152 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 153 из 166 ВМС; при ультрафильтрации этот же процесс осуществляется под давлением. Диспергирование – получение частиц дисперсной фазы из сплошного и более крупного по размерам вещества. Дисперсные системы – такие гетерогенные системы, которые состоят по крайней мере из двух фаз, одна из которых – дисперсная фаза – является раздробленной (прерывной), а другая – дисперсионная среда – представляет собой непрерывную, нераздробленную часть системы. Дисперсность – величина, обратная характерному размеру частиц дисперсной фазы. Диффузия – процесс переноса вещества (ионов, молекул, частиц дисперсных систем) из области большей в область меньшей концентрации. ДЭС – двойной электрический слой, который образуется на границе раздела фаз из пространственно разделенных электрических зарядов противоположного знака. Золи – седиментационно-устойчивые высокодисперсные системы с твердой дисперсионной фазой и жидкой дисперсионной средой. Изобарный процесс - процесс, протекающий при постоянном давлении. Изотопы - Атомы одного и того же элемента, различающиеся по массе из-за разного количества нейтронов в ядре. Изохорный процесс - процесс, протекающий при постоянном объеме. Ингибиторы - вещества, замедляющие коррозию (нитрит натрия, хромат и дихромат калия, фосфат натрия, высокомолекулярные соединения и др.). Ионы - заряженные частицы, на которые распадаются молекулы электролита в процессе диссоциации. Ионная связь - связь в молекуле, осуществляемая электростатического притяжения разноименно заряженных ионов. 153 за счет ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 154 из 166 Изомеризации - химическая реакция, главный продукт которой является изомером подразумевает главного молекулярную реагента. Изомеризация перегруппировку, необязательно например, переходы конформеров. Изотопный эффект - отношение констант скорости или констант равновесия двух реакций, которые отличаются только изотопным составом одного или нескольких химически идентичных компонентов Клегк./ Ктяж. Илид - соединение образующееся при потере протона атомом, прямо связанным с центральным гетероатомом “ониевого иона”. Ингибирование - уменьшение скорости реакции, вызываемое добавлением вещества-ингибитора, которое влияет на реагент, катализатор или интермедиат. Индекс реакционной способности - какой либо численный индекс, выведенный из квантовохимических модельных расчетов, позволяющий предсказать относительную реакционную способность различных положений в молекуле. Наиболее успешно применяется к реакциям замещения в сопряженных системах. Индукционный эффект - экспериментально наблюдаемый эффект передачи заряда по цепи атомов за счет электростатической индукции. Не смешивать с эффектом поля. Инициирование - реакция или процесс, генерирующий свободные радикалы, которые затем участвуют в цепной реакции. Интермедиат, промежуточный продукт - молекула, время жизни которой заметно больше, чем время молекулярного колебания (соответствующее локальному минимуму потенциальной энергии на глубине большей, чем RT) и которая образуется из реагентов и превращается далее, давая продукты химической реакции. 154 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 155 из 166 Ионизация - генерация одного или нескольких ионов. Может происходить при потере электрона нейтральной молекулой за счет мономолекулярного гетеролиза на два или несколько ионов. Другим вариантом является гетеролитическая реакция замещения, включающая нейтральные молекулы. RCl + AlCl3 -> R+ + AlCl4Ионизирующая способность - качественное понятие для обозначения тенденции определенного растворителя промотировать ионизацию незаряженного растворенного вещества. Ион-радикал - радикал, имеющий электрический заряд. Положительно заряженный радикал называют “катион-радикал”, отрицательно заряженный радикал называют “анион-радикал”. Если положение неспаренного спина и заряда невозможно связать с определенным атомом, значки точки и заряда располагают последовательно ·+ или ·– в соответствии названием “радикалион”. Коагуляция – слипание частиц в дисперсных системах при их контакте и образование агрегатов из слипшихся частиц. Коалесценция – слияние капель жидкости (либо двух жидкостей с неограниченной взаимной растворимостью) или пузырьков газа внутри подвижной среды (жидкости или газа). Когезия – связь между молекулами (атомами, ионами) внутри тела в пределах одной фазы. ККМ (критическая концентрация мицеллообразования) – такая концентрация коллоидных ПАВ, при которой в растворе возникают мицеллы, находящиеся в термодинамическом равновесии с молекулами (ионами) ПАВ раствора. Коллоидные ПАВ – ПАВ, обладающие моющим действием, молекулы которых способны образовывать мицеллы. 155 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 156 из 166 Краевой угол – угол между поверхностью, с которой контактирует жидкость, и касательной к контуру жидкости в одной из точек ее контакта с твердым телом, отсчитываемый всегда в сторону жидкости. Комплексное соединение - соединение в состав которого входят комплексные частицы. В настоящее время строгого определения понятия «комплексная частица» нет. Обычно используется следующее определение. Комплексная частица - сложная частица, способная к самостоятельному существованию в кристалле или растворе, образованная из других, более простых частиц, также способных к самостоятельному существованию. Иногда комплексными частицами называют сложные химические частицы, все или часть связей в которых образованы по донорноакцепторному механизму. Комплексообразователь - центральный атом комплексной частицы. Обычно комплексообразователь - атом элемента, образующего металл, но это может быть и атом кислорода, азота, серы, йода и других элементов, образующих неметаллы. Координационный полиэдр воображаемый - молекулярный многогранник, в центре которого расположен атом-комплексообразователь, а в вершинах— частицы лигандов, непосредственно связанные с центральным атомом. Координационное число (КЧ) - число связей, образуемых центральным атомом с лигандами. Для комплексных соединений с монодентантными лигандами КЧ равно числу лигандов, а в случае полидентантных лигандов — числу таких лигандов, умноженному на дентатность. Кислота Льюиса - молекула, представляющая собой акцептор электронной пары, и поэтому способная реагировать с основанием Льюиса с 156 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. образованием аддукта путем обобществления электронной Лист 157 из 166 пары, представляемой основанием. Катод - электрод, на котором протекает процесс восстановления, принятия электронов в электрохимических процессах. Катодная защита - защищаемая деталь или конструкция присоединяется к отрицательному полюсу источника электрической энергии и становится катодом. В качестве анода используются куски металлолома, которые и окисляются, разрушаются. Квант - отдельная порция энергии, испускаемая нагретым телом. Квантовые числа - целочисленные величины, характеризующие состояние электрона в атоме. Ковалентная связь - двухэлектронная, двухцентровая связь между атомами в молекуле. Координационное число комплексообразователя - число лигандов в комплексном ионе. Комплексообразователь. Центральный атом или ион в комплексном соединении. Входит в состав комплексного иона. Контактная коррозия - коррозия при контакте двух металлов с разными потенциалами в среде электролита. В этом случае на поверхности металла образуется короткозамкнутая микрогальванопара. Концентрация - содержание вещества в единице системы. Коррозия металлов - самопроизвольное разрушение металлических Лиганды - атомы или изолированные группы атомов, располагающиеся вокруг комплексообразователя. Лигандами могут быть частицы, до образования комплексного соединения представлявшие собой молекулы (H2O, CO, NH3 и др.), анионы (OH−, Cl−, PO43− и др.), а также катион водорода. Лиофильные дисперсные системы – системы, характеризующиеся интенсивным взаимодействием дисперсной фазы с дисперсионной средой, 157 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. термодинамической устойчивостью и способностью Лист 158 из 166 образовываться самопроизвольно путем диспергирования. Лиофобные дисперсные системы – системы, характеризующиеся отсутствием или слабым взаимодействием между дисперсной фазой и дисперсионной средой, термодинамической устойчивостью и неспособностью к самопроизвольному дисперированию. Мицеллы коллоидных ПАВ – агрегаты молекул в растворе ПАВ, имеющие размеры высокодисперсных частиц, находящиеся в равновесии с растворенными молекулами ПАВ и сообщающие растворам объемные свойства. Моющее действие – совокупность коллоидно-химических процессов, которые приводят к удалению загрязнений с различных поверхностей, удержанию этих загрязнений в растворе и предотвращению их вторичного оседания на обрабатываемую поверхность. Магнитное квантовое число (m) - определяет ориентацию электронных облаков в пространстве. Оно принимает целочисленные значения в пределах от (–) l до (+) l. Материя - объективная реальность, существующая независимо от нашего сознания. Молекула - мельчайшая частица вещества, обладающая его химическими свойствами. Моль - количество вещества. Нейтрон - элементарная частица с массой 1,00867 а.е.м., не имеющая электрического заряда. Набухание – увеличение массы и объема макромолекул ВМС в результате поглощения низкомолекулярной жидкости или ее пара ой частью ядра атома. 158 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Окисление - процесс отдачи электронов в Лист 159 из 166 окислительно- восстановительной реакции. Окислитель - вещество, атомы или ионы которого принимают электроны в окислительно-восстановительных реакциях. Орбитальное квантовое число (l) - определяет энергию электрона на энергетическом подуровне и форму электронного облака. Для данного главного квантового числа nl принимает значения от 0 до (n – 1), т. е. число подуровней на уровне равно n. Обратный осмос – движение растворенных примесей через мембрану под действием внешнего давления; применяется для очистки истинных растворов. Осмос – (дисперсионной самопроизвольный среды) через процесс мембрану переноса из растворителя растворителя (менее концентрированного или коллоидного раствора) в раствор (или в более концентрированный раствор). ПАВ (поверхностно-активные вещества) – вещества, которые самопроизвольно концентрируются на поверхности раздела фаз и снижают межфазовое поверхностное натяжение. Пены – высококонцентрированные и концентрированные дисперсные системы типа Г/Ж, в которых пузырьки газа, образующие дисперсную фазу, находятся между слоями жидкости, из которой формируется дисперсионная среда. Пептизация – процесс, обратный коагуляции, т. е. Переход осадка золей во взвешенное состояние с одновременным дроблением агрегатов на отдельные частицы. Поверхностное натяжение – сила, действующая тангенциально на поверхности раздела жидкости (или другого тела) и отнесенная к единице длины контура, ограничивающего поверхность раздела фаз. 159 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 160 из 166 Полимеры – такие ВМС, макромолекулы которых состоят из большого числа повторяющихся групп или мономерных звеньев, соединенных химическими связями. Потенциал седиментации - возникает при седиментации (оседании) частиц дисперсной фазы за счет ДЭС между этими частицами и жидкой дисперсионной средой. Потенциал течения - возникает при движении жидкой дисперсионной среды за счет ДЭС между этой жидкостью и частицами дисперсной фазы. Период полураспада - Промежуток времени, в течение которого разлагается половина первоначального количества радиоактивного элемента. Позитрон - элементарная частица с массой, равной массе электрона, и положительным зарядом, равным заряду электрона по абсолютной величине. Позитрон возникает в реакции превращения протона в нейтрон. Принцип Паули - положение, запрещающее присутствие в атоме двух электронов с четырьмя одинаковыми квантовыми числами. Следствием из принципа Паули является наличие на одной орбитали не больше двух электронов. Правила Клечковского - два положения, позволяющие определить порядок заполнения электронами энергетических уровней и подуровней в атоме. Правило Гунда - определяет такой порядок заполнения электронами орбиталей в пределах подуровня, при котором абсолютное значение суммарного спина атома максимально. Протон - элементарная частица с массой 1,00728 а.е.м. и положительным зарядом, равным по абсолютной величине заряду электрона. Протон является составной частью ядра атома. 160 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Протекторная защита - защита металла от коррозии Лист 161 из 166 путем присоединения к защищаемой конструкции металла (металлический лом) с более отрицательным значением электродного Радиоактивность - самопроизвольное превращение неустойчивого изотопа одного химического элемента в изотоп другого элемента, сопровождающееся испусканием элементарных частиц или ядер. Спин - квантованная величина, связанная с собственным вращением электрона вокруг своей оси. Обозначается буквой s, принимает значения +1/2 или –1/2. Сродство к электрону - энергия, выделяющаяся при присоединении электрона к свободному атому. Стандартные условия - процесс протекает при постоянном давлении 101,3 кПа (1 атм), температуре 298 К (25 °С). Степень окисления - условный заряд атома в соединении Свободнодисперсные системы – системы, в которых частицы дисперсной фазы могут свободно перемещаться по всему объему системы. Связнодисперсные системы – системы, частицы дисперсной фазы которых образуют каркас, сообщающий этим системам прочность и другие структурно-механические свойства. Седиментация – оседание частиц дисперсной фазы в жидкой или газовой дисперсионной среде под действием гравитации. Синерезис – самопроизвольное выделение жидкости из студней и гелей, уменьшение их объема за счет упрочения каркаса, состоящего из макромолекул ВМС или высокодисперсных частиц. Смачивание – следствие адгезии жидкости к различным конденсированным телам, которое определяет форму мениска жидкости, площадь контакта и возможность растекания этой жидкости. 161 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 162 из 166 Солюбилизация – включение нерастворимых или слаборастворимых веществ (например, углеводородов и некоторых спиртов в воде) в состав мицелл коллоидных ПАВ. Студни – структурированные системы, заполненные жидкостью, каркас которых образуется из макромолекул ВМС. Суспензии -седиментационно-неустойчивые средне- и грубодисперсные системы с твердой дисперсной фазой и жидкой дисперсионной средой. Сыпучие материалы (порошки) – дисперсные системы типа Т/Г, в которых имеется непосредственный контакт между частицами дисперсной фазы. Термохимия - раздел химии, изучающий энергетические процессы реакции (выделение или поглощение тепла, выделение света, звука, электричества и др.). Тепловой эффект реакции - выделение или поглощение тепла в ходе химической реакции. Удельная поверхность – площадь, приходящаяся на единицу массы (обычно 1 кг) частиц дисперсной фазы. Удельная свободная поверхностная энергия – энергия, обусловленная нескомпенсированностью межмолекулярного взаимодействия на поверхности границы раздела фаз и характеризующая избыточную энергию поверхности. Устойчивость – способность дисперсных систем сохранять состав неизменным, если концентрация дисперсной фазы и распределение частиц по размерам остаются постоянным во времени. Химия - наука о веществах, их строении и свойствах. Химический элемент - вид атомов с одинаковым зарядом ядра. Электроосмос – перемещение дисперсионной среды под действием внешнего электрического поля. 162 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 163 из 166 Электрофорез – движение частиц дисперсной фазы под действием внешнего электрического поля. Эмульсии – дисперсные системы, дисперсная фаза и дисперсионная среда которых состоят из взаимонерастворимых или слаборастворимых жидкостей. Эквивалент - количество вещества, равное 1 молю атомов водорода. Эквивалентная масса - масса одного эквивалента вещества. Экзотермическая реакция - реакция, которая протекает с выделением тепла. Электрон - элементарная частица, обладающая зарядом 1,602·10–19 Кл, массой 9,1095·10–28 г. Электродный потенциал металла - скачок потенциала, возникающий на границе раздела фаз “металл-раствор”. Электрохимия - раздел химии, изучающий процессы, которые либо сопровождаются возникновением электрического тока, либо вызваны электрическим током. Электролиз –совокупность процессов, происходящих при прохождении постоянного электрического тока через электрохимическую систему, состоящую из двух электродов и раствора или расплава электролита. Электролит - вещество, молекулы которого распадаются на ионы. Электролитическая диссоциация - процесс распада вещества на ионы. Электрохимическая коррозия - коррозия в средах, имеющих ионную проводимость. Процесс взаимодействия металла с окислителем вызывает анодное растворение металла и катодное восстановление окислителя. Эндотермическая реакция - реакция, которая протекает с поглощением тепла. Энергия ионизации - энергия, необходимая для отрыва электрона от атома с превращением его в ион. 163 ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Разработчик: Шишлова М.А. Лист 164 из 166 Энтальпия - величина, характеризующая теплосодержание системы. Энтропия - величина, характеризующая количественную меру беспорядка в системе. Ядро атома - часть атома, состоящая из положительно заряженных протонов и не имеющих заряда нейтронов. Список использованной литературы: 1. Алексашин, А.Ю. Общая химия / А.Ю. Алексашин, Н.Е. Шпак. – М.: Дашков и К, 2010. - 256 с. 2. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М: Высшая школа, 2006. - 743 с. 3. Неорганическая химия. Физико-химические основы неорганической химии: учебник для вузов по напр. 510500 "Химия" и спец. 011000 "Химия": в 3-х т. / под ред. Ю.Д. Третьякова. – Т. 1. — М.: Академия, 2004. — 240c. 164 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 165 из 166 МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное автономное образовательное учреждение высшего профессионального образования «Дальневосточный федеральный университет» (ДВФУ) Филиал ДВФУ в г. Уссурийске ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ по дисциплине «Неорганические вещества в природе» 050100.68 «Педагогическое образование» Магистерская программа – «Химическое образование» г. Уссурийск 2012 165 Разработчик: Шишлова М.А. ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Неорганические вещества в природе Идентификационный номер: Контрольный экземпляр находится на УМКД.10(32)-050100.68кафедре естественнонаучного М2.В.ДВ.1.1-2012 образования Лист 166 из 166 Электронные информационные образовательные ресурсы http://window.edu.ru Афиногенов Ю.П., Гончаров Е.Г., Ховив А.М., Селеменев В.Ф. Химическая связь в курсе неорганической химии (Межмолекулярное взаимодействие): Учебное пособие. – Часть 5. – М., 2012. http://window.edu.ru Богомолова И.В. Неорганическая химия: учебное пособие. - М.: Альфа-М: ИНФРА-М, 2009. - 336 с. http://znanium.com Татаринцева Т.Б. Технологии синтеза моно-, биметалльных и металлокомплексных гексацианоферратов: Монография М.: НИЦ Инфра-М, 2012. – 86 с. http://window.edu.ru/ Афиногенов Ю.П., Гончаров Е.Г., Ховив А.М., Селеменев В.Ф. Химическая связь в курсе неорганической химии (Межмолекулярное взаимодействие): Учебное пособие. – Часть 5. – М., 2011. 65 с. 166