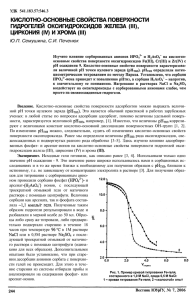
Таблица 1 – Экспериментальные результаты
реклама

ПРАКТИЧЕСКОЕ ЗАНЯТИЕ №2 Тема: Электрохимические методы анализа. Общая цель: Вам необходимо овладеть учебной программой данного занятия и научиться применять учебный материал в своей будущей профессии. 1. 2. 3. 4. Сделайте записи в рабочей тетради по плану: дата; номер занятия; тема занятия; цель занятия; основные вопросы темы. Учебные вопросы занятия: Классификация электрохимических методов анализа. Потенциометрия. Сущность и аналитические возможности метода. Прямая потенциометрия (ионометрия) и потенциометрическое титрование. Кондуктометрия. Сущность и аналитические возможности метода. Прямая кондуктометрия и кондуктометрическое титрование. Лабораторная работа Ваши действия при подготовке к занятию и отработке программы занятия При подготовке к данному занятию Повторите тему «Электрохимические методы анализа» рабочей учебной программы дисциплины «Физико-химические методы анализа в биотехнологии». Это очень важно, так как этот материал является базовой основой для получения новых знаний и на нем строится программа занятия. 1. 2. 3. 4. 5. 6. 7. Обратите внимание на: Реакции, применяемые в потенциометрическом титровании. Графические способы нахождения конечной точки титрования. Электроды в потенциометрии, требования к индикаторным электродам и электродам сравнения. Классификация электродов. Ионоселективные электроды (ИСЭ). Основные характеристики ИСЭ. Выбор электродов. Аппаратура для измерения потенциала. Электропроводность и ее зависимость от концентрации ионов в растворе. Кривые кондуктометрического титрования. Аппаратура метода. Электроды и ячейки для измерения электропроводности. Высокочастотное кондуктометрическое титрование. При отработке 1-го учебного вопроса обратите внимание на: классификацию электрохимических методов анализа. При отработке 2-го учебного вопроса обратите внимание на: реакции, применяемые в потенциометрическом титровании, графические способы нахождения конечной точки титрования, электроды в потенциометрии, требования к индикаторным электродам и электродам сравнения. При отработке 3-го учебного вопроса обратите внимание на: кривые кондуктометрического титрования, аппаратуру метода, электроды и ячейки для измерения электропроводности. При отработке 4-го учебного вопроса обратите внимание на: методику выполнения работы. Лабораторная работа КОНДУКТОМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ КОНСТАНТЫ ДИССОЦИАЦИИ УКСУСНОЙ КИСЛОТЫ Цель работы. Ознакомиться с методом прямой кондуктометрии, определить константу диссоциации уксусной кислоты. Аппаратура и материалы Кондуктометр «Эксперт», стакан 250мл, стакан 100 мл, мерный цилиндр 50 мл, мерный цилиндр 25 мл, стеклянная палочка, пипетка, раствор 0,1 M CH3COOH. Указания по технике безопасности При выполнении работы запрещается включать лабораторные установки в отсутствие преподавателя. Все приборы, входящие в состав лабораторной установки, должны быть заземлены, все электрические соединения надежно изолированы. Соблюдать меры предосторожности при работе со стеклом. Определение электропроводности раствора слабого электролита В сосуд для измерения электропроводности наливают 50 мл 0,1н. раствора слабого электролита. Последующими разбавлениями готовят 0,05; 0,025; 0,0125н. и т.д. растворы и измеряют их электропроводность. Результаты измерений записывают в таблицу: Таблица 1 – Экспериментальные результаты Исследуемый раствор 0,1M CH3COOH…Температура опыта…… Номер С, моль/л æ, λv, λ∞ -1 -1 -1 -2 измеом ·см ом ·см рения α дис. Кдис. 1 2 3 4 5 6 Эквивалентная электропроводность λ, рассчитывается по уравнению æ 1000V , где V – разведение (объем раствора, в котором содержится 1 г-экв растворенного вещества), л; 1000 V – разведение, мл. Согласно закону независимого движения ионов в разбавленных растворах (закон Кольрауша) λ∞ = λ∞+ + λ∞-, где λ∞+ и λ∞- – ионные электропроводности, при бесконечном разведении или подвижности ионов. Вычислив значения λ и λ∞ для слабого электролита, можно рассчитать его степень диссоциации и по закону разбавления Оствальда определить константу диссоциации слабого электролита. Последняя зависит от температуры, природы растворенного вещества и природы растворителя 2c 2 c K , (1 ) ( ) где с – концентрация электролита. Так как для слабых электролитов α < 1, то это позволяет преобразовать уравнение K 2c , K откуда . c На основании полученных экспериментальных данных необходимо: 1. Рассчитать эквивалентную электропроводность при бесконечном разведении для раствора слабого электролита (по табличным данным). 2. Рассчитать степень и константу диссоциации раствора слабого электролита для шести концентраций. Сравнить с табличной величиной. Рассчитать относительную погрешность эксперимента. Контрольные вопросы и защита работы 1. Можно ли при определении электропроводности пользоваться постоянным током? 2. Почему при проведении измерений необходимо термостатирование? 3. Почему при определении электропроводности надо пользоваться дистиллированной водой? 4. Играет ли роль количество жидкости, взятой для определения электропроводности? Что будет происходить, если электроды не полностью погружены в жидкость? 1. 2. 3. 4. Рекомендуемая литература: Список основной литературы: Беляев, А. П. Физическая и коллоидная химия [Текст] : учеб. для студ. вузов / А. П. Беляев, В. И. Кучук ; под ред. А. П. Беляева. - 2-е изд., перераб. и доп. - М. : ГЭОТАР-Медиа, 2012. 752 с. : табл., ил.(20) Разделы физической химии. лабораторные работы и тесты: уч. по. – Ставрополь: СтГМА, 2008.-120с. Кудряшева, Н. С. Физическая химия : [базовый курс] : учебник для бакалавров / Н.С. Кудряшева, Л.Г. Бондарева ; Сиб. федер. ун-т. – Москва : Юрайт, 2012. – 340 с. : ил. ; 21. – (Бакалавр). – Гриф: Доп. МО. – Библиогр.: с. 334-335. Горшков, В. И. Основы физической химии : учебник / В. И. Горшков, И. А. Кузнецов. – 3-е изд. – Москва : БИНОМ. Лаборатория знаний, 2009. – 407 с. : ил. – Предм. указ.: с. 395-402. Дополнительная литература: 1. Задачи по физической химии : учеб. пособие для студентов вузов / В.В. Еремин, С.И. Каргов, И.А. Успенская [и др.]. – Москва : Экзамен, 2005. – 318 с. – (Учебное пособие для вузов). – Библиогр.: с. 316-318. 2. Основы физической химии : теория и задачи : учеб. пособие для вузов / [Еремин В. В. и др.] ; Мос.гос. ун-т им. М. В. Ломоносова. – М. : Издательство "Экзамен", 2005. – 478 с. : ил. – (Классический Университетский Учебник). – Библиогр.: с. 468-470. – Предм. указ.: с. 471-478. 3. Стромберг, А. Г. Физическая химия : учебник для вузов / А. Г. Стромберг, Д. П. Семченко ; под ред. А. Г. Стромберга. – Изд. 4-е испр. – М. : Высшая школа, 2001. – 527 с. : ил. – Библиогр.: с. 511-515.