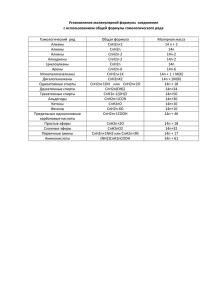
К 3 [Al(ОН) 6 ]
реклама
![К 3 [Al(ОН) 6 ]](http://s1.studylib.ru/store/data/000736995_1-ec5da85c75d78e2ec01b0a0ed67ee6af-768x994.png)
ЗАДАНИЯ ШКОЛЬНОГО ЭТАПА ОЛИМПИАДЫ 2012г. (36 баллов) 10 КЛАСС. 1. Через 2кг 9,8%-ного по массе раствора серной кислоты пропустили 67,2л (н.у.) аммиака. Определите процентную концентрацию солей в полученном растворе. Учитываем, что могут образоваться одновременно кислая и средняя соль(Подсказка: средняя соль получится при взаимодействии кислой соли с оставшимся после первой реакции аммиаком). 7 баллов 2.Перед вами в трех шкатулках находятся: в первой – натуральный и фальшивый бриллианты; во второй – натуральный и фальшивый жемчуг; в третьей – натуральное и поддельное золотое изделие. Задание: С помощью каких химических реакций можно отличить натуральные объекты? 6 баллов 3.При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. 4 балла 4. Какие массы 96%-ного и 40%-ного растворов серной кислоты потребуются для приготовления 1кг 70%-ного раствора серной кислоты, для заполнения кислотных аккумуляторов. 5 баллов 5. Предложите не менее 10 формул изомеров вещества с молекулярной формулой С5Н10Сl2. Назовите получившиеся вещества от 1 до 15 баллов 6.Составьте уравнения химических реакций, соответствующих следующей схеме превращений: К3[Al(ОН)6] Al AlС l3 Аl(ОН)3 КAlО2 1 балл за каждую реакцию ОТВЕТЫ НА ЗАДАНИЯ ШКОЛЬНОГО ЭТАПА ОЛИМПИАДЫ 2012г. 10 класс 1. Через 2кг 9,8%-ного по массе раствора серной кислоты пропустили 67,2л (н.у.) аммиака. Определите процентную концентрацию солей в полученном растворе. Учитываем, что могут образоваться одновременно кислая и средняя соль(Подсказка: средняя соль получится при взаимодействии кислой соли с оставшимся после первой реакции аммиаком). Составлено уравнение реакции: NH3 + H2SO4 = NH4HSO4 1моль 1моль (1б) 1моль определено вещество, данное в недостатке n(NH3) = 67.2/22.4= 3 моль n(H2SO4) = 9,8*2000/100*98 =2 моль (1б) рассчитана масса кислой соли : m(NH4HSO4 ) = n*M = 1*115 = 115г. (1б). оставшийся 1моль аммиака будет реагировать с кислой солью (1б) NH3 + NH4HSO4 = (NH4)2HSO4 1моль 1моль 1моль рассчитана масса средней соли : m((NH4)2HSO4) = n*M = 1*132 = 132г. рассчитана масса раствора : (1б) 2000+m(NH3)= 2000+n*M = 2000+3*17 = 2051г (1б) рассчитана W((NH4)2HSO4)= 132*100/2051 = 5,6% (0,5 б) рассчитана W(NH4HSO4)= 115*100/2051 = 6,4% (0,5 б) Всего 7 баллов 2. Перед вами в трех шкатулках находятся: в первой – натуральный и фальшивый бриллианты; во второй – натуральный и фальшивый жемчуг; в третьей – натуральное и поддельное золотое изделие. Задание: С помощью каких химических реакций можно отличить натуральные объекты? Бриллианты – правильно отшлифованные алмазы и состоят из чистого углерода. Они полностью сгорают в атмосфере кислорода с образованием только углекислого газа, поддельные бриллианты (стекло, хрусталь) либо не горят, либо при сгорании дают твердые продукты. (1б) С+О2 = СО2 (1б) Натуральный жемчуг представляет собой природную разновидность карбоната кальция, подобно всем карбонатам жемчуг растворяется в кислотах: СаСО3 +2 СН3СООН → (СН3СОО)2Са + СО2 + Н2О, (1б) поддельные жемчужины, изготовленные из стекла или пластмассы, не растворяются в кислотах, или не выделяют СО2. (1б) Чистое золото растворяется в “царской водке”, (1б) образуя желтый раствор: Au + 4HCl + HNO3 → H[AuCl4] + NO↑ + 2 H2O, (1б) 2 поддельные золотые изделия могут быть изготовлены из сплавов меди и др. веществ, они растворяются в соляной или азотной кислоте. Всего 6 баллов 3. При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. Составленна реакция в общем виде СnH2n+2 + Br2 =CnH2n+1Br + HBr (2б) n(CnH2n+2) = n(CnH2n+1Br) n(CnH2n+2)= 1,74/14n+2 n(CnH2n+1Br)= 4.11/14n+80 Правильно составлена пропорция 1,74 / (14n+2) = 4,11 / (14n+80) (1б) правильно посчитано значение n n = 4, (1 б) Ответ : C4H10 Всего 4 балла 4. Какие массы 96%-ного и 40%-ного растворов серной кислоты потребуются для приготовления 1кг 70%-ного раствора серной кислоты, для заполнения кислотных аккумуляторов. По правилу «креста»: 96% 40% 70% m (96%)= m (40%)= 1000 56 1000 56 30 26 ; 30+26=56 ∗ 30 = 535,7 г ∗ 26 = 464,3 г или m(в-ва) в 70% растворе = 1000*0,7 = 700г m (96%)р-ра = х г m(40%)р-ра =y г. m(в-ва 96%) = 0,963х г m(в-ва 40%) = 0,4у г тогда 0,96х + 0,4у = 700 х + у = 1000; х = 535,7 у = 464,3 Всего 5 баллов. 3 5. Предложите не менее 10 структурных формул изомеров вещества с молекулярной формулой С5Н10Сl2. Назовите получившиеся вещества. предложенное строение оценивается в 0,5баллов. название этого же вещества еще 0,5 баллов. , т.о. каждый названный изомер – это 1 балл 1. 1,2-дихлорпентан 2. 1,1-дихлорпентан 3. 2-метил-1,1-дихлорбутан 4. 1,4-дихлорпентан 5. 2,2-дихлорпентан 6. 2-метил-3,3-дихлорбутан 7. 1,3-дихлорпентан 8. 3,3-дихлорпентан 9. 2-метил-2,3-дихлорбутан 10. 1,5-дихлорпентан 11. 2-метил-1,4-дихлорбутан 12. 2,2-диметил-1,3-дихлорпропан 13. 2,3-дихлорпентан 14. 2-метил-1,3-дихлорбутан 15. 2,2-диметил-1,1-дихлорпропан 16. 2,4-дихлорпентан 17. 2-метил-2,4-дихлорбутан Возможно набрать более 10 баллов. 6. Составьте уравнения химических реакций, соответствующих следующей схеме превращений: К3[Al(ОН)6] Al AlС l3 Аl(ОН)3 КAlО2 2Al+6HCl → 2 AlС l3 + 3H2 AlС l3+ 3NaOH → Аl(ОН)3 + 3NaCl Аl(ОН)3+3KOH → К3[Al(ОН)6] Аl(ОН)3+KOH → КAlО2 + 2H2O Всего 4 балла. 4