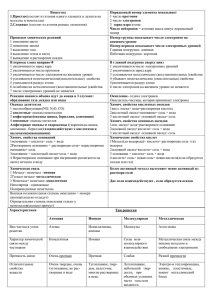
Химические свойства оснований Цель: изучить химические свойства растворимых (шелочь) и
реклама

Лабораторная работа: Химические свойства оснований Цель: изучить химические свойства растворимых (шелочь) и нерастворимых оснований. Уметь определять тип реакций и записывать уравнения химических реакций в молекулярном и ионном видах. Оборудование: штатив, пробирки, спички, спиртовка. Реактивы: NaOH, Fe2(SO4)3, KOH, CuSO4, HCl, Ba(OH)2. Ход работы: 1. Из перечня предложенных веществ выберите формулы оснований: NaOH, Fe2(SO4)3, KOH, CuSO4, SO2, HCl, Ba(OH)2, P2O5, Al(OH)3. 2. Выбранные вами формулы оснований распределите на две группы: растворимы (щелочи) и нерастворимые. 3.Выберите только одно основание для изучения химических свойств. Оно растворимое (щелочь), двухкислотное, является сильным электролитом - _________________. 3. Запомни схему «Химические свойства оснований» растворимое и Оксид неметалла (кислотный оксид) нерастворимое основание Кислота Растворимая соль нерастворимое основание Разлагается при нагревании на оксиды 4. Впишите в таблицу формулы веществ из пункта 1: Оксид неметалла (кислотный оксид) Кислота Растворимая соль 5. Реакция «кислотный оксид + основание (щелочь)» SO2 + Ba(OH)2 = BaSO3 + H2O Кислотному оксиду SO2 соответствует сернистая кислота H2SO3, значит, образуется соль сернистой кислоты – сульфит бария. Определите тип реакции, запишите уравнение в ионном виде. 6. Проведите реакцию «основание (ф/ф)+кислота». Определите тип реакции, запишите уравнение в ионном виде. 7. Проведите реакцию «растворимая соль +основание». Определите признак и тип реакции, запишите уравнение в ионном виде. Вы получили нерастворимое основание. Далее проведите реакцию разложения при нагревании. Какой признак реакции. Запишите уравнение в молекулярном виде. Вывод: Лабораторная работа: Химические свойства оснований Цель: изучить химические свойства растворимых (шелочь) и нерастворимых оснований. Уметь определять тип реакций и записывать уравнения химических реакций в молекулярном и ионном видах. Оборудование: штатив, пробирки, спички, спиртовка. Реактивы: NaOH, Fe2(SO4)3, KOH, CuSO4, HCl, Ba(OH)2. Ход работы: 1. Из перечня предложенных веществ выберите формулы оснований: NaOH, Fe2(SO4)3, KOH, CuSO4, SO2, HCl, Ba(OH)2, P2O5, Al(OH)3. 2. Выбранные вами формулы оснований распределите на две группы: растворимы (щелочи) и нерастворимые. 3.Выберите только одно основание для изучения химических свойств. Оно растворимое (щелочь), однокислотное, является сильным электролитом - _________________. 3. Запомни схему «Химические свойства оснований» растворимое и Оксид неметалла (кислотный оксид) нерастворимое основание Кислота Растворимая соль нерастворимое основание Разлагается при нагревании на оксиды 4. Впишите в таблицу формулы веществ из пункта 1: Оксид неметалла (кислотный оксид) Кислота Растворимая соль 5. Реакция «кислотный оксид + основание (щелочь)» P2O5 + NaOH = Na3PO4 + H2O Кислотному оксиду P2O5 соответствует фосфорная кислота H3PO4, значит, образуется ее соль – фосфат натрия. Расставь коэффициенты. Определи тип реакции, запиши уравнение в ионном виде. 6. Проведите реакцию «основание (ф/ф)+кислота». Определите тип реакции, запишите уравнение в ионном виде. 7. Проведите реакцию «растворимая соль +основание». Определите признак и тип реакции, запишите уравнение в ионном виде. Вы получили нерастворимое основание. Далее проведите реакцию разложения при нагревании. Какой признак реакции. Запишите уравнение в молекулярном виде. Вывод: