Nikolaeva_Bogatyrevax
реклама
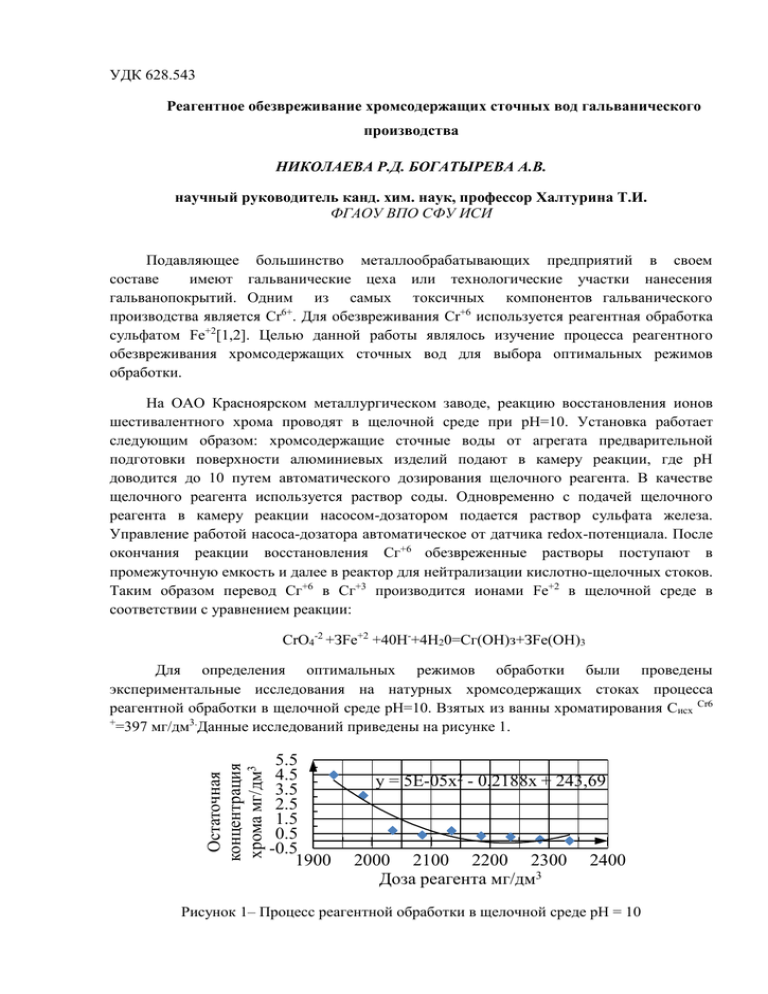
УДК 628.543 Реагентное обезвреживание хромсодержащих сточных вод гальванического производства НИКОЛАЕВА Р.Д. БОГАТЫРЕВА А.В. научный руководитель канд. хим. наук, профессор Халтурина Т.И. ФГАОУ ВПО СФУ ИСИ Подавляющее большинство металлообрабатывающих предприятий в своем составе имеют гальванические цеха или технологические участки нанесения гальванопокрытий. Одним из самых токсичных компонентов гальванического производства является Cr6+. Для обезвреживания Сr+6 используется реагентная обработка сульфатом Fе+2[1,2]. Целью данной работы являлось изучение процесса реагентного обезвреживания хромсодержащих сточных вод для выбора оптимальных режимов обработки. На ОАО Красноярском металлургическом заводе, реакцию восстановления ионов шестивалентного хрома проводят в щелочной среде при рН=10. Установка работает следующим образом: хромсодержащие сточные воды от агрегата предварительной подготовки поверхности алюминиевых изделий подают в камеру реакции, где рН доводится до 10 путем автоматического дозирования щелочного реагента. В качестве щелочного реагента используется раствор соды. Одновременно с подачей щелочного реагента в камеру реакции насосом-дозатором подается раствор сульфата железа. Управление работой насоса-дозатора автоматическое от датчика redox-потенциала. После окончания реакции восстановления Сг+6 обезвреженные растворы поступают в промежуточную емкость и далее в реактор для нейтрализации кислотно-щелочных стоков. Таким образом перевод Сг+6 в Сг+3 производится ионами Fе+2 в щелочной среде в соответствии с уравнением реакции: CrO4-2 +ЗFe+2 +40Н-+4Н20=Сг(ОН)з+ЗFе(ОН)3 Остаточная концентрация хрома мг/дм3 Для определения оптимальных режимов обработки были проведены экспериментальные исследования на натурных хромсодержащих стоках процесса реагентной обработки в щелочной среде рН=10. Взятых из ванны хроматирования Сисх Сr6 + =397 мг/дм3.Данные исследований приведены на рисунке 1. 5.5 4.5 3.5 2.5 1.5 0.5 -0.5 1900 y = 5E-05x2 - 0,2188x + 243,69 2000 2100 2200 2300 Доза реагента мг/дм3 2400 Рисунок 1– Процесс реагентной обработки в щелочной среде рН = 10 Как видно из рисунка 1, оптимальная доза FеS04 составляет 2335 мг/дм3 для концентрации ионов хрома СисхCr6+ =397 мг/дм3. т.е. на 1г ионов хрома требуется 5,9г ионов двух валентного железа Процесс обезвреживания хромсодержащих сточных вод может так же проводиться и в кислой среде (Сисх Cr6+=397 мг/дм3, рН=2,3). Химизм процесса может быть выражен с помощью уравнений: 6FeSO4 + K2Cr2O7 + 7H2SO4 = Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O Cr2(SO4)3 + 3Ca(OH)2 = 2Cr(OH)3 + 3CaSO4 Fe2(SO4)3 + 3Ca(OH)2 = 2Fe(OH)3 + 3CaSO4 Остаточная концентрация хрома мг/дм3 Данные экспериментальных исследований представлены на рисунке 2. 9 7 y = 0,0001x2 - 0,477x + 529,14 5 3 1 -11900 1950 2000 2050 2100 2150 2200 2250 2300 2350 Доза реагента мг/дм3 Рисунок 2 – Процесс обезвреживания хромстоков в кислой среде рН = 2,3 Как видно из рисунка 2, оптимальная доза FеS04 составляет 2200 мг/дм3 для концентрации ионов хрома СисхCr6+ =397 мг/дм3. т.е. на 1г ионов хрома требуется 5,5г ионов двух валентного железа. Установлено что, для проведения процесса обезвреживания хромсодержащих сточных вод в щелочной среде требуется и расход NаОН примерно в 1,7 раза больше, чем в кислой среде. Кроме того, для нейтрализации при щелочной обработке требуется расход Н2SО4 (0,9 г/дм3) для нейтрализации,что приведет к дополнительному содержанию SО42- в сточной воде. Таким образом при реагентном обезвреживании хромсодержащих сточных вод более предпочтительно является проведение процесса в кислой среде при pH=2,3 СПИСОК ЛИТЕРАТУРЫ 1. Измерова Н. Ф. Научные обзоры литературы по токсичности и опасности химических веществ. Программа ООН по окружающей среде / Под редакцией Н.Ф. Измеровой. –.М:, -1989, с 225. 2. Урецкий Е. А. Ресурсосберегающие технологии в водном хозяйстве промышленных предприятий. Монография, Брест. из-во, -2007, с 396.


