“Утверждаю” Проректор по учебной работе __________________ проф. Гуминский Ю.И.
реклама
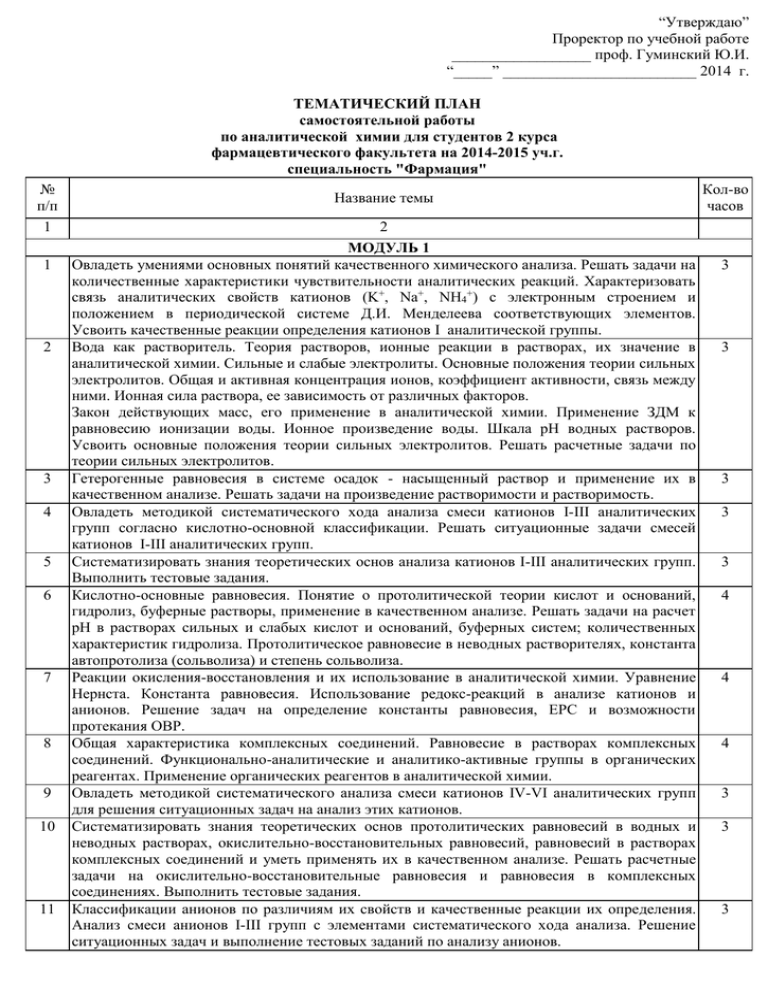
“Утверждаю” Проректор по учебной работе __________________ проф. Гуминский Ю.И. “_____” _________________________ 2014 г. ТЕМАТИЧЕСКИЙ ПЛАН самостоятельной работы по аналитической химии для студентов 2 курса фармацевтического факультета на 2014-2015 уч.г. специальность "Фармация" № п/п 1 1 2 3 4 5 6 7 8 9 10 11 Название темы 2 МОДУЛЬ 1 Овладеть умениями основных понятий качественного химического анализа. Решать задачи на количественные характеристики чувствительности аналитических реакций. Характеризовать связь аналитических свойств катионов (K+, Na+, NH4+) с электронным строением и положением в периодической системе Д.И. Менделеева соответствующих элементов. Усвоить качественные реакции определения катионов І аналитической группы. Вода как растворитель. Теория растворов, ионные реакции в растворах, их значение в аналитической химии. Сильные и слабые электролиты. Основные положения теории сильных электролитов. Общая и активная концентрация ионов, коэффициент активности, связь между ними. Ионная сила раствора, ее зависимость от различных факторов. Закон действующих масс, его применение в аналитической химии. Применение ЗДМ к равновесию ионизации воды. Ионное произведение воды. Шкала рН водных растворов. Усвоить основные положения теории сильных электролитов. Решать расчетные задачи по теории сильных электролитов. Гетерогенные равновесия в системе осадок - насыщенный раствор и применение их в качественном анализе. Решать задачи на произведение растворимости и растворимость. Овладеть методикой систематического хода анализа смеси катионов I-ІII аналитических групп согласно кислотно-основной классификации. Решать ситуационные задачи смесей катионов I-III аналитических групп. Систематизировать знания теоретических основ анализа катионов I-III аналитических групп. Выполнить тестовые задания. Кислотно-основные равновесия. Понятие о протолитической теории кислот и оснований, гидролиз, буферные растворы, применение в качественном анализе. Решать задачи на расчет рН в растворах сильных и слабых кислот и оснований, буферных систем; количественных характеристик гидролиза. Протолитическое равновесие в неводных растворителях, константа автопротолиза (сольволиза) и степень сольволиза. Реакции окисления-восстановления и их использование в аналитической химии. Уравнение Нернста. Константа равновесия. Использование редокс-реакций в анализе катионов и анионов. Решение задач на определение константы равновесия, EPC и возможности протекания ОВР. Общая характеристика комплексных соединений. Равновесие в растворах комплексных соединений. Функционально-аналитические и аналитико-активные группы в органических реагентах. Применение органических реагентов в аналитической химии. Овладеть методикой систематического анализа смеси катионов IV-VI аналитических групп для решения ситуационных задач на анализ этих катионов. Систематизировать знания теоретических основ протолитических равновесий в водных и неводных растворах, окислительно-восстановительных равновесий, равновесий в растворах комплексных соединений и уметь применять их в качественном анализе. Решать расчетные задачи на окислительно-восстановительные равновесия и равновесия в комплексных соединениях. Выполнить тестовые задания. Классификации анионов по различиям их свойств и качественные реакции их определения. Анализ смеси анионов I-III групп с элементами систематического хода анализа. Решение ситуационных задач и выполнение тестовых заданий по анализу анионов. Кол-во часов 3 3 3 3 3 4 4 4 3 3 3 1 12 13 14 2 Реакции определения анионов органических кислот: винной, бензойной, лимонной и салициловой. Условия их выполнения. Особые случаи в анализе анионов. Освоить методы разделения и концентрирования. Теоретические основы экстракции. "Содовая вытяжка", ее назначение в анализе, условия выполнения. Особенности анализа смесей веществ известного и неизвестного состава. Систематизировать знания по анализу анионов и смесей веществ, решать ситуационные задачи. Выполнить тестовые задания по анализу анионов. 3 3 2 3 Итого 44 МОДУЛЬ 2 1 Титриметрический анализ. Основные понятия. Классификация методов. Титрованные 2 растворы, их приготовление и стандартизация. Вычисления в титриметрическом анализе. 2 Кислотно-основное титрование. Первичные и вторичные стандарты. Титрования сильных 2 кислот и сильных оснований. Фиксирование КТТ. рН-индикаторы. Выбор рН-индикаторов. 3 Кислотно-основное титрование. Титрование слабых кислот щелочами и слабых оснований 5 сильными кислотами. 4 Кислотно-основное титрование. Титрование многоосновных кислот, оснований, смесей 5 кислот, оснований. 5 Кислотно-основное титрование. Титрования амфолитов. Ошибки титрования. Классификация 2 индикаторных ошибок, причины их возникновения. 6 Неводное титрование. Применение кислотно-основного титрования 7 7 Окислительно-восстановительное титрование. Перманганатометрия. 10 8 Окислительно-восстановительное титрование. Йодометрия и йодиметрия. 4 9 Окислительно-восстановительное титрование. Бромато- и бромометрическе титрование. 4 10 Окислительно-восстановительное титрование. Нитритометрия. 4 11 Окислительно-восстановительное титрование. Дихроматометрия. Цериметрия. 12 Йодхлорометрия. Йодатометрия. 12 Осадительное титрование. Аргентометрия. Меркурометрия. 8 13 Комплексиметрическое титрование. Комплексонометрия. 11 14 Гравиметрический анализ. Применение гравиметрии в анализе лекарственных препаратов. 6 Итого 82 МОДУЛЬ 3 1 Оптические методы анализа. Атомно-абсорбционная фотометрия пламени. Применение в 2 фармацевтическом анализе. 2 Оптические методы анализа. Эмиссионный спектральный анализ. Применение в 2 фармацевтическом анализе. 3 Оптические методы анализа. ИК-спектрофотометрия. Применение в фармацевтическом 2 анализе. 4 Оптические методы анализа. Нефелометрия и турбидиметрия. Применение в 2 фармацевтическом анализе. 6 Электрохимические методы анализа. Общая характеристика. Применение в фармацевтическом 2 анализе. 7 Вольтамперометрия. Кондуктометрия. Кулонометрия. 2 8 Хроматографические методы анализа. Газовая хроматография. Применение в 6 фармацевтическом анализе. Итого 18 Заведующий кафедрой фармацевтической химии доц. Ющенко Т.И.