Электрохимический ряд напряжений металлов
реклама
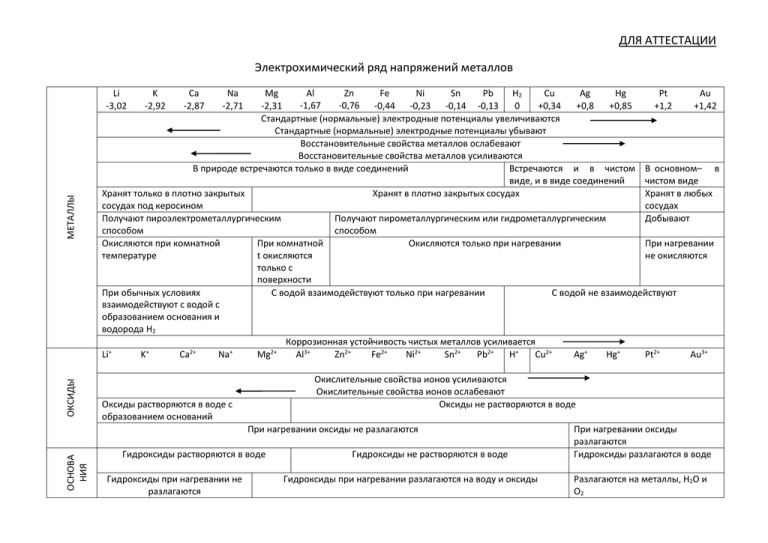
ДЛЯ АТТЕСТАЦИИ Электрохимический ряд напряжений металлов ОКСИДЫ МЕТАЛЛЫ Li -3,02 K -2,92 Ca -2,87 Na -2,71 Mg Al Zn Fe Ni Sn Pb H2 Cu Ag Hg Pt Au -1,67 -0,76 -0,44 -0,23 -0,14 -0,13 -2,31 0 +0,34 +0,8 +0,85 +1,2 +1,42 Стандартные (нормальные) электродные потенциалы увеличиваются Стандартные (нормальные) электродные потенциалы убывают Восстановительные свойства металлов ослабевают Восстановительные свойства металлов усиливаются В природе встречаются только в виде соединений Встречаются и в чистом В основном– в виде, и в виде соединений чистом виде Хранят только в плотно закрытых Хранят в плотно закрытых сосудах Хранят в любых сосудах под керосином сосудах Получают пироэлектрометаллургическим Получают пирометаллургическим или гидрометаллургическим Добывают способом способом Окисляются при комнатной При комнатной Окисляются только при нагревании При нагревании температуре t окисляются не окисляются только с поверхности При обычных условиях С водой взаимодействуют только при нагревании С водой не взаимодействуют взаимодействуют с водой с образованием основания и водорода Н2 Коррозионная устойчивость чистых металлов усиливается + + 2+ + 2+ Li K Ca Na Mg Al3+ Zn2+ Fe2+ Ni2+ Sn2+ Pb2+ H+ Cu2+ Ag+ Hg+ Pt2+ Au3+ Окислительные свойства ионов усиливаются Окислительные свойства ионов ослабевают Оксиды не растворяются в воде Оксиды растворяются в воде с образованием оснований ОСНОВА НИЯ При нагревании оксиды не разлагаются Гидроксиды растворяются в воде Гидроксиды при нагревании не разлагаются Гидроксиды не растворяются в воде Гидроксиды при нагревании разлагаются на воду и оксиды При нагревании оксиды разлагаются Гидроксиды разлагаются в воде Разлагаются на металлы, H2O и О2 СОЛИ КИСЛОТЫ Li+ K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Ni2+ Sn2+ Pb2+ H+ Cu2+ Ag+ Hg+ Pt2+ Au3+ Из растворов кислот вытесняют водород ( исключение – HNO3) Из растворов кислот не вытесняют водород Взаимодействуют с разбавленной и конц. HNO3 и в зависимости от условий, восстановительных свойств металлов, С HNO3 не концентрации кислоты образуются N2, N2O, NO, N2O3, NO2 и NH3 (NH4NO3), Al, Cr, Fe в конц. HNO3 пассивируются взаимодействую т Взаимодействуют с конц. H2SO4. В зависимости от условий и восстановительных свойств металлов образуются SO2, S, H2S С конц. H2SO4 не (Fe, Ni, и некоторые металлы в конц. H2SO4 пассивируются) взаимодействую т С разбавленной H2SO4 взаимодействуют с выделением Н2 С разб. H2SO4 не взаимодействуют С соляной кислотой взаимодействуют с выделением Н2 С соляной кислотой не взаимодействуют При нагревании нитраты При нагревании нитраты разлагаются на оксид металла, Разлагаются на металл, NO2, О2 разлагаются на нитриты и NO2 и О2 кислород Металлы вытесняют правее стоящие металлы из растворов солей и расплавов Соли, образованные сильными Соли, образованные сильными кислотами, подвергаются гидролизу по катиону с образованием кислой кислотами, не гидролизируются среды (среда нейтральная) Соли, образованные слабыми Существующие и растворимые соли, образованные слабыми кислотами, гидролизируются полностью кислотами, подвергаются (среда нейтральная) гидролизу по аниону с образованием щелочной среды При электролизе водных растворов солей на При электролизе водных растворов При электролизе водных растворов солей на катоде восстанавливаются ионы водорода солей на катоде восстанавливаются катоде восстанавливаются ионы металлов ионы водорода и ионы металлов При электролизе сначала изменяется тот катион, металл которого находится правее в электрохимическом ряду напряжний металлов + Li K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Ni2+ Sn2+ Pb2+ H+ Cu2+ Ag+ Hg+ Pt2+ Au3+ Таблица используется при изучении: химии (10 класс, профильное обучение), общей химии (11 класс), при подготовке к ЕГЭ. С помощью ее можно характеризовать свойства металлов, оксидов, оснований, кислот и солей. Распространение металлов в природе, условия хранения и способы получения. Используемая литература: В.В. Еремин, Н.Е. Кузьменко и др. «Химия 10 класс, профильный уровень» М. издательство «ДРОФА», 2008 г. Г.Е. Рудзитис, Ф.Г. Фельдман «Химия 11 класс», М. издательство «Просвещение», 2012 г. А.Е. Насонова «Химия в таблицах 8-11 класс. Справочное пособие», М. издательство «ДРОФА», 2008 г.


