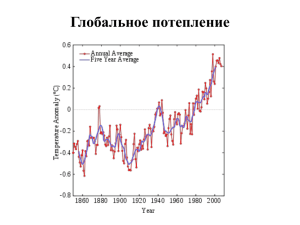
Химические свойства углерода. Углерод (C) — первый элемент главной подгруппы IV группы Периодической системы. На его высшем энергетическом уровне 4 электрона, поэтому его атомы могут принимать четыре электрона, приобретая степень окисления –4, т.е. проявлять окислительные свойства, и отдавать свои электроны, проявляя восстановительные свойства, приобретая степень окисления +4. О свойствах аллотропных модификаций алмаза и графита мы уже говорили ранее. Химические свойства углерода и его соединений обобщены в таблице. Углерод — это особый химический элемент. Он — основа многообразия органических соединений, из которых построены все живые организмы на планете. Углерод и его соединения. Углерод Соединения углерода Оксид углерода (IV) 1. Имеет аллотропные модификации: алмаз, графит, карбин, фуллерен. 2. Проявляет восстановительные свойства: а) горит в кислороде: C+O2=CO2+Q неполное сгорание: 2C+O2=2CO+Q; б) взаимодействует с оксидом углерода (IV), образуя ядовитое вещество — угарный газ: C+CO2=2CO; в) восстанавливает 1. Газ без запаха, цвета и вкуса, тяжелее воздуха. 2. Кислотный оксид. 3. При растворении взаимодействует с водой: CO2+H2O⇄H2CO3 4. Реагирует с основаниями (известковая вода при его пропускании мутнеет): CO2+Ca(OH)2=CaCO3↓+H2O 5. Реагирует с основными оксидами: CO2+CaO=CaCO3 6. Образуется в реакциях: - горения углерода в кислороде: C+O2=CO2 - окисления оксида углерода (II): Угольная кислота 1. Непрочная молекула. Слабая двухосновная кислота. Равновесие в водном растворе: 2. Взаимодействует с растворами щелочей как раствор углекислого газа в воде с образованием кислых (гидрокарбонатов) и средних (карбонатов) солей: 3. Вытесняется из солей более сильными кислотами: 4. Соли угольной кислоты подвергаются гидролизу: металлы из их оксидов: C+2CuO=CO2+2Cu Получение Неполное сжигание метана: CH4+O2=C+2H2O 2CO+O2=2CO2 - сгорания метана: CH4+2O2=CO2+2H2O - взаимодействия кислот с карбонатами: CaCO3+2HCl=CaCl2+CO2↑+H2O - термического разложения карбонатов и гидрокарбонатов: CaCO3=CaO+CO2↑ 2NaHCO3=Na2CO3+CO2↑+H2O - окислительных биохимических процессов дыхания, гниения Химические свойства кремния. Кремний (Si) — второй представитель главной подгруппы IV группы. По распространенности в природе кремний — второй после кислорода. Наиболее распространенными соединениями кремния являются диоксид кремния SiO2 — кремнезем и силикаты. Кристаллический кремний имеет структуру алмаза, очень хрупок, относится к тугоплавким веществам. При обычных условиях инертен, что объясняется прочностью его кристаллической решетки. В таблице обобщены химические свойства кремния и его соединений. Соединения кремния служат основой производства стекла и цемента. Состав оконного стекла: Na2O·CaO·6SiO2. Кремний и его соединения. Кремний Соединения кремния Оксид кремния (IV) 1. Обладает полупроводниковыми свойствами. 2. Горит в кислороде: Si+O2=SiO2+Q 1. Твердое бесцветное прозрачное вещество, легко затвердевающее в виде стекла. 2. В воде не растворяется и с водой не реагирует. Кремниевая кислота 1. Очень слабая двухосновная не растворимая в воде кислота состава 2. Разлагается уже при несильном нагревании: Получение - Восстановление оксида кремния (IV) углеродом (в промышленности): SiO2+2C=Si+2CO - порошком магния (в лаборатории): SiO2+2Mg=Si+2MgO 3. Как кислотный оксид взаимодействует с: а) щелочами: SiO2+2NaOH=Na2SiO3+H2O; б) основными оксидами: SiO2+CaO=CaSiO3 4. Вытесняет из солей летучие кислоты (реакции, лежащие в основе варки стекла): SiO2+Na2CO3=Na2SiO3+CO2↑ SiO2+CaCO3=CaSiO3+CO2↑ 3. Соли кремниевой кислоты (силикаты) подвергаются гидролизу: Получение Действие кислот на растворимые силикаты: