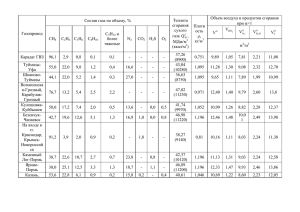
Практическое занятие № 1 Определение состава и количества продуктов сгорания, определение теплоты сгорания топлива. Цель работы : выполнить расчет на определение теплоты сгорания топлива. Ход работы: Исходные данные Таблица 1 – Состав топлива в сухой массе CH4, % C2H6, % H2, % CO, % N2, % 65 14,6 4,2 1,8 14,4 𝑛 = 1,30 – коэффициент избытка воздуха; 𝑇в = 500℃ - температура подогретого воздуха; 𝑊 = 30 г⁄м3 – влажность топлива 1) Рассчитать влажный (рабочий) состав топлива 2) Определить количество воздуха, теоретически необходимого для сжигания единицы топлива 3) Определить действительное количество воздуха, необходимое для сжигания единицы топлива 4) Рассчитать количество продуктов сгорания топлива (при заданном n) 5) Рассчитать калориметрическую температуру топлива (при заданном n) 6) Составить материальный баланс процесса горения топлива 2 1 Расчет состава влажного топлива Пересчет состава сухой массы в рабочую производится по формуле: 𝑋𝑝 = 𝑋с ∙ 100 100 + 0,1242 ∙ 𝑊 где 𝑋 с – содержание компонента X в сухом топливе, %; 0,1242 ∙ 𝑊 – содержание водяного пара в газообразном топливе влажностью 𝑊 топлива, %; 𝑋 𝑝 - содержание компонента X во влажном топливе, %. 𝐶𝐻4 𝑝 = 𝐶𝐻4 с ∙ 𝐶2 𝐻6 𝑝 = 𝐶2 𝐻6 с ∙ 100 100 = 65 ∙ = 62,56 % 100 + 0,1242 ∙ 𝑊 100 + 0,1242 ∙ 30 100 100 = 14,6 ∙ = 14,07 % 100 + 0,1242 ∙ 𝑊 100 + 0,1242 ∙ 30 𝐻2 𝑝 = 𝐻2 с ∙ 100 100 = 4,2 ∙ = 4,04% 100 + 0,1242 ∙ 𝑊 100 + 0,1242 ∙ 30 𝐶𝑂𝑝 = 𝐶𝑂с ∙ 100 100 = 1,8 ∙ = 1,73 % 100 + 0,1242 ∙ 𝑊 100 + 0,1242 ∙ 30 𝑁2 𝑝 = 𝑁2 с ∙ 100 100 = 14,4 ∙ = 13,88 % 100 + 0,1242 ∙ 𝑊 100 + 0,1242 ∙ 30 𝐻2 𝑂 = 0,1242 ∙ 𝑊 = 0,1242 ∙ 30 = 3,72 % Сумма процентного состава влажного топлива: ∑ = 𝐶𝐻4 𝑝 + 𝐶2 𝐻6 𝑝 + 𝐻2 𝑝 + 𝐶𝑂𝑝 + 𝑁2 𝑝 + 𝐻2 𝑂 ∑ = 62,56 + 14,07 + 4,04 + 1,73 + 13,88 + 3,72 = 100 % 3 2 Определение количества воздуха, теоретически необходимого для сжигания единицы топлива Количество кислорода, идущего на сжигание 1 м3 топлива, м3кисл ⁄м3топл : 𝐶H4 + 2 ∙ O2 = CO2 + 2 ∙ H2 O 1 м3 CH4 → 2м3 О2 0,6256 CH4 → 2 · 0,6266 = 1,2512 (м3кисл ⁄м3топл ); С2 H6 + 3,5 ∙ O2 = 2 ∙ CO2 + 3H2 O 1 м3 С2 H6 → 3,5 м3 О2 0,1407 м3 С2 H6 → 3,5 ∙ 0,1407 = 0,4924 (м3кисл ⁄м3топл ); CO + 0,5 ∙ O2 = CO2 1 м3 CO → 0,5 м3 О2 0,0174 м3 CO → 0,5 ∙ 0,0173 = 0,0086 (м3кисл ⁄м3топл ); H2 + 0,5 ∙ O2 = H2 O 1 м3 H2 → 0,5 м3 О2 0,0404 м3 H2 → 0,5 ∙ 0,0404 = 0,0202 (м3кисл ⁄м3топл ) Общее количество кислорода, требующееся для сжигания горючих компонентов (на 1 м3 топлива) / м3: 𝐶𝐻4 𝑝 OT2 = ∑ = O2 O2 𝐶 𝐻6 𝑝 + O22 𝑝 𝐻 𝑝 + O2𝐶𝑂 + O2 2 OT2 = 1,2512 + 0,4924 + 0,0086 + 0,0202 = 1,7724 Расход азота, содержащегося в воздухе на 1 м3 топлива / м3 N2T = OT2 ∙ K = 1,7724 ∙ 3,762 = 6,6678 (м3) где К– соотношение объёмных процентов содержания азота и кислорода (%), 4 К= 79 = 3,762 21 Теоретический объем воздуха, необходимый для сжигания 1 м3 топлива: VBт = Oт2 + N2т = 1,7724 + 6,6678 = 8,4402 (м3воз ⁄м3топл ) 5 3 Определение действительного расхода воздуха, необходимого для сжигания 1 м3 топлива Oд2 = OT2 · n (м3 ⁄м3топл ) N2д = N2T · n (м3 ⁄м3топл ) VBд = Oд2 + N2д (м3воз ⁄м3топл ) где 𝑛 – коэффициент избытка воздуха. Oд2 = 1,7724 · 1,30 = 2,304 (м3 ⁄м3топл ) N2д = 6,6678 · 1,30 = 8,668 (м3 ⁄м3топл ) VBд = 2,304 + 8,668 = 10,972 (м3воз ⁄м3топл ) 6 4 Расчет количества продуктов сгорания при сжигании 1 м3 топлива Расчет состава и продуктов горения при сжигании: 1 CH4 + 2 O2 → 1 CO2 + 2 H2 O 0,6256 м3 CH4 → 0,6256 м3 CO2 + 1,2512 м3 H2 O 1 C2 H6 + 3,5 O2 → 2 CO2 + 3 H2 O 0,1407 м3 C2 H6 → 0,2814 м3 CO2 + 0,4221 м3 H2 O 1 CO + 0,5 O2 → 1 CO2 0,0173 м3 CO → 0,0173 м3 CO2 1 H2 + 0,5 O2 → 1 H2 O 0,0404 м3 H2 → 0,0404 м3 H2 O Количество избыточного кислорода, полностью перешедшего в продукты сгорания: O2 вых = Oд2 − OT2 = 2,304 − 1,7724 = 0,5316 (м3). Содержание азота после сгорания топлива: N2 вых = N2 вл + N2д = 0,1388 + 8,668 = 8,8068 (м3). Количество продуктов сгорания, образующихся при сжигании 1 м3 топлива: VП.С = ∑ CO2 + ∑ H2 O + O2 вых + N2 вых = (0,6256 + 0,2814 + 0,0173) + (1,2512 + 0,4221 + 0,0404) + 0,5316 + 8,8068 = 11,9784 (м3П.С. ⁄м3топл ) Vco2 = 0,6256+0,2814+0,0173 = 0,9243 VH2o = 1,2512+0,4221+0,0404 = 1,7137 Химический состав продуктов горения: CO2 = 𝑉𝐶𝑂2 0,9243 ∙ 100% = · 100% = 7,7163% Vпс 11,9784 7 𝑉𝐻2𝑂 1,7137 ∙ 100% = · 100% = 14,3232 % Vпс 11,9784 H2 O = N2 = 𝑉𝑁2 8,8068 ∙ 100% = · 100% = 73,5223 % Vпс 11,9784 O2 = 𝑉𝑂2 0,5316 ∙ 100% = · 100% = 4,4382 % Vпс 11,9784 Контроль: ∑ = 7,7163 + 14,3232 + 73,5223 + 4,4382 = 100 % 8 5 Расчет калориметрической температуры горения топлива Низшая теплота сгорания рабочего топлива: вл вл вл вл QPH = QCH4 · nвл CH4 + Q С2 H6 ∙ nC2 H6 + Q CO · nCO + Q H2 · nH2 = 35,82 · 0,6256 + 63,75 · 0,1407 + 12,64 · 0,0173 + 10,76 · 0,0404 = 30,03 (МДж/м3) где QCH4 – низшая теплота сгорания метана, QCH4 = 35,82 (МДж/м3 ); вл nвл CH4 − доля метана в рабочей массе газообразного топлива, nCH4 = 0,6256 Q С2 H6 – низшая теплота сгорания этана, QС2 H6 = 63,75 (МДж/м3 ); вл nвл C2 H6 – доля этана в рабочей массе газообразного топлива, nC2 H6 = 0,1407 QCO – низшая теплота сгорания угарного газа, QCO = 12,64 (МДж/м3 ); вл nвл CO – доля угарного газа в рабочей массе газообразного топлива, nCO = 0,0173 3 Qвл H2 – низшая теплота сгорания водорода, Q H2 = 10,76 (МДж/м ); вл nвл H2 – доля водорода в рабочей массе газообразного топлива, nH2 = 0,0404 Физическая теплота подогретого воздуха: Qвф = VBд ∙ 𝐶𝐵 ∙ 𝑇в , где 𝑇в −температура воздуха; 𝐶𝐵 − удельная теплоемкость воздуха при 𝑇в , 𝐶𝐵 (при 𝑇в = 500 ℃) = 1,093 кДЖ/ (м3 ∙ 𝐾). Qвф = 10,972 ∙ 1,093 ∙ 773 = 9270,122 (кДЖ/м3 ) = 9,270 (МДж/м3 ) Расчет калориметрической температуры методом последовательного приближения: Tк = QPH + Qвф VПС · СПС Тк · СПС = QPH + Qвф VПС 9 = i0 i0 = в QP H +Qф VПС = 30,03+9,270 11,9784 = 3,461 (МДж/м3) Энтальпия при калориметрической температуре 2100 ºC T1 = 2100 ºC i1 = i1CO2 · n1CO2 + i1H2 O · n1H2 O + i1O2 · n1O2 + i1N2 · n1N2 , (МДж/м3) где i1CO2 – энтальпия углекислого газа при калориметрической температуре 2100 ºC, i1CO2 = 5,186 (МДж/м3 ); n1CO2 – доля углекислого газа в продуктах сгорания, n1CO2 = 0,077163; i1H2 O – энтальпия воды при калориметрической температуре 2100 ºC, i1H2 O = 4,121 (МДж/м3 ); n1H2 O – доля воды в продуктах сгорания, n1H2 O = 0,143232; i1O2 – энтальпия кислорода при калориметрической температуре 2100 ºC, i1O2 = 3,314 (МДж/м3 ); n1O2 – доля кислорода в продуктах сгорания, n1O2 = 0,044382; i1N2 – энтальпия азота при калориметрической температуре 2100 ºC, i1N2 = 3,131 (МДж/м3 ); n1N2 – доля азота в продуктах сгорания, n1N2 = 0,735223. i1 = 5,186 ∙ 0,077163 + 4,121 ∙ 0,143232 + 3,314 ∙ 0,044382 + 3,131 ∙ 0,735223 = 3,439 (МДж/м3 ) Энтальпия при калориметрической температуре 2200 ºC T1 = 2200 ºC i2 = i2CO2 · n2CO2 + i2H2 O · n2H2 O + i2O2 · n2O2 + i2N2 · n2N2 , (МДж/м3) где i2CO2 – энтальпия углекислого газа при калориметрической температуре 2200 ºC i2CO2 = 5,464 (МДж/м3 ); n2CO2 – доля углекислого газа в продуктах сгорания, n2CO2 = 0,077163; 10 i2H2 O – энтальпия воды при калориметрической температуре 2200 ºC, i2H2 O = 4,358 (МДж/м3 ); n2H2 O – доля воды в продуктах сгорания, n2H2 O = 0,143232; i2O2 – энтальпия кислорода при калориметрической температуре 2200 ºC, i2O2 = 3,487 (МДж/м3 ); n2O2 – доля кислорода в продуктах сгорания, n2O2 = 0,044382; i2N2 – энтальпия азота при калориметрической температуре 2200 ºC, i2N2 = 3,295 (МДж/м3 ); nN2 – доля азота в продуктах сгорания, nN2 = 0,735223. i2 = 5,464 ∙ 0,077163 + 4,358 ∙ 0,143232 + 3,487 ∙ 0,044382 + 3,295 ∙ 0,735223 = 3,624 (МДж/м3 ) i0 = 3,461 (МДж/м3 ) оказалась между i1 = 3,439 (МДж/м3 ) и i2 = 3,624 (МДж/ м3 ).По правилу интерполяции находится Tk . i −i Tk = i0 −i1 · ∆T + T1, (ºC) 2 1 где ΔT – разность между первой и второй заданными калориметрическими температурами ∆T = 2200 − 2100 = 100ºС Tk = 3,461−3,439 3,624−3,439 · 100 + 2100 = 2111,89 (ºC) 11 6 Материальный баланс процесса горения топлива Количество метана, вступившего в реакцию: 𝑛𝐶𝐻4 (вл) ∙М𝐶𝐻4 CH4 = 𝑉м (г/м3) где М𝐶𝐻4 − молярная масса метана (г/моль), М𝐶𝐻4 = 16 г/моль; 𝑉м − стандартный молярный объём (м3/моль), 𝑉м = 22,4 м3 /моль; 𝑛𝐶𝐻4 (вл) − доля метана, вступающего в реакцию. 0,6256∙16 CH4 = 22,4 = 0,4469 (г/м3) Количество этана, вступившего в реакцию: C2 H6 = 𝑛𝐶2 𝐻6 (вл) ∙𝑀𝐶2 𝐻6 𝑉м (г/м3) где 𝑀𝐶2 𝐻6 − молярная масса этана (г/моль), 𝑀𝐶2 𝐻6 = 30 г/моль; 𝑛𝐶2 𝐻6 (вл) − доля этана, вступающего в реакцию. C2 H6 = 0,1407∙30 22,4 = 0,1884 (г/м3) Количество угарного газа, вступившего в реакцию: 𝐶𝑂 = 𝑛𝐶𝑂(вл) ∙𝑀𝐶𝑂 𝑉м (г/м3) где 𝑀𝐶𝑂 − молярная масса угарного газа (г/моль), 𝑀𝐶𝑂 = 28 г/моль; 𝑛𝐶𝑂(вл) − доля угарного газа, вступающего в реакцию. 𝐶𝑂 = 0,0173∙28 22,4 12 = 0,0216 (г/м3) Количество водорода, вступившего в реакцию: 𝐻2 = 𝑛𝐻2 (вл) ∙𝑀𝐻2 𝑉м , (г/м3) H2 где 𝑀𝐻2 – молярная масса водорода (г/моль), 𝑀𝐻2 = 2 г/моль; 𝑛𝐻2 (вл) − доля водорода, вступающего в реакцию с горючим топливом; H2 = 0,0404∙2 22,4 = 0,0036 (г/м3) Масса веществ, вступивших в реакцию: ∑ = 0,4469 + 0,1884 + 0,0216 + 0,0036 = 0,6605 (г/м3) Количество углекислого газа, вышедшего из реакции: CO2 = ∑ 𝑛𝐶𝑂2 ∙𝑀𝐶𝑂2 𝑉м , (г/м3) где 𝑛𝐶𝑂2 −доля углекислого газа, вышедшего из реакции; 𝑀𝐶𝑂2 − молярная масса углекислого газа (г/моль), 𝑀𝐶𝑂2 = 44 г/моль. CO2 = 0,0772∙44 22,4 = 0,0152 (г/м3) Количество водяного пара, вышедшего из реакции: 𝐻2 O = ∑ 𝑛𝐻2 O ∙𝑀𝐻2 O 𝑉м , (г/м3) где 𝑛𝐻2 O −доля водяного пара, вышедшего из реакции; 𝑀𝐻2 O − молярная масса водяного пара (г/моль), 𝑀𝐻2 O = 18 г/моль. 𝐻2 O = 0,1432∙18 22,4 Количество азота: 13 = 0,1151 (г/м3) 𝑁2 = ∑ 𝑛𝑁2 ∙𝑀𝑁2 𝑉м , (г/м3) где 𝑛𝑁2 −доля азота; 𝑀𝑁2 − молярная масса азота (г/моль), 𝑀𝑁2 = 28 г/моль. 𝑁2 = 0,7352∙28 22,4 = 0,4683 (г/м3) Количество кислорода: 𝑂2 = ∑ 𝑛𝑂2 ∙𝑀𝑂2 𝑉м , (г/м3) где 𝑛𝑂2 −доля кислорода; 𝑀𝑂2 − молярная масса кислорода (г/моль),𝑀𝑂2 = 32 г/моль. 𝑂2 = 0.0444∙32 22,4 = 0,0634 (г/м3) Масса веществ, вышедших из реакции: ∑ = 0,0152 + 0,1151 + 0,4683 + 0,0634 = 0,662 Невязка баланса: δ= 0,662 − 0,6605 A-Б · 100% = · 100 % = 0,241 % 0,662 А Из-за округления расчетных величин допускается величина невязки не более 0,5 %. Вывод: поскольку δ = 0,241 % < 0,5 %, следовательно, расчёт горения топлива выполнен верно. 14 Порядок выполнения работы: 1. Ознакомиться с примером расчета 2. Выполнить расчет на основе своих данных 3. Сформировать вывод 4. Ответить на контрольные вопросы Контрольные вопросы 1. низшая теплота сгорания это? 2. ΔT это? 3. Как определить количество водорода? 4. Какой буквой обозначается величина невязки? 5. Как определить энтальпию? 15 16