Министерство Российской Федерации
по делам гражданской обороны, чрезвычайных ситуаций
и ликвидации последствий стихийных бедствий
_______
САНКТ-ПЕТЕРБУРГСКИЙ УНИВЕРСИТЕТ
ГОСУДАРСТВЕННОЙ ПРОТИВОПОЖАРНОЙ СЛУЖБЫ
В.Р. Малинин, В.И. Климкин, С.В. Аникеев,
Е.Г. Коробейникова, Н.Г. Винокурова, Н.Ю. Кожевникова,
А.А.Мельник, В.А.Родионов
ТЕОРИЯ ГОРЕНИЯ И ВЗРЫВА
Учебник для вузов
МЧС России
по специальности 280104.65 – пожарная безопасность
проект
Санкт-Петербург
2007
2
В.Р.Малинин, В.И. Климкин, С.В. Аникеев, Е.Г.Коробейникова,
Н.Г.Винокурова, Н.Ю.Кожевникова, А.А.Мельник, В.А.Родионов. Теория
горения и взрыва. Учебник для вузов МЧС России по специальности
280104.65 – пожарная безопасность /Под. ред. проф. В.С. Артамонова/. СПб.:
Санкт-Петербургский университет ГПС МЧС России, 2007. – 293 с.
Учебник соответствует требованиям Государственного образовательного стандарта
по дисциплине ТГиВ для специальности 280104.65 – "Пожарная безопасность" и включает
необходимый объем общих знаний по фундаментальным законам теории горения и
взрыва и специальных знаний по возникновению горения и взыва в разных средах. В
каждую главу включены расчетные задачи с подробным разбором методики их решения, а
также вопросы для самоконтроля.
Рецензенты: И.Д. Чешко, доктор технических наук, профессор,
(ФГУ ВНИИПО МЧС России);
А.И. Лукашевич (Главное управление МЧС России
по г. Москве)
Санкт-Петербургский университет
ГПС МЧС России, 2007
3
100-летию Санкт-Петербургского
университета Государственной
противопожарной службы
МСЧ России посвящается
ПРЕДИСЛОВИЕ
Данный учебник представляет собой попытку систематического изложения физико-химических основ процессов горения и взрыва, знание которых необходимо для плодотворной творческой деятельности инженерных
кадров Государственной противопожарной службы МЧС России.
Основой для выбора содержания учебника явились требования Государственного образовательного стандарта высшего профессионального образования, примерная программы по дисциплине "Теория горения и взрыва"
федерального компонента цикла ОПД ГОС ВПО второго поколения по специальности 280104.65 – "Пожарная безопасность".
Цель курса "Теории горения и взрыва" - заложить основу для профессиональной подготовки пожарного специалиста, дать необходимый объем
общих знаний по фундаментальным законам возникновения и развития горения и специальных знаний по видам и классификации взрывов.
Материал учебника излагается в традиционной последовательности. Он
включает в себя пять разделов, двенадцать глав, содержание которых составляет весь необходимый для инженера объем знаний по теории горения и
взрыва. Общая редакция учебника проведена д.т.н., профессором Артамоновым В.С.
Авторы выражают искреннюю благодарность рецензентам д.т.н., профессору Чешко И.Д. и А.И. Лукашевичу за внимательное прочтение работы,
а также всем сотрудникам кафедры физико-химических основ процессов горения и тушения Санкт-Петербургского университета ГПС МЧС России за
помощь в подготовке рукописи к изданию.
4
СОДЕРЖАНИЕ
Введение
I. ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ ГОРЕНИЯ
1. Горение – основной процесс на пожаре ………………………….
1.1. Определение горения ………………………………………………..
1.2. Характеристика участников процесса горения ……………………
1.3. Основные процессы, происходящие при горении. Виды горения...
1.4. Опасные факторы пожара ……………………………………………
2. Материальный баланс процессов горения ………………………
2.1. Расчет объема воздуха, необходимого для горения ……………….
2.1.1. Горючее – индивидуальное химическое соединение ……………...
2.1.2. Горючее – смесь газов и паров ………………………………………
2.1.3. Горючее – сложное вещество с известным элементным составом..
2.2. Расчет объема и процентного состава продуктов горения ………...
2.2.1. Горючее – индивидуальное химическое соединение ……………...
2.2.2. Горючее – смесь газов и паров ………………………………………
2.2.3. Горючее – сложное вещество с известным элементным составом..
2.3. Продукты сгорания. Дым и его характеристики …………………...
3. Тепловой баланс процессов горения ……………………………..
3.1. Уравнение теплового баланса процесса горения …………………..
3.2. Расчет теплоты горения ……………………………………………...
3.3. Расчет температуры горения ………………………………………...
II. ТЕОРИИ ГОРЕНИЯ
4. Тепловая, цепная и диффузионная теории горения ……………
4.1. Тепловая теория горения ……………………………………………
4.1.1. Механизм химических реакций при горении ………………………
4.1.2. Факторы, влияющие на скорость реакций горения ………………..
4.2. Цепная теория горения ………………………………………………
4.3. Диффузионная теория горения ……………………………………...
III. ВИДЫ ПЛАМЕНИ И СКОРОСТИ ЕГО РАСПРОСТРАНИЯ
5. Пламя и его распространение в пространстве
5.1. Виды пламени ………………………………………………………...
5.2. Структура пламени …………………………………………………..
5.3. Процессы, протекающие в пламени ……....………………………..
5.4. Скорость распространения пламени ………………………………..
5.4.1. Факторы, влияющие на скорость реакций распространения
пламени ……………………………………………………………….
5.5. Характер свечения пламени …………………………………………
IV. УСЛОВИЯ ВОЗНИКНОВЕНИЯ И РАЗВИТИЯ ПРОЦЕССОВ
ГОРЕНИЯ
IV.I. ВОЗНИКНОВЕНИЕ ГОРЕНИЯ
6. Самовоспламенение ………………………………………………...
6.1. Радикально-цепной механизм процессов окисления и его основные закономерности …………………………………………
6.2. Элементы тепловой теории самовоспламенения горючих смесей
6.3. Температура самовоспламенения как показатель пожарной опасности, практическое значение и методы ее определения ……
7. Самовозгорание …………………………………………………….
7.1. Механизм процесса самовозгорания веществ ……………………..
7.2. Самовозгорание жиров и масел …………………………………….
7.3. Самовозгорание химических веществ ………………………………
8
17
17
17
19
23
26
28
32
35
36
37
39
40
41
43
47
57
57
58
61
69
63
63
71
73
76
79
83
83
83
85
90
92
97
103
106
106
106
106
110
114
121
121
127
131
8.
8.1.
8.2.
8.3.
8.4.
8.5.
8.6.
8.7.
8.8.
8.9.
8.10.
IV.II.
9.
9.1.
9.2.
9.2.1.
9.2.2.
9.2.3.
9.2.4.
10.
10.1.
10.2.
10.3.
10.4.
10.5.
10.6.
10.7.
10.8.
11.
11.1.
11.2.
11.3.
11.4.
11.5.
11.6.
V.
12.
12.1.
12.2.
12.3.
12.4.
12.5.
12.6.
12.6.1.
Вынужденное воспламенение (зажигание) ………………………
Понятие «источник зажигания» и его значение для обеспечения
пожарной безопасности ……………………………………………...
Закономерности перехода самовоспламенения к зажиганию ……..
Зажигание нагретым телом ………………………………………….
Элементы тепловой теории зажигания ……………………………..
Особенности зажигания газопаровоздушных смесей нагретой поверхностью …………………………………………………………
Элементы тепловой теории зажигания электрической искрой …...
Минимальная энергия зажигания, зависимость ее от некоторых
параметров, практическое применение …………………………….
Зажигание твердых и жидких горючих веществ …………………..
Зажигание лучистым тепловым потоком …………………………...
Основные виды и характеристики источников зажигания ………..
РАЗВИТИЕ ПРОЦЕССОВ ГОРЕНИЯ
Горение газопаровоздушных смесей ……………………………..
Концентрационные пределы распространения пламени
Факторы, влияющие на КПР ………………………………………...
Зависимость КПР от химической природы горючего ……………..
Влияние начальной температуры смеси на КПР …………………...
Влияние давления горючей смеси на КПР …………………………
Влияние флегматизаторов и ингибиторов на КПР ………………...
Горение жидкостей ………………………………………………….
Условия для возникновения горения жидкостей …………………..
Температурные пределы распространения пламени ………………
Скорость испарения жидкостей ……………………………………..
Температура вспышки. Температура воспламенения жидкостей…
Механизм теплового распространения горения жидкостей ………
Основные характеристики горения жидкостей …………………….
Распределение температуры в горящей жидкости ………………...
Вскипание и выброс при горении резервуаров с ГЖ ……………...
Горение твердых веществ и материалов ………………………...
Физико-химические основы процессов термического
разложения твердых веществ и материалов ………………………..
Основные закономерности процессов горения органических
твердых горючих материалов ……………………………………….
Основные характеристики возникновения, распространения
пламени и горения твердых органических веществ ……………….
Гетерогенное горение ………………………………………………..
Горение металлов …………………………………………………….
Особенности горения пылевидных веществ ………………………..
ВЗРЫВЫ
Взрывы. Ударные волны и детонация …………………………...
Основные определения. Типы взрывов………………….
Закономерности взрывных процессов паровоздушных смесей …..
Энергия и мощность взрыва. Тротиловый эквивалент ……………
Основные свойства и параметры ударной волны ………………….
Условия возникновения детонации и зажигания ударной волной...
Взрывчатые вещества . …………………….......................................
Краткие сведения об основных взрывчатых веществах …………...
ПРИЛОЖЕНИЯ
136
137
139
140
143
147
150
157
158
160
163
169
169
169
173
173
174
175
176
182
182
187
190
192
197
203
205
209
214
214
222
227
233
238
241
245
245
245
247
253
265
268
276
279
287
Литература
292
Список расчетных задач
№ задачи
Задача
Расчет коэффициента горючести
Составление уравнений реакции горения в кислороде
Составление уравнений реакции горения в воздухе
Расчет молей (киломолей) исходных веществ и продуктов реакции
по уравнению реакции горения
2.4. Расчет теоретического объема воздуха, необходимого для горения
индивидуального вещества
2.5. Расчет объема воздуха, необходимого для горения индивидуального
вещества
2.6. Расчет объема воздуха, необходимого для горения газовой смеси
1.1.
2.1.
2.2.
2.3.
2.7. Расчет объема воздуха, необходимого для горения вещества сложного
элементного состава
2.8. Расчет объема и процентного состава продуктов горения индивидуального вещества
2.9. Расчет объема и процентного состава продуктов горения газовой смеси
2.10. Расчет объема и процентного состава продуктов горения вещества
сложного элементного состава
3.1. Расчет теплового эффекта реакции горения индивидуального вещества
3.2. Перевод значения энтальпии горения из кДж/моль в кДж/кг
3.3. Расчет низшей теплоты сгорания Q н по формуле Д.И. Менделеева
3.4. Расчет действительной температуры горения индивидуального вещества
3.5. Расчет действительной температуры горения сложного вещества с
известным элементным составом
5.1. Расчет стехиометрической концентрации
5.2. Определение характера свечения пламени
6.1. Зависимость температуры самовоспламенения от величины удельной
поверхности
7.1. Условия теплового самовозгорания
7.2. Расчет иодного числа жиров и масел
9.1. Расчет концентрационных пределов распространения пламени по
аппроксимационной формуле
9.2. Расчет КПР по известным энтальпиям образования веществ
9.3. Расчет КПР газовой смеси
9.4. Расчет КПР при повышенных температурах
9.5. Расчет размеров зон, ограниченных НКПР газов и паров
9.6. Расчет безопасных концентраций газов и паров с использованием коэффициентов безопасности
10.1. Расчет давления насыщенного пара по уравнению Антуана
10.2. Расчет объемной концентрации паров по давлению насыщенного пара
10.3. Вычисление объемной доли и объема пара в паровоздушной смеси
10.4. Расчет ТПР по данным уравнения Антуана
10.5. Расчет ТПР по структурной формуле вещества
10.6. Расчет скорости испарения и массы испарившейся жидкости
Стр.
21
28
30
31
35
36
37
39
40
42
46
59
60
60
66
68
101
104
117
126
130
170
171
172
175
179
180
185
185
187
188
190
192
7
10.7.
10.8.
10.9.
10.10.
12.1.
12.2.
12.3.
12.4.
12.5.
12.6.
Расчет температуры вспышки по структурной формуле
Расчет температуры вспышки некоторых классов органических веществ
Расчет температуры воспламенения по структурной формуле
Расчет температуры воспламенения спиртов и сложных эфиров
Расчет максимального давления взрыва газов и паров
Расчет максимального давления взрыва пылей
Расчет избыточного давления взрыва газов и паров
Расчет избыточного давления взрыва пылей
Расчет тротилового эквивалента взрыва
Определение радиусов зон разрушений
194
195
196
197
254
254
257
260
263
264
8
ВВЕДЕНИЕ
Огонь – это явление природы, которому во многом люди обязаны
развитию своей цивилизации, начиная с раннего периода истории человечества. Археологи установили, что люди стали пользоваться огнем 60000
лет назад, а научились получать огонь около 30000 лет назад. С огнем связаны многие ранние мифы и легенды. Нельзя не вспомнить миф о Прометее, похитившем огонь у богов и отдавшем его людям.
Огонь был первым источником энергии первобытного человека. По
мере эволюции человек эмпирически познавал процессы горения, находил
и применял новые виды горючего, открывал термические процессы, протекающие под воздействием теплоты горения, необходимые ему для удовлетворения своих нужд – приготовления пищи, выплавке металлов, изготовлению керамики, стекла и многое другое. Без применения процессов
горения человечество так и осталось бы в каменном веке, после которого
никогда бы не наступил ни бронзовый, ни железный век.
Поэтому огонь привлекал внимание ученых, начиная с глубокой
древности. Так еще в V веке до н.э. Эмпедокл утверждал, что существуют 4
начала всех вещей – огонь, воздух, вода и земля, считая их материальными
субстанциями. Возможно, такие представления были заимствованы им из
древнеиндийских и древнекитайских философских учений.
В IV веке до н.э. древнегреческий философ Аристотель, признавая
эти начала, дополнил их пятым принципом – «существо», но он считал их
не материальными субстанциями, а лишь носителями некоторых основных
свойств веществ, ощущаемых человеком при помощи осязания: теплоты,
холода, сухости, влажности.
Долгое время представления об огне и горении оставались столь же
9
наивными с точки зрения современной науки. Так в XIII веке Фома Аквин-
ский утверждал, что, если тело подвергается действию огня, то оно становится горячим, принимая на некоторое время «форму тепла». В зависимости от того, восприняло ли оно эту форму полностью или нет, тело охлаждалось при удалении огня или улавливало огонь и, таким образом, могло
передавать эту форму другим телам.
Развитие цивилизации требовало все больше энергии, которая получалась, в основном, за счет сжигания древесины, запасы которой были
не безграничны. Кроме того, расширялась выплавка различных металлов
путем обжига руд, которая также была малоэффективной из-за образования большого количества окалины.
Начало научных разработок, и исследования процессов горения
следует отнести к 1660 году к экспериментам представителей оксфордской
школы во главе с Робертом Бойлем, отбросившим идеализм древнегреческих натурфилософов, считавших, что «пламя - это элемент».
Однако во времена Бойля связь науки с практической деятельностью человечества была слабая.
Только к концу XVII века стала отчетливо проявляться потребность
свести многообразные изменения веществ, которые происходят в процессе
горения, к одному общему принципу.
Это обусловило то, что в XVII веке немецким ученым Георгом Шта-
лем была создана теория флогистона, установившая глубинную связь между процессами горения и окисления. Флогистон (термин происходит от
греческого слова ϕλογιστον - горючий) – некоторый абстрактный принцип горючести, который становится «горючей субстанцией» только тогда,
когда находится в сложном теле в сочетании с другими веществами. Шталь
10
предполагал, что при нагревании сложных тел флогистон улетучивается и,
соединяясь с воздухом, воспламеняется. Однако этому противоречили
факты об увеличении массы металлов при их нагревании на воздухе, поэтому последователи флогистона объясняли это тем, что флогистон имеет
отрицательный вес, поэтому при прокаливании металлов в воздухе, когда
удаляется флогистон, остаток обжигаемого металла становится более тяжелым.
Несмотря на все отмечаемые противоречия, теория флогистона просуществовала более 100 лет.
А.Лавуазье отмечал, что она получила столь широкое распространение потому, что на ее основе были сделаны два важных открытия. Одно
из них состоит в установлении факта, что металлы – тела горючие и превращение их в окалины представляет явление горения, второе – в том, что
свойство гореть или быть воспламеняемым может передаваться от одного
тела к другому.
Окончательная победа над заблуждениями теории о флогистоне и
переход исследований в области горения на правильную научную основу
стало возможным только лишь в середине XVIII века в результате бурного
развития химии газов и первым ученым, подвергшим основательной и аргументированной критике теорию флогистона был М.В.Ломоносов. Он
впервые показал, что горение – это реакция химического взаимодействия
вещества с воздухом.
В дальнейшем практически одновременно с Дж.Пристли и К.В.Шееле
А.Лавуазье получил кислород, установил его химическую природу и способность соединяться с фосфором и серой при горении и металлами при
окислении, правильно объяснил процессы горения и окисления и создал
11
основы кислородной теории.
А.Лавуазье впервые установил, что воздух имеет сложный состав и
состоит из «живительного» воздуха (кислорода) и инертной его части (азота), которая не поддерживает горение и не пригодна для дыхания. В 1777
году в мемуаре «О горении вообще» он дал следующее определение явления горения:
«Первое явление. При всяком горении происходит выделение огненной материи или света.
Второе явление. Тела могут гореть только в очень немногих видах
воздуха или, вернее, горение может происходить в одном виде воздуха, который я буду называть «чистым воздухом». Тела, которые мы называем горючими, не только не горят в пустоте или каком-либо другом воздухе, но
там они гаснут так быстро, как если бы их погрузили в воду или любую
другую жидкость.
Третье явление. При всяком горении происходит разрушение или
разложение чистого воздуха, и вес сгоревшего тела увеличивается точно на
количество поглощенного воздуха.
Четвертое явление. При всяком горении горящее тело превращается
… в результате прибавления того вещества, которое увеличивает его
вес…».
25 мая 1812 года в Англии на одной из угольных шахт произошел
взрыв, унесший жизнь 92 человек. После этой катастрофы в городе Андерленде (Англия) было учреждено общество по предотвращению аварий на
угольных шахтах. А двумя годами позже, в 1814 году, по поручению этого
общества в Королевском научном обществе сэром Хэмфри Дэви был выполнен ряд исследований пламени. В дальнейшем ученые инженеры Аме-
12
рики и Европы, связанные с каменноугольными предприятиями, занимающиеся исследованиями в целях борьбы с авариями в шахтах, заложили
фундамент науки о горении. Так, например М. Фарадей по результатам
своих исследований опубликовал книгу «История свечи», переведенную на
многие языки.
В начале внимание исследователей процессов горения было
направлено на химические аспекты, то есть на изучение преобразования
веществ, при горении. Однако для практического использования горения
было необходимо исследовать и физику горения, то есть изучить явления
воспламенения и распространения пламени, температуру и излучение газов, образовавшихся при сгорании.
В XIX веке исследованием температуры и скорости распространения
пламени
занимался
Р.В.Бунзен. А.Л.Ле-Шателье совместно с
П.Э.М.Бертло и Ф.Малларом изучали процессы воспламенения, горения,
взрывов и детонации и впервые сделали попытку рассчитать скорость горения. В конце XIX века Маллар и А. Л. Ле-Шателье с появлением технических возможностей начали исследования распространения пламени с
помощью фотосъемки.
С началом всех этих исследований изучение процессов горения
вступило в новый важный этап.
В связи с изобретением во второй половине XIX века двигателей
внутреннего сгорания расширяются исследования процессов горения, постепенно выделившись в отдельную область знаний, получивших название
физика горения.
Выдающийся вклад в развитие теории горения и взрыва внесли
представители русской школы горения. Русский ученый В. А. Михельсон
13
в 1890 г. открыл закон распространения пламени, носящий его имя и заложил основы тепловой теории взрывного горения.
В конце XIX века в двигателях внутреннего сгорания стали использовать искровое зажигание, однако научные исследования зажигания были
начаты лишь примерно в 1910 году Торнтоном.
Теория
автоокисления,
разработанная
русским
академиком
А.Н.Бахом, позволила объяснить самопроизвольно протекающие процессы
окисления, являющиеся причиной самовозгорания различных веществ.
Так начиналось развитие современной теории горения и взрыва.
В настоящее время изучение горения успешно развивается в областях фундаментальных исследований и практического применения процессов горения. Заметный качественный и количественный скачок в развитии этих исследований произошел перед самым началом Второй мировой войны в связи с разработкой реактивных и ракетных двигателей.
Работы академика Н.Н.Семенова по изучению механизма разветвленных цепных реакций и теплового самовоспламенения (взрыва) являются выдающимся вкладом в мировую науку, за что он в 1956 году был удостоен Нобелевской премии. Теория цепных реакций горения позволяет
объяснить механизм перехода обычного горения во взрывное, а также количественно оценить газовые взрывы. Академик Я.Б.Зельдович и профессор Д. А. Франк-Каменецкий создали теорию распространения пламени.
Исследования наших ученых получили всемирное признание.
С развитием научно-технического прогресса, появлением интегральных типов научно-исследовательского оборудования и более мощных
электронно-вычислительных устройств развитие теории горения заметно
ускорилось. Тем не менее, из-за большой сложности физико-химических
14
процессов горения, разнообразия «топочных» устройств теория еще далека
от совершенства.
Можно более конкретно указать причины этого:
Во - первых, главный участник горения – горючее – является комплексом как природных органических, так и неорганических веществ
сложного химического строения. Правда, при нагреве и взаимодействии с
окислителем происходит распад этих комплексов на более простые соединения и элементы, но при анализе процесса горения невозможно обойтись
без учета поведения горючего в его исходной форме и в промежуточных
стадиях, а это крайне затрудняет изучение процесса.
Во - вторых, в процессе горения, так же, как и в других химических
процессах обязательны два этапа: создание молекулярного контакта между
горючим и окислителем (физический этап), и взаимодействия молекул с
образованием продуктов реакции (химический этап). При этом второй этап
протекает только у молекул, находящихся в особом энергетически или кинетически возбужденном состоянии. Возбуждаются же молекулы в результате начавшегося процесса горения из-за повышения общего энергетического уровня (температуры) и взаимодействия молекул. Даже при рассмотрении простейших реакций горения необходимо учитывать различия
между отдельными молекулами, составляющими сложную полисистему.
В – третьих горение принципиально не является равновесным процессом. При горении обязательно возникают неоднородности состояния
молекул, их концентраций, неравномерности полей температур и скоростей потоков. Существенно изменяются условия взаимной диффузии молекул, находящихся на разных ступенях возбуждения. Из этого вытекает
необходимость одновременного решения нестационарной задачи массо-и
15
теплопроводности и химической кинетики, причем наиболее часто при
турбулентности вызванной самим процессом горения.
Задачи теории горения, следовательно, охарактеризовать как нестационарные задачи турбулентной массо- и теплопроводности при наличии
динамических источников вещества и тепла. Но хотя такое представление
и определяет анализы процесса горения, конкретное решение задач теории
горения при этом затруднено. Исследование процесса горения по пути составления систем интегрально-дифференциальных уравнений, соответствие которых истинному ходу процессов следует проверять сопоставлением результатов решения этих систем, выполняемого во многих случаях с
применением ЭВМ, с данными эксперимента. Именно так и развивается
ныне теория горения.
В современном обществе существует контролируемое горение, специально организованное человеком для удовлетворения своих потребностей в тепловой (печи, топки и т.п.), световой (свечи, керосиновые лампы,
газовое освещение др.) и механической энергии (двигатели внутреннего
сгорания, дизеля и т.п.), и неконтролируемое горение – пожары.
Используя горение как источник энергии в своих целях, человек
иногда становился и жертвой этого «джина, самим им выпущенного из бутылки» - пожаров. Поэтому изучение процессов горения, приобретение
умений их регулирования и прекращения стало жизненно важной потребностью.
Ежегодно в России случается около 300000 пожаров. В огне гибнут
около 20 тысяч человек и примерно столько же получают травмы. В мире
на каждые 100 пожаров гибнет 1 человек, в России эта печальная статистика еще выше.
16
Пожар – это горение, способное самостоятельно распространяться
вне специально предназначенного для этого места, приводящее к травмированию или гибели людей, уничтожению или повреждению имущества,
ухудшению экологической обстановки.
Как следует из этого определения в основе всех явлений, протекающих на пожарах, лежит процесс горения, иногда сопровождающийся
возникновением взрыва. Уяснить сущность процессов, происходящих на
пожаре можно только на основе изучения теории горения и взрыва. Все
сопутствующие явления – деформация и обрушение строительных конструкций, вскипание и выбросы и т.п. - являются следствием процесса горения.
В настоящее время продолжаются исследования процессов горения
и взрыва, а также способов их предотвращения и прекращения во ВНИИПО (Москва) и Санкт-Петербургском филиале ВНИИПО, в Академии ГПС
МЧС (Москва), в Санкт-Петербургском Университете ГПС МЧС России, в
испытательных пожарных лабораториях, в научно-исследовательских институтах и учебных заведениях.
17
РАЗДЕЛ I. ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ ГОРЕНИЯ
ГЛАВА 1. ГОРЕНИЕ – ОСНОВНОЙ ПРОЦЕСС НА ПОЖАРЕ
1.1. Определение горения
Как следует из самого определения пожара, основной процесс, протекающий на пожаре, это горение.
Поскольку процесс горения является сложным, однозначного определения горения нет, различные авторы предлагают собственные определения.
Д.А.Франк-Каменецкий горением называет протекание химической
реакции в условиях прогрессивного самоускорения, связанного с накоплением в системе тепла или катализирующих продуктов реакции.
Горением также называют сложный физико-химический процесс взаимодействия горючего вещества и окислителя, характеризующийся самоускоряющимся превращением и сопровождающийся выделением большого
количества тепла и света.
Однако в определенных условиях возникают так называемые холодные пламена, в которых химическая реакция протекает с умеренной скоростью и сопровождается свечением без заметного разогрева.
Горением называют физико-химический процесс, для которого характерны три признака: химическое превращение, выделение тепла, излучение
света.
Другие авторы процессом горения называют сложный физикохимический процесс, при котором горючие вещества и материалы под воздействием высоких температур вступают в химическое взаимодействие с
окислителем (кислородом воздуха), превращаясь в продукты горения, и который сопровождается интенсивным выделением тепла и световым излучением.
Различия в трактовке понятия горения вызваны направлением научных интересов авторов. На наш взгляд, практическим интересам сотрудников
18
ГПС наиболее полно отвечает следующее определение горения:
Горение – это совокупность, как правило, самоподдерживающихся сложных физико-химических процессов, основой которых являются
быстропротекающие химические реакции окисления, сопровождающиеся выделением большого количества тепла и света.
Доминирующим процессом при горении является химическая реакция окисления, именно она влечет появление различных физических процессов: переноса тепла, переноса реагирующих веществ, излучения и др. Эти
физические процессы развиваются по своим законам. Химические процессы
окисления обладают большими потенциальными возможностями по скорости
их протекания, но реальная скорость окисления при горении ниже, т.к. лимитируется скоростями физических процессов.
Химические реакции окисления в общем виде можно представить
уравнением
аГор + bОк = ∑ ni ПГ i
(1.1)
где:
Гор – горючее вещество,
Ок – окислитель,
ПГ – продукты горения.
a, b, n i – соответствующие стехиометрические коэффициенты.
При решении пожарно-технических задач при описании процессов
горения обычно принимают «a»=1, при этом «b» может быть дробной величиной.
Тогда химические процессы при горении можно представить в виде
Гор + bОк = ∑ ni ПГ i
(1.2)
Но данное уравнение является лишь суммарным отражением, происходящих превращений. На самом деле химические реакции при горении являются многостадийными. Не разобравшись в механизме, происходящих
процессов, невозможно понять причины распространения пламени, различие
в его скоростях, величину температуры горения и др.
19
1.2. Характеристика участников процесса горения
Известно, что для возникновения горения необходимо наличие:
1. Горючего вещества
2. Окислителя
3. Источника зажигания (энергетический импульс)
Эти три составляющие часто называют треугольником пожара. Если
исключить одну из них, то горение возникнуть не может. Это важнейшее
свойство треугольника используется на практике для предотвращения и тушения пожаров.
После
возникновения
горения
источником
зажигания
далее
является само пламя.
Горючие вещества и материалы
Горючие вещества и материалы классифицируют по химической природе, происхождению, агрегатному состоянию, дисперсности и т.д.
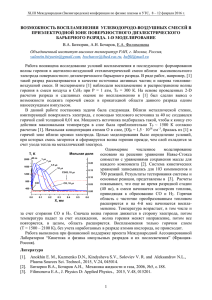
По химической природе горючие вещества и материалы подразделяются на два основных класса: органические и неорганические (рис. 1.1). Такое
подразделение весьма условно, поскольку многие органические вещества содержат как в химически связанном, так и в виде примесей неорганические
компоненты, нелетучая часть которых остается в виде золы, шлаков и.т.п.
Органические горючие вещества – это все вещества на основе углерода, представляющие собой материалы растительного и животного происхождения, или же ископаемые вещества, т.е. добываемые из недр земли. Все
они применяются как в натуральном виде, так и после соответствующей обработки.
Неорганические горючие вещества и материалы представляют собой все простые и сложные вещества неорганической природы, способные к
реакциям горения. По современной химической классификации это мталлы и
неметаллы, их различные производные.
20
К горючим металлам и их производным относятся все щелочные и щелочноземельные металлы, а также металлы других групп периодической системы Д.И. Менделеева и их производные - карбиды, сульфиды и т.п.
К горючим неметаллам и их производным относятся бор, кремний,
фосфор, мышьяк, сера, селен, теллур, их карбиды, гидриды, сульфиды и т.д.
По агрегатному состоянию горючие вещества и материалы подразделяются на газообразные, жидкие и твердые.
Горючие вещества и
материалы
ОРГАНИЧЕСКИЕ
Растительного и
животного происхождения:
Древесина, хлопок,
джут, масла, жиры,
смолы и т.д.
Ископаемы и их
производные:
Каменный и бурый
уголь, нефть, газ,
нефтепродукты, кислородсодержащие
соединения, синтетические полимеры
НЕОРГАНИЧЕСКИЕ
Металлы и их
производные:
Щелочные и щелочноземельные
и др. металлы
Неметаллы и
их производные:
Сера, фосфор,
кремний и т.д.
Рис. 1.1 Классификация горючих веществ и материалов.
Все индивидуальные вещества могут быть охарактеризованы коэффициентом горючести.
Коэффициент горючести К является безразмерным коэффициентом и
служит для определения горючести вещества. Рассчитанный коэффициент
горючести может быть использован для приближенного вычисления темпе-
21
ратуры вспышки вещества, а также величины нижнего концентрационного
коэффициента распространения пламени.
Коэффициент горючести рассчитывается по следующей формуле:
K = 4 ⋅ n(C ) + 4 ⋅ n( S ) + n( H ) + n( N ) − 2 ⋅ n(O) − 2 ⋅ n(Cl ) − 3 ⋅ n( F ) − 5 ⋅ n( Br )
(1.3)
где:
n(C), n(S), n(H), n(N), n(O), 2 n(Cl), n(F), n(Br) – число атомов углерода, серы,
водорода, азота, кислорода, хлора, фтора и брома в молекуле вещества.
Если коэффициент горючести К больше единицы (К ≥ 1), то вещество
является горючим; при значении К меньше единицы (К < 1) – вещество негорючее.
Расчет коэффициента горючести
Пример 1.1. Рассчитать коэффициент горючести анилина
С 6 Н 5 NH 2 и хлорной кислоты HClO 4 .
Решение:
1. В молекуле анилина
n(C) = 6; n(Н) = 7; n(N) = 1;
К = 4 ⋅ 6 + 7 + 1 = 32
К > 1, следовательно, анилин – горючее вещество.
2. В молекуле хлорной кислоты
n(Н) = 1; n(Cl) = 1; n(О) = 4;
К=1–2⋅4–2⋅1=−9
К < 1, хлорная кислота – негорючее вещество.
Окислители
Основными химическими процессами при горении являются межмолекулярные окислительно-восстановительные реакции между горючими веществами и окислителями, например:
С + О 2 = СО 2
Н 2 + Cl 2 = 2 НСl
22
Во втором уравнении окислителем является хлор. Но чаще всего в процессах горения и на реальных пожарах окислителем бывает кислород воздуха.
Окислители - это вещества, атомы которых в химических превращениях принимают электроны. Среди простых веществ к ним относятся все галогены и кислород.
Наиболее распространенным в природе окислителем является кислород
воздуха. Именно ему человечество обязано широким распространением пожаров на Земле. Воздух содержит 21 % по объему кислорода и 79 % азота. На
один объем (моль) кислорода в воздухе приходится 79/21 = 3,76 объема (моля) азота, который не вступает в реакции горения. Однако его приходится
учитывать при составлении уравнения материального и теплового баланса
процессов горения, поскольку часть теплоты расходуется на его нагревание.
Горение в воздухе - основной процесс на пожаре, однако во многих
технологических процессах используется воздух, обогащенный кислородом,
и даже чистый кислород (например, металлургические производства, газовая
сварка, резка и т.д.). С атмосферой, обогащенной кислородом, можно встретиться в подводных и космических аппаратах, доменных процессах и т.д. Такие горючие системы имеют повышенную пожарную опасность. Это необходимо
учитывать
при
разработке
систем
пожаротушения,
пожарно-
профилактических мероприятий и при пожарно-технической экспертизе пожаров.
Помимо кислорода воздуха и галогенов окислителями в реакциях горения могут выступать и сложные вещества, например, соли кислородсодержащих кислот - нитраты, хлораты и т.п., применяемые в производстве порохов, боевых и промышленных взрывчатых веществ и различных пиротехнических составов.
23
1.3. Основные процессы, происходящие при горении.
Виды горения
Для возникновения процессов горения необходимо наличие горючего
вещества и окислителя. Для инициирования возникновения горения необходимо наличие источника тепловыделения (зажигания). Иногда горение может
возникать самопроизвольно без источника зажигания (самовоспламенение и
самовозгорание). Для возникновения горения должны быть соблюдены следующие условия:
− непосредственный контакт горючего и окислителя;
− горючее и окислитель должны находиться в определенных количественных соотношениях;
− источник зажигания должен обладать достаточной энергией.
При температурах, характерных для горячих пламен, а именно они
возникают в подавляющем большинстве случаев на реальных пожарах, скорость химической реакции окисления при горении потенциально может быть
очень высокой. Это вызвано тем, что как было показано выше согласно правилу Вант-Гоффа, при повышении температуры на каждые 100 скорость реакции увеличивается в 2-4 раза. Но скорость процесса горения в целом, зачастую, лимитируется ограниченной скоростью того или иного физического
процесса, сопровождающего горение.
Основные физические процессы при горении – это тепло- и массообмен с окружающей средой за счет конвекции, диффузии и излучения.
При горении органических веществ образуются нагретые до высокой
температуры летучие продукты горения: СО 2 , Н 2 О, СО и др. При горении
некоторых неорганических веществ, например, некоторых металлов могут
образовываться наряду с летучими и нелетучие продукты горения. Плотность
летучих продуктов горения в 3-5 раз меньше плотности окружающего воздуха, поэтому над очагом горения существует конвективный (непрерывно поднимающийся вверх) поток горячей парогазовой смеси продуктов горения,
24
сопровождающийся всасыванием свежего воздуха снизу к очагу горения. Эти
процессы обуславливают массообмен (газообмен) и теплообмен очага горения с окружающей средой. Кроме того, теплообмен с окружающей средой
осуществляется за счет теплового (невидимого инфракрасного) светового
изучения, Лучистый поток распространятся во все стороны от зоны горения,
в том числе и падает вниз на поверхность горящего вещества. Нагреваясь под
воздействием лучистого теплового потока, горючее вещество испаряется или
разлагается и испаряется с выделением горючих газообразных продуктов, которые, смешиваясь с воздухом, поступают в зону горения. Такое горение сопровождается образованием пламени.
Пламя - это часть газового пространства, где протекают все физико-химические процессы, связанные с горением.
Пламя, как правило, излучает свет, лишь в редких случаях оно невидимо, например, при горении водорода. Наиболее высокотемпературная поверхность пламени, где протекают окислительно-восстановительные реакции, называется реакционной зоной или фронтом пламени.
В газообразных горючих системах все подготовительные и, собственно, процессы горения протекают в пламени. Поэтому для них понятия горение и пламя часто отождествляют и используют как синонимы. При горении
конденсированных систем (жидких и твердых) подготовительные процессы
(нагревание, плавление, испарение, термическое разложение) протекают вне
пламени непосредственно на поверхности горящего вещества.
Следует отметить, что горение может происходить и за счет кислорода, содержащегося в молекуле горючего вещества.
В зависимости от агрегатного состояния компонентов горючей смеси
горение подразделяется на два вида: гомогенное и гетерогенное.
Гомогенное горение - это процесс взаимодействия горючего и окислителя, находящихся в одинаковом агрегатном состоянии.
Оно бывает кинетическим и диффузионным в зависимости от однородности горючей смеси.
25
Однородной смесью называется предварительно перемешанная
смесь горючего с окислителем.
Скорость ее горения определяется только кинетикой окислительных
реакций. Поэтому процесс горения гомогенной однородной (предварительно
перемешанной) горючей смеси называется также кинетическим горением
(пламенем).
В большинстве случаев на реальных пожарах горючее и окислитель
предварительно не перемешаны. В этом случае окислитель (кислород воздуха) поступает в пламя из окружающей среды преимущественно за счет процессов диффузии.
Диффузионное горение (пламя) - это процесс горения неоднородной (предварительно не перемешанной) горючей смеси, в котором существенную роль играют процессы диффузии окислителя к фронту пламени.
Более подробно виды и режимы горения будут рассмотрены ниже.
Наиболее широко распространено гомогенное горение газов и паров в
воздухе, последние могут быть предварительно перемешаны или же нет. Гомогенное горение характерно для всех газообразных и большинства жидких
и твердых горючих материалов. Отличительным признаком такого горения
является возникновение пламени над поверхностью конденсированного горючего вещества.
Часто на пожарах гомогенное горение твердых горючих материалов
на заключительной стадии после выгорания летучих веществ или после ликвидации пожара переходит в гетерогенное горение (догорание) карбонизированных остатков (угля) и в ряде случаев (при определенных условиях) может
снова привести к открытому горению, через стадию возникновения повторных очагов горения.
Гетерогенное горение - это горение твердых горючих материалов
на границе раздела фаз, т.е. горение происходит практически непосредственно на их поверхности. Характерной особенностью гетерогенного горения является небольшая высота (до 2 мм) пламени или его отсутствие. Бес-
26
пламенное горение в ряде случаев называют тлением.
Тление - особый вид гетерогенного (беспламенного) горения.
Данному виду горения подвержены только пористые вещества и материалы, образующие твердый углистый остаток при нагревании, а также в
ряде случаев горючие жидкости, пропитавшие твердые пористые материалы.
Примерами его являются горение антрацита, кокса, древесного угля,
нелетучих металлов. В связи с тем, что при гетерогенном горении (тлении)
образуются высокотоксичные продукты неполного горения, которые к тому
же при определенных условиях способны привести к пламенному горению
и/или взрыву данный вид горения будет более подробно рассмотрен в главе
посвященной горению твердых веществ и материалов.
1.4. Опасные факторы пожара
Тяжелые последствия пожаров связаны с действием протекающих на
нем явлений. При внимательном анализе алгоритма пожара оказывается, что
материальные тела и процессы в очаге пожара теснейшим образом взаимосвязаны и взаимозависимы.
Так, например, при достаточной мощности пожара в здании конвективный и лучистый тепловые потоки будут нагревать негорючие ограждающие конструкции вплоть до их обрушения, будут воспламенять удаленные от
зоны горения предметы и конструкции из горючих материалов и тем самым
способствовать распространению пожара в смежные помещения, выше расположенные этажи и т.д. Если же горит достаточно большая постройка,
например, из древесины (деревянный дом 6х6 м), то очень часто возникают
мощные конвективные потоки продуктов горения, которые способны разносить далеко по округе искры, угли, горящие куски кровли и даже крупные
головни. Падая на удаленные постройки (до 3-х км ), они могут вызывать
быстрое распространение пожара, например, на весь квартал города, всю
улицу и даже на соседние улицы деревни, села и т.д.
27
Опасными факторами, воздействующими на людей и материальные
ценности, являются:
1. пламя и искры;
2. повышенная температура окружающей среды (безопасной для человека
считается температура не выше 70 °С);
3. токсичные продукты горения и термического разложения (предельные
значения концентраций - 0,1% СО; 6,0 % об. С0 2 и т.д.);
4. дым (происходит резкое снижение видимости);
5. пониженная концентрация кислорода (пороговая - 17 % об.);.
К вторичным проявлениям опасных факторов пожара, воздействующим на людей и материальные ценности, относятся:
1. осколки, части разрушившихся аппаратов, агрегатов, установок, конструкций;
2. радиоактивные и токсичные вещества и материалы, вышедшие из разрушенных аппаратов и установок;
3. электрический ток, возникший в результате выноса высокого напряжения на токопроводящие части конструкций, аппаратов, агрегатов;
4. опасные факторы взрыва, происшедшего вследствие пожара (согласно
ГОСТ 12.1.010 - ударная волна, во фронте которой давление превышает допустимое значение; пламя; обрушивающиеся конструкции, оборудование, коммуникации, здания и сооружения и их разлетающиеся части; образовавшиеся при взрыве и (или) выделившиеся из поврежденного оборудования вредные вещества, содержание которых в воздухе
рабочей зоны превышает предельно допустимые концентрации);
5. огнетушащие вещества.
Задания для самоконтроля
рения.
1. Дайте определение пожара и назовите необходимые и достаточные условия го-
2. Приведите примеры простых и сложных веществ:
а) горючих и негорючих;
б) негорючих, представляющих пожарную опасность;
в) представляющих опасность при взаимодействии с водой;
28
г) окислителей;
д) восстановителей;
е) огнетушащих веществ.
3. Перечислите первичные и вторичные опасные факторы пожара.
4. Что называется горючей средой. В чем особенность образования горючей среды
для жидкостей и твердых горючих материалов?
5. Приведите примеры источников тепловыделения различной природы.
6. Вычислите коэффициент горючести для С 6 Н 5 NHNHCSNNC 6 H 5 .
ГЛАВА 2. МАТЕРИАЛЬНЫЙ БАЛАНС ПРОЦЕССОВ ГОРЕНИЯ
Баланс – (от фр. balance – буквально “весы”) – количественное выражение сторон какого-либо процесса, которые должны уравновешивать друг
друга. Другими словами, баланс – это равновесие, уравновешивание. Процессы горения на пожаре подчиняются фундаментальным законам природы,
в частности, законам сохранения массы и энергии.
Для решения многих практических задач, а также для выполнения пожарно-технических расчетов необходимо знать количество воздуха, необходимого для горения, а также объем и состав продуктов горения. Эти данные
необходимы для расчета температуры горения веществ, давления при взрыве,
избыточного давления взрыва, флегматизирующей концентрации флегматизатора, площади легкосбрасываемых конструкций.
Методика расчета материального баланса процессов горения определяется составом и агрегатным состоянием вещества. Свои особенности имеет
расчет для индивидуальных химических соединений, для смеси газов и для
веществ сложного элементного состава.
Индивидуальные химические соединения – это вещества, состав которых можно выразить химической формулой. Расчет процесса горения в этом
случае производится по уравнению реакции горения.
Составление уравнений
реакций горения
в кислороде
Пример 2.1. Составить уравнение реакции
горения в кислороде пропана С 3 Н 8 и глицерина С 3 Н 8 О 3 , аммиака NH 3 , сероуглерода CS 2 .
Составляя уравнение реакции горения, следует помнить, что в пожарнотехнических расчетах принято все величины относить к 1 молю горючего вещества. Это, в
29
частности, означает, что в уравнении реакции горения перед горючим веществом коэффициент всегда равен 1.
Состав продуктов горения зависит от состава исходного вещества.
Элементы, входящие в состав горючего вещества
Углерод С
Водород Н
Сера S
Азот N
Фосфор Р
Галогены F, Cl, Br, I
Продукты горения
Углекислый газ СО 2
Вода Н 2 О
Оксид серы (IV) SO 2
Молекулярный азот N 2
Оксид фосфора (V) Р 2 О 5
Галогеноводороды HCl, HF,
HBr, HI
Горение пропана в кислороде
газа.
1. Записываем реакцию горения:
С 3 Н 8 + О 2 = СО 2 + Н 2 О
2. В молекуле пропана 3 атома углерода, из них образуется 3 молекулы углекислого
С 3 Н 8 + О 2 = 3СО 2 + Н 2 О
3. Атомов водорода в молекуле пропана 8, из них образуется 4 молекулы воды:
С 3 Н 8 + О 2 = 3СО 2 + 4Н 2 О
4. Подсчитаем число атомов кислорода в правой части уравнения
2⋅3 + 4 = 10
5. В левой части уравнения так же должно быть 10 атомов кислорода. Молекула
кислорода состоит из двух атомов, следовательно, перед кислородом нужно поставить коэффициент 5.
С 3 Н 8 + 5О 2 = 3СО 2 + 4Н 2 О
Коэффициенты, стоящие в уравнении реакции, называются стехиометрическими коэффициентами и показывают, сколько молей (кмолей) веществ участвовало в реакции или образовалось в результате реакции.
Стехиометрический коэффициент, показывающий число молей кислорода, необходимое для полного сгорания вещества, обозначается буквой β.
В первой реакции β = 5.
Горение глицерина в кислороде
1. Записываем уравнение реакции горения.
С 3 Н 8 О 3 + О 2 = СО 2 + Н 2 О
2. Уравниваем углерод и водород:
С 3 Н 8 О 3 + О 2 = 3СО 2 + 4Н 2 О.
3. В правой части уравнения 10 атомов кислорода.
В составе горючего вещества есть 3 атома кислорода, следовательно, из кислорода
в продукты горения перешли 10 – 3 = 7 атомов кислорода.
Таким образом, перед кислородом необходимо поставить коэффициент 7 : 2 = 3,5
30
С 3 Н 8 О 3 +3,5О 2 = 3СО 2 + 4Н 2 О.
В этой реакции β = 3,5.
Горение аммиака в кислороде
Аммиак состоит из водорода и азота, следовательно, в продуктах горения будут вода и молекулярный азот.
NH 3 + 0,75O 2 = 1,5H 2 O + 0,5N 2
β = 0,75.
Обратите внимание, что перед горючим веществом коэффициент 1, а все остальные
коэффициенты в уравнении могут быть дробными числами.
Горение сероуглерода в кислороде
Продуктами горения сероуглерода CS 2 будут углекислый газ и оксид серы (IV).
CS 2 + 3O 2 = CO 2 + 2SO 2
β = 3.
Чаще всего в условиях пожара горение протекает не в среде чистого
кислорода, а в воздухе. Воздух состоит из азота (78 %), кислорода (21 %),
окислов азота, углекислого газа, инертных и других газов (1 %). Для проведения расчетов принимают, что в воздухе содержится 79 % азота и 21 % кислорода. Таким образом, на один объем кислорода приходится 3,76 объемов
азота (79:21 = 3,76).
В соответствии с законом Авогадро и соотношение молей этих газов
будет 1 : 3,76. Таким образом, можно записать, что молекулярный состав
воздуха (О 2 + 3,76N 2 ).
Составление уравнений
реакций горения
в воздухе
Пример 2.2. Составить уравнение реакции
горения в воздухе водорода Н 2 , анилина
С 6 Н 5 NH 2 , пропанола С 3 Н 7 ОН, угарного газа
СО, хлорметана СН 3 Сl, диэтилтиоэфира
(С 2 Н 5 ) 2 S, диметилфосфата (СН 3 ) 2 НРО 4 .
Составление реакций горения веществ в воздухе аналогично составлению реакций
горения в кислороде. Особенность состоит только в том, что азот воздуха при температуре
горения ниже 20000С в реакцию горения не вступает и выделяется из зоны горения вместе
с продуктами горения.
Горение водорода в воздухе
Н 2 + 0,5(О 2 + 3,76N 2 ) = Н 2 О + 0,5⋅3,76N 2
β = 0,5.
Обратите внимание, что стехиометрический коэффициент перед кислородом 0,5
необходимо поставить и в правой части уравнения перед азотом.
31
Горение пропанола в воздухе
С 3 Н 7 ОН + 4,5(О 2 + 3,76N 2 ) =3СО 2 + 4Н 2 О +4,5⋅3,76N 2
β = 4,5.
В составе горючего есть кислород, поэтому расчет коэффициента β проводят следующим образом: 10 – 1 = 9; 9 : 2 = 4,5.
Горение анилина в воздухе
С 6 Н 5 NН 2 + 7,75(О 2 + 3,76N 2 ) =6СО 2 + 3,5Н 2 О + 0,5N 2 +7,75⋅3,76N 2
β = 7,75.
В этом уравнении азот в правой части уравнения встречается дважды: азот воздуха
и азот из горючего вещества.
Горение угарного газа в воздухе
СО + 0,5(О 2 + 3,76N 2 ) =СО 2 + 0,5⋅3,76N 2
β = 0,5.
Горение хлорметана в воздухе
СН 3 Сl + 1,5(О 2 + 3,76N 2 ) =СО 2 + НСl + Н 2 О +1,5⋅3,76N 2
β = 1,5.
Горение диэтилтиоэфира в воздухе
(С 2 Н 5 ) 2 S + 7,5(О 2 + 3,76N 2 ) =4СО 2 + 5Н 2 О + SO 2 + 7,5⋅3,76N 2
β = 7,5.
Горение диметилфосфата в воздухе
(СН 3 ) 2 НР О 4 + 3(О 2 + 3,76N 2 ) =2СО 2 + 3,5Н 2 О + 0,5Р 2 О 5 + 3⋅3,76N 2
β = 3.
В процессах горения исходными веществами являются горючее вещество и окислитель, а конечными - продукты горения.
Расчет молей (киломолей)
исходных веществ и
продуктов реакции
по уравнению реакции
горения
Пример 2.3. Сколько молей исходных веществ участвовало в реакции и сколько молей
продуктов горения образовалось при полном
сгорании 1 моля бензойной кислоты
С 6 Н 5 СООН?
1. Запишем уравнение реакции горения бензойной кислоты.
С 6 Н 5 СООН + 7,5(О 2 + 3,76N 2 ) =7СО 2 + 3Н 2 О +7,5⋅3,76N 2
2. Исходные вещества: 1 моль бензойной кислоты;
7,5 молей кислорода;
7,5⋅3,76 молей азота.
Газов воздуха всего 7,5⋅4,76 молей.
32
Всего (1 + 7,5⋅4,76) молей исходных веществ.
3. Продукты горения: 7 молей углекислого газа;
3 моля воды;
7,5⋅3,76 моля азота.
Всего (7 + 3 + 7,5⋅3,76) молей продуктов горения.
Аналогичные соотношения и в том случае, когда сгорает 1 киломоль бензойной
кислоты.
Смеси сложных химических соединений или вещества сложного элементного состава нельзя выразить химической формулой, их состав выражается чаще всего в процентном содержании каждого элемента. К таким веществам можно отнести, например, нефть и нефтепродукты, древесину и многие другие органические вещества.
2.1. Расчет объема воздуха, необходимого для горения
Расчет объема воздуха, необходимого для горения, предполагает вычисление
а) теоретического объема воздуха V в теор и
б) практического объема воздуха V в пр, затраченного на горение (с учетом коэффициента избытка воздуха).
Стехиометрическое количество воздуха в уравнении реакции горения предполагает, что при данном соотношении компонентов, участвующих
в реакции горения, воздух расходуется полностью. Объем воздуха в данном
случае называется теоретическим (V в теор).
Горение может происходить не только при стехиометрическом соотношении компонентов, но и при значительном отклонении от него. Как правило, в условиях пожара на сгорание вещества воздуха затрачивается больше, чем определяется теоретическим расчетом. Избыточный воздух ∆V в в реакции горения не расходуется и удаляется из зоны реакции вместе с продуктами горения. Таким образом, практический объем воздуха равен
V в пр = V в теор + ∆V в
и, следовательно, избыток воздуха будет равен
(2.1)
33
∆V в = V в пр - V в теор
(2.2)
Обычно в расчетах избыток воздуха при горении учитывается с помощью коэффициента избытка воздуха (α). Коэффициент избытка воздуха
показывает, во сколько раз в зону горения поступило воздуха больше, чем
это теоретически необходимо для полного сгорания вещества:
α=
Vвпр
Vвтеор
(2.3)
Величина α является важной характеристикой машин и агрегатов, в которых осуществляется организованное горение.
Для горючих смесей стехиометрического состава (т.е. состава, соответствующего уравнению реакции горения) коэффициент избытка воздуха α = 1,
при этом реальный расход воздуха равен теоретическому. В этом случае
обеспечивается оптимальный режим горения. Однако добиться полной однородности смеси чрезвычайно трудно. Существующие для этой цели технические средства не позволяют в полной мере обеспечить стехиометрическое
соотношение компонентов при реакции горения и создать однородную смесь.
Регулирование значения коэффициента избытка воздуха дает возможность
максимально приблизиться к оптимальным условиям сжигания.
Почти всегда α несколько больше единицы и находится в интервале
значений 1,02 – 1,3 в зависимости от характера сжигаемого вещества. Именно этим обусловлено название коэффициента α- коэффициент избытка воздуха. В действительности для кинетического горения его значения могут
быть как больше, так и меньше 1.
При α > 1 горючую смесь называют бедной по горючему компоненту, а
при α < 1 – богатой по горючему компоненту. В технике эти понятия имеют
очень большое значение для правильного управления организованным горением (двигатели внутреннего сгорания, теплогенерирующие агрегаты и т.д.).
Сгорание богатых смесей, как правило, приводит к перерасходу горючего и возникновению экологических загрязнений атмосферы. Бедные смеси
34
не обеспечивают оптимальных режимов работы машин и приводят к снижению их КПД.
Избыток воздуха имеется только в смеси, бедной по горючему компоненту. Из формул (2.2) и (2.3) следует
∆V в = V в теор(α −1)
(2.4)
Для неорганизованного горения характерен диффузионный режим горения, потому большинство горючих материалов на пожаре могут гореть
только в этом режиме. Однородные смеси, конечно, могут образовываться и
при реальном пожаре, однако их образование скорее предшествует пожару
или обеспечивает начальную стадию развития.
Если происходит открытый пожар, то понятие «избыток» - «недостаток» воздуха приобретает абсурдный смысл. В закрытом объеме диффузионное горение большинства горючих материалов возможно только до определенной пороговой концентрации кислорода, так называемой остаточной
концентрации кислорода в продуктах горения ϕ (О 2 )ПГ. Для большинства
органических веществ она составляет 12 – 16 % О 2 . Для некоторых веществ,
например, ацетилена С 2 Н 2 , ряда металлов, горение возможно и при значительно меньшем содержании кислорода (до 5 % объемных О 2 ).
Коэффициент избытка воздуха для диффузионного горения правильнее
назвать коэффициент участия воздуха в горении. Эта характеристика более полно отражает суть процесса горения на пожаре и не дает ошибочных
представлений и понятий. Это важный параметр, определяющий динамику
развития пожара и, как следствие, развитие его опасных факторов.
Зная содержание кислорода в продуктах горения, можно определить
коэффициент избытка воздуха (коэффициент участия воздуха в горении) на
реальном пожаре:
α=
21
21 − ϕ (О2 ) ПГ
(2.5)
35
Анализ уравнения (3.5) показывает, что α не может быть меньше 1, и, в
среднем, для диффузионных режимов горения находится в интервале от
2 до 5.
2.1.1. Горючее – индивидуальное химическое соединение
Теоретический объем воздуха, необходимый для горения рассчитывается по уравнению реакции горения.
Расчет теоретического
объема воздуха, необходимого
для горения индивидуального
вещества
Пример 2.4. Какой теоретический объем воздуха необходим для полного сгорания 1 кг диэтилового эфира
С 2 Н 5 ОС 2 Н 5 ? Температура 100С, давление 1,2 ат
1. Записываем уравнение реакции горения
1 кг
х м3
С 2 Н 5 ОС 2 Н 5 + 6(О 2 + 3,76N 2 ) =4СО 2 + 5Н 2 О +6⋅3,76N 2
М = 74 кг
6⋅4,76 ⋅ V м =
=6⋅4,76⋅19,35 м3
2. Записываем в уравнении известные и неизвестные величины с указанием размерности.
3. Молярная масса диэтилового эфира 74 кг/кмоль. Записываем эту величину под
формулой эфира.
4. При нормальных условиях молярный объем (V м ) любого газообразного вещества
составляет 22, 4 л/моль или 22,4 м3/кмоль.
Если условия отличаются от нормальных, то необходимо определить, какой объем
будет занимать 1 кмоль любого газообразного вещества при данных условиях. Расчет V М
ведут по формуле объединенного газового закона:
P ⋅V T
VM = 0 0 ⋅ , где
T0
P
Р и Т – данные в задаче температура и давление.
Рассчитаем, какой объем занимает 1 кмоль воздуха (как и любого другого газообразного вещества) при данных температуре и давлении.
1 ⋅ 22,4 283
VM =
⋅
= 19,35 м3/кмоль
273 1,2
Записываем данную величину под формулой воздуха, умножив ее на стехиометрический коэффициент (6⋅4,76).
5. По уравнению реакции найдем теоретический объем воздуха, необходимый для
полного сгорания эфира:
V в теор = x =
1⋅ 6 ⋅ 4,76 ⋅19,35
= 7,5 м3
74
36
Пример 2.5. Какой объем воздуха необходим для полРасчет объема воздуха,
ного
сгорания 50 кг ацетона СН 3 СОСН 3 при температуре
необходимого для горения
230С и давлении 95 кПа, если горение протекало с коэффииндивидуального вещества
циентом избытка воздуха 1,2?
1. Записываем уравнение реакции горения
50 кг
х м3
СН 3 СОСН 3 + 4(О 2 + 3,76N 2 ) = 3СО 2 + 3Н 2 О +4⋅3,76N 2
М = 58 кг
4⋅4,76 ⋅ V м =
=4⋅4,76⋅25,9 м3
2. Рассчитаем, какой объем занимает 1 кмоль воздуха (как и любого другого газообразного вещества) при данных температуре и давлении.
101,3 ⋅ 22,4 296
VM =
⋅
= 25,9 м3/кмоль
273
95
3. По уравнению реакции найдем теоретический объем воздуха, необходимый для
полного сгорания эфира:
V в теор = x =
50 ⋅ 4 ⋅ 4,76 ⋅ 25,9
= 425,1 м3
58
4. По условию задачи коэффициент избытка воздуха α = 1,2.
С учетом этого определим практический объем воздуха, необходимый для горения:
V в пр = V в теор ⋅ α = 425,1 ⋅ 1,2 = 510,1 м3.
2.1.2. Горючее – смесь газов и паров
Природный, попутный нефтяной газ, промышленные газы (доменный,
коксовый, генераторный и т.п.) представляют собой смеси газов. Состав газов выражается обычно в объемных процентах (ϕобъемн, %).
Алгоритм расчета в
данном случае следующий: для каждого горю-
чего компонента вычисляется теоретическое количество воздуха с учетом его
концентрации в смеси, и полученные концентрации суммируются. Формула
для расчета теоретического объема воздуха для сгорания газовой смеси имеет следующий вид:
Vвтеор =
где
β1 ⋅ ϕ1 + β 2 ⋅ ϕ 2 + β 3 ⋅ ϕ 3 + ... − ϕ (О2 )
21
⋅ V ГГ , м ,
3
(2.6)
β 1 , β 2 , β 3 – стехиометрические коэффициенты при воздухе в уравне-
нии реакции горения для каждого горючего компонента газовой смеси;
37
ϕ 1 , ϕ 2 , ϕ 3 – концентрации каждого горючего компонента смеси (в объемных %);
ϕ (О 2 ) – процентное содержание кислорода в горючем газе (в объемных
%);
V ГГ – объем газовой смеси, м3.
Если горение протекает с избытком воздуха, то практический объем
воздуха рассчитывают по уже известной формуле:
V в пр = V в теор ⋅ α.
Расчет объема воздуха,
необходимого для горения
газовой смеси
Пример 2.6. Определить объем воздуха, необходимого
для полного сгорания 10 м3 доменного газа следующего состава (в % объемных): оксид углерода (II) СО – 27 %, водород Н 2 – 3 %, углекислый газ СО 2 – 13 %, метан СН 4 – 1 %,
азот N 2 – 56 %. Горение протекает при α = 1,3.
1. Определяем стехиометрические коэффициенты в уравнении реакции горения для
каждого горючего компонента газовой смеси. Горючими газами в этой смеси являются
угарный газ СО, водород Н 2 и метан СН 4 .
СО + 0,5(О 2 + 3,76N 2 ) = СО 2 + 0,5⋅3,76N 2
Н 2 + 0,5(О 2 + 3,76N 2 ) = Н 2 О +0,5⋅3,76N 2
СН 4 + 2(О 2 + 3,76N 2 ) = СО 2 + 2Н 2 О +2⋅3,76N 2
β 1 = 0,5
β 2 = 0,5
β3 = 2
2. По формуле (2.6) определяем теоретический объем воздуха, необходимый для
горения данной газовой смеси:
0,5 ⋅ 27 + 0,5 ⋅ 3 + 2 ⋅1
⋅10 = 8,1 м3
21
3. С учетом коэффициента избытка воздуха реально на сгорание данной газовой
смеси будет затрачено воздуха
V в пр = V в теор ⋅ α = 8,1 ⋅ 1,3 = 10,5 м3.
V в теор =
2.1.3. Горючее – сложное вещество с известным элементным составом
Состав таких веществ выражается в массовых долях (ω, %) каждого
элемента. При горении кислород воздуха расходуется на окисление углерода
С, водорода Н, серы S и других горючих составляющих.
38
Рассчитаем, какой теоретический объем воздуха необходим для сгорания 1 кг каждого элемента при нормальных условиях.
1 кг
х м3
С + (О 2 + 3,76N 2 ) = СО 2 + 3,76N 2
12 кг
4,76⋅22,4 м3
4,76 ⋅ 22,4
= 8,885 м3 – объем воздуха для сгорания 1 кг углерода.
12
V в (С)теор = х =
1 кг
х м3
Н + 0,25(О 2 + 3,76N 2 ) = 0,5Н 2 О + 0,25⋅3,76N 2
1 кг
0,25⋅4,76⋅22,4 м3
V в (Н)теор = х =
рода.
0,25 ⋅ 4,76 ⋅ 22,4
= 26,656 м3 – объем воздуха для сгорания 1 кг водо1
1 кг
х м3
S + (О 2 + 3,76N 2 ) = SО 2 + 3,76N 2
32 кг
4,76⋅22,4 м3
V в (S)теор = х =
4,76 ⋅ 22,4
= 3,332 м3 – объем воздуха для сгорания 1 кг серы.
32
Углерод, водород и сера являются основными составляющими большинства органических соединений. Значительное число органических веществ имеют в своем составе
кислород, и, следовательно, воздуха на горение будет затрачено меньше.
Рассчитаем объем воздуха, в котором содержится 1 кг кислорода.
32 кг О 2 − 4,76⋅22,4 м3 воздуха
1 кг
− х м3
V в (О)теор = х =
4,76 ⋅ 22,4
= 3,332 м3 – объем воздуха, содержащий 1 кг кислорода.
32
Сопоставим полученные значения.
V в (Н)теор : V в (С)теор : V в (S)теор :V в (О)теор =
= 26,665 : 8,885 : 3,332 : 3,332 = 1 : 1/3 : 1/8 : 1/8
Теоретическое количество воздуха для сгорания 1 кг вещества сложного элементного состава в общем виде можно записать следующим образом:
V в теор = V в (С)теор ⋅
ω (С )
100
+ V в (Н)теор ⋅
ω (Н )
100
+ V в (S)теор ⋅
ω (S )
100
− V в (О)теор ⋅
ω (О)
100
, м3
(2.7)
где
ω (С), ω (Н), ω (S), ω (О) – массовые доли элементов в веществе, %.
После подстановки в формулу (2.7) полученных выше расчетных значений теоретический объем воздуха для сгорания заданной массы (m) вещества сложного элементного
состава при нормальных условиях определяется по формуле:
39
Vвтеор = m ⋅ 0.267 ⋅ (
ω (С )
Расчет объема воздуха,
необходимого для горения
вещества сложного
элементного состава
3
+ ω(Н ) +
ω ( S ) ω (О)
8
−
8
) , м3/кг.
(2.8)
Пример 2.7. Определить объем воздуха, необходимого
для полного сгорания 5 кг торфа следующего состава (в %):
С – 56,4 %, Н – 5,04 %, О – 24,0 %, S – 0,06 %, N – 3,6 %,
зола – 10,9 %. Горение протекает при α = 1,5, условия
нормальные.
1. По формуле (2.8) определяем теоретический объем воздуха, необходимый для
горения данной массы образца торфа:
0,06 24
56,4
− ) = 27,7 м3
+ 5,04 +
8
8
3
2. С учетом коэффициента избытка воздуха реально на сгорание данной массы образца торфа будет затрачено воздуха
V в пр = V в теор ⋅ α = 27,7 ⋅ 1,5 = 41,6 м3.
V в теор = 5 ⋅ 0,267(
2.2. Расчет объема и процентного состава продуктов горения
Состав продуктов горения зависит от химической природы горючего
материала и условий его горения. Практически всегда органические вещества
горят с образованием продуктов полного и неполного горения.
К продуктам полного сгорания относятся: углекислый газ, образующийся при горении углерода, разложении карбонатов; водяной пар, образующийся при горении водорода и испарении влаги в исходном веществе; оксид серы (IV) SO 2 и азот – продукты горения соединений, содержащих серу и
азот.
Продукты неполного сгорания – это оксид углерода (II) – угарный газ
СО, сажа С, продукты термоокислительного разложения – смолы.
Неорганические вещества сгорают, как правило, до соответствующих
оксидов.
Выход продуктов горения количественно установить невозможно из-за
чрезвычайной сложности их состава, поэтому материальный баланс процесса
горения рассчитывается из предположения, что вещество сгорает полностью
40
до конечных продуктов. При этом в состав продуктов горения включают
также азот воздуха, израсходованного на горение, и избыток воздуха при
α > 1.
Как и в случае расчета объема воздуха, необходимого для горения,
свои особенности имеет расчет продуктов горения для индивидуальных веществ, смеси газов и веществ с известным элементным составом.
2.2.1. Горючее – индивидуальное химическое соединение
В случае индивидуального химического соединения объем и состав
продуктов горения рассчитывается по уравнению реакции горения.
Расчет объема и процентного состава продуктов
горения индивидуального
вещества
Пример 2.8. Определить объем и состав в объемных %
продуктов горения, образовавшихся при сгорании 3 кг бензола С 6 Н 6 . Температура 200С, давление 770 мм рт.ст.,
коэффициент избытка воздуха α = 1,4.
1. Записываем уравнение реакции горения
х 2 м3
3 кг
х 1 м3
С 6 Н6
+ 7,5(О 2 + 3,76N 2 ) = 6СО 2 +
М = 78 кг
7,5⋅4,76 ⋅ V м =
6⋅V м =
=7,5⋅4,76⋅23,7 м3
=6⋅23,7 м3
х 3 м3
3Н 2 О +
3⋅V м =
=3⋅23,7 м3
х 4 м3
7,5⋅3,76N 2
7,5⋅3,76⋅V м =
=7,5⋅3,76⋅23,7 м3
2. Рассчитаем, какой объем занимает 1 кмоль газообразных веществ при заданных
температуре и давлении.
760 ⋅ 22,4 293
⋅
= 23,7 м3/кмоль
VM =
273
770
ции.
3. Теоретический объем продуктов горения (V ПГ ) определяем по уравнению реак-
3 ⋅ (6 + 3 + 7,5 ⋅ 3,76) ⋅ 23,7
= 33,9 м3
78
4. Горение протекает с коэффициентом избытка воздуха, следовательно, в состав
продуктов горения войдет избыточный воздух ∆V в .
Для расчета избытка воздуха по уравнению реакции найдем теоретический объем
воздуха, необходимый для полного сгорания бензола:
V ПГ =
V в теор = х 1 =
3 ⋅ 7,5 ⋅ 4,76 ⋅ 23,7 = 32,5 м3
78
Избыток воздуха определим по формуле (2.4):
∆V в = V в теор(α −1) = 32,5(1,4 – 1) = 13 м3
41
С учетом избытка воздуха практический объем продуктов горения составит:
V ПГ * = V ПГ + ∆V в = 33,9 + 13 = 46,9 м3
5. Иногда возникает необходимость рассчитать объем отдельных компонентов
продуктов горения и их процентный состав.
В этом случае по уравнению реакции определяем объем СО 2 , Н 2 О и N 2 .
V(СО 2 ) = х 2 =
3 ⋅ 6 ⋅ 23,7
= 5,47 м3
78
V(Н 2 О) = х 3 =
3 ⋅ 3 ⋅ 23,7
= 2,73 м3
78
V(N 2 ) = х 4 =
3 ⋅ 7,5 ⋅ 3,76 ⋅ 23,7
= 25,71 м3
78
∆V в = 13 м3 (рассчитано в п.4)
Объемная концентрация каждого компонента смеси рассчитывается следующим
образом:
ϕоб (СО 2 ) =
V (СО2 ) ⋅100
5,47 ⋅100
=
= 11,7 %
*
VПГ
46,9
ϕоб (Н 2 О) =
V ( Н 2О) ⋅100
2,73 ⋅100
=
= 5,8 %
*
VПГ
46,9
ϕоб (N 2 ) =
V ( N 2 ) ⋅100
25,71 ⋅100
=
= 54,8 %
*
VПГ
46,9
ϕоб (∆V в ) =
V (∆Vв ) ⋅100
13⋅100
=
= 27,7 %
*
VПГ
46,9
Обратите внимание, что более половины объема всех продуктов горения – это азот воздуха, израсходованного на горение. Если же горение протекает с коэффициентом избытка воздуха α > 1, то избыточный воздух также
составляет значительную часть продуктов горения.
2.2.2. Горючее – смесь газов и паров
При расчете продуктов горения газовой смеси необходимо знать, какой
объем продуктов горения выделяются при сгорании 1 м3 каждого горючего
газа смеси. Далее, зная процентное содержание (в объемных %) каждого го-
42
рючего газа, вычислить суммарный объем образовавшихся продуктов горения. Если горение протекает с избытком воздуха, то в состав продуктов горения необходимо включить и избыточный воздух.
Расчет объема и
процентного состава
продуктов горения
газовой смеси
Пример 2.9. Определить объем и состав продуктов горения 10 м3 природного газа следующего состава (в % объемных): метан СН 4 – 75 %, этан С 2 Н 6 – 4 %, пропан С 3 Н 8 –
2 %, углекислый газ СО 2 – 19 %. Горение протекает при
α = 1,2.
1. Составляем уравнение реакции горения для всех горючих газов смеси:
СН 4 + 2(О 2 + 3,76N 2 ) = СО 2 + 2Н 2 О +2⋅3,76N 2
β (СН 4 ) = 2
Для газообразных веществ отношение числа моль равно отношению объемов, следовательно, стехиометрические коэффициенты для каждого вещества в реакции горения –
это и есть объем в м3 каждого компонента продуктов горения, выделившийся при сгорании 1 м3 горючего газа.
По уравнению реакции можно определить, что при сгорании 1 м3 метана СН 4 образуется 1 м3 СО 2 , 2 м3 Н 2 О и 2⋅3,76 м3 N 2 .
С 2 Н 6 + 3,5(О 2 + 3,76N 2 ) =2СО 2 + 3Н 2 О +3,5⋅3,76N 2
β (С 2 Н 6 ) = 3,5
При сгорании 1 м3 этана С 2 Н 6 образуется 2 м3 СО 2 , 3 м3 Н 2 О и 3,5⋅3,76 м3 N 2 .
С 3 Н 8 +,5(О 2 + 3,76N 2 ) =3СО 2 + 4Н 2 О +5⋅3,76N 2
β (С 3 Н 8 ) =5
При сгорании 1 м3 этана С 3 Н 8 образуется 3 м3 СО 2 , 4 м3 Н 2 О и 5⋅3,76 м3 N 2 .
2. Определим теоретический объем продуктов горения.
Суммарный объем углекислого газа, образовавшегося при сгорании 1 м3 газовой
смеси определяется с учетом процентного состава каждого горючего компонента газовой
смеси, и также включается объем углекислого газа, входящий в состав исходной газовой
смеси:
V(СО 2 ) = 1 ⋅
= 1⋅
вит:
ϕ (СН 4 ) об
100
+ 2⋅
ϕ (С2 Н 6 ) об
100
+3
ϕ (С3 Н 8 ) об
100
+
ϕ (СО2 )
100
=
2
19
4
75
= 1,08 м3
+
+ 2⋅
+ 3⋅
100
100 100
100
При сгорании 10 м3 газовой смеси объем образовавшегося углекислого газа состаV(СО 2 ) = 1,08 ⋅ 10 = 10,8 м3
Аналогично рассчитываем объем паров воды, образовавшийся в результате сгорания 1 м3 смеси газов:
75
4
2
V(Н 2 О) = 2 ⋅
= 1,7 м3
+ 3⋅
+ 4⋅
100
100
100
При сгорании 10 м3 газовой смеси объем паров воды будет:
43
V(Н 2 О) = 1,7 ⋅ 10 = 17 м3
Объем азота в продуктах горения составит для 1 м3 природного газа:
2
4
75
V(N 2 ) = 2 ⋅ 3,76 ⋅
= 6,55 м3,
+ 5 ⋅ 3,76 ⋅
+ 3,5 ⋅ 3,76 ⋅
100
100
100
а для 10 м3
V(N 2 ) = 6,55 ⋅ 10 = 65,5 м3
Теоретический объем продуктов горения 10 м3 газовой смеси составит:
V ПГ = V(СО 2 )+ V(Н 2 О)+ V(N 2 ) = (10,8 + 17 + 65,5) = 93,3 м3
2. Горение протекает с коэффициентом избытка воздуха α = 1,2, следовательно, в
состав продуктов горения войдет и избыток воздуха. Для его расчета по формуле (2.6)
определяем теоретический объем воздуха, необходимый для горения данной газовой смеси:
2 ⋅ 75 + 3,5 ⋅ 4 + 5 ⋅ 2
⋅10 = 82,9 м3
21
Избыток воздуха определим по формуле (2.4):
V в теор =
∆V в = V в теор(α −1) = 82,9⋅(1,2 – 1) = 16,6 м3
С учетом избытка воздуха практический объем продуктов горения составит:
V ПГ * = V ПГ + ∆V в = 93,3 + 16,6 = 109,9 м3
2. Определим процентный состав продуктов горения:
ϕоб (СО 2 ) =
V (СО2 ) ⋅100
10,8 ⋅100
=
= 9,8 %
*
VПГ
109,9
ϕоб (Н 2 О) =
V ( Н 2О) ⋅100 17 ⋅100
=
= 15,5 %
*
VПГ
109,9
ϕоб (N 2 ) =
V ( N 2 ) ⋅100
65,5 ⋅100
=
= 59,6 %
*
VПГ
109,9
ϕоб (∆V в ) =
V (∆Vв ) ⋅100
16,6 ⋅100
=
= 15,1 %
*
VПГ
109,9
2.2.3. Горючее – сложное вещество с известным элементным составом
В этом случае теоретический выход продуктов горения определяется
как сумма продуктов горения каждого элемента, входящего в состав вещества.
44
Рассчитаем, какой теоретический объем продуктов горения образуется при сгорании 1 кг каждого элемента при нормальных условиях.
Для углерода:
х 2 м3
1 кг
х 1 м3
С + (О 2 + 3,76N 2 ) = СО 2 + 3,76N 2
12 кг
22,4 м3 3,76⋅22,4 м3
22,4
= 1,87 м3
12
3,76 ⋅ 22,4
= 7,0 м3
V(N 2 ) = х 2 =
12
V(СО 2 ) = х 1 =
Для водорода:
х 2 м3
1 кг
х 1 м3
Н + 0,25(О 2 + 3,76N 2 ) = 0,5Н 2 О + 0,25⋅3,76N 2
0,25⋅3,76⋅22,4 м3
1 кг
0,5⋅22,4 м3
0,5 ⋅ 22,4
= 11,2 м3
1
0,25 ⋅ 3,76 ⋅ 22,4
V(N 2 ) = х 2 =
= 21,0 м3
1
V(Н 2 О) = х 1 =
Для серы:
1 кг
х 1 м3
х 2 м3
S + (О 2 + 3,76N 2 ) = SО 2 + 3,76N 2
32 кг
22,4 м3
3,76⋅22,4 м3
22,4
= 0,7 м3
32
3,76 ⋅ 22,4
V(N 2 ) = х 2 =
= 2,63 м3
32
V(SО 2 ) = х 1 =
Для фосфора:
1 кг
х 1 м3
х 2 м3
Р + 1,25(О 2 + 3,76N 2 ) = 0,5Р 2 О 5 + 1,25⋅3,76N 2
31 кг
0,5⋅22,4 м3
1,25⋅3,76⋅22,4 м3
0,5 ⋅ 22,4
= 0,36 м3
31
1,25 ⋅ 3,76 ⋅ 22,4
V(N 2 ) = х 2 =
= 3,4 м3
31
V(Р 2 О 5 ) = х 1 =
В состав горючего вещества может входить азот, влага, которые удаляются вместе
с продуктами горения.
Объем 1 кг азота при нормальных условиях составит:
45
V(N 2 ) =
m( N 2 ) ⋅ VM 1 ⋅ 22,4
= 0,8 м3
=
M (N2 )
28
При нормальных условиях 1 кг паров воды займет объем:
V(Н 2 О) =
m( Н 2О) ⋅ VM 1 ⋅ 22,4
= 1,24 м3
=
M ( Н 2О )
18
Если в состав горючего вещества входит кислород, то при горении он будет расходоваться на окисление горючих компонентов (углерода, водорода, серы, фосфора) и, поэтому из воздуха на горение будет израсходовано кислорода меньше на количество, которое содержалось в горючем веществе. Следовательно, в продуктах горения и азота будет
меньше на количество, которое приходилось бы на кислород, если бы он находился не в
горючем веществе, а в воздухе.
На 1 кг кислорода в воздухе будет приходиться объем азота, равный
3,76 ⋅ 22,4
= 2,63 м3
V(N 2 ) =
32
Полученные значения выходов продуктов горения элементов приведены в
таблице 2.1.
Таблица 2.1.
Теоретический объем продуктов горения элементов сложных веществ
при нормальных условиях
Элемент
Углерод
Водород
Сера
Фосфор
Азот в горючем
Азот за счет кислорода в горючем
Влага в горючем
Объем продуктов горения (м3) на 1 кг
Вещества
СО 2
Н2О
SO 2
Р2О5
N2
1,87
7,0
11,2
21,0
0,7
2,63
0,36
3,4
0,8
− 2,63
1,24
Используя данные таблицы 2.1., можно вычислить объем продуктов горения любого вещества с известным элементным составом.
Пусть ω (С), ω (Н), ω (S), ω (О),ω (N) – – массовые доли элементов в веществе, %;
ω (W) – содержание влаги в веществе, %.
Тогда общие формулы для расчета каждого компонента продуктов горения при
сгорании заданной массы (m) вещества будут иметь следующий вид:
V(СО 2 ) = m⋅
1,86 ⋅ ω (С ) 3
,м
100
V(H 2 O) = m⋅
{
11,2 ⋅ ω ( Н ) 1,24 ⋅ ω (W )
+
100
100
(2.9)
}, м3
(2.10)
46
0,7 ⋅ ω ( S ) 3
,м
100
V(SО 2 ) = m⋅
V(N 2 ) = m⋅
{
(2.11)
7 ⋅ ω (С ) 21 ⋅ ω ( H ) 2,63 ⋅ ω ( S ) 0,8 ⋅ ω ( N ) 2,63 ⋅ ω (O)
+
+
+
−
100
100
100
100
100
Расчет объема и
процентного состава
продуктов горения
вещества сложного
элементного состава
}, м3
(2.12)
Пример 2.10. Определить объем и процентный состав
продуктов горения 5 кг каменного угля следующего состава
(в %): С – 75,8 %, Н – 3,8 %, О – 2,8 %, S – 2,5 %,
N – 1,1 %, W – 3,0 %, зола – 11,0 %. Горение протекает при
α = 1,3, условия нормальные.
1. По формулам (2.9) – (2.12) определяем объем каждого компонента продуктов горения 5 кг каменного угля.
1,86 ⋅ 75,8
= 7 м3
100
11,2 ⋅ 3,8 1,24 ⋅ 3,0
V(H 2 O) = 5⋅ {
} = 2,31 м3
+
100
100
0,7 ⋅ 2,5
V(SО 2 ) = 5⋅
= 0,085 м3
100
7 ⋅ 75,8 21 ⋅ 3,8 2,63 ⋅ 2,5 0,8 ⋅1,1 2,63 ⋅ 2,8
V(N 2 ) = 5⋅ {
+
+
+
−
100
100
100
100
100
V(СО 2 ) = 5⋅
} = 33,14 м3
V ПГ = 7 + 2,31 + 0,085 + 33,14 = 42,5 м3
2. Горение протекает с коэффициентом избытка воздуха 1,3, следовательно, в состав продуктов горения будет входить избыточный воздух.
По формуле (2.8) определяем теоретический объем воздуха, необходимый для горения данной массы образца угля:
75,8
2,5 2,8
V в теор = 5 ⋅ 0,267(
+ 3,8 +
−
) = 38,6 м3
3
8
8
Избыток воздуха определим по формуле (2.4):
∆V в = V в теор(α −1) = 38,6⋅(1,3 – 1) = 11,6 м3
С учетом избытка воздуха практический объем продуктов горения составит:
V ПГ * = V ПГ + ∆V в = 42,5 + 11,6 = 54,1 м3
3. Определим процентный состав продуктов горения:
ϕоб (СО 2 ) =
V (СО2 ) ⋅100
7,0 ⋅100
=
= 12,9 %
*
VПГ
54,1
ϕоб (Н 2 О) =
V ( Н 2О) ⋅100
2,31 ⋅100
=
= 4,3 %
*
VПГ
54,1
47
ϕоб (SО 2 ) =
ϕоб (N 2 ) =
V ( SО2 ) ⋅100
0,085 ⋅100
=
= 0,2 %
*
VПГ
54,1
V ( N 2 ) ⋅100
33,14 ⋅100
=
= 61,2 %
*
VПГ
54,1
ϕоб (∆V в ) =
V (∆Vв ) ⋅100
11,6 ⋅100
=
= 21,4 %
*
VПГ
54,1
2.3. Продукты сгорания. Дым и его характеристики
Продуктами сгорания называются газообразные, жидкие и твердые
вещества, образующиеся в результате горения веществ в воздухе.
Состав их зависит от состава горящего вещества и условий его горения.
На пожарах чаще всего горят органические вещества (древесина, ткани, бензин, керосин, резина и др.), в состав которых входят углерод, водород, кислород, сера и азот. В зависимости от условий их горения могут образовываться продукты полного и неполного сгорания. К продуктам полного сгорания относятся углекислый газ, сернистый газ, пары воды, азот (при сгорании
азотсодержащих соединений). Все они не способны гореть и не поддерживают горение большинства горючих веществ.
К продуктам неполного сгорания относятся окись углерода, сажа и
продукты термоокислительного разложения.
Реже на пожарах горят неорганические вещества, такие как фосфор,
натрий, калий, кальций, алюминий, титан, магний и др. Продуктами их
сгорания являются твердые вещества. Одни из них (Р 2 О 5 , МgО, Na20) в
продуктах сгорания мелко диспергированы и поднимаются в воздух в виде
плотного дыма, другие (А1 2 О 3, ТiO 2) в процессе горения находятся в расплавленном состоянии.
Продукты сгорания многих органических и неорганических веществ
содержат взвешенные твердые частицы (сажа, окислы, соли и др.). Такая
дисперсная система называется дымом.
48
Дым - это дисперсная система из продуктов горения и воздуха, состоящая из газов, паров и раскаленных частиц.
Дым представляет собой пример аэрозоля - дисперсной системы, состоящей из мельчайших твердых частиц (дисперсной фазы), взвешенных в
дисперсионной газообразной среде (продуктах сгорания или смеси их с
воздухом, или в чистом воздухе). Размер частиц дисперсной фазы дыма
колеблется в пределах 10-5 и 10-8 м.
Дым, состоящий из мелкодисперсных частиц, образуется в результате
неполного сгорания. Он образуется как при беспламенном, так и при пламенном горении, хотя характер частиц и формы их образования весьма различны. Дым при тлении аналогичен дыму, который получается, когда любой
углеродсодержащий материал нагревается до температур, при которых происходит химическое разложение и эволюция летучих продуктов горения.
Фракции с большим молекулярным весом конденсируются по мере их перемешивания с холодным воздухом, что приводит к образованию тумана, состоящего из мельчайших капель смолы и высококипящих жидкостей. Эти
капли стремятся в условиях спокойного воздуха слипаться, образуя мелкие
частицы со средним диаметром порядка одного микрона, и осаждаются на
поверхностях, образуя маслянистый остаток.
По своему характеру дым при пламенном сгорании материалов отличается от дыма при тлении. Он состоит почти целиком из твердых частиц. В то время как небольшая часть этих частиц может быть образована
при абляции твердого материала в условиях воздействия на этот материал
мощного теплового потока, большая часть частиц образуется в газовой
фазе в результате неполного сгорания и высокотемпературных реакций
пиролиза при низких концентрациях кислорода. Следует заметить, что
дым, состоящий из твердых частиц, может образоваться даже, если исходным горючим материалом является газ или жидкость.
49
Дымы обоих типов являются возгораемыми и могут образовывать
воспламеняемую атмосферу. При поджигании такой атмосферы может
произойти взрыв.
Концентрацию твердых частиц в дыме выражают в кг/м3 или количеством частиц в единице объема (в 1 м3). Весовая концентрация дисперсной фазы в дыме, образующейся на пожарах, колеблется в широких
пределах и составляет обычно от десятых долей до (6-7)⋅10-3 кг/м3, что
соответствует содержанию в 1⋅10-6 м3 (1 см3) дыма нескольких миллионов твердых частиц. Так, на пожаре при горении древесины и хлопчатобумажной ткани концентрация твердых частиц в дыме в разных местах
помещения составляла от 0,1⋅10-4 до 6,5⋅10-3 кг/м3.
Частицы, составляющие дым, подвергаются воздействию двух противоположно направленных сил: силы тяжести, которая увлекает твердые частицы вниз и ведет к их оседанию, и силы аэродинамического сопротивления. Твердые частицы дисперсной фазы дыма с радиусом менее
1⋅10-5 м при падении быстро достигают постоянной скорости, при которой аэродинамическое сопротивление, действующее на частицу, становится равным силе тяжести, действующей на частицу.
Если размер частицы дисперсной фазы соизмерим со средней длиной
свободного пробега молекул дисперсионной среды дыма, то удары молекул
газа о поверхность частицы приводят к броуновскому движению, которое
накладывается на процесс оседания частиц. Следовательно, броуновское
движение придает кинетическую устойчивость частицам дисперсной фазы.
Кинетической устойчивостью называется способность дисперсных
частиц удерживаться по взвешенном состоянии, не оседая и распределяясь в
пространстве (по высоте) по определенному закону.
Решающим условием кинетической устойчивости дисперсной фазы
дыма является степень ее дисперсности. Чем выше степень дисперсности фазы, тем больше сказывается броуновское движение. Следовательно, тем выше кинетическая устойчивость.
50
Экспериментальные данные свидетельствуют, что скорость оседания
частиц уменьшается с уменьшением радиуса частиц, а скорость броуновского движения возрастает. Расчеты, даже без учета броуновского движения,
показывают, что частицы с радиусом не выше 1⋅10-5 м оседают медленно.
Так, при радиусе частицы 1⋅10-7 м и плотности дисперсной фазы 1⋅103 кг/м3
скорость оседания будет равна:
υ к ≈1⋅ 10-6 м/с.
(2.13)
Таким образом, за 3 ч частица пройдет путь, равный приблизительно
1⋅ 10-2 м (1 см). Следовательно, перемещение облака дыма в основном определяется ветром, а при его отсутствии - конвективными потоками в атмосфере,
а не воздействием силы тяжести.
Дым как дисперсная система проявляет, кроме того, и агрегативную
устойчивость.
Под агрегативной устойчивостью дисперсных систем понимается
способность твердых частиц дисперсной фазы удерживать определенную
степень дисперсности этой фазы путем сопротивления частиц к слипанию.
Эта устойчивость возникает за счет имеющегося на частицах одноименного электрического заряда или пленки адсорбированного газа. Приобрести электрический заряд частицы дисперсной фазы дыма могут при трении
о дисперсионную газовую среду либо за счет адсорбции, возникающих при
горении ионов.
Дым, образующийся при пожарах, особенно в закрытых помещениях,
затрудняет действие пожарных подразделений. Во время организации тушения пожара принимают меры по устранению устойчивости дыма. Для этого используют аппараты, принудительно создающие поток дыма. Во время движения дымового облака столкновение частиц приводит к их слипанию (коагуляции), что ведет к увеличению размера частиц, а, следовательно, к
быстрому выделению их из дисперсионной среды и рассеиванию дыма.
На движение дыма в условиях пожара влияют следующие факторы:
1. Воздействие ветра. Ветер создает избыточное давление и с обрат-
51
ной стороны сооружения – разрежение. Его сила превосходит другие, возникающие на пожаре естественные явления. Ветер может изменить продолжительность пожара. Он может дуть в разных направлениях на различных уровнях высотного здания, особенно в местах скопления газов,
способствующих проявлению "каньон эффекта". Действие ветра усиливается при наличии открытых проемов в здании. Следует особо отметить,
что особенности движения воздушного потока, создаваемого ветром на
пожаре, могут не соответствовать информации, сообщаемой ближайшей
метеорологической станцией.
2. Эффект дымовой трубы. Эффект этот создается в результате различия
в температурах внутри и снаружи здания. Чем больше это различие, тем
больше эффект дымовой трубы. Создающееся по этой причине движение
воздуха с нижнего до верхнего этажа здания, благодаря имеющимся отверстиям, может сигнализировать также о начавшемся в нижних этажах пожаре
по присутствию газообразных продуктов разложении примешивающихся к
воздушному потоку.
3. Действие системы кондиционирования воздуха и вентиляции. Должно
учитываться возможное влияние этой системы на развитие пожара.
4. Действие дымоудаляющего оборудования, которое может устанавливаться в зданиях для вентиляции площади возможного пожара.
5. Влияние открытых проемов в здании. Особенно большие проемы могут разрывать действие эффекта дымовой трубы, усиливать влияние ветра и
препятствовать операциям механического оборудования по дымоудалению.
В связи с этим важной информацией для исследователя развития пожара является знание, когда и каким путем образовались открытые проемы.
6. Влияние атмосферных условий. Падение температуры, наблюдаемое в
атмосфере по высоте, способствует движению дыма вверх и удалению от места пожара. Наличие слоя воздуха, более теплого по сравнению с нижележащим, создает условия, при которых такой слой (инверсионный слой) может
действовать как крыша для поднимающегося дыма. В высотных домах по-
52
следний может проникать в инверсионный слой, что служит причиной значительных различий в местонахождении дыма выше и ниже такого слоя.
Присутствие твердой дисперсной фазы обусловливает непрозрачность
дыма. Степень понижения прозрачности зависит от концентрации, размера
и природы частиц дисперсной фазы. Частицы дыма способны как поглощать
свет, так и рассеивать его. В том случае, когда размер частиц дыма значительно
меньше длины волны проходящего через него света, интенсивность рассеянного света быстро растет с увеличением размера частиц дыма.
Задымление на пожаре резко ухудшает видимость, что значительно
затрудняет действия пожарных подразделений и осложняет обстановку тушения
пожара. В связи с этим большой интерес представляет оценка плотности
дыма на пожарах.
Под плотностью дыма D д понимают отношение интенсивности света
ℑ п , прошедшего через слой дыма, к интенсивности падающего света ℑ о .
D д =ℑ п /ℑ о =ехр(-КGl сл )
где
(2.14)
К - коэффициент поглощения;
G - весовая концентрация дыма, кг/м3;
l сл - толщина слоя дыма, м.
Один из основных параметров, характеризующих обстановку на пожаре - интенсивность или плотность задымления.
Интенсивность или плотность задымления, z [г/м3], [м] - это параметры пожара, характеризующиеся ухудшением видимости и степенью токсичности в зоне задымления.
Ухудшение видимости при задымлении определяется оптической
плотностью дыма. Она оценивается по толщине слоя дыма, через которую не
виден свет эталонной лампы (мощностью 21 Вт) или по количеству твердых
частиц, содержащихся в единице объема.
В зависимости от плотности задымления дым бывает оптически плотный, средней плотности, оптически слабый.
53
Таблица 2.2
Наименование
дыма
Оптически плотный
Плотность дыма,
г. твердой фазы/м3
> 1,5
Видимость предметов,
освещаемых лампой (21 Вт), м
до 3
Средней плотности
0,6 - 1,5
до 6
Оптически слабый
0,1 - 0,6
до 12
Под дымообразованием на пожаре понимают количество дыма, м3/с,
выделяемого со всей площади пожара. Оно может быть определено из соотношения:
Vd = ϕυ mVпг S п
где
Td
To
(2.15)
ϕ - коэффициент пропорциональности;
ν m – массовая скорость выгорания;
V пг – объем продуктов горения, образовавшихся при сжигании одного
килограмма горючего, м3/кг;
S п – площадь пожара, м2;
T d и T o – температура дыма и окружающей среды (соответственно), К.
Коэффициент дымообразования (D m )- (только для ТГМ) показатель,
характеризующий оптическую плотность дыма, образующегося при пламенном горении или термоокислительной деструкции (тлении) определенного
количества твердого вещества (материала) в условиях специальных испытаний (ГОСТ 12.1.044-89).
Различают три группы материалов:
- с малой дымообразующей способностью - D m до 50 м2⋅кг-1 включит.;
- с умеренной дымообразующей способностью - D m свыше 50 до 500
м2⋅кг-1 включит.;
- с высокой дымообразующей способностью - D m свыше 500 м2⋅кг-1.
Коэффициент дымообразования (D m ) в м2⋅кг-1 вычисляют по формуле
(п. 4.18. ГОСТ 12.1.044-89):
54
Dm =
T
V
ln o
L ⋅ m Tmin
(2.16)
где V – вместимость камеры измерения, м3;
L – длина пути луча света в задымленной среде, м;
m – масса образца, кг;
Т о , Т min – соответственно значения начального и конечного светопропускания, %.
Коэффициент дымообразования используют для классификации материалов по дымообразующей способности. Этот показатель можно использовать также в расчетах систем противодымной защиты объектов.
Примеры дымообразующей способности строительных материалов при
тлении (горении), м3/кг:
Древесное волокно (береза, осина) – 62 (20);
Декоративный бумажно-слоистый пластик – 75 (6);
Фанера марки ФСФ – 140 (30);
ДВП, облицованная пластиком – 170 (25).
В большинстве случаев при пламенном горении выделяется меньше
дыма, чем при тлении.
В составе дисперсионной среды дыма, образующегося на пожарах при горении органических веществ, кроме продуктов полного и неполного сгорания,
содержатся продукты термоокислительного разложения горючих веществ. Образуются они при нагреве еще негорящих горючих веществ, находящихся в
среде воздуха или дыма, содержащего кислород. Обычно это происходит перед факелом пламени или в верхних частях помещений, где находятся нагретые продукты сгорания.
Состав продуктов термоокислительного разложения зависит от химической природы горючих веществ, температуры и условий контакта с окислителем
(в частности, - от коэффициента избытка воздуха). Так, исследования показывают, что при термоокислительном разложении горючих веществ, в молеку-
55
лах которых содержатся гидроксильные группы, всегда образуется вода. Если
в составе горючих веществ находятся углерод, водород и кислород, продуктами термоокислительного разложения чаще всего являются углеводороды,
спирты, альдегиды, кетоны и органические кислоты. Если в составе горючих
веществ, кроме перечисленных элементов, есть хлор или азот, то в дыме
находятся также хлористый и цианистый водород, окислы азота и другие соединения.
Концентрация продуктов термоокислительного разложения в дыме одних и тех же горючих веществ непостоянна и во многом зависит от условий
горения. В связи с этим концентрацию их в дыме определяют опытным путем.
Большинство продуктов термоокислительного разложения, так же как
и продукты неполного сгорания, способны гореть. На пожарах при достаточном притоке воздуха к очагу горения эти вещества в дыме смешаны с продуктами полного сгорания и концентрация их невелика, поэтому горючей
смеси они образовать не могут. На пожарах в зданиях при недостаточном
притоке воздуха к очагу горения или при тлении твердых горючих веществ
концентрация продуктов неполного сгорания и термоокислительного разложения в дыме значительно увеличивается, а продуктов полного сгорания уменьшается. Это ведет к образованию дыма, способного гореть при условии
притока к нему свежего воздуха и даже создавать взрывоопасную газовую
смесь. В практике тушения пожаров были случаи, когда после открывания закрытых помещений, где происходил пожар, наблюдался взрыв. Взрывоопасная
смесь возникала в результате поступления в помещение воздуха и смешения его
с дымом, содержащим большое количество продуктов неполного сгорания и
термоокислительного разложения.
Входящие в состав дыма углекислоты и продукты неполного сгорания и
термоокислительного разложения представляют опасность для человека. Основная составная часть дыма - углекислый газ - в малых концентрациях не
представляет большой опасности: его 1,5%-ную концентрацию в воздухе чело-
56
век переносит без вреда для организма при многочасовом воздействии. При
концентрации 3-4,5% этот газ становится опасным для жизни при получасовом
вдыхании, а концентрация 8-10% вызывает быструю потерю сознания и
смерть.
Другой продукт окисления углерода - окись углерода - присутствует не
в каждом дыме, а только при горении органических веществ, особенно, когда
горение протекает при недостатке воздуха. Окись углерода - отравляющее
вещество. Вдыхание воздуха, содержащего 0,4% окиси углерода в течение
300 с смертельно. На пожарах в помещениях концентрации окиси углерода в
дыме могут превышать указанную величину, поэтому тушение пожаров в
помещениях производят только в кислородных изолирующих противогазах.
В последние десятилетия наблюдается резкое расширение производства и использования новых химических материалов в промышленности,
строительстве и быту (различные полимерные материалы: пластмассы, декоративные пластики и др.). В дыме этих продуктов могут присутствовать хлористый водород, сероводород, окислы азота, синильная кислота и многие
другие вредные для дыхания вещества.
Задания для самоконтроля
1. На какие группы подразделяются горючие вещества при расчетах материального
и теплового баланса?
2. Как связаны между собой коэффициент избытка воздуха и остаточное содержание кислорода в продуктах горения?
3. При каком значении коэффициента избытка воздуха смесь называется бедной по
горючему?
4. В каком случае коэффициент избытка воздуха равен 1?
5. Как изменится объем продуктов горения при α = 2?
6. Какие значения принимает коэффициент избытка воздуха для открытых пожаров?
7. Какой объем воздуха необходим для полного сгорания 15 кг бутиламина
С 4 Н 9 NH 2 ? Температура – 50С, давление 1,1 ат, коэффициент избытка воздуха 1,4.
8. Рассчитать объем воздуха, необходимый для полного сгорания 25 м3 светильного
газа, состоящего из 3 % диоксида углерода, 8 % оксида углерода, 35 % метана, 48 % водорода, 3 % азота и 3 % этана. Условия нормальные, α = 1,5.
9. Какой объем воздуха необходим для полного сгорания 100 кг древесины, состоящей из 46 % углерода, 6 % водорода, 42 % кислорода, 2 % азота, 2 % воды и 2 % золы,
при t =170С и р =1,3 ат, α = 2,1.
57
10. Сгорело 10 кг пропанола С 3 Н 7 ОН. Определить объем и процентный состав образовавшихся продуктов горения. t =170С и р =1,3 ат, α = 2,2.
11. Определить объем и процентный состав продуктов горения, образовавшихся при
полном сгорании 1000 м3 генераторного газа, состоящего из 24 % диоксида углерода, 7 %
водорода, 1 % метана, 5 % оксида углерода и 63 % азота. Условия стандартные, α = 1,3.
12. Определить объем и процентный состав продуктов горения, образовавшихся при
полном сгорании 3 кг нитроклетчатки, состоящей из 28,6 % углерода, 57,1 % кислорода,
3,2 % водорода и 11,1 % азота, при t =20 °С и р =110 КПа, α = 2,0.
ГЛАВА 3. ТЕПЛОВОЙ БАЛАНС ПРОЦЕССОВ ГОРЕНИЯ
Тепловое воздействие – один из наиболее опасных факторов пожара,
который вызывает основные разрушения, уничтожает материальные ценности, вызывает гибель людей, определяет обстановку на пожаре, создает
огромные трудности при его ликвидации. Расчет тепловых явлений, сопровождающих горение, позволяет принять правильные и своевременные меры
противопожарные защиты.
3.1. Уравнение теплового баланса процесса горения
Тепловой баланс процесса горения складывается из следующих составляющих:
Приход:
Основная статья приходной части теплового баланса – это теплота горения вещества Q гор .
Вторая составляющая – Q исх – теплота исходных веществ, т.е. теплосодержание горючего и окислителя. Эта величина зависит от агрегатного состояния и химической природы горючего. Например, для метана Q исх < 1 %, а
для древесины ≈ 3%.
Расход:
Q ПГ – теплота, уходящая с продуктами горения. Так как продукты горения создают конвективный поток над пламенем, то Q ПГ называют также
теплотой конвекции или конвективной теплотой. Q ПГ колеблется в пределах
58
35 – 95 % от Q гор .
Q недожог – это часть химической энергии исходного горючего вещества,
заключенная в продуктах неполного горения, уходящих из пламени. В зависимости от условий газообмена и вида горючего. Q недожог составляет 5 – 25 %
от Q гор .
Q излуч – теплота излучения пламени. Небольшая часть ее уходит с конвективным потоком, а также падает на горящую поверхность, основная часть
излучается в окружающую среду. Величина Q излуч достигает до 40 % от Q гор .
С учетом перечисленных составляющих уравнение теплового баланса
процесса горения будет выглядеть следующим образом:
Q исх + Q гор = Q ПГ + Q недожог + Q излуч
______________
(3.1)
____________________________
приход
расход
Анализ этого уравнения показывает, что практически единственным
источником тепловой энергии любого процесса горения, а значит, и любого
пожара, является тепловой эффект химических реакций окисления в пламени, т.е. теплота горения, которая относится к важнейшим характеристикам
пожарной опасности веществ и материалов.
3.2. Расчет теплоты горения
Энтальпией горения (∆Н гор , кДж/моль) вещества называется тепловой
эффект реакции окисления 1 моль горючего вещества с образованием высших оксидов.
Теплота горения (Q гор ) численно равна энтальпии горения, но противоположна по знаку.
Для индивидуальных веществ тепловой эффект реакции может быть
рассчитан по I следствию закона Гесса.
59
Расчет теплового
эффекта реакции горения
индивидуального вещества
Пример 3.1. Рассчитать тепловой эффект реакции горения 1 моль бутана С 4 Н 10 .
1. Запишем уравнение реакции горения бутана.
С 4 Н 10 + 6,5(О 2 +3,76 N 2 ) = 4СО 2 + 5Н 2 О + 6,5⋅3,76 N 2
2. Выражение для теплового эффекта этой реакции по I следствию закона Гесса
∆Н0 р-и = 4∆Н0(СО 2 ) + 5∆Н0(Н 2 О) - ∆Н0(С 4 Н 10 ).
3. По таблице 1 приложения находим значения энтальпий образования углекислого
газа, воды (газообразной) и бутана.
∆Н0(СО 2 ) = −393,5 кДж/моль; ∆Н0(Н 2 О) = − 241,8 кДж/моль;
∆Н0(С 4 Н 10 ) = − 126, 2 кДж/моль.
Подставляем эти значения в выражение для теплового эффекта реакции
∆Н0 р-и = 4⋅(–393,5) + 5⋅(–241,8) – (− 126,2) = − 2656,8 кДж
∆Н0 р-и = ∆Н0 гор = − 2656,8 кДж/моль или Q гор = + 2656,8 кДж/моль.
Таким образом, при сгорании 1 моля бутана выделяется 2656,8 кДж тепла.
В пожарно-технических расчетах часто пользуются понятием удельной
теплоты горения. Удельная теплота горения – это количество теплоты, которое выделяется при полном сгорании единицы массы или объема горючего
вещества. Размерность удельной теплоты горения – кДж/кг или кДж/м3.
В зависимости от агрегатного состояния воды в продуктах горения различают низшую и высшую теплоту горения. Если вода находится в парообразном состоянии, то теплоту горения называют низшей теплотой горения
Q н . Если пары воды конденсируются в жидкость, то теплота горения – высшая Q в .
Температура пламени достигает 1000 К и выше, а вода кипит при
373 К, поэтому в продуктах горения на пожаре вода всегда находится в парообразном состоянии, и для расчетов в пожарном деле используется низшая
теплота горения Q н .
Низшая теплота горения индивидуальных веществ может быть определена переводом значения ∆Н гор , кДж/моль в Q н , кДж/кг или кДж/м3. Для веществ сложного элементного состава низшая теплота горения может быть
определена по формуле Д.И. Менделеева. Кроме того, для многих веществ
60
значения низшей теплоты горения приведены в справочной литературе, некоторые данные представлены в приложении 2.
Перевод значения
энтальпии горения из
кДж/моль в кДж/кг
Пример 3.2. Энтальпия горения этилацетата
СН 3 СООС 2 Н 5 равна ∆Н гор = − 2256,3 кДж/моль. Выразить
эту величину в кДж/кг.
Значение ∆Н гор = − 2256,3 кДж/моль показывает, что при сгорании 1 моля этилацетата выделяется 2256,3 кДж тепла, т.е. Q гор = + 2256,3 кДж/моль.
1 моль СН 3 СООС 2 Н 5 имеет массу 88 г. Можно составить пропорцию
М (СН 3 СООС 2 Н 5 ) = 88 г/моль
1 кг = 1000 г
Qн =
Q гор = 2256,3 кДж/моль
Q н кДж/кг
1000 ⋅ 2256,3
= 25639,8 кДж/кг
88
В общем виде формула для перевода из размерности кДж/моль в кДж/кг
выглядит следующим образом:
1000 ⋅ ∆Н
кДж
моль
; кДж/кг
(3.2)
г
M
моль
Если необходимо осуществить перевод из размерности кДж/моль в кДж/м3, то
можно воспользоваться формулой
кДж
1000 ⋅ ∆Н
моль , кДж/м3.
(3.3)
Qн =
л
VM
моль
Qн =
Расчет низшей теплоты
сгорания Q н по формуле
Д.И. Менделеева
Пример 3.3. Вычислить низшую теплоту сгорания
сульфадимезина С 12 Н 14 О 2 N 4 S по формуле
Д.И. Менделеева.
Значения низшей теплоты сгорания веществ и материалов могут быть рассчитаны
по формуле Д.И.Менделеева. Данная формула может быть использована для расчетов Q н
веществ сложного элементного состава, а также для любых индивидуальных веществ, если предварительно рассчитать массовую долю каждого элемента в соединении (ω).
Q Н = 339,4⋅ω(C) + 1257⋅ω(H) − 108,9 [(ω(O) +ω(N)) −ω(S)] − 25,1[9⋅ω(H) +ω(W)], кДж/кг,
(3.4)
где
ω (С), ω (Н), ω (S), ω (О),ω (N) – – массовые доли элементов в веществе, %; ω (W) – содержание влаги в веществе, %.
61
1. Для того, чтобы воспользоваться данной формулой, необходим расчет процентного состава каждого элемента в веществе (массовой доли).
Молярная масса сульфадимезина С 12 Н 14 О 2 N 4 S составляет 278 г/моль.
ω(C) = (12⋅12)/278 = 144/278 = 0,518 ⋅100 = 51,8 %
ω(H) = (1⋅14)/278 = 14/278 = 0,05 ⋅100 = 5,0 %
ω(O) = (16⋅2)/278 = 32/278 = 0,115 ⋅100 = 11,5 %
ω(N) = (14⋅4)/278 = 56/278 = 0,202 ⋅100 = 20,2 %
ω(S) = 100 – (51,8 + 5,0 + 11,5 + 20,2) = 11,5 %
2. Подставляем найденные значения в формулу Д.И. Менделеева.
Q Н = 339,4⋅51,8+1257⋅5,0−108,9⋅(11,5+20,2−11,5)−25,1⋅9⋅5,0 = 22741 кДж/кг.
Теплота горения смеси газов и паров определяется как сумма произведений теплот горения каждого горючего компонента (Q н ) на его объемную
долю в смеси (ϕоб):
Q н = Qн (1) ⋅
ϕ1 об
100
+ Qн ( 2 ) ⋅
ϕ 2 об
100
+ Qн (3) ⋅
ϕ3об
100
+ ... , кДж/м3.
(3.5)
Можно воспользоваться эмпирической формулой для расчета Q н для
газовой смеси:
Q н = 126,5⋅ϕ(СО) + 107,7⋅ϕ(Н 2 ) + 358,2⋅ϕ(СН 4 ) + 590,8⋅ϕ(С 2 Н 4 ) + 636,9⋅ϕ(С 2 Н 6 ) +
+ 913,4⋅ϕ(С 3 Н 8 ) + 1185,8⋅ϕ(С 4 Н 10 ) + 1462,3⋅ϕ(С 5 Н 12 ) + 234,6⋅ϕ(Н 2 S), кДж/м3
(3.6)
3.3. Расчет температуры горения
Выделяющееся в зоне горения тепло расходуется на нагревание продуктов горения, на нагрев горючего вещества и окружающей среды. Та температура, до которой в процессе горения нагреваются продукты горения,
называется температурой горения. В технике и пожарном деле различают
теоретическую, калориметрическую, адиабатическую и действительную
температуру горения (табл.3.1).
Таблица 3.1.
Условия определения и область применения температуры горения
Температура горения
Теоретическая
Калориметрическая
Адиабатическая
Действительная
Условия определения
Учет
Q потерь
α
диссоциации
ПГ
0
0
0
≠0
1
1
≠1
≠1
да
нет
нет
нет
Область применения
Сравнение
промышленных топлив
Пожарно-технические
расчеты
62
Теоретическая температура горения – это температура, при которой
выделившаяся теплота горения смеси стехиометрического состава расходуется на нагрев и диссоциацию продуктов горения. Практически диссоциация
продуктов горения начинается при температурах выше 2000 К.
Калориметрическая температура горения – это температура, которая достигается при горении стехиометрической горючей смеси, с начальной
температурой 273 К и при отсутствии потерь в окружающую среду.
Теоретическая и калориметрическая температура горения парогазовых
смесей широко используется при оценке пожарной опасности веществ. Кроме того, ее можно применять для расчета максимального давления взрыва
при горении парогазовой смеси в замкнутом объеме.
Калориметрическая температура горения некоторых веществ приведена в таблице 3.2.
Калориметрическая температура горения
некоторых видов топлив
Топливо
Древесина
Торф
Бурый уголь
Каменный уголь
Антрацит
Мазут
t г , 0С
1855
1700
1875
2100
2270
2125
Таблица 3.2.
Топливо
Угарный газ СО
Водород Н 2
Коксовый газ
Метан СН 4
Природный газ
доменный газ
t г , 0С
2370
2230
2090
2030
2020
1410
Адиабатическая температура горения – это температура полного
сгорания смесей любого состава (коэффициент избытка воздуха α > 1) при
отсутствии потерь в окружающую среду.
С увеличением коэффициента избытка воздуха α в продуктах горения
появляется дополнительное (по сравнению с теоретическим) количество воздуха , на подогрев которого затрачивается теплота. Это сопровождается
уменьшением температуры, что видно из данных таблицы 3.3.
63
Таблица 3.3.
Зависимость температуры горения (0С) от
коэффициента избытка воздуха для различных топлив
Топливо
Бурый уголь
Мазут
Природный газ
1,0
1875
2125
2000
Коэффициент избытка воздуха
1,3
1,5
1590
1425
1740
1580
1749
1478
2,0
1150
1265
1167
Действительная температура горения – это температура горения,
достигаемая в условиях реального пожара. Она намного ниже теоретической,
калориметрической и адиабатической, т.к. в реальных условиях до 40 % теплоты горения обычно теряется на излучение, недожог и т.п.
Экспериментальное определение температуры горения для большинства горючих веществ представляет значительные трудности, особенно для
жидкостей и твердых материалов. Однако в ряде случаев теория позволяет с
достаточной для практики точностью вычислить температуру горения веществ, основываясь на знании их химической формулы, состава исходной
смеси и продуктов горения. При расчетах исходят из того, что при быстром
сгорании газо- и паровоздушных смесей развивается высокая температура. В
этих условиях из-за большой скорости химических реакций к моменту окончания горения система приходит в состояние химического равновесия, и по
этой причине при расчете можно применить законы термодинамики.
В общем случае для вычислений используется следующая зависимость:
Q ПГ = V ПГ ⋅ С р ⋅Т Г , где
(3.7)
Q ПГ – теплота (теплосодержание) продуктов горения, кДж/кг;
V ПГ – объем продуктов горения, м3/кг;
С р – средняя объемная теплоемкость смеси продуктов горения в интервале
температур от
Т 0 до Т г , кДж/м3⋅К;
Т Г – температура горения, К.
64
При расчете калориметрической температуры горения исходят из того,
что теплопотери в окружающую среду отсутствуют, и в этом случае низшая
теплота сгорания горючего вещества (Q н ) равна теплосодержанию продуктов
горения (Q ПГ ), т.е. энергии, необходимой для нагревания продуктов горения
от 00С до теоретической температуры горения.
В реальных условиях температура горения зависит не только от состава
горючего материала, но и от условий горения: разбавления продуктов горения избыточным воздухом (что учитывается коэффициентом избытка воздуха α), начальной температуры воздуха, полноты сгорания исходного горючего материала и наличия теплопотерь (коэффицент теплопотерь η).
Q потерь = Q излучения + Q недожог + Q диссоциации ПГ
(3.8)
В зависимости от рода учитываемых потерь теплоты из зоны горения
вычисляется та или иная температура горения.
Расчет температуры горения проводят по уравнению энергетического
баланса:
Q н ⋅ (1 – η) = V ПГ пр ⋅ С р ⋅ (Т Г – Т 0 )
(3.9)
где
Q н – тепло, выделяемое в реакции горения, кДж;
η – коэффициент теплопотерь;
Q н ⋅ (1 – η)= Q ПГ ;
V ПГ пр – объем продуктов полного горения с учетом избытка воздуха, м3;
С р – средняя объемная теплоемкость продуктов горения при постоянном
давлении, кДж/м3⋅К;
Т Г – температура горения, К;
Т 0 – начальная температура, К.
Из уравнения (3.9) следует, что для расчета температуры горения необходимо знать теплоту горения, объем и теплоемкость продуктов горения.
В первом приближении температуру горения можно рассчитать непосредственно из уравнения (3.7), имея в виду, что средняя теплоемкость газо-
65
образных продуктов горения в интервале температур 1500 – 2500 К может
быть принята равной С р = 1,75 кДж/м3⋅К. Однако, теплоемкость зависит от
температуры, и поэтому для более точных расчетов значения теплоемкостей
берут из таблиц (приложение 3 и 4), а подсчет производят методом последовательных приближений (методом итераций), каждый раз определяя теплосодержание продуктов горения при выбранной температуре.
Алгоритм расчета температуры горения
1. Рассчитать суммарный объем продуктов горения и отдельно объем каждого компонента продуктов горения.
V ПГ пр = V(CO 2 ) + V(H 2 O) + V(N 2 ) + V(SO 2 ) + ∆V возд
Расчет объема продуктов горения выполняется в зависимости от характера горючего вещества (индивидуальное вещество, смесь газов или вещество сложного элементного
состава). Методика расчета приведена в примерах 2.8, 2.9, и 2.10.
Для индивидуальных веществ можно также определять количество продуктов горения в молях (коэффициенты в уравнении реакции горения).
2. Рассчитать низшую теплоту сгорания вещества.
Для индивидуальных веществ расчет выполняется по I следствию закона Гесса
(при наличии табличных значений энтальпий образования).
По формуле Д.И. Менделеева (3.4) расчет Q н может быть выполнен как для веществ с известным элементным составом, так и для индивидуальных веществ.
Для газовых смесей Q н рассчитывается по формулам (3.5) и 3.6).
3. Если по условию задачи есть теплопотери (η), то рассчитывается количество
тепла, пошедшего на нагрев продуктов горения Q ПГ
Q ПГ = Q н (1 – η), кДж/кг или кДж/м3
(3.9)
4. Находим среднее теплосодержание продуктов горения Q ср
при отсутствии теплопотерь (η)
Q
Q ср = прн , кДж/м3
VПГ
при наличии теплопотерь
Q
Q ср = ПГ
, кДж/м3
пр
VПГ
(3.10)
(3.11)
5. По значению Q ср с помощью таблиц приложений 3 и 4 (“Теплосодержание газов
при постоянном давлении”), ориентируясь на азот , приближенно определяем температуру
горения Т 1 .
66
При подборе температуры горения ориентируются на азот, т.к. в большей степени
продукты горения состоят именно из азота. Однако, поскольку теплосодержание углекислого газа и паров воды выше, чем у азота, то их присутствие в продуктах горения несколько понижает температуру горения, поэтому ее нужно принимать несколько ниже (на
100-2000С), чем по азоту.
Т1:
6. Рассчитываем теплосодержание продуктов горения при выбранной температуре
Q1ПГ = Q1 (CO2 ) ⋅ V (CO2 ) + Q1 ( H 2O) ⋅ V ( H 2O) + Q1 ( N 2 ) ⋅ V ( N 2 ) + Q1 ( SO2 ) ⋅ V ( SO2 ) + Q1 (возд) ⋅ ∆V (в )
(3.12)
где
Q1(CO 2 ), Q1(H 2 O), Q1(N 2 ), Q1(SO 2 ), Q1(возд) – табличные значения теплосодержания газов
при выбранной температуре Т 1 .
7. Сравниваем Q1 ПГ с Q н или Q ПГ , рассчитанных по п.2 или п.3.
Если Q1 ПГ < Q н (Q ПГ ), то выбираем температуру Т 2 > Т 1 на 1000С;
если Q1 ПГ > Q н (Q ПГ ), то выбираем температуру Т 2 < Т 1 на 1000С .
Т2:
8. Повторяем расчет теплосодержания продуктов горения при новой температуре
2
= Q 2 (CO2 ) ⋅ V (CO2 ) + Q 2 ( H 2O) ⋅ V ( H 2O) + Q 2 ( N 2 ) ⋅ V ( N 2 ) + Q 2 ( SO2 ) ⋅ V ( SO2 ) + Q 2 (возд) ⋅ ∆V (в )
QПГ
9. Расчет проводим до получения неравенства:
Q1 ПГ < Q н (Q ПГ ) < Q2 ПГ , где
Q1 ПГ и Q2 ПГ – теплосодержание продуктов горения при температурах Т 1 и Т 2 ,
отличающихся на 1000С.
10. Интерполяцией определяем температуру горения Т Г :
ТГ = Т1 +
QПГ − Q1ПГ
⋅ (Т 2 − Т1 )
2
QПГ
− Q1ПГ
(3.13)
Если потери тепла не учитывались, то получаем адиабатическую температуру горения, а если учитывались, то − действительную температуру горения вещества.
Пример 3.4. Вычислить действительную температуру
Расчет действительной
горения анилина С 6 Н 5 NH 2 , если потери тепла излучением
температуры горения
составляют 20 %, а горение протекает с коэффициентом
индивидуального вещества
избытка воздуха 1,1.
1. Составляем уравнение реакции горения анилина:
С 6 Н 5 NH 2 + 7,75(O 2 + 3,76 N 2 ) = 6 CO 2 + 3,5 H 2 O + 7,75⋅3,76 N 2 + 0,5 N 2
67
По уравнению реакции горения определяем число моль (киломоль) продуктов горения и число моль (киломоль) избытка воздуха:
моль
n в теор = 7,75 ⋅ 4,76 = 36,89 моль
∆n в = n в теор (α –1) = 36,89 (1,1 – 1) = 3,689 моль
n пг пр = n(СО 2 )+n(Н 2 О) n(N 2 )+n(∆V в ) = 6 + 3,5 + 7,75⋅3,76 + 0,5 + 3,689 = 42,829
2. Теплота горения анилина по справочным данным [17] составляет
Q гор = 3484, кДж/моль = 3484000 Дж/моль
3. По условию задачи теплопотери составляют 20 %, следовательно, η = 0,2.
Q ПГ = 3484000(1 – 0,2) = 2787200 Дж/моль (кДж/кмоль)
4. Определяем среднее теплосодержание продуктов горения:
QПГ 2787200
Q ср = пр
=
= 65077,4 кДж
42,829
nПГ
5. По таблице приложения 3, ориентируясь на азот, определяем Т 1 = 18000С
6. Рассчитываем теплосодержание продуктов горения при 18000С.
Q ПГ 1800 = 96579,5⋅6 + 77598,8⋅3,5 + 59539,9⋅7,75⋅3,76 + 66000⋅3,689 = 2859312,7 кДж
7. Q ПГ 1800 = 2859312,7 > Q ПГ = 2787200 , следовательно, выбираем Т 2 = 17000С
8. Рассчитываем теплосодержание продуктов горения при 17000С.
Q ПГ 1700 = 90545,9⋅6 + 72445,1⋅3,5 + 55936,5⋅7,75⋅3,76 + 56397,4⋅3,689=2662844,5 кДж
Q ПГ 1700 = 2662844,5 < Q ПГ = 2787200, следовательно температура горения находится в интервале от 1700 до 18000С.
9. Рассчитываем температуру горения:
Т Г =1700 +
2787200 − 2662844
⋅ (1800 − 1700) = 17630С = 2036 К
2859312 − 2662844
Расчет действительной
температуры горения
сложного вещества с
известным элементным
составом
Пример 3.5. Вычислить действительную температуру
горения горючего сланца следующего состава: С – 35 %,
Н – 5 %, О – 10 %, S – 4 %, N – 1 %, W – 15 %, зола – 30 %.
Потери тепла излучением составляют 10 %, а горение протекает с коэффициентом избытка воздуха 1,2. Условия
нормальные.
1. По формулам (3.9) – (3.12) определяем объем каждого компонента продуктов горения 1 кг горючего сланца.
68
1,86 ⋅ 35
= 0,651 м3
100
11,2 ⋅ 5 1,24 ⋅15
= 0,746 м3
V(H 2 O) =
+
100
100
0,7 ⋅ 4
= 0,028 м3
V(SО 2 ) =
100
7 ⋅ 35 21 ⋅ 5 2,63 ⋅ 4 0,8 ⋅1 2,63 ⋅10
V(N 2 ) =
= 3,455 м3
−
+
+
+
100
100
100
100 100
V(СО 2 ) =
V ПГ = 0,651 + 0,746 + 0,028 + 3,455 = 4,88 м3
2. Горение протекает с коэффициентом избытка воздуха 1,2, следовательно, в состав продуктов горения будет входить избыточный воздух.
По формуле (3.8) определяем теоретический объем воздуха, необходимый для горения данной массы образца угля:
35
4 10
V в теор = 0,267( + 5 + − ) = 4,28 м3
3
8 8
Избыток воздуха определим по формуле (2.4):
∆V в = V в теор(α −1) = 4,28⋅(1,2 – 1) = 0,856 м3
С учетом избытка воздуха практический объем продуктов горения составит:
V ПГ * = V ПГ + ∆V в = 4,88 + 0,856 = 5,736 м3
3. Рассчитываем Q н по формуле Д.И. Менделеева.
Q н = 339,4⋅35 + 1257⋅5 – 108,9⋅(10 + 1 – 4) – 25,1⋅(9⋅5 + 15) = 15881,7 кДж/кг
4. С учетом теплопотерь определяем теплосодержание продуктов горения:
Q ПГ = 15881,7 (1,1 – 1) = 14293,53 кДж/кг
5. Определяем среднее теплосодержание продуктов горения:
QПГ 14293,53
=
= 2480,22 кДж/м3
пр
5,736
VПГ
По таблице приложения 4, ориентируясь на азот, определяем Т 1 = 15000С.
Q ср =
6. Определяем теплосодержание продуктов горения при 15000С:
Q ПГ 1500 = 3505,7⋅0,651 + 2781,3⋅0,746 + 2176,7⋅3,455 + 3488,2⋅0,028 + 2194,7⋅0,856 =
= 13853,889 кДж
7. Q ПГ 1500 = 13853,889 < Q ПГ = 14293,53, следовательно, выбираем Т 2 = 16000С.
8. Определяем теплосодержание продуктов горения при 16000С:
Q ПГ 1600 = 3771,4⋅0,651 + 3004,2⋅0,746 + 2335,5⋅3,455 + 3747,5⋅0,028 + 2355,2⋅0,856 =
= 14886,44 кДж
69
9. Q ПГ 1600= 14886,44 > Q ПГ = 14293,53, следовательно, температура горения вещества находится в интервале от 1500 до 16000С.
10. Определяем температуру горения:
Т Г =1500 +
14293,53 − 13853,889
⋅ (1600 − 1500) = 15560С = 1829 К
14886,44 − 13853,889
Задания для самоконтроля
1. Написать уравнение теплового баланса для процессов горения.
2. Что такое удельная теплота горения, ее размерность ?
3. Чем отличается низшая теплота горения от высшей?
4. Как связаны энтальпия и теплота горения?
5. Энтальпия горения этана ∆Н ГОР = - 1430,4 кДж/моль. Чему равно значение теплоты горения этана в кДж/моль и кДж/м3. Условия стандартные.
6. Энтальпия горения нафталина С 10 Н 8 ∆Н ГОР = - 5161,2 кДж/моль. Выразить величину теплоты горения этого вещества в кДж/кг.
7. Перечислите температуры горения.
8. При расчете каких ТГ не учитывается диссоциация продуктов горения?
9. При расчете каких ТГ не учитываются теплопотери в окружающую среду?
10. При расчете каких ТГ принимается, что состав горючей смеси является стехиометрическим?
11. Рассчитать температуру горения бензола, если потери тепла излучением составляют 20 %, а коэффициент избытка воздуха 1,8.
12. Определить температуру горения торфа состава: 56,4 % углерода, 6,56 % водорода, 24,0 % кислорода, 0,6 % серы, 3,6 % азота и 9,84 % золы. η = 0,4, α = 2,0.
13. Вычислить температуру горения газовой смеси состава: пропан – 60 %, бутан –
40 %. η = 0,3, α = 1,7.
РАЗДЕЛ II. ТЕОРИИ ГОРЕНИЯ
ГЛАВА 4. ТЕПЛОВАЯ, ЦЕПНАЯ И ДИФФУЗИОННАЯ
ТЕОРИИ ГОРЕНИЯ
4.1. Тепловая теория горения
В существующем виде тепловую теорию разработали академики
Я.Б.Зельдович, Н.Н.Семенов и профессор Д.А.Франк-Каменецкий. В основе ее лежит представление о подобии полей концентраций и температуры
во фронте пламени.
Если с помощью оптического прибора рассмотреть кинетическое пламя в неподвижной горючей смеси, то можно увидеть следующую картину
70
(рис. 4. 1).
а)
Сгор,
Т
Т0
С0 q
Uн
Тг
С0
Т С1 = Т Г − θ
Тг Тпг
q
δпод
δгор
Т0
δфп
б)
δфп
Рис. 4.1. Схема фронта (а) и изменение температуры и концентрации
горючего (б) в кинетическом пламени
Справа находятся нагретые до высокой температуры Т пг продукты горения, слева - холодная с температурой Т 0 исходная горючая смесь, а
между ними - ярко светящаяся полоска - фронт пламени с толщиной δ. Горючий компонент во фронте пламени сгорает, и в продуктах горения его
концентрация практически равна нулю. Естественно, температура продуктов
горения Т пг = Т г >> Т 0 - температуры исходной смеси. Поскольку теплота
распространяется от горячего к холодному, в сторону исходной смеси будет
идти тепловой поток q, нагревая прилегающий к ней слой, так называемую
зону подогрева. Передача теплоты от нее осуществляется теплопроводностью. Смесь в этом слое воспламенится при достижении температуры самовоспламенения. Зона горения переместится туда, затем в следующий слой,
следующий и т.д. Фронт пламени будет непрерывно перемещаться до самой
границы горючей смеси. Такое распространение пламени называют нормальным или дефлаграционным горением.
Обратимся к рисунку 4.1 и составим уравнение теплового баланса для
71
фронта пламени. В результате сгорания 1 моля горючего газа или пара выделится Q кДж/моль теплоты и концентрация его понизится от C 0 до С. Теплота будет израсходована на нагрев горючей смеси от T 0 до T. Если принять
теплоемкость смеси постоянной, то уравнение материального баланса будет
иметь следующий вид:
Q(c 0 - c) = c р (Т - Т 0 ).
(4.1)
При T = T г концентрация горючего С = 0, т.е.
Q⋅c = c р (T г - T 0 ).
(4.2)
Разделив уравнение (4.1) на выражение (4.2), получим:
(c 0 – c)/с 0 = (T - T 0 )/(Т г – Т 0 ).
Это соотношение указывает на то, что во фронте пламени концентрация и
температура меняются по одному и тому же закону. Следовательно, скорость реакции горения зависит в основном от температуры. Это означает,
что реакции горения протекают в очень узкой части фронта пламени при
температурах, близких к максимальной температуре горения. Толщина зоны горения составляет менее одной десятой части фронта пламени:
δ гор ≈ 00,1δ фп .
4.1.1. Механизм химических реакций при горении
Акты химического превращения происходят при непосредственном
контакте реагирующих компонентов (молекул, атомов, радикалов), но только
в тех случаях, когда их энергия превышает определенный энергетический
предел, называемый энергией активации Е а . Изобразим графически изменение энергии реагирующих компонентов (горючего и окислителя) и продуктов
реакции при горении (рис.4.2)
По оси абсцисс изображен путь реакции горения, по оси ординат –
72
энергия. E H – средняя начальная энергия реагирующих компонентов,
E K - средняя энергия продуктов горения.
Е
Е̉
Еа пр.
Еа обр.
Ен
Ек
Ход реакции
Рис 4.2. Изменение энергии реагирующих веществ и продуктов
реакции при горении
В реакцию горения будут вступать только активные частицы горючего и окислителя, которые будут обладать энергией, необходимой для вступление во взаимодействие, т.е. способные преодолеть энергетический барьер
E ′ . Избыточная энергия активных частиц по сравнению со средней энергией
E H , называется энергией активации E a . Поскольку реакции, протекающие при горении являются экзотермическими E K ≤ E H . Разность
энергий образовавшихся продуктов горения и исходных веществ (горючего и
окислителя) определяет тепловой эффект реакции:
73
Q = Eк − Е Н
N /N0
(4.3)
при Т 1
при Т 2
E
E0
Рис. 4.3. Распределение частиц по энергиям:
N – число частиц с данной энергией;
N0 – общее число частиц.
Доля активных молекул возрастает при увеличении температуры горючей смеси.
На рис.4.3. изображено распределение энергий между молекулами
при температуре Т 1 Если по оси энергий отметить значение, равное энергии
активации E a , то получим долю активных молекул в смеси при заданной
температуре Т 1 . Если под действием источника тепла температура смеси возросла до значения Т 2 , то возрастет и доля активных молекул, а следовательно, и скорость реакции горения.
4.1.2. Факторы, влияющие на скорость реакций горения
Для реакции горения в общем виде аГор + bОк = ∑ ni ПГ i
(1.2)
зависимость скорости реакции от концентрации реагирующих веществ можно представить выражением
x
V = k 0 ⋅ C гор
⋅ Cокy
(4.4)
где:
k 0 – константа скорости реакции,
С гор - концентрация горючего вещества, кмоль/м3,
С ок – концентрация окислителя, кмоль/м3,
x,y – порядки реакции по горючему и окислителю соответственно.
74
Как выше было сказано, суммарное уравнение реакции (1.2) не отражает истинного механизма протекания реакции горения, которая является
многостадийной и, зачастую цепной, поэтому порядки реакции в уравнении
(4.4) далеко не всегда совпадают с величиной стехиометрических коэффициентов в уравнении (1.2).
Отсюда следует, что чем больше концентрация горючего вещества,
тем выше скорость горения.
Скорость реакции горения зависит от температуры:
k = A⋅e
−
Ea
RT
(1.5)
где:
А – фактор эффективности соударений;
е – основание натурального логарифма;
кДж
Е а – энергия активации,
;
кмоль
кДж
;
К ⋅ кмоль
R – универсальная газовая постоянная, R = 8,314
Т – температура, К.
Это уравнение является выражением закона Аррениуса о зависимости
скорости химических реакций от температуры. В упрощенном виде для узкого интервала температур можно пользоваться правилом Вант-Гоффа:
v1 = v0 ⋅ γ
t 2 −t1
10
(4.6)
где:
t 1 - первоначальная температура среды;
t 2 - конечная температура среды;
v 0 -начальная скорость реакции;
v 1 -скорость реакции при заданных условиях
γ – температурный коэффициент.
Согласно данному правилу скорость химической реакции возрас-
75
тает в 2-4 раза при повышении температуры на каждые 100.
Таким образом, скорость химической реакции окисления горючего
вещества при горении резко возрастает с повышением температуры, причем
тем больше, чем ниже энергия активации.
Поскольку большинство реакций, протекающих при горении, являются обратимыми, то необходимо при описании их кинетики пользоваться константами равновесия.
КР =
К пр
К обр
=
СdПГ1 1 ⋅ СdПГ2 2 ⋅ ⋅ ⋅ CdПГn n
x
⋅ C окy
C гор
(4.7)
где:
К р – константа равновесия,
К пр – константа скорости прямой реакции (окисления),
К обр – константа скорости обратной реакции.
C ПГ - концентрация продуктов горения
x,y,d i –порядки реакции по горючему, окислителю и продуктам
реакции соответственно.
Анализируя это выражение, можно сделать вывод о том, что скорость
реакций окисления при горении зависит также от давления.
По принципу Ле-Шателье: при повышении давления равновесие смещается в сторону образования меньшего числа молей газоообразных веществ
и соответственно в сторону уменьшения давления в системе. Если число молей газообразных продуктов горения значительно превышает число молей
газообразных исходных веществ (горючих газов или паров и газообразного
окислителя), то увеличение давления должно несколько тормозить процесс
горения. Однако при этом не следует забывать о том, что увеличение давления приводит к возрастанию объемной концентрации горючих газообразных
веществ и окислителя. А в соответствии с выражением (4.4) скорость реакций горения возрастает при повышении концентрации горючего вещества.
На практике это приводит к тому, что при увеличении давления скорость реакций горения большинства веществ увеличивается.
76
При высоких давлениях возникают горячие пламена.
Как отмечалось выше, химические реакции окисления высокоэкзотермичны, поэтому горение сопровождается выделением большого количества теплоты и следовательно протекает при высокой температуре. Например, температура горения древесины 700-8000С, нефтепродуктов – еще выше
– 1300-15000С.
4.2. Цепная теория горения
Существуют химические реакции, которые не нуждаются для своего
развития в заметном предварительном подогреве. Это цепные реакции.
Основа теории цепных реакций – предположение о том, что исходные
вещества превращаются в конечный продукт не сразу, а с образованием активных промежуточных продуктов
Продукт первичной химической реакции обладает большим запасом
энергии, которая может рассеиваться в окружающем пространстве при соударении молекул продуктов реакции или за счет излучения, а может переда-
(а)
(б)
Рис. 1.3. Схема протекания неразветвленной (а) и
разветвленной (б) цепных реакций.
77
ваться молекулам реагирующих компонентов, переводя их в активное состояние. Эти активные молекулы (атомы, радикалы) реагирующих веществ порождают цепь реакций, где энергия передается от одной молекулы к другой.
Поэтому такие реакции называются цепными.
Химически активные молекулы, атомы, радикалы, образующиеся на
элементарных стадиях цепной реакции – звеньях цепи- называются активными центрами. Большую часть активных центров составляют атомы и радикалы, которые наиболее реакционноспособны. Но вследствие этого они и неустойчивы, т.к. могут вступать в реакции рекомбинации с образованием малоактивных продуктов.
Длина цепи, образуемая одним начальным активным центром, может
достигать несколько сотен тысяч звеньев. Кинетические закономерности
цепных реакций существенно зависят от того, сколько активных центров образуется в одном звене цепи. Если при участии исходного активного центра в
результате образуется только один активный центр, то такая цепная реакция
называется неразветвленной, если же в одном звене цепи образуются два или
более активных центров, то такая цепная реакция называется разветвленной.
Скорость разветвленных цепных реакций возрастает лавинообразно, в чем и
состоит причина самоускорения химических реакций окисления при горении,
так как для большинства из них характерен механизм разветвленных цепных
реакций.
Практически любая реакция горения может иметь одновременно признаки и теплового и цепного механизма протекания реакции. Зарождение
первых активных центров может иметь тепловой характер, а реагирование
активных частиц по цепному механизму приводит к выделению тепла, разогреву горючей смеси и тепловому зарождению новых активных центров.
Любая цепная реакция складывается из элементарных стадий зарождения, продолжения и обрыва цепи.
Зарождение цепи является эндотермической реакцией. Образование
78
свободных радикалов (т.е. атомов или групп атомов, имеющих свободные
валентности, например,
Н , О , О Н , С Н 3 ) из молекул исходных веществ воз-
можно в результате мономолекулярного или бимолекулярного взаимодействия, а также в результате каких-либо посторонних воздействий на горючую
смесь – инициирования.
Инициирование может осуществляться путем добавки специальных
вещест – инициаторов, легко образующих свободные радикалы (например,
пероксидов, химически активных газов NO2 , HBr ), под действием ионизирующих излучений, под действием света – фотохимическое инициирование.
Например, взаимодействие водорода с хлором
H 2 + Cl2 = 2 HCl
при обычных условиях протекает крайне медленно, а при сильном
освещении (солнечным светом, горящим магнием) протекает со взрывом.
К реакциям продолжения цепи относятся элементарные стадии цепной реакции, идущие с сохранением свободной валентности и приводящие к
расходованию исходных веществ и образованию продуктов реакции.
Примером разветвленной цепной реакции может служить реакция горения водорода в кислороде.
зарождение цепи:
H 2 + O2 → 2O H
O H + H 2 → H 2O + H
разветвление цепи:
H + O2 → O H + O
+ H → O H + H
O
2
обрыв цепи:
гомогенный
H + H → H 2
гетерогенный
79
H + стенка → обрыв
O H + стенка → обрыв
При развитии цепи, когда концентрация активных центров станет достаточно большой возможно образование такого звена, в котором активный
центр прореагирует без генерации нового активного центра. Такое явление
называется обрывом цепи.
Обрыв цепи может быть гомогенным и гетерогенным.
Гомогенный обрыв цепей возможен либо при взаимодействии радикалов или атомов между собой с образованием устойчивых продуктов, либо
при реакции активного центра с посторонней для основного процесса молекулой без генерации новых активных центров.
Гетерогенный обрыв цепи происходит на стенках сосуда, где протекает реакция горения или поверхности твердых микрочастиц, присутствующих в газовой фазе, иногда специально вводимых (например, как при тушении порошками). Механизм гетерогенного обрыва цепей связан с адсорбцией
активных центров на поверхности твердых частиц или материалов. Скорость
гетерогенного обрыва цепей сильно зависит от соотношения площади поверхности стенок к объему сосуда, где происходит горение. Таким образом,
уменьшение диаметра сосуда заметно снижает скорость реакции горения,
вплоть до его полного прекращения. На этом основано создание огнепреградителей.
4.3. Диффузионная теория горения
Критерием возможности применения тепловой теории распространения
пламени является соблюдение условия подобия поля температур и поля концентраций. Однако иногда происходящие в пламени физико-химические
процессы не отвечают этому требованию, и тепловая теория в подобном случае не может быть применена. Так, например, при высоких температурах горения (более 25000С) в результате диссоциации газа часть энергии находится
в форме химической энергии свободных атомов и радикалов. Большая по-
80
движность высокоэнергетических частиц приводит к тому, что они оказываются раньше в исходной среде, чем туда поступает тепловая энергия из зоны
горения. Атомы и радикалы передают свою энергию исходной горючей смеси (рекомбинируют) и являются основной причиной распространения пламени.
Причиной продвижения возбужденных (активных) частиц в холодную
зону является диффузия, и распространение пламени по такому механизму
называется диффузионным распространением пламени.
Следует отметить, что диффузия играет важную роль и в тепловом механизме распространения пламени, так как в силу подобия полей передача
тепла теплопроводностью и диффузионное распространение реагирующих
веществ осуществляется параллельно. Однако здесь диффузия является лишь
сопутствующим фактором, а не причиной распространения пламени как в
случае диффузионного механизма.
Определение нормальной скорости распространения пламени по диффузионному механизму является сложной задачей и требует принятия существенных ограничений.
Я.Б. Зельдовичем и Д.А. Франк-Каменецким была разработана теория
диффузионного распространения пламени в изотермических условиях.
Н.Н. Семенов с сотрудниками экспериментально доказал возможность
чисто диффузионного механизма распространения пламени.
Определение скорости распространения пламени из кинетики реакции
горения особенно сложно в неизотермических условиях.
Наибольшее внимание заслуживает теория Тенфорда и Пиза. В основе
теории лежит представления о том, что в нагретом газе за фронтом пламени,
имеющем максимальную температуру горения Τ2 , осуществляется термодинамическое равновесие. Активные центры реакции диффундируют в зону горения, где их концентрация оказывается больше равновесной концентрации,
отвечающей температуре соответствующего участка зоны горения. Химические процессы, осуществляющиеся в зоне горения при участии этих актив-
81
ных центров, ведут к уменьшению их концентрации, приближая ее к равновесному значению.
В теории Тенфорда и Пизе принимается, что продукты реакции образуются в зоне горения в результате взаимодействия диффундирующих сюда
из области термодинамического равновесия активных центров с молекулами
исходных веществ.
Авторы предложили формулу для определения скорости пламени U 0 :
U0 =
∑
κ iπ i ci Di
N ПГ Bi
,
(4.8)
где
κ i - константа скорости взаимодействия с горючим активных центров i-
го вида;
πi -
Ρi
- относительное парциальное давление соответствующего акΡ
тивного центра в зоне термодинамического равновесия;
ci - концентрация i- го компонента;
Di - коэффициент диффузии i- го компонента при средней температуре
зоны горения;
Ν ПГ - количество молей продуктов горения;
Βi - концентрация активных центров.
Таким образом, согласно диффузионной теории пламя распространяется вследствие диффузии активных центров из зоны горения в свежую
смесь. Там они инициируют реакции окисления, которые приводят к разогреву смеси с последующим ее воспламенением. Диффузионная теория применяется, в основном, для процессов горения, протекающих по цепному механизму, т.е. для холодных пламен.
Так называемые холодные пламена могут возникать при низких давлениях. Самоускорение цепной химической реакции горения при этом происходит в изотермическом режиме. Это происходит при определенном составе
горючей смеси и определенном состоянии среды. Изотермическое самоуско-
82
рение характерно для смесей с достаточно высокой концентрацией активных,
но достаточно стабильных промежуточных продуктов, что приводит к
уменьшению разветвления цепей, а следовательно и к уменьшению выделения теплоты, которая за счет теплоотвода рассеивается в окружающую среду
и частично затрачивается на нагрев стабильных промежуточных продуктов.
Возникает свечение, представляющее собой хемилюминесценцию, а не тепловое излучение нагретых продуктов горения, которое имеет место в горячих
пламенах.
Кроме того, на возникновение холодных пламен большое влияние
оказывают стенки сосуда, в котором происходит горение. Они оказывают каталитическое влияние на процесс уничтожения активных центров, т.е. происходит гетерогенный обрыв цепи. Интенсивность этого процесса определяется
скоростью диффузии активных центров к стенкам сосуда. Понижение давления способствует этому процессу. Понижение давления может не только
привести к образованию холодных пламен вместо горячих, но в определенных условиях (например, в узких сосудах) даже к полному прекращению горения.
Теоретические исследования и существующие теории распространения
пламени имеют определенные ограничения, поскольку заложенные в их основу допущения не всегда отражают истинную картину происходящих явлений при распространении пламени.
Конкурирующая
с тепловой теорией диффузионная теория распро-
странения пламени применима лишь при горении газов. При горении конденсированных веществ и материалов в условиях пожара более применима
тепловая теория, которая должна совершенствоваться, исходя из решения
полной системы уравнений диффузии и теплопроводности, и не ограничиваться условием подобия полей температуры и концентрации или условием
стационарности концентраций промежуточных веществ.
Задания для самоконтроля
83
1. Какие факторы влияют на скорость реакции горения?
2. Что является основной причиной увеличения скорости реакции при повышении
температуры?
3. Что называется свободным радикалом?
4. В чем различие неразветвленных и разветвленных цепных реакций?
5. В чем отличие диффузионной теории распространения пламени от тепловой и
цепной?
РАЗДЕЛ III. ВИДЫ ПЛАМЕНИ И
СКОРОСТИ ЕГО РАСПРОСТРАНЕНИЯ
ГЛАВА 5. ПЛАМЯ И ЕГО РАСПРОСТРАНЕНИЕ В ПРОСТРАНСТВЕ
5.1. Виды пламени
Пламя возникает в результате сложного взаимодействия химических и
физических процессов.
В литературе нет общепринятого определения пламени.
На наш взгляд, с точки зрения специалистов противопожарной службы, наиболее подходят следующие определения пламени.
Пламя – определенный объем газового пространства, в котором
протекают все физико-химические процессы горения.
Как уже отмечалось выше, возникновение пламени характерно для гомогенного горения.
Различают два режима гомогенного горения: кинетический и диффузионный.
При гомогенном горении горючие газы или пары могут быть предварительно перемешаны с воздухом перед входом в зону горения (как, например, в горелке Бунзена). Предварительно перемешанная смесь называется
однородной. Горение однородной смеси протекает во всем объеме пламени,
а
скорость
горения
определяется
только
кинетикой
окислительно-
восстановительной реакции. Такой режим горения называется кинетическим. При горении однородных смесей при достаточном количестве окислителя происходит, как правило, полное сгорание горючего газа или пара с образованием летучих продуктов горения СО 2 , Н 2 О и др.
84
В большинстве случаев на реальных пожарах горючее и окислитель
предварительно не перемешаны. В этом случае окислитель (кислород воздуха) из окружающей среды и горючие газы поступают в зону непосредственного взаимодействия преимущественно за счет процесса диффузии.
Наиболее высокотемпературная поверхность пламени, где протекают
в тонком поверхностном слое ограничивающем пламя физико-химические
окислительно-восстановительные реакции, называется реакционной зоной
или фронтом пламени.
Толщина фронта пламени невелика, она зависит от газодинамических
параметров и механизма распространения пламени (дефлаграционный или
детонационный) и может составлять от десятых долей милиметра до нескольких сантиметров. Внутри пламени практически весь объем занимают
горючие газы (ГГ) и пары. Во фронте пламени находятся продукты горения
(ПГ). В окружающей среде находится окислитель.
Диффузионное горение – это процесс горения неоднородной (предварительно не перемешанной) горючей смеси, в котором существенную роль
играют процессы диффузии горючих газов и паров и окислителя во фронт
пламени.
При диффузионном горении возможно неполное сгорание горючего
газа или пара с образованием продуктов горения СО 2 , Н 2 О, СО, С и др.
По газодинамическим параметрам различают ламинарный и турбулентный режимы горения.
Ламинарным (от лат. lamina - слой, пластина) называется спокойное,
безвихревое пламя устойчивой геометрической формы.
Турбулентным (от лат. turbulenze - вихрь) называется беспокойное,
закрученное вихрями пламя постоянно меняющейся формы.
Газодинамический режим горения зависит от линейной скорости горючего вещества или смеси и характеризуется критерием Рейнольдса (мера
отношения сил инерции и внутреннего трения в потоке):
85
Re =
vdρ
⋅
µ
(для запоминания: "ведро молока")
(5.1)
где:
v - линейная скорость газового потока, м/с;
d - характерный размер потока, м;
ρ - плотность газа, кг/м3;
µ - динамический коэффициент вязкости, Н⋅с/м2
Ламинарный режим наблюдается при Re < 2300, при
2300 < Re < 10000 режим переходный, а при Re > 10000 - турбулентный. Во
всех случаях толщина δ зоны горения (фронта) пламени δ лам < δ пepex < δ тyp .
Из-за ограничений, налагаемых скоростью диффузии, горючие газы и
пары зачастую не успевают прореагировать с кислородом воздуха полностью
и продукты горения помимо летучих газов и паров содержат мелкие раскаленные конденсированные частички несгоревшего углерода органических
веществ в виде сажи, которые также излучают свет и тепло
Излучение пламени определяется излучением продуктов горения в
различном агрегатном состоянии.
По этому признаку все пламена можно разделить на две группы:
-
серое пламя, в котором основными излучателями являются конденсированные продукты горения;
-
спектральное пламя, в котором основными излучателями являются
газообразные продукты горения.
Иногда при рассмотрении источников излучения выделяют пламенна
по наибольшему излучению в данной области спектра:
-
пламя ИК-излучения,
-
пламя УФ-излучения,
-
осветительное пламя,
-
цветные пламена.
86
5.2. Структура пламени
Рассмотрим диффузионное пламя газовой горелки, например, пропана
с воздухом.
Экспериментами доказано, что в пределах слабо светящегося факела
имеется ярко очерченный конус. Видимая толщина стенки конуса – фронта
пламени,- составляет 0,4 мм. В пределах этого расстояния горючая смесь
успевает нагреться и прореагировать с выделением тепла и излучения. Нормальная скорость распространения фронта пламени пропана составляет 40
см/с. Следовательно в течение времени реакции 10
-3
с топливо сгорает до
конечных продуктов СО 2 и Н 2 О. На участке фронта пламени пропанвоздушной смеси площадью 1 см2 сгорает ежесекундно 40 см3 горючей смеси, т.е. в объеме 0,4 см3 за это время выделяется 210 Дж тепла. В расчете на 1
м3 тепловыделение составит 1,9 ⋅ 1010 кДж.
Толщина фронта пламени разнообразных газовых смесей в ламинарном режиме составляет 0,5 – 10-3 см. Среднее время полного превращения
топлива в продукты горения в этой узкой зоне составляет 10-3 –10-6 с.
Структура ламинарного пламени в газовой горелке показана на
рис. 5.1.
3
1- ядро; 2- средняя зона; 3- наружный
факел; (зона догорания смеси)
2
1
Рис. 5.1. Ламинарное пламя в горелке Бунзена стехиометрической
смеси пропана с воздухом
87
Область пламени, следующая за фронтом пламени, называется внешним конусом.
Зона максимальных температур расположена на 5-10 мм выше светящегося конуса и для пропан-воздушной смеси составляет порядка 1600 К.
Схема диффузионного пламени газовой горелки и изменение концентраций горючих веществ, окислителя и продуктов горения по сечению пламени приведены на рис. 5.2.
Диффузионное пламя возникает при горении, когда процессы горения и
смешения протекают одновременно.
Главное отличие диффузионного горения от горения заранее перемешанных горючих смесей состоит в том, что скорость химического превращения при диффузионном горении лимитируется процессом смешения окислителя и горючего, даже если скорость химической реакции очень велика, интенсивность горения ограничена условиями смешения.
ПГ
ПГ
С%
100
ПГ
δф
С%
100
О2
ГГ +
пары
О2
ГГ +
пары
δф
О2
Х
О2
δф
δф
Х
Рис 5.2. Схема диффузионного пламени газовой горелки (а)
и изменение концентрации исходных веществ
и продуктов горения по сечению пламени (б)
88
Важным следствием этого представления является тот факт, что во
фронте пламени горючее и окислитель находятся в стехиометрическом соотношении. В каких соотношениях не находились бы подаваемые раздельно
потоки окислителя и горючего, фронт пламени всегда устанавливается в таком положении, чтобы поступление реагентов происходило в стехиометрических соотношениях. Это подтверждено многими экспериментами.
Собственно окислительные процессы протекают только во фронте
пламени. Движущей силой диффузии кислорода в зону горения является разность его концентраций внутри пламени (С О = 0) и в окружающем воздухе
(начальная С О = 21%). С уменьшением этой разности скорость диффузии
кислорода уменьшается и при определенных концентрациях кислорода в
окружающем воздухе – ниже 14-16 %, горение прекращается. Такое явление
самопроизвольного затухания (самозатухания) наблюдается при процессах
горения в замкнутых объемах.
Каждое пламя занимает в пространстве определенный объем, внешние границы которого могут быть четко или нечетко ограничены. При горении газов форма и размеры образующегося пламени зависят от характера исходной смеси, формы горелки и стабилизирующих устройств. Влияние состава горючего на форму пламени определяется его влиянием на скорость
горения.
Высота пламени является одной из основных характеристик размера
пламени. Это особенно важно при рассмотрении процессов горения и тушения газовых фонтанов, горения нефтепродуктов в открытых резервуарах.
В горелке Бунзена, где истечение газа происходит снизу поверхность
пламени (фронта пламени) имеет коническую форму. Высота пламени может
быть рассчитана по формуле:
Lb =
где:
R
2
⋅ (wb + wR ) ⋅
u
3
(5.2)
89
wb - осевая (максимальная) скорость течения газа;
R – радиус трубки;
wR - краевая скорость движения газа;
u - нормальная скорость распространения фронта пламени.
Высота пламени тем больше, чем больше диаметр трубы и больше
скорость истечения, и тем меньше, чем больше нормальная скорость распространения пламени.
Скорость потока оказывает влияние и на угол образующегося конуса пламени. При изменении скорости потока угол конуса меняется в соответствии с расходом (рис.5.3).
100 см/с
10 см/с
7,7 см/с
Горелка
2,56 см
Рис.5.3. Влияние скорости потока на форму
пламени горелки для пропан-воздушной среды.
При некоторой критической низкой скорости течения пламя неожиданно приобретает «пуговичную» форму. Если в пламя для подавления конической формы поместить плоское препятствие со стороны горючих газов,
то можно получить увеличенное плоское пламя.
90
Для заданной смеси горючего и окислителя высота пламени пропорциональна скорости потока и квадрату диаметра струи:
h=
u⋅d2
D
(5.3)
где:
u - скорость потока;
d - диаметр струи;
D -коэффициент диффузии.
Но при этом форма пламени остается неизвестной и зависит от естественной конвекции и распределения температур во фронте пламени.
Эта зависимость сохраняется до определенного значения скорости потока. При возрастании скорости потока пламя турбулизируется, после чего
прекращается дальнейшее увеличение его высоты. Этот переход совершается, как уже отмечалось, при определенных значениях критерия Рейнольдса.
Для пламен, когда происходит выделение значительное выделение несгоревших частиц в виде дыма, понятие высота пламени теряет свою определенность, т.к. трудно определить границу сгорания газообразных продуктов в
вершине пламени.
Кроме того, в пламенах, содержащих твердые частицы, по сравнению с
пламенами, содержащими только газообразные продукты сгорания, значительно возрастает излучение.
5.3. Процессы, протекающие в пламени
В пламени одновременно протекают химические и физические процессы, между которыми существуют определенные причинно-следственные связи.
К химическим процессам в пламени относятся:
на подходе к зоне горения:
91
- термическое разложение исходных веществ с образованием более легких продуктов (водорода, оксидов углерода, простейших углеводородов, воды и т.д.);
во фронте пламени:
- термоокислительные превращения с выделением теплоты и образованием продуктов полного (диоксида углерода и воды) и неполного горения
(оксида углерода, сажи, копоти, смол и др.);
- диссоциация продуктов горения,
- ионизация продуктов горения.
К физическим процессам в пламени относятся:
-
тепломассоперенос во фронте пламени;
-
процессы, связанные с испарением и доставкой летучих горючих
веществ в зону горения.
Скорость переноса (диффузии) веществ имеет решающее значение,
например, в неоднородных системах, где она гораздо меньше скорости химических реакций окисления. Соотношение скорости химических превращений
и физических процессов определяет режим процесса горения.
Полное время горения τ г , складывается из длительности физических
и химических процессов:
τ г = τ ф +τ х
(5.4)
Кинетический режим горения характеризуется длительностью
τ г ≈ τ х , поскольку в этом случае физических процессов подготовки (перемешивания) не требуется, т.е. τф ≈ 0
Диффузионный режим горения, наоборот, зависит в основном от
скорости подготовки однородной горючей смеси, т.е. длительность его
τ г ≈ τ ф . В этом случае τф >> τ х , и поэтому последним можно пренебречь.
Если τф ≈ τ х , т.е. они соизмеримы, то горение протекает в так
называемой промежуточной области.
92
5.4. Скорость распространения пламени
Важнейшей характеристикой горючей смеси является нормальная скорость распространения пламени.
Нормальная скорость распространения пламени — скорость перемещения фронта пламени относительно несгоревшего газа в направлении, перпендикулярном к его поверхности.
Размерность ее [м/с].
Форма фронта пламени, возникшего от небольшого источника зажигания в неподвижной однородной среде - сферическая, а в ряде случаев,
например, при горении в трубах, может быть плоской. Наблюдаемая в реальных условиях скорость распространения пламени относительно неподвижных предметов (стенки трубы, сосуда и т.п.), называется видимой скоростью.
В зависимости от направления и величины линейной скорости v потока газовой смеси фронт пламени может быть неподвижным (стационарным)
или движущимся. Стационарное пламя возникает в тех случаях, когда горючая смесь движется навстречу фронту пламени с такой же скоростью, т.е.
v = u в . Типичным примером стационарного пламени являются пламена факельных горелок в промышленных печах, лабораторных горелок Бунзена,
Теклю и др. (рис.8.2).
93
В UН
φ
UВ
С
А
U0
Гор.+Ок
Рис. 5.4. Схема распространения пламени в горелке Бунзена
В них видимая скорость пламени равна скорости горючей смеси:
v 0 = u в = V 0 / S,
(5.5)
где v 0 - скорость горючей смеси, м/с;
V 0 - расход смеси, м3/с;
S - площадь поперечного сечения газового потока, м2.
Аналогично для фронта пламени можно записать:
u н = V 0 /F ,
(5.6)
где F - площадь всей поверхности пламени, м2.
Подставляя в выражение (5.6) значение V 0 из (5.5), получаем
u н = u в ⋅S/F ,
т.е. нормальная
(5.7)
скорость
пламени во столько раз меньше видимой, во
сколько площадь поперечного сечения трубы меньше поверхности пламени.
Векторы нормальной и видимой скоростей пламени в горелке Бунзена
составляют угол ϕ, поэтому для скалярных величин из прямоугольного треугольника АВС следует:
u н = u в ⋅cos ϕ .
(5.8)
Эта закономерность называется законом косинуса. Ее установил
94
один из основателей теории горения, российский физик-метеоролог
В.А. Михельсон.
Очень важной особенностью фронта пламени является то, что нормальная скорость его распространения представляет собой также объемную
скорость горения газовой смеси:
u н = [ м3/(м2⋅с) ] = [ м/с ] ,
(5.9)
т.е. показывает, сколько объемов смеси сгорает в единицу времени на единице площади фронта пламени. Это позволяет для любого газа определить
массовую скорость горения u m :
u m = u н ⋅ ρ0 ,
(5.10)
где ρ 0 - плотность исходной горючей смеси, кг/м3.
Выражение (5.10) широко используется в теории распространения
пламени в паро- и газо-воздушных смесях при исследовании материального и
теплового, балансов процессов горения.
Уравнение для нормальной скорости горения выводится из общего
уравнения теплопроводности:
λ⋅
d 2T
dT
− C p ⋅ ρ 0 ⋅ uн ⋅
+Q⋅w = 0
2
dx
dx
потеря
теплоты
теплопроводностью
расход тепла
на нагрев
исходной
смеси
(5.11)
тепловыделение
процесса
горения
В зоне подогрева реакция горения не идет, поэтому уравнение
(5.11) примет вид:
λ⋅
d 2T
dT
=0
− C p ⋅ ρ0 ⋅ uн ⋅
2
dx
dx
Интегрирование этого уравнения дает следующее выражение для градиента температуры в зоне подогрева:
95
dT = c p ⋅ ρ0 ⋅ u 0 ( − Т0 ).
Tс
λ
dx под
(5.12)
В зоне горения нагрев исходной смеси практически отсутствует, поэтому уравнение (5.11) примет вид:
d 2T
+Q⋅w = 0
dx 2
или после интегрирования:
dT
=
dx
2
R Tг
2Q
w (T г )
.
λ
Е
(5.13)
В точке T с ’ должно соблюдаться условие:
dT
dT
= .
dx под dx гор
следовательно,
RТг
с р ρ0 u н '
2Q
(Т c − T 0 ) =
w (Т г )
.
λ
λ
Е
2
(5.14)
Из уравнения (5.14) путем преобразований, и принимая во внимание,
что T' с ≈ T г , выводится уравнение для нормальной скорости распространения пламени:
uн =
2Qλw (Tг )
R Т г2
Е
[ср ρ0 (Тг − Т0]
2
.
(5.15)
В формуле (5.15) нет ни одного параметра, связанного с размерами
формой горючей смеси (объемом, удельной поверхностью и т.п.). Это говорит о том, что в отличие от температуры самовоспламенения, нормальная
скорость распространения пламени является физической константой горючей смеси и не зависит от условий ее экспериментального определения.
96
Значения u н применяются в расчетах скорости нарастания давления
взрыва газопаровоздушных смесей, критического (гасящего) диаметра, при
разработке мер пожаровзрывобезопасности, при исследовании причины возникновения пожаров и взрывов и т.д.
Для воздушных смесей углеводородов максимальная нормальная скорость составляет 0,3-0,4 м/сек. Максимальная нормальная скорость в водородо-воздушной смеси равна 2,67 м/сек. Это максимальная нормальная скорость, зарегистрированная в воздушных смесях горючих газов.
Кислородные смеси
горючих газов или паров, для которых число
столкновений, необходимых для одного акта химической реакции, значительно меньше, чем для воздушных смесей, имеют более высокие нормальные скорости, но все же далекие от скорости звука. Так максимальная нормальная скорость в бутано-кислородной смеси равна 4,8 м/сек, в водородокислородной смеси – около 10 м/сек.
Ширина зоны химической реакции (фронта пламени) в нормальном
(дефлаграционном) пламени в воздушных смесях прядка нескольких десятых
долей мм, в кислородных она еще меньше.
Теория дефлаграционного горения не накладывает никаких ограничений на температуру горения газопаровоздушных смесей, а значит, и на величину нормальной скорости распространения пламени. Согласно выражению (5.15) температура горения Т г может снижаться вплоть до температуры
исходной горючей смеси Т 0 . Однако в действительности это не так. До сих
пор мы учитывали расход теплоты горения только на нагрев горючей смеси
теплопроводностью в зоне подогрева фронта пламени. На самом же деле в
реальных горючих системах существенную роль играют еще и другие виды
теплопотерь из зоны горения. Все зависит от формы и, особенно, от поперечного сечения сосуда, емкости или аппарата с горючей смесью.
Классическая тепловая теория распространения пламени позволяет
оценить величину дополнительных тепловых потерь из зоны горения как в
стенку, так и на излучение, и учесть их при расчетах скорости распростра-
97
нения пламени. Величина этих потерь может достигать 40 % от Q н .
Тепловая теория позволяет сделать еще один очень важный для практики вывод: кинетические закономерности накладывают очень жесткие
ограничения на процессы горения и распространения пламени, а именно,
при снижении температуры горения в результате теплопотерь на величину
θ = RT2/E (характеристический интервал температуры) скорость химических реакций, а значит, и скорость распространения пламени, снижается в e
раз, и горение прекращается.
Это значит, что существует критическое значение u н(кр) , которое равно:
u н (кр ) =
uн
при Т г (кр ) = Т г − θ.
e
(5.16)
Критическую скорость распространения пламени можно оценить по
следующему выражению:
u н (кр ) =
1
2e λ пг q пот
c 0 ρ0
θ
Расчеты и эксперименты показывают,
(5.17)
что критическое значение
нормальной скорости распространения пламени составляет примерно
0,04 м/с. С меньшей скоростью пламя распространяться не может ни в какой
горючей системе.
5.4.1. Факторы, влияющие на скорость
распространения пламени
Уравнение (5.15) показывает, что нормальная скорость распространения пламени зависит от теплофизических свойств газопаровоздушной смеси.
Но в еще большей степени скорость распространения зависит от ее физикохимических свойств - скорости и температуры реакции горения. Из уравнения видно, что:
98
E
,
u н ~ w (Т г ) ~ exp −
Т
R
2
г
(5.16)
т.е. u н пропорциональна скорости реакции окисления и обратно пропорциональна температуре горения. Определяющим параметром здесь, безусловно, будет скорость реакции.
Запишем уравнение скорости химической реакции горения:
E
w (Tг ) = k 0 сгn сβок exp −
.
RT
(5.17)
Рассмотрим, как будет меняться скорость реакций окисления для
смесей с разным соотношением горючего и воздуха (рис.5.5).
Из графика видно, что для смеси стехиометрического состава коэффициент
избытка воздуха α = 1, скорость реакции окисления максимальна:
w(T г ) = w стех .
При увеличении содержания концентрации горючего в смеси, когда
α становится < 1, воздух находится в недостатке, и горючее сгорает не полностью, а частично. Поэтому меньше выделится теплоты Q гор , а значит T г
снизится.
99
ώ(τг)
ά=1
ά>1
ά<1
ώстех
Сстех
гор
Сгор٫%
Рис.5.5. Зависимость скорости горения от концентрации
горючего в смеси
Скорость реакций окисления по сравнению со стехиометрической
уменьшится, причем из-за снижения сразу и концентрации окислителя О 2 , и
температуры горения. То есть при последовательном снижении α (что эквивалентно увеличению концентрации С гор в смеси) скорость реакций окисления w(T г ) будет последовательно снижаться. На графике при C гор > С г стех
кривая становится нисходящей. Значит, при α > 1 скорость реакций окисления также снижается. Именно такая зависимость скорости реакции горения
от концентрации горючего компонента в исходной смеси предопределяет
параболический вид зависимости многих параметров процесса горения от состава смеси: температуры самовоспламенения и минимальной энергии зажигания, рассмотренных ранее, концентрационных пределов распространения
пламени. Вид параболы имеет также и зависимость u н от С г (рис.5.6).
100
Uн(м/с)
811К
2
644К
311К
1
4,4
4,0
2,8
Сстех
6,8
С3Н8
(φв)
Рис.5.6. Зависимость u н от концентрации пропана в воздухе
Согласно теории u н мах должна соответствовать стехиометрической
концентрации. Однако экспериментальные ее значения для большинства
углеводородов несколько сдвинуты в сторону богатых смесей ( α < 1).
Часто в пожарно-технических расчетах необходимо определить стехиометрическую концентрацию.
Расчет
стехиометрической
концентрации
Пример 5.1. Рассчитать стехиометрическую концентрацию пропана С 3 Н 8 в % объемных и г/м3 при температуре 250С и давлении 95 кПа.
Стехиометрической концентрацией называется такая концентрация, когда реагирующие вещества взяты в эквивалентных отношениях, при этом коэффициент избытка
воздуха α = 1.
Расчет стехиометрической концентрации производится по уравнению реакции горения индивидуального вещества. Общие формулы для вычисления объемной и массовой
стехиометрической концентрации следующие:
ϕ стех объем =
100
,%
1 + 4,76 ⋅ β
(5.18)
101
ϕ стех масс =
1000 ⋅ М
, г/м3.
(1 + 4,76 ⋅ β ) ⋅ VМ
(5.19)
1. Уравнение реакции горения пропана.
С 3 Н 8 + 5( О 2 + 3,76 N 2 ) = 3СО 2 +4Н 2 О + 5· 3,76 N 2
β=5
ϕ стех объем =
100
= 4,03 %
1 + 4,76 ⋅ 5
2. Молярная масса М (С 3 Н 8 ) = 46 г/моль (кг/кмоль);
Vм =
22,4 ⋅101,3 298
= 26,1 м3/кмоль
⋅
273
95
ϕ стех масс =
1000 ⋅ 46
= 71,0 г/м3.
(1 + 4,76 ⋅ 5) ⋅ 26,1
С увеличением начальной температуры смеси разность Т г - Т 0 , что
стоит в знаменателе уравнения (5.15), уменьшается. Значит в целом величина дроби, т.е. скорость распространения пламени, должна повышаться, что и
наблюдается на практике. Например, для смеси паров бензина и керосина с
воздухом она имеет вид, приведенный на рис.5.6.
Uн(м/с)
2,5
1,5
0,5
300
500
700
Т(К)
Рис.5.6. Зависимость u н от начальной температуры для смеси паров
бензина и керосина с воздухом ( α = 0,95)
102
Для различных веществ u н зависит от их химического строения и колеблется в довольно широких пределах (табл.5.1).
Таблица 5.1
Нормальная скорость распространения пламени для различных
горючих смесей
Горючая смесь
Водород + воздух
Ацетилен + воздух
Ацетилен + кислород
Этилен + воздух
Бутан + воздух
Метан + воздух
Формула
u н , м/с
Н 2 + 0,5(О 2 + 3,76N 2 )
СН≡СН + 2,5(О 2 + 3,76N 2 )
СН≡СН + 2,5О 2
СН 2 =СН 2 + 3(О 2 + 3,76N 2 )
С 4 Н 10 + 6,5(О 2 + 3,76N 2 )
СН 4 + 3(О 2 + 3,76N 2)
1,60
1,50
8,00
0,60
0,40
0,34
Для большинства смесей углеводородных топлив с воздухом
u н < 1 м/с. При введении в горючую смесь балласта – избыточного воздуха
или азота - заметно снижается температура горения. Введение в горючую
смесь азота N 2 , аргона Аr, диоксида углерода СО 2 и т.п. газов разбавляет ее
и тем самым снижает скорость реакции окисления и распространения пламени. Данные рис.5.7 иллюстрируют эти факты.
Uн(м/с)
0,4
0,2
Ar
N2
СО2
114В2
20
40
φф,%
Рис.5.7. Влияние флегматизаторов на скорость распространения
103
пламени С 3 Н 8 (α = 1,15)
Разная флегматизирующая способность этих газов связана с различием
их теплофизических свойств, в частности теплопроводности. Более подробно этот вопрос будет изложен позже при изучении свойств огнетушащих веществ.
5.5. Характер свечения пламени
Характер свечения пламени при горении веществ зависит от процентного содержания элементов в веществе, главным образом, углерода, водорода, кислорода и азота.
Свечение пламени связано с наличием несгоревших
раскаленных
твердых частиц углерода С, а также трехатомных молекул.
Если в горючем веществе при термическом разложении углерод не
образуется, то вещество горит бесцветным пламенем как, например, в случае
горения водорода Н 2 .
При термическом разложении веществ с массовой долей углерода менее 50 % и содержащих в своем составе кислород (более 30 %) несгоревших
частиц углерода образуется очень мало, и в момент образования они успевают окислиться до СО.
t
СН 3 ОН
СО + 2Н 2
→
Такие вещества имеют голубоватые пламена (пламя угарного газа СО, метанола СН 3 ОН и этанола С 2 Н 5 ОН).
При горении веществ, содержащих более 75 % углерода (ацетилен
С 2 Н 2 , бензол С 6 Н 6 ), в зоне горения образуется настолько много частиц С, что
поступающего путем диффузии воздуха не хватает для полного окисления
всего углерода.
t
С6Н6
6С + 3Н 2
→
Не окислившийся в пламени углерод выделяется в виде копоти, и пламя при горении таких веществ будет ярким и коптящим.
104
Если кислород в веществе отсутствует или его содержание не превышает 30 %, но, в свою очередь, и массовая доля углерода не очень велика
(менее 75 %), то при термическом разложении будет выделяться значительное количество частиц углерода, но при нормальном доступе воздуха в зону
горения они успевают окислиться до СО 2 .
Возможная реакция при термическом разложении ацетона :
t
СН 3 СОСН 3
СО + 2С + 3Н2 .
→
В подобных случаях пламя будет яркое, но не коптящее.
Сопоставляя значения процентного содержания углерода и кислорода
в горючих веществах, можно приблизительно судить о характере свечения
пламени (таблица 5.2).
Таблица 5.2.
Характер свечения пламени в зависимости от ω (С) и ω (Н)
Содержание углерода в
Горючем веществе, ω (С) %
< 50
Содержание кислорода в
горючем веществе, ω (О) %
> 30
Характер свечения пламени
пламя бесцветное или
голубоватое
< 75
отсутствует или < 30
пламя яркое, не коптящее
> 75
отсутствует или < 25
пламя яркое, коптящее
Определение
характера свечения
пламени
Пример 5.2. Определить характер свечения пламени метаналя НСОН, фенола С 6 Н 5 ОН и пентанола С 5 Н 11 ОН.
Решение:
1. Массовые доли углерода и кислорода в молекуле метаналя составляют:
М r (НСОН) = 30
ω (С) =
12 ⋅100
16 ⋅100
= 40 %; ω (О) =
= 53 %
30
30
Массовая доля углерода < 50 %, а массовая доля кислорода > 30 %, следовательно,
при горении метаналя наблюдается голубоватое пламя.
2. Массовые доли углерода и кислорода в молекуле фенола составляют:
М r (С 6 Н 5 ОН) = 94
105
ω (С) =
16 ⋅100
6 ⋅12 ⋅100
= 77 %; ω (О) =
= 17 %
94
94
Массовая доля углерода > 50 %, а массовая доля кислорода < 25 %, следовательно,
пламя при горении фенола яркое и коптящее.
3. Массовые доли углерода и кислорода в молекуле пентанола составляют:
М r (С 5 Н 11 ОН) = 88
ω (С) =
5 ⋅12 ⋅100
16 ⋅100
= 68 %; ω (О) =
= 18 %
88
88
Массовая доля углерода < 75 %, а массовая доля кислорода < 30 %, следовательно,
пламя при горении пентанола будет ярким, но не коптящим.
Задания для самоконтроля
1. Что называется горением? В каких случаях горение сопровождается пламенем?
2. Перечислите физические и химические процессы, протекающие в пламени.
3. Что представляет собой:
а) диффузионное и кинетическое горение;
б) однородное и неоднородное горение;
в) гомогенное и гетерогенное горение;
г) ламинарное и турбулентное горение;
д) дефлаграционное и детонационное горение?
4. Для какого вида горения общее время горения определяется преимущественно
временем протекания химических процессов? Почему?
5. Что представляет собой дым? Дым и продукты горения – это одно и то же?
6. Что является движущей силой конвективных тепловых потоков при горении?
7. Что является движущей силой диффузии кислорода из воздуха к зоне горения?
8. Почему в верхней части пламени образуется сажа?
9. Что является причиной свечения пламени?
10. Как меняется величина зоны горения при переходе от ламинарного к турбулентному режимугорения?
11. Определите характер свечения пламени глицерина С 3 Н 8 О 3 .
106
РАЗДЕЛ IV. УСЛОВИЯ ВОЗНИКНОВЕНИЯ И
РАЗВИТИЯ ПРОЦЕССОВ ГОРЕНИЯ
IV.I. ВОЗНИКНОВЕНИЕ ГОРЕНИЯ
ГЛАВА 6. САМОВОСПЛАМЕНЕНИЕ
6.1. Радикально-цепной механизм процессов окисления
и его основные закономерности
Процессы самовоспламенения могут протекать по цепному и по тепловому механизму. Теория этих процессов разработана академиком
Н.Н. Семеновым и его школой.
Рассмотрим механизм радикально-цепных реакций на примере горения
водорода и углеводородов.
Заполним сосуд стехиометрической смесью Н 2 :О 2 = 1:1 по объему и
будем медленно нагревать его со всех сторон. При определенной температуре в сосуде возникнут химические превращения. Взаимодействие водорода с
кислородом начинается со следующей эндотермической реакции:
H 2 + О 2 → 2ОН - 67 кДж/моль,
зарождение цепи.
/1/
Далее происходит развитие цепи:
продолжение
ОН + Н 2 → Н 2 О + Н + 44 кДж/моль,
/2/
разветвление
Н + О 2 → ОН + О − 54 кДж/моль,
/3/
О + H 2 → ОН + Н
/4/
Н + О 2 + Н 2 → 2ОН + Н − 42 кДж/моль.
/5/
107
На каждой элементарной стадии процесса образуются один (продолжение) или два (разветвление цепи) радикала. Наконец, когда концентрация активных центров станет достаточно большой, все более заметными становятся
реакции обрыва цепи:
Н + ОН → Н 2 О,
/6/
ОН + Н → Н 2 О,
/7/
Н + Н → Н 2 ,
/8/
Н + стенка → обрыв,
/9/
ОН + стенка → обрыв.
/10/
Таким образом, окисление водорода представляет собой непрерывную
и разветвляющуюся цепь последовательных превращений активных частиц
(молекул, атомов, радикалов), т.е. радикально-цепной процесс с разветвлением. Цепь сильно ветвится, и концентрация активных центров лавинообразно
нарастает, т.е. реакция самоускоряется, что в конечном итоге приводит к самовоспламенению.
В целом по аналогичному механизму, но несколько медленнее, протекают процессы окисления углеводородов, хотя в зависимости от вида горючего многие элементарные стадии будут различными. Окисление углеводородов обычно протекает по следующим типичным элементарным стадиям:
RH + О 2 → R + НО 2
зарождение цепи
R + О 2 → ROO (или R’-CH-OO) продолжение цепи
/11/
/12/
На этой стадии образуется пероксидный радикал. Далее превращение
этого радикала протекает по двум конкурирующим направлениям в зависимости от температуры. Так, при температурах ниже примерно 400°С образуется гидропероксид:
ROO + HR → ROOH + R,
/13/
который далее распадается на два новых радикала:
ROOH → RO + ОН вырожденное разветвление.
/13а/
108
При температурах выше 400°С часть пероксидных радикалов изомеризуется и, распадаясь, превращается в альдегид:
R’-CH 2 -OO → R’-CH-О-OH → R’-CHO + ОН
/14/
и далее - вырожденное разветвление:
R’-CHO + O 2 → R’-CO +HO
/14а/
Реакции вырожденного разветвления /13/ и /13а/ протекают при низких
давлениях и могут привести к возникновению так называемых "холодных
пламен".
При высоких давлениях и температуре цепь разветвляется по реакциям
/14/ и /14а/ и возникает "горячее" пламя. Горячие пламена от холодных отличаются также тем, что в них кроме конечных продуктов СО 2 и Н 2 О в заметных количествах образуются оксид углерода СО, а также радикалы :С=С:
и :СН, при рекомбинации которых получается сажа. Процессы цепного самовоспламенения других органических горючих веществ во многом аналогичны.
Характерной особенностью разветвленных цепных реакций является
незначительное количество активных центров, появляющихся в результате
теплового движения молекул. Основная их часть образуется в результате
разветвления цепи. Их концентрация n определяется скоростью начального
инициирования цепи W o , а также скоростью разветвления и обрыва цепей.
Сумма этих трех скоростей представляет собой общую скорость образования
активных центров. Тогда в дифференциальной форме выражение для скорости цепной разветвленной реакции окисления будет иметь следующий вид:
dn / dt = w 0 + f⋅n - g⋅n = w o + (f-g)n,
где W o - скорость начального инициирования активных центров;
f - константа скорости разветвления цепи;
g - константа скорости обрыва цепи;
n - концентрация активных центров.
(6.1)
109
Скорость образования активных центров в начальной стадии зависит в
известной степени от температуры и, в большей степени, от давления горючей смеси. Увеличение температуры повышает только скорость инициирования радикалов и скорость разветвления цепей. Скорость обрыва цепей от
температуры не зависит, так как рекомбинация радикалов протекает без
энергии активации. Изменение давления влияет, главным образом, на скорость обрыва цепей.
При низких давлениях преобладает обрыв цепей на стенках сосуда, при
высоких - в объеме горючей смеси.
Если скорость разветвления цепи меньше скорости обрыва (f < g), то
реакция протекает спокойно, как обычная цепная неразветвленная реакция
(рис.6.1). Если же f > g, то в этом случае имеет место лавинообразное нарастание концентрации радикалов, а следовательно, и скорости самой реакции.
Интегрирование уравнения (5.1) приводит к выражению:
n ≈ w o /(f-g)⋅[exp(f-g)τ-l],
(6.2)
из которого видно, что через каждые τ = 1/(f-g) сек концентрация радикалов
n, а следовательно, и скорость цепной реакции возрастает в е раз, и за время
порядка нескольких интервалов 1/(f-g) практически полное отсутствие реакции сменяется взрывным протеканием процесса. Иными словами, после некоторого периода индукции происходит самовоспламенение смеси.
110
ω=
dn
dτ
(4.14; 4.14а)
(4.13; 4.13а)
τинд
время, τ
Рис. 6.1. Суммарная скорость разветвленных цепных реакций
Период индукции - это начальный период реакции, в течение которого
скорость реакции неизмеримо мала, и который далее сменяется периодом
быстрого развития химического превращения. То есть период индукции - это
период накопления активных центров (рис.6.1).
6.2. Элементы тепловой теории самовоспламенения
горючих смесей
Самовоспламенение по цепному механизму с образованием холодных
пламен происходит нечасто, в основном под пониженным давлением, и не
сопровождается резким повышением температуры реагирующей смеси. Цепной механизм учитывает только химическую сторону процесса. Но при горении выделяется большое количество теплоты, которая оказывает существенное влияние на протекание процесса.
Поместим в герметичный сосуд объемом V и с температурой стенок Т о
горючую газо-воздушную смесь с температурой Т. В смеси начнутся реакции
окисления со скоростью:
111
W = А⋅ C rop С ок β е
−
Еа
RT
(6.3)
где А – фактор соударений;
C гop , С ок - концентрация горючего и кислорода;
Е а - энергия активации;
R - универсальная газовая постоянная;
β - стехиометрический коэффициент при горючем в уравнении реакции
горения.
Выделяющаяся теплота (q + ) будет расходоваться на нагрев смеси и
рассеиваться в окружающую среду:
q + = Q гop ⋅W⋅V, кДж/с, где
(6.4)
Q гор - тепловой эффект реакции, кДж/моль;
V - объем сосуда, м3,
или
β
q + = Q гop ⋅V⋅ А⋅ C rop С ок е
−
Еа
RT
(6.5)
А каков будет теплоотвод?
Если температура смеси Т будет выше температуры стенки Т о , т.е.
Т > Т о , то смесь будет отдавать теплоту стенке, и вычислить такой тепловой
поток можно по формуле Ньютона:
q_ = α ⋅ (Т − Т о ), кДж/м2⋅с,
(6.6)
где α - коэффициент теплоотдачи, кДж/м2⋅град.
С учетом общей поверхности сосуда S получается следующее выражение для расхода теплоты:
q_ = α ⋅ (Т − Т о )⋅ S, кДж/c.
(6.7)
Анализ полученных выражений (6.5) и (6.7) показывает, как и почему
будет меняться тепловое состояние системы в зависимости от температуры
стенки сосуда и самой горючей смеси. Графически q+ представляет собой
экспоненциальную зависимость, а q_ - прямую линию (рис.6.2).
Рассмотрим состояние системы при температуре стенки T 01 = const.
Пусть Т будет меньше T 01 (начало графика). Здесь приход теплоты выше
расхода, т.е. q+ > q_, поэтому смесь будет нагреваться, и в точке А устано-
112
вится равновесие. В этой точке, естественно, химическая реакция продолжается, но при малейшем повышении температуры смеси система вновь вернется в эту точку, поскольку там (справа от точки А) расход теплоты выше
прихода. При смещении влево система опять же вернется в точку А, поскольку здесь наоборот приход теплоты больше расхода. Таким образом, в
точке А система находится в состоянии устойчивого равновесия, и реакция
будет спокойно идти до полного расходования компонентов или ее вообще
не будет.
q
q−
Г
q+
В
С
А
Т01
Т02
Тс
Т
Рис.6.2. Изменение выделения q+ и отвода q_ теплоты
в зависимости от температуры.
Теперь повысим температуру стенок сосуда до Т 02 . Прямая теплоотвода
сместится параллельно самой себе вправо, и кривая прихода будет касаться
ее в единственной точке С. Вначале горючая смесь будет нагреваться от температуры Т а до Т с , и система перейдет в точку С, установится равновесие
113
(q+ = q_). При малейшем увеличении температуры смеси выше Т с система
тут же сместится вправо, а там приход теплоты превышает расход. Поэтому
смесь будет стремительно по экспоненциальному закону нагреваться до самовоспламенения. То есть произойдет тепловой взрыв. Следовательно, температура стенки Т 02 , для которой прямая отвода теплоты – касательная кривой выделения, является предельной для существования стационарного режима, т.е. критической температурой самовоспламенения.
Таким
образом,
критическими
условиями
самовоспламенения
являются:
1. q + = q_ ;
2.
dq+ dq−
=
dT
dT
При превышении тепловыделения над теплоотводом произойдет самовоспламенение смеси.
Как видно из рисунка 6.2., критическая температура самовоспламенения несколько ниже истинной температуры самовоспламенения Т с . Для
саморазогрева горючей смеси от температуры Т 02 до Т с необходимо время,
которое называется индукционным периодом теплового взрыва (самовоспламенения).
Величина индукционного периода в ряде случаев достигает пяти и более секунд. Следует отметить, что реальные системы находятся либо под атмосферным, либо под повышенным давлением. Поэтому в них не реализуется в чистом виде только цепной или только тепловой механизм самовоспламенения. На практике в большинстве случаев механизм самовоспламенения
смешанный, цепочечно-тепловой, но рассмотренные здесь закономерности
остаются справедливыми и для такого смешанного механизма.
114
6.3. Температура самовоспламенения как показатель пожарной
опасности, практическое значение и методы ее определения
Температура самовоспламенения - это наименьшая температура
окружающей среды, при которой в условиях специальных испытаний
наблюдается самовоспламенение вещества.
Температура самовоспламенения относится к числу важнейших показателей пожарной опасности. Ее используют при оценке пожаровзрывоопасности веществ, при определении группы взрывоопасности горючей смеси и
т.д.
Практическое определение температуры самовоспламенения основывается на следующих теоретических предпосылках (см. рис.6.2). В точке С
устанавливается равенство прихода и расхода теплоты, т.е. q+ = q_. Подставив сюда соответствующие выражения для тепловыделения (6.5) и теплоотвода (6.7), получим уравнение теплового баланса для точки С:
β
Q гop ⋅V⋅ А⋅ C rop С ок е
−
Еа
RT
= α ⋅ (Т − Т о )⋅ S
(6.8)
Разделим обе части уравнения на величину объема V:
Q гop А⋅ C rop С ок β е
−
Еа
RT
= α ⋅ (Т − Т о )⋅
S
V
(6.9)
Левая часть этого выражения представляет собой скорость выделения
теплоты в единице объема горючей смеси, а правая - скорость отвода через
поверхность стенок сосуда из этой же единицы объема.
Выражение (6.9) показывает, что температура самовоспламенения не
является физической константой горючих веществ, и зависит от множества факторов: от размера и формы сосуда (S/V); от химических свойств горючего и его способности к окислению (тепловой эффект Q гop, энергия активации Е а ), от концентрации реагирующих веществ (C гop и С ок ) и, наконец, от
теплофизических свойств горючей смеси и материала стенки сосуда (коэффициент теплоотдачи α).
115
Отношение площади стенок к объему S/V называется удельной поверхностью и имеет размерность 1/м или м-1. Величина удельной поверхности
существенно влияет на теплоотвод и, тем самым, на величину температуры
самовоспламенения. Чем больше величина удельной поверхности S/V, тем
больше значение Т св .
Рассмотрим, как будет меняться температура самовоспламенения при
изменении объема сосуда, т.е. при изменении отношения площади стенок к
объему S/V? Например, для куба с гранью «а» удельная поверхность будет
равна
S/V = 6а2/а3 == 6/а.
(6.10)
Предположим, что в уравнении (6.9) теплового баланса меняется только температура в точке С. Тогда левая часть уравнения изменяться не будет,
и соответствующая ей кривая тепловыделения останется на прежнем месте.
Правая часть уравнения - прямая линия, которая касается кривой в точке С.
Величина αS/V есть угловой коэффициент этой прямой или tgβ - угла ее
наклона к оси абсцисс (см. рис.6.3)
q
q+
q−
С
q−1
С′
δ′
Т′0 Т′С
δ
Т0
ТС
Рис.6.3. Изменение теплового баланса горючей смеси
при увеличении объема сосуда.
116
Увеличим грань куба в три раза. Его удельная поверхность станет
равной:
S / V = 6(3а)2 / (За)3 = 2 /а,
(6.11)
т.е. уменьшится в три раза, значит уменьшится и сам угол β. В этом случае
прямая теплоотвода будет располагаться ниже предыдущей прямой, и точка
С в месте с ней переместится в точку C 1 , а значит будет ниже и критическая
температура самовоспламенения. Следовательно, с увеличением объема сосуда температура самовоспламенения снижается. Увеличить теплоотвод
можно не только уменьшением объема горючей смеси, но и приданием ей
соответствующей формы.
На рис.6.4 изображены равные объемы разной формы. При нагреве в
2∙10-3
кубе происходит самовоспламенение, а в пластине - нет.
2∙10-2
8∙10-1
2∙10-2
Рис.6.4. Равновеликие объемы разной формы сосудов
с горючей смесью (размеры даны в метрах)
Зависимость
температуры
самовоспламенения от
величины удельной
поверхности
Решение:
1. Для куба (сосуд № 1)
Пример 6.1. Имеются три сосуда с горючей паровоздушной смесью при одинаковых внешних условиях.
Сосуд № 1: куб с ребром а = 5 см;
Сосуд № 2: параллелепипед с размерами а = 25 см,
b = 5 см, с = 1 см;
Сосуд № 3: шар диаметром d = 6,2 мм.
В каком из сосудов наибольшая температура самовоспламенения?
117
S = 6 ⋅ 52 = 150 см2
V = 53 = 125 см3
S 150
=
= 1, 2 см-1
V 125
2. Для параллелепипеда (сосуд № 2)
S = 25⋅5⋅2 + 5⋅1⋅2 + 25⋅1⋅2 = 250 + 10 + 50 = 310 см2
V = 25⋅5⋅1 = 125 см3
S 310
= 2, 48 см-1
=
V 125
3. Для шара (сосуд № 3)
S = πd2 = 3,14 ⋅ 6,22 = 120,7 см2
4
4 ⋅ 3,14 ⋅ 3,13
V = πr 3 =
= 124,7 ≈ 125 см3
3
3
S 120,7
=
= 0,97 см-1
V 124,7
ется.
Объем реакционных сосудов примерно одинаков, а площадь теплоотвода различа-
Наибольшее значение S/V у сосуда № 2, следовательно, в нем будет наибольшая
температура самовосплаименения, а наименьшее значение Т св в реакционном сосуде в
форме шара.
Температура самовоспламенения зависит от состава горючей смеси,
принимая минимальное значение при стехиометрическом соотношении
компонентов (рис.6.5). Эта зависимость используется для экспериментального определения Т с . Начиная с некоторых предельных значений, смеси как
бедные, так и богатые не способны воспламеняться. Это подтверждается экспериментально. Например, кривая зависимости Т с = f(C) для оксида углерода
имеет минимум при 20 %.
118
ТВ
ТН
ТС
СН
ССТЕХ
СВ
С,%
Рис. 6.5. Зависимость температуры самовоспламенения
от состава смеси
Скорость реакции горения зависит от давления и катализаторов, поэтому температура самовоспламенения зависит также и от этих факторов
(табл.6.1).
Таблица 6.1
Зависимость температуры самовоспламенения от давления
Вещество
Бензин
Бензол
1,013
753
953
Т с , К при давлении р⋅10-5 Па:
5,065 10,13 15,18 20,26
623
583
563
553
893
893
793
773
25,23
523
763
Катализаторы, как известно, делятся на положительные (ускоряющие)
и отрицательные (замедляющие реакцию – ингибиторы). Положительные катализаторы снижают температуру самовоспламенения, а отрицательные - повышают. Каталитическими свойствами могут обладать стенки сосуда, в ко-
119
тором находится горючая смесь. С увеличением каталитической активности
материала стенки сосуда Т с снижается.
Температура самовоспламенения смеси горючих веществ обычно не
подчиняется правилу аддитивности. Так, например, температура самовоспламенения смеси метанола и диэтилового эфира разного состава всегда ниже рассчитанной по правилу аддитивности.
Таким образом, приведенные данные показывают, что температура самовоспламенения действительно не является константой, а зависит от
множества факторов. Истинное ее значение в точке С на рис.6.2 экспериментально можно определить только путем прямого измерения температуры.
Однако современные средства измерений не позволяют пока это сделать с
достаточной степенью точности, поскольку неизвестно, в какой именно точке
объема горючей смеси возникает первоначальный очаг горения. Тепловая
теория самовоспламенения подсказывает выход из данной ситуации. В точке
касания С, с одной стороны, существует равенство тепловыделения и теплоотвода. С другой стороны, в точке С каждая функция является касательной к
другой, т.е. производные по температуре от q+ и q_ также должны быть равны между собой В математической форме это будет иметь следующий вид:
Q гop ⋅V⋅k o ⋅C гop ⋅C ок ⋅exp(-E/RT c ) = α (T-To)-S
(6.12)
и для производных:
Q гop ⋅V⋅k o ⋅C гop ⋅C ок ⋅exp(-E/RTc)⋅E/RT c 2 = a⋅S
(6.13)
Разделив (6.12) на (6.13), получим:
RT c 2/E = T c - T o .
(6.14)
Путем несложных математических преобразований из этого квадратного уравнения можно найти выражение для Тс, которое будет иметь вид:
Т с = То + RT c 2 / Е.
(6.15)
120
Из рис.6.2 видно, что при самовоспламенении смесь в сосуде нагревается от температуры Т о до Т с . Расчеты показывают, что разница между ними
невелика. Например, для углеводородов она равна всего 30 °С.
Это обстоятельство используется на практике: за температуру самовоспламенения принимается наименьшая температура стенки сосуда, при
которой происходит самовоспламенение.
Так как температура самовоспламенения сильно зависит от условий ее
определения (от материала сосуда, его формы, размеров и т.д.), то чтобы исключить этот отрицательный момент, в нашей стране и за рубежом законодательным путем установлены одинаковые для всех лабораторий условия испытаний, зафиксированные в ГОСТе 12.1.044-89. Следует отметить, что методика эта универсальна и применяется для определения температуры самовоспламенения газов, жидкостей и твердых горючих веществ.
В настоящее время температура самовоспламенения определена для
многих веществ, и ее можно найти в справочной литературе. Однако не для
всех. Для алканов, ароматических углеводородов и алифатических спиртов
она может быть приближенно рассчитана по условной средней длине молекулы соединения.
Задания для самоконтроля
1. Что называется самовоспламенением?
2. Что называется свободным радикалом?
3. Как влияет повышение температуры на скорость инициирования радикалов, скорость разветвления цепей и скорость обрыва цепей?
4. За какое время скорость цепной реакции возрастает в "е" раз?
5. Напишите выражения для скорости реакции окисления.
6. Напишите выражения для скорости тепловыделения и теплоотвода.
7. Как зависит скорость теплоотвода от площади поверхности теплоотвода?
8. Как зависит скорость теплоотвода от объема реакционной смеси?
9. Изобразите графически изменение тепловыделения от температуры.
10. Изобразите графически изменение теплоотвода от температуры.
11. Изобразите графически ситуацию, когда тепловыделение всегда больше теплоотвода.
12. Изобразите графически ситуацию, при которой теплоотвод всегда превышает
тепловыделение.
13. Какая температура называется температурой самовоспламенения?
121
14. Изобразите графически условие самовоспламенения.
15. Напишите математическое выражение критических условий теплового самовоспламенения.
16. Является ли достаточным условием для самовоспламенения равенство тепловыдеоления и теплоотвода в системе?
17. От каких факторов зависит температура самовоспламенения?
18. Что называется удельной поверхностью?
19. Как зависит температура самовоспламенения от удельной поверхности реакционного сосуда?
20. Как меняется температура самовоспламенения при изменении реакционного
объема?
21. Как изменяется угол наклона прямой теплоотвода при изменении реакционного
объема?
22. Как зависит температура самовоспламенения от состава горючей смеси?
23. При какой концентрации горючего вещества температура самовоспламенения
будет минимальной?
24. Как зависит температура самовоспламенения от давления?
25. Как можно увеличить теплоотвод?
26. Как изменяется температура самовоспламенения при увеличении теплоотвода?
27. На какой принципе основано действие сетчатых, гравийных огнепреградителей
и щелевой защиты?
28. Сравните температуры самовоспламенения горючей газо-воздушной смеси в
сосудах в форме шара диаметром: № 1 – 10 см: № 2 – 20 см; № 3 – 30 см.
29. В каком из образцов торфа теплоотвод будет максимальным? Образец № 1 –
куб с ребром 0,5 м; образец № 2 – куб с ребром 0,75 м; образец № 3 – куб с ребром 1 м.
30. Как зависит температура самовоспламенения от длины углеродной цепи? Расставить вещества в порядке возрастания температуры самовоспламенения: декан, пентан,
октан, гексан.
31. Расставьте вещества в порядке убывания температуры самовоспламенения: 2,3диметилгексан, 3-метилгептан, октан, 2,2,3-триметилпентан.
ГЛАВА 7. САМОВОЗГОРАНИЕ
7.1. Механизм процесса самовозгорания веществ
В некоторых случаях горение твердых горючих материалов
может
возникнуть за счет самонагревания, которое обусловлено происходящими в
веществах физическими, химическими и биологическими процессами при
низких (до 70 °С) температурах (окисление, разложение, адсорбция, конденсация, жизнедеятельность микроорганизмов и т.д.). Этот процесс называется
самовозгоранием.
Самовозгорание − резкое увеличение скорости экзотермических
процессов в веществе, приводящее к возникновению очага горения.
122
Самовозгорание веществ и материалов часто становится причиной пожара на
промышленных объектах.
Все горючие вещества, находящиеся в соприкосновении с воздухом,
при определенных температурах начинают окисляться. Этот процесс сопровождается выделением тепла. В некоторых случаях отвод выделяющегося
тепла сильно ограничен, и при определенном соотношении скоростей выделения и отвода тепла, возможно самонагревание горючего материала.
Самонагревание некоторых веществ может происходить не только в
результате окисления, но и от других экзотермических реакций (разложение),
а также от ряда физических и биологических явлений.
При определенных условиях, процесс самонагревания может привести
к возникновению горения, аналогично как при явлении самовоспламенения.
Современная теория теплового самовозгорания веществ и материалов
базируется на представлении о блуждающих "горячих точках", которые формируются по определенным закономерностям. Представим дисперсную систему (рис.6.1) ограниченных размеров (кипы ваты, хлопка, мешки с рыбной
мукой и т.п.). Система и окружающая среда имеют температуру Т о , а внутри
ее образовалась небольшая зона, в которой начались окислительные процессы.
T0
O2
Т0
q
O2
O2
O2
q
O2
ПГ
ТР
q
q
O2
Рис.7.1. Схема возникновения "горячей точки"
123
В результате окисления выделяется теплота, которая распространяется во всех направлениях (конвекцию учитывать не будем). Температура
в реакционной зоне будет постепенно расти и достигнет значений, при
которых начнутся процессы термической деструкции твердого материала
с выделением продуктов разложения. Последние будут конденсироваться
и адсорбироваться на поверхности вещества.
Обязательным условием такого процесса является наличие кислорода и развитой поверхности горючего вещества. Чем больше дисперсность материала, тем больше его удельная поверхность, а значит и выше
скорость процессов окисления, разложения, конденсации и адсорбции, в
результате которых выделяется и накапливается внутри материала теплота:
q + = q р + q дестр + q конд + q адс ,
где q + - тепловой эффект реакций окисления;
q дестр - тепловой эффект реакций термической деструкции;
q конд - теплота конденсации продуктов разложения;
q адc - теплота адсорбции продуктов реакций.
Если скорость теплоотвода будет ниже скорости тепловыделения в
зоне реакций, то начнется процесс самонагревания внутри объема вещества.
С увеличением температуры данный процесс будет ускоряться за счет увеличения скорости реакций и интенсивности тепловыделения. Если кислорода в
зоне реакций достаточно, а отвод теплоты в окружающую среду затруднен,
то непрерывный процесс самонагревания может перейти в качественно новую стадию - самовозгорание. Процессы самонагревания и самовозгорания
развиваются, как правило, в диффузионной области, и скорость их зависит от
скорости поступления (диффузии) кислорода снаружи в зону реакции.
Самовозгоранию подвержены легкоокисляющиеся пористые и волокнистые вещества и материалы, имеющие в себе большой запас молекулярного кислорода.
124
Структура горючих материалов по объему неоднородна: разная плотность упаковки, плотность, влажность и т.д. Это приводит к тому, что в
большом объеме материала зона реакции будет перемещаться с разной скоростью, в разных направлениях. В той части, где теплоты отводится меньше,
температура будет выше. Этот участок будет как бы подвижным тепловым
центром реакционной зоны, ее блуждающей "горячей точкой". Максимальная температура будет наблюдаться в наиболее заглубленной части материала.
Первоначальный период самовозгорания часто бывает незаметен снаружи, так как продукты термоокислительной деструкции полностью адсорбируются внутри вещества. В объеме материала, как правило, возникают одновременно несколько "горячих точек", которые по мере развития процесса
сливаются друг с другом с образованием глухих, не сообщающихся с поверхностью вещества прогаров. Обнаружение таких прогаров при исследовании пожара является однозначным признаком его возникновения в
результате самовозгорания.
Причиной возникновения "горячих точек" в некоторых материалах растительного происхождения являются микробиологические процессы. В органических веществах, подобных зерну, шерсти, рыбной муке, сену, торфу и
т.п., вследствие жизнедеятельности микроорганизмов выделяется теплота,
которая аккумулируется в объеме материала. При достижении температуры
60-70 °С микроорганизмы погибают. Однако к этому времени уже формируются блуждающие "горячие точки", и начинается процесс теплового самовозгорания.
Анализ приведенного выше выражения показывает, что условия самовозгорания зависят от химической природы материала, его формы и массы,
начальных и граничных условий теплообмена с окружающей средой. Для
каждого сыпучего или волокнистого материала существуют свои критические условия самовозгорания. Расчетные методы их определения отсутствуют, хотя и накоплен большой экспериментальный материал, на базе которого
125
разрабатываются мероприятия по предотвращению пожаров от самовозгорания. Для этого прежде всего необходимы знания параметров пожарной опасности веществ и материалов в конкретных условиях их переработки, хранения и транспортировки. К этим параметрам относятся температура самонагревания, температура тления и условия теплового самовозгорания. Указанные параметры определяются по специальным экспериментальным методикам, изложенным в ГОСТ 12.1.044-89.
Температура тления при самовозгорании - это температура твердого
вещества, при которой происходит резкое увеличение скорости экзотермических реакций окисления твердых продуктов разложения, приводящее к возникновению очага тления.
Условия теплового самовозгорания - это экспериментально выявленная зависимость между температурой окружающей среды, массой вещества и
временем до момента его самовозгорания. Методика испытаний позволяет на
малых образцах получить достаточно надежные и пригодные для практики
аналитические выражения для критических условий теплового самовозгорания t c = f(S) и t c = f(τ) (С.Н. Таубкин и В.Т. Монахов). Образец помещают в
сетчатые корзиночки кубической формы с длиной ребра от 35 до 200 мм
(всего шесть размеров), нагревают в воздушном термостате в изотермических условиях и для каждого размера определяют минимальную температуру, при которой образец самовозгорается. По результатам испытаний строят
графики зависимости логарифма температуры самовозгорания от логарифма
удельной поверхности корзиночки, а также от логарифма времени до самовозгорания (рис.7.2). Полученные на графиках прямые аппроксимируют в
виде уравнений (условия теплового самовозгорания):
lg t c = а + b lg S
(7.1)
lg t c = a/ − b/ lg τ,
(7.2)
где
t c – минимальная температура самовозгорания, 0С;
S – удельная поверхность образца, м-1;
126
τ - время до возникновения самовозгорания, час;
а, b, a/, b/ - константы для каждого горючего материала.
Эти уравнения позволяют легко рассчитать время и температуру самовозгорания для веществ, находящихся в таре, ссыпанных в кучи, сложенных
в штабель и т.п.
lg(tc)
lg(tc)
lgτ
lg S
Рис. 7.2. Зависимость температуры Т с от удельной
поверхности S и от времени τ до самовозгорания образца
Условия теплового
самовозгорания
Пример 7.1. Оценить возможность теплового самовозгорания хлопка (образцы в форме куба, плотность материала ρ = 80 кг/м3 и влажность W = 4,5 %) при t c = 100 0С по
следующим данным:
lg t c = 1,986 + 0,157⋅ lg S
lg t c = 2,334 − 0,06 ⋅ lg τ.
Решение:
1. Для заданных условий (t c = 1000С) определим удельную поверхность образца
хлопка:
lg 100 = 2
2 = 1,986 + 0,157⋅ lg S
2 − 1,986
lg S =
= 0,09
0,157
S = 100,09 = 1,23 м-1
2. Определим геометрические размеры куба (ребро куба):
6
а=
= 6/1,23 = 4,88 м
S
3. Определим время до возникновения самовозгорания при этих условиях:
127
2,334 − 2
= 5,57
0,06
τ = 105,57 = 368694 часа ≈ 43 года
lg τ =
7.2. Самовозгорание жиров и масел
Статистика показывает, что около 80 % пожаров от самовозгорания по
причине обусловлено самовозгоранием промасленных волокнистых и сыпучих материалов. В промышленности и в быту применяется огромное количество жиров и масел, которые по своему происхождению можно подразделить
на природные, искусственные и синтетические.
Природные масла - добываются из тканей наземных, морских животных и рыб (животный жир), из семян и мякоти плодов различных растений
(растительные масла).
Искусственные масла - получают из нефти (это минеральные масла)
или из смолы полукоксования каменных углей (каменноугольные масла).
Синтетические масла - получают полимеризацией и поликонденсацией низших алкенов, гликолей и их эфиров, силоксанов и других мономеров.
Все они по применению подразделяются на пищевые, технические, (производство высыхающих пленкообразующих для лаков и красок, ПАВ, глицерина, жирных кислот и другие), смазочные (моторные, индустриальные,
трансмиссионные и другие) и не смазочные (электроизоляционные, гидравлические, шпалопропиточные и т.д.) масла.
Большинство из них имеют температуру вспышки в пределах
170-350 °С, температуру самовоспламенения выше 350 °С, поэтому относительно пожаробезопасны. В чистом виде жиры и масла не склонны к самовозгоранию. Но при попадании на волокнистые, пористые и сыпучие вещества и материалы с большой удельной поверхностью многие из них приобретают исключительно высокую способность к окислению кислородом воздуха
даже без нагревания. К ним относятся растительные высыхающие масла,
подвергавшиеся нагреву минеральные, например, моторные, цилиндровые,
128
закалочные масла и т.п. Рассмотрим их поведение на примере природных
жиров и масел.
Растительные масла (льняное, конопляное, хлопковое, подсолнечное
другие), а также животные жиры (тресковый, тюлений, китовый, бараний,
говяжий и т.д.) представляют собой смесь сложных эфиров, глицерина и
жирных предельных и непредельных кислот общей формулы
СН 2 ОН
О
CH 2 -OCO-R
\\
-ЗН 2 О
СНОН + 3C - R ——→ CH-OCO-R .
/
СН 2 0Н НО
CH 2 -OCO-R
глицерин кислота
глицерид (жир)
Общее название этих эфиров – глицериды. Они могут содержать как
одинаковые, так и разные кислотные остатки. Чаще всего встречаются кислоты с числом атомов углерода 12 – 18.
Глицерин – постоянная составная часть жиров, т.е. входит во все природные жиры. Кислоты же, входящие в состав жиров весьма разнообразны.
Из жиров выделено около 50 различных кислот.
Наиболее распространены в жирах и маслах следующие ВЖК.
Предельные кислоты, т.е. не содержащие кратных связей:
С 17 Н 35 СООН – стеариновая кислота
С 15 Н 31 СООН – пальмитиновая кислота
Непредельные кислоты, т.е. содержащие двойные и тройные связи:
С 17 Н 33 СООН – олеиновая кислота (1 двойная связь)
С 17 Н 31 СООН – линолевая кислота (2 двойные связи)
С 17 Н 29 СООН – линоленовая кислота (3 двойные связи).
Производные углеводородов непредельного ряда способны к реакциям присоединения по месту двойных связей. Поэтому они склонны к
окислению кислородом воздуха, а значит и к самовозгоранию. Механизм
129
окисления имеет сложный, многостадийный характер. На начальной стадии процесса кислород воздуха присоединяется по месту двойной связи с
образованием нестойкого пероксида, который распадается на два активных радикала, продолжающих далее цепь окисления до промежуточных и
конечных продуктов. В общем виде схема зарождения цепи выглядит
следующим образом:
R-CH=CH-R' + О 2
О—О
→ R-CH-CH-R' → R-HCO + OCH-R′.
пероксид
Ненасыщенные соединения по месту двойных связей, помимо кислорода, легко присоединяют галогены, в том числе и йод:
−СН=СН− + J 2 → −CHJ − CHJ−.
Эта реакция протекает количественно, поэтому ее используют для оценки
непредельности соединений в виде йодного числа.
Йодное число - это количество йода (в граммах), поглощенное 100
граммами жира за счет разрыва кратных связей.
Например, 1 моль триглицерида олеиновой кислоты может присоединить 3 моля иода (в каждой молекуле олеиновой кислоты произойдет разрыв
двойной связи):
СН 2 – О – ОС – С 17 Н 33
СН – О – ОС – С 17 Н 33 + 3I 2
СН 2 – О – ОС – С 17 Н 33 +
СН 2 – О – ОС – С 17 Н 33 I2
→ СН – О – ОС – С 17 Н 33 I2
СН 2 – О – ОС – С 17 Н 33 I2
Этот показатель может быть использован в качестве приближенной количественной меры склонности масел и жиров к самовозгоранию (табл.7.1).
Практика показала, что к самовозгоранию склонны жиры и масла с йодным
числом выше 50.
130
Таблица 7.1.
Йодное число некоторых жиров и масел
Масло, жир
Содержание ненасыщенных кислот, %
95
75
85
Льняное
Подсолнечное
Тресковый
Расчет иодного числа
жиров и масел
Йодное число,
г J 2 /100 г
174-195
127-136
150-175
Пример 7.2. Рассчитать иодное число льняного масла
состава: глицериды пальмитиновой и стеариновой кислоты
– 5 %; глицериды олеиновой кислоты – 18 %; глицериды
линолевой кислоты – 30 %; глицериды линоленовой кислоты – 47 %.
Решение:
1) В 100 г масла глицеридов насыщенных кислот содержится 5 г, и эти кислоты иод
не присоединяют.
2) Глицеридов олеиновой кислоты в 100 г масла содержится 18 г. Это количество
масла может присоединить иода:
100 г
х1
С 3 Н 5 (С 17 Н 33 СОО) 3 + 3I2
=
С 3 Н 5 (С 17 Н 33 I2 СОО) 3
М = 884 г
3⋅М=3⋅254 г
х1 =
100 ⋅ 3 ⋅ 254
= 15,5 г
884
3) Глицеридов линолевой кислоты в 100 г масла содержится 30 г. В этом случае
иода присоединится:
100 г
С 3 Н 5 (С 17 Н 31 СОО) 3
М = 878 г
х2 =
х2
+ 6I2
=
6⋅М=6⋅254 г
С 3 Н 5 (С 17 Н 31 I4 СОО) 3
100 ⋅ 6 ⋅ 254
= 52 г
878
4) Глицеридов линоленовой кислоты в 100 г масла содержится 47 г. В этом случае
иода присоединится:
100 г
х3
С 3 Н 5 (С 17 Н 29 СОО) 3 + 9I2
=
С 3 Н 5 (С 17 Н 29 I6 СОО) 3
М = 872 г
9⋅М=9⋅254 г
х3 =
100 ⋅ 9 ⋅ 254
= 124,3 г
872
131
5) Иодное число масла данного состава равно:
И.ч. = х 1 + х 2 + х 3 = 15,5 + 52 + 124,3 = 191,8 г
Данное масло склонно к самовозгоранию.
Таким образом, для самовозгорания жиров и масел необходимыми и
достаточными условиями являются:
- содержание достаточного количества ненасыщенных углерод углеродных связей (йодное число выше 50 г J 2 /1OO г);
- большая поверхность окисления и малая теплоотдача. Только будучи
нанесенными на большую, развитую поверхность (вата, тряпки, ветошь, пакля, порошки, пористые твердые материалы типа пенопластов, сыпучие материалы и т.п.) масло будет способным к самовозгоранию;
- наличие кислорода внутри материала или доступ его к окисляющей
поверхности.
Растительные, высыхающие масла находят широкое применение в производстве лаков и красок, куда обязательно добавляют сиккативы - вещества, ускоряющие, катализирующие процесс окислительной полимеризации
лакокрасочных материалов. В этом случае опасность самовозгорания еще
выше,
что
необходимо
учитывать
при
разработке
пожарно-
профилактических мероприятий.
7.3. Самовозгорание химических веществ
Среди огромного множества химических соединений есть большая
группа веществ, способных воспламеняться (взрываться) и гореть при взаимодействии с кислородом воздуха, водой и другими веществами. Обычно
считают склонными к химическому самовозгоранию вещества и материалы с
температурой самонагревания ниже 50 °С.
Вещества, воспламеняющиеся при взаимодействии с воздухом
132
К ним относятся:
• Щелочные металлы - калий, рубидий и цезий.
• Карбиды и гидриды щелочных металлов.
• Порошкообразные металлы - цинк, алюминий, железо, никель,
кобальт, титан, цирконий
• Сульфиды металлов - серный колчедан или пирит FeS 2 .
• Белый (желтый) фосфор.
• Фосфины, силаны, арсин и др.
Так, например, гидриды щелочных металлов - натрия, калия, рубидия и цезия интенсивно взаимодействуют с влагой воздуха по реакции:
МеН + Н 2 О → МеОН + H 2 ↑.
Среди сульфидов металлов серный колчедан или пирит FеS 2 является
компонентом ископаемых углей и руд черных и цветных металлов. Другие
сульфиды железа - FeS и Fe 2 S 3 - образуются в технологических аппаратах,
трубопроводах и резервуарах, где перерабатываются, транспортируются и
хранятся серосодержащие вещества (высокосернистые нефти и нефтепродукты, сероводородсодержащие газы и др.). При температурах до 200°С органическая сера гидролизуется с выделением сероводорода, который реагирует с
продуктами коррозии железа с образованием сульфида:
2Fe(OH) 2 + 3H 2 S → Fe 2 S 3 + 6H 2 O.
При температуре выше 200°С органическая сера способна выделяться в
чистом виде и вступать с железом в реакцию:
Fe+S → FeS + 100 кДж.
Сульфиды железа легко самовозгораются на воздухе, что является довольно частой причиной пожаров и взрывов в горнодобывающей и перерабатывающей промышленности, а также на транспорте. Сульфиды многих других металлов также склонны к самонагреванию и самовозгоранию, особенно
в измельченном состоянии и при соприкосновении с влажным воздухом.
133
Вещества, воспламеняющиеся и вызывающие горение
при воздействии на них воды
К ним относятся:
• Щелочные металлы.
• Гидриды и карбиды щелочных и щелочноземельных металлов.
• Металлоорганические соединения и др.
Щелочные металлы реагируют с водой с выделением водорода и
большого количества теплоты по общей схеме:
2Ме + 2Н 2 O → 2МеОН + H 2 ↑ + Q.
Многие металлоорганические соединения чрезвычайно чувствительны к кислороду - производные щелочных и щелочноземельных металлов, некоторых элементов 3 и 5 групп периодической системы. Низшие их алкильные производные (метилаты, этилаты и другие) самовоспламеняются на воздухе. Производные щелочных и щелочно-земельных металлов, а также Be,
Mo, Zn, Cd, Ga, In бурно реагируют с водой, причем многие из них с самовоспламенением выделяющегося углеводорода.
Помимо упомянутых имеется большая группа пожароопасных веществ,
энергично взаимодействующих с водой с выделением самовоспламеняющихся на воздухе газов. Например, силициды металлов (Mg 2 Si, Fe 2 Si и т.д.)
разлагаются водой с образованием силана, который самовозгорается на воздухе:
Mg 2 Si + 4Н 2 О → 2Mg(OH) 2 + SiH 4 + 646 кДж,
SiH 4 + 2O 2 → SiO 2 + 2Н 2 O + 1517 кДж.
Некоторые неорганические соединения сильно разогреваются при взаимодействии с водой, как, например оксид кальция СаО (негашеная известь).
При попадании небольшого количества воды на негашеную известь она разогревается до яркого свечения и может поджечь соприкасающиеся с ней горючие материалы.
134
Вещества, самовозгорающиеся при контакте друг с другом
К ним относятся, в основном, различные окислители: кислород, галогены, перекись водорода, азотная кислота и ее соли, марганцовокислый калий,
хромовый ангидрид, соли хлоркислородных кислот и др. Сами они негорючие, но при контакте с органическими веществами вызывают их химическое
возгорание.
Чистый кислород чрезвычайно пожароопасен. Многие негорючие на
воздухе вещества становятся горючими в атмосфере кислорода (железо).
Наиболее опасен кислород в сжатом и сжиженном состоянии. Так, минеральные масла воспламеняются при контакте со сжатым кислородом и взрываются со сжиженным.
Галогены - хлор, бром, фтор, йод. Наиболее широко в промышленности применяется хлор. Смеси горючих газов (водород, метан, этан, этилен,
ацетилен и другие) с хлором самовоспламеняются под воздействием света
(т.е. эти реакции фотокаталитические). Некоторые из них, например, с водородом, протекают со взрывом.
Н 2 + Сl 2 → 2НСl + Q.
Характерной особенностью горения углеводородов в хлоре является
выделение значительных количеств чистого углерода в виде копоти.
Многие металлы и неметаллы самовозгораются в среде галогенов. При
этом образуется соответствующий галогенид и выделяется большое количество теплоты. Некоторые органические галогенпроизводные взрываются при
контакте со щелочными металлами, например, тетрахлорэтан.
Пероксид водорода Н 2 О 2 - сильный окислитель, обычно выпускается
в виде 30 % раствора в воде (пергидроль). Нестойкое соединение, легко разлагается в присутствии следов тяжелых металлов (меди, железа, марганца,
металлов группы платины и других) и их ионов с выделением атомарного
кислорода. При концентрациях 65 % и выше перекись водорода вызывает са-
135
мовозгорание многих горючих веществ: бумаги, древесных опилок, ветоши,
спиртов и др.
Азотная кислота HNO 3 - сильный окислитель. Концентрированная
азотная кислота энергично действует на многие металлы и неметаллы. Органические вещества (солома, бумага, древесные опилки и стружки, уголь,
масла, скипидар, этиловый спирт и др.) при ее воздействии разрушаются и
воспламеняются.
Соли азотной кислоты (нитраты, селитры) менее активны, чем азотная кислота. Из них наиболее широко применяются калиевая КNО 3 , аммиачная NH 4 NO 3 и натриевая NaNO 3 селитры, главным образом в качестве минеральных удобрений и компонентов промышленных взрывчатых веществ.
Смеси селитры со многими порошкообразными горючими материалами (серой, древесным углем, сажей и др.) взрываются при нагревании, от удара и
трения с выделением большого количества раскаленных газов.
Перманганат калия КМnO 4 вызывает самовозгорание многоатомных
спиртов (этиленгликоля, глицерина и т.д.). При взаимодействии его с аммиачной селитрой образуется очень чувствительный к нагреванию, удару и трению перманганат аммония NH 4 MnO 4 .
Хромовый ангидрид СrO 3 - очень сильный окислитель. При контакте
с ним возгораются все классы кислородсодержащих органических соединений: спирты, эфиры, кислоты и др.
Хлораты и перхлораты - соли соответствующих хлоркислородных
кислот: хлорноватой НСlO 3 и хлорной НClO 4 . Хлораты и перхлораты (гипохлориты) относятся к сильнейшим окислителям, по своему поведению аналогичны селитрам.
Рассмотренный перечень веществ, естественно, далеко не полный, количество их неизмеримо больше. Более полная информация об этих, а так же
о пожароопасных свойствах других веществ содержится в справочной и специальной литературе.
136
Задания для самоконтроля
1. Самовозгорание и самовоспламенение - это одно и то же или нет?
2. Назовите причины самовозгорания.
3. Запишите условия теплового самовозгорания.
4. Как влияет дисперсность материалов на скорость протекания химических и физических процессов?
5. Какие физические процессы могут привести к выделению тепла и накоплению
его внутри материала?
6. Что представляют собой жиры и масла?
7. Какие масла наиболее склонны к самовозгоранию?
8. Что называется иодным числом?
9. Причины и условия самовозгорания жиров и масел.
10. Приведите примеры веществ, самовозгорающихся при контакте с воздухом.
11. Приведите примеры веществ, самовозгорающихся при контакте с водой.
12. Приведите примеры веществ, самовозгорающихся при контакте друг с другом.
13. Меры профилактики, исключающие самовозгорание жиров и масел.
14. Меры профилактики, исключающие самовозгорание растительных материалов.
15. Приведите примеры негорючих веществ, вызывающих самовозгорание органических материалов.
16. Меры профилактики, исключающие самовозгорание угля.
17. Какие вещества относят к пирофорным? Приведите примеры.
18. Вычислить иодное число масла состава: глицеридов стеариновой кислоты
С 17 Н 35 СООН – 20 %; глицеридов клупадоновой кислоты С 19 Н 35 СООН – 35 %; глицеридов
линолевой кислоты С 17 Н 31 СООН – 45 %.
19. Рассчитать температуру самовозгорания витамина В 2 , если известно, что
lg t c = 1,716 + 0,220⋅lg S; lg t c = 2,140 − 0,30⋅lg τ, а упаковка имеет размеры 1×1×1 метр.
ГЛАВА 8. ВЫНУЖДЕННОЕ ВОСПЛАМЕНЕНИЕ (ЗАЖИГАНИЕ)
В научной литературе о горении воспламенение рассматривается как
начальная стадия горения, при которой, подводимая от внешнего источника
энергия, вызывает резкое увеличение скорости химической реакции окисления. Резкое возрастание скорости окисления происходит из-за прогрессивного накопления тепла и называется тепловым воспламенением. Тепловое
воспламенение может проходить в двух режимах: в режиме самовоспламенения и в режиме зажигания. Для последнего часто употребляют термин «вынужденное воспламенение». Эти два термина относятся к одному и тому же
явлению и должны рассматриваться как синонимы.
Традиционно, в пожарном деле термин и понятие «зажигание» отличается от общепринятого научного и обозначает возникновение горения при
137
воздействии на горючую систему теплового источника или, как его чаще
называют, источника зажигания.
8.1. Понятие «источник зажигания» и его значение
для обеспечения пожарной безопасности
Согласно ГОСТ 12.1.004-91 Пожарная безопасность. Общие требования
Источник зажигания (ИЗ) – это средство энергетического воздействия, инициирующее горение.
Явление возникновения горения путем зажигания представляет научный и практический интерес с двух точек зрения:
• запланированное (ожидаемое) устойчивое зажигание, специально подготовленных для сжигания горючих сред, в связи с разработкой высокофорсированных двигателей внутреннего сгорания и камер сгорания
газовых турбин, топочных устройств и т.д.;
• не запланированное (нежелательное) зажигание с точки зрения возникновения пожаров и взрывов.
Упомянутый выше «Стандарт» подчеркивает чрезвычайно важную
роль источника зажигания в системе предупреждения пожаров (СПП). Считается, что если исключить ИЗ, то горения – основного процесса на пожаре –
не возникнет. Однако горение может возникнуть и в этом случае, но в другом
режиме – режиме самовоспламенения или самовозгорания.
Часто перед пожарно-техническими специалистами возникают вопросы: «Что явилось источником зажигания при возникновении очага горения?
Мог ли тот или иной источник тепла инициировать горение? Что надо сделать, чтобы источник энергии (теплоты) стал безопасным и не смог инициировать горение?»
138
Для того чтобы ответить на поставленные вопросы необходимо понимать сущность процесса зажигания, знать условия зажигания и отличие зажигания от других видов возникновения горения.
Природа возникновения горения во всех случаях имеет тепловой характер. Впервые основы теплового взрыва разработаны Н.Н. Семеновым еще
в 1928 году. Согласно этой теории зажигание реакционноспособной
горю-
чей системы внешним источником тепла может произойти лишь в том случае, если скорость выделения тепла в реагирующей смеси q+ (теплоприход)
станет больше скорости отвода тепла q− (теплоотвод).
Передача тепла от источника зажигания может осуществляться различными способами: контактным, радиационным, конвекционным. В зависимости от механизма теплопередачи различают следующие способы зажигания
горючих смесей: накаленными телами, электрической искрой, факелом, раскаленными продуктами горения и т.д.
И.З.
Г.С.
Г.С.
Г.С.
И.З.
И.З.
И.З.
Г.С.
контактный
радиационный
конвекционный
Рис 8.1. Схема передачи тепла от ИЗ контактным, радиационным,
конвекционным способами.
Несмотря на большое разнообразие способов и механизмов, процесс
возникновения горения характеризуется некоторыми общими качественными
закономерностями.
139
8.2. Закономерности перехода самовоспламенения к зажиганию
Предположим, что в некоторой емкости находится горючая смесь. Горение этой смеси можно вызвать, либо поджиганием ее с помощью факела,
искры или нагретого тела, либо создав условия для реализации самовоспламенения, путем нагрева всего объема смеси до критической температуры.
При нагревании емкости с горючей смесью снаружи, поверхность этой
емкости можно рассматривать как поверхность нагретого тела. В этом случае, по какому механизму (самовоспламенения или зажигания) произошло
возникновение горения сказать трудно.
Прежде чем перейти к рассмотрению основных особенностей процесса
зажигания, следует отметить, что принципиального отличия между воспламенением, самовоспламенением и вынужденным зажиганием нет. В основе
возникновения горения во всех случаях лежит тепловая и цепная теория
возникновения горения, разработанная академиком Н.Н. Семеновым.
т
а
т
Г.С.
Тсв
б
т
Г.С.
Х
Т2
в
Г.С.
Х
Т3
Х
Рис. 8.2. Схема перехода самовоспламенения в зажигание.
На рис. 8.2. показана схема перехода самовоспламенения в зажигание.
Для иллюстрации перехода показано распределение температуры по объему
горючей среды (ГС), где х – расстояние, F – границы поверхности, в которой
находится ГС. Температура окружающей среды T o растет от T СВ до T З . На
рис 8.2 а распределение температуры внутри объема, ограниченного поверхностью F, соответствует температуре самовоспламенения. Профиль темпера-
140
турного поля в симметричном реакционном сосуде описывается параболой.
Максимальное значение достигается при температуре самовоспламенения.
С повышением температуры окружающей среды первоначальный очаг
горения перемещается от центра к периферии. При достижении на поверхности горючей смеси критической температуры зажигания возникает очаг
горения на поверхности F. При этом волна горения распространяется от поверхности вглубь горючей среды.
Инициирование
такого начального
очага горения и есть зажигание.
Как видно, четкой границы между самовоспламенением и зажиганием
нет. Имеет место плавный переход от одного режима горения к другому.
Рис.8.2в. отражает переходную область от самовоспламенения к зажиганию.
Определение условий зажигания более сложная задача, чем определение условий самовоспламенения.
8.3. Зажигание нагретым телом
Зажигание подготовленной газовоздушной смеси нагретым телом
наиболее изученный случай. Рассмотрим его более подробно. Пусть имеется
горючая смесь, в которую попадает источник зажигания (рис.8.3.)
Горючая смесь (Гор.+Ок.)
T0
δ
И.З.
ТСТ
q
X
dT
dx
Рис.8.3. Схема тепловых потоков в системе «газ – источник зажигания»
Температура газа во всем его объеме одинаковая и равна T 0 , поэтому
141
конвекция, т.е. перемешивание газа, отсутствует. Поместим в эту систему
накаленное тело (источник зажигания) с бесконечно малой поверхностью и
температурой стенки Т ст выше температуры газа Т 0 .
В этом случае газ начнет нагреваться, и возникнет тепловой поток q от
поверхности тела к периферии смеси. Передача теплоты будет осуществляться теплопроводностью. В газовой смеси возникнет температурное поле, градиент которого будет направлен в сторону теплового потока от источника
зажигания. Распределение температуры по объему газовой смеси будет зависеть от Т ст нагретого тела и от того, какая смесь находится в системе: горючая или негорючая (рис. 8.4).
Т
ТЗ=Т2ст
Т1ст
ИЗ
δ
dT/dX
q
X
Рис.8.4. Критические условия зажигания горючей смеси
Графически зависимость распределения температуры по негорючему
газу будет представлять собой прямую линию, поскольку из закона Фурье
следует, что
q=λ
T ст
∫
T0
Тст − Т0
dT
=λ
,
dx
x
(8.1)
142
и для температуры газа T 1 cт получаем прямую линию (рис.8.2):
T = T ст – qx/λ,
(8.2)
где q - тепловой поток, Вт/м2 ;
λ - коэффициент теплопроводности, Вт/м2⋅К;
х - расстояние от поверхности источника зажигания, м.
Если же в системе находится горючая смесь, то характер зависимости
изменится за счет дополнительного выделения теплоты окислительновосстановительных реакций. Они будут протекать только в очень узком,
приповерхностном слое δ горючей смеси. Далее теплота будет отводиться из
этого слоя в объем холодной горючей смеси. Если поднять температуру
стенки выше T 1 , то в этом случае в негорючем газе будет увеличиваться
только наклон температурной прямой. В среде же горючей смеси скорость
реакции окисления будет, естественно, увеличиваться с повышением температуры, а значит, больше будет и тепловыделение. И может найтись такая
температура стенки Т 2 ст , при которой в приповерхностном слое температура
горючей смеси понижаться не будет, и кривая температуры на этом участке
пойдет параллельно оси абсцисс. То есть в этом слое установится равенство,
баланс теплоотвода и тепловыделения. Малейшее увеличение температуры
выше Т 2 ст приведет к тому, что скорость реакции в пограничном слое начнет
прогрессивно возрастать, как при самовоспламенении. Смесь воспламенится.
Температуру стенки Т 2 ст называют критической или температурой
зажигания Тз. Она аналогична по смыслу, но не равна по величине температуре самовоспламенения горючей смеси.
Температура зажигания - это критическая, минимальная температура источника зажигания, выше которой всегда происходит воспламенение от него горючей смеси.
Критические условия при вынужденном воспламенении связаны со
свойствами источника зажигания и условиями распространения пламени. С
143
того момента, когда температура стенки источника зажигания становится
равной критической, источник более не участвует в процессе теплообмена с
газом. Здесь определяющими становятся процессы, протекающие в прилегающем к источнику слое газа.
8.4. Элементы тепловой теории зажигания
Более строгая теория зажигания накаленным телом, получившая всемирное признание, разработана академиком Я.Б.Зельдовичем и профессором
Д.А.Франк - Каменецким. Теории зажигания в качестве горючей среды рассматривали однородную, заранее подготовленную смесь, находящуюся в статических условиях. При разработке теорий были сделаны следующие допущения:
- температура внутри газовой смеси распределена равномерно;
- теплоотвод описывается уравнением Ньютона;
- тепловыделение описывается уравнением Аррениуса;
- расход продуктов реакции чрезвычайно мал.
Поместим горючую смесь между двумя параллельными стенками, отстоящими друг от друга на расстоянии L (рис. 8.5а). Пластины расположены
горизонтально, причем нагрета только верхняя, что позволяет исключить
конвекцию в газовой смеси. Нижняя поверхность имеет температуру газа Т 0 .
Пусть верхняя пластина нагревается до температуры Тст . Начиная от
некоторой температуры Т 2 ст, линейный характер теплоотвода будет меняться
за счет начинающихся процессов окисления (рис.8.5). При температуре Т 2 ст
наступает баланс тепловыделения и теплоотвода, т.е. на поверхности стенки,
где х = 0, градиент температуры (dT/dx) = 0. Значит, и для стенки можно записать (dT/dx) cт = 0. При малейшем увеличении температуры пластины температура газа становится выше Т 2 ст за счет выделения теплоты реакции
окисления, и градиент температуры меняет свой знак. Это означает, что если
стенка раньше отдавала теплоту в смесь, то теперь, наоборот, она ее воспринимает от газа.
144
По теории Я.Б. Зельдовича, условие (dT/dx) ст = 0 является критическим условием воспламенения, а распределение температуры, т.е. ее градиент в горючей смеси, определяется уравнением теплопроводности, которое
для данного случая имеет вид:
d2 T
λ 2 + Q гор ⋅ W (T) = 0,
dx
(8.3)
где λ - коэффициент теплопроводности смеси;
Q гop - тепловой эффект реакции горения;
W(T) - скорость реакции горения.
Представим это уравнение в виде:
Qгор
d2 T
=
−
⋅ W (T).
λ
dx 2
(8.4)
Имея в виду, что скорость реакции равна
W(T) = k 0 ⋅C гор n⋅C ок β⋅exp(- E/RT),
(8.5)
путем математического преобразования экспоненты по методу Франк- Каменецкого и интегрирования уравнения теплопроводности при начальных
условиях х = 0, (dT/dx) = 0 и Т = Т cт приходим к выражению:
2
2Q гор
RTст2
dT
⋅ W (T ) ⋅
.
=
λ
Е
dx кр
(8.6)
145
δ
ТСТ
q
T
T
T2СТ
TСТ2
T1СТ
T1СТ
T0
T0
L
Т0
a)
δ
L х
L х
в)
Рис. 8.5. Схема зажигания горючей смеси от нагретого тела
по Я.Б. Зельдовичу
Так как скорость W(T) сильно зависит от температуры, то можно считать, что реакция окисления идет практически только в узком слое δ, прилегающем к нагретой пластине, т.е. L >> δ. Тогда теплоотвод из зоны реакции в
смесь можно количественно выразить законом Фурье:
q=λ
T − Т0
dT
.
≈ λ ст
dx
L
(8.7)
Далее, подставляя сюда dT/dx из полученного выше выражения (8.6),
приходим к уравнению:
2Q гор
λ
⋅ W (Tст ) ⋅
RTст Tст − T0
=
E
L
(8.8)
146
и после несложных преобразований получаем основное уравнение процесса
зажигания:
L=
λ(Tст − Т 0 ) 2 ⋅ Е
2
2Q гор W (Tст ) ⋅ RТ ст
(8.9)
.
Основное уравнение процесса зажигания связывает геометрические
размеры горючей смеси с температурой стенки и физико-химическими
свойствами горючей смеси при воспламенении. Анализ его позволяет,
например, предсказать пределы воспламенения горючих веществ, максимально допустимые, пожаровзрывобезопасные размеры и температуру источников зажигания и т.д. Например, для раскаленного шарика (искры сварки и т.п.) его критический диаметр будет равен
d кр =
λ(Tст − Т 0 ) 2 ⋅ Е
2
2Q гор W (Tст ) ⋅ RТ ст
.
(8.10)
Для раскаленной проволочки в цилиндрической трубе с горючей
смесью
λ(Tст − Т 0 ) 2 ⋅ Е
R
r ⋅ ln =
,
2
r
2Q гор W (Tст ) ⋅ RТ ст
(8.11)
где R - радиус трубы, м;
r - радиус проволочки, м.
Таким образом, уравнение (8.9) позволяет рассчитывать основные параметры и условия процесса зажигания от нагретой поверхности.
147
8.5. Особенности зажигания газопаровоздушных смесей
нагретой поверхностью
Критическая температура зажигания всегда выше температуры самовоспламенения смеси. Причиной этому является теплоотвод из приповерхностного слоя, в котором начинаются реакции окисления: теплоотвод в стенку и в газовую смесь.
Для того, чтобы смесь воспламенилась, необходимо выделение большого количества теплоты реакции. Это возможно только при достаточных
размерах поверхности металлического шарика, массы и площади поверхности источника зажигания для прогрева необходимого объема горючей смеси.
Чем больше запасено источником теплоты, тем ниже температура зажигания
(рис.8.6).
Тз , К
C5H12
H2
S, см2
Рис.8.6. Зависимость критической температуры зажигания от площади
поверхности металлического шарика
Данное обстоятельство однозначно подтверждается экспериментами.
Так, критическая температура зажигания от металлического шарика снижается с увеличением его диаметра:
148
Диаметр шарика d,
Т З , °С
мм
2
1000
3
800
5
600
В реальных условиях при нагревании газопаровоздушной смеси какимлибо "горячим телом" часть горючего в пристенном слое окисляется, и концентрация его быстро снижается. При этом, естественно, снижается и скорость реакции, а значит и скорость тепловыделения. Поэтому для достижения критической температуры зажигания необходима компенсация теплопотерь, которая может быть достигнута повышением температуры нагретого
тела. Но здесь существенную роль может играть каталитическая активность
поверхности источника зажигания. Если на его стенке происходит ингибирование реакции окисления (дезактивация активных центров), то Т З повышается. Если же процесс катализируется, то происходит ускорение реакции окисления, и поэтому следовало бы ожидать снижения температуры зажигания.
Но наблюдается неожиданное, на первый взгляд, явление. Например, для зажигания платиной, которая каталитически активна, необходима более высокая температура, чем в случае инертного материала. Причем максимум ее
приходится на стехиометрический состав горючей смеси. Причиной этого
парадокса является интенсивный расход реагирующих компонентов вблизи
каталитической поверхности (рис.8.7).
149
Тз
Pt
Au
Mo
Cт.
Сстех
СН4,%об
Рис.8.7. Влияние природы металла на температуру зажигания
метано-воздушной смеси
Приведенные на рисунке данные для метана показывают, что наибольшей каталитической активностью среди этих металлов обладает платина,
наименьшей - сталь. Однако температура самовоспламенения, измеренная в
платиновом сосуде, будет ниже, чем в таком же стеклянном. Именно этим
принципиально отличается физико-химия явлений зажигания и самовоспламенения газов и паров.
До сих пор теорию процесса зажигания мы рассматривали в стационарных условиях, т.е. при установившемся, стационарном процессе теплопередачи (все его параметры постоянны). В реальных условиях процесс нестационарный и гораздо сложнее. Источник зажигания в горючей среде появляется внезапно. В этом случае распределение температуры или ее градиент
будет иметь графический вид, приведенный на рис. 8.5в. За короткий промежуток времени в газе прогреется только слой δ. Остальной объем газовой
смеси останется практически холодным. Уравнение теплового потока в этом
случае будет иметь следующий вид:
q=λ
Tст − Т 0
dT
+ срρ .
dτ
δ
(8.12)
150
Тепловой поток будет значителен только в слое δ, а в остальной части
горючей смеси - невелик.
На практике очень часто приходится иметь дело с подвижными горючими смесями. В этом случае у границы поверхности источника зажигания
возникает неподвижный слой. Для расчета критических условий зажигания
толщины неподвижного и тепловыделяющего пограничных слоев принимаются равными друг другу, а вместо выражения (8.1) используется формула
Ньютона для конвективной теплопередачи:
q = α ⋅ (Tст − Т 0 ),
(8.13)
где α - коэффициент теплоотдачи от стенки в подвижную газовую среду.
Критическим условиям зажигания соответствует равенство процессов
теплоотвода и тепловыделения в слое δ, которое описывается уравнением
теплового баланса. Из него можно вывести выражение, которое позволяет
оценить определяющий размер нагретого тела, способного вызвать воспламенение движущегося потока горючей смеси с заданными физикохимическими свойствами.
8.6. Элементы тепловой теории зажигания электрической искрой
Электрическая искра - один из наиболее распространенных способов
зажигания в технике, и именно она является частой причиной возникновения
пожаров и взрывов. И если другие виды источников зажигания образуются,
как правило, в результате аварий, их в известной степени можно предвидеть,
то явление зажигания электрической искрой меньше всего поддается контролю, возникает неожиданно и в качестве причины пожара не всегда доказуемо. Само явление электрического разряда недостаточно изучено.
Электрический разряд - это сложное физико-химическое явление, в
результате которого в диэлектрике в зоне проскока (пробоя) искры образует-
151
ся канал разряда, в котором происходит возбуждение и ионизация молекул
газа с выделением большого количества теплоты. Образуется и плазма. Схема искрового разряда представлена на рис.8.8.
пламя (≈3000 К)
+
-
канал
Рис.8.8. Схема искрового электрического разряда
В зоне электрического разряда происходит мгновенное развитие химических реакций горения, при этом период индукции практически отсутствует. Выделенная в разрядном канале теплота приводит к сгоранию горючей
смеси, но количества ее может не хватить для образования и распространения устойчивого фронта пламени. Поэтому для каждого вида горючего в зависимости от соотношения его с окислителем существует наименьшее, критическое значение мощности электрической искры. Минимальная мощность
разряда есть функция состава горючей смеси, давления, температуры и т.д
Е кр = f(С гор /С ок , Р, Т)
(8.14)
Теория теплового механизма зажигания электрической искрой разработана академиком Я.Б.Зельдовичем. Рассмотрим некоторые элементы этой
теории. Представим горючую смесь, в центре которой расположен точечный
источник зажигания в виде электрической искры (рис.8.9).
152
Qгор
Тг
Т
τ4
τ5
Q
ИЗ
r
Рис.8.9. Схема тепловых потоков при искровом зажигании
За время τ1 >0 источником зажигания выделяется ∆Q Дж теплоты. К
ней будет добавляться теплота химической реакции Q гop . Часть выделяющейся теплоты будет передаваться теплопроводностью в холодную горючую
смесь.
Если мощность искры мала, то нагреваемого ею объема недостаточно
для поддержания в начальный момент реакции горения. Поэтому смесь
охлаждается, и воспламенения не происходит (рис.8.10), сплошные линии
τ1 > τ2 > τ3 ). При увеличении мощности искры нагреваемая ею часть объема
смеси будет больше. В этом случае выделяемой теплоты реакции уже достаточно для компенсации теплоотвода в холодную смесь. Возникает устойчивый фронт горения, пламя распространяется по всему объему смеси (пунктирные линии τ4 > τ 5 ).
153
T
τ1
T1
τ2
τ3
τ4
τ5
T0
0
r
Рис.8.10. Температурное поле вокруг ИЗ (r – расстояние в разное время τ)
Представленные на рис.8.10 зависимости изменения температуры
описываются следующим уравнением:
T = T0 +
Q
c p ⋅ ρ ⋅ (4π ⋅ a ⋅ τ)
3/ 2
⋅e
−
r2
4 aτ ,
(8.15)
где Т 0 - начальная температура горючей смеси. К;
с р - средняя теплоемкость смеси, кДж/кг⋅К;
а - температуропроводность, м2/с;
ρ - плотность свежей смеси, кг/м3;
r - радиус смеси, приведенный к ее начальной плотности, м.
Максимальная температура в точке r = 0 нагретой зоны изменяется во
времени по гиперболическому закону (рис.8.11):
Tmax = T0 +
Q
c p ⋅ ρ ⋅ (4π ⋅ a ⋅ τ) 3 / 2
.
(8.16)
154
Т
1
ТГ
2
ТГ-θ
Δτохл
τ1охл
τ2охл
τ
Рис.8.11. Изменение температуры в искровом пространстве от времени
Если искра нагревает некоторый объем горючей смеси до температуры
горения Т Г (точка 1), и если время охлаждения объема смеси до температуры
Т Г - θ (точка 2) больше или равно времени начала реакций τ хр в зоне нагрева,
то воспламенение возможно:
∆τохл ≥ τхр ,
(τ хр ≈ 10-4 с)
(8.17)
Согласно теории Я.Б.Зельдовича минимальная температура горючей
смеси, при которой может возникнуть горение, должна быть не менее разности температуры горения (Т Г ) и характеристического температурного интервала (θ)
ΤГmin = ΤГ − θ
(8.18)
Здесь θ = RT2/E - характеристический интервал температуры, который
означает, что при снижении температуры в зоне горения от Т Г до Т Г - θ скорость реакции снижается в е раз, причем при температуре Т Г - θ горение становится невозможным.
155
Любой источник зажигания должен обладать такими энергетическими
параметрами, чтобы осуществить прогрев горючей смеси до значения ΤГmin .
При этом время прогрева горючей среды всегда связано со временем охлаждения источника зажигания, то есть горючая среда нагревается, а источник
зажигания охлаждается. Снижению скорости охлаждения источника зажигания и, как следствие, увеличению времени достижения критической температуры препятствует теплота, выделяемая химической реакцией. Возникновение горения происходит не сразу, а через определенный интервал времени
температурного воздействия ( τ ХР ). Значение τ ХР находится в пределах от 10-3
до 10-4 с и зависит от свойств горючего вещества и внешних условий. Если
τ ХР ≥ τ ОХЛ ( τ ОХЛ - время охлаждения источника зажигания), то теплота, выделя-
емая при химической реакции, не успевает оказывать свое влияние на снижение температуры источника зажигания, и в этом случае воспламенение не
произойдет. Если τ ХР ≤ τ ОХЛ , то воспламенение произойдет.
Критические условия создаются, когда выполняется равенство
τ ХР = τ ОХЛ
( 8.19)
Время охлаждения источника зажигания τ ОХЛ определяется энергией
нагретого тела и зависит от температуры, массы источника зажигания, теплофизических параметров среды и источника зажигания, условий теплообмена, природы источника зажигания и т.д. Например, зажигание не произойдет, если температура нагретого тела будет очень высокой, но при этом
охлаждаться оно будет очень быстро, то есть время охлаждения будет мало.
Произведя математические преобразования и подставив далее в него
теплофизические параметры газовой смеси, можно получить численные значения критического радиуса эквивалентной сферы разогретых газов, которая способна зажечь горючую смесь данного вида и состава:
r экв ≥ 3,7 δ ф ,
(8.20)
156
где δ ф - толщина фронта пламени.
Для большинства горючих газовых смесей δ ф ≈ 0,1 мм, т.е.
r экв = 0,4 - 0,5 мм. В табл.8.1 приведены расчетные критические радиусы эквивалентной сферы для некоторых стехиометрических смесей горючих газов
и паров с воздухом.
Таблица 8.1
Расчетные критические радиусы смесей
стехиометрического состава газов и паров
Вещество
r кр , мм
Вещество
r кр , мм
Метан
1,03
Бензол
0,85
Этан
0,90
Метанол
0,76
Пропан
0,92
Водород
0,26
Бутан
0,95
Ацетилен
0,28
Для создания очага минимального критического размера к горючей
смеси необходимо локально подвести некоторое минимальное количество
энергии. Приблизительно ее величина определяется следующим выражением:
Q min =
λ3г ⋅ T02 ⋅ (Tг − T0 )
u 3н
⋅ p 02
⋅ c p2
(8.21)
,
где U H - нормальная скорость распространения пламени, м/с;
р 0 - начальное давление смеси, Па.
Таким образом, для зажигания электрической искрой также существуют критические условия, определяемые минимальной энергией зажигания,
необходимой
для
создания
элемента
пламени,
способного
к
распространению.
В настоящее время стандартную зажигающую способность искры
оценивают по минимальной энергии конденсатора, разряд которого образует
157
искру достаточную для зажигания горючей смеси. Однако надо учесть, что
зажигающая способность искры определяется не энергией, а мощностью –
количеством энергии, выделяющейся в единицу времени. Для конденсатора
кажущееся сходство между энергией зажигания и мощностью объясняется
тем
фактом,
что
время
существования
электрической
искры
пропорционально энергии разряда конденсатора. При этом температура в
центре искрового разряда всегда выше температуры зажигания, поэтому
зажигающая способность электрической искры всегда очень высокая, и ею
леко управлять. Этот факт чрезвычайно важен
при экспериментальной
оценке пожарной опасности подготовленных горючих смесей.
8.7. Минимальная энергия зажигания, зависимость ее от
некоторых параметров, практическое применение
Минимальная энергия зажигания Е min - это наименьшее значение
электрического разряда, способного воспламенить наиболее легковоспламеняющуюся смесь горючего газа, пара или пыли с воздухом.
Минимальная энергия зажигания - один из показателей пожарной опасности
веществ, применяется при разработке мероприятий по пожаровзрывобезопасности и электростатической искробезопасности технологических процессов с обращающимися горючими газами, жидкостями и пылями. Эти мероприятия касаются выбора взрывобезопасного электрооборудования, материалов, условий их безопасной эксплуатации и т.д.
Минимальная энергия зажигания зависит от множества различных параметров. Она определяется экспериментально.
Зависимость энергии зажигания от концентрации горючего имеет
параболический характер. Так, например, у алканов каждая кривая имеет
минимум, причем Е min в гомологическом ряду с увеличением молекулярной массы вещества снижается.
Е min зависит от химической природы вещества. Например, для сме-
158
сей с воздухом ряда веществ она имеет следующие значения:
Таблица 8.2
Зависимость минимальной энергии зажигания
от химической природы вещества
Вещество
Е min , мДж
Вещество
Е min ,
мДж
Водород
0,019
Сера
0,30
Ацетилен
0,019
Алюминий
0,50
Диэтиловый эфир
0,19
Оксид углерода
8,0
Метан
0,33
Пшеничная пыль
20,0
Этан
0,27
Сахар
10,6
Пропан
0,35
Стеариновая кислота
25,0
8.8. Зажигание твердых и жидких горючих веществ
Рассмотренные основополагающие теории зажигания базируются на
возникновении горения в заранее подготовленных газовых смесях. Это существенно упростило решаемую задачу и позволило теоретически связать основные параметры зажигания.
На практике возникновение горения и перерастание горения в пожар
носит случайный (вероятностный) характер и, как правило, связано с горением твердых и жидких горючих веществ. Условия зажигания для таких веществ существенно отличаются. Подводимая энергия затрачивается не только на процесс зажигания, но и расходуется на образование горючей среды. В
реальной ситуации энергия передается, как правило, присутствуют все тремя
основными видами теплообмена, однако доминирует, обычно, какой-либо
один.
Процесс зажигания твердых веществ имеет сложный многостадийный
характер. Основными стадиями являются:
• нагрев горючего материала,
159
• газификация горючего материала,
• термическая деструкция,
• плавление,
• образование карбонизированного остатка,
• воспламенение карбонизированного остатка и т.д.
Каждая стадия может быть охарактеризована температурой, временем
начала и окончания соответствующей стадии, зависимостью температуры от
времени. Значение указанных параметров необходимо для выявления определяющих стадий и закономерностей процесса возникновения горения.
Огромное разнообразие твердых и жидких горючих материалов, отличающихся теплофизическими параметрами, физико-химическими свойствами и особенностями горения не позволяют в полном виде применять к ним
теоретические представления, разработанные для газов. Однако общие представления о процессе зажигания, основанные на тепловой теории, могут
быть применены и для твердых горючих материалов.
Согласно тепловой теории зажигание горючей смеси происходит тогда, когда температура источника зажигания (ИЗ) больше температуры зажигания, а время его действия больше или равно периоду индукции.
Температура зажигания – не является постоянной величиной, а зависит
от свойств горючей среды и геометрических размеров источника зажигания
С увеличением площади ИЗ температура зажигания будет уменьшаться, но
всегда будет больше температуры самовоспламенения.
При зажигании твердых или жидких горючих веществ энергия теплового источника зажигания расходуется на образование горючей среды и ее
нагревание до температуры зажигания в месте контакта с этим источником.
Зажигание произойдет только в том случае, когда температура источника
зажигания превысит на определенную величину температуру самовоспламенения. При этом энергия источника зажигания должна быть не меньше суммы поглощенной и потерянной энергии.
160
Условия зажигания твердых горючих материалов можно представить в
следующем виде:
Т ИЗ > К З ·Т С ; Е И > Е П + Е У ,
(8.22)
где Е И – энергия источника зажигания;
Е П - энергия, поглощенная горючим;
Е У – энергия утерянная;
Т ИЗ - температура источника зажигания;
ТС
- температура самовоспламенения;
К З - коэффициент, учитывающий отличие теплоотвода при реальном зажигании и стандартных условиях определения температуры самовоспламенения.
8.9. Зажигание лучистым тепловым потоком
Знание особенностей зажигания твердых горючих материалов лучистым тепловым потоком (ЛТП) имеет особое практическое значение, поскольку определяет основной механизм развития и распространения пожара.
Воздействие теплового потока на твердые горючие материалы приводит к нагреву их поверхности и как следствие инициированию поверхностных явлений.
Температура поверхности (Т пов ) нагреваемой в результате излучения
определяется уравнением:
Т пов = 1004 (
Т1 4
q
) −
⋅ спр
100
,
(8.23)
где Т ξ - температура излучающего тела, К ,
q - плотность теплового потока излучения, Вт/м2,
с пр – приведенный коэффициент излучения, Вт/ м2·К4.
Условия зажигания определяются свойствами твердого материала, теплофизическими характеристиками твердого материала, его геометрическими
161
размерами и ориентацией твердой поверхности
к тепловому потоку. На
рис.8.12. показана зависимость времени зажигания от интенсивности излучения для образцов древесины с разной толщиной.
τзаж(с)
3
1
2
Q(кВт/м2)
Рис.8.12 . Зависимость времени зажигания древесины от интенсивности
облучения. 1 – d - 50 мм, 2 – d -13 мм, 3 – d - 20 мм
Как видно на рис.8.12 время зажигания уменьшается с ростом интенсивности облучения.
Для каждого вида твердых горючих материалов имеется свой критический тепловой поток, при котором происходит зажигание. Пламя при этом
возникает не сразу, а после некоторой задержки. Величина «задержки» определяется, главным образом, теплофизическими параметрами горючего материала и условиями теплообмена между горючим материалом и излучающими
поверхностями.
Возникновение горения твердого горючего материала при тепловом
облучении может произойти в двух режимах: при малых мощностях тепловых потоков – в режиме зажигания, при больших мощностях – увеличивается вероятность создания условий самовоспламенения. Критические значения
для разных режимов имеют существенные количественные отличия. Например, для древесины: при значении критического теплового потока 12 кВт/м2
– горение возникает в режиме зажигания, если значение критического теплового потока достигает 28 кВт/м2 – горение происходит в режиме самовоспламенения.
162
Критический тепловой поток часто воспринимают как критерий зажигания того или иного материала, однако, это не всегда оправдано, поскольку
этот поток зависит от большого числа различных факторов.
В нормативных документах величины критических тепловых потоков
широко используются для определения безопасных разрывов и оценки сравнительных характеристик горючих материалов при прочих равных условиях.
В таблице 8.3 приведены критические значения тепловых потоков для некоторых твердых горючих материалов.
Таблица 8.3.
Критические значения тепловых потоков
для твердых горючих материалов
Материал
q кр , кВт
Древесина (сосна влажностью 12 %)
Древесно-стружечные плиты (плотностью 417 кг
-2
м
13,9
-3
) м
8,3
Торф брикетный
13,2
Торф кусковой
9,8
Хлопок-волокно
7,5
Слоистый пластик
15,4
Стеклопластик
15,3
Пергамин
17,4
Резина
14,8
Уголь
35,0
Рулонная кровля
17,4
Сено, солома (при минимальной влажности до 8 %)
7,0
8.10. Основные виды и характеристики источников зажигания
Классификация источников зажигания позволяет правильно и своевременно принимать профилактические меры, унифицировать известные технические приемы по снижению пожарной опасности и облегчает проведение
технического анализа при расследовании и экспертизе пожаров.
163
Для того чтобы произошло возникновение горения в результате внешнего воздействия на горючую среду или горючей материал, необходима тепловая энергия. Носителями тепловой энергии являются внешние источники
зажигания. Передача теплоты от них осуществляется по механизму теплопроводности, излучения или конвекции. При этом в чистом виде конкретный
механизм теплопередачи не реализуется, а доминирует один из возможных
видов.
Горение может возникнуть и в результате внутренних источников теплоты по механизму самовоспламенения или самовозгорания вещества.
Наиболее часто возникновение горения происходит при непосредственном контакте источника зажигания с горючим материалом. Нагрев горючего материала при этом происходит, главным образом, по механизму
кондуктивной теплопередачи. На рис.8.13. приведены основные виды тепловых источников зажигания.
искры
Низкое напряжение
Тепловое проявление
химической энергии
Тепловое проявление электрической энергии
Тепловое проявление
механической энергии
Активные
искры
Инертные
Искры
Тела
Активные
Топочные
Инертные
Фрикционные
чество
Высокое напряжение
Электрические
Статическое электри-
Нагретые
Рис.8.13. Основные виды тепловых источников зажигания
В свою очередь, несмотря на большое многообразие, тепловые источники (нагретые тела) полезно разделить по природе механизма их возникновения на три группы:
1. тепловое проявление механической энергии;
164
2. тепловое проявление электрической энергии;
3. тепловое проявление химической энергии.
К тепловым проявлениям механической энергии можно отнести: разогрев тела при трении, при ударах, при образовании фрикционных искр и в
ряде других случаев.
Общность причин в том, что механическая энергия превращается в
тепловую и идет на нагревание узлов трения, деформируемых или сжимаемых тел. Используя такие превращения, человек научился добывать огонь.
Источники зажигания могут также классифицироваться по времени
действия. Кроме того, для каждого производства характерны свои источники зажигания. В связи с этим целесообразно провести разделение источников зажигания по очевидности: очевидные и неочевидные.
Наиболее часто на практике пожары возникают от тепловых источников зажигания.
Открытое пламя обычно имеет температуру 800 - 1000 К, а при горении отдельных видов горючих веществ достигает 3000 К.
Источники зажигания
Т, К
спички
890-910
стеариновая свеча
920-1200
керосиновая лампа
1050-1300
древесная лучина
1120-1270
бензиновая зажигалка
1470-1570
природный газ
2470
метан
2970
ацетилен
3420
Открытое пламя во всех случаях приводит к воспламенению горючих
газо-, паро- и пылевоздушных смесей, так как его минимальная температура
870-970 К, что всегда выше температуры самовоспламенения известных горючих веществ. Практически для воспламенения горючей смеси надо гораздо
165
меньше теплоты, чем та, которую содержит любое пламя любого размера.
Для воспламенения твердых веществ помимо высокой температуры требуется более длительное воздействие пламени. Так, например, термит, температура горения которого около 3300 К, за две секунды прожигает сосновую
доску толщиной 15 мм насквозь, но не зажигает ее. В то же время пламя объемом всего один см3 с температурой 1200 К при воздействии в течение 15-20
с воспламеняет ее.
Открытое пламя часто является источником большого количества
лучистой энергии.
Топочные искры образуются при сжигании топлива. Искры возникают в результате различных причин, обусловленных несовершенством оборудования и организации самого процесса горения. Температура таких искр достаточно высокая - более 1000 К. Искры способны воспламенять только подготовленные к горению газопаровоздушные смеси, осевшую горючую пыль,
пролитые жидкости и т.п.
Фрикционные искры образуются при соударении или трении деталей
машин и оборудования, инструментов, твердых предметов и т.п. При этом
происходит механическое разрушение поверхности материала и отрыв различных по величине частичек разогретого вещества, чаще всего металла. Высокая начальная температура и скорость окисления этих частичек предопределяет их способность разогреваться во время полета. При соударении стальных деталей с содержанием углерода до 0,8 % максимальная начальная температура обрывающихся частиц не ниже 1600 К. Окисление металлических
частичек, как и всякая реакция окисления, происходит с выделением теплоты. При оптимальных соотношениях температуры частицы, скорости движения и скорости образования на ее поверхности оксидной пленки может произойти воспламенение окружающей горючей среды. Большую роль при этом
играет продолжительность соприкосновения такой искры с горючей смесью.
Так, например, время существования искр от трения стали о наждачный камень не превышает в среднем одной секунды, а их температура - не выше
166
870- 970 К. Такие искры не могут воспламенить природный газ, у которого
период индукции равен нескольким секундам при самовоспламенении. Если
время жизни этих искр увеличить до трех секунд, то природный газ воспламенится.
Фрикционные искры могут быть инертными (негорючими) и активными – горючими. Активные фрикционные искры вносят в процесс зажигания
дополнительную энергию от горения самой искры. Зажигательная способность в этом случае существенно выше, чем от инертной фрикционной искры.
До недавнего времени считалось, что истирание таких мягких металлов, как медь и алюминий, не может приводить к пожароопасному искрообразованию. Однако оказалось, что они в определенных условиях могут давать
опасные искры. И наоборот, многие металлы и сплавы при истирании не дают пожароопасных искр с высокой энергией.
Способность металлов и сплавов к фрикционному искрообразованию
обуславливается, в первую очередь, их химической природой, а не твердостью.
Особый характер имеет искрообразование при соударении и трении
алюминиевых деталей со стальными поверхностями, покрытыми ржавчиной.
В этом случае протекает термитная химическая реакция с выделением большого количества теплоты:
Fе 2 О 3 + FeO = Fе 3 O 4 – ржавчина
8А1 + 3Fе 3 O 4 → 4Аl 2 O 3 + 9Fe + 3340 кДж.
Разряды статического электричества возникают в результате электризации. Электризация - это разделение положительных и отрицательных
зарядов. В настоящее время нет единой теории статического электричества, а
существует ряд гипотез. Наиболее распространена гипотеза о контактной
электризации жидких и твердых веществ. Электризация возникает при трении двух разнородных веществ, обладающих различными атомными и моле-
167
кулярными силами притяжения на поверхности соприкосновения. По крайней мере, одно из них должно быть диэлектриком. При этом происходит перераспределение электронов и ионов вещества, образующих двойной электрический слой с зарядами противоположных знаков.
Пары и газы электризуются только в том случае, если в них присутствуют твердые или жидкие примеси, либо продукты конденсации. Наэлектризованные тела несут заряды статического электричества и оказывают силовое воздействие друг на друга. В окружающем их пространстве образуется
электрическое поле, воздействие которого обнаруживается при внесении в
него заряженных или нейтральных тел. Основными его параметрами являются напряженность и потенциал отдельных точек. В ряде производств потенциал относительно земли достигает огромных значений. Например, при
фильтрации бензина через шелк - 335 кВ. Токи составляют несколько микроампер.
Разряд статического электричества возникает тогда, когда напряженность электростатического поля над поверхностью диэлектрика или проводника достигает критического, пробивного напряжения. Для воздуха пробивное напряжение составляет 3⋅103 В/мм. Статическое электричество может
вызвать воспламенение при следующих условиях:
- наличие источников статических зарядов;
- накопление значительных зарядов на контактирующих поверхностях;
- достаточная разность потенциалов для электрического пробоя среды;
- возможность возникновения электрических разрядов.
Статическое электричество может накапливаться на человеке. Заряд
может достигать 15 кВ, а энергия разряда - от 2,5 до 7,5 мДж.
Разряды атмосферного электричества - это электрические разряды в
атмосфере между отрицательно заряженным облаком и землей. Молния имеет следующие параметры: сила тока - до 100 кА, напряжение - несколько
миллионов вольт, температура - до 30 000 К. Действие молнии - тепловое,
силовое и химическое. Длительность разряда – до 0,1 мс, энергия разряда - в
168
среднем 100 МДж. Воздействие молнии обычно двоякое; прямой удар и вторичные проявления (электростатическая индукция). Прямой удар прожигает
стальной лист толщиной до 4 мм. Вторичные проявления характеризуются
возникновением на больших металлических массах (крыши домов, технологическое оборудование и т.п.) многочисленных искровых разрядов, индуцированных молнией. Энергия их может превышать 250 мДж.
Таким образом, несмотря на многочисленность источников зажигания,
все они по своей природе могут быть разделены на несколько основных видов. Зажигание такими из них, как топочные, фрикционные искры, частички
расплавленного металла и т.п. носит тепловую природу и описывается теоретическими представлениями, рассмотренными выше. Электрические искры
имеют свои отличительные особенности, поэтому их необходимо рассматривать отдельно.
Задания для самоконтроля
нием?
1. Какой процесс называется зажиганием? Что он имеет общего с самовоспламене-
2. Какая температура называется температурой зажигания ?
3. Изобразите график зависимости температуры от расстояния до нагретой поверхности в инертной и горючей среде.
4. Что является критическим условием зажигания по тепловой теории?
5. Напишите основное уравнение теплового зажигания нагретой поверхностью.
6. Напишите уравнение для критического радиуса шарообразного источника зажигания.
7. Изобразите график зависимости температуры зажигания от диаметра источника
зажигания.
8. Изобразите график зависимости температуры зажигания. от площади поверхности источника зажигания.
9. Почему температура зажигания платиновой поверхностью выше, чем для инертных поверхностей. В чем отличие от температуры самовоспламенения?
10. Что называется минимальной энергией зажигания? Укажите ее размерность и
практическое значение.
11. Какие факторы, химические или физические, обуславливают способность к зажиганию фрикционных искр.
12. Что происходит, в чем опасность удара или трения алюминия, его сплавов с
ржавыми стальными поверхностями в среде горючих газопаровоздушных смесей?
13. Как происходит накопление статического электричества при истечении жидкостей?
14. В чем особенность зажигания электрической искрой?
15. Чем определяется минимальная мощность источника зажигания?
16. Почему уравнение для минимальной энергии зажигания не дает полную информацию о потенциальной зажигающей способности источника зажигания?
17. Как влияет скорость потока горючей смеси на температуру зажигания?
169
IV.II. РАЗВИТИЕ ПРОЦЕССОВ ГОРЕНИЯ
ГЛАВА 9. ГОРЕНИЕ ГАЗОПАРОВОЗДУШНЫХ СМЕСЕЙ
Все основные теоретические представления о горении базируются на
экспериментальных результатах изучения горения предварительно перемешанных газовых смесей. В этом случае горение легче поддается теоретическому описанию, горючие смеси в любом соотношении легко готовить, пламена в подобных смесях распространяются самопроизвольно в сторону исходной смеси.
Такое распространение пламени по однородной горючей среде, при
котором фронт пламени движется вследствие ее послойного разогрева по
механизму теплопроводности от продуктов горения называется нормальным или дефлаграционным горением.
Основные теоретические положения тепловой теории распространения
пламени по газопаровоздушным смесям изложены в главах 4 и 5.
Показано, что основным фактором, определяющим скорость распространения пламени в газовых смесях, является скорость химической реакции
горения.
9.1. Концентрационные пределы распространения пламени
Обратимся вновь к рис. 5.5. и 5.6. На них представлена зависимость
скорости реакции горения (нормальной скорости распространения пламени)
от концентрации горючего в газопаровоздушной смеси. В обоих случаях
максимальные значения скорости реакции и U н соответствуют стехиометрической концентрации горючего, т.е. при коэффициенте избытка воздуха α =
1.
При отклонении от стехиометрического состав смеси как в сторону
бедных по горючему смесей (α > 1), так и в сторону богатых смесей (α < 1)
скорость реакции горения снижается, достигая своих предельных значений,
170
ниже которых реакция горения не возможна.
Это означает, что существуют два значения концентраций горючего
вещества, при которых нормальная скорость распространения пламени достигает своих критических значений.
Их называют концентрационными
пределами распространения пламени (сокращенно - КПР).
Нижний и верхний концентрационный предел распространения
пламени (воспламенения) - соответственно, минимальное и максимальное содержание горючего вещества в однородной смеси с окислительной средой, при котором возможно распространение пламени по
смеси
на
любое расстояние от источника зажигания.
Обозначается
НКПР (ϕ н ) и ВКПР (ϕ в ).
КПР применяют при расчете взрывобезопасных концентраций газов,
паров, пылей в воздухе рабочей зоны, внутри технологического оборудования, трубопроводов, при проектировании вентиляционных систем.
Область концентраций горючего, заключенная между КПР, называется областью распространения пламени или областью воспламенения.
Горючие смеси, в которых концентрация горючего вещества находится
вне области воспламенения, не могут быть зажжены даже от самого мощного источника зажигания. Если смесь не имеет КПР, то она вообще негорюча.
КПР для реальных горючих веществ определяется экспериментально
по ГОСТ 12.1.044-89. Там же приведены инженерные методы расчета КПР в
воздухе.
Расчет КПР
по аппроксимационной
формуле
Пример 9.1. Рассчитать концентрационные пределы
распространения пламени газа пропана С 3 Н 8 .
Концентрационные пределы распространения пламени (область воспламенения)
для газо- и паровоздушных смесей могут быть рассчитаны по следующей формуле
100
, %,
(9.1)
ϕ Н ( В) =
а⋅β + b
где
171
ϕ Н(В) - нижний (верхний) концентрационный предел распространения пламени ( НКПР и
ВКПР ), %;
β - число молекул кислорода ( коэффициент перед кислородом в уравнении реакции горения вещества );
a и b - константы, имеющие значения, приведенные в таблице 9.1.
Для расчета массовой концентрации можно воспользоваться формулой:
ϕ н масс =
М
, кг/м3 или г/л.
( а ⋅ β + b ) ⋅ VМ
(9.2)
Таблица 9.1.
Значения коэффициентов “а” и “b” для расчета концентрационных
пределов распространения пламени
КПР
а
8,684
B
4,679
β≤ 7,5
β> 7,5
1,550
0,768
0,560
6,554
НКПР
ВКПР
1. Составляем уравнение реакции горения пропана.
С 3 Н 8 + 5( О 2 + 3,76 N 2 ) =3СО 2 + 4Н 2 О + 5· 3,76 N 2
β=5
100
2. ϕ н = НКПР =
= 2,07 %
8,684 ⋅ 5 + 4,679
ϕ в = ВКПР =
100
= 12,03%
1,55 ⋅ 5 + 0,56
Расчет
КПР по известным
энтальпиям образования
веществ
Пример 9.2. Вычислить нижний концентрационный
предел распространения пламени фенола С 6 Н 5 ОН. Теплота
образования фенола составляет 94,2 кДж/моль.
Если известно значение энтальпии (теплоты) образования, НКПР может быть рассчитан по формуле
ϕн =
100
, %,
hC nC + hH ⋅ nH + hO nO + hN n N + h f ∆H 0f + 1
где
n С , n H , n O , n N , n f - число атомов С, Н, О, N в молекуле горючего;
коэффициенты
(9.3)
172
h C = 8,737; h Н = 2,757; h О = −0,522; h N = −0,494; ; h f = 2,36⋅10-2 кДж/моль;
∆Н0 f - стандартная теплота образования горючего вещества, кДж/моль.
Решение:
ϕн =
100
= 1,39 %
8,737 ⋅ 6 + 2,757 ⋅ 6 − 0,494 ⋅ 1 + 2,36 ⋅ 10 −2 ⋅ 94,2 + 1
По справочным данным НКПР фенола составляет 1,52 %.
Для определения КПР смесей газов и паров можно воспользоваться
формулой Ле Шателье:
ϕ н(см) =
ϕ в(см) =
100
,%
(9.4)
100
, % где
(9.5)
ϕ1 ϕ 2 ϕ3
+ ...
+
+
ϕ н1 ϕ н 2 ϕ н 3
ϕ1 ϕ 2 ϕ3
+
+
+ ...
ϕв1 ϕв 2 ϕв 3
ϕ н(см) , ϕ н(см) – концентрационные пределы распространения пламени смеси;
ϕ н1 , ϕ н2 , ϕ н3 - НКПР каждого компонента газовой смеси;
ϕ в1 , ϕ в2 , ϕ в3 - ВКПР каждого компонента газовой смеси.
Расчет КПР
газовой смеси
Пример 9.3. Рассчитать КПР смеси газов следующего состава:
угарный газ СО – 10 %; водород Н 2 – 60 %; метан СН 4 – 30 %.
1. Определяем НКПР и ВКПР каждого горючего компонента (по справочным данным или расчетным путем):
для угарного газа
для водорода
для метана
ϕ н = 12,5 %;
ϕ н = 4 %;
ϕ н = 5 %;
ϕ в = 74 %
ϕ в = 75 %
ϕ в = 15 %
2. Определяем НКПР и ВКПР для смеси газов по формулам (9.4) и (9.5):
ϕ н(см) =
100
= 4,58 %
10 60 30
+
+
5
12,5 4
ϕ в(см) =
100
= 34 %.
10 60 30
+
+
74 75 15
173
9.2. Факторы, влияющие на КПР
Концентрационные пределы распространения пламени зависят от химических, теплофизических свойств, а также параметров состояния горючего вещества и окислителя. Основными из них являются:
1. Химическая природа горючего и окислителя
2. Начальная температура смеси
3. Начальное давление смеси
4. Наличие флегматизаторов и ингибиторов
9.2.1. Зависимость КПР от химической природы горючего вещества
КПР существенно зависит от длины углеродной цепи и от класса органического вещества, т.е. наличия различных функциональных групп. Так,
в гомологическом ряду с увеличением числа углеродных атомов в цепи снижаются оба КПР пламени, причем область воспламенения существенно
сужается. Например, для гомологического ряда метана данная зависимость
показана на рис.9.1.
С%. об.
15
СН4
С2Н6
С3Н8
10
С4Н10
С5Н12 С6Н14
С7Н16
φн
5
φн
1
2
3
4
5
6
nC
174
Рис.9.1. Изменение КПР в гомологическом ряду метана
Влияние на КПР пламени различных функциональных групп (кратных связей, карбонильных, карбоксильных, гидроксильных, простых и
сложноэфирных групп) наглядно иллюстрируется данными таблицы 9.2.
С появлением в молекуле вещества ненасыщенных связей и увеличением их кратности область воспламенения сильно расширяется. Заметно повышается химическая активность молекул и при появлении в них атомов кислорода. Хотя в этом случае НКПР несколько повышается, но область воспламенения в целом расширяется.
Таблица 9.2.
Концентрационные пределы распространения пламени
некоторых веществ
Наименование вещества
Этан
Этилен
Ацетилен
Пропан
н-Пропиловый спирт
Ацетон
Метилэтиловый эфир
Метилацетат
Структурная формула
СН 3 - СН 3
СН 2 = СН 2
СН ≡ СН
СН 3 - СН 2 - СН3
СН 3 - СН 2 – СН2 - ОН
СН 3 – СО - СН 3
СН 3 – О - СН 2 - СН 3
СН 3 – О – СО - СН 3
ϕн
3,22
2,75
2,50
2,10
2,10
2,26
2,00
3,15
ϕв
12,45
28,60
80,0
9,50
13,55
13,00
10,10
15,60
9.2.2. Влияние начальной температуры смеси на КПР
При увеличении
начальной
температуры горючей смеси область
воспламенения расширяется, в основном за счет увеличения ВКПР. Например, зависимость для метана выглядит следующим образом (рис.9.2).
Формулы для расчета концентрационных пределов распространения
пламени справедливы при температурах среды близкой к 200С. Для более
175
высоких температур необходимо производить расчет с учетом изменения
температуры.
Приближенно это можно сделать с помощью следующих формул:
ϕ н(t) = ϕ н ⋅ ( 1 − Т − Т 0
)
(9.6)
ϕ в(t) = ϕ в ⋅ ( 1 + Т − Т 0
) , где
(9.7)
1550 − Т 0
1100 − Т 0
ϕ н , ϕ в – концентрационные пределы распространения пламени, рассчитанные
или определенные экспериментально при ∼ 200С;
ϕ н(t) ,ϕ н(t) – концентрационные пределы распространения пламени при температуре Т;
1550 К, 1100 К – температура горения соответственно на НКПР и ВКПР.
Пример 9.4. Рассчитать КПР газа пропана С 3 Н 8 при
3000С.
Расчет КПР при
повышенных
температурах
1. В примере 8.2. были рассчитаны значения НКПР и ВКПР для пропана при 200С:
ϕ н = 2,07 %; ϕ в = 12,03%.
2. С учетом заданной температуры КПР составят:
ϕ н(t) = 2,07 ⋅ ( 1 −
573 − 293
1550 − 293
ϕ в(t) = 12,03 ⋅ ( 1 +
573 − 293
1100 − 293
) = 1,61 %
) = 16,20 %
9.2.3. Влияние давления горючей смеси на КПР
При давлениях выше атмосферного НКПР практически не меняется.
Изменение ВКПР зависит от вида горючего. Так, у водорода он остается постоянным вплоть до 127⋅105 Па (127 атм), а у метана возрастает в три с лишним раза. При разрежении область воспламенения сужается и при определенном давлении, для каждого горючего своем, сливаются. При еще более
176
низких давлениях смесь становится негорючей (рис.9.3).
φ,%
φ,в
Р, Па
Область
воспламенения
20
15
10
5
φ,н
1
0
300
400
500
600
φ,% об
Т,К
Рис.9.2. Зависимость КПР метано-воздушной смеси от
начальной температуры
Рис.9.3. Влияние давления на
область воспламенения
метана
9.2.4. Влияние флегматизаторов и ингибиторов на КПР
При введении инертных газов в газопаровоздушную смесь область
воспламенения сужается, причем в основном за счет уменьшения ВКПР.
Нижний предел возрастает незначительно. Графически зависимость КПР =
f(ϕ ф ) имеет вид треугольника и часто носит название "полуострова флегматизации". На рис.9.4 показан "полуостров флегматизации" метана различными
газами. Точка Ф, находящаяся на мысе "полуострова", в которой КПР сливаются,
называется минимальной флегматизирующей концентрацией. Это
важнейшая характеристика инертных (нейтральных) газов, применяемых для
предотвращения и тушения пожаров.
Минимальная флегматизирующая концентрация флегматизатора
- это наименьшая концентрация флегматизатора, добавляемая в смесь
горючего с окислителем, при которой смесь становится неспособной к
распространению пламени при любом соотношении горючего и окислителя.
177
Применяется этот показатель при расчетах взрывоопасных составов
газо-, паро- и пылевоздушных смесей в технологических и других процессах.
Флегматизирующая способность зависит от ряда теплофизических
свойств флегматизаторов: теплоемкости, теплопроводности.
Ингибиторы горения, например, хладоны, по своей огнетушащей способности в десятки раз превосходят инертные газы. "Полуостров флегматизации" у хладонов почти незаметен на графике, поскольку их минимальная
флегматизирующая концентрация не превышает 2,5 % об.
φ,%
15
хладоны
СО2
N2
Ar
10
Ф
5
10
20
30
40
50
φф,%
Рис.9.4. Изменение КПР метана в зависимости от количества и
вида инертных газов
В практических расчетах для организации эффективной противопожарной защиты часто требуется знать геометрические размеры взрывоопасной зоны.
178
Метод расчета размеров зон, ограниченных НКПР газов и паров,
при аварийном поступлении горючих газов и паров ненагретых
легковоспламеняющихся жидкостей в помещение
Расстояния Х НКПР , Y НКПР и Z НКПР для ГГ и ЛВЖ, ограничивающие область концентраций, превышающих НКПР, рассчитывают по формулам
0,5
Х НКПР
δ ⋅ C0
,
= K1 ⋅ l ⋅ K 2 ⋅ ln
C НКПР
Y НКПР
δ ⋅ C0
,
= K1 ⋅ b ⋅ K 2 ⋅ ln
C НКПР
Z НКПР
δ ⋅ C0
,
= K 3 ⋅ h ⋅ K 2 ⋅ ln
C НКПР
(9.8)
0,5
(9.9)
0,5
(9.10)
где
К 1 – коэффициент, принимаемый равным
1,1314 для горючих газов и
1,1958 для легковоспламеняющихся жидкостей;
К 2 – коэффициент, равный
1 для ГГ и
Т/3600 для ЛВЖ;
Т – продолжительность поступления паров ЛВЖ, с;
К 3 – коэффициент, принимаемый равным
0,0253 для ГГ при отсутствии подвижности воздушной среды,
0,02828 для ГГ при подвижности воздушной среды,
0,04714 для ЛВЖ при отсутствии подвижности воздушной среды,
0,3536 для ЛВЖ при подвижности воздушной среды;
l – длина помещения , м;
b – ширина помещения, м;
h – высота помещения, м;
δ – допустимые отклонения концентраций при задаваемом уровне
значимости. При уровне значимости Q = 0,05 значения δ будут равны
1,27 для ЛВЖ при работающей вентиляции,
1,25 для ЛВЖ при неработающей вентиляции,
1,37 для ГГ при работающей вентиляции,
1,38 для ГГ при неработающей вентиляции;
С 0 – предэкспоненциальный множитель, % (объемн.), равный:
m
для ГГ при отсутствии подвижности воздушной среды,
ρ г ⋅ Vсв
m
С 0 = 3 ⋅10 2 ⋅
для ГГ при подвижности воздушной среды,
ρ г ⋅ Vсв ⋅ U
С 0 = 3,77 ⋅103 ⋅
U – подвижность воздушной среды, м/с;
179
m ⋅100
С 0 = C H
C H ⋅ ρ п ⋅ Vсв
0 , 41
m ⋅100
С 0 = C H
C H ⋅ ρ п ⋅ Vсв
0 , 46
для ЛВЖ при отсутствии подвижности воздушной среды,
для ЛВЖ при подвижности воздушной среды;
С Н – концентрация насыщенных паров при расчетной температуре, кПа.
С Н может быть рассчитана по формуле:
СН =
100 ⋅ pH
, где
p0
Р Н – давление насыщенных паров при расчетной температуре, кПа;
Р 0 – атмосферной давление, равное 101, 3 кПа;
ρ п – плотность паров, кг/м3.
Плотность паров ρ п рассчитывается по формуле:
ρ п = М/V м , кг/м3.
При отрицательных значениях логарифмов расстояния Х НКПР , Y НКПР и
Z НКПР принимают равным 0.
Во всех случаях значения расстояний Х НКПР , Y НКПР и Z НКПР должны
быть не менее 0,3 м для ГГ и ЛВЖ.
Расчет размеров зон,
ограниченных НКПР
газов и паров
Пример 9.5. Определить размеры зоны, ограниченной
НКПР паров, образующейся при аварийной разгерметизации аппарата с ацетоном при работающей и неработающей
вентиляции.
Данные для расчета:
В центре помещения размером 40×40×3 м установлен аппарат с ацетоном. Масса
ацетона в аппарате 25 кг. Расчетная температура в помещении 300С, давление нормальное.
НКПР ацетона составляет 2,7 % (об). В результате разгерметизации в помещение поступило 25 кг паров ацетона за время испарения 208 с. При работающей общеобменной вентиляции подвижность воздушной среды в помещении υ = 0,1 м/с.
Решение:
1. Расчет молярного объема паров при заданных условиях.
1 ⋅ 22,4 303
VМ =
= 24,9 м3/кмоль.
⋅
273
1
2. Расчет плотности паров при заданных условиях.
М(СН 3 СОСН 3 ) = 58 кг/кмоль
ρ п = М/V м = 58/24,9 = 2,33 кг/м3.
3. Расчет свободного объема помещения.
V св = 40⋅40⋅3⋅0,8 = 3840 м3.
4. Расчет давления насыщенного пара ацетона при 300С по уравнению Антуана.
180
Уравнение Антуана: lg р = 6,37551 – 1281,721/(237,088 + t)
( 6 , 37551−
РН =
10
1281, 721
)
237 , 088 + 30
= 37,73 кПа.
5. Расчет концентрации насыщенных паров С Н .
С Н = 100⋅37,73/101,3 = 37,36 %.
6. Расчет предэкспоненциального множителя С 0 при работающей вентиляции.
25 ⋅100
С 0 = 37,36
3736 ⋅ 2,33 ⋅ 3840
0 , 46
= 3,93 %
7. Расчет предэкспоненциального множителя С 0 при неработающей вентиляции.
0 , 41
25 ⋅100
С 0 = 37,36
= 5,02 %
3736 ⋅ 2,33 ⋅ 3840
8. Расстояния Х НКПР , Y НКПР и Z НКПР при работающей вентиляции составят
0,5
Х НКПР
1,27 ⋅ 3,93
208
= 1,1958 ⋅ 40 ⋅
⋅ ln
= 9,01 м
2,7
3600
Y НКПР
1,27 ⋅ 3,93
208
= 1,1958 ⋅ 40 ⋅
⋅ ln
= 9,01 м
2,7
3600
0,5
0,5
1,27 ⋅ 3,93
208
Z НКПР = 0,3536 ⋅ 3 ⋅
⋅ ln
= 0,2 м.
2,7
3600
9. Расстояния Х НКПР , Y НКПР и Z НКПР при неработающей вентиляции составят
1,25 ⋅ 5,02
208
Х НКПР = 1,1958 ⋅ 40 ⋅
⋅ ln
2,7
3600
Y НКПР
0,5
1,25 ⋅ 5,02
208
= 1,1958 ⋅ 40 ⋅
⋅ ln
2,7
3600
= 10,56 м
0,5
= 10,56 м
0,5
1,25 ⋅ 5,02
208
Z НКПР = 0,04714 ⋅ 3 ⋅
⋅ ln
= 0,03 м.
2,7
3600
За начало отсчета принимают внешние габаритные размеры аппарата.
Расчет безопасных
концентрации газов и
паров с использованием
коэффициентов
безопасности
Пример 9.5. Газоанализатор показал наличие 0,3 % паров амилацетата СН 3 СООС 5 Н 11 . Можно ли проводить
сварочные работы?
Значения НКПР И ВКПР следует применять при расчетах безопасных концентраций газов и паров с использованием коэффициентов безопасности:
ϕ г.без. ≤
ϕ г.без.
ϕн
, где
(9.11)
Кб
– безопасная концентрация горючих газов, паров или пылей, % объемных;
181
ϕ н – НКПР, % объемных;
К б – коэффициент безопасности.
1. При расчете взрывобезопасных концентраций газов, паров и пылей внутри технического оборудования, трубопроводов, вентиляционных систем.
К б = 2.
2. При расчете предельно-допустимых взрывобезопасных концентраций газов,
парво, пылей в воздухе рабочей зоны с потенциальными источниками зажигания
К б = 20.
Решение:
1. Составляем уравнение реакции горения амилацетата.
СН 3 СООС 5 Н 11 + 9,5( О 2 + 3,76 N 2 ) =7СО 2 + 7Н 2 О + 9,5· 3,76 N 2
β = 9,5
100
2. ϕ н = НКПР =
= 1,14 %
8,684 ⋅ 9,5 + 4,679
3. Рассчитаем безопасную концентрацию:
1,14
ϕ г.без. =
= 0,05 %
20
0,3 > 0,05, следовательно, проводить сварочные работы нельзя.
Задания для самоконтроля
1. Как связаны нормальная и видимая скорости распространения пламени?
2. Укажите значение α в области безопасных концентраций.
3. Как влияет отвод тепла на скорость распространения пламени?
4. Как называется область концентраций горючего вещества выше ВКПР? Почему
она так называется?
5. Зависит ли U н от скорости химической реакции? Поясните.
6. Изобразите графически изменение температуры в кинетическом пламени.
7. Влияют ли инертные примеси на U н ? Поясните.
8. КПР вещества составляет 2-20 %. Какова пожаробезопасная область для этого
вещества при проведении сварочных работ?
9. Как влияет на КПР начальная температура смеси?
10. В какой области концентраций горючего находится стехиометрическая концентрация?
11. В каком случае возникает стационарное пламя?
12. Сущность закона косинусов.
13. Что означает и чему равно критическое значение U h ?
14. КПР этилена 3-32 %, а КПР пропана 2-9,5 %. Сравните пожарную опасность этих
веществ.
15. Как зависит КПР от концентрации флегматизаторов и ингибиторов?
16. Сколько зон можно выделить во фронте пламени?
17. Что называется нормальной скоростью распространения пламени?
18. Как связаны массовая и нормальная скорости распространения пламени?
19. Являются ли КПР конкретного вещества постоянной величиной? Почему?
20. Что называется фронтом пламени?
21. Как зависит U н от состава горючей смеси?
182
22. При какой концентрации горючего скорость распространения пламени максимальна?
23. Какие процессы происходят в зоне подготовки горючей смеси к горению?
24. В каком случае газовоздушную смесь можно считать горючей, трудногорючей и
негорючей?
25. В емкости объемом 800 мл образовалась стехиометрическая концентрация метанола. Сколько мл спирта (ρ = 0,792 г/мл) испарилось в этой емкости?
ГЛАВА 10. ГОРЕНИЕ ЖИДКОСТЕЙ
В огромных количествах горючие жидкости добываются, транспортируются, хранятся, перерабатываются и используются в народном хозяйстве
страны. Основным их источником являются нефть и газовый конденсат,
объем добычи, которых сейчас у нас в стране составляет более 300 млн. т.
Такое количество нефти и конденсата транспортируется, хранится, перерабатывается и потребляется во многих отраслях народного хозяйства - в
нефтеперерабатывающей, нефтехимической, химической промышленности и
других, на всех видах транспорта и в быту.
Характерной особенностью практически всех горючих жидкостей является способность их к испарению при любых условиях. Над поверхностью горючих жидкостей всегда находятся их пары, которые, смешиваясь с
воздухом, могут образовать взрывоопасные смеси. Такое состояние жидкостей приводит к тому, что пожарная их опасность представляет опасность
двоякого рода: в одном случае происходит только вспышка паров, а в другом - вспышка паров и возникновение устойчивого горения самой жидкости.
10.1. Условия для возникновения горения жидкостей
Реакция горения жидкости начинается и протекает сложнее, чем у газов. Представим себе, что жидкость налита в открытый сосуд (рис.10.1).
Жидкости непрерывно испаряются даже при низких температурах. Поэтому
над зеркалом жидкости всегда присутствует парообразная смесь с воздухом
за счет того, что часть молекул на поверхности, которые имеют большую
183
кинетическую энергию,
покидают жидкость и смешиваются с воздухом.
При этом поверхность жидкости охлаждается. За счет теплового движения
молекулы постепенно распространяются за пределы открытого сосуда.
Плотность пара жидкостей по воздуху больше единицы, т.е. пар тяжелее
воздуха. Он оседает вниз, скапливаясь на поверхности земли, пола и т.п. В
результате длительного испарения могут образовываться взрывоопасные паровоздушные облака очень большой протяженности - до нескольких десятков и даже сотен метров.
Рис.10.1. Схема испарения жидкости из открытого сосуда
Рис.10.2. Схема парообразования
в закрытом сосуде
Пар по своим свойствам во многом аналогичен газу, поэтому его пожарная опасность характеризуется всеми показателями пожарной опасности
газов. Концентрация пара по высоте над зеркалом жидкости в открытом сосуде монотонно уменьшается от ϕ нас . до 0. На характер зависимости не оказывает влияние температура и вид жидкости.
Иначе ведут себя жидкости в закрытом сосуде (рис. 10.2). В этом
случае пары уже не могут рассеиваться в окружающую среду. По мере испарения концентрация пара за время τ 0 до τ испар. в свободном пространстве сосуда повышается и в итоге достигает состояния насыщения. Устанавливается
динамическое равновесие, за время при котором количество испаряющихся
184
молекул жидкости равно количеству молекул пара конденсирующихся обратно в жидкость. Такой пар называют насыщенным, а его парциальное давление - давлением насыщенного пара Р s Как правило, давление насыщенного пара обозначается Р s . Концентрация насыщенного пара во всем закрытом
объеме одинакова.
Н
Н
τ4
б
а
τs
τ3
τ2
τ2
τ1
τ1
φ, % об
НКПР
ВКПР
τn
φ, % об
НКПР
ВКПР
Рис. 10.3 Изменение концентрации паров от высоты над уровнем жидкости и времени.
а - открытая емкость;
б - закрытая емкость;
τ- время, τn>τ
Давление насыщенного пара горючих жидкостей часто используется в
пожарно-технических расчетах.
Зависимость давления насыщенного пара от температуры описывается
уравнением Клапейрона - Клаузиуса:
в дифференциальной форме:
dlnP/dT = Q исп /(RT2),
(10.1)
или в интегральной форме:
P s = P 0 exp(-Q исп /(RT 0 ),
где Р s - давление насыщенного пара;
(10.2)
185
Q исп - мольная теплота испарения жидкости.
Помимо уравнения Клапейрона - Клаузиуса давление насыщенных паров может быть рассчитано по эмпирическому уравнению Антуана:
lgP s = А - В/(t + C),
(10.3)
Уравнение Антуана для большого числа горючих жидкостей приведено в
справочной литературе.
Пример 10.1. Определить давление насыщенного пара толуола С 6 Н 5 СН 3 при температуре
200С по уравнению Антуана.
Расчет давления
насыщенного пара по
уравнению Антуана
Решение:
В пожарных расчетах наиболее распространенным способом определения давления
насыщенного пара при заданной температуре является расчет по уравнению Антуана:
B
lg P = А −
C + tP
;
Рs
= 10
( А−
B
)
C +t P
,
где
Р s - давление насыщенного пара, кПа;
t Р - рабочая (заданная) температура, 0С;
А, В, С - константы уравнения Антуана из справочной литературы [17].
( таблица 5 приложения).
Для нашей задачи:
t Р = 200С;
А = 6,0507; В = 1328,17; С = 217,713.
Р = 10
( 6, 0507 −
1328,17
)
217, 713+ 20
= 2,9
кПа.
Зная давление насыщенного пара, можно рассчитать его концентрацию
в паро-воздушной смеси и установить пожарную опасность смеси насыщенного пара с воздухом.
Расчет объемной
концентрации паров по
давлению насыщенного
пара
Пример 10.2. Резервуар заполнен бензолом С 6 Н 6 . Вычислить объемную и массовую концентрацию паров бензола в свободном пространстве резервуара. Температура
100С, давление 780 мм рт.ст.
Решение:
Зная величину давления насыщенного пара в емкости, можно определить объемную концентрацию паров жидкости при данных условиях. Величина давления насы-
186
щенного пара не зависит от объема жидкости в резервуаре.
Объемная концентрация паров (газов) в замкнутом объеме рассчитывается через
давление насыщенного пара по формуле:
ϕ ОБ =
где
Ps
⋅ 100 , % ,
PАТМ
ϕ ОБ - объемная концентрация газа или пара, %;
Р S - давление насыщенного пара при данной температуре, мм рт.ст., кПа,
МПа, атм; Р s рассчитывают по уравнению Антуана или определяют по
номограмме.
Р АТМ - внешнее давление, мм рт.ст., кПа, МПа, атм.
При температуре 100С для бензола Р
40
ϕ ОБ =
⋅ 100 = 5,1 %
780
ПАР
= 40 мм рт.ст.( по номограмме). Тогда
Определяем массовую концентрацию паров бензола.
Для этого воспользуемся формулой для определения массовой концентрации паров
Ps
М
⋅
ϕ МАС =
PАТМ VМ
где
ϕ МАС - массовая концентрация, кг(г)/м3;
Р s - давление насыщенного пара, мм рт.ст., кПа, МПА, атм;
Р АТМ - внешнее давление, мм рт.ст., кПа, МПа, атм;
М - молярная масса вещества, г/моль, кг/кмоль,
V М - молярный объем газа или пара, л/моль, м3/кмоль.
Для нашей задачи:
М ( С 6 Н 6 ) = 78 кг/кмоль;
V М необходимо рассчитать.
VМ =
760 ⋅ 22,4 283
⋅
= 22,6 м3/кмоль.
273
780
Рассчитаем массовую концентрацию паров бензола.
40 78
⋅
= 0,177 кг/м3 = 177 г/м3.
780 22,6
Зная концентрационные пределы распространения пламени вещества и объемную
концентрацию его паров, можно оценить взрывоопасность паров при заданной температуре. Так КПР бензола составляет от 1,4 до 7,1 % (объемных). Сравним этот интервал с полученной объемной концентрацией паров бензола при заданных условиях – 5,1 %. Можно
сделать вывод, что данная концентрация паров бензола взрывоопасна.
ϕ МАС =
187
Пример 10.3. В герметичной емкости объемом 30 м3, заВычисление объемной доли
полненной на 1/3, давление паров ацетона при температуре
и объема пара в
300С составляет 190 мм рт.ст. Определить концентрацию
паровоздушной смеси
паров ацетона в % и объем его паров в м3 в свободном пространстве емкости.
Решение:
1. Объемная концентрация паров в замкнутом объеме рассчитывается через давление насыщенного пара по формуле:
ϕ ОБ =
Ps
⋅ 100 , % ,
PАТМ
(смотри предыдущую задачу).
В условии данной задачи величина атмосферного давления не указана, поэтому
принимаем его равным нормальному атмосферному давлению.
Определим объемную концентрацию паров ацетона:
190
ϕ ОБ =
⋅ 100 = 25 %
760
2. По условию задачи в емкости жидкий ацетон занимает 1/3 всего объема. Следовательно, газообразная фаза, в которую входят пары ацетона и воздух, составляет 2/3 объема емкости или
30 ⋅ (2/3) = 20 м3.
25 % этого объема составляют пары ацетона. Определим объем паров ацетона в м3:
20 ⋅ 0,25 = 5 м3
9.2. Температурные пределы распространения пламени
Выражения (10.1) и (10.2) показывают, что парциальное давление
насыщенного пара пропорционально температуре жидкости. Графически эта
зависимость в общем, виде представлена на рис.10.4 (здесь численные значения Р s пересчитаны на концентрацию пара). На приведенном графике видно, что НКПР и ВКПР пара достигаются при значениях температур: Т н и
Т в . Эти температуры называются температурными пределами распространения пламени жидкости, обозначаются ТПР.
Нижним (НТПР) или верхним (ВТПР) температурным пределом
распространения пламени называется температура жидкости, при которой
концентрация паров над ее поверхностью равна соответствующему концентрационному пределу.
Температурные пределы распространения пламени могут быть определены как экспериментальным, так и расчетным путем.
188
φнас,%
φв
φн
Тн
Тв
Т
Рис.10.4. Зависимость концентрации паров
от температуры жидкости
Температурные пределы Т н и Т в связаны с КПР пламени зависимостью:
t пр =
B
− Ca ,
A − lg(0,01 ϕпр p0)
(10.4)
где ϕ пр - нижний или верхний КПР, %;
Р 0 - атмосферное давление, кПа;
А, В, С а - константы уравнения Антуана для давления насыщенных
паров.
Расчет ТПР по данным
уравнения Антуана
Решение:
Расчет НТПР:
Пример 10.4. Вычислить температурные пределы распространения пламени 2-метилнонана, если известны следующие данные: НКПР 0,71 %; ВКПР 5,4 %; уравнение Антуана lg р = 6,12003 – 1521,3/(202,75 + t); Р 0 = 101,3 кПа.
189
tн =
1521,3
101,3
6,12003 − lg(0,71 ⋅
)
100
− 202,75 = 40,10С
Расчет ВТПР:
tв =
1521,3
101,3
6,12003 − lg(5,4 ⋅
)
100
− 202,75 = 79,90С.
По справочным данным НТПР 2-метилнонана составляет 430С.
Если неизвестна зависимость давления насыщенного пара от температуры, то для веществ, состоящих из атомов С, Н, О, N значение нижнего или
верхнего температурного предела (t п ) вычисляют по формуле
n
t п = а 0 + а 1 t кип + ∑ a j l j
(10.5.)
j= 2
где а 0 — размерный коэффициент, равный минус 62,46°С для нижнего и минус 41,43°С для верхнего пределов;
а 1 — безразмерный коэффициент, равный 0,655 для нижнего и 0,723 для
верхнего пределов;
a j — эмпирические коэффициенты, характеризующие вклад j-х структурных групп, приведены в табл. 10.1.
Вид
Вид
a j , °C
струкструкtн
tв
турной
турной
группы
группы
С—С —0,909 —1,158 C—N
С=С
—2,66 —4,64 N—H
С—Н —0,009 0,570
О—Н
С—О
0,110 1,267
С=O
5,57
a j , °C
tн
Таблица 10.1.
tв
—2,14 0,096
6,53
6,152
19,75 17,80
—4,40 —4,60
5,86
Среднее квадратичное отклонение расчета составляет 9 °С.
190
Расчет ТПР по
структурной формуле
вещества
Пример 10.5. Рассчитать температурные пределы распространения пламени этиламина С 2 Н 5 NH 2 .
Решение:
Н
Н
Н
Н С С N Н
Н
Н
Данные для расчета:
t кип = 16,60C
Число связей:
С–С
С–Н
С–N
N–Н
1
5
1
2
Для расчета воспользуемся формулой 10.5 и данными таблицы 10.1.
Расчет НТПР:
t н = − 62,46 + 0,655⋅16,6 + 1⋅(−0,909) + 5⋅(– 0,009) +1⋅(– 2,14) + 2⋅(6,53) = – 41,60С.
Расчет ВТПР:
t в = − 41,43 + 0,723⋅16,6 + 1⋅(−1,158) + 5⋅(0,570) +1⋅(0,0967) + 2⋅(6,152) = – 15,30С.
По справочным данным НТПР этиламина составляет – 390С, ВТПР этиламина составляет – 220С.
Температурные пределы распространения пламени применяются при
расчете пожаровзрывобезопасных температурных режимов работы технологического оборудования, при оценке аварийных ситуаций, связанных с
разливом жидкостей и для расчетов КПР пламени.
10.3. Скорость испарения жидкости
Интенсивность испарения W ИСП жидкости с открытой поверхности может быть определена расчетным путем по следующей формуле
где
WИСП = 10-6⋅ η ⋅ М ⋅ P S , кг/м2⋅с,
M - молярная масса, кг/кмоль;
(10.6.)
191
P S - давление насыщенного пара жидкости при рабочей температуре t РАБ ,
определяемое по номограмме или расчетным способом по уравнению Антуана [3], кПа;
Приведенную формулу допускается использовать для не нагретых выше
температуры окружающей среды ЛВЖ при отсутствии справочных и экспериментальных данных.
η - коэффициент, принимаемый по таблице 10.2, приведенной ниже, в зависимости от скорости и температуры воздушного потока над поверхностью
испарения
Таблица 10.2.
Скорость воздушного потока
в помещении, м⋅ с-1
Значение коэффициента η при температуре t, ° С, воздуха в помещении
10
15
20
30
35
0
1,0
1,0
1,0
1,0
1,0
0,1
3,0
2,6
2,4
1,8
1,6
0,2
4,6
3,8
3,5
2,4
2,3
0,5
6,6
5,7
5,4
3,6
3,2
1,0
10,0
8,7
7,7
5,6
4,6
ле:
Масса испарившейся жидкости рассчитывается по следующей формуm ИСПАР. ЖИДК. = S ИСП ⋅ W ИСП ⋅ τИСП ,
где
S ИСП - площадь испарения жидкости, м2;
τ ИСП - время испарения, с;
WИСП - интенсивность испарения, кг/м2⋅с.
(10.7)
Площадь испарения жидкости S ИСП определяется исходя из следующего расчета:
1 литр смесей и растворов,
содержащих 70 % и менее
(по массе) растворителей разливается на площади 0,5 м2.,
соответственно 1 м3 разливается на площади 500 м2.
1 литр остальных жидкостей разливается на площади 1,0 м2,
соответственно 1 м3 разливается на площади 1000 м2.
192
Расчет скорости
испарения и массы
испарившейся жидкости
Пример 10.6. Какая масса жидкости испарится за 0,5 часа при разливе 20 л этанола, если температура воздуха
18 0С, скорость движения воздуха в помещении w = 0,2 м/с.
Решение:
1. Константы уравнения Антуана для этанола составляют
А = 7,81158; В = 1918,508; С = 252,125.
2. Давление насыщенного пара этанола определяем по уравнению Антуана.
t Ж = 18 0С.
1918, 508
7 ,81158 −
252 ,125 +18
Р S = 10
= 3,3 кПа.
3. Рассчитаем интенсивность испарения WИСП .:
При ωВОЗД равныо 0,2 м/с значение коэффициента η = 3,5.
Молярная масса этанола С 2 Н 5 ОН М = 46 кг/кмоль.
Интенсивность испарения будет равна
W ИСП = 10-6 ⋅ 3,5 ⋅ 46 ⋅ 3,3 = 78,3 ⋅ 10-6 кг/м2⋅с.
4. Масса жидкости, испарившейся с поверхности разлива m ИСП РАЗЛ .
Время испарения 1800 с.
Площадь испарения 20 м2.
m ИСП . ЖИДК = 78,3 ⋅ 10-6 ⋅ 1800 ⋅ 20 = 2,8 кг.
10.4. Температура вспышки. Температура воспламенения жидкости
При нагревании жидкости можно подобрать такую температуру, при
которой над ее поверхностью концентрация паров станет равной НКПР, т.е.
паро-воздушная смесь становится способной к воспламенению от постороннего источника зажигания. Эксперименты показывают, что при этой температуре сгорают только пары, а жидкость не загорается. Поэтому ее называют
температурой вспышки.
Температура вспышки - это наименьшая температура конденсированного вещества, при которой в условиях специальных испытаний над его
поверхностью образуются пары и газы, способные вспыхивать от источника
зажигания; устойчивое горение при этом не возникает.
При дальнейшем нагревании жидкости можно достичь такой температуры, при которой скорость испарения будет уже достаточной для возникновения самоподдерживающегося процесса горения жидкости после удаления источника зажигания. Такая температура называется температурой вос-
193
пламенения.
Температура воспламенения - это наименьшая температура вещества, при которой в условиях специальных испытаний вещество выделяет горючие газы и пары с такой скоростью, что при воздействии источника зажигания наблюдается воспламенение жидкости.
Температура воспламенения обычно на 1-30 °С выше температуры
вспышки.
Температура вспышки
является важнейшим показателем пожарной
опасности жидкостей. Применяется при классификации жидкостей по степени пожарной опасности, при категорировании помещений и зданий по
взрывной, взрывопожарной и пожарной опасности, а также при определении классов взрывоопасных и пожароопасных зон.
Жидкости с температурой вспышки до 61°С относятся к легковоспламеняющимся (ЛВЖ), а выше 61 °С - к горючим (ГЖ).
Температура вспышки и температура воспламенения могут быть определены как экспериментально, так и расчетными методами.
Температуру вспышки жидкостей (t всп ) в закрытом тигле в °С , имеющих нижеперечисленные виды связей (табл. 9.3), вычисляют по формуле:
n
t всп = а 0 + а1 ⋅ t кип + ∑ a j ⋅ l j , оС
j =2
(10.8)
где а 0 - размерный коэффициент, равный минус 73,14 °С;
а 1 -. безразмерный коэффициент, равный 0,659;
t кип - температура кипения исследуемой жидкости, °С;
а j - эмпирические коэффициенты, приведённые в табл. 10.3. в зависимости от связей в структурной формуле вещества;
l j - количество связей вида j в молекуле исследуемой жидкости.
Средняя квадратичная погрешность расчета по этой формуле составляет 13°С.
194
Таблица 10.3.
Вид связи
С—С
С − С
C=C
С—Н
С—О
С=О
C—N
CS≡N
C—S
C=S
C—F
Расчет температуры
вспышки по структурной
формуле
a j , °С
—2,03
—0,28
1,72
1,105
2,47
11,66
14,15
12,13
2,09
—11,91
3,33
Вид связи
С—С1
C—Br
С—Si
Si—H
Si—Cl
N—H
O—H
S—H
P—O
P=O
a j , °С
15,11
19,40
—4,84
11,00
10,07
5,83
23,90
5,64
3,27
9,64
Пример 10.7. Вычислить температуру вспышки
2-метилпропанола-1 (изобутилового спирта).
Решение:
Структурная формула 2-метилпропанола-1 выглядит следующим образом:
Н
Н
НС С
Н Н– С –Н
Н
Н
С О Н
Н
Данные для расчета:
t кип = 107,80C
Число связей:
С–С
3
С–Н
9
С–О
1
О–Н
1
Используя данные таблицы 9.3, по формуле 10.8:
t всп = −73,14 + 0,659 ⋅ 107,8 + 3 ⋅ (−2,03) + 9 ⋅ 1,105 + 2,47 + 23,90 = 28,10С.
280С.
По справочным данным температура вспышки 2-метилпропанола-1 составляет
Для перечисленных в табл.10.4 классов веществ температуру вспышки
в °С вычисляют по формуле:
t всп = а + b·t кип ,
(10.9)
где а, b — эмпирические коэффициенты, приведенные в табл. 10.4.
195
Класс веществ
Алканы
Спирты
Алкиланилины
Карбоновые кислоты
Алкилфенолы
Ароматические углеводороды
Альдегиды
Бромалканы
Кетоны
Хлоралканы
Расчет температуры
вспышки некоторых
классов органических
веществ
Таблица 10.4.
Коэффициенты
а, С
b
δ, С
—73,22
0,693
1,5
—41,69
0,652
1,4
—21,94
0,533
2,0
—43,57
0,708
2,2
—38,42
0,623
1,4
—67,83
0,665
3,0
—74,76
0,813
1,5
—49,56
0,665
2,2
—52,69
0,643
1,9
—55,70
0,631
1,7
Пример 10.8. Вычислить температуру вспышки
пара-ксилола (1,4-диметилбензола).
Решение:
Структурная формула 1,4-диметилбензола выглядит следующим образом:
Н
Вещество относится к классу ароматических углеводородов.
Н−С−Н
Данные для расчета:
С
t кип = 138,30C
// \
H−С
С−H
Расчет: используя данные таблицы 9.4.
H−С
С−H
t всп = −67,83 + 0,665⋅138,3 = 24,10С
\\ /
С
По справочным данным температура
вспышки п-ксилола составляет 260С.
Н−С−Н
Н
Температура воспламенения жидкости рассчитывается по той же фор-
муле что и температура вспышки, но со своими коэффициентами:
n
t.воспл = а0 + а1 ⋅ tкип + ∑ a j ⋅ l j , оС,
j =2
где
(10.10)
196
а 0 = - 47,78 °С;
а 1 = 0,882;
t кип - температура кипения жидкости, °С;
а j - коэффициент j-той химической связи, приведены в табл. 10.5
l j - число химических связей вида j в молекуле жидкоcти
Вид связи
С—С
С − С
С=С
С—Н
С—О
a j , °С
0,027
— 2,069
— 8,980
— 2,118
— 0,111
Вид связи
С=О
C—N
O—Н
N—Н
Таблица 10.5.
a j , °С
—0,826
—5,876
8,216
—0,261
Средняя квадратичная погрешность расчета составляет 5 °С.
Расчет температуры
воспламенения по
структурной формуле
Пример 10.9. Вычислить температуру воспламенения
гептена-3.
Решение:
Н Н Н Н Н Н Н
Н С С С == С С С С Н
Н Н
Н Н Н
Данные для расчета:
t кип = 960C
Число связей:
С–С
С–Н
С=С
5
14
1
Используя данные таблицы 9.5,
t воспл = −47,78 + 0,882 ⋅ 96 + 5 ⋅ 0,027 – 8,980 – 14 ⋅ 2,118 = 1,60С.
По справочным данным температура вспышки гептена-3 составляет −30С.
Температуру воспламенения алифатических спиртов и сложных эфиров вычисляют по формуле
t восп =
t кип + 273
− 273
1 + К ( t кип + 273)
(10.11)
197
где К — эмпирический коэффициент, равный 6·10-4 для спиртов и 7·10-4 для
сложных эфиров.
Средняя квадратичная погрешность расчета составляет 2 °С для спиртов и 4°С — для сложных эфиров.
Расчет температуры
воспламенения спиртов и
сложных эфиров
Пример 10.10. Рассчитать температуру воспламенения
изопропилформиата (изопропилового эфира муравьиной
кислоты).
Решение:
Н Н Н
Н С С С Н
Н О Н
С ==О
Н
Данные для расчета:
t кип = 68,20C
t воспл =
68,2 + 273
− 273 = 2,40 С
−4
1 + 7 ⋅10 (68,2 + 273)
По справочным данным температура воспламенения
изопропилформиата составляет −20С.
10.5. Механизм теплового распространения горения жидкостей
Условия возникновения и характер распространения горения жидкости
во многом определяется свойствами самой жидкости, здесь следует различать жидкости с низкими температурами вспышки от жидкостей с высокими
температурами вспышки.
Жидкости с низкими температурами вспышки, содержащие летучие
компоненты, представляют пожарную опасность уже при обычных температурах, независимо от того, где они находятся: в закрытых объемах или в
открытых емкостях. Над поверхностью летучего нефтепродукта всегда находится пар, который на определенном расстоянии от зеркала образует однородные паровоздушные смеси по всей площади жидкости. Первоначально
198
возникает кинетическое горение подготовленной смеси, которое переходит в
диффузионное. Распространение пламени осуществляется по гомогенной
смеси и ничем не отличается от горения газовоздушной смеси. После того,
как подготовленная смесь сгорела, и если интенсивность испарения достаточна для поддержания горения, возникает диффузионное пламя.
На рис.10.5. представлена схема образования горючей зоны и формы
фронта пламени по поверхности жидкости с низкой температурой вспышки.
При нагреве жидкости до температуры воспламенения над ее поверхностью создается зона концентрации паров близкая или равная НКПР. В
этой зоне пламя уже может распространяться, но скорость распространения
пламени минимальная.
При повышении температуры от Т 1 до Т 2 растет концентрация паров
над жидкостью и увеличивается зона области распространения пламени. При
температуре Т 2 концентрация паров в горючей смеси может быть равной
стехиометрической. Тогда скорость распространения пламени (U) будет
иметь максимальное значение (рис 10.5.б). Дальнейшее повышение температуры до Т 3 увеличивает зону распространения пламени, однако скорость распространения пламени по поверхности жидкости остается примерно постоянной. Пламя распространяется над всей поверхностью жидкости. Однородная смесь быстро сгорает, и пламя переходит из кинетического режима горения в диффузионный.
199
а
б
U=Umin
в
U=Umax
U=Umax
бедная горючая
смесь (α<1)
бедная горючая
смесь (α<1)
Горючая
жидкость
Т1
(α=1)
F
F
F
бедная горючая
смесь (α<1)
стехиометрическая
горючая смесь (α=1)
Горючая
жидкость
богатая горючая
смесь (α>1)
Т2
Рис. 10.5. Схема образования горючей зоны и фронта пламени по поверхности жидкости с низкой температурой вспышки.
а- движение пламени по жидкости с температурой Т1
б- движение пламени по жидкости с температурой Т2
в- движение пламени по жидкости с температурой Т3
Т3>Т2>Т1
Для жидкостей с температурой вспышки ниже температуры окружающей среды горючая среда образуется без дополнительного подогрева. Скорость распространения пламени по таким жидкостям практически не зависит
от температуры и равна скорости распространения пламени в гомогенной паровоздушной смеси.
Жидкости с высокой температурой вспышки можно поджечь и, не
подогревая всю её, а ограничится подогреванием лишь незначительной части ее поверхности. Часто пожары имеют именно такой характер развития.
Горючая среда над поверхностью таких жидкостей отсутствует, а возникает
она постепенно, вследствие подогрева топлива непосредственно перед движущимся фронтом пламени. Первоначальный фронт пламени создается в результате локального теплового воздействия. Распространение пламени до
полного охвата зеркала занимает некоторое время, которое требуется для
нагрева поверхности до температуры вспышки, дальнейшего прогрева до
температуры воспламенения и времени продвижения фронта по всей жидкости.
200
На рис.10.6. представлена схема распространения пламени по жидкости
с высокой температурой вспышки.
7
6
5
q
Un пламени
4
3
2
1
1-Горючая жидкость; 2- Зона прогрева до температуры вспышки; 3- Зона прогрева до температуры воспламенения; 4 - Пульсирующее пламя; 5- Основной
фронт пламени; 6- Неустойчивое пламя; 7- Устойчивое пламя
Из приведенной схемы видно, что при локальном тепловом воздействии на жидкость возникает локальное горение с фронтом пламени (5). Основному пламени предшествует небольшое пульсирующее пламя (3). Передовой край пульсирующего пламени соответствует температуре вспышки, а
фронт установившегося пламени – температуре воспламенения. Начальное
кратковременное продвижение пламени совпадает с нагревом поверхности
жидкости до температуры вспышки. Из-за недостатка поступления паров
устойчивое горение не устанавливается и фронт пламени(3) возвращается в
область устойчивого горения (5). При достижении концентрации паров в
зоне подготовки до уровня воспламенения фронт продвигается дальше по
жидкости. Таким образом, над жидкостью с некоторым запозданием распространяется фронт пламени, а внутри жидкости с некоторым опережением –
тепловая волна, в которой температура изменяется от начальной до темпера-
201
туры вспышки, далее, до температуры воспламенения и в дальнейшем приближается к температуре кипения на поверхности.
Все жидкости для возникновения и распространения горения требуют
определенных затрат теплоты. Энергия необходима, прежде всего, для первоначального возникновения горения, далее она пополняется за счет излучения пламени. Возникновение и распространение горения в этом случае происходит в диффузионном режиме.
Количественная характеристика таких процессов зависит от многих
факторов и не всегда поддается расчету. Наибольшее влияние на возникновение и распространение горения оказывают теплофизические параметры горючей жидкости, процессы теплопередачи от пламени к жидкости и условия
образования горючей среды. Так, например, жидкость с высокой температурой воспламенения легко поджигается, если ею пропитать пористый материал с низким коэффициентом теплопроводности. Это свойство используется в
керосиновых лампах и свечах. Аналогичным образом, с помощью пропитанного кусочка материи, можно поджечь огромное хранилище с жидкостью,
имеющей высокую температуру воспламенения, При этом не надо прогревать всю массу жидкости. В тоже время поджечь тонкий слой жидкости (2-3
мм) с низкой температурой вспышки, например, разлитый нефтепродукт на
воде, не представляется возможным из-за большого съема теплоты и невозможности прогрева горючего до заданной температуры.
Рассмотрим тепловые процессы, которые имеют место при горении
жидкостей. На рис.10.7 изображен резервуар с горящей жидкостью.
202
О2
О2
Воздух
Qизл
111111
2
Воздух
О2
qи=0,2-0,3Qизл
qпад=qф
О2
Рис. 10.7. Схема процессов теплообмена при горении жидкостей
1- нагрев жидкости;
2-нагрев соседних
резервуаров
Над жидкостью имеется зона паров. Последние на периферии зоны
смешиваются с воздухом и сгорают, образуя пламя. Для того, чтобы пламя
не гасло, в него должны непрерывно поступать пары и воздух. Процесс парообразования возможен только при постоянном подогреве поверхности
жидкости. Источником теплоты в данном случае является лишь теплота излучения пламени, т.к. продукты горения (конвективный тепловой поток)
оттесняются парами от поверхности жидкости. Теплоту излучения можно
рассчитать по закону Стефана - Больцмана:
Q изл = ε⋅δ (Т гор 4 - Т ж 4),
(10.12)
где ε - степень черноты пламени (ε = 0,75 - 1,0);
δ - постоянная Стефана - Больцмана (5,7⋅1011 кДж/м2⋅с⋅К);
Т гор и Т ж - соответственно, температура пламени и жидкости, К.
На поверхность
жидкости падает только часть теплоты излучения,
равная:
q ж = (0,2 - 0,3)Q изл .
Эта теплота расходуется на нагрев жидкости q нагр и на ее испарение
203
q исп . В целом тепловой баланс этого процесса будет иметь следующий вид:
q ж = q нагр + q исп = ρ⋅v нагр ⋅c⋅(T п - T 0 ) + ρ⋅V исп. ⋅q исп ,+ q потерь
(10.13)
где q ж - теплота, поступающая от факела к жидкости;
ρ - плотность жидкости, кг/м3;
V нагр – объем прогретой жидкости, м3;
с - теплоемкость жидкости, кДж/кг град;
T п и T 0 - соответственно, температура поверхности и начальная
температура жидкости, К;
V исп - объем испарившейся жидкости, м3;
q исп - удельная теплота испарения, кДж/кг.
В установившемся
стационарном режиме наблюдается равновесие
между количеством поступающего в зону горения и сгорающего там вещества. Именно это обстоятельство определяет постоянство скорости нагревания и скорости выгорания жидкости при стационарном режиме горения.
Другая часть теплоты излучения в виде падающего теплового потока
оказывает нежелательное воздействие на соседние резервуары, конструкции
и оборудование.
Падающий тепловой поток определяется как:
qпад. = qф ⋅ ϕ ; Квт/м2,
(10.14)
где q ф – поверхностная площадь собственного излучения
ϕ - коэффициент облучения.
Коэффициент облучения зависит от геометрической формы и пространственного расположения излучаемых и поглощаемых поверхностей.
10.6. Основные характеристики горения жидкостей
Для пожарных специалистов первостепенное значение имеют количественные данные о геометрических размерах емкостей и тепловых параметрах горящих жидкостей. В настоящее время нет теории, которая могла бы
204
описать, и позволила бы количественно прогнозировать все параметры горения жидкостей. Это очень большая проблема, над решением которой уже
длительное время работают наши и зарубежные ученые. Идет интенсивное
накопление экспериментальных данных по изучению процессов, протекающих при горении жидкостей. Результаты их обрабатываются пока в виде эмпирических зависимостей.
Геометрические размеры пламени. Линейные размеры пламени, т.е.
его длина, ширина и площадь F гор лежат в основе расчетов сил и средств, необходимых для тушения горящих жидкостей.
Горизонтальные размеры пламени определяются формой горизонтального сечения сосуда, в котором находится горящая жидкость. Если жидкость пролита на землю, то форма и площадь поверхности горения будет зависеть от рельефа местности. Все это говорит о том, что величину линейных размеров и площади горения жидкости нужно рассматривать в каждом
случае отдельно, применительно к конкретным условиям, в которых хранится жидкость, транспортируется и т.д.
Для определения площади разлива жидкостей из емкостей, резервуаров и т.д. в соответствии с НПБ 105-03 можно ориентировочно принять, что
1 л чистой жидкости растекается на площади 1 м2 горизонтальной поверхности.
Высота факела Н ф пламени горящей жидкости определяет интенсивность излучения пламени в окружающую среду. Ориентировочно ее величину можно оценить по следующей эмпирической зависимости:
Hф = 16,4 ⋅ sin α ⋅
3
( u m d ф)
2
,
(10.15)
где α - угол наклона оси факела к горизонту по действием ветра, град;
u m - массовая скорость выгорания жидкости кг/м2с;
d ф - характерный горизонтальный размер зеркала горящей жидкости.
Высота факела пламени зависит от многих факторов: линейных раз-
205
меров зеркала горящей жидкости (для резервуара - это его диаметр), скорости выгорания жидкости, скорости ветра и многих других. Высота факела
может достигать 10-15 м. Используется при проектировании для определения
противопожарных разрывов, т.е. безопасных расстояний до соседних объектов, а при тушении пожаров - безопасных расстояний до пожарных и пожарной техники.
Для характеристики процессов горения жидкостей используют также
линейную и массовую скорости выгорания:
Линейная скорость выгорания U л - это высота слоя жидкости, которая выгорает в единицу времени. U л = [м/c].
Массовая скорость выгорания U m– это количество жидкости, которая выгорает с единицы площади в единицу времени. U m =[кг/м2с].
Массовая и линейная скорости выгорания жидкости связаны соотношением:
U m = U л ⋅ ρ, кг/м2c,
(10.16)
где ρ - плотность жидкости, кг/м3.
10.7. Распределение температуры в горящей жидкости
Во время горения часть теплоты излучения факела расходуется на
нагревание жидкости. Распределение температуры в жидкости зависит от ее
физико-химических свойств и условий горения.
При горении однокомпонентной жидкости в стационарном (т.е. установившемся) режиме температура ее поверхности равна температуре кипения.
При горении многокомпонентных смесей вначале выгорают преимущественно легкокипящие компоненты. Поверхностный слой со временем
обогащается более тяжелыми компонентами. Температура его для небольших количеств жидкости повышается в соответствии с ее температурной
кривой фракционной перегонки. Однако в резервуарах, например, где объ-
206
ем жидкости большой (от нескольких до десятков тысяч м3), уже примерно
через 10 мин на поверхности нефтепродуктов устанавливается температура,
которая далее очень медленно, малозаметно повышается (рис. 10.8). Распределение температуры по глубине для различных жидкостей имеет разный
характер (рис.10.9).
Например, в бензине (рис.10.9) образуется прогретый слой определенной толщины, температура которого приблизительно одинакова во всех его
точках. Такой слой называют гомотермальным. За его нижней границей
температура резко падает. Толщина прогретого слоя растет со временем. В
керосине гомотермальный слой, как правило, не образуется, и температура
плавно снижается по мере удаления от поверхности жидкости.
t,С˚
t,С˚
1
400
трансформ. масло
100
ДТ
300
τ=30'
нефть
200
2
τ=80'
50
бензин
100
2
4
Рис.10.8. Изменение температуры
поверхности жидкости
во времени
τ, мин
100
200
300
400
h, мм
Рис.10.9. Распределение температуры жидкости по глубине:
1- керосин; 2 - бензин
Значение некоторых рассмотренных параметров, можно проиллюстрировать данными табл.9.5.
Таблица 10.5.
207
Параметры выгорания некоторых горючих жидкостей
Горючие
жидкости
Нефть
Мазут
Керосин
Дизельное топливо
Бензины
Скорость
выгорания, см/мин
Скорость
нарастания
прогретого слоя,
см/мин
Температура
прогретого слоя, 0С
0,23
0,17
0,40
0,33
0,50
0,5
0,5
1,2
130 – 160
230 – 300
220 – 240
220 – 240
80 – 100
Чем же обусловлено наличие двух типов распределения температур в
горючей жидкости?
При возникновении в горящей жидкости гомотермального слоя жидкость как бы разделяется на два слоя: верхний и нижний. В верхнем нагретом
слое температура практически не понижается с увеличением расстояния от
поверхности зеркала. Распределение температуры в этом слое напоминает
распределение температуры в металле, и даже теплопроводность гомотермального слоя превышает теплопроводность меди. В нижнем слое температура быстро падает по мере удаления от верхнего нагретого слоя. Распределение температуры в нем такое же, как в жидкости, плохо проводящей тепло.
Механизм теплопроводности в верхнем слое в тысячи раз превышает молекулярную теплопроводность соответствующей жидкости. Такую аномалию
связывают с наличием мощных конвективных потоков на границе раздела
фаз. В нижнем слое мощность конвективных потоков существенно слабее.
На модели резервуара с диаметром 0,5 метра экспериментально установлено:
- скорость прогрева растет с увеличением скорости воздушного потока;
- с ростом диаметра резервуара толщина гомотермального слоя увеличивается;
- охлаждение стенок резервуара может, как уменьшать интенсивность
прогрева, так и, в некоторых случаях, увеличивать;
- нефть с большим содержанием воды имеет большую скорость прогрева и меньшую температуру на поверхности;
208
- характер распределения температуры в мазуте зависит от количества
в нем воды. Гомотермальный слой образуется, если влажность более 0,5%.
Перечисленные экспериментальные факты являлись основой при разработке гипотез, объясняющих механизм образования гомотермального
слоя. Все гипотезы связывают механизм образования гомотермального слоя
с наличием мощных конвективных потоков и отличаются объяснением условий их возникновения.
Рис.10.10. Схема образования прогретого слоя
Наиболее известна гипотеза профессоров Блинова В.И. и Худякова
Г.Н. В результате собственных экспериментальных исследований ими было
установлено влияние нагревающего эффекта стенки резервуара. Схему образования прогретого слоя можно представить следующим образом (рис.10.10).
Стенки резервуара и прилегающая к ним жидкость во время горения
нагреваются. Если температура стенки выше температуры кипения жидкости, жидкость закипает. Кипение усиливает конвекцию жидкости и, естественно, передачу теплоты в ее глубину. В приповерхностной области жидкости образуется гомотермальный слой. От нижней его границы стенка
209
продолжает прогреваться теплопроводностью вниз, вызывая непрерывный
подогрев прилегающих слоев жидкости. Это и вызывает снижение во времени нижней границы гомотермального слоя. При горении обводненных высококипящих жидкостей образованию этого слоя способствует вскипание
воды.
Изложенное представление о причине образования гомотермального
слоя не в полной мере соответствует реальной действительности, особенно,
при пожарах крупных резервуаров. Роль стенки в этом случае не объясняет
всех существующих факторов. В резервуарах большого диаметра происходят
наряду с рассмотренными процессами и другие процессы, обусловленные
изменением плотности жидкости за счет выгорания более легких фракций.
При этом процесс массообмена и выгорания летучих фракций происходит по
всей площади горючей жидкости. Влияние процессов у стенки таких резервуаров ослабевает.
Уравнение скорости прогрева жидкости имеет вид:
ρ C 1 − CЛ
∂Z 0
2ατ
= U= V T T
,
exp
ρ O Co C Д
ρ O CO R
∂τ
(10.17)
где
ZO
τ
- толщина гомотермального слоя,
- время от начала формирования слоя,
ρО , ρТ
- плотности исходной жидкости и высококипящей фракции,
С О , С Т , С Л - теплоемкости исходной жидкости, высококипящей и легкокипящей фракций,
α
- коэффициент теплоотдачи,
R - радиус резервуара,
U - скорость изменения толщины слоя,
V - скорость выгорания жидкости.
10.8. Вскипание и выброс при горении резервуара с ГЖ
210
Процессы горения жидкости могут сопровождаться очень опасными
явлениями - вскипанием и выбросом (рис. 10.11).
Вскипание нефтепродукта обусловлено наличием воды, которая находится в виде эмульсии по всему объему горючего. Устойчивость таких
эмульсий чрезвычайно высока, однако при горении, когда горючая жидкость
перегревается и ее вязкость уменьшается, канальные воды под действием
Архимедовых сил начинают свое движение, которое может быть направлена
как вверх, так и вниз. Если прогреваемый слой имеет температуру более
1000С, то капельки воды в эмульсии превращаются в пар, резко изменяют
объем и всплывают на поверхность жидкости, образуя большой объем горящей пены. Пена переливается через край, и площадь горения существенно
увеличивается.
Рис.10.11. Схема выброса горящей нефти
Процесс вскипания при наличии гомотермального слоя характеризуется накоплением оседающей воды на границе «горячего» и «холодного» слоев. При прогреве обводненного слоя до
1000С происходит превращение
накопленной воды в пар, и начинается интенсивное движение смеси «паровых» пузырьков с нефтепродуктом вверх к зеркалу горящей жидкости. Коли-
211
чество образующейся пены и интенсивность ее образования на поверхности в
этом случае может принимать угрожающие размеры.
Образование пены на поверхности нефтепродукта возможно только
при определенном содержании воды. Например, для нефти такое содержание
воды составляет ≈ 4%, для мазута – выше 0,6%. Следует отметить, что при
большом содержании в нефти воды происходит процесс самотушения.
Выброс горящей жидкости из резервуара вызывается взрывным вскипанием воды, находящейся под слоем нефтепродукта. Для того чтобы это
произошло необходимо:
- наличие водяной подушки на дне резервуара;
- образование гомотермального слоя с температурой выше температуры кипения воды;
- контакт гомотермального слоя с придонной водой и прогрев воды до
температуры выше температуры кипения.
Перегрев воды выше температуры кипения является основным условием выброса. Перегревание воды надо связывать с отсутствием центров парообразования и влиянием давления нефтепродукта на термодинамику фазового перехода воды.
Большая опасность выброса предусматривает принятие специальных
мер безопасности. Важно знать, через какое время может произойти выброс,
и какие меры надо принять, чтобы устранить это явление или увеличить время возникновения выброса. Решение такой задачи возможно, если известны
условия теплообмена резервуара с окружающей средой. На рис 10.12. показана схема теплообмена при образовании гомотермального слоя.
212
q
Q*m
α1 F0(Tп-Т0)
UhF0ρC(Tп –T0)
α1 F0(Tп-Т0)
α2 F0(Tп-Т0)
Рис. 10.12 Схема теплообмена при горении резервуара и
образование гомотермального слоя
Уравнение теплового баланса имеет вид:
q = m ⋅ Qисп . + Vh F ρ ⋅ c(TП − TO ) + α1 Fδ (TП − TO ) + α 2 F (TП − TO ) ,
где
(10.18)
q − поток теплоты от факела пламени к поверхности жидкости в резер-
вуаре, Дж/с;
m – массовая скорость испарения горючей жидкости кг/с; m = V m ·F;
Q исп. – удельная теплота испарения, Дж/кг;
Vh
- скорость прогрева жидкости, м/с;
V m - удельная скорость выгорания, кг/м2с;
F - площадь поверхности жидкости, м2
Т п и Т 0 – температура поверхности горючей жидкости при горении и начальная температура, К;
ρ − плотность горючей жидкости, кг/м ;
3
213
с – теплоемкость горючей жидкости, Дж/кг·К;
α 1 , α 2 - коэффициенты теплопередачи через стенку резервуара и от гомотер-
мального слоя вглубь горючей жидкости, Дж/м2 ·с ·К;
Fδ - боковая поверхность гомотермального слоя горючей жидкости, м ,
2
ГТС; Fδ = 2πRh ;
R – радиус резервуара, м.
Решения уравнения (10.18) позволяют описывать динамику изменения
гомотермального слоя, и могут быть использованы для прогнозирования
времени выброса нефтепродукта.
τ = τ 0 hм
τ 0V0
(10.18)
τ 0V0 − H
где τ 0 = ρ ⋅ с ⋅ R / 2α
Формула применима при условии, что
h м >> H или τ 0V0 >> H ( τ 0V0 =h м )
При h м << H
τ=
H − hм
Vc
(10.19)
Вскипанию и выбросу обычно предшествуют вибрация, шумы и возрастание размеров факела. Выбросы могут в отдельных случаях достигать
высоты 80 м. Выброшенная горящая жидкость может накрыть очень большую площадь вблизи очага горения вместе с находящимися на ней сооружениями, техникой и людьми. Вскипание на пожарах наблюдается чаще выбросов.
Задания для самоконтроля
1. Поясните, возможно ли горение в толще жидкости?
2. Что называется массовой и линейной скоростью выгорания? Их размерность?
3. Чему равно давление насыщенного пара ацетона при температуре кипения?
4. От каких факторов зависит теплота излучения?
5. Чему равна температура на поверхности горящей жидкости?
6. При какой температуре происходит испарение?
7. Как зависит давление насыщенного пара от температуры?
8. От чего зависит степень черноты пламени?
9. Как изменяется температура на поверхности горящей жидкости во времени?
214
стей.
10. Какие жидкости относятся к ЛВЖ?
11. Что называется температурой вспышки?
12. Какую зависимость выражает уравнение Антуана?
13. Приведите примеры физических и химических процессов при горении жидко-
14. Как можно рассчитать скорость (интенсивность) испарения?
15. Что называется ТПР?
16. Почему горение жидкостей самораспространяющийся процесс?
17. Что называется температурой воспламенения?
18. Предложите несколько способов прекращения горения жидкостей.
19. Определить, какая масса изопрена С 5 Н 8 (2-метил-бутадиен-1,3) испарится за 10
минут, если было разлито 2 л вещества. Температура 180С, скорость воздушного потока в
помещении 0,3 м/с. Какой объем займут пары изопрена?
20. Рассчитать время образования взрывоопасной концентрации паров сероуглерода СS 2 в помещении объемом 120 м3, если было разлито 5 л жидкости. Условия стандартные , скорость воздушного потока 0,2 м/с.
ГЛАВА 11. ГОРЕНИЕ ТВЕРДЫХ ВЕЩЕСТВ И МАТЕРИАЛОВ
Процесс горения твердых веществ, как и жидкостей, протекает в две
стадии: образование горючих газов и паров в результате термического разложения вещества под действием излучения пламени и горение продуктов
разложения над поверхностью твердого вещества.
Стадия термического разложения имеет свои существенные особенности. Именно она определяет условия, режимы и последствия стадии непосредственного горения, в том числе взрыва или явления "общей вспышки" в
помещениях, отравление потерпевших и пожарных токсичными продуктами
горения и т.д.
11.1. Физико-химические основы процессов термического
разложения твердых веществ и материалов
В повседневной жизни нас окружает большое многообразие твердых
горючих веществ и материалов. Поэтому основные особенности термической деструкции здесь рассматриваются на примере наиболее широко распространенных представителей высокомолекулярных соединений - древесины, твердых горючих ископаемых, хлопка, шерсти, а также представителей
215
синтетических высокомолекулярных веществ - некоторых полимеров и волокон.
Рассмотрим вначале поведение при нагревании, например, древесины
и бурого угля. При медленном нагревании до 1000°С масса их начнет
уменьшаться. Значит, с веществом начинают происходить какие-то превращения, и часть его улетучивается. График зависимости выхода летучих продуктов от температуры приведен на рис.11.1.
Оказывается, древесина (кривая 1) начинает выделять летучие продукты уже при 120 0С. У бурого угля (кривая 2) процесс начинается при
200 °С. Максимальный выход летучих продуктов у древесины наблюдается в
интервале 220-400 °С, а у бурого угля - в интервале 300-500°С. Причем у
древесины количество летучих больше, чем у бурого угля.
G лет,
% масс
40
1
30
20
10
2
300
500
700
900
1100
Т,К
Рис.11.1. Выход летучих продуктов (масс. %) термического разложения
древесины (1) и бурого угля (2)
Древесина и уголь - пространственно сшитые природные полимеры.
При их нагревании наблюдается явление выделения летучих продуктов,
216
сущностью которого является разрыв химических связей под действием теплоты, сообщаемой извне.
Термодинамические расчеты и эксперименты показали, что прочность
химических связей в веществе определяется их химической природой:
алифатические, олефиновые, ароматические и т.д. Количественной мерой
прочности любой химической связи является ее энергия. По существу, это
количество энергии, которую нужно затратить для разрыва связи.
В таблице 11.1 приведена энергия основных типов химических связей.
Приведенные в этой таблице данные показывают, что самые слабые,
нестойкие - простые углерод- углеродные связи и связи между углеродом и
гетероатомами О, Н,S (Ecв<400 кДЖ/моль). Самые прочные связи - ненасыщенные углерод - углеродные: двойные и тройные в алкенах и алкинах, а также в
аренах (Ecв > 400 кДЖ/моль). Для расщепления связи между углеродным и водородным атомом также требуется затратить значительную энергию.
Таблица 11.1.
Энергия разрыва химических связей органических веществ
Связь
Соединения
Энергия разрыва Е св
кДж/моль
ккал/моль
С-С
Алканы
330
79,30
С=С
Алкены
590
140,5
С≡ С
Алкины
820
196,70
С ар - С алк
Алкиларены
300
70,70
С-С
Арены
610
145,80
С-Н
Алканы
410
98,70
С ар - Н
Арены
430
103,70
С-Н
Алкены
320
77,00
О-О
Пероксиды
140
33,00
С - СООН
Кислоты
230
55,00
217
С-О
Эфиры
310
75,00
С - ОН
Спирты
380
90,00
С-S
Сульфиды
230
55,00
С-Н
Амины алифати-
290
70,00
360
85,00
ческие
С-Н
Амины ароматические
Приведенные в этой таблице данные показывают, что самые слабые,
нестойкие - простые углерод - углеродные связи и связи между углеродом и
гетероатомами О, Н, S (Е св < 400 кДж/моль). Самые прочные связи - ненасыщенные углерод - углеродные: двойные и тройные в алкенах и алкинах, а
также в аренах (Е св > 400 кДж/моль). Трудно отщепляется также водород от
углерода.
Эти данные, а также термодинамические расчеты для температур
нагревания до 500-600°С (полукоксование) позволили выявить ряд очень
важных закономерностей термической деструкции органических веществ:
1. Углеродные цепи в алканах (насыщенных углеводородах) расщепляются на меньшие по молекулярной массе алканы и алкены, состоящие из более
коротких цепей. Разрывается преимущественно связь между углеродными
атомами в середине цепи:
С−С−С−С−С−С → С−С−С + С=С−С
гексан
пропан
пропен
2. Алкены более стабильны при нагревании, чем алканы, в летучих продуктах термического разложения их всегда больше.
3. Циклоалканы разлагаются двумя путями: с разрывом кольца и образованием алкенов или же, если в кольце содержится шесть и более углеродных
атомов, дегидрированием кольца, т.е. отщеплением водорода и образованием аренов:
218
С=С−С−С-С−С
гексен
+ 3Н 2
циклогексан
бензол
4. Ароматические соединения (арены) разрушаются с отщеплением боковых цепей, а сами конденсируются в многокольчатые структуры с образованием твердых веществ с графитированной углеродной решеткой:
R
R+ ¦¦¦¦¦¦¦
\/\/\/\/\/\/
¦¦¦¦¦¦¦
\/\/\/\/\/\/
¦¦¦¦¦¦¦
\/\/\/\/\/\/
Механизм химических реакций термической деструкции твердых органических веществ многостадийный, очень сложный и детально не изучен.
Поэтому скорость термического разложения твердых веществ точно определена быть не может. На практике скорость разложения приходится определять экспериментальными методами. Среди них наиболее эффективным и
экспрессным является
термогравиметрический метод анализа. Прово-
дится на специальном приборе, называемом "дериватограф".
-←ΔH→+
219
ДТА
DTG
200
400
0
t,˚C
20
40
Δm,
% масс
TG
Рис.11.2. Дериватограмма керогена сланца
Прибор на одной небольшой навеске вещества одновременно регистрирует (рис. 11.2) изменение температуры образца (Т) и нескольких параметров, как функцию температуры нагрева: потерю массы (ТG), скорость
потери массы (DТG) и тепловые эффекты протекающих процессов и реакций
(DТА). Образец вещества нагревается с постоянной скоростью, которую
можно варьировать в пределах от нескольких до десятков градусов в минуту. Анализ можно проводить в инертной среде азота, аргона, гелия, а также в
присутствии воздуха или чистого кислорода в режиме окисления или горения.
Процессы термической деструкции многих органических
веществ
начинаются при низкой температуре. Это можно проиллюстрировать данными по температуре начала разложения древесины, торфа и ископаемых углей (табл.11.2).
220
Таблица 11.2.
Температура начала разложения некоторых ТГМ
Горючее вещество
Температура начала
разложения, °С
Древесина
120 - 150
Торф
160 - 200
Ископаемые угли
300
При термической деструкции органических веществ протекает множество параллельно-последовательных реакций. Начальные и промежуточные стадии процессов термического разложения многих веществ сходны.
Рассмотрим их на примере одного из наиболее широко распространенных
материалов - древесины (табл.11.3).
Сопоставив данные таблицы 11.3 с величинами энергии разрыва химических связей (табл. 11.1), можно прийти к выводу, что чувствительность органических веществ к нагреву во многом должна определяться наличием в
веществе водорода и гетероатомов: O, N, S Hal и т.д. Чем больше их содержание в веществе, тем выше выход летучих продуктов.
Исследования показали, что в состав продуктов термического разложения входят газы, смола и твердый остаток
Таблица 11.3.
Основные макростадии процесса термолиза древесины
Температура
Протекающие процессы
Летучие продукты
древесины, °С
120 - 150
Сушка
Н 2 О адсорбированная
150 - 180
Декарбоксилирование дегидратация
Н 2 О капиллярная и химически
связанная, СО 2
180 - 250
Деструкция гемицеллюлозы
Н 2 О химически связанная, СО,
СО 2 , Н 2 , СН 4
250 - 300
Начало
интенсивного
древесины (целлюлозы)
разложения
221
300 - 450
Интенсивный пиролиз
древесины 25 % Н 2 О химически
с экзотермическим эффектом (в том связанной, 40 % алканов и алкечисле и лигнина)
450 - 550
нов.
Резкое снижение скорости пиролиза
древесины
550 - 600
Окончание пиролиза
древесины (карбонизированный
остаток)
Исследования показали, что в состав продуктов термического разложения входят газы, смола и твердый остаток.
Газообразные продукты термического разложения состоят преимущественно из негорючего диоксида углерода СО 2 и горючих оксида углерода
СО, простейших газообразных алканов, алкенов, водорода и др.
В состав жидких продуктов (смол) входят горючие низкомолекулярные вещества: углеводороды (алканы, алкены, арены), альдегиды, кетоны,
карбоновые кислоты, полифункциональные соединения и др.
Твердый остаток (полукокс) представляет собой высококарбонизованное вещество с высоким содержанием углерода (84-92 %) и низким содержанием водорода (2,5-4,5 % масс.), уже не способное к выделению большого количества летучих веществ.
Очень важным является то обстоятельство, что при нагревании до 500
- 600°С твердые горючие материалы разлагаются с выделением помимо негорючих большого количества горючих газов и паров. Именно это и определяет способность любого твердого вещества к горению.
Рассмотренные закономерности по термическому разложению некоторых
твердых горючих материалов носят общий характер и могут быть распространены на другие материалы. Зная эти закономерности, можно прогнозировать, предсказывать горючесть любого органического вещества или материала.
222
11.2. Основные закономерности процессов горения органических
твердых горючих материалов
Ранее, при рассмотрении алгоритма пожара
были указаны только
главные стадии процесса: нагрев, термическое разложение вещества и горение летучих продуктов деструкции. В действительности картина явлений
здесь значительно сложнее, поскольку зависит не только от химических, но
и от физических свойств вещества. Лучше всего представить ее в виде схемы
(рис.11.3). Часть лучистого теплового потока от пламени падает на твердую
горючую поверхность, которая нагревается, и под воздействием теплоты
вещество претерпевает различные превращения.
Линейные полимеры - термопласты, а также многие индивидуальные
вещества плавятся с образованием расплава. К ним относятся полиэтилен,
полипропилен, каучук, волокна капрона и нейлона, стеарин, парафин, битум,
сера и многие другие. Часть горючих паров будет претерпевать дальнейшее
разложение с образованием более низкомолекулярных горючих газов и паров.
Пространственно сшитые высокомолекулярные соединения с трехмерной структурой (это древесина, хлопок, резина, многие пластмассы, ископаемые угли, торф и т.д.) будут без плавления сразу разлагаться с образованием тех же продуктов: газов, паров и твердого остатка.
В природе существует много твёрдых веществ, которые при нагревании испаряются сразу, минуя стадию плавления. К ним относится всем известный нафталин, витамин С(аскорбиновая кислота) , уротропин (сухой
спирт), камфара, щавелевая кислота и др. Этот процесс называется сублимацией или возгонкой. Сублимация сразу приводит к образованию паров, которые далее будут расщепляться до более летучих продуктов.
223
Qизл
Гомогенное
диффузионное
горение
Гетерогенное горение
Воздух
Термическое
разложение
Воздух
Летучие
Продукты
(газы и пары)
Твердый
остаток
(уголь)
Горючие
газы и пары
Термическое
разложение
Расплав
Испарение
Сублимация
Плавление
ТГМ
Рис.11.3. Алгоритм процессов, протекающих при горении ТГМ
224
Таким образом, независимо от физических свойств твердого горючего
вещества при его термическом разложении образуются летучие горючие и
инертные продукты (газы и пары) и твердый остаток (рис.3).
Рис.11.4. Схема процесса горения ТГМ.
1 - сублимация, 2 - плавление, 3 - термическое разложение.
Образование горючей паро-воздушной смеси происходит на периферии потока за счет диффузии кислорода воздуха. Поэтому процесс горения
ТГМ протекает в газовой фазе в диффузионном режиме. Закономерности его
те же, что и при диффузионном горении горючих газов.
Естественно, летучие продукты выделяются не постоянно, выход их со
временем уменьшается. Температура на горящей поверхности твердого органического вещества редко превышает 600-700 °С. После бурного горения в
начальный период на ней образуется углистый остаток. Толщина его постепенно увеличивается, тем самым изолируя свежие слои вещества от лучистого теплового потока пламени. Выход летучих продуктов существенно
снижается, пламя уменьшается, и воздух начинает доходить до поверхности
углистого остатка, который тоже начинает гореть, но в гетерогенном режиме. По мере выгорания слой угля утончается, растрескивается, открывая доступ к свежим слоям горючего и т.д.; процесс продолжается до полного вы-
225
горания всех летучих веществ и, наконец, заканчивается гетерогенным горением угля.
На реальных пожарах твердые материалы, как и жидкие, горят в диффузионном режиме при недостатке воздуха, т.е. при коэффициенте избытка
воздуха непосредственно в зоне горения α < 1. В таких условиях продукты
термического разложения будут, естественно, сгорать не полностью. Состав
образующихся продуктов термического разложения и неполного горения
можно видеть из табл. 11.4.
Таблица 11.4
Состав газообразных продуктов неполного горения некоторых
твердых веществ (температура 500-550 °С)
Горючее вещество
Древесина + воздух
Содержание, % об. от суммы газов
СО 2
СО
Алканы
Прочие
4-6
30-31
1,4-1,7
5-8 Н 2 ; 0,4-0,8 О 2 ;
54-58 N 2
Полиметилметакрилат +
19,5
12,2
2,58
воздух Поливинилхлорид+воздух
52,4 мономер
24,3
15,1
5,82
0,22 алкены; 50 HCl;
2,88 арены
(при 600 °С)
Капрон + воздух
10,3 CO 2 ;
6,5
8,0
6,42
2,6 Н 2 ; 1,1 NH 3 ; 2,4
HCN; 0,48 O 2 ; 72,5
N2
Как видно из этих данных, газообразные продукты неполного горения большинства ТГМ содержат до 75 % горючих веществ. В этом заключается смысл химического недожога, о котором говорилось при изучении теплового баланса процессов горения.
В этом же заключается чрезвычайно высокая опасность пожаров в закрытых помещениях без доступа воздуха. В них накапливаются раскаленные горючие газообразные продукты термического разложения и неполного
горения. При необдуманном, неосторожном вскрытии снаружи оконных проемов и дверей открывается доступ свежему воздуху в горящее помещение.
226
Часто происходит мощный взрыв и так называемая "общая вспышка", когда
загорается вся нагретая и подготовленная к воспламенению пожарная
нагрузка. При этом пожарные получают травмы, сильные ожоги, а нередко и
гибнут.
Продукты горения, особенно неполного, опасны также своей токсичностью. В них всегда содержатся оксиды углерода, а многие полимеры
выделяют в больших количествах ряд других высоко токсичных веществ.
Например, вдыхание некоторых из них в течение 5-10 мин. смертельно при
следующих концентрациях в воздухе:
диоксид углерода. . . . . . . . . . . . 9,0 % об.
оксид углерода . . . . . . . . . . . . . 0,5 %
сернистый газ. . . . . . . . . . . . . . 0,3 %
хлористый водород. . . . . . . . . . 0,3 %
цианистый водород. . . . . . . . . . . 0,02 %
Хлористый водород и цианистый водород выделяются полимерами
практически на всех пожарах. Для оценки токсичности продуктов горения
применяется специальный показатель пожарной опасности:
Показатель токсичности продуктов горения - отношение количества
материала к единице объема замкнутого пространства, в котором образующиеся при горении материала газообразные продукты вызывают гибель 50
% подопытных животных.
По значению показателя токсичности материалы классифицируются на
чрезвычайно опасные, высокоопасные, умеренноопасные и малоопасные.
227
11.3. Основные характеристики возникновения, распространения
пламени и горения твердых органических веществ
Важнейшим показателем пожарной опасности, который характеризует
способность вещества или материала к горению в воздухе, является группа
горючести.
По горючести вещества и материалы подразделяют на три группы:
Негорючие (несгораемые) - не способные к горению в воздухе.
Негорючие вещества могут быть пожароопасными (например, окислители, а
также вещества, выделяющие горючие продукты при взаимодействии с водой, кислородом воздуха или друг другом).
Трудногрючие (трудносгораемые) - способные гореть в воздухе при
воздействии источника зажигания, но не способные самостоятельно гореть
после его удаления.
Горючие (сгораемые) - способны самовозгораться, а также возгораться при воздействии источника зажигания и самостоятельно гореть после его
удаления.
В пожарном деле каждое вещество или материал должны пройти специальные испытания на горючесть по методикам, регламентируемым
ГОСТ 12.1.044-89.
Результаты испытаний на группу горючести скажут пожарному специалисту: будет или не будет гореть вещество или материал при возникновении пожара. Но этого часто недостаточно. Очень важно знать также
условия, при которых оно может загореться. Причиной может стать как источник зажигания, так и радиационный нагрев или, другими словами,
нагрев теплотой излучения пламени горящих по соседству других веществ и
материалов.
Действие источника зажигания и характер возникшего горения будут
определяться макростроением твердого вещества. Рассмотрим, что произойдет, если капля расплавленного металла (стали) упадет на древесину и хло-
228
пок. Древесина под каплей будет
нагреваться. Вначале испарится в месте
контакта влага, а затем при 200-250 °С появятся первые летучие продукты
термического разложения, которые будут смешиваться с воздухом вокруг
капли с образованием горючей паро-воздушной смеси (рис.11.5). Если к
этому моменту температура капли будет выше температуры зажигания такой
смеси, то последняя воспламенится, и дальше пламя уже само будет себя
поддерживать. Древесина будет гореть.
Рис.11.5. Зажигание древесины (а) и хлопка (б) каплей расплавленного
металла
Хлопок вначале поведет себя также. Под каплей он также будет высыхать, а затем начнет разлагаться с выделением летучих продуктов. Но в этом
случае их будет меньше, чем у древесины, из-за низкой объемной плотности
волокон. Летучие продукты будут сильно разбавляться воздухом и могут не
воспламениться.
Однако твердый углистый остаток разложения волокон
возгорится от раскаленной, капли но горение в этом случае будет без пламени, т.е. гетерогенным. Такое горение называют тлением. Для хлопка и
подобных ему растительных материалов не характерно пламенное горение.
Тление - особый вид гетерогенного (беспламенного) горения.
Такое горение характерно для волокнистых материалов растительного происхождения. Наблюдается также часто внутри достаточно больших масс сы-
229
пучих материалов (в штабелях торфа, в кучах опилок, зерна, в скирдах соломы, копнах и стогах сена, в мешках с рыбной мукой и др.).
Тление от пламенного горения отличается тем, что не требует большого количества кислорода. Для его поддержания достаточно бывает воздуха,
содержащегося внутри сыпучего или волокнистого материала между его частицами или волокнами.
Тление - очень опасный вид горения, поскольку может возникнуть,
например, в хлопке даже от невидимых глазу фрикционных искр или искр
глушителей двигателей автотракторной техники. Известны случаи возгорания кип хлопка, перевязанных стальной лентой, при транспортировке их волоком по асфальтовому или железобетонному покрытию причалов в морских и речных портах и т.д. Тление может продолжаться часами, сутками,
неделями, месяцами и даже годами. Очаги тления чаще всего скрыты от
глаз, поэтому их очень трудно обнаружить и потушить. В определенных
условиях, часто при выходе наружу, тление может перейти в пламенное горение. В большинстве случаев пламенное горение твердых веществ заканчивается тлением углей. Более подробно процесс тления будет рассмотрен в
п. 10.4.
Аналогичная картина будет наблюдаться и при радиационном нагреве поверхности твердого вещества. Возгоранию будут также предшествовать стадии сушки и термического разложения. Как только образовавшаяся
горючая газо- паро - воздушная смесь возгорится, возникнет пламенное горение облучаемого вещества.
Пожарную опасность
твердых горючих материалов характеризуют
температурой воспламенения Т в , самовоспламенения Т св и тления Т тл .
Температура тления Т тл - это температура вещества, при которой
происходит резкое увеличение скорости экзотермических реакций окисления, заканчивающихся возникновением тления. Применяется при экспертизах причины пожаров, при выборе взрывозащищенного электрооборудования.
230
Все три температуры для каждого вещества определяются экспериментально на одной установке по ГОСТ 12.1.044-89.
Как поведет себя дальше возникшее пламя? Если на горизонтальной
поверхности
бруска древесины небольшой очаг пламени (рис.11.6.), то
лучистый тепловой поток q и от пламени будет нагревать прилегающую к
зоне горения свежую часть древесины. После достижения на ней температуры Т в эта часть также воспламенится, далее будет нагреваться следующая
часть, за ней - следующая и т.д. То есть пламя будет перемещаться, распространяться до тех пор, пока не охватит всю свободную верхнюю поверхность материала.
Рис. 11.6. Схема распространения пламени на поверхности ТГМ
Далее пламя будет распространяться на боковые ребра бруска и торцы,
но гораздо медленнее. Экспериментами установлено, что скорость распространения пламени вертикально вниз в 2 раза ниже и вертикально вверх в
8-10 раз выше, чем в горизонтальном направлении.
Распространение пламени является одним из важнейших показателей
пожарной опасности твердых веществ. Этот показатель определяется экспериментально по ГОСТ 12.1.044-89.
Индекс распространения пламени J - условный безразмерный показатель, характеризующий способность веществ воспламеняться, распростра-
231
нять пламя по поверхности и выделять теплоту. Этот показатель применяется для классификации строительных материалов, лакокрасочных полимерных
покрытий, тканей, пленок:
• J=0
- не распространяют пламя;
• 0<J<20 - медленно распространяют пламя;
• J>20
- быстро распространяют пламя
Этот показатель применяется для классификации поверхностных слоев
кровли и полов, в том числе ковровых покрытий. Материалы по распространению пламени подразделяются на четыре группы:
• РП1 - не распространяющие;
• РП2 - слабо распространяющие;
• РП3 - умеренно распространяющие;
• РП4 - сильно распространяющие.
На реальных объектах, где твердых горючих материалов множество,
определить или рассчитать предполагаемую скорость распространения пламени невозможно. В этом случае для пожарно-технических расчетов пользуются усредненными данными, полученными на основе результатов исследований и наблюдений на реальных пожарах. В качестве иллюстрации можно
привести несколько значений
Таблица 11.5.
Скорость распространения горения на реальных объектах
Объекты
Скорость распространения
пламени, u, м/мин
1,0 - 1,5
Административные здания
Библиотеки
0,5 - 1,0
Жилые дома
0,5 - 0,8
Коридоры и галереи
4,0 - 5,0
Волокнистые материалы на
стильных
предприятиях
Склады
тек-
7,0 - 8,0
до 4,0
232
Скорости очень высокие. Это значит, что за время прибытия пожарных подразделений на пожар в течение 4-5 минут согласно Боевому уставу
(БУПО) пожар в помещениях, например, административных зданий, библиотек, жилых домов может распространиться в радиусе 5 м от очага, т.е. на
площади до 70 м2. Именно этим обусловлено категорическое требование
для любого лица немедленно сообщить в пожарную охрану об обнаружении
загорания и только потом уже приступить к борьбе с огнем подручными
средствами.
Основной количественной характеристикой процесса
горения твер-
дых материалов является массовая скорость выгорания. Скорость выгорания влияет на множество динамических характеристик пожара: тепловой
режим, скорость изменения температуры, допустимое время эвакуации людей, фактическую огнестойкость конструкций, скорость распространения
горения и изменения площади пожара и др.
В пожарно-технических расчетах (расчет сил и средств для тушения
пожара, расчет продолжительности пожара и т.д.) применяют приведенную
массовую скорость выгорания:
u m пр = u m ⋅ К п ,
(11.1)
где: u m пр - удельная массовая скорость выгорания, кг/м2с ;
К п - коэффициент поверхности горения пожарной нагрузки.
Скорость выгорания большинства ТГМ (табл.11.6.) примерно в 2-3 раза
ниже, чем у жидкостей.
233
Таблица 11.6.
Сравнительная таблица приведенных скоростей выгорания
твердых горючих материалов и жидкостей
Приведенная скорость выгорания, u m пр,
Горючее
кг/м2⋅мин
Древесина в изделиях
1,11
Каучук синтетический
0,72
Органическое стекло
1,14
Полистирол
1,14
Ацетон
2,83
Бензин
2,93
Керосин
2,30
11.4. Гетерогенное горение
Часто на пожарах гомогенное горение твердых горючих материалов на
заключительной стадии после выгорания летучих веществ переходит в гетерогенное догорание карбонизованных остатков (угля).
Тление - особый вид гетерогенного (беспламенного) горения, а
именно экзотермический процесс низкотемпературного гетерогенного
горения карбонизированного остатка.
Такой вид горения характерен для
волокнистых материалов расти-
тельного происхождения. Наблюдается также часто внутри достаточно
больших масс сыпучих материалов (в штабелях торфа, в кучах опилок, зерна, в скирдах соломы, копнах и стогах сена, в мешках с рыбной мукой и др.).
Тление от пламенного горения отличается тем, что не требует большого количества кислорода. Для его поддержания достаточно бывает воздуха,
содержащегося внутри сыпучего или волокнистого материала между его частицами или волокнами.
234
Тление - очень опасный вид горения, поскольку может возникнуть,
например, в хлопке даже от невидимых глазу фрикционных искр или искр
глушителей двигателей автотракторной техники. Известны случаи возгорания кип хлопка, перевязанных стальной лентой, при транспортировке их волоком по асфальтовому или железобетонному покрытию причалов в морских и речных портах и т.д. Тление может продолжаться часами, сутками,
неделями, месяцами и даже годами. Очаги тления чаще всего скрыты от
глаз, поэтому их очень трудно обнаружить и потушить. В определенных
условиях, часто при выходе наружу, тление может перейти в пламенное горение. В большинстве случаев пламенное горение твердых веществ заканчивается тлением углей.
Главным требованием к материалу подверженному тлению, является
то, что при его нагревании образовывался жесткий углистый остаток. Материалы, которые при интенсивном нагреве образуют нежесткий углистый
остаток или смолистые жидкие продукты, не склонны к тлению. Это наводит
на мысль о том, что главным в определении характера поведения материала,
связанного с тлением, является строение молекулы вещества и форма разложения исходного материала. Хотя тление чаще всего связано с целлюлозными материалами, чистая целлюлоза обладает низкой склонностью к тлению
или вовсе ею не обладает. Это можно сопоставить с тем фактом, что чистая
целлюлоза дает мало углистого остатка при нагреве по сравнению с хлопком
и вискозой, относительно которых известно, что они тлеют. Разницу в их поведении можно объяснить каталитической активностью неорганических
примесей, которые способствуют реакции образования углистого остатка
Зарождение тлеющего горения
Известно, что тление может начаться вслед за пламенным горением
многих целлюлозосодержащих материалов, если пламя погаснет, а также при
условии, что тлеющий источник, например сигарета, может действовать в качестве источника воспламенения. Для зарождения тления основным является
требование о наличии источника тепла, который приведет к образованию уг-
235
листого остатка и начале его окисления. Значимость таких факторов, как
температура источника и (или) интенсивность теплового потока (например,
от радиатора), для разных материалов различна.
К тлеющему горению могут привести следующие ситуации:
- соприкосновение с тлеющим материалом;
- равномерный подогрев (самовоспламенение внутри материала);
- несимметричный подогрев (мелкодисперсный материал на раскаленной поверхности, материал подвергается воздействию теплового потока с
одной стороны);
- развитие тления из горячей точки внутри массы материала.
Этот процесс способен самостоятельно распространяться по пористому телу
за счет тепла, выделившегося при реакции окисления.
К пористым материалам, образующим при горении углистый остаток, и
склонным к тлению относятся:
- каменный и бурый уголь, сажа, торф;
- дерево и древесноволокнистые материалы, древесный уголь, пробковый порошок, мелкодисперсные органические материалы;
-
сено, клевер, трава, солод и солодовые ростки, зерно и отруби,
хмель, вайда, табак, сильные корма и их смеси;
- шерсть, хлопок, шёлк, лён, конопля, джут, пакля
- некоторые виды полимерных материалов (в основном термореактопласты), кожи изготовленные по методу хромового дубления; латексные
резины; определенные сорта пенофенопластов; пенополиуретаны.
Для реализации механизма горения необходимо, чтобы окисление поверхности твердой фазы углистого остатка генерировало количество тепла,
которого было бы достаточно для того, чтобы вызвать обугливание не прогретой еще пылевоздушной смеси, которая в свою очередь начнет окисляться. Пламенное горение кучи древесной муки, например, может прекратиться
само по себе или быть потушено. Однако после тушения остается тлеющее
пламя, которое будет развиваться внутри кучи.
236
Тление включает в себя процесс поверхностного окисления углистого остатка, чем обеспечивается тепловая энергия, необходимая для
продолжения процесса термического разложения соседнего слоя горючего материала. Для успешного распространения этого процесса требуется
последовательное удаление летучих продуктов из зоны активного горения, что в свою очередь обнажит свежий углистый остаток, который после этого загорится.
Интенсивность тлеющего горения зависит, в основном, от реакционной
способности карбонизированного остатка и условий тепломассопереноса в
системе.
Зона тления в материалах с высокой газопроницаемостью и пористостью (к ним относятся хлопок, отложения промышленной пыли, сено и ряд
других материалов) способна распространяться сквозь массу горючего.
В материалах с низкой газопроницаемостью зона тления ограничена
поверхностью горючего и проникает в его массу только по мере потребления
внешних слоев.
Критические условия тления
Для устойчивости любых режимов диффузионного горения должны
быть выполнены как минимум два условия: достаточно высокая скорость
подвода окислителя из окружающей атмосферы к зоне реакции и не слишком
большие теплопотери из зоны реакции .
Первое из них не может быть определяющим для закрытых систем, а
второе для любых тонкослойных систем. Действительно, для закрытых систем подвод кислорода лимитируется скоростью фильтрации через рыхлый
слой горючего (в случае встречного потока воздуха) или через слой золы,
остающейся за волной тления (в случае попутного потока воздуха). Роль теплопотерь может быть относительно малой для тонкослойных систем, однако
она быстро возрастает по мере уменьшения толщины слоя горючего.
237
Следовательно, для рассматриваемых режимов должны существовать
нижние пределы по концентрации окислителя С *н и толщине образца ∆ *н , а
также верхний предел по пористости слоя горючего П *в , т.е. процесс устойчив лишь при условии
С > С *н , ∆ > ∆ *н и П < П *в .
Кроме того, имеются верхний и нижний пределы по скорости окислителя V, т.е. тление будет устойчиво лишь при Vн <V<Vв . Температура в зоне
реакции не должна быть слишком низкой, т.е. существует нижний предел по
начальной температуре образца и воздуха Т *н . Аналогичный смысл имеет
верхний предел по скорости потока воздуха: при чрезмерной скорости обдува температура в зоне реакции нарастает до критического условия.
Очень важно подчеркнуть, что критические условия тления взаимосвязаны. Кроме того, для ряда горючих веществ отмечаются переходы от тления
к горению и наоборот. Тем самым возникает связь между критическими
условиями тления и пламенного горения.
Установлено, что ряд веществ могут выступать в роли катализаторов
гетерогенных процессов горения древесноволокнистых материалов.
Так, к примеру, железо и никель являются активными катализаторами,
влияющими на одну из стадий возникновения гетерогенного горения - процесса разложения углеводородов при более низкой температуре, к числу таких же катализаторов относятся хлориды железа, сульфиды цинка и меди.
Вот уже более столетия ведутся многочисленные попытки каталитической
активации процессов горения твёрдого топлива. Установлено, что в присутствии хлористых солей железа реакционная способность кокса повышается
примерно вдвое. Каталитической активностью обладают
соли и оксиды
алюминия, кобальта, марганца, ванадия, железа, никеля, хрома и меди, калия, магния и кальция.
238
11.5. Горение металлов
Общей закономерностью для всех металлов является то, что пожарная
опасность их в чистом виде возрастает с уменьшением номера группы и увеличением номера периода.
Характерные признаки горения металлов приведены в табл.11.7.
Самыми пожароопасными являются щелочные металлы первой группы
главной подгруппы.
Щелочноземельные металлы (II группа, главная подгруппа) плавятся
при нагревании до 600-8000С и в присутствии воздуха легко загораются.
Металлы III группы главной подгруппы (B, Al и их аналоги) плавятся
при нагревании до 150-7000С и энергично окисляются, т.е. медленно горят,
легко воспламеняются и быстро горят в порошкообразном состоянии.
Мышьяк, сурьма и висмут (V группа, главная подгруппа) легко сгорают в расплавленном состоянии при 250-7000С.
Остальные металлы более тугоплавки, температура их плавления выше
10000С. В монолитном виде (слитки, массивные изделия) они не горят активно даже при нагревании, за исключением титана и циркония, однако
многие из них пирофорны в порошкообразном и губчатом состоянии (Fе, Аl,
Zn, Cо и др.).
В принципе все металлы, за исключением благородных (VIII группа),
должны хорошо гореть на воздухе при нагревании. Однако в действительности это не так. Способность металлов к горению на воздухе определяется
свойствами образующихся продуктов - оксидов.
Многие оксиды металлов тугоплавки, температура их плавления выше
10000С, а некоторые плавятся даже при 2000-30000С и выше. Такие
оксиды покрывают поверхность горящего металла, изолируя его от воздуха.
Сопротивление оксидной пленки зависит от объемного отношения
ϕ - это отношение объема оксида к объему сгоревшего металла. Если
239
ϕ < 1,
оксид не представляет существенной преграды
для
воздуха
(табл.11.7.) и не мешает горению (металлы I и II групп). Если 1 < ϕ < 2, то
оксидная пленка плотная, компактная и служит эффективной преградой,
резко снижающей скорость окисления (металлы III группы, медь и ее аналоги, бериллий и др.) Однако, некоторые такие оксиды (например, титана или
циркония) растворяются в расплавленном металле и поэтому не мешают горению.
Воспламенение металлов наблюдается, как уже отмечалось, при относительно низкой температуре. Однако процессы их горения сильно экзотермичны, и поэтому многие из них, покрываясь оксидной пленкой, быстро
разогреваются, плавятся, а многие начинают даже испаряться (температуры
могут достичь 30000С и выше). То есть металлы горят с поверхности расплава и в виде паров. Парообразование часто приводит к резкому разрушению
оксидных пленок с разбрызгиванием капель расплава металла и его оксида и
интенсифицирует горение.
Отличительной от органических материалов особенностью многих металлов является способность их при нагревании окислятся в среде азота с образованием нитридов - соединений формулы Ме n Н m . То есть азот - флегматизатор горения органических веществ - является окислителем металлов.
Таблица 11.7.
Способность металлов к горению на воздухе
группа
Подруппа
Элементы
Характерные признаки горения на воздухе
ϕ (*)
I
Главная
Щелочные
Li, Nа, К, Rb, Cs
ϕ<1
II
Главная
Rb и Cs воспламеняются при контакте с
воздухом. Остальные легко воспламеняются при незначительном нагревании
щелочно-земельные
При простом контакте с воздухом не вос-
Bе, Мg, Ca, Sr, Bа
пламеняются. Довольно легко загораются
ϕ<1
при нагревании до 600-800 С. Горят с об-
0
240
разованием оксидов и отчасти нитридов
(Мg)
Побочная
Zn, Cd, Hg
Hg пожаробезопасна. Zn и Cd при нагрева-
1<ϕ<2
нии до 200-250°С воспламеняются и горят
до оксидов.
III
Главная
B, Al, Gа, In, Те
1<ϕ<2
IV
Побочная
Тi Zr,
1<ϕ<2
V
Главная
Аs, Sb, Bi
VI
Главная
Se, Те, Po
VIII
Fе, Cо, Оs
В холодном состоянии пожаробезопасны.
При нагревании выше температуры
плавления (150-700 °С) энергично окисляются, в виде стружки или порошка - быстро
сгорают
Холодные пожаробезопасны. Самовозгораются при локальном нагреве в тонких
сечениях. Особенно опасны в виде стружки
и порошка. Горят не только в кислороде,
но и в азоте
Холодные пожаробезопасны. Легко
сгорают в расплавленном состоянии
(250-700 °С)
Se загорается легко при нагревании,
Те и Po пожаробезопасны
Холодные пожаробезопасны. Оs при
нагревании сгорает. Fе и Cо не горят при
нагревании, свежеприготовленные в виде
порошка и губки пирофорны
(*) ϕ - отношение объема окисла к объему сгоревшего металла.
Нитриды щелочных металлов при 300-350 °С разлагаются на элементы,
поэтому в продуктах горения не накапливаются. Нитриды щелочноземельных металлов стабильны до 1500-2000°С, поэтому в реакции горения этих
металлов заметно участвует и азот. Более тугоплавкие металлы (B, Аl, Тi,
Zr и др.) в порошкообразном виде могут при нагревании воспламеняться и
гореть в среде азота с образованием тугоплавких нитридов.
Обобщая рассмотренные данные, можно выделить следующие основные особенности пожарной опасности и горения металлов:
1. Некоторые металлы пирофорны, т.е. способны воспламеняться при
контакте с кислородом воздуха, в слитках и массивных изделиях (щелочные),
а так же в измельченном, порошкообразном состоянии (железо, никель, кобальт, титан, цирконий и др.).
241
2. Многие металлы опасно хранить совместно с горючими органическим веществами и материалами. Последние, как правило, легко воспламеняются даже от малокалорийных источников зажигания и могут зажечь металлы, при горении которых развиваются очень высокие температуры (до
3000°С и выше). Достигаемые значения опасных факторов пожара при горении металлов в 1,5-2,0 раза выше, чем при горении других горючих материалов.
3. Следует также отметить большую пожарную опасность многих металлов, способных бурно реагировать с водой со взрывами, интенсивным
горением.
11.6. Особенности горения пылевидных веществ
Пыли - это твердые вещества и материалы, диспергированные до частиц размером 850 мкм (0,85 мм) и менее.
Горючая пыль представляет собой дисперсную систему,
которая в
процессе горения во взвешенном состоянии (аэрозоль) ведет себя как газы и
пары, и как твердое вещество - в осевшем состоянии (аэрогель). Поэтому
горючие пыли сочетают в себе пожароопасные свойства горючих газов,
паров и твердых веществ. Пожарная опасность горючих пылей характеризуется показателями, применяемыми для тех и других.
Наиболее важными из них являются 6 показателей:
• группа горючести,
• температура самовоспламенения,
• НКПР пламени,
• P max ,
• dP/dt,
• минимальное взрывоопасное содержание кислорода в горючей смеси
(МВСК),
242
• способность взрываться и гореть при взаимодействии с водой, кислородом воздуха и другими веществами.
Наибольшую пожарную опасность представляют пыли, взвешенные в
воздухе (аэрозоли, аэровзвеси, пылевоздушные смеси). Они способны к
распространению пламени на неограниченное расстояние от источника зажигания.
Пожарная статистика
показывает, что ежегодно происходит боль-
шое количество взрывов пылей на предприятиях угледобывающей, мукомольной, химической и других отраслей промышленности, на зерновых элеваторах и многих других объектах, где обращаются или образуются пылевидные горючие материалы.
Распространение пламени по пылевоздушной смеси - очень сложный
процесс, не поддающиийся точному математическому описанию. Механизм
распространения пламени по аэрозолю пытались объяснить с позиций классической тепловой теории Я.Б.Зельдовича и Н.Н.Семенова, радиационной
теории (О.М.Тодес), "эстафетной" теории (Л.А.Клячко) и многих других.
Но ни одна из них не может объяснить все происходящие в пылевидном облаке явления. В действительности распространение фронта пламени по аэрозолю происходит в результате протекающих одновременно и последовательно многих процессов: передаче теплоты из зоны горения в свежую смесь
конвекцией, кондукцией и радиацией, факельном зажигании свежих пылинок
от горящих и т.д.
Принципиальным отличием от механизма горения паро- газовоздушных смесей является турбулентный режим распространения пламени
по аэрозолям, т.е. искривление его фронта, образование "языков" пламени,
непостоянство нормальной скорости горения, а отсюда часто и повышенные
значения скорости распространения пламени.
Взрыв пыли - это быстрое сгорание аэрозоля с мгновенным выделением теплоты и газообразных продуктов. При таком взрыве быстро возникает
давление, и волны сжатия распространяются в окружающей среде со ско-
243
ростью до нескольких сотен м/с. Ударная волна очень часто взвихривает,
поднимает в воздух осевшую пыль (аэрогель), после чего следует новая серия взрывов. Особенно страдают от пылевых взрывов зерновые элеваторы,
предприятия мукомольной и комбикормовой промышленности.
Взрыв может возникнуть только в том случае, если концентрация пыли
находится
в
концентрационной области распространения пламени.
НКПР для пылей колеблется в очень широких пределах – от нескольких
граммов до килограммов в одном кубическом метре. ВКПР по величине
огромен (от нескольких до десятков кг/м3), в реальных условиях никогда и
нигде не достигается, поэтому для пылей его не определяют.
НКПР пылей сильно зависит от их дисперсности, влажности и зольности (рис.11.7). Промышленные пыли все без исключения переменного состава, поэтому при решении ов пожарной профилактики на разных предприятиях необходимо каждый раз определять НКПР пыли и ее концентрацию в
конкретных производственных условиях.
НКПР
НКПР
НКПР
W,%
d, мкм
а)
б)
A,%
в)
Рис.11.7. Зависимость НКПР пылей от их дисперсности (а),
содержания влаги (б) и золы (в)
244
Для иллюстрации порядка величин в табл.11.8. приведены основные
показатели пожарной опасности некоторых пылей.
Таблица 11.8.
Основные пожароопасные свойства некоторых пылей
Вещество
НКПР,
г/м3
7
P max ,
кПа
618
dP/dt кПа/с,
Алюминий
Е min ,
мДж
30
430
МВСК
% об.
3,0
Сера
15
32
406
510
10,0
Сурьма
40
420
203
460
16,0
Полистирол
18
20
590
370
9,5
Минимальная энергия зажигания пылей снижается с уменьшением их
дисперсности и влаги. Е min пылей в 10-20 раз выше, чем у газов и паров горючих жидкостей.
Максимальное давление взрыва пылей зависит от их химической природы, дисперсности и ряда других факторов. По своей абсолютной величине
оно несколько выше, чем у газопаровоздушных смесей, поскольку при горении пылей развиваются очень высокие температуры, в ряде случаев превышающие 3000 °С.
Пылевоздушные смеси горят в широком интервале концентраций кислорода. Наименьшее значение МВСК имеют вещества типа магния и алюминия: всего 2-3 % об. Как отмечалось выше, некоторые металлы и особенно их
пыли , способны гореть, т.е. взрываться в среде азота, оксидов углерода,
например, те же алюминий и магний.
Задания для самоконтроля
1. Какие материалы склонны к гетерогенному горению?
2. Приведите примеры веществ, разлагающихся с образованием летучих веществ и
твердого остатка.
3. Приведите примеры ТГМ, которые при нагревании сублимируются.
4. В чем различие термопластов и реактопластов? В чем особенность их горения?
5. Приведите примеры жидких продуктов разложения при нагревании ТГМ.
6. Перечислите причины химического недожога.
7. Назовите токсичные продукты неполного сгорания ТГМ.
245
КПР?
8. Какой процесс называется пиролизом?
9. В чем проявляются анизотропные свойства древесины?
10. Почему для ТГМ не используется такой показательпожарной опасности как
11. Что представляет собой твердый остаток при сгорании ТГМ?
12. Какой процесс называется газификацией?
13. Что называется температурой тления?
14. Что представляет собой аэрозоль? В чем опасность этого состояния?
15. Где будет больше толщина углистого слоя: в обработанной антипиреном древесине или необработанной?
16. Что называется коэффициентом дымообразования? Какова его размерность?
17. Что называется кислородным индексом?
18. Чему равна минимальная критичесая скорость горения? Что означает эта величина?
19. В чем опасность аэрогелей?
20. Какие факторы влияют на массовую скорость выгоранияТГМ?
21. Индекс распространения пламени одного горючего материала 14, а другого 28.
Какой вывод Вы можете сделать?
22. Как влияет образование углистого слоя на поверхности ТГМ на дальнейшее горение материала?
23. Критические плотности падающих лучистых потоков для древесины составляет
12 кВт/м2, а для ДСП - 18 кВт/м2. Какой вывод можно сделать?
24. Как зависит скорость распространения пламени от толщины материала?
РАЗДЕЛ V. ВЗРЫВЫ.
ГЛАВА 12. ВЗРЫВЫ. УДАРНЫЕ ВОЛНЫ И ДЕТОНАЦИЯ
12.1. Основные определения. Типы взрывов
Статистика показывает, что многие пожары начинаются либо сопровождаются взрывами. При этом к наиболее типичным опасным факторам
пожара добавляются новые, не характерные для диффузионного вида горения. Основными поражающими факторами взрыва являются:
- продукты взрыва;
- воздушная ударная волна;
- осколки и разлетающиеся части близко расположенных конструкций;
- специальные поражающие средства.
Понятия взрыва, как правило, связывают с процессом выделения большого количества энергии за очень маленький промежуток времени. Это позволяет рассматривать взрыв как явление, в основе которого лежат химиче-
246
ские и физические процессы, связанные с выделением энергии. Таким образом, энергия, выделяющаяся при взрыве, может иметь физическую либо химическую природу. Она может находиться внутри взрывчатой системы в виде потенциальной энергии, высвобождающейся при определенных условиях. Источником такой потенциальной энергии может быть ядерная энергия
либо химическая, заключенная в горючих смесях, пылях, взрывчатых веществах и т.д.
Другим видом потенциальной энергии взрыва может быть энергия,
которая привнесена извне. Примером выделения такой энергии может быть
разрушение баллона со сжатым газом, разрушение электрического проводника при увеличении силы тока, разряд мощного электрического заряда и т.д.
Основной характеристикой, определяющей взрывные процессы, является время выделения энергии. Взрыв – высокоскоростной процесс.
Например, химический взрыв представляет собой результат экзотермической
окислительно-восстановительной реакции протекающей с большой скоростью. Для паровоздушных смесей скорость может достигать десятков и сотен
м/с, а при определенных условиях – тысяч м/с.
Характерной особенностью взрыва горючей смеси является то, что потенциальная энергия превращается в тепловую, носителем которой являются
газообразные продукты сгорания. Газообразные продукты горения могут совершать работу.
Физические взрывы не всегда происходят с выделением энергии.
Например, взрыв парового котла происходит с поглощением энергии.
Взрыв (взрывное превращение) – это процесс быстрого физического или химического превращения вещества, сопровождающееся превращением потенциальной энергии в механическую энергию, движение
или разрушение.
На рисунке 12.1 приведена схема основных типов и видов взрыва.
247
Взрывы
По характеру подводимой энергии
Внутренняя потенциальная
Внешняя подводимая энергия
По механизму протекания процесса
Физические
Химические
энергия
Ядерные взрывы
Взрывчатых
ществ
Электрических разрядов
Сосудов с перегретой
жидкостью
В ограниченн
объеме
Сосудов с газами
Излучение большой
плотности
В неограничен
объеме
Рис.12.1. Схема основных типов и видов взрывов.
Кроме указанных в схеме типов и видов, взрывы могут быть квалифицированны по причине, которая их вызвала, по физическому состоянию
взрывчатых веществ, по характеру и силе разрушения и т.д.
12.2. Закономерности взрывных процессов паровоздушных смесей
Горение и взрыв - близкие по своей сути процессы, в основе которых
лежат
быстропротекающие
экзотермические
окислительно-
248
восстановительные реакции. Нормальное кинетическое горение может перерастать во взрыв. Рассмотрим основные причины, приводящие к взрыву.
Представим, что процесс горения происходит в трубе, через один конец которой поступает горючая смесь, а через другой – отводятся продукты
реакции. При поступлении горючей смеси со скоростью равной скорости
распространения пламени внутри трубы пламя стабилизируется – становится
неподвижным. Из закона сохранения вещества следует:
U ГС ⋅ ρ ГС = U ПГ ⋅ ρ ПГ
(12.1)
где: U ГС – скорость подхода горючей среды к фронту пламени, м/с;
U ПГ – скорость продуктов горения по отношению к неподвижному
фронту пламени, м/с;
ρ ГС - плотность горючей смеси, кг/м ;
3
ρ ПГ - плотность продуктов горения, кг/м .
3
Величина U ПГ во столько раз больше нормальной скорости, во сколько
плотность исходной горючей смеси больше плотности продуктов горения.
Увеличение скорости газового потока при сгорании является следствием
расширения газового потока. По этой же причине горение всегда сопровождается движением газов.
Движение газов вызывает искажение фронта пламени, как правило, поверхность фронта увеличивается. При этом поверхность пламени превосходит поперечное сечение трубы, и скорость распространения пламени в трубе
будет во столько раз больше нормальной, во сколько поверхность пламени
больше поперечного сечения трубы. Изменение фронта пламени приводит к
изменению скорости распространения пламени и, как следствие, к турбулизации горючей смеси. Неупорядоченное движение отдельных объемов горючей смеси вызывает значительное увеличение поверхности пламени и
приводит к ускорению горения. Ускорение горения, параметры горения, в
этом случае, ограничены только лишь газодинамическими особенностями
при переходе к детонационному режиму горения.
249
Режимы обычного горения отличаются только скоростью распространения пламени. Это различие обусловлено неодинаковым развитием поверхности фронта пламени. Достаточно быстрое сгорание ( ≈ 100м/с) реализуется
при существенной турбулизации пламени. Такое горение называется взрывом. Медленное горение от взрыва отличается только величиной поверхности пламени, а значит – его скоростью. Граница между двумя режимами
устанавливается произвольно и не имеет четких очертаний (различий).
Горение в замкнутом объеме имеет свои особенности, обусловленные
динамикой роста давления. Например, при поджигании горючей смеси в центре сферического объема, в начальной стадии распространении пламени от
центра примерно до половины пути роста давления внутри объема практически не наблюдается. Далее давление резко возрастает и достигает своего максимального значения. Таким образом, в начальной стадии горение протекает
как бы в условиях свободного расширения газов в неограниченном пространстве с видимой скоростью, а в конце – со скоростью, приближающейся к
нормальной. Причиной этого является то, что объем сгоревшего газа пропорционален радиусу пламенной сферы в третьей степени ( r 3 ) , поэтому относительно невелик при значительных перемещениях в начале пути. Так, например, при отношении радиусов пламенной сферы (r) и сферического объема
(R)
r:R= 1:3 объем продуктов горения будет равен 1/27 объема сосуда. По
этой причине при взрыве газо-воздушной смеси внутри здания колонны в
центре здания остаются целыми, а ограждающие конструкции разрушаются.
В соответствии с характером движения газов при сгорании в замкнутом
объеме изменяется и скорость перемещения пламени.
Максимальное давление, создаваемое стехиометрической смесью какого-либо углеводорода, будет находиться в пределах 8 -12 атм. В данном примере, согласно определению, горение внутри сосуда не является взрывом,
поскольку нет разрушений и нет перехода потенциальной энергии в энергию
механического движения. В этом случае энергия химического превращения
(E хим ) была меньше, чем энергия механического разрушения сосуда (E разр )
250
E хим < E разр
Если бы сосуд был менее прочным и разрушился, то данный вид горения можно было бы квалифицировать как взрыв. Сжигание аналогичного
объема горючей смеси в свободном пространстве (без наружной оболочки)
также нельзя отнести к взрыву. Приведенные примеры показывают условность и неоднозначность сделанных определений и отсутствие четкой границы между протекающими явлениями.
Давление взрыва можно увеличить, если каким-либо путем воздействовать на пламя и турбулизировать горящую смесь. Легче всего такое горение
осуществить в трубах с определенным отношением длины и диаметра. При
локальном зажигании газовых смесей характер горения будет различен для
коротких и длинных труб.
При горении газовых смесей в коротких трубах, когда процесс протекает при постоянном давлении, (зажигание осуществляется у открытого конца трубки), фронт пламени распространяется с постоянной и небольшой скоростью горения.
Горение газовой смеси в длинных трубках можно разделить на две
стадии: первоначально распространение пламени происходит по механизму,
который можно наблюдать при горении в коротких трубках или в сферическом сосуде. Далее, на второй стадии, на длине трубы примерно равной десяти ее диаметрам скорость распространения пламени становится огромной и
может измеряться тысячами метров в секунду. Это явление носит название
детонация. Оно происходит в результате адиабатического сжатия последовательных слоев горючего газа, вызванного горением, и фактически представляет собой перемещение ударной волны по горючей смеси в трубе.
Возникновение ударных волн. Ударная волна может быть получена,
например, при разрыве мембраны или разделяющей емкости с разными давлениями газов. Ударная волна является границей, где осуществляется скачкообразный переход от состояния исходной смеси к состоянию сжатой смеси. Это изменение происходит на расстоянии длины свободного пробега мо-
251
лекул в газе. Ударная волна распространяется по смеси со скоростью большей скорости звука в воздухе.
В ударной волне происходит заметное
нагревание смеси, которое усиливается при торможении и отражении ударной волны от твердой поверхности. При достаточно сильном нагревании горючей смеси ударной волной смесь может воспламениться. Возможность
воспламенения в ударной волне и при адиабатическом сжатии необходимо
учитывать при оценке взрывоопасности разрыва или быстрого открывания
аппаратуры, содержащей горючую смесь. Например, при разрушении вакуумированного сосуда в камере, заполненной горючей смесью, возможно, ее
воспламенение, которое можно объяснить нагреванием отраженной ударной
волной смеси, втекающей в разбитый сосуд.
Возникновение детонации газов в трубах всегда связано с образованием ударной волны. Рассмотрим этот процесс более детально. Представим себе трубу с поршнем (рис.12.2.)
1
2
21
3
V
V
Д
Р0,ρ0
Р,ρ
31
Д
Р,ρ
Р
ΔР
ΔР
Р0
разрежение
Х
Рис.12.2. Схема образования ударной волны и распределение давления.
252
В трубке под давлением Р О находится инертный газ с плотностью ρ Ο .
Если очень быстро, например, ударом молотка сдвинуть поршень из положения 1 в положение 2 со скоростью U O , то при этом газ сожмется, но не весь, а
только небольшой, прилегающий к поршню, ее волной сжатия, слой. Давление и плотность в этой сжатой части газа, назовем ее волной сжатия, повысится до значения Р и ρ . Волна сжатия представляет собой как бы газовую
«пробку». Если поршень оставить в положении 2, то «пробка» будет продолжать двигаться по трубе со скоростью U. Передняя ее граница, ее фронт будет перемещаться со скоростью D.
Если изобразить изменение давления в трубе в результате произведенных действий с поршнем, то получается следующая картина. При достаточно
высокой скорости (U) поршня давление в волне сжатия будет возрастать и
достигнет во фронте своего максимального значения. То есть возникнет резкий скачок давления с амплитудой Δр. Поскольку волна сжатия действует
как поршень, она увлекает за собой газ, смещая его вперед, и за ней следом
образуется разряжение. Теория показывает, что такой скачек давления возникает в волне сжатия при ее скорости (U) больше скорости звука (U звука ): U
> U звука . Таким образом, волна представляет собой зону сжатия газовой среды, играющую роль поршня.
Благодаря скачку давления волна сжатия очень опасна для человека и
материальных объектов. При встрече с препятствием она действует наподобие всесокрушающего молота, в связи с этим она получила название «ударная волна». При отражении ударной волны от препятствия под действием сил
инерции происходит как бы дополнительное сжатие газа на поверхности
преграды, вследствие чего давление в отраженной волне еще более возрастает. Например, для двухатомных газов давление в отраженной волне в 8 раз
больше, чем в вызвавшей ее падающей волне. Поэтому падающая ударная
волна с амплитудой всего Δр = 35 кПа (0.35 атм) разрушает здание, с амплитудой Δр = 50 кПа (0.5 атм) – убивает человека, всего лишь несколько кПа –
выбивает стекла в окнах.
253
12.3. Энергия и мощность взрыва.
Тротиловый эквивалент
При сгорании паровоздушной смеси стехиометрического состава в замкнутом объеме создается максимальное давление взрыва. Величина такого
давления в основном определяется степенью температурного расширения
продуктов горения и является функцией отношения температуры взрыва к
начальной температуре горючей смеси
Т взр
Т0
. Температура взрыва определяет-
ся энергетическими свойствами горючего материала. Чем выше теплота сгорания горючего материала, тем выше температура взрыва и, соответственно,
больше давление взрыва.
Другим важным фактором, влияющим на создание избыточного давления, является дополнительное образование новых молекул в продуктах реакции. Для парогазовых воздушных смесей повышение давления за счет образования новых газообразных продуктов не является определяющим. Отношение
m
, где m – число газообразных продуктов горения, а n – число исходных
n
газообразных веществ, для большинства углеводородов не превышает значения 1.3 – 1.4
Давление, развиваемое при взрыве газо- и паровоздушных смесей в замкнутом объеме, для большинства горючих веществ лежит в пределах
0,6 – 1 МПа.
Наименьшее давление при взрыве развивается при концентрациях горючего вещества, равных нижнему и верхнему концентрационным пределам
распространения пламени. Оно обычно не превышает 0,3 МПа. Это объясняется низкой температурой взрыва. На НКПР она равна 1550 К, на ВКПР –
254
1100 К. Наибольшее давление при взрыве наблюдается при концентрации,
близкой к стехиометрической.
Расчет максимального давления взрыва производится по следующей
формуле:
Р взр =
Р0 ⋅ Т взр m
⋅ , где
Т0
n
(12.2)
Р 0 – начальное давление, кПа (МПа);
Т 0 – начальная температура, К;
Т взр – температура взрыва, К;
m – число молей (киломолей) газообразных продуктов горения;
n – число молей (киломолей) исходных газообразных веществ.
Расчет максимального давления взрыва
газов и паров
Пример 12.1. Вычислить максимальное давление взрыва
смеси гексана С 6 Н 14 с воздухом, если начальное давление 101,3
кПа, начальная температура 273 К, температура взрыва 2355 К.
1. Уравнение реакции горения гексана в воздухе:
С 6 Н 14 + 9,5( О 2 + 3,76 N 2 ) =6СО 2 + 7Н 2 О + 9,5· 3,76 N 2
2. Рассчитаем число молей (киломолей) газообразных веществ до и после взрыва:
m = 6 + 7 + 9,5⋅3,76 = 48,72 моль
n = 1 + 9,5⋅4,76 = 46,22 моль
3. Максимальное давление взрыва составит:
Р взр =
101,3 ⋅ 2355 48,72
= 921,1 кПа
⋅
273
46,22
Расчет максимального давления взрыва
горючих пылей
Пример 12.2. Вычислить максимальное давление взрыва
пыли полиэтилена [С 2 Н 4 ] с воздухом, если начальное давление
101,3 кПа, начальная температура 293 К, температура взрыва
1900 К.
1. Уравнение реакции горения полиэтилена в воздухе:
[С 2 Н 4] +3( О 2 + 3,76 N 2 ) =2СО 2 + 2Н 2 О +3· 3,76 N 2
2. Рассчитаем число молей (киломолей) газообразных веществ до и после взрыва:
m = 2 + 2 + 3⋅3,76 = 15,28 моль
255
n = 3⋅4,76 = 14,28 моль
ся.
Обратите внимание, что полиэтилен – твердое вещество и в расчете не учитывает3. Максимальное давление взрыва составит:
Р взр =
101,3 ⋅ 1900 15,28
= 702,9 кПа
⋅
293
14,28
В практике при оценке устойчивости от взрыва используется величина
избыточного давления взрыва.
Избыточное давление взрыва является основным критерием, разделяющим взрывоопасные категории помещений от пожароопасных. Этот показатель, главным образом, зависит от массы вещества, которое поступает в
аварийное помещение, и доли ее, принимающей участие во взрыве.
Определение поступающей в помещение массы вещества является одной из предварительных задач, которую необходимо решить перед тем, как
определять массу вещества, принимающего участие во взрыве. Алгоритм
расчета при этом зависит от агрегатного состояния горючих веществ, их
свойств и технологических параметров.
Избыточное давление взрыва в замкнутом помещении - это разность
между максимально возможным и начальным давлением, при котором он
происходит.
∆P = P MAX - P 0
Максимальное давление достигается, если
- вся масса горючего, поступившего в помещение, примет участие в образовании горючей среды и полностью взорвется;
- помещение полностью герметично и в нем отсутствует теплоотвод через
ограничивающие поверхности (неадиабатический процесс);
- горючее и окислитель в горючей среде находятся в стехиометрическом
соотношении.
В реальных условиях максимальное давление взрыва не достигается,
так как имеются существенные отклонения. При расчете это необходимо
256
учитывать, поэтому формулы для расчета ∆P индивидуальных веществ и
смесей имеют более сложный вид.
Расчет избыточного давление взрыва для индивидуальных веществ
производится согласно ГОСТ Р 12.3.047 – 98 и НПБ 105-03.
Избыточное давление взрыва ∆Р для индивидуальных горючих веществ
(газов и паров ЛВЖ и ГЖ), состоящих из атомов С, Н, О, N, Cl, Br, I, F, определяется по формуле
∆P = (PMAX − P0 ) ⋅
m⋅Z
100
1
⋅
⋅
, кПа,
VСВ ⋅ ρ Г ( П ) С СТЕХ К Н
(12.3)
где
Р MAX - максимальное давление взрыва стехиометрической газовоздушной
и паровоздушной смесив замкнутом объеме. Определяется экспериментально
или по справочным данным. При отсутствии данных допускается принимать
Р MAX = 900 кПа.
Р 0 - начальное давление, кПа. Допускается принимать равным 101 кПа.
m - масса горючего газа или паров ЛВЖ и ГЖ, вышедших в результате
аварии в помещение.
Z - коэффициент участия горючего во взрыве. Допускается принимать
значение Z по таблице 12.1.
V СВ - свободный объем помещения, м3. Свободный объем помещения
определяется как разность между объемом помещения и объемом, занимаемым технологическим оборудованием.
Если свободный объем помещения определить невозможно, то его допускается принимать равным 80 % геометрического объема помещения.
V СВ = 0,8V ПОМЕЩ .
Таблица 12.1.
Значение коэффициента Z для различных видов горючего
_________________________________________________
Вид горючего
Значение
_________________________________________________________
Водород
1,0
Горючие газы (кроме водорода), пыли
0,5
Легковоспламеняющиеся и горючие
жидкости, нагретые до температуры
вспышки и выше
0,3
Легковоспламеняющиеся и горючие
жидкости, нагретые ниже температуры вспышки, при наличии возможности образования аэрозоля
0,3
257
Легковоспламеняющиеся и горючие
жидкости, нагретые ниже температуры вспышки, при отсутствии возможности образования аэрозоля
0
_________________________________________________________
ρ Г - плотность газа или пара при расчетной температуре t РАСЧ , кг/м3, где
ρ Г (П) =
М Г (П)
VМ
, кг/м3, а
VM =
P0 ⋅ V0 TРАСЧ
, м3/кмоль.
⋅
T0
PРАСЧ
Если принять, что давление в помещении равно нормальному атмосферному
давлению (101,3 кПа) то плотность газа или пара можно рассчитать по следующей формуле:
ρ Г (П) =
М
, кг/м3,
V0 ⋅ (1 + 0,0037 ⋅ t РАСЧ )
где
М - молярная масса газа или пара, кг/кмоль;
V 0 - молярный объем при нормальных условиях, равный 22,4 м3/кмоль.
t РАСЧ - расчетная температура, 0С.
С СТЕХ - стехиометрическая концентрация горючих газов или паров ЛВЖ и
ГЖ, % (объемных). Стехиометрическая концентрация вычисляется по формуле
С СТЕХ =
100
, % , где
1 + 4,76 ⋅ β
β - стехиометрический коэффициент кислорода в уравнении реакции горения. Коэффициент β также может быть рассчитан по следующей формуле:
β = nС +
n H − n X nO
, где
−
4
2
n C , n H , n X, , n O - число атомов С, Н, О, галогенов в молекуле горючего вещества.
К Н - коэффициент, учитывающий негерметичность помещения и неадиабатичность процесса горения. Допускается принимать К Н = 3.
Расчет избыточного
давления взрыва
индивидуальных веществ
Пример 12.3. Вычислить избыточное давление взрыва
в помещении, где обращается толуол.
Данные для расчета:
1. Характеристика горючего вещества.
Толуол С 6 Н 5 СН 3 - метилбензол. Температура вспышки t ВСП = -5 0С.
Нижний концентрационный предел распространения пламени
НКПР = 1, 21 %
Константы уравнения Антуана
А = 6,0507; В = 1328,17; С = 217,713.
Плотность жидкости ρ Ж = 867 кг/м3.
Максимальное давление взрыва паров толуола Р MAX = 634 кПа.
258
2. Характеристика помещения.
Длина l = 18 м,
ширина b = 12 м,
высота h = 6 м.
Температура воздуха в помещении 25 0С.
Скорость воздушного потока в помещении 0,1 м/с.
3. Характеристика оборудования и параметры технологического процесса.
Объем аппарата V АП = 0,05 м3.
Степень заполнения аппарата жидкостью ε = 0,85.
Температура жидкости в аппарате 400С.
В результате аварийной ситуации аппарат полностью разрушен, вся жидкость поступила в помещение. Испарение жидкости проходило в течение 1 часа.
Решение:
1. Определяем массу жидкости, которая поступит в помещение m АП .
m = 867 ⋅ 0,05 ⋅ 0,85 = 37 кг
2. Определяем площадь испарения жидкости.
S ИСПАР = 37 м2.
3. Определяем интенсивность испарения WИСП .
При 25 0С и ωВОЗД = 0,1 м/с,
η = 2,1.
Молярная масса толуола С 6 Н 5 СН 3 М = 92 кг/кмоль.
Давление насыщенного пара толуола определяем по уравнению Антуана. В качестве температуры жидкости t Ж принимаем среднюю температуру между температурой
воздуха в помещении и температурой жидкости в аппарате.
t Ж = (25 + 40) / 2 = 32,5 0С.
Р S = 10
1328,17
6.0507 −
217 , 713+ 32 , 5
= 5,53 кПа.
Тогда интенсивность испарения будет равна
W ИСП = 10-6 ⋅ 2,1 ⋅
92 ⋅ 5,53 = 111,4 ⋅ 10-6 кг/м2⋅с.
4. Определяем массу жидкости, испарившейся с поверхности разлива m ИСП ЖИДК .
Расчетное время испарения принимаем
τ РАСЧ = 3600 с.
m ИСП ЖИДК = 111,4 ⋅ 10-6 ⋅ 3600 ⋅ 37= 14,8 кг.
5. Избыточное давление при взрыве паров толуола определяем по формуле
100
1
m⋅Z
, кПа.
∆P = (PMAX − P0 ) ⋅
⋅
⋅
VСВ ⋅ ρ Г ( П ) С СТЕХ К Н
Для расчета нам известны следующие величины:
Р MAX = 634 кПа;
259
Р 0 = 101 кПа;
m = 14,8 кг;
Z = 0,3 (по таблице 2 приложения ; по условию нашей задачи толуол - ЛВЖ, нагретая выше температуры вспышки);
К Н = 3.
Остальные величины V СВ , ρ Г , С СТЕХ необходимо рассчитать.
6. Определим свободный объем помещения V СВ .
V СВ = 18 ⋅ 12 ⋅ 6 ⋅ 0,8 = 1036,8 м3.
7. Определим плотность паров толуола в помещении ρ Г .
Температура воздуха в помещении t РАС = 25 0С.
Поскольку атмосферное давление в помещении принимаем равным нормальному атмосферному давлению Р 0 , плотность паров можно рассчитать по формуле
92
= 3,76 кг/м3.
22,4 ⋅ (1 + 0,00367 ⋅ 25)
8. Определим стехиометрическую концентрацию паров толуола С СТЕХ .
100
,%
С СТЕХ =
1 + 4,76 ⋅ β
Уравнение реакции горения толуола
ρГ =
С 6 Н 5 СН 3 + 9 (О 2 + 3,76 N 2 ) = 7 CО 2 + 4 Н 2 О + 9 ⋅ 3,76 N 2
β=9
Коэффициент β можно рассчитать и по формуле:
β=7+8/4=9
Тогда С СТЕХ = 100 / (1 + 4,76 ⋅ 9) = 1,86 %.
9. Определяем избыточное давление взрыва паров толуола, используя величины,
полученные в п.п. 6 - 8.
∆Р = (634 − 101) ⋅
14,8 ⋅ 0,3 100 1
⋅
⋅ = 10,9 кПа.
1036,8 ⋅ 3,76 1,86 3
Расчет ∆Р для пылей и смесей производится по формуле
∆P =
m ⋅ Н Т ⋅ Р0 ⋅ Z
1
, кПа,
⋅
VСВ ⋅ ρ В ⋅ С Р ⋅ Т Н К Н
(12.4)
где
m - масса пылей или смесей, вышедших в результате аварии в помещение.
Р 0 - начальное давление, кПа. Допускается принимать равным 101 кПа.
Н Т - теплота сгорания веществ, Дж/кг. Эти данные приведены в справочниках. Для ряда веществ значение теплоты сгорания приведены в приложении 2 данного пособия.
260
Для нефтепродуктов теплота сгорания может быть рассчитана по формуле Басса
(12.5)
Q Т = 50460 - 8,545 ⋅ ρ Ж , кДж/кг,
где
ρ Ж - плотность жидкости, кг/м3.
Z - коэффициент участия горючего во взрыве. Допускается принимать
значение Z по таблице 12.1, приведенной выше,
V СВ - свободный объем помещения, м3. Свободный объем помещения
определяется как разность между объемом помещения и объемом, занимаемым технологическим оборудованием. Если свободный объем помещения
определить невозможно, то его допускается принимать равным 80 % геометрического объема помещения. V СВ = 0,8V ПОМЕЩ .
ρ В - плотность воздуха до взрыва при начальной температуре Т Н , кг/м3.
ρВ =
МВ
29
, кг/м3, а
=
VМ
VМ
VM =
P0 ⋅ V0 TН
, м3/кмоль.
⋅
T0
PПОМ
М В - средняя молярная масса воздуха. М В = 29 кг/кмоль.
Если принять, что давление в помещении равно нормальному атмосферному
давлению (101,3 кПа) то плотность воздуха можно рассчитать по следующей
формуле:
ρВ =
29
, кг/м3,
V0 ⋅ (1 + 0,0037 ⋅ t Н )
где
V 0 - молярный объем при нормальных условиях, равный
22,4 м3/кмоль
С Р - теплоемкость воздуха, Дж/кг⋅К. Допускается принимать
С Р = 1,01 ⋅ 103 Дж/кг⋅К.
T Н - начальная температура воздуха, К.
К Н - коэффициент, учитывающий негерметичность помещения и неадиабатичность процесса горения. Допускается принимать К Н = 3.
Расчет избыточного
давления взрыва
пылей и смесей
Пример 12.4. Вычислить избыточное давление взрыва
в помещении, где обращается горючая пыль торфа.
Данные для расчета:
1. Характеристика горючего вещества.
Пыль торфа, дисперсностью 450 мкм.
Теплота сгорания Н Т = 10439 кДж/кг.
2. Характеристика помещения.
Длина l = 14 м,
ширина b = 12 м,
высота h = 6 м.
261
Температура воздуха в помещении t Н = 200С. Т Н = 293 К.
3. Характеристика оборудования и параметры технологического процесса.
Масса пыли в аппарате m АП = 40 кг.
В результате аварийной ситуации вся пыль поступила в помещение.
Решение:
1. Общая массу пыли в объеме помещения.
m ПЫЛИ = 40 кг .
2. Определяем избыточное давление взрыва ∆Р для пылей по
формуле:
m ⋅ Н Т ⋅ Р0 ⋅ Z
1
, кПа, где
∆P =
⋅
VСВ ⋅ ρ В ⋅ С Р ⋅ Т Н К Н
Для расчета нам известны следующие величины:
m = 40 кг;
Н Т = 10439 кДж/кг;
Р 0 принимаем равным 101 кПа;
Z = 0,5;
Теплоемкость воздуха С Р принимаем равной 1,01 ⋅ 103 Дж/кг⋅К = 1,01 кДж/кг⋅К.
Т Н = 293 К;
Коэффициент, учитывающий негерметичность и неадиабатичность процесса горения К Н
принимаем равным К Н = 3.
Остальные величины V СВ и ρ В необходимо рассчитать.
3. Определяем свободный объем помещения V СВ .
V СВ = V ПОМЕЩ ⋅ 0,8 = 14 ⋅ 12 ⋅ 6 ⋅ 0,8 = 806,4 м3.
4. Определяем плотность воздуха при данных условиях ρ ВОЗД .
101 ⋅ 22,4 293
VМ =
⋅
= 24 м3 /кмоль. Тогда
273
101
ρ В = 29 / 24 = 1,21 кг/м3.
( Этот же расчет можно провести по формуле
29
= 1,21 кг/м3. )
22,4 ⋅ (1 + 0,00367 ⋅ 20 )
5. Определяем избыточное давление взрыва пыли торфа в данном помещении, используя величины, полученные в п.п. 2 - 4.
ρВ =
40 ⋅ 10439 ⋅ 103 ⋅ 101 ⋅ 0,5 1
∆Р =
⋅ = 24 кПа.
806,4 ⋅ 1,21 ⋅ 1,01 ⋅ 103 ⋅ 293 3
В результате действия поражающих факторов взрыва происходит разрушение или повреждение зданий, сооружений, технологического оборудо-
262
вания, транспортных средств, элементов коммуникаций и других объектов,
гибель людей.
Предельно допустимое избыточное давление при сгорании газо-, пароили пылевоздушных смесей в помещениях или в открытом пространстве:
Таблица 12.2.
Избыточное давление, кПа
Степень поражения
Полное разрушение зданий
100
50 %-ное разрушение зданий
53
Средние повреждения зданий
28
Умеренные повреждения зданий (повреждение внутренних перегородок, рам, дверей и т.п.)
12
Нижний порог повреждения человека волной давления
5
Малые повреждения (разбита часть остекления)
3
Для сравнительной оценки уровня воздействия взрыва газо- паровоздушной смеси используется также тротиловый эквивалент взрыва.
Тротиловым эквивалентом взрыва называется условная масса тринитротолуола (тротила), взрыв которой адекватен по степени разрушения
взрыву парогазовой среды с учетом реальной доли участия во взрыве горючего вещества.
Тротиловый эквивалент взрыва определяется по формуле:
WТ =
0,4 QH
⋅
⋅ z ⋅ m , кг,
0,9 QТ
(12.5.)
где
0,4 – доля энергии взрыва парогазовой смеси, затрачиваемой непосредственно на формирование ударной волны;
0,9 – доля энергии взрыва тринитротолуола, затрачиваемой непосредственно
на формирование ударной волны;
Q H – удельная (низшая) теплота сгорания парогазовой среды , кДж/кг;
263
Q Т – удельная теплота взрыва ТНТ (q Т = 4240 кДж/кг);
z – доля приведенной массы паров, участвующей во взрыве.
В общем случае для неорганизованных парогазовых облаков в незамкнутом пространстве с большой массой горючих веществ доля участия во
взрыве может приниматься 0,1. В отдельных обоснованных случаях доля
участия веществ во взрыве может быть снижена, но не менее чем до 0,02.
Для производственных помещений (зданий) и других замкнутых объемов
значения z могут приниматься в соответствии с табл. 12.1.
Расчет тротилового
эквивалента взрыва
Пример 12.5. В производственном помещении находится аппарат с бензолом С 6 Н 6 . Масса жидкости в аппарате 20
кг. В результате аварии аппарат разрушен, жидкость поступила в помещение и полностью испарилась. Вычислить
тротиловый эквивалент взрыва паровоздушной смеси. Теплота сгорания бензола составляет 3169,4 кДж/моль.
Решение:
1. Определим низшую теплоту сгорания бензола
М(С 6 Н 6 ) = 78 кг/кмоль
3169,4 ⋅1000
= 40633 кДж/кг.
78
2. Для легковоспламеняющейся жидкости бензола в замкнутом помещении z = 0,3.
3. Рассчитаем тротиловый эквивалент взрыва
QН =
WТ =
0,4 40633
⋅
⋅ 0,3 ⋅ 20 = 25,6 кг
0,9 4240
Значения избыточного давления взрыва и тротилового эквивалента
взрыва используются для расчета радиуса зон разрушений.
Зоной разрушения считается площадь с границами, определяемыми
радиусами R, центром которой является рассматриваемый технологический
блок или наиболее вероятное место разгерметизации технологической системы. Границы каждой зоны характеризуются значениями избыточных давлений по фронту ударной волны ∆Р и соответственно безразмерным коэффициентом К. Классификация зон разрушения приводится в табл. 12.3.
264
Классификация зон разрушения
Класс зоны
разрушения
1
2
3
4
5
К
∆Р, кПа
3,8
5,6
9,6
28,0
56,0
≥100
70
28
14
≤2,0
Таблица 12.3.
Радиус зоны разрушения (м) в общем виде определяется выражением:
R= K⋅
3
WT
3180 2
1 +
WT
1/ 6
,
(12.6)
где
К — безразмерный коэффициент, характеризующий воздействие взрыва на
объект.
При массе паров т более 5000 кг радиус зоны разрушения может определяться выражением:
R = K ⋅ 3 WT .
(12.7)
Расчет радиуса
зон разрушений
Пример 12.6 . Определить радиус зон разрушений в помещении, где произошло разрушение аппарата с толуолом.
Условие примера 12.3.
Решение:
1. Определим низшую теплоту сгорания толуола
М(С 6 Н 5 СН 3 ) = 92 кг/кмоль
∆Нсгор = − 3771,9 кДж/моль
3771,9 ⋅ 1000
= 40999 кДж/кг.
92
2. Для легковоспламеняющейся жидкости бензола в замкнутом помещении z = 0,3.
3. Рассчитаем тротиловый эквивалент взрыва
QН =
0,4 40999
⋅
⋅ 0,3 ⋅ 37 = 47,7 кг
0,9 4240
4. В соответствии с расчетом в примере 12. 3.
∆ Р = 10,9 кПа
Тогда по таблице 12.3. класс зоны разрушений 4 и коэффициент К = 28.
WТ =
265
5. Радиус зоны разрушений составит:
R = 28 ⋅
3
47,7
3180 2
1 +
47,7
1/ 6
= 24,9 м.
12.4. Основные свойства и параметры ударной волны
Ударная волна является одним из основных поражающих факторов взрыва. Как правило, при воздушном взрыве форма фронта волны является сферической и при достижении земной поверхности отражается от нее
(рис.12.3.)
П
О
П
Э
О
Ближняя зона
П
П
О
Г
Г
Дальняя зона
Рис. 12.3. Схема волнообразования при воздушном взрыве.
П – фронт падающей волны; О – фронт отражённой волны; Г – фронт головной ударной волны; Э – эпицентр волны.
На некотором расстоянии от эпицентра взрыва фронт отраженной
волны сливается с фронтом падающей волны, вследствие чего образуется
так называемая головная волна с вертикальным фронтом, распространяющимся вдоль земной поверхности. Ближняя зона, где отсутствует слияние
фронтов, называется зоной регулярного отражения, а дальняя – зоной нерегулярного отражения. В ближней зоне давление ударной волны очень высокое и без применения специальных мер защиты имеет место 100% характер
266
разрушений. Дальняя зона представляет интерес с точки зрения установления
зоны поражающего действия.
Важнейшими характеристиками ударной волны являются избыточное
давление в волне и скорость напора. Эти характеристики определяют разрушающую способность ударной волны. На рис.12.4. показано изменение
давления в ударной волне от времени.
Р
ΔРФ
РФ
ΔР
Р0
0
τ+
Фаза сжатия
τ-
τ
Фаза разрежения
Рис.12.4. Характер изменения давления от времени в ударной волне.
Фронт ударной волны при переходе в какую-нибудь точку на земной
поверхности повышает давление в этой точке до максимального значения –
Р ф, а затем убывает до атмосферного давления Р 0 . , и далее достаточно длительный период времени остается ниже атмосферного давления.
Период, обозначенный на рис.8 «τ + », повышенного давления, для которого характерно ΔР= Р – Р 0 > 0, называется фазой сжатия, а период, обозначаемый «τ - », характеризующейся понижением давления ΔР < 0, называется τ фазой разрежения.
267
Время нахождения в фазе сжатия принято называть длительностью
импульса.
С ростом давления в ударной волне одновременно возникает движение
воздушных масс от эпицентра взрыва. Движение воздушных масс, их массовые скорости (U) и изменение плотности среды ( ρ ) – подобны и изменяются
по одинаковым законам. Однако вследствие инертности воздушного потока
период времени «τ +скор. » скоростного потока несколько больше, чем период
времени «τ +давл » давления. По мере удаления от эпицентра взрыва динамические характеристики ударной волны уменьшаются, и на значительном расстоянии ударная волна превращается в акустическую. Скорость ударной
волны больше скорости звука, поэтому разрушение происходит гораздо
раньше, чем возникает звуковой эффект.
Основными параметрами, определяющими интенсивность ударной
волны, являются избыточное давление на фронте (Р ф ) и длительность фазы сжатия (τ + ). Эти параметры зависят от количества взрывчатой массы, химической природы взрывающегося вещества, места расположения взрывающегося устройства над уровнем земли, условиями взрыва и расстоянием до
эпицентра.
Все параметры подчиняются закону подобия, и это позволяет определить их для любого взрывчатого вещества. Например, одинаковые параметры
во фронте ударной волны могут находиться на приведенных по тротиловому
эквиваленту расстояниях R , м/кг1/3 и приведенных высот H по формулам:
R = R3 c ;
H =3 c,
(12.8)
где R – приведенное расстояние, м;
R – расстояние от эпицентра до фронта ударной волны;
с – тротиловый эквивалент, кг.
Удельный импульс ударной волны (I, кПа·с) является важной характеристикой, определяющей эффект механического воздействия на пути ее
продвижения. Для фазы сжатия удельный импульс ударной волны может
быть найден по формуле:
268
τ+
I = ∫ ∆Ρ(τ )∂τ = Α ⋅ с 2 / 3 / R ,
(12.9 )
0
где А ≈ 0.4,
∆Ρ(τ ) – функция, характеризующая изменение избыточного дав-
ления за фронтом ударной волны во времени.
Из подобия I 1 и I 2 , соответственно на расстоянии R 1 и R 2 , следует,
что:
I 2 = I 1 3 с2 / с1
(12.10)
Избыточное давление во фронте сферической ударной волны можно
определить по формуле:
∆Ρф =
0.084 0.27 0.7
+ 2 + 3
R
R
R
(12.11)
где R – расстояние от эпицентра, м;
WТ – тротиловый эквивалент взрыва, кг.
Безопасное расстояние по действию ударной волны может быть определено
по эмпирическому уравнению:
Rбез = 153 WТ ,
(12.12)
где R без – безопасное расстояние, м;
WТ – тротиловый эквивалент взрыва, кг.
12.5. Условия возникновения детонации и зажигания
ударной волной
Если поменять инертный газ в трубе на однородную горючую смесь,
то при сжатии под воздействием волны смесь будет разогреваться и воспламеняться. Причем, в некоторых случаях горючая смесь будет разогреваться
даже выше температуры самовоспламенения. Ударная волна в инертном газе
постепенно затухает, в горючей смеси этого не происходит. Это объясняется
269
тем, что при горении смеси в ударной волне продукты горения, расширяясь,
действуют как своего рода поршень, последовательно сжимая слои свежей
горючей смеси, вызывая их зажигание. Тем самым продукты горения передают импульс давления все дальше и дальше по горючей смеси, поддерживая
и распространяя ударную волну, и, вместе с тем, фронт пламени. Такой режим горения называется детонационным.
Существует несколько теорий детонационного горения. Наибольшее
признание получила так называемая гидродинамическая теория, предложенная Чампеном и Жуге. Сущность этой теории состоит в следующем.
Плоская (ударная волна) двигается по трубе со скоростью U , вместе с
ней движется фронт пламени. Оси координат перемещаются с фронтом пламени, т.е. фронт пламени оказывается как бы неподвижным, навстречу ему
движется холодная исходная горюющая смесь.
С
А
ПГ
Исходная смесь
(P 2 ,V 2 , T 2 , U 2 , E 2 )
(P 1 ,V 1 , T 1 , U 1 , E 1 )
Д
В
Рис.12.5. Волна детонации по Чампену и Жуге.
Массу газа, проходящего через сечения АВ, можно вычислить по уравнению:
m1 = U 1 S ∂τ
1
V1
(12.13)
где τ – время, сек;
S – площадь поперечного сечения трубы, м2;
V – удельный объем газа, м3/кг;
U – скорость потока газа, м/с.
Масса газа, проходящая через сечение СД равна:
m2 = U 2 S ∂τ
1
V2
Так как m 1 = m 2 , то получаем уравнение:
(12.14)
270
U1 U 2
=
V1 V2
(12.15)
Уравнение (12.15) является первым из пяти уравнений, характеризующих детонацию.
Второе уравнение – это уравнение сохранения количества движения:
U1
U1
U
+ P1 = U 2 2 + P2
V1
V2
(12.16)
Третье уравнение – это уравнение сохранения энергии:
2
E 1+
2
U1
U
+ P1V1 = E 2 + 2 + P2V2
2
2
(12.17)
Четвертым уравнением является уравнение состояния идеального газа:
P2V2 = n2 RT2
Пятое уравнение
(12.18)
составляется на основании уравнений механики и
гидродинамики, и носит название адиабаты Гюгонио:
∂P
P2 − P1
= − 2
V2 − V1
∂V2 ад
(12.19)
Главным вопросом в теории возникновения детонации является переход от нормального (дефлаграционного) горения с относительно небольшими
скоростями пламени к детонационному горению. В переходной области многократно возрастают скорости движения фронта пламени и давление в зоне
реакции.
Рассмотрим теорию возникновения детонации, разработанную академиком Зельдовичем.
Предположим, что распространение пламени происходит в длинной
трубе постоянного сечения при воспламенении у закрытого конца. В результате горения газовой смеси, сопровождающегося резким увеличением объема
газа, возникает движение смеси перед фронтом пламени. На рис. 12.6. пока-
271
зана схема изменения давления в трубе в зависимости от ее длины по Зельдовичу.
I
Р
(давление)
II
Сжатая
движущаяся
смесь
Продукты реакции
Исходная смесь
0
I
II
L
(длина трубы)
Рис.12.6. Схема изменения давления в трубе по Зельдовичу.
Давление пламени со скоростью U вызывает движение смеси со скоростью (n-1)U, где n – коэффициент, характеризующей изменение объема газа
при горении и зависящей от соотношения температур и числа молекул до и
после реакции ( обычно n ≈ 5 – 10).
Участок трубы 0 – I занят покоящимися продуктами горения, участок I
I – II – занят исходной смесью, движущейся со скоростью (n-1)U, остальная
часть трубы справа от поверхности II занята покоящейся исходной смесью.
При этом поверхность I – I – фронт пламени, движущейся со скоростью nU
по отношению к началу координат и со скоростью U относительно движущейся сжатой смеси. Поверхность II – II представляет собой фронт ударной
волны.
Вследствие торможения слоев газовой смеси у стенок трубы во время
движения пламени происходит увеличение поверхности фронта горения и
увеличение скорости газа в центре трубы. Пламя принимает форму конуса
(рис. 12.7.) с вершиной, направленной в сторону движения газовой смеси.
272
ΔР
Рис.12.7 Форма пламени при горении в трубах
Такое изменение поверхности пламени приводит к увеличению количества сгораемой в единицу времени смеси и вызывает еще более ускоренное
движение исходной смеси.
Таким образом, Зельдович считает конкретным механизмом ускорения
горения прогрессивное растяжение фронта горения. При переходе горения
в детонацию движение потока всегда турбулентно. В результате воздействия
на фронт пламени турбулентных пульсаций поверхность горения значительно увеличивается. По мере увеличения скорости пламени увеличивается давление в ударной волне, с ростом давления увеличивается температура газовой смеси, которая, в конечном счете, достигает температуры воспламенения
смеси, и фронт пламени начинает перемещаться вместе с ударной волной.
Скорость распространения пламени при детонации целиком и полностью будет определяться скоростью распространения ударной волны:
U дет. = U ПГ + U звука
(12.20)
где U дет. - скорость распространения пламени при детонации, м/с;
U ПГ – скорость продуктов горения, м/с;
U звука – скорость звука в продуктах горения, м/с.
Скорость детонации в реальных горючих газовых системах может превышать 1 км/с. Опыт показывает, что для водорода, например,
U дет = 2820 м/с.
В настоящее время считают, что детонировать могут почти все газообразные воздушно-углеводородные смеси. Практические аспекты взрывной
защиты учитывают скорость горения смеси, время протекания взрыва, ско-
273
рость нарастания давления и максимальное давление взрыва в замкнутом
пространстве. Основные характеристики могут быть вычислены с достаточной для практики точностью. Любой емкостной аппарат с горючей жидкостью может быть разрушен в результате взрыва парогазовоздушной смеси, и
поэтому требует специальных мер защиты. Так, например, в конструкции резервуаров для хранения нефтепродуктов имеется слабое соединение, которое
разрушается в случае возникновения взрыва (рис.12.8.)
Сварной ослабленный шов
крыша
стенка
Рис. 12.8. «Слабое место» резервуара РВС для сохранения от разрушения боковых стенок.
Считается, что современная форма и сравнительно небольшие размеры
резервуаров для нефтепродуктов таковы, что в них реализуется только дефлаграционный взрыв, а детонация не происходит. Однако с увеличением
размеров резервуара ситуация может измениться.
Для детонационного взрыва, неподдающегося точному расчету, характерны три особенности:
- он создает пик давления примерно в 20 раз больше пика давления
нормального взрыва при тех же начальных условиях;
274
- фронт детонации распространяется со сверхзвуковой скоростью, что
делает бесполезными устройства стравливания давления;
- детонация дает прямой удар особо разрушающей силы, Ане гидростатическое давление.
На рис.12.9. показано принципиальное различие обычного дефлаграционного взрыва и детонационного взрыва в цилиндрической емкости
1.
4,2 кг/см2
2.
4,2 кг/см2
4,2 кг/см2
Продукты горения
7 кг/см2
49 кг/см2
Исходная
смесь
1,05 кг/см2
Рис. 12.9. Дефлаграционный и детонационный взрывы:
1- Дефлаграционный взрыв. Давление во всех точках
внутри сосуда через 10 секунд после взрыва составляет 4,2 кг/см2.
2- Детонационный взрыв. Давление через 3 секунды
после взрыва.
Давление при детонации достигает существенно более высоких значений. Защита от разрушений в этом случае практически невозможна.
До недавнего времени считалось, что детонация присуща лишь быстро
сгорающим смесям, к которым относятся: смеси водорода с кислородом или
воздухом; смеси непредельных углеводородов с кислородом или воздухом;
смеси предельных углеводородов с кислородом. Предельные углеводороды с
воздухом детонируют только в условиях высокой турбулентности.
275
В настоящее время считают, что могут детонировать практически все
газообразные углеводороды в воздухе.
Основным критерием возможности детонации в трубопроводах и сосудах малого диаметра (при атмосферном давлении, без турбулентности при
начальных условиях) является отношение длины к диаметру. В таблице 12.4.
приведены минимальные отношения для некоторых горючих сред.
Таблица 12.4.
№
Горючая смесь
2.
Предельные углеводороды - воздух
Водород – воздух
3.
Водород - кислород
1.
Минимальное отношение длина/диаметр для детонации
75
50
10
Преддетонационное расстояние резко сокращается при наличии на пути пламени различного рода турбулизаторов. В трубопроводах это могут
быть продукты коррозии, диафрагмы, задвижки, вентили и т.п., в узостях –
трубопроводы и запорно-регулирующая арматура, конструкции этажерок,
лестницы, трапы и др.
Как и дефлаграция, детонация газовых систем возможна только в определенной области концентраций горючего и окислителя, причем области
воспламенения. В таблице 12.5. приведены КПР пламени при дефлаграционном и детонационном режимах горения некоторых горючих систем.
Таблица 12.5.
Концентрационные пределы распространения пламени
при дефлаграции и детонации
Горючая смесь
КПР, % об.
Дефлаграция
Детонация
Н 2 + воздух
4,0 – 75
15,0 – 63.5
С 2 Н 4 + воздух
2,7 – 35
5,5 – 11.5
276
С 2 Н 2 + воздух
2,5 – 80
4,2 – 50.0
С3Н8 + О2
2,3 – 55
3,2 – 37.0
С 4 Н 10 + О 2
1,8 – 49
2,9 –31.3
(С 2 Н 5 ) 2 О + О 2
2,0 – 82
2.7 – 40.0
Как видно из таблицы, круг горючих веществ, способных образовывать
детонирующие смеси, достаточно широк, причем способность их к детонации повышается в смесях с кислородом. Несмотря на то, что концентрационные пределы детонации несколько уже дефлаграционных, следует всегда
иметь в виду, что опасность детонации от этого не снижается, и последствия
ее всегда катастрофичны.
.
12.6. Взрывчатые вещества
Вещество называют взрывчатым, если оно обладает способностью
моментально по всей своей массе разлагаться с выделением значительного
количества тепла и образовывать газообразные продукты. Или другими словами, вещества, способные к химическим реакциям, сопровождающимся
взрывом, называют взрывчатыми веществами (ВВ).
Например, взрыв 1 кг тротила (тринитротолуола) происходит за одну
стотысячную долю секунды. При этом образуются газы, объем которых при
нормальных условиях (00С) составляет 700 л. Известно, что при нагревании
на один градус объем газа увеличивается на 1/273 первоначального объема.
Температура взрыва достигает 30000С, и при этих условиях объем этих
газов составит 8400 л (в 12 раз больше).
Тротил имеет плотность 1,6 кг/л, т.е. 1 кг занимает объем
V тр = 1/1,6 = 0,66 л.
Вследствие огромной скорости реакции и большой скорости ее распространения по веществу образующиеся газы не успевают заметно расшириться и занимают в момент образования тот объем, который занимало твердое
277
вещество. В этом случае давление продуктов взрыва в этом объеме должно
быть равно Р = 8400/0,66 = 13000 атм.
Поскольку такое давление возникает за очень малый промежуток времени, то оно действует как резкий удар огромной силы, который вызывает
разрушение или отбрасывание предметов, окружающих заряд взрывчатого
вещества.
Таким образом, для конденсированных взрывчатых веществ отношение объема продуктов горения к объему твердого вещества может достигать
значений 8 – 9, в этом случае вклад этого фактора становится определяющим.
Именно поэтому давление взрыва конденсированных взрывчатых веществ
намного больше, чем паровоздушных смесей. Расчет давления взрыва для
конденсированных взрывчатых веществ может быть сделан с использованием
следующего уравнения:
Ρвзр =
Ρ0 ΤвзрVПГ
Τ0VТв. В. В.
Па ,
(12.21)
где Р 0 – начальное давление, Па;
Т взр. – температура взрыва, К;
Т 0 – начальная температура взрыва, К;
V ПГ – объем газообразных продуктов взрыва, м3;
V Тв.В.В. – объем исходного твердого вещества, м3.
Химические превращения ВВ могут протекать в различных формах, а
именно в форме термического распада, горения и детонации.
Основное отличие детонации от горения заключается в том, что разогрев, вызывающий реакцию, передается не теплопроводностью, а ударной
волной. Передача энергии волной происходит намного быстрее, чем теплопроводностью.
278
Таблица 12.6
Параметры детонационной волны некоторых ВВ
Название
ВВ
Тротил
(литой)
Тротил
(прессов)
Гексоген
Плотность, г/см3
Скорость Давление
начальная Во фронте детонации, детонации,
м/с
Н/м2
детонац.
волны
Скорость
потока среды за фронтом детонации,
м/с
1,45
1,93
6500
157⋅108
1625
1,59
2,12
6900
193⋅108
1725
1,62
2,16
8100
296⋅108
2025
Взрывчатыми могут быть только те вещества, при химическом превращении которых выделяется теплота. Количество тепла, выделяющееся при
взрывном разложении вещества, может также служить характеристикой ВВ.
Таблица 12.7
Теплота взрыва некоторых ВВ
Взрывчатое вещество
Тротил (ТНТ)
Гексоген
Тэн
Пикрат аммония
Аммотол 50/50
ТГ 36/64 (ТНТ/гексоген)
Порох дымный
Теплота взрыва Q V
МДж/кг
4,24
5,54
5,88
3,36
4,20
4,80
2,79
Q V /Q ТНТ
1
1,31
1,39
0,79
0,99
1,39
0,66
Полная работа взрыва определяется следующими факторами:
1. Работа взрыва тем больше, чем больше соотношение объема газов
после и до взрыва (конечного и начального объемов).
2. Чем выше значение теплоты взрыва Q V , тем больше работа взрыва.
3. Чем меньше теплоемкость продуктов взрыва, тем больше работа
взрыва.
279
4. Так как теплоемкость растет с увеличением числа атомов в молекуле,
то выгоднее иметь в составе продуктов взрыва больше двухатомных газов
(например, азота N 2 ); вместе с тем, чем больше двухатомных газов, тем
больше объем продуктов взрыва, что тоже приводит к увеличению работы
взрыва.
5. Твердые вещества обладают большой теплоемкостью. Чем больше в
продуктах взрыва твердых веществ, тем больше общая теплоемкость продуктов взрыва и тем меньше работа взрыва.
12.6.1. Краткие сведения об основных взрывчатых веществах
В зависимости от чувствительности к внешним воздействиям и способности к переходу от горения к детонации взрывчатые вещества разделяются на три основные группы ВВ.
Инициирующие, или первичные ВВ используются для возбуждения
детонации или горения взрывчатых веществ других групп. Горение и детонация инициирующих ВВ происходит при незначительной затрате внешней
энергии в результате теплового или механического воздействия (нагревание,
удар, трение).
Бризантные, или вторичные ВВ используются для изготовления разрывных снарядов боеприпасов и для взрывных работ. Горение их переходит
в детонацию только при определенных условиях (например, при горении
большой массы вещества с большим числом пор или при горении в замкнутом прочном сосуде). При применении бризантных ВВ детонацию их вызывают с помощью взрыва вспомогательного заряда инициирующего (первичного) ВВ или с помощью взрыва заряда другого бризантного ВВ.
Пороха, или метательные ВВ используются в качестве метательных
зарядов для огнестрельного оружия и в качестве топлива для реактивных
двигателей. По составу они близки к бризантным ВВ, но горение их более
устойчиво. Горение порохов не переходит в детонацию даже при давлении в
несколько тысяч атмосфер.
280
При определенных условиях (например, при воздействии на них достаточно мощного начального импульса или если диаметр их больше критического) пороха могут детонировать. Некоторые из порохов имеют большой
критический диаметр, и, кроме того, детонация порохов возможна только при
взрыве мощного детонатора, - по этим причинам возникло мнение, что пороха не могут детонировать.
Инициирующие взрывчатые вещества
Гремучая ртуть [Hg(CNO) 2 ] – соль гремучей кислоты HCNO, фульминат ртути - белый или серый кристаллический порошок с плотностью 4,4
г/ см3. Температура вспышки 175 – 1800С. Легко взрывается от незначительного удара и трения. Разложение гремучей ртути происходит в соответствии
с уравнением
[Hg(CNO) 2] → Hg + 2CO + N 2 + 494 кДж.
Может гореть, но горение легко и быстро переходит в детонацию. Известны случаи детонации в результате падения коробки с сухой гремучей
ртутью, в результате падения какого-либо предмета на рассыпанную гремучую ртуть и т.д.
Азид свинца [Pb(N 3 ) 2 ] – соль азотистоводородной кислоты HN 3 , белый
порошок с плотностью 4,8 г/ см3 и температурой вспышки 330-3400С.
Обладает высокой чувствительностью. Известны случаи, когда азид
свинца взрывался в результате нажима ногтем на его кристаллы. Для уменьшения чувствительности его флегматизируют парафином.
Бризантные взрывчатые вещества
Бризантные ВВ могут быть однородными и неоднородными (взрывчатые смеси).
I. Однородные бризантные ВВ
По химическому строению однородные бризантные ВВ разделяются на
2 группы: нитросоединения и нитроэфиры.
281
НИТРОЭФИРЫ – азотнокислые нитраты спиртов или углеводов.
1. Азотнокислые эфиры углеводов: главным представителем этих ВВ
являются нитраты целлюлозы (нитроклетчатки). В зависимости от содержания азота делят на две разновидности: пироксилины (содержание азота 12
– 13,5 %) и коллоксилины (содержание азота 11,5 – 12 %).
Нитроцеллюлоза и пироксилин были открыты в 1832 г. Браконо. В
1846 – 1848 г.г. Г.И. Гесс и А.А. Фадеев исследовали свойства пироксилина и
показали, что он по мощности в несколько раз превосходит дымный порох.
Взрывное разложение пироксилина может быть представлено уравнением:
2C 6 H 7 O 2 (ONO 2 ) 3 → 3N 2 + 9СО + 3СО 2 + 7Н 2 О.
При взрыве 1 кг пироксилина совершается работа, равная подъему 470
тонн на высоту 1 метр.
Пироксилин применяется для изготовления пироксилиновых порохов.
По чувствительности пироксилин близок к гексогену. Сухой пироксилин при
плотности 1,3 г/см3 имеет скорость детонации около 6500 м/с.
Коллоксилин менее чувствителен, чем пироксилин, и опасен главным
образом в пожарном отношении. Хранят нитроклетчатку во влажном состоянии (с содержанием влаги до 30 %).
Коллоксилин используют для получения лаков, целлулоида.
2. Азотнокислые эфиры спиртов.
Глицеринтринитрат (нитроглицерин)[C 3 H 5 (ONO 2 ) 3 – маслянистая
жидкость плотностью 1,6 г/мл, с температурой вспышки 1800С. Впервые
был получен итальянским химиком Собреро в 1846 г.
Чистый, не содержащий кислотных примесей нитроглицерин менее
взрывчат, и более прочен.
Нитроглицерин очень чувствителен к механическим воздействиям
(толчкам, ударам, зажиганию гремучей ртутью). От пламени загорается с
трудом и сгорает без взрыва.
282
При взрыве 1 г нитроглицерина образует 467 см3 газов, а 1 л – 750 л газов (порох только 280 л).
Чтобы сделать нитроглицерин менее опасным при хранении, транспорте и применении, а также для лучшего использования его взрывной силы, его
смешивают с кизельгуром (панцири инфузорий, инфузорная земля) и получают твердый динамит. 100 г кизельгура впитывает 75 г нитроглицерина.
Готовый динамит без взрыва переносит толчки, падение, трение. Однако внезапное нагревание, взрыв гремучей ртути может привести к взрыву.
Так же как и нитроглицерин, динамит не следует доводить до замерзания, которое происходит при – 40С. Оттаивание можно проводить только
очень медленно с помощью влажного, умеренно теплого песка. Замерзший
динамит нельзя подвергать резкому нагреванию (пламенем, искрами и даже
комнатной температурой).
НИТРОСОЕДИНЕНИЯ представляют собой важнейший класс бризантных ВВ. Они характеризуются значительным фугасным и бризантным
действием при малой чувствительности к механическим воздействиям. Эти
вещества особенно пригодны для снаряжения артиллерийских снарядов и
других боеприпасов. Достоинством этих соединений является их химическая
стойкость.
Тротил или тринитротолуол [C 6 H 2 CH 3 (NO 2 ) 3 – желтый кристаллический порошок или чешуйки. Плотность 1,66 г/см3, температура вспышки
3000С. Температура затвердевания чистого ТНТ 80,850С, поэтому часто его
используют в плавленом виде.
Литой тротил детонирует не от капсюля-детонатора, а только в результате взрыва промежуточного детонатора из прессованного бризантного ВВ.
Скорость детонации до 6900 м/с.
Насыпной тротил более чувствителен к детонации, чем литой.
283
Горение тротила обычно не переходит в детонацию, однако если оно
протекает в замкнутом сосуде с прочными стенками или в больших массах
тротила, то возможна детонация.
Тротил не реагирует с металлами, но может реагировать со щелочами,
образуя тротилаты. Тротилаты менее опасны, чем пикраты, но при их образовании выделяется значительное количество тепла, что может привести к
возгоранию. Зарегистрирован случай воспламенения тротила в результате
контакта с мыльной эмульсией.
Хотя горение тротила, как и других ВВ, происходит за счет кислорода,
находящегося в самом тротиле, горящий тротил можно и нужно тушить
водой. Вода, попадая на него, испаряется, на испарение требуется много
тепла, поэтому температура продуктов горения уменьшается. Из-за недостатка тепла следующие слои не нагреваются до температуры вспышки, и горение прекращается.
Тротил является основным бризантным взрывчатым веществом для
снаряжения боеприпасов. Его применяют в значительных количествах в
сплавах с другими нитросоединениями: с гексогеном для снаряжения кумулятивных снарядов малого калибра; с 20 % динитронафталина под названием
К-2; с 5 % ксилила под названием сплава Л и др. Из тротила готовят патроны
и шашки для взрывных работ, в военное время применяли в смеси с селитрой.
Гексоген или циклотриметилентринитрамин [C 3 H 6 O 6 N 6 ] - белое
/ NO 2
Н2С N
/
\
NO 2 -N
CH 2
\
/
H2C N
\NO 2
кристаллическое вещество с температурой вспышки 2300С, температурой плавления 202,50С. Чрезвычайно чувствительно к удару, скорость детонации
8500 м/с. Из-за свой высокой чувствительности в чистом виде не употребляется для изготовления зарядов, а используется флегматизированный гексоген.
284
Чтобы различить флегматизированный гексоген, в флегматизатор добавляют оранжевый краситель.
Нефлегматизированный гексоген используется для снаряжения боеприпасов в сплавах с тротилом. В этом случае тротил является флегматизатором. Такие смеси менее чувствительны, чем гексоген, и обладают большей
мощностью, чем тротил.
II. Неоднородные бризантные ВВ.
К неоднородным бризантным ВВ относятся смеси окислителя с взрывчатым веществом или горючим.
1. Аммиачно-селитренные ВВ, содержащие в качестве окислителя аммиачную селитру NH 4 NO 3 – аммониты.
Аммониты, состоящие из смеси тротила с селитрой, содержащие более
20 % тротила, называются аммотолами. По чувствительности и опасности
при изготовлении эти вещества опаснее тротила.
Аммоналы – аммониты, содержащие алюминиевую пудру. Эти смеси
могут загораться при соприкосновении с водой. Тушить водой при загорании
категорически запрещается.
Динамоны - смеси аммиачной селитры с горючими невзрывчатыми
добавками (сухим торфом, древесной корой и т.д.).
III. Метательные взрывчатые вещества, или пороха.
Для этих веществ характерным видом взрывного превращения является
горение, не переходящее в детонацию даже при высоких давлениях, которое
развивается в условиях выстрела. Эти вещества используются для сообщения
пуле или снаряду движения в канале ствола оружия и для сообщения движения ракетным снарядам.
Для возбуждения горения порохов необходимо действие на них пламени.
285
Пороха разделяются на две группы: пороха – механические смеси (и
как разновидность - твердые ракетные топлива) и пороха на основе нитроклетчатки.
1. Пороха – механические смеси.
До недавнего времени из этой группы веществ наиболее значительное
практическое применение находил дымный (черный или охотничий) порох.
Черный порох был изобретен в Китае 800 г. до н.э.
Дымный порох состоит из гранул темно-зеленого или черного цвета.
Он состоит из 75 % селитры (чаще калийной КNO 3 ), 10-12 % угля и 12-16 %
серы. Воспламеняется при температуре 270 – 3000С, развивает температуру
при взрыве 22000С, скорость горения до 300 м/с и давление до 6000 атмосфер.
Горение черного пороха можно представить следующим уравнением:
2KNO 3 + 3C + S → N 2 + 3CO 2 + K 2 S (тв)
При горении пороха селитра разлагается с выделением кислорода. Этот
кислород необходим для горения угля и серы, которые играют роль горючего. Сера, кроме этого, является цементатором – цементирует частица угля и
селитры.
Дымный порох мало чувствителен к удару, но очень чувствителен к
пламени, он загорается в результате воздействия даже незначительной искры.
Известны случаи воспламенения пороха в результате образовавшейся фрикционной искры от трения обуви с металлическими гвоздями о цементный
пол.
Порох воспламеняется при соприкосновении с пламенем, раскаленными телами, электрической искрой при нагревании до 2700С, фрикционных
искр.
Самопроизвольно порох может взрываться только в том случае, если
селитра содержит примеси хлора.
Чувствительность пороха значительно уменьшается в присутствии влаги. При содержании влаги 15 % порох теряет способность к воспламенению.
286
Задания для самоконтроля
1. Что называется взрывом?
2. Приведите примеры физических и химических взрывов.
3. В чем различие механизмов дефлаграционного и детонационного горения?
4. Что называется максимальным давлением взрыва?
5. Что называется избыточным давлением взрыва?
6. Что такое тротиловый эквивалент взрыва?
7. Приведите примеры конденсированных взрывчатых веществ?
8. Как выглядит характер изменения давления от времени в ударной волне?
9. Назовите основные параметры, определяющие интенсивность ударной волны.
10. От чего зависит избыточное давление и длительность фазы сжатия в ударной
волне?
11. Перечислите 5 основных уравнений, характеризующих детонацию.
12. Назовите основную причину ускорения горения при переходе в детонацию.
13. Назовите основной критерий возможности детонации в трубопроводах.
14. Приведите пример технического устройства защиты от взрыва.
15. Вычислите максимальное давление взрыва нафталина С 8 Н 10 , если начальная
температура 300С, начальное давление 0,1 МПа, температура взрыва 17000С.
16. Вычислите максимальное давление взрыва материала, состоящего из 80% углерода и 20 % водорода, если начальная температура 250С, начальное давление 110 кПа,
температура взрыва 14000С.
17. Вычислить избыточное давление взрыва паров этилацетата С 4 Н 10 О 2 , если в помещении размерами 15×10×6 м было разлито 30 л жидкости. Температура 250С, скорость
воздушного потока в помещении 0,3 м/с.
18. Рассчитать тротиловый эквивалент взрыва 50 кг пропана.
287
Приложение 1
Стандартные энтальпии образования и энтропии
некоторых веществ при 298 К
№
п/п
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
24.
25.
26.
27.
28.
29.
30.
31.
32.
33.
34.
Вещество
Углекислый газ СО 2 (г)
Вода Н 2 О (г)
Азот N 2 (г)
О 2 (г)
Бутан С 4 Н 10 (г)
Пентан С 5 Н 12 (г)
Гексан С 6 Н 14 (ж)
Гептан С 7 Н 16 (ж)
Октан С 8 Н 18 (ж)
Циклопентан С 5 Н 10 (г)
Циклогексан С 6 Н 12 (г)
Ацетилен С 2 Н 2 (г)
Этилен С 2 Н 4 (г)
Пропен С 3 Н 6 (г)
Бутен-1 С 4 Н 8 (г)
Бутадиен-1,3 С 4 Н 6 (г)
Бензол С 6 Н 6 (ж)
Толуол С 7 Н 8 (ж)
о- Ксилол С 8 Н 10 (ж)
м-Ксилол С 8 Н 10 (ж)
Метиловый спирт СН 3 ОН (ж)
Этиловый спирт С 2 Н 5 ОН (ж)
Пропиловый спирт С 3 Н 7 ОН (ж)
Изопропиловый спирт С 3 Н 8 О(ж)
Метаналь НСОН (г)
Этаналь СН 3 СОН (г)
Муравьиная кислота НСООН (ж)
Уксусная кислота СН 3 СООН (ж)
Ацетон СН 3 СОСН 3 (ж)
Этилацетат СН 3 СООС 2 Н 5 (ж)
Глицерин С 3 Н 8 О 3 (ж)
Диметиламин (СН 3 ) 2 NH
Анилин С 6 Н 5 NH 2
Нитробензол С 6 Н 5 NО 2
∆Н0 обр.,
кДж/моль
- 393,5
- 241,8
0
0
- 126,2
- 146,4
- 198,8
- 224,4
- 208,5
- 77,2
- 123,1
226,8
52,3
20,4
- 0,13
110,2
49,1
12,0
19,0
17,2
- 238,7
- 277,6
- 306,9
- 320,3
- 115,9
- 166,4
- 409,2
- 487,0
- 248,3
- 463,2
- 659,4
- 27,6
35,3
15,9
S0, Дж/моль⋅К
213,7
188,7
191,5
205,0
310,1
348,9
295,9
328,5
466,7
292,9
298,2
200,8
219,4
266,9
305,6
278,7
173,2
219,6
352,8
357,7
126,7
160,7
192,9
179,9
220,1
265,7
128,9
159,8
155,4
259,0
207,9
273,2
191,6
244,3
288
Приложение 2
Низшая теплота сгорания некоторых сложных веществ
Вещество
Антрацит
Бензин
Бумага
Бурый уголь
Винипласт
Волокно
вискозное
капроновое
лавсан
нитрон
Древесина
свежая W= 50 %
воздушносухая
Ископаемый
Уголь
Карболит
Каучук
натуральный
синтетический
Капролактам
Керосин
Q Н , кДж/кг
31425
46928
13408
8380 - 25140
18105
15512
31132
22584
30755
7150
14665
25140 - 35615
25978
42319
37710
29749
41481 - 46090
Вещество
Кинопленка
триацетатная
целлулоидная
Кокс
Крахмал
Мазут
Масло
соляровое
Нефть сырая
Пенополиуретан
Полипропилен
Полистирол
Полиэтилен
Резина
Сланцы
Оргстекло
Топливо Т-1
Топливо Т-2
Торф сухой
Торф W = 10 %
Целлюлоза
Q Н , кДж/кг
18779
16760
29330 - 33520
17510
38129 - 41900
43069
43576 - 46090
24320
45671
38967
47138
33520
5782 - 11564
27737
42948
43157
27654
16613
17300
289
Приложение 3
Энтальпия (теплосодержание) газов при постоянном давлении
Температура,
t0С
100
200
300
400
500
600
700
800
900
1000
1100
1200
1300
1400
1500
1600
1700
1800
1900
2000
2100
2200
2300
2400
2500
2600
2700
2800
2900
3000
Теплосодержание, кДж/кмоль
О2
N2
воздух
СО 2
Н2О
SO 2
2956,0
5991,7
9125,8
12360,5
15678,9
19072,9
22521,2
26019,9
29564,6
33142,9
36750,5
40391,6
44036,9
47724,1
51453,2
55182,3
58953,3
62766,2
66579,1
70392,0
74246,8
78101,6
81998,3
85936,9
89875,5
94015,2
97857,4
101833,7
106124,2
110113,2
2917,0
5849,3
8819,9
11849,3
14945,7
18104,9
21331,3
24616,2
27955,7
31337,0
34760,2
38221,2
41719,8
45252,0
48771,6
52375,0
55936,5
59539,9
63143,3
66788,6
70433,9
74121,1
77766,4
81453,6
85140,8
89003,9
92653,5
96437,0
100488,7
103828,2
2917,5
5866,0
8861,8
11924,7
15058,8
18255,8
21524,0
24842,5
28211,3
31621,9
35074,5
38560,6
42067,6
45629,1
49190,6
52794,0
56397,4
60000,8
63646,1
67333,3
71020,5
74707,7
78394,9
82124,0
85853,1
89330,8
93105,9
96789,0
100488,7
104205,3
3814,1
8019,6
12536,5
17313,1
22303,4
27473,8
32795,1
38237,9
43785,5
49442,0
55140,4
60922,6
66788,6
72654,6
78562,5
84554,2
90545,9
96579,5
102613,1
108646,7
114722,2
120839,6
126915,1
133032,5
139149,9
145325,9
151481,1
157560,7
163795,5
169946,4
1281,7
6829,7
10378,6
14044,9
17828,4
21733,5
25772,7
29937,5
34232,3
38648,5
43198,9
47807,9
52584,5
57403,0
62347,2
67333,3
72445,1
77598,8
82794,4
88073,8
93395,1
98758,3
104163,4
109631,3
115141,1
119398,2
124782,4
130342,5
135848,2
141161,1
4081,1
8505,7
13223,6
18167,8
23275,4
28533,9
33876,1
39285,5
44799,5
50321,9
55907,2
61492,4
67161,5
72797,1
78436,8
84135,2
89821,0
95557,1
101184,3
107012,6
112715,2
118451,3
124220,9
130024,1
135756,0
141513,0
147295,2
152985,3
158813,6
164667,0
290
Приложение 4
Энтальпия (теплосодержание) газов при постоянном давлении
Температура,
t0С
100
200
300
400
500
600
700
800
900
1000
1100
1200
1300
1400
1500
1600
1700
1800
1900
2000
2100
2200
2300
2400
2500
2600
2700
2800
2900
3000
Теплосодержание, кДж/м3
О2
N2
воздух
СО 2
Н2О
SO 2
131,8
267,2
407,1
551,4
669,3
850,6
1004,7
1160,6
1319,0
1478,6
1639,5
1802,1
1965,1
2129,8
2295,7
2462,4
2630,5
2799,7
2969,4
3140,8
3311,7
3497,8
3659,1
3834,3
4009,8
4184,9
4368,9
4546,1
4729,2
4914,9
130,1
260,9
393,6
528,7
666,6
807,8
951,9
1098,2
1246,9
1398,2
1551,1
1705,3
1861,2
2010,0
2176,7
2335,5
2495,9
2656,4
2818,2
2979,9
3142,9
3306,3
3469,3
3633,1
3797,4
3953,9
4135,9
4304,4
4469,0
4634,5
130,1
261,6
395,4
532,1
672,0
814,5
960,3
1108,2
1258,7
1410,7
1564,9
1720,4
1877,5
2035,5
2194,7
2355,2
2515,7
2678,2
2840,4
3004,2
3167,6
3332,3
3497,4
3663,3
3828,8
3988,4
4156,5
4320,7
4484,9
4652,1
170,1
357,7
559,7
772,6
925,1
1225,6
1463,1
1706,2
1953,8
2205,2
2460,4
2718,5
2979,1
3241,4
3505,7
3771,4
4039,6
4307,3
4579,7
4847,8
5118,2
5392,5
5660,7
5933,0
6209,6
6487,4
6761,8
7033,3
7311,1
7589,7
150,6
304,7
463,0
626,8
786,2
969,5
1149,7
1335,3
1527,2
1724,2
1926,5
2133,9
2345.5
2560,9
2781,3
3004,2
3231,7
3461,3
3693,5
3928,5
4166,1
4405,8
4667,1
4890,9
5136,5
5387,1
5639,3
5897,8
6159,3
6425,8
181,4
377,9
587,0
824,6
1034,9
1269,6
1507,5
1746,4
1994,8
2237,4
2488.8
2735,2
2979,5
3238,0
3488,2
3747,5
4003,1
4261,2
4529,8
4667,6
5059,4
5337,2
5608,7
5892,8
6169,8
6460,1
6753,8
7050,9
7351,3
7655,1
291
Приложение 5
№
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
24.
25.
26.
27.
28.
29.
30.
31.
32.
33.
34.
Вещество
Амиловый спирт С 5 Н 11 ОН
Ацетон С 3 Н 6 О
Ацетальдегид С 2 Н 4 О
Бензол С 6 Н 6
Гексан С 6 Н 14
Гептан С 7 Н 16
Диэтиловый эфир С 4 Н 10 О
м-Ксилол С 8 Н 10
п-Ксилол С 8 Н 10
о-Ксилол С 8 Н 10
Метанол СН 3 ОН
Этилбензол С 8 Н 10
Этиленгликоль С 2 Н 4 О 2
Бутанол С 4 Н 9 ОН
Октан С 8 Н 20
Пентан С 5 Н 12
Пропанол С 3 Н 7 ОН
Пропанол-2 С 3 Н 7 ОН
Пропилбензол С 9 Н 12
Толуол С 7 Н 8
Уксусная кислота С 2 Н 4 О 2
Этанол С 2 Н 5 ОН
Этилацетат С 4 Н 8 О 2
2,2-Диметилбутан С 6 Н 14
Диметиловый эфир С 2 Н 6 О
Дипропиловый эфир С 6 Н 14 О
2-Метилбутан С 5 Н 12
Муравьиная кислота СН 2 О 2
Циклогексан С 6 Н 12
Циклогексанон С 6 Н 10 О
Циклогексен С 6 Н 10
Циклопентан С 5 Н 10
2-Метилгексан С 7 Н 16
Пентанон-2 С 5 Н 10 О
Физико-химические константы некоторых веществ
Константы уравнения
Диэлектр. про- t КИПЕНИЯ , 0С
∆Н образ. кДж/моль
Антуана
ниц.
lgр = 6,3073 - 1287,625/(161,330 + t)
lgр = 6,37551 - 1281,721/(237,088 + t)
lgр = 6,31653 - 1093,537/(233,413 + t)
lgр = 5,61391 - 902,275/(178,099 + t)
lgр = 5,99517 - 1166,274/(223,661 + t)
lgр = 6,07647 - 1295,405/(219,819 + t)
lgр = 6,9979 - 1098,945/(232,372 + t)
lgр = 6,58807 -1906,796/(234,917 + t)
lgр = 6,25485 - 1537,082/(223,608 + t)
lgр = 6,28893 - 1575,114/(223,579 + t)
lgр = 7,3527 - 1660,454/(245,818 + t)
lgр = 6,35879 - 1590,660/(229,581 + t)
lgр = 8,13754 - 2753,183/(252,099 + t)
lgр = 8,72232 - 2664,684/(279,638 + t)
lgр = 6,09396 - 1379,556/(211,896 + t)
lgр = 5,97208 - 1062,555/(231,805 + t)
lgр = 7,44201 - 1751,981/(225,125 + t)
lgр = 7,51055 - 1733,00/(232,380 + t)
lgр = 6,29713 - 1627,827/(220,499 + t)
lgр = 6,0507 - 1328,171/(217,713 + t)
lgр = 7,10337 - 1906,53/(255,973 + t)
lgр = 7,81158 - 1918,508/(252,125 + t)
lgр = 6,22672 - 1244,951/(217,881 + t)
lgр = 5,87976 - 1081,176/(229,343 + t)
lgр = 6,34963 - 1004,099/(254,831 + t)
lgр = 6,2408 - 1397,34/(240,177 + t)
lgр = 5,91799 - 1022,511/(233,493 + t)
lgр = 4,99272 - 765,889/(154,546 + t)
lgр = 5,96991 - 1203,526/(222,863 + t)
lgр = 6,33089 - 1670,009/(230,312 + t)
lgр = 6,0111 - 1229,973/(224,104 + t)
lgр = 6,00291 - 1119,208/(230,738 + t)
lgр = 5,99812 - 1236,026/(219,545 + t)
lgр = 6,98913 - 1870,4/(273,2 + t)
14,4
20,7
21,1
2,02
1,890
1,974
4,22
2,374
2,270
2,568
32,63
2,4
37,7
17,7
1,948
1,844
19,7
18,3
2,284
2,379
6,15
25,2
6,02
2,02
3,50
3,88
1,9
57,9
2,02
18,3
2,220
1,965
1,9
14,0
138
56,5
20,2
80,1
68,74
98.43
34,5
139
138,3
144,4
64,9
136,2
197
117
125,66
36
97,8
83,2
159
110,6
118,1
78,5
77
49,7
- 24,8
89,5
27,9
100,8
80,7
155,6
82,9
49,3
90
103,3
- 36,39
- 248,28
- 166,36
+ 82,9
- 167,2
- 187,7
- 252,2
- 28,4
- 24,4
- 24,4
- 203,1
+ 29,9
- 453,8
- 274,6
- 208
- 146,4
- 257,7
- 272,4
+ 7,9
+ 50,17
- 437,3
- 234,9
- 442,9
- 185,6
- 184
- 293,4
- 154,5
- 378,6
- 123,13
- 226
- 5,36
-77,2
- 194,9
- 258,6
∆Н
исп. кДж/моль
46,05
32,29
27,00
48,14
28.88
26,71
36,84
36,56
36,71
35,28
36,31
56,93
43,83
34.62
52,12
46,15
40,19
38,47
33,53
27,2
38,59
46,3
30,73
291
292
ЛИТЕРАТУРА
1. Абдурагимов И.М. и др. Процессы горения. М.:ВИПТШ МВД СССР,
1984.
2. Власов Д.А. Взрыв и его последствия – СПб.: Технологический
институт, 2002 г.
3. Голотин Г.И. Теория горения и взрыва. Челябинск. Изд.ЮурГУ,
1999.
4. Демидов П.Г., Саушев В.С. Горение и свойства горючих веществ. М.:
ВИПТШ МВД СССР, 1975.
5. Ксандопуло Г.И. Химия пламени. М.:1980.
6. Кутуев Р.Х., Малинин В.Р. и др. Теоретические основы процессов
горения. С-Пб: 1996.
7.Мальцев В.М., Мальцев М.И., Кашпоров Л.Я. Основные характеристики горения. М.: Химия, 1977.
8. Симаков В.А. Топливо и основы теории горения. Уфа. УГНТУ, 1998.
9. Терминологический словарь по пожарной безопасности / Сост.
М.С.Васильев, Н.В.Бородина. – М.; ФГУ ВНИИПО, 2001.
10. Фристром Р.М., Вестенберг А.А. Структура пламени. М.: Металлургия, 1969.
11. Хацринов А.И., Батурова Г.С., Валеев Н.Х. Пламя. Казань, КГТУ,
1999.
12. Хитрин Л.Н. Физика горения и взрыва. М.: МГУ, 1957.
13. Излучательные свойства твердых материалов. Справочник/ Под ред.
А.Е. Шейндлина. – М.: Энергия, 1974.
14. Драйздейл Д. Введение в динамику пожаров /пер. с англ. К.Г. Бомштейна; Под. ред. Ю.А. Кошмаров, В.Е. Макарова. – М.: Стройиздат, 1990.
15. ГОСТ 12.1.004-91* Пожарная безопасность. Общие требоания.
16. ГОСТ 12.1.044-89* Пожаровзрывобезопасность веществ и
материалов. Номенклатура показателей и методы их определения.
17. Пожаровзрывоопасность веществ и материалов и средства их тушения. (Справочное издание в двух книгах) / Баратов А.Н., Корольченко А.Я.,
Кравчук Г.Н. и др. - М.: Химия, 1990.
18. Моделирование пожаров и взрывов / Под общ. Ред. Н.Н. Брушлинского и А.Я. Корольченко. – М.: Изд. «Пожнаука», 2000.
292